Изобретение относится к области получения соединений, которые могут найти применение в фармацевтической промышленности.
Предлагается способ получения азадибензоциклогептена общей формулы I
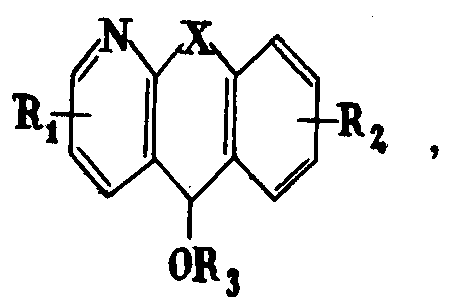
где X - группа -СН2-СН2- или -СН=СН-; R1 и R2 - одинаковые или разные - водород, галоид или низший алкил; R3 - группа -А-В, где А - низший алкилен, В - низшая алкил (или диалкил) - аминогруппа; R3 - также представляет собой тропан-3-ил, нортропан-3-ил, 8-(низший алкил)-нортропан-3-ил или же группу общей формулы II
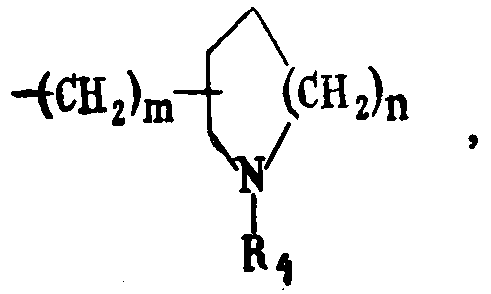
где R4 - водород или низший алкил
(m 0, 1, 2; n 1, 2).
Способ заключается в том, что соединения общей формулы III
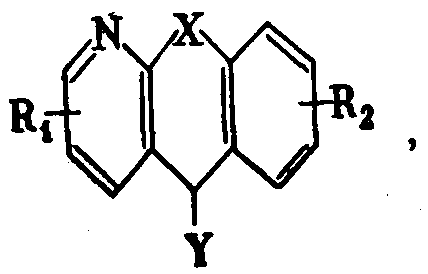
где Y - галоид или ОМе, a R1 и R2 - имеют вышеуказанные значения, подвергают взаимодействию с соединением общей формулы Z-R3, где Z=ОМе или соответственно галоид, R3 - имеет вышеуказанные значения.
Пример 1. а) Приготовление 10, 11-дигидро-5-гидрокси-5Н-бензо-(4,5) - циклогепта-(1,2-b)-пиридина.
К раствору 8,5 г 10, 11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-она в 50 мл метанола прибавляют 3 г боргидрида натрия и 150 мл метанола три 25-30°С. Смесь нагревают в течение 1 час при 60°С, затем ее кипятят с вертикальным холодильником в течение также 1 час. Спиртовой раствор выливают в воду и промывают водой до рН, равного 7. После сушки 10, 11-дигидро-5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридин кристаллизуется из этанола. Анализ: выход 95%; т. пл. 165-166°С.
Вычислено, %: С 79,59; Н 6,20; N 6,63.
C14H13NO.
Найдено, %: С 79,2; Н 6,3; N 6,8%.
б) Приготовление 2-(10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси)-N,N-диметилэтиламиномалеината.
0,04 моль 10,11-дигидро-5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина растворяют в 60 мл толуола. К раствору прибавляют 0,04 г·атом натрия, растворенного в 15 мл метанола. Метанол удаляют дистилляцией и после охлаждения до 30°С прибавляют 0,05 моль хлористого диметиламиноэтила. Полученную смесь кипятят с вертикальным холодильником в течение 18 час. После охлаждения смесь тщательно промывают водой и концентрируют выпариванием растворителя. Остаток растворяют в теплом петролейном эфире (предел т. кип. 40-60°С), после чего оставшийся свободный карбинол кристаллизуется. После фильтрации раствор снова концентрируют выпариванием растворителя. Оставшееся масло растворяют в диэтиловом эфире и подкисляют малеиновой кислотой. Получается 9 г 2-10, 11-дигидро-5Н-бензо(4,5)-циклогепта(1,2-b-пирид-5-илокси)-N,N-диметилэтиламиномалеината. После кристаллизации из смеси этанола и ацетона получают продукт с т. пл. 155-157°С и выходом 55%.
Вычислено, %: С 66,32; Н 6,58; N 7,03.
C22H26N2O5.
Найдено, %: С 66,1; Н 6,7; N 7,0.
Пример 2. а) Приготовление 5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b) -пиридина.
Согласно методике примера 1а, но с заменой 10, 11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-она эквивалентным количеством 5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-она, получен 5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридин. Т. пл. 206-208°С, выход 95%.
Вычислено, %: С 80,36; Н 5,30; N 6,69.
C14H11NO.
Найдено, %: С 80,5; Н 5,5; N 6,5.
б) Приготовление 3α-[5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-тропанмалеината.
5 г (0,024 моль) 5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2)-пиридина кипятят с вертикальным холодильником в течение 5 час с 30 мл хлористого тионила. Избыток хлористого тионила удаляют дистилляцией и после прибавления бензола и повторной дистилляции удаляют последние следы. Образованную таким образом хлористоводородную соль хлористого 5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-ила подвергают кипячению с вертикальным холодильником в течение 16 час с 10,2 г (0,072 моль) тропина и 20 мл толуола. Хлористоводородную соль тропина удаляют фильтрацией и оставшийся раствор промывают 6 раз водой. Органический слой сушат и концентрируют выпариванием растворителя. Остаток растворяют в диэтиловом эфире и прибавляют малеиновую кислоту. Образованный таким образом 3α-5Н-бензо-(4,5)-циклогепта (1,2-b)-пирид-5-илокси]-тропанмалеинат кристаллизируется из смеси ацетона и диэтилового эфира. Выход 51%; т. пл. 196-198°С.
Вычислено, %: С 69,63; Н 6,29; N 6,25.
С26Н28N2O5.
Найдено, %: С 69,8; Н 6,0; N 6,1.
Пример 3. Приготовление 2-[5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-N,N-диметилэтиламиномалеината.
Согласно методике примера 1б, но с заменой 10, 11-дигидро-5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина эквивалентным количеством 5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина, приготовление которого описано в примере 2 а, получен 2-[5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-N,N-диметилэтиламиномалеинат. Выход 52%; т. пл. 141-142°С.
Вычислено, %: С 66,65; Н 6,10; N 7,07.
C22H24N2O5.
Найдено, %: С 66,4; Н 6,2; N 7,0.
Пример 4. Приготовление 3α-[10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-тропанмалеината.
Согласно методике примера 2б, но с заменой 5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина эквивалентным количеством 10,11-дигидро-5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина, приготовление которого описано в примере 1а, получен 3-[10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-тропанмалеинат. Выход 36%; т. пл. 169-171°С.
Вычислено,.%: С 69,31; Н 6,71; N 6,22.
C26H30N2O5.
Найдено, %: С 69,2; Н 6,6; N 6,1.
Кроме того, согласно методикам, описанным в предыдущих примерах, но начиная с подходящих соединений формулы 111-незамещенных или замещенных в одном из колец или в обоих кольцах бензола и пиридина, и соединений формулы Z-R3, могут быть получены другие эфиры азадибензоциклогептен-5-олов, соответствующих формуле 1, например 10,11-дигидро-5-[(1-метил-2-пиперидил)-метокси]-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридин и 5-[(1-метил-2-пиперидил)-метокси]-5-Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридин.
Пример 5. а) Приготовление 5-хлор-10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина.
Газообразный хлористый водород пропускают через суспензию 25 г 10,11-дигидро-5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина, приготовленного по методике примера 1а, в 250 мл дихлорметана до насыщения. Прибавляют несколько мл хлористого тионила с тем, чтобы удалить образованную воду. Затем прозрачный раствор концентрируют выпариванием растворителя, и остаток снова растворяют в небольшом количестве дихлорметана. К раствору прибавляют 12,1 г три-этиламина при 0°С и после этого прибавляют приблизительно 300 мл диэтилового эфира. Осажденное твердое вещество удаляют фильтрацией и кристаллизируют из петролейного эфира (пределы т. кип. 60-80°С). Выход 85%; т. пл. 91-92°С.
Вычислено, %: С 73,20; Н 5,27; N 6,10.
C14H12NCl.
Найдено, %: С 73,5; Н 5,4;, N 5,8.
б) Приготовление 10,11-дигидро-[(1-метил-пиперид-2-ил)-метокси]-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина.
Раствор 11,5 г (0,05 моль) 5-хлор-10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина в толуоле прибавляют при 50°С к раствору 12,9 г (0,1 моль) 1-метил-2-пиперидин-метанола в толуоле. Полученную смесь кипятят с вертикальным холодильником в течение 6 час, после чего хлористоводородная соль аминоспирта осаждается. Твердое вещество удаляют фильтрацией и промывают раствором разбавленной щелочной гидроокиси. Хлористоводородную соль растворяют в разбавленной уксусной кислоте, и в растворе аминоспирт снова освобождается в воде, затем его извлекают при помощи диэтилового эфира и высушивают на сернокислом натрии. Выпариванием удаляют растворитель и аминоспирт дистиллируют при пониженном давлении. Получают 9,5 г (60%) масла, состоящего из 10,11-дигидро-5-[(1-метилпиперид-2-ил)-метокси]-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина, с т. пл. 185°С (при 1 мм рт.ст.).
Свободное основание, растворенное в диэтиловом эфире, может быть превращено при помощи кислот, таких как хлористоводородная кислота, малеиновая кислота, щавелевая кислота и др., в соли, представляющие собой твердые или полутвердые вещества, которые после кристаллизации превращаются в масла.
Пример 6. а) Приготовление 5-хлор-5Н-бензо(4,5)-циклогепта (1,2-b) пирида.
Согласно методике, описанной в примере 5а, но с заменой 10,11-дигидро-5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина эквивалентным количеством 5-гидрокси-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина, получают 5-хлор-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридин.
б) Приготовление 5[(1-метилпиперид-2-ил) метокси]-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина.
Согласно методике примера 5б, но с заменой 5-хлор-10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина эквивалентным количеством 5-хлор-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридина, получен 5-[(1-метилпиперид-2-ил)-метокси]-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пиридин.
Пример 7. Приготовление 3α-(10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-8-йодистого метилтропана.
14 г 3α-[10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-тропана, приготовленного из малеината, полученного согласно методике примера 4, растворяют в 50 мл диэтилового эфира. К раствору прибавляют 0,5 г йодистого метила и смесь оставляют простоять в течение 36 час при комнатной температуре. Кристаллическое твердое вещество кристаллизируют из смеси ацетона и диэтилового эфира.
Получен 3α-[(10,11-дигидро-5Н-бензо-(4,5)-циклогепта-(1,2-b)-пирид-5-илокси]-8-йодистотого метилтропана с выходом 80% и т. пл. 225-227°С.
Анализ спектра ядерного магнитного резонанса подтверждает, что при этих условиях образование четвертичного основания происходит исключительно у азотного атома в тропаниловой боковой цепи.
Способ получения производных азадибензоциклогептена общей формулы I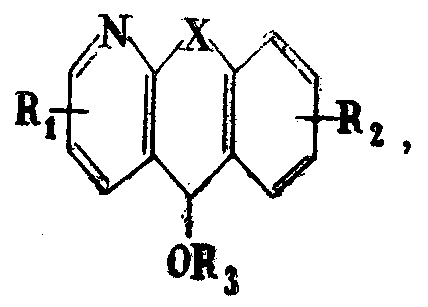
где X-группа -СН2-СН2- или СН=СН-; R1 и R2 - одинаковые или различные - водород, галоид, низший алкил; R3 - группу -А-В, где А - низший алкилен, В - низшая алкил (или диалкил)-аминогруппа; R3 - также представляет собой тропан-3-ил, нортропан-3-ил или 8-(низший алкил)-нортропан-3-иловую или группу, или же группу общей формулы II.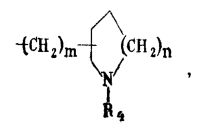
где R4 - водород или низший алкил, m - 0, 1, 2 и n - 1, 2, отличающийся тем, что соединения общей формулы III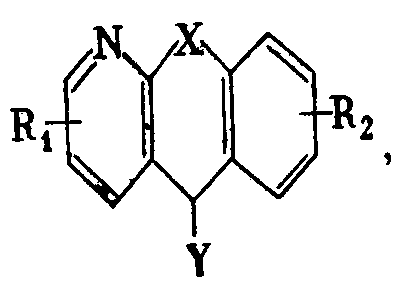
где Y - галоид или ОMe, R1 и R2 - имеют вышеуказанные значения, подвергают взаимодействию с соединением общей формулы Z-R3, где Z=OMe или соответственно галоид, R3 - имеет вышеуказанные значения.
Авторы
Даты
1969-01-30—Публикация
1967-01-27—Подача