Предлагаются новые химические соединения, конкретно дигидробромиды S-(2-аминоалкил)- или S-(1-аминопропил-2)изо- тиомочевины общей формулы
RCH(NH2˙HBr)CR1 SC(=NH)NH3 ˙HBr где R - H, CH3, C3H7;
R1 - H, CH3.
Дигидробромиды S-(2-аминоалкил)- или S-(1-аминопропил-2)изотиомочевины проявляются значительную противолучевую активность и могут представлять интерес как радиозащитные средства.
Указанные соединения, их свойства и способ получения в литературе не описаны.
В настоящее время известно большое число химических соединений, способных уменьшать поражение организма при их введении незадолго до облучения. К числу наиболее эффективных радиозащитных средств относятся S-(2-аминоэтил)изотиомочевина (АЭТ) и S-(3-аминопропил)-изотиомочевина (3-АПТ). Установлено, что введение алкильных заместителей в амино- или амидиновую группу молекулы АЭТ или увеличение расстояния между функциональными группами снижает или приводит к полной утрате соединением радиозащитной активности. Так в настоящее время из биологически активных S-(аминоалкил)изотиомочевин известны всего лишь три соединения: S-(2-аминоэтил)изотиомочевина, ее гомолог - S-(3-аминопропил)изотиомочевина и S-(2-аминобутил)изотиомочевина.
Известно также, что S-(аминоалкил)изотиомочевины получают, как правило, взаимодействием тиомочевины с соответствующими галогеналкилами в воде, этаноле или пропаноле-2.
Целью изобретения является синтез биологически активных S-(аминоалкил)изотиомочевин, где одна из функциональных групп (тиурониевая или аминогруппа) находится у вторичного атома углерода. Вновь полученные соединения из-за особенностей их структуры нельзя синтезировать известными способами. Действительно, в таких растворителях, как вода, этанол или пропанол-2 целевые соединения образуются лишь с очень низкими выходами. Это объясняется весьма высокой скоростью их циклизации до соответствующих гетероциклических соединений. Так, например, при 20оС в воде скорость превращения S-(2-аминопропил)изотиомочевины в 5 раз, а S-(1-аминопропил-2)изотиомочевины в 13 раз выше, чем у S-(2-аминоэтил)изотиомочевины.
Кроме того, синтез S-(1-аминопропил-2)изотиомочевины осложняется еще и тем, что реакционная способность атома галогена в реакциях нуклеофильного замещения у вторичного атома углерода (в гидробромиде 2-бромпропиламина) существенно ниже, чем у первичного атома углерода (например, в гидробромиде 3-бромпропиламина). Так скорость замещения в этом случае уменьшается почти в 10 раз. Таким образом, как это следует из представленных данных, синтезированные S-(аминоалкил)изотиомочевины оказалось невозможно получать способами, описанными ранее.
Предлагаемым способом синтезируют биологически активные S-(аминоалкил)изотиомочевины указанной общей формулы, где одна из функциональных групп (тиурониевая или аминогруппа) находятся у вторичного атома углерода. Они могут быть использованы в качестве радиозащитных средств. Эти соединения весьма устойчивы в индивидуальном состоянии, хорошо растворимы в воде, что очень важно при применении этих веществ в качестве радиопротекторов. Величина противолучевого эффекта, проявляемого полученными веществами, соизмерима с противолучевым действием такого распространенного радиопротектора, как АЭТ.
Предлагаемый способ получения S-(аминоалкил)изотиомочевин основан на реакции нуклеофильного замещения тиомочевиной атома брома в соответствующих гидробромидах галогеналкиламинов. Гидробромиды галогеналкиламинов в подобную реакцию ранее не вводили.
Способ получения гидробромидов S-(аминоалкил)изотиомочевин заключается в том, что гидробромиды 1-бром-2-аминоалкана или 2-бром-1-аминопропана подвергают взаимодействию с тиомочевиной в среде безводного органического растворителя при повышенной температуре с последующим выделением целевых продуктов многократной перекристаллизацией в этилацетата и этаноле, взятых в соотношении 1:1 и многократным кипячением в безводном ацетоне.
Синтез S-(аминоалкил)изотиомочевин подобного строения осложняется внутримолекулярной перегруппировкой, приводящей к образованию побочных продуктов реакции - соли аммония и соответствующих производных 2-амино-2-тиазолина по реакции
R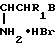 r+SC(=NH)NH
r+SC(=NH)NH H
H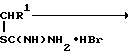 R
R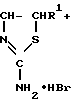 NH4Br
NH4Br
где R и R' = H, Аlk.
Поэтому необходимо применять специальные условия проведения реакции и выделения S-(аминоалкил)изотиомочевин в индивидуальном состоянии: растворители, длительность проведения реакции. Кинетические исследования реакции тиомочевины с гидробромидами галогеналкиламинов в различных условиях, проведенные методом радиохроматографии на бумаге и в тонком слое на целлюлозе, показывают что синтез лучше всего осуществлять в безводном растворителе. Состав растворителя и длительность проведения реакции подбирают так, чтобы образовывались минимальные количества побочных продуктов реакции. Изменение условий проведения реакции существенно уменьшает выход S-(аминоалкил)изотиомочевин. Определенная последовательность очисток и перекристаллизаций полученной реакционной массы в разных безводных органических растворителях обеспечивает выделение S-(аминоалкил)изотиомочевин в индивидуальной форме.
В качестве органического растворителя для получения целевых продуктов следует использовать смесь безводных этилацетатов и этанола в соотношении 5: 1,2. Реакцию необходимо проводить при 80оС в течение 40-50 мин. Выделяют гидробромиды S-(аминоалкил)изотиомочевин многократной перекристаллизацией из смеси этилацетата и этанола при соотношении их 1:1 до отрицательной пробы на ион аммония и многократным кипячением в порциях безводного ацетона для отделения от соответствующего гетероциклического соединения.
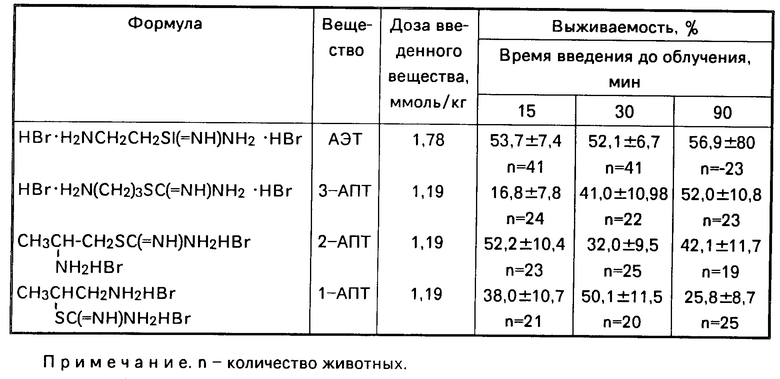
Дигидробромиды S-(2-аминопропил) изотиомочевины (2-АЦТ) и S-(1-аминопропил-2)изотиомочевины (1-АПТ) обладают выраженным противолучевым действием, соизмеримым с радиозащитным эффектом, проявляемым АЭТ, причем 2-АПТ и 1-АПТ в пересчете на эквимолярные дозы введения животным в 1,5 раза эффективнее.
Следует отметить, что по динамике противолучевого действия 1-АПТ и 2-АПТ существенно отличаются от АЭТ и 3-АПТ. Так, например, 1-АПТ значительно лучше защищает млекопитающих через 15-30 мин после введения, чем 3-АПТ, защитный эффект которого достигает максимума лишь к 90 мин после введения соединения. Это может оказаться перспективным при составлении рецептурных смесей веществ, обладающих пролонгированным радиозащитным действием.
Синтезированные дигидробромиды S-(аминоалкил)изотиомочевин весьма устойчивы и хорошо растворимы в воде и физиологическом растворе, что очень важно при проведении биологических испытаний этих соединений. Кроме того, для получения максимального противолучевого эффекта 2-АПТ и 1-АПТ следует вводить в 1,5 раза меньше, чем, например, АЭТ (в пересчете на молярные количества). Сравнительные данные по противолучевой активности, проявляемой изотиомочевинами, и их токсичности представлены в таблице.
П р и м е р 1. Получение дигидробромиды S-(2-аминопропил)изотиомочевины.
2,63 г (0,012 г.моль) гидробромида 2-амино-14бромпропана кипятят с 0,45 г (0,006 г.моль) тиомочевины в 10 мл смеси безводных этилацетата и этанола (5:1,2) в течение 60 мин.
Выпавшее масло промывают 2 раза смесью безводных этилацетата и этанола (5: 1,2), а затем кипятят в течение 10 мин в безводном ацетоне. После двукратной перекристаллизации из смеси безводных этилацетата и этанола (1:1) получают бесцветный кристаллический осадок, выход 75%, т.пл. 157-158оС.
Найдено, %: C 16,17; 16,37; H 4,20; 4,35; N 4,12; 14,30.
C4H11N3S˙2HBr
Вычислено, %: C 16,29; H 4,41; N 14,24.
ПМР-спектр, м.д.: CH2S 3,97; CHN 4,17; CH3 1,97.
ПМР-спектры S-(аминоалкил)изотиомочевин снимали в растворе D2O на спектрометре Varian Т-60 )60 мгц) при 35оС. В качестве внутреннего эталона использовали D2O. Точность измерения химических сдвигов +0,05 м.д.
П р и м е р 2. Получение дигидробромида S-(1-аминопропил-2)изотиомочевины.
2,63 г (0,012 г.моль) 2-бром-1-аминопропана кипятят с 0,45 г (0,006 г. моль) тиомочевины в 5 мл смеси безводных этилацетата и этанола (5:1,2) в течение 40 мин. Раствор декантируют с выпавшего масла, которое 2 раза отмывают (порциями по 5 мл каждая) смесью безводных этилацетата и этанола (1: 1) до отрицательной пробы на ион аммония. После этого полученный кристаллический осадок несколько раз кипятят с порциями (по 5-6 мл каждая) безводного ацетона для отделения побочного продукта, образовавшегося в ходе реакции 5-метил-2-амино-2-тиазолина, выход 20%, т.пл. 177-178оС.
Найдено, %: C 16,22; 16,37; H 4,58; 4,60; N 14,37; 14,20
C4H11N3S˙2HBr
Вычислено, %: С 16,2; H 4,41; N 14,24.
ПМР-спектры, м.д.: CH2N 3,97; CHS 4,60; CH3 2,14.
Противолучевая активность (выживаемость) дигидробромидов S-аминоалкил)изотиомочевин в экспериментах на мышах при подкожном способе введении приведены в таблице.
ДИГИДРОБРОМИДЫ S-(2-АМИНОАЛКИЛ)- ИЛИ S-(1-АМИНОПРОПИЛ-2)ИЗОТИОМОЧЕВИНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОЛУЧЕВУЮ АКТИВНОСТЬ, И СПОСОБ ИХ ПОЛУЧЕНИЯ.
| Василевский В.А., Свердлов Е.Д., Федосеев В.М., Силаев А.С | |||
| Взаимодействие изотиомочевин с $$$ -масляной кислотой, ЖОХ, 1963, 33, с.2397. |
Авторы
Даты
1995-02-09—Публикация
1975-03-19—Подача