Область техники, к которой относится изобретение
Изобретение относится к способу получения оптически активных соединений (S)-(-)-2-(N-пропиламино)-5-метокситетралина, в данном контексте S-(II), и (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина, в данном контексте S-(III), характеризующихся высокой степенью оптической чистоты, из смеси энантиомеров 2-(N-пропиламино)-5-метокситетралина (II) и 2-(N-пропиламино)-5-гидрокситетралина (III) соответственно, при оптическом разделении с использованием диастереомерной соли оптически активной кислоты.
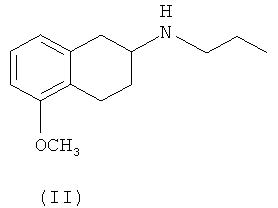
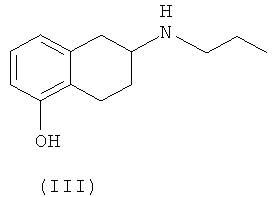
Промежуточные соединения S-(II) и S-(III) используют для получения (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола(ротиготин).
Уровень техники
В патенте США 4564628 описаны алкилпроизводные аминотетралина, обладающие дофаминергической активностью. В число этих соединений входит соединение (I),
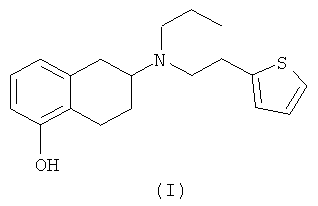
В результате исследований, которые описаны в патенте США 4657925, было установлено, что дофаминергическая активность энантиомера (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола, в данном контексте S-(I), в 140 раз выше, чем дофаминергическая активность энантиомера (6R)-(+)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола.
В патенте США 4885308 описано использование S-(I), активного ингредиента (другое название ротиготин), для лечения болезни Паркинсона.
Следовательно, существует потребность в способе получения оптически чистого S-(I) энантиомера, не содержащего энантиомер R-(I).
Известные в настоящее время способы получения S-(I) основаны на получении промежуточного соединения (S)-2-(N-пропиламино)-5-метокситетралина, S-(II).
В патенте США 4657925 описано получение (S)-2-(N-пропиламино)-5-метокситетралина, S-(II), при разделении соответствующей рацемической смеси. Однако способ разделения подробно не описан.
В статье Hoeve и др., J. Org. Chem., т.50, стр.4508-4515 (1985) описано получение S-(II) при оптическом разделении рацемической смеси с использованием хирального (R)-(+)-4-(2-хлорфенил)-5,5-диметил-2-гидрокси-1,3,2-диоксафосфоринано-2-оксида фосфорной кислоты в качестве агента для разделения. Описанный способ является дорогостоящим и трудоемким, поскольку требуется получать указанный агент, что в свою очередь включает стадию оптического разделения.
В статье Seiler и др., J. Med. Chem., т.29, стр.912-917 (1986) описано получение S-(II) при пропилировании с последующим дебензилированием (S)-(-)-2-(N-бензиламино)-5-метокситетралина, получение которого описано в статье McDermed и др., J. Med. Chem., т.19, №4, 547-549, (1976), который получают при восстановительном аминировании 5-метокситетралона бензиламином, при кристаллизации диастереоизомерной соли (-)-миндальной кислоты, обогащенной (S)-энантиомером, оптической очистке указанной соли, включая шесть последовательных стадий перекристаллизации из эфира, и, наконец, при получении амина в виде основания. Указанный способ требует больших затрат времени и является дорогостоящим в промышленном масштабе.
В патенте США 4968837 описано разделение промежуточного соединения (II) на энантиомеры с использованием L-(-)-дибензоилвинной кислоты, однако согласно опыту авторов настоящего изобретения этот метод не позволяет получить соединения с высокой оптической чистотой, даже после последовательных стадий очистки диастереоизомерной соли.
Как показано выше, ни один из указанных способов получения S-(II) и, следовательно, S-(I) не позволяет масштабировать процесс до промышленного уровня. Следовательно, существует необходимость в альтернативном способе получения ротиготина, S-(I), который можно использовать в промышленном масштабе.
Раскрытие изобретения
Цель настоящего изобретения заключается в разработке альтернативного применимого в промышленном масштабе способа получения соединения (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола, S-(I), с высокой оптической чистотой, что позволяет использовать его в качестве лекарственного средства.
Цель настоящего изобретения осуществляется за счет неожиданного открытия факта, что некоторые оптически активные органические кислоты образуют диастереоизомерные соли соединения (II), а также соли энантиомеров R-(II) и S-(II) и энантиомеров (III), R-(III) и S-(III), характеризующиеся различной растворимостью в реакционной среде, что позволяет разделять их при кристаллизации. При кристаллизации смеси указанных диастереоизомерных солей в реакционной среде или в пригодном растворителе за счет их различной растворимости, образующиеся кристаллы обогащаются диастереоизомерными солями энантиомеров S-(II) и S-(III), которые можно использовать в качестве промежуточных соединений для получения S-(I). После выделения и очистки диастереоизомерных солей из них можно получить указанные промежуточные соединения, характеризующиеся высокой степенью оптической чистоты.
Способ по настоящему изобретению позволяет получить промежуточные соединения S-(II) и S-(III) с оптической чистотой, равной 99% или более, предпочтительно более 99,9%, с использованием последовательных стадий перекристаллизации или ресуспендирования соответствующих диастереоизомерных солей.
Соединения (II) и (III), в их рацемической форме, можно получать любым из способов, описанных в литературе, например, как описано в статье Hacksell и др., J. Med. Chem., т.22, №12, стр.1469-1475 (1979), при восстановительном аминировании 5-метокси-2-тетралона в присутствии 1-пропиламина, при этом получают соединение (II), и последующем деблокировании фенольной группы в присутствии 48% HBr, при этом получают соединение (III).
Схема синтеза промежуточных соединений S-(II) и S-(III) - объект настоящего изобретения - показана на схеме 1:
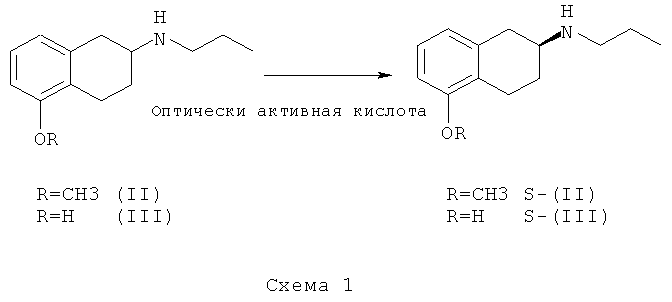
Способ получения S-(II) энантиомера по настоящему изобретению включает оптическое разделение при обработке смеси энантиомеров (II) в присутствии кислоты, (+)-N-(3,5-динитробензоил)-α-фенилглицина, в пригодном растворителе. Полученную соль можно перекристаллизовывать или ресуспендировать несколько раз до образования соединения требуемой оптической чистоты. Затем из полученной соли можно получить амин S-(II) в виде свободного основания.
Способ получения энантиомера S-(III) по настоящему изобретению включает оптическое разделение при обработке смеси энантиомеров (III) в присутствии кислоты, (-)-N-(3,5-динитробензоил)-α-фенилглицина в пригодном растворителе. Полученную соль можно перекристаллизовывать или ресуспендировать несколько раз до образования соединения требуемой оптической чистоты. Затем из полученной соли можно получить амин S-(II) в виде свободного основания.
Осаждение указанных диастереоизомерных солей и последующие стадии перекристаллизации или ресуспендирования можно проводить в пригодных растворителях, таких как вода, спирты, нитрилы или их смеси. В предпочтительном варианте осуществления настоящего изобретения указанным растворителем является смесь ацетонитрила и воды.
Количество добавленной оптически активной органической кислоты может составлять от приблизительно 0,5 до приблизительно 1,2 экв., предпочтительно от приблизительно 0,6 до 1 экв., в расчете на количество исходного амина.
В одном объекте настоящего изобретения предлагается также получение солей указанных промежуточных соединений S-(II) и S-(III) в присутствии оптически активных кислот, (-)-N-(3,5-динитробензоил)-α-фенилглицина и (+)-N-(3,5-динитробензоил)-α-фенилглицина формулы (V) и (VI) соответственно.
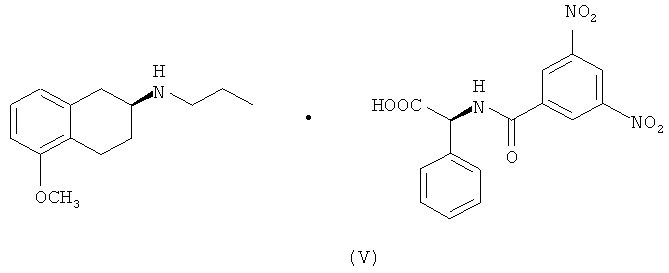
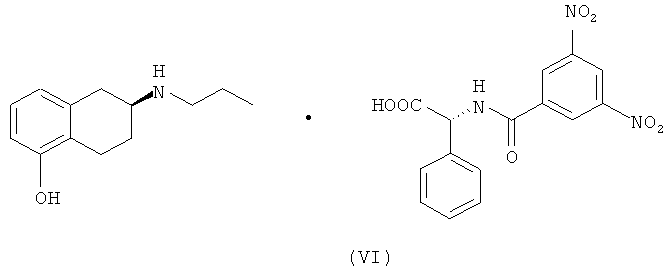
В другом варианте настоящего изобретения предлагается применение соединений S-(II) и S-(III) в качестве промежуточных соединений для получения ротиготина, S-(I), и указанные соединения получают, как указано на схеме 2:
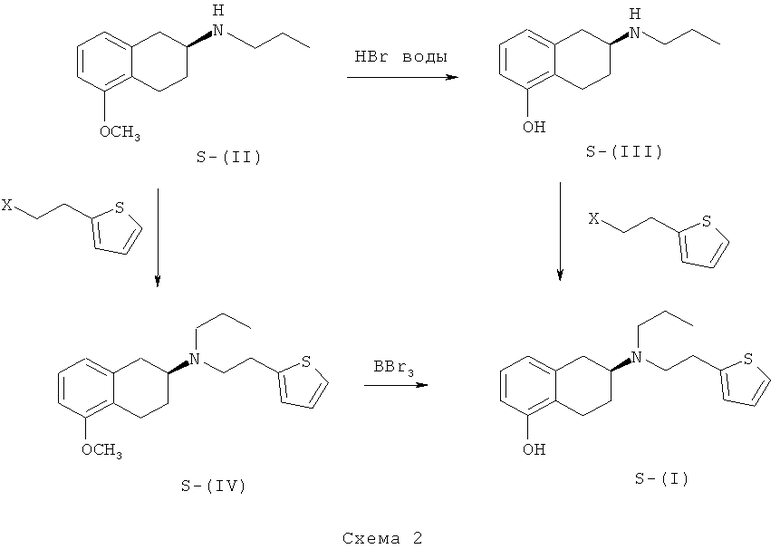
где X обозначает пригодную уходящую группу, выбранную из галогенов, таких как хлор или бром, сульфонатов, таких как мезилат, нозилат или тозилат, и т.п.
В еще одном варианте настоящего изобретения предлагается применение солей (V) и (VI) в качестве промежуточных соединений для получения ротиготина, S-(I).
Осуществление изобретения
Приведенные ниже примеры представлены дополнительно для иллюстрации настоящего изобретения и не ограничивают объем настоящего изобретения.
Пример 1. Получение (S)-(-)-2-(N-пропиламино)-5-метокситетралина, S-(II), из рацемической смеси при оптическом разделении в присутствии (+)-N-(3,5-динитробензоил)-α-фенилглицина
10 г Соединения (II) растворяли в 120 мл смеси ацетонитрил/вода, 60:40, затем добавляли 9,4 г (0,6 экв.) (+)-N-(3,5-динитробензоил)-α-фенилглицина. Смесь нагревали до растворения твердого вещества. Затем смесь медленно охлаждали, при этом сначала образовывался опалесцирующий раствор, затем начиналось выпадение осадка. Смесь выдерживали при температуре 0-5°C в течение 2 ч. Суспензию фильтровали и полученное твердое вещество сушили в сушильном шкафу.
При этом получали 9,8 г соли (выход 38%). Анализ полученной соли методом ЖХВР свидетельствует о присутствии энантиомеров S-(II)/R-(II) в соотношении 83:17.
Твердое вещество последовательно перекристаллизовывали из 10 объемов смеси ацетонитрил/вода, 80:20, нагревали до кипения растворителя, затем охлаждали до температуры 0-5°C. После трех стадий перекристаллизации получали 3,8 г (суммарный выход 15%) соли (V), анализ которой методом хиральной ЖХВР свидетельствует о присутствии энантиомера (S) в количестве более 99,5%.
tпл. (пик ДСК): 220,27°C.
ИК (см-1, KBr): 3423, 2955, 2838, 1664, 1621, 1585, 1542, 1345, 731, 705.
1Н-ЯМР (AMCO-d6): δ 0,88 (t, 3H), 1,54-1,63 (m, 3H), 2,14 (m, 1H), 2,42 (m, 1H), 2,75 (m, 2H), 2,83 (t, 2H), 3,03 (dd, 1H), 3,18 (m, 1H), 3,35 (ушир. s, 2Н, NH2 +), 3,73 (s, 3H, OCH3), 5,25 (d, 1Н, СН-СООН), 6,62 (d, 1Н, Ar-H), 6,74 (d, 1Н, Ar-H), 7,07 (t, 1H, Ar-H), 7,16 (m, 1H, Ar-H), 7,23 (t, 2H, Ar-H), 7,45 (d, 2H, Ar-H), 8,91 (s, 1H, Ar-H), 9,03 (s, 2H, Ar-H), 9,42 (d, 1H, NH амид).
Очищенную сухую соль суспендировали при перемешивании в смеси толуола (20 мл) и 5% раствора K2CO3 (60 мл), нагревали при температуре 60°C до полного растворения твердого вещества. Слои разделяли и органический слой промывали 5% раствором K2CO3 (15 мл), затем водой (8 мл). Органический слой концентрировали до полного удаления растворителя, при этом получали 1,44 г соединения S-(II) в виде масла (выход 98%).
ИК (см-1, NaCl): 2955, 2930, 2834, 1586, 1469, 1438, 1260, 1095, 766.
1Н-ЯМР (CDC3): δ 0,92 (t, 3H, СН2-CH3), 1,48-1,60 (m, 3H, СН2-СН2-СН3 и N-CH-CH2-CH2-C), 1,80 (ушир. s, 1Н, NH), 2,07 (m, 1Н, N-CH-CH2-CH2-C), 2,50-2,61 (т, 2Н, C-CH2-CHN и N-CH-CH2-CH2-C), 2,66 (t, 2Н, СН2-СН2-СН3), 2,84-2,93 (m, 2Н, C-CH2-CHN и N-CH-CH2-CH2-C), 2,95-3,10 (dd, 1Н, C-CH2-CHN), 3,78 (s, 3H, ОСН3), 6,63 (d, 1Н, Ar-H), 6,68 (d, 1Н, Ar-H), 7,07 (t, 1H, Ar-H).
Удельное вращение полученного продукта [α]20 D: -73,49 (с=1 в метаноле). В патенте США 4968837 величина [α]20 D составляет -65, в статье Seiler M.P. и др., J. Med. Chem., т.29, №6, стр.912-917 (1986) [α]20 D составляет -72,7 (с=1 в метаноле).
Пример 2. Получение (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина, S-(III), из рацемической смеси оптическим разделением в присутствии (-)-N-(3,5-динитробензоил)-α-фенилглицина
Суспензию 10 г соединения (III) и 11,7 г (0,7 экв.) соединения (-)-N-(3,5-динитробензоил)-α-фенилглицина в 160 мл смеси ацетонитрил/вода, 70:30, нагревали до растворения твердого вещества. Полученный раствор медленно охлаждали, при этом сначала образовывался опалесцирующий раствор, затем начиналось выпадение осадка. Смесь выдерживали при температуре 0-5°C в течение 2 ч. Суспензию фильтровали и полученное твердое вещество сушили.
При этом получали 11,2 г соли (выход 42%). Анализ полученного продукта методом ЖХВР свидетельствует о присутствии энантиомеров S-(III)/R-(III) в соотношении 91:9.
Твердое вещество несколько раз перекристаллизовывали из 10 объемов смеси ацетонитрил/вода, 80:20, нагревали до кипения растворителя, затем охлаждали до температуры 0-5°C. После двух стадий перекристаллизации получали 6,0 г (суммарный выход 24%) соли (VI), анализ которой методом хиральной ЖХВР свидетельствует о наличии энантиомера (S) в количестве более 99,9%.
ИК (см-1, KBr): 3450, 3032, 2972, 2854, 1652, 1621, 1539, 1467, 1376, 1275, 729.
1Н-ЯМР (ДМСО-d6): δ 0,87 (t, 3H), 1,53-1,62 (m, 3H), 2,13 (m, 1Н), 2,39 (m, 1Н), 2,72 (m, 2Н), 2,83 (t, 2Н), 3,00 (dd, 1Н), 3,18 (m, 1Н), 3,35 (ушир. s, 2Н, NH2 +), 5,23 (d, 1Н, CH-СООН), 6,46 (d, 1Н, Ar-H), 6,58 (d, 1Н, Ar-H), 6,87 (t, 1Н, Ar-H), 7,17 (т, 1Н, Ar-H), 7,24 (t, 2Н, Ar-H), 7,44 (d, 2Н, Ar-H), 8,91 (s, 1H, Ar-H) 9,03 (d, 2H, Ar-H), 9,41 (d, 1H, NH амид), 9,55 (s, 1H, OH).
Очищенную сухую соль суспендировали при перемешивании в смеси толуола (20 мл) и 5% раствора K2CO3 (60 мл) и нагревали при температуре 60°C до полного растворения твердого вещества. Слои разделяли и органический слой промывали 5% раствором K2CO3 (15 мл), затем водой (8 мл). Органический слой концентрировали до полного удаления растворителя, при этом получали 1,8 г соединения S-(III) в виде твердого вещества (выход 98%).
tпл. (пик ДСК): 88,3°C.
ИК (см-1, KBr): 3532, 3269, 2923, 2854, 1585, 1464, 1281, 773.
1Н-ЯМР (ДМСО-d6): δ 0,86 (t, 3H), 1,40 (m, 3H), 1,94 (m, 1Н), 2,38 (m, 2Н), 2,53 (t, 2Н), 2,69 (m, 2Н), 2,84 (dd, 1Н), 3,36 (ушир. s, 1Н, NH), 6,46 (d, 1Н, Ar-H), 6,54 (d, 1Н, Ar-H), 6,84 (t, 1Н, Ar-H), 9,08 (s, 1Н, OH).
Удельное вращение [α]20 D: -74,89 (с=1 в метаноле). По данным Seiler, M.P. и др., J. Med. Chem., т.29, №6, стр.912-917 (1986), [α]20 D составляет -75.
Пример 3. Получение (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина, S-(III), из (S)-(-)-2-(N-пропиламино)-5-метокситетралина, S-(II)
10 г (S)-(-)-2-(N-пропиламино)-5-метокситетралина, S-(II), полученного, как описано в примере 1, смешивали с 40 мл 48% раствора HBr и 20 мл уксусной кислоты. Полученную смесь кипятили с обратным холодильником в течение 3 ч. В этот период начиналось осаждение твердого вещества. Суспензию постепенно охлаждали до температуры 0-5°C, затем добавляли 30 мл воды. Реакционную смесь фильтровали, при этом получали 11,7 г (выход 90%) бромгидрата S-(-)-2-(N-пропиламино)-5-гидрокситетралина.
Указанное твердое вещество суспендировали в 110 мл воды и суспензию нагревали до 40°C. Затем добавляли 10 М раствор NaOH до рН 12,5, при этом получали раствор. Затем смесь подкисляли до pH 9-9,5 при добавлении 6 М раствора HCl и получали осадок твердого вещества. Смесь постепенно охлаждали до 0-5°C и фильтровали, при этом получали 7,5 г S-(-)-2-(N-пропиламино)-5-гидрокситетралина, S-(III), (выход 90%).
tпл. (пик ДСК): 88,25°C.
Удельное вращение [α]20 D: -74,95 (с=1 в метаноле).
Пример 4. Получение (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола, S-(I), из S-(-)-2-(N-пропиламино)-5-гидрокси-тетралина, S-(III)
10 г (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина, S-(III), полученного, как описано в примере 2, смешивали с 9 г NaHCO3 (2,2 экв.) и 16 г 2-нитробензолсульфоната 2-(2-тиенил)этанола (1,05 экв.) в 80 мл ацетонитрила.
Смесь кипятили с обратным холодильником в течение 9 ч, затем охлаждали и фильтровали для удаления суспендированных солей. В фильтрат добавляли 60 мл воды и упаривали для удаления ацетонитрила. Затем добавляли 40 мл толуола и слои разделяли. Органический слой дважды промывали 10% раствором NaHCO3. Затем добавляли 50 мл воды и H3PO4 до pH 1-2. Слои разделяли, кислотный водный слой нейтрализовали при добавлении 30% раствора K2CO3 до рН 7-7,5 и экстрагировали 20 мл этилацетата. Органический слой промывали 10 мл воды, растворитель упаривали, при этом получали 10 г (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола, S-(I), в виде твердого вещества белого цвета (выход 70%).
tпл. (пик ДСК): 78,94°C.
ИК (см-1, KBr): 3500, 3098, 3065, 2969, 2932, 1585, 1465, 1281, 775, 701.
1Н ЯМР (CDCl3): δ 0,89 (t, 3H, N-CH2-CH2-CH3), 1,51 (секстет, 2Н, N-CH2-CH2-CH3), 1,58 (ddd, 1Н, N-CH-CH2-CH2-C), 2,10 (ddd, 1Н, N-CH-CH2-CH2-C), 2,55 (t, 2H, N-CH2-CH2-CH3), 2,47-2,60 (m, 1H, C-CH2-CHN), 2,67-2,87 (m, 4H, N-CH-CH2-CH2-C и N-СН2-СН2-тиофен), 2,90 (m, 1H, C-CH2-CHN), 2,92-3,01 (m, 3H, C-CH2-CHN и N-СН2-СН2-тиофен), 4,83 (s, 1H, OH), 6,57 (d, 1H, Ar-H), 6,67 (d, 1H, Ar-H), 6,80 (d, 1H, Ar-H), 6,90 (dd, 1H, Ar-H), 6,97 (t, 1H, Ar-H), 7,10 (d, 1H, Ar-H).
Пример 5. Получение бромгидрата (S)-2-(N-н-пропил-N-2-тиенилэтиламино)-5-метокситетралина, S-(IV)·HBr из (S)-(-)-2-(N-пропиламино)-5-метокситетралина, S-(II)
10 г (S)-(-)-2-(N-пропиламино)-5-метокситетралина, S-(II), полученного, как описано в примере 1, смешивали с 13,8 г K2CO3 (2,2 экв.) и 15 г 2-нитробензолсульфоната 2-(2-тиенил)этанола (1,05 экв.) в 60 мл ацетонитрила. Смесь кипятили с обратным холодильником в течение 9 ч, затем охлаждали до комнатной температуры, добавляли 80 мл воды, ацетонитрил удаляли при упаривании, добавляли 40 мл толуола и слои разделяли. Органический слой дважды промывали 40 мл 5% раствора NaHCO3 при нагревании двухфазной смеси при 60°C и, наконец, водой. Затем в органический слой добавляли 40 мл воды и H3PO4 (до pH 1-2). Слои разделяли, кислотный водный слой подщелачивали при добавлении 10 М NaOH до pH 11 и экстрагировали 30 мл толуола. Органический слой промывали 20 мл воды, упаривали и получали продукт в виде масла. Продукт превращали в бромгидрат при повторном растворении его в этилацетате и добавлении HBr/АсОН. Полученное твердое вещество отделяли фильтрованием и высушивали, при этом получали 15,3 г бромгидрата (S)-2-(N-н-пропил-N-2-тиенилэтиламино)-5-метокситетралина, S-(IV)·HBr, в виде твердого вещества белого цвета (выход 82%).
tпл. (пик ДСК): 142,59°C.
ИК (см-1, KBr): 2933, 2623, 2546, 1587, 1469, 1438, 1258, 1093, 772.
1Н ЯМР (CDCl3): δ 1,01 (t, 3H), 1,90 (гл, 1Н), 2,08 (m, 1Н), 2,59 (m, 2Н), 3,00-3,70 (m, 11Н), 3,78 (s, 1Н, ОСН3), 6,67 (d, 1Н, Ar-H), 6,70 (d, 1Н, Ar-H), 6,92 (m, 2Н, Ar-H), 7,11 (t, 1Н, Ar-H), 7,17 (d, 1Н, Ar-H), 11,43 (s, 1Н, NH).
Пример 6. Получение (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола, S-(I), из бромгидрата (S)-2-(N-н-пропил-N-2-тиенилэтиламино)-5-метокситетралина, S-(IV)·HBr
10 г бромгидрата (S)-2-(N-н-пропил-N-2-тиенилэтиламино)-5-метокситетралина, S-(IV)·HBr, растворяли в 50 мл дихлорметана при комнатной температуре. Смесь охлаждали при температуре ниже 0-5°C. Затем по каплям добавляли 55 мл раствора BBr3 в дихлорметане (5 экв.) и смесь выдерживали при температуре 0-5°C при перемешивании в течение 6 ч. В реакционную смесь добавляли 60 мл воды. Полученный осадок твердого вещества отделяли фильтрованием. Влажное твердое вещество суспендировали при комнатной температуре в 20 мл воды и 40 мл этилацетата. Смесь подщелачивали до pH 7-7,5 при добавлении 30% раствора K2CO3. Слои разделяли и водный слой экстрагировали 20 мл этилацетата, который объединяли с полученным ранее органическим слоем. Органический слой промывали 10 мл воды и упаривали, при этом получали 6,9 г (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола, S-(I), в виде твердого вещества белого цвета (выход 90%).
tпл. (пик ДСК): 78,37°C.
| название | год | авторы | номер документа |
|---|---|---|---|
| S-ЭНАНТИОМЕР ЗАМЕЩЕННОГО 2-АМИНОТЕТРАЛИНА, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВОМ АНТАГОНИСТА 5-НТ*001*00А-РЕЦЕПТОРА | 1990 |
|
RU2086537C1 |
| СОЕДИНЕНИЯ ТИЕНИЛ[3, 2-d]ПИРИМИДИН-4-ОН, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624021C2 |
| (R)-2-АРИЛПРОПИОНАМИДЫ, ПОЛЕЗНЫЕ ПРИ ИНГИБИРОВАНИИ ИЛ-8-ИНДУЦИРОВАННОГО ХЕМОТАКСИСА НЕЙТРОФИЛОВ, СПОСОБ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ХЕМОТАКСИС НЕЙТРОФИЛОВ, ИНДУЦИРОВАННЫЙ ИНТЕРЛЕЙКИНОМ-8 | 2001 |
|
RU2273630C2 |
| СПОСОБ ПОЛУЧЕНИЯ (S)-3-АМИНОМЕТИЛ-5-МЕТИЛГЕКСАНОВОЙ КИСЛОТЫ (ПРЕГАБАЛИНА) | 2013 |
|
RU2544859C1 |
| ПРОИЗВОДНЫЕ 5-ГИДРОКСИМЕТИЛОКСАЗОЛИДИН-2-ОНА | 2007 |
|
RU2453546C2 |
| НОВЫЕ N-МОДИФИЦИРОВАННЫЕ 5-МЕТИЛ-2'-ДЕЗОКСИЦИТИДИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКОЗНУЮ АКТИВНОСТЬ | 2021 |
|
RU2766333C1 |
| СОЕДИНЕНИЯ 3,5-ДИАМИНО-6-ХЛОР-N-(N-(4-ФЕНИЛБУТИЛ)КАРБАМИМИДОИЛ)ПИРАЗИН-2-КАРБОКСАМИДА | 2013 |
|
RU2671976C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-ПИРРОЛИН-2-КАРБОНОВОЙ КИСЛОТЫ | 1997 |
|
RU2199529C2 |
| ФОСФОРОАМИДАТНЫЕ ПРОИЗВОДНЫЕ 5-ФТОР-2'-ДЕЗОКСИУРИДИНА ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2614406C2 |
| Способ получения N-((гидроксиамино)-оксоалкил)-2-(хиназолин-4-иламино)-бензамидов | 2019 |
|
RU2722694C1 |
Изобретение относится к новому способу получения оптически активных соединений: (S)-(-)-2-(N-пропиламино)-5-метокситетралина и (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина. Указанный способ включает оптическое разделение смеси энантиомеров 2-(N-пропиламино)-5-метокситетралина и 2-(N-пропиламино)-5-гидрокситетралина в присутствии оптически активной формы N-(3,5-динитробензоил)-α-фенилглицина. Способ позволяет получать продукт с высокой степенью оптической чистоты. Изобретение также относится к применению солей (S)-(-)-2-(N-пропиламино)-5-метокситетралина и (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина в качестве промежуточных соединений при получении ротиготина. 5 н. и 2 з.п ф-лы, 6 пр.
1. Способ получения оптически активных (S)-(-)-2-(N-пропиламино)-5-метокситетралина и (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина формул S-(II) и S-(III) соответственно:
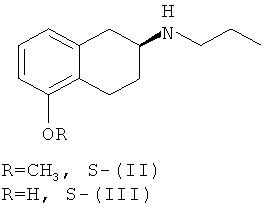
включающий оптическое разделение соответствующих соединений формул (II) и (III):
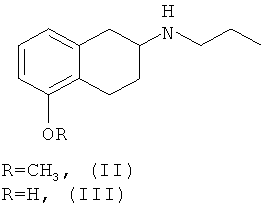
в присутствии оптически активной формы N-(3,5-динитробензоил)-α-фенилглицина.
2. Способ по п.1, в котором получение оптически активного соединения S-(II) включает оптическое разделение соответствующего соединения (II) в присутствии (+)-N-(3,5-динитробензоил)-α-фенилглицина.
3. Способ по п.1, в котором получение оптически активного соединения S-(III) включает оптическое разделение соответствующего соединения (III) в присутствии (-)-N-(3,5-динитробензоил)-α-фенилглицина.
4. Соль (S)-(-)-2-(N-пропиламино)-5-метокситетралина, S-(II), и (+)-N-(3,5-динитробензоил)-α-фенилглицина формулы (V):
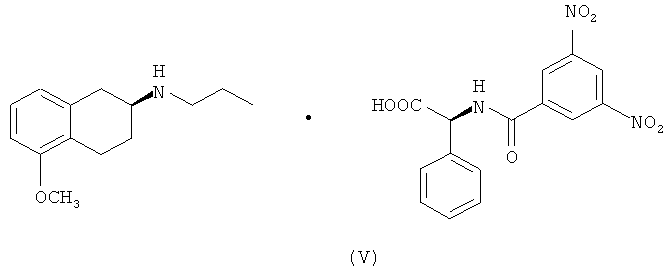
5. Соль (S)-(-)-2-(N-пропиламино)-5-гидрокситетралина, S-(III), и (-)-N-(3,5-динитробензоил)-α-фенилглицина формулы (VI):
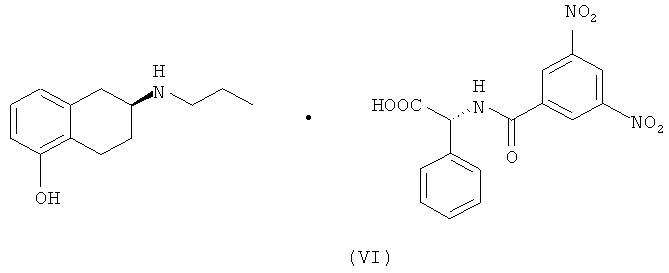
6. Применение соли формулы (V) по п.4, в качестве промежуточного соединения при получении (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола (ротиготина).
7. Применение соли формулы (VI) по п.5 в качестве промежуточного соединения при получении (6S)-(-)-5,6,7,8-тетрагидро-6-[пропил(2-тиенил)этил]амино-1-нафтола (ротиготина).
| CUSACK N.J | |||
| ЕТ AL, "N-0923 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Drugs of the future, vol.18(11), p.1005-1008 | |||
| WO 9013294 A, 15.11.1990 | |||
| WO 1981003491 A, 10.12.1981 | |||
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРО-2-НАФТИЛАМИНА | 1990 |
|
RU2086535C1 |
Авторы
Даты
2013-01-27—Публикация
2009-10-09—Подача