Данное изобретение касается ново гетероциклической системы-индоло/3, -d//1,3/бензоди.азе1шна и ее производ ных общей формулы I НС1 (I) где R означает атом водорода, хлора метил, метоксигруппу. В литературе описаны системы тип А и типа Б) нижеследующих стру тур соответственно: Новизна системы индoлo/3,2-d//1,3 бензодиазепина (I) состоит в том, что индольный цикл сочленен с 1,3-бензодиазепиновым кольцом по положе нию 3,2-d, что можно рассматривать, как новое сочетание известных типов связей , C-N, , N-C, С-С. Образование новой системы доказано ходом химических превращений. Структура соединений общей формулы I подтверждена спектральными характеристиками, а также данными элементного анализа. В масс-спектрах указанных соединений наблюдаются пики молекулярных ионов, массовые числа которых отвечают молекулярным весам оснований соответствующих индoлo/3,2-d//1,3/бензодиазепинов. К-Шз - + I
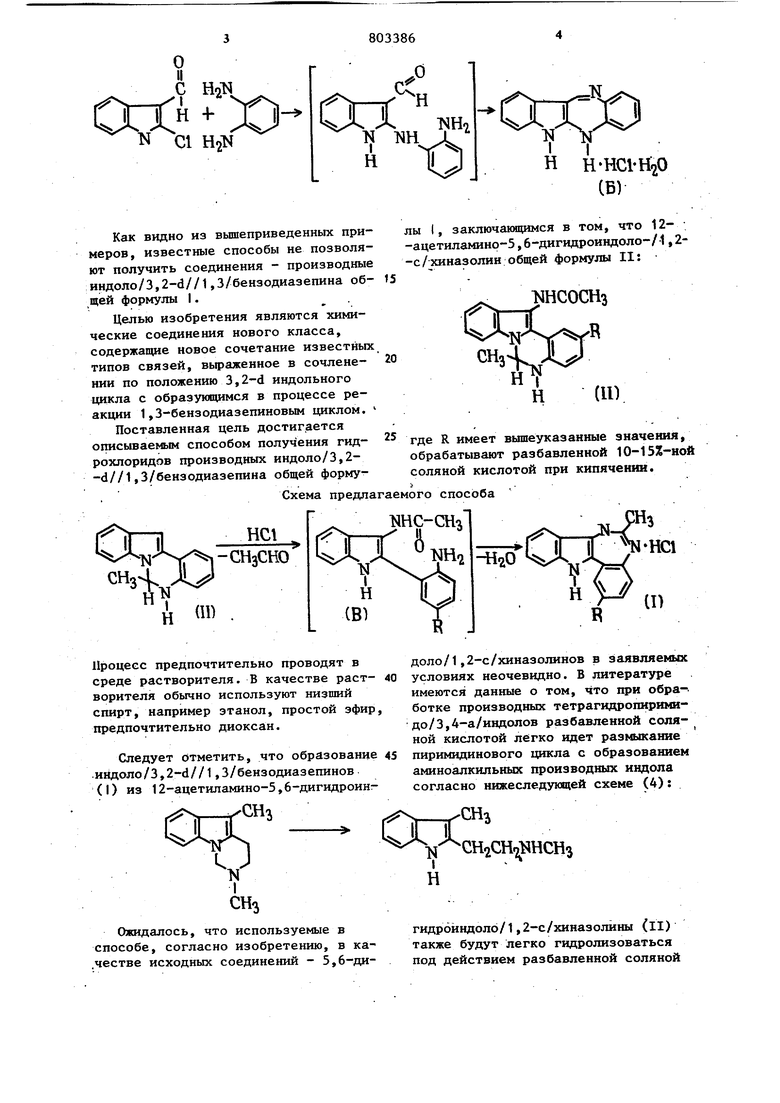
Известен способ получения соединения формулы Б путем нагревания 2-х.т1Ор-3-формилиндола с
о-фенилендиамином в спиртовой среде согласно нижеследующей схеме : 86 Соединение} общей формулы I представляют собой кристаллические вещества красного цвета, растворимые в воде и в спирте, устойчивые на воздухе, высокоплавкие (т.пл. 310 С и более с разложением). , Описываемые соединения - индоло /3,2-d//1,3/бензодиазепины общей формулы 1 - сочетают в себе фрагменты индола и бензодиазепина, производные которых обладают большим комплексом фармакологических свойств. Так, например, 1-(и-хлорбензоил)-5-метокси-2-метилиндолил-З-уксуснаякислота обладает противовоспалительной активностью, а также используется как противоревматическое средст1,2-Диметил-3-карбэтокси-5-оксииндол обладает гипотензивным действием . Различные производные 1,4-бензодиазепина применяют в качестве снотворных и транквилизирующих средств . Принимая во внимание вышеизложенное, можно ожидать, что новые соединения могутпредставить интерес в качестве потенциальных биологически активных веществ. Кроме того, наличие в молекуле данных соединений двух иминогрупп и активной метильной группы обуславливает использование этих соединений в качестве полупродуктов для синтеза по.тенциальных биологически активных веществ ряда индoлo/3,,3/бензодиазепина. Объектом изобретения является также способ получения соединений общей формулы I. Известен способ синтеза соединений формулы (А) путем взаимодействия 1,2,3,4-тетрагидро-2,5-диметилпиридо/4,3-в/индола с тозилазидом при нагревании (45°С) в течение двух дней или при кипячении в течение трех ч.асов в пропаноле, согласно нижеследующей схеме : ;к-Шз AHJ (А)
HHClH O (Б) Как видно из вышеприведенных примеров, известные способы не позволяют получить соединения - производные индоло/3,2-6//1,3/бензодиазепина общей форьсулы I. Целью изобретения являются химические соединения нового класса, содержащие новое сочетание известных типов связей, выраженное в сочленении по положению 3,2-d индольного 1Ц1кла с образующимся в процессе реакции 1,3-бензодиазепиновым циклом. Поставленная цель достигается описываемым способом получения гидрохлоридов производных индоло/3,2-d//1,3/бензодиазепина общей формуСхемапредлагаемого способа лы I, заключающимся в том, что 12-ацетиламинр-5,6-дигидроиндоло-/1,2-с/хиназолин общей формулы II: NHCOCH3 где R имеет вышеуказанные значения, обрабатывают разбавленной 10-15%-ной соляной кислотой при кипячении. ИНС-СНа X и im,
Процесс предпочтительно проводят в среде растворителя. В качестве раст- 40 ворителя обычно используют низший спирт, например зтанол, простой зфир, предпочтительно диоксан.
Следует отметить, что образование 45 .индoлo/3,2-d//1,3/бензодиазепинов (I) из 12-ацетш1амино-5,6-дигидроиндоло/1,2-с/хиназолинов в заявляемых условиях неочевидно. В литературе имеются данные о том, что при обра-, ботке производных тетрагидропиримидо/3,4-а/индолов разбавленной соляной кислотой легко идет размыкание пиримидинового цикла с образованием аминоалкильных производных индола согласно иижеследукяцей схеме (4):
СНа
i.lL
I
н
Ожидапось, что используемые в способе, согласно изобретению, в ка.честве исходных соединений - 5,6-дигидр6индол6/1,2-с/хиназолины (ll) также будут легко гидролизоваться под действием разбавленной соляной
кислоты с образованием вышеуказанных 2-(о-аминоарил)-3-ацетиламиноиндолов общей формулы (В). Однако в описьшаемых условиях реакция не останавливается на стадии образования соединений (В), а моментально протекает дальше с замыканием бензодиазепинового цикла и с образованием сое динений общей формулы I. Такое протекание реакции, в свою .очередь, также неожиданно, так как в литературе имеются сведения о неудачной
5 попытке циклизации 2-амино-Н-бензоил-4,5-диметоксифенетиламина в бензодиазепиновьй цикл при нагревании до , а также при кипячении в ксилоле в присутствии кислотного катализатора (5):
СНзО
С
СНзОНижеследующие примеры иллюстрирую новый способ получения новых соедине НИИ общей формулы 1. Пример 1. Гидрохлорид 1(3)Н-2,6-диметил-8Н индоло/3,2-а/ /1,3/бензодиазепина. К суспензии 0,6г (0,002 моль) 2,6-диметил-12-ацетиламино-5,6-дигидроиндоло/1,2-с/хиназолина в 9 мп диоксана добавляют 4 мл 10%-ной соляной кислоты и кипятят 1 ч. Затем реакционный раствор упаривают досух Остаток кристаллизуют из спирта. Получают 0,3 г (51%) гидрохлорид 1(3)Н-2;6-диметил-8Н-индоло/3,2-а//1,3/бензодиазепина, т.пл. свьше разложением (из спирта). Найдено, %: С 68,80, Н 5,35; N 14,00; С1 11,90. Вычислено, %: С 68,57; Н 5,42; N 14,11; С1 11,91. УФ-спектр,Дмл« (Ig) 228(4,46), 280(4,52), 290(4,50)плечо 315(4,12)плечо ПМР-спектр,б , М.Д.: 2,21 ш.с.СНз(б) , 2,27 - c.CHjij) , 6,567,30-м. СА,5,т -Н,С5.„ тН,7,4-м.Си-И В условиях, аналогичных вышеуказанным, но с проведением процесса в среде этилового спирта, выход целевого продукта составляет 37%, а без использования растворителя 10%. Смешанная проба соединения, полученного в этих условиях, с продуктом (1), полученным в среде диоксана, н показывает депрессии температуры плавления. Пример 2. Гидрохлорид 1(3) -2-метил-8Н-индоло/3,2-а//1,3/бензодиазепина. Из 0,6 г (0,002 моль) 6-метил-12ацетил-5,6-дигидроиндоло/1,2-с/-хиазолина в условиях примера 1 полуают 0,2 г (34%) гидрохлорида 1(3)Н2-мецил-8Н-индоло/3,2-d//1,3/бензоиазепина,т.пл. ЗЮс с разложением (из спирта). Найдено, %: С 67,62; Н 4,87, N 14,66; С1 12,57. Ci6 HI N,C1 Вычислено, %: С 67,72; Н 4,97; .. N 14,81; С1 12,50. УФ-спектр,Дмокс , н.м. (Ig6): 28(4,38), 272(4,45)плечо, 278(4,46), 310(4,08)плечо. ПМР-спектр,8 , М.Д.: 2,23 с.СНз(г , 6,6-7,3-м.С/,.7-Н,Сд.ц -Н, 7,5-м..-Н. Пример 3. Гидрохлорид 1(3)Н-2-метил-6-хлор-8Н-индоло/3,2-d/ /1,3/-бензодиазепина. к суспензии 0,8 г (0,00246 моль) 2-хлор-6-метил-12-ацетиламино-5,6-дигидроиндоло/1,2-с/хиназолина в 12 мл диоксана добавляют 6 мл соляной кислоты и кипятят 1 ч. Смесь охлаждают, выпавший осадок отфильтровывают, промывают спиртом, эфиром. Получают 0,58 г (74%) гидрохлорида 1(3)Н-2-метил-6-хлор-8Н-индоло/3,2-d//1,3/бензодиазепина, т.пл. CBbmie (с разложением). Найдено, %: С 60,26; Н 4,19; N 13,14; С1 21,86. 16 1 . Вычислено, %: С 60,39; Н 4,12; N 13,21; С1 22,.29. УФ-спектр,Лмлк , н.м. (lg): 231(4,46), 270(4,41)ш1ечо, 291(4,51), 322(4,05)плечо. П р- л м е р 4. Гидрохлорид 1(3) -2-метил-6-метокси-8Н-индоло/3,2-d//1,3/бензодиазепина. Из 0,64 г (0,002 моль) 2-метокси -6-метил-12-ацетиламнно-5,6-дигидро индоло/1,2-с/биназолина в условиях примера 3 (смесь кипятят в течение 2 ч)получают 0,25 г (40%) гидрохлорида 1(3)Н-2-метш1-6-метокси-8Н-индоло/3,2-ё/./1,3/бензодиазепина. Найдено,%: С 65,27; Н 5,14; N 13,34; С1 11,11. Н, N ОС1. Вычислено,%: С 65,07; Н 5,14; N 13,39; С1 11,ЗО: 6 8 УФ-спектр, Ямочке , н.м. 228 (4,41), 268(4,35)плечо,298(4,51), 320(4,08)плечо. ПМР-спектр, В, М.Д.: 2,30 с.СНз(, , 3,75 - c.OCHi(k) , 7,35 7,77-M.C,s,7,-H,Cg.,i -Н 7,8-м.С,г Н. Описываемый способ позволяет получать новые соединения общей форму являкщиеся производными новой гетероциклической системы индоло|/3,2-d//1,3/бензодназепина и пред ставляющие интерес в качестве потенциальных биологически активных соединений или полупродуктов для синтеза последних.


1.. Гидрохлориды производных1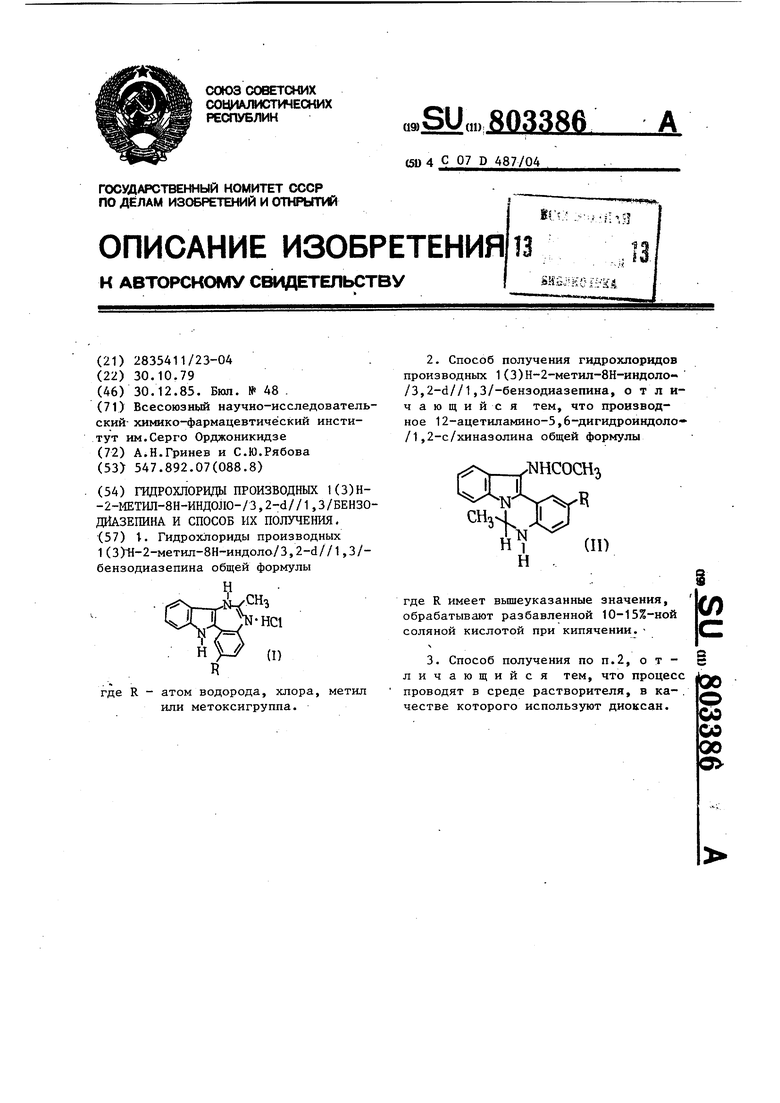
Авторы
Даты
1985-12-30—Публикация
1979-10-30—Подача