Предлагаются новые производные пирано[4',3':4,5]тиено[2,3-d]пиримидина, обладающее противосудорожной актив- ностью, которые могут найти применение в медицине.
Известно применение заронтина (α-этил-α-метилсукцинимид) и люминала (фенобарбитал) в качестве противосудорожных и противоэпилептических средств.
Наиболее близким по структуре и действию к предлагаемому соединению являются 3-N-производные 6,6-диметил-5,6- дигидро-8Н-пирано-7-пирано[4',3': 4,5]-4 -оксотиено[2,3-d]дигидропиримидина общей формулы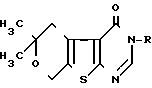 R H, CH3, C2H5, изо-C3H7, трет-C4H9, обладающие противосудорожной активностью.
R H, CH3, C2H5, изо-C3H7, трет-C4H9, обладающие противосудорожной активностью.
Цель изобретения поиск в области производных пирано[4',3':4,5]тиено[2,3-d]пиримидина, обладающих более высокой противосудорожной активностью.
Поставленная цель достигается предлагаемым 2-метиламино-4-оксо-3,6,6-триметил-5,6-дигидро -8Н-пирано[4',3':4,5] тиено[2,3-d]пиримидином формулы или его солями, обладающими противосудорожной активностью.
или его солями, обладающими противосудорожной активностью.
2-Метиламино-4-оксо-3,6,6-триметил-5, 6-дигидро- 8Н-пирано[4',3':4,5] тиено[2,3-d] пиримидин получают взаимодействием 2-меркапто-4-оксо-3,6,6-триметил-5,6-дигид-ро- 8Н-пирано[4',3':4,5]тиено[2,3-d]пиримидина с йодистым метилом в спиртовой среде в присутствии щелочи с последующим нагреванием смеси образовавшегося 2-метилмеркапто-4-оксо-3,6,6-триметил-5,6-дигид-ро -8Н-пирано[4', 3': 4,5]тиено[2,3-d]пиримидина и 25%-ного водного раствора метиламина в закрытой металлической бомбе. Для получения гидрохлорида и цитрата 2-метиламино-4-оксо-3,6,6-триметил-5,6-дигидро -8Н-пирано[4',3':4,5]тиено[2,3-d] пиримидина на его хлороформный раствор действуют эфирным раствором хлористого водорода или лимонной кислоты соответственно. Схема синтеза:
Строение полученных соединений доказано элементным анализом, ИК- и ПМР-спектроскопически и масс-спектрометрически. Чистота проверена тонкослойной хроматографией на пластинках "Silufol UV-254", проявитель пары йода.
2-Метиламино-4-оксо-3,6,6-триметил-5, 6-дигидро -8Н-пирано[4',3':4,5] тиено[2,3-d] пиримидин (соединение I) представляет собой белое кристаллическое вещество без запаха, растворимое в хлороформе, пиридине и диметилcульфокcиде, нераcтворимое в воде, эфире. Его гидрохлорид (соединение Ia) кристаллическое вещество кремового цвета, а цитрат (соединение Iб) кристаллическое вещество белого цвета; оба они не имеют запаха, раствоpимы в пиридине, диметилсульфоксиде, плохо растворимы в воде, этиловом и бутиловом спиртах, нерастворимы в эфире.
П р и м е р 1. 2-Метилмеркапто-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидин (II).
К раствору 2,82 г (0,01 моль) 2-меркапто-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидина (III), 0,56 г (0,01 моль) гидроокиси калия в 20 мл 90%-ного этилового спирта при комнатной температуре и перемешивании по каплям прибавляют раствоp 1,42 г (0,01 моль) йодистого метила в 5 мл этилового спирта. Перемешивание продолжают 2 ч, затем реакционную смесь разбавляют 10 мл воды, выпавшие кристаллы отфильтровывают и промывают эфиром. Выход 2,75 г (93,1%), т.пл. 230-231оС (этиловый спирт), Rf 0,65 (этилацетат-эфир, 1:1).
Найдено, С 52,57; Н 5,50; N 9,72; S 21,56.
C13H16N2O2S2.
Вычислено, С 52,67; Н 5,44; N 9,45; S 21,69.
ИК-спектр, ν см-1: 1690 (С=О); 1650 плечо и 1530 (ароматика).
ПМР-спектр (CDCl3), δ, м.д. 4,73 (2Н, т, 8-СН2); 3,50 (3Н, с, N-CH3); 2,93 (2Н, т, 5-СН2); 2,60 (3Н, с, S-CH3); 1,33 [6Н, с, 6-(СН3)2]
П р и м е р 2. 2-Метиламино-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидин (I).
Смесь 2,96 г (0,01 моль) 2-метилмаркапто-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидина (II) и 19,8 г (0,16 моль) 25% -ного водного раствора метиламина нагревают в закрытой металлической бомбе при 150оС в течение 20 ч. Выпавшие кристаллы отфильтровывают и промывают водой. Выход 1,67 г (60,0% ), т.пл. 255-257оС (бутиловый спирт), Rf 0,66 (ацетон-хлороформ, 1:1).
Найдено, C 56,38; H 6,12; N 15,20; S 11,78.
C13H17N3O2S.
Вычислено, С 56,01; Н 6,02; N 15,04; S 11,50.
ИК-спектр, ν, см-1":3400 (NH); 1685 (С=О); 1650 плечо и 1530 (ароматика).
ПМР-спектр (пиридин-d5), δ, м.д. 4,74 (2Н, т, 8-СН2); 3,46 (3Н, с, N-СН3); 3,13 (2Н, т, 5-СН2); 3,0 (3Н, д, J 5 Гц, 2- 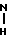
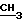 ); 1,33 [6H, c, 6-(CH3)2]
); 1,33 [6H, c, 6-(CH3)2]
Масс-спектр, м/е: M+ 279.
П р и м е р 3. Гидрохлорид 2-метиламино-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидина (Ia).
К раствору 2,79 г (0,01 моль) 2-метиламино-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидина (I) в 20 мл сухого хлороформа при перемешивании прибавляют эфирный раствор хлористого водорода до кислой реакции. Выпавшие кристаллы отфильтровывают, многократно промывают эфиром и высушивают в вакуум-эксикаторе. Выход 3,10 г (98,4%), т. пл. 250-251оС (абсолютный бутиловый спирт).
Найдено, C 49,26; H 5,61; N 13,59; S 9,97; Cl 11,08.
C13H18N3O2SCl.
Вычислено, С 49,43; Н 5,74; N 13,30; S 10,15; Cl 11,22.
ПМР-спектр (пиридин-d5), δ м.д. 10,96 (1Н, с,  CH3); 4,71 (2Н, т, 8-СН2); 3,43 (3Н, с, N-CH3); 3,10 (5Н, с, 5-СН2, 2-
CH3); 4,71 (2Н, т, 8-СН2); 3,43 (3Н, с, N-CH3); 3,10 (5Н, с, 5-СН2, 2- 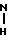
 ); 1,27 [6H, c, 6(CH3)2]
); 1,27 [6H, c, 6(CH3)2]
П р и м е р 4. Цитрат 2-метиламино-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидина (Iб).
К раствору 2,79 (0,01 моль) 2-метиламино-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидина (I) в 20 мл сухого хлороформа при перемешивании прибавляют эфирный раствор 1,92 г (0,01 моль) лимонной кислоты. Выпавшие кристаллы отфильтровывают, многократно промывают эфиром и высушивают в вакуум-эксикаторе. Выход 4,6 г (97,6%), т. пл. 251-253оС (абсолютный бутиловый спирт).
Найдено, С 48,24; Н 5,62; N 8,98; S 6,58.
С19H25N3O9S.
Вычислено, С 48,40; Н 5,34; N 8,91; S 6,80.
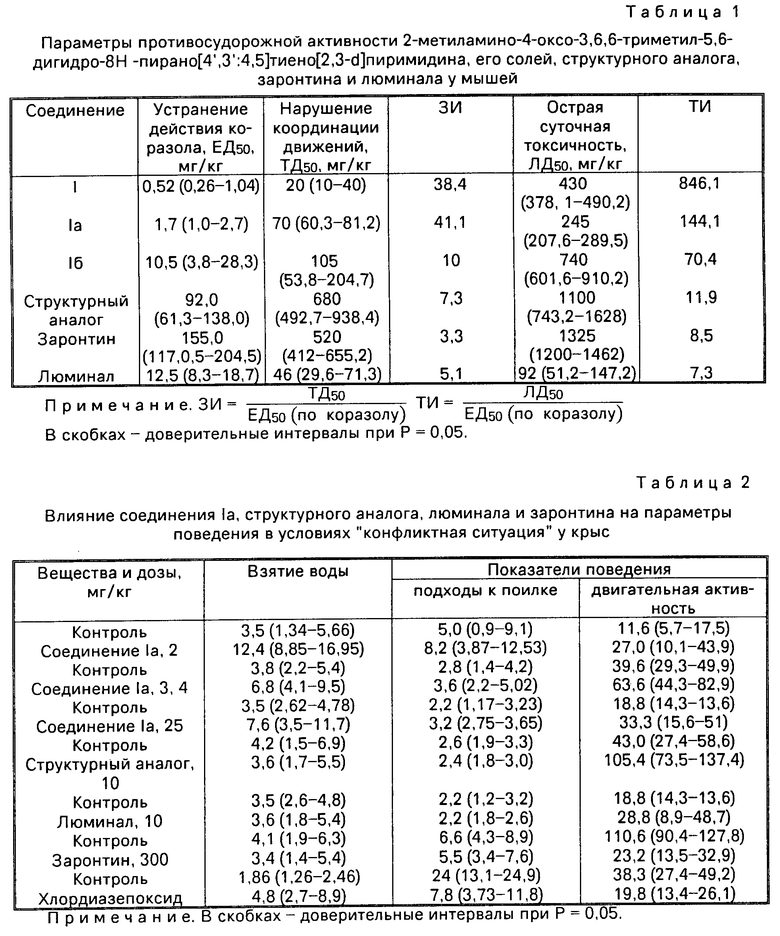
Фармакологические исследования соединений I, Ia и Iб проводили в сравнении с люминалом, заронтином и 6,6-диметил-5,6-дигидро-8Н-7-пирано[4',3':4,5] -4-оксотиено[2,3-e] -3Н-дигидро пири(структурный аналог) наиболее активным соединением из 3-N-производных 6,6-диметил-5,6- дигидро-8Н-7-пирано[4',3': 4,5]-4 -оксотиено[2,3-d]дигидропиримидинов.
В опытах использовано 436 белых мышей массой 18-20 г и 194 белые крысы (самцы) массой 120-130 г.
О противосудорожной активности судили по устранению клонических судорог при подкожном введении коразола, по предотвращению тонической экстензии максимального электрошока, никотиновой гипертензии и ареколинового тремора. Миорелаксантный эффект (побочное действие антиконвульсантов) исследовали по нарушению координации движения, используя методику "вращающегося стержня". Определяли также острую суточную токсичность у мышей. Вычисляли 50%-ные эффективные (ЕД50), нейтротоксические (ТД50) и летальные (ЛД50) дозы, а также защитные ЗИ (ТД50/ЕД50) и терапевтические ТИ (ЛД50/ЕД50) индексы.
Исследуемые соединения за исключением соединения Ia, предотвращающего электрические судороги в токсической дозе 76 (47,5-151,6) мг/кг, не ослабляют никотиновой гипертензии, ареколинового тремора и тонической экстензии максимального электрошока. Однако все они, введенные за 45 мин до судорожного вещества коразола, обладают антикоразоловой активностью и предупреждают клонические судороги у мышей в незначительных дозах (см. табл. 1).
Побочные явления нарушение координации движения, атаксия, миорелаксация и токсичность, вызываемые изучаемыми соединениями, отмечаются в дозах, превышающих противосудорожные в десятки и сотни раз (см. табл. 1).
В аналогичных условиях эксперимента люминал, заронтин и структурный аналог также проявляют антагонизм в отношении коразола, однако небольшое увеличение доз антиконвульсантов приводит к явлениям миорелаксации и летальности.
В поиске новых противосудорожных соединений целесообразно выявление сопутствующих антиневротических (транквили- зирующих) эффектов. В связи с этим соединения I, Ia и Iб были дополнительно исследованы на наличие транквилизирующего свойства. Оценку транквилизирующего действия проводили с помощью методики "конфликтная ситуация". Она создавалась у крыс столкновением двух безусловных рефлексов питьевого и оборонительного. В момент, когда животное брало воду, наносили электроболевое раздражение. О наличии антиневротического эффекта судили по возрастанию основного показателя поведения крыс числу взятий воды. Вещества вводили внутрибрюшинно. Результаты обрабатывали статистически по Стьюденту-Фишеру.
Как показали исследования транквилизирующим свойством обладает только соединение Ia. Так, в дозе 2 мг/кг оно приводит к возрастанию (в 3,5 раза) основного показателя поведения животных числа взятий воды, несмотря на электроболевое раздражение, что свидетельствует о наличии транквилизирующего эффекта. Наблюдается рост и других показателей подходов к поилке и двигательной активности. Транквилизирующее действие сохраняется у этого соединения также в дозах 3,4 и 25 мг/кг. Структурный аналог, люминал и заронтин в дозах 10, 10 и 300 мг/кг соответственно лишены антиневротической активности (см. табл. 2). Введение хлордиазепоксида широко применяемого транквилизатора в дозе 2 мг/кг в аналогичных условиях сопровождается возрастанием числа взятий воды всего в 2,5 раза, а остальные показатели даже снижаются.
Таким образом, 2-метиламино-4-оксо-3,6,6-триметил-5,6-дигидро-8Н -пирано[4',3':4,5]тиено[2,3-d]пиримидин и его соли обладают выраженным антикоразоловым действием, вызывают слабые побочные и токсические эффекты. Их терапевтические и защитные индексы значительно превосходят таковые структурного аналога, люминала и заронтина. Так, ЗИ соединений I, Ia и Iб превосходит ЗИ люминала в 7,5, 8 и 1,9 раза, заронтина в 11,6, 12,4 и 3 раза и структурного аналога в 5,2, 5,6 и 1,3 раза соответственно. ТИ соединений I, Ia и Iб больше ТИ люминала в 115,8, 19,7 и 9,5 раза, заронтина в 99,5, 17,3 и 8,2 раза и структурного аналога в 71,1, 12,1 и 5,9 раза соответственно. Кроме того, соединение Iа обладает также желательным транквилизирующим эффектом, превосходящим таковой структурного аналога, люминала и заронтина.
2-МЕТИЛАМИНО-4-ОКСО-3,6,6-ТРИМЕТИЛ-5,6-ДИГИДРО-8Н-ПИРАНО[4′,3′ : 4,5] ТИЕНО[2 ,3-D]ПИРИМИДИН ИЛИ ЕГО СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ 2-Метиламино-4-оксо-3,6,6-триметил-5,6- дигидро-8H-пирано[4′,3′ : 4,5] тиено[2,3-d]пиримидин формулы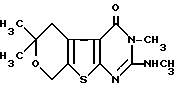
или его соли, обладающие противосудорожной активностью.
2-Метиламино-4-оксо-3,6,6-триметил-5,6- дигидро-8H-пирано[4′,3′ : 4,5] тиено[2,3-d]пиримидин формулы
или его соли, обладающие противосудорожной активностью.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Машковский М | |||
| Д | |||
| Лекарственные средства | |||
| М.: Медицина, 1978, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Там же, с.28 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Авторское свидетельство СССР N 636883, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1996-02-10—Публикация
1983-12-06—Подача