(5) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-ФЕНИЛ-2-АМИНОЭТАНОЛА В СВОБОДНОМ ВИДЕ
1
Изобретение относится к способу получения новых производных 1-фенил- 2-аминоэтанола, обладающих противовоспалительным действием,
Известно, что некоторые 1-фенок- 5 си-3 f (ациламино) -алканоиламино}.-алкиламино -пропан-2-оловые производные обладают фармакологическим действием l.,
Целью изобретения является рас- ю ширение арсенала производных 1-фенил-2-аминоэтанола, обладающих фармакологическим действием.
Указанная цель достигается способом получения 1-фенил-2-аминоэта- is мольных производных формулы
fiCHtOH)CHq NHC{ BrANHtC04NK)Q, (Г) где R - радикал рбщёй формулы ИЛИ В ВИДЕ СОЛИ
где W - алканоилокси с 1-12 углеродными атомами ,
VV не могут быть одинаковыми и обозначают водород или алканоилокси с 2-12 углеродными атома1
ми, А
прямая связь или метиленовый двухвалентный радикал, или же R - фенил, 2-хлорфенил или 3,5-Дихлор-А-аминофенил;
R и водород или алкильный радикал с l-t углеродными атомами, А - алкиленовый двухвалентный радикал с }-k углеродными атомами, V - алкиленовый двухвалентный радикал С- I- углеродными атомами, возможно содержащий алкильный заместитель (с 1- углеродными атомами) или бензильный заместитель-, п - а Q- бензоил, фенилацетил или феноксиацетил возможно содержащий в кольце заместитель, выбираемый из класса галоидов, алкилов с 1- углеродными атомами, алкоксилов с 1-А углеродными атомами и трифторметила ,при условии, что, в том случае, когда rw 3 « 9 отлично от 1, значения в радикала формулы COYNH могут быть одинаковы или различны, в свободном виде или в виде соли. Способ получения соединений формулы (1 ) основан на известной реакции восстановительного аминирования карбонильных соединений при комнатной температуре и рН - 4-6 Г2 и заключается в обработке глиоксаля общей формулы R. С О-С НО («1) амином общей формулы HnNC#R ANH(COVNH;na ,{ж) в которой R, R, R, А , Y, n и d имеют указанны значения, в присутствии боргидрида щелочного металла с последующим выделением целевого п дукта в свободном виде или в виде соли. Восстановление проводят, например цианборгидридом щелочного металла, в частности цианборгидридом натрия, обычно в среде инертного растворителя или разбавителя, например ацетонитрила, метанола, эт нола или 2-пропанола, и при темпера туре от -20 до 30°С„ Процесс обычно проводят при величине рН, равной 4 или близкой к этому значению, напри мер в присутствии уксусной кислоты. Установлено, что соединения форм лы (1) обладают противовоспалительным действием, вследствие чего их можно использовать для лечения мест ных воспалительных процессов или за леваний, связанных с воспалением кожи у теплокровных животных. Противовоспалительные свойства соединений формулы ( ) демонстрируют путем проведения стандартных испытаний, включающих в себя ингибиро вание действия кротонового масла, индуцирующего воспаления уха мыши. Активность индивидуальных соединени формулы {1 ) в ходе проведения этого испытания зависит от его химической структуры. Соединения формулы (1 )пр являют заметную способность ингибировать воспаление при местном нан сении вещества в дозировке 0,30 мг/у или при значительно более низкой дозировке. Другое станГдартное испытание, в котором демонстрируют противовоспалительные свойства соединения форму лы (1 ), включает в себя ингибирование контактной чувствительности уха МЫШИ, вызванное оксазолоном. Обычно соединения формулы (1 ) производят заметное, подавление воспаления в данном испытании при их нанесении на воспалительный участок в дозировке 0,6 мг/ухо или еще меньше. Пример 1„ Раствор 0,9 г 3,-бис-(пи валоилокси)-фенилглиоксаля и 0,б7 г N-(2-амино-2-метилпропил)-N-бензоилглицинамида в 2 мл уксусной кислоты и 10 мл ацетонитрила перемешивают 30 мин с последующей обработкой 0,3 г цианоборгидрида натрия. Зат.ем эту реакционную смесь перемешивают в течение ночи, после чего выпаривают в глубоком вакууме. Остаток растворяют в 50 мл этилацетата, и раствор 1промывают 20 мл водного раствора уксусной кислоты концентрацией 10 об.. Водный слой экстрагируют двумя порциями по 50 мл этилацетата, а объединенные органические слои промывают насыщенным раствором хлористого натрия, высушивают над сульфатом магния и выпаривают. Остаток растворяют в диэтиловом эфире, а затем отфильтровывают. Фильтрат обрабатывают небольшим избытком Свежеприготовленного раствора бромистого водорода в диэтиловом эфире. Выпавший в осадок твердый продукт отделяют и перекристаллизовывают из смеси этанола с диэтиловым эфиром с получением 0,3г ,-бис -1ивалоилокси|-фенил -2- (N -бензоилглицил )-амиHoJ-1,1-диметилэтиламино|-этанолбромида в виде твердого вещества с т.пл. 127-129°С, П р и м е р 2. Аналогично примеру 1, но с использованием соответствующего глицинамидного производства получают , -(пивалоилокси)-фенил}-2-Г2-t(N-фeнилaцeтилглицил -амиHoJ-1,1-диметилэтиламино -этанолгидробромид с достижением 35%-ного выхода продукта, . 145-150 С. Найдено, %: С 57,9; 6,7;N6,b Вычислено, %: С 57,8; Н ё,9; N6,3. П р и м е р 3. Аналогично примеру 1, но с использованием соответствующего глицинамидного производного получают 1 Г-3,-бис-(пивалоилокси)-фенил -2- 2- (N-феноксиацетилглицил)-амино -1,Ндиметилэтиламино -этанолгидробромид с достижением 22%-ного выхода продукта, т.пл. 12 4126С. Найдено, Z: С 53,7; Н 7J; Ь 6,1, вычислено, %: С 53,6j H6,8;N$,9 П р и м е р А. Раствор 0,90 г 3, -бис-(пивалоилокси)-фенилглиоксаля и 0,86 г М-(2-амино-2-метилпропил)-N (фенилацетил)-глицил -глицинамида в 2 мл уксусной кислоты и 10 м ацетонитрила перемешивают 30 мин, а затем обрабатывают 0,3 г цианоборгидрида натрия. Реакционную смесь перемешивают а течение ночи, а затем выпаривают в глубоком вакууме. Остаток растворяют в 60 мл этилацетата и раствор последовательно промывают по объему раствором уксусной кислоты (20 мл), 20 мл насыщенного раствора бикарбоната натрия, а затем 20 мл насыщенного раствора хлористого натрия высушивают и выпаривают. Остаток растворяют в диэтиловом эфире и обрабатывают эфирным раствором бромистого водорода по аналогии с изложенным в примере 1. Выпавшей в осадок 0,6 г сырой соли растворяют в минимальном количестве метанола и очищают препаративной хроматографической обработкой на пластинках с силикагелем с использованием в качестве элюента смеси метанола с хлороформом в объемном соотношении 1:, Основной компонент, который содержит ДВУОКИСЬ кремния, выделяют и экстрагируют метанолом. Затем экстракты фильтруют и выпаривают Остаток раст воряют в диэтиловом эфире и раствор обрабатывают эфирным раствором броми того водорода.. Полученную таким образом соль кристаллизуют из смеси этанола с диэтиловым эфиром с получением 0,1 г ,-бис -(пивалоилокси)-фенил -2-f2-(N-бензоилглицил )-глициламино -1,1-диметилэтиламинр -этанолгидробромида в виде твердого продукта, т.пл. 110-115°С, Найдено, %: С 55,8; Н 7,3, N 7,6 118 4°8- /2НВг. Вычислено, г-. С 55,8, Н 6,8; N7,6 Примеры . С использованием соответствующего глиоксаля формулы (III )и амина формулы III ( метилен; R и R- - метилы ) аналогично примеру 1 за исключением того, что очистку соединения формулы{1)в виде свободного основания проводят хроматографической обработкой сырого свободного основания (полученного выпариванием этилацетатных экстрактов) на хроматографическом силикагеле (с размерами частиц 0,,063 мм) (80-100 вес.ч./ч. свободного основания) с использованием хлороформа, который содержит 1-5 об. метанола в качестве элюента. Полученное таким образом и очищенное свободное основание затем растворяют в минимальном объеме хлороформа и подкисляют эфирным раствором бромистого водорода (или хлористого водорода в зависимости от необходимости), а образовавшуюся смесь выпаривают с получением соединения формулы (.1) в виде его гидробромида или гидрохлорида. Характеристики полученных соединений сведены в таблицах l-t. В табл. 1 приведены примеры , где R - 3, -(пивалоилокси)-фенил. В табл. 2 приведены примеры .7i где Rl - 3,5-бис-(пивалоилокси)-фенил : В табл. 3 приведены примеры 18-2, где R - радикал общей формулы . ., в табл. 4 приведены примеры 2,j-30, П р и м е р 31о Аналогично примеру k получают 0,25 г ,-бис-(пивалоилокси)-фенил -2- 2-(N -фенилацетил глицил -амино}-этиламино -этанол гидробромида в виде твердого продукта т.пл. 1 6-Й8°С. Вычислено, %: С 55,0-,Н 6,7; N6,А. CjA.NjO HBr-H-iO Найдено, %: С 5,6; Н 6,5; N6,4. Исходя из 0,9 г 3,-бис -Ч пивалоилокси/-фенилгилоксаля и 0,63б г N -(2-aминo-этил - N (фенилацетил)-глицинамида ).
COCH,jCH, (|5-Аланил)
р-Аяанил
CO-CHCHjNH
о -Аланил
d-Аланил
0о1 Апанил
1 CO-CH/CH,iPh/ СО-Р-Ь /NH (cL-фенилаяанил)
I
2(COCHQ NH)Q,,
(ГЛИЦИЛ-ГЛИцил)
3COC%NHCOx CO-Ph xCHCHjNH (Глицил с -аланил)
CO-CHCHsNHx CO-Ph
xCOCHij NH (oL-аланил глицил;
CO-Ph
Пена
Т.пл. 122-127°С СО- Вычислено, -,С 58,t; Н 6,9; N 6,1 C,J.MJ).mr Найдено, %: С 58,1; Н 7,1; N 5,8
Т.пл. 110-П2°С.
CO-Ph Вычислено, %: С 53,5; И 7,2; N 5,8 (уИ. .тг - 2H,jO
1 г - о,о г- ч 1
Найдено, -и: С 53,2 Н 6,5; N 5,7
Т.пл. П1-113°С
CO-CHoPh Вычислено, : С 50,; Н 7,6; N 5,3 . Cj NjO -HBrSHf D Найдено, %: С 50,1; Н 7,5i N 5,7.
Т.пл. 95-98°С.
COCH OPh Вычислено, %: С 52,9; Н 7,2, N 5,6 (Д зОвКВг-ЗНг О Найдено, %: С 52,3; Н 7,2; 5,6
Т.пл. 158-1б2С
CO-Ph Вычислено, %: С 5,7j Н 7,1-, N 6.Ц (,ЛjnJ) Найдено, %: С 55,1; И 7,0; N 6,3
Т.пл. 145-150 0 Вычислено, %: N 5,7 .HBr Найдено, Z: N 5,. Т.пл. 155-158°С
Т.пл. 145-155°С Вычислено, %: С 56,6, Н 6,8; N 7,7 СЛ«408-НВг Найдено, °4: С 52,0; Н 6,7; N 7,7
Т.пл. 152-158с Вычислено, %: С 8,7i Н 6,8, N 6,6, Вг 14,3 yi, SHBr. Найдено, %: С 48,2; Н 6.5; N 6,4; Вг 14,1.
dt -Фенилаланил CO-Ph
17
Вычислено, : С 53,6; Н 7.2; N 5,7 С:,,НВг.2, 5Н.2.0Найдено, : С 53,А, Н 7,2, N 6,0.
Т.пл. 110-П1°С Вычислено, %: С 58,8; Н 6,9; « 5,J. (,-HBr-2H.iO Найдено, %i С 58,8; Н 6,9; N 5,6.



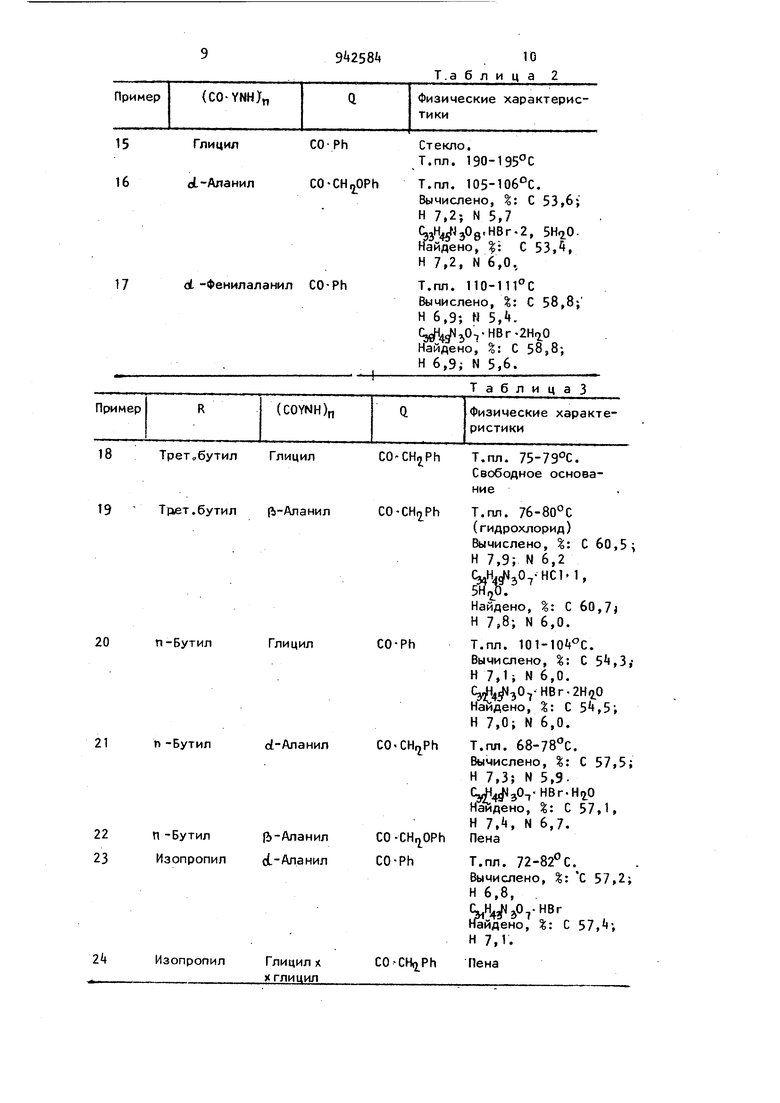



18Трет„бутил Глицил
19 Трет.бутил (i-Аланил
Глицил
20п-Бутил
21
п-Бутил
о1-Аланил
(Ь-Аланил
П-Бутил ({.-Ал а НИЛ Изопропил
24
Изопропил
Глицил X
X ГЛИЦИЛ
Т.пл. 75-7Э°С.
Свободное основание
Т.пл. 7б-80°С (гидрохлорид) Вычислено, %: С 60,5; Н 7,9; N 6,2
ад зОунсм,
5%0.
Найдено, %: С 60,7j
Н 7„8; N 6,0.
Т.пл. lOI-lOt C.
Вычислено, %: С 5,3,И 7,Ь N 6,0. HaWno, %i С 5,5; Н 7,0; N 6,0.
Т.пл. 68-78с.
Вычислено, : С 57,S;
Н 7,3; N 5,9.
Cy.jp-,
Найдено, %: С 57,1,
Н 7,, N 6,7. Пена
Т.пл. 72-82 с.
Вычислено, %: С 57,2; Н 6,8,
.JJjO -НВг Найдено, %: С 57,, Н 7,1.
Пена
11
Фенил
Глиция
2-Хлорфенил Глицил
Глицил
3,5-Дихлор--аминофеНИЛ
3,5-ДихлорdL-Аланил- -аминофенил
3,5-Дихлор- р-Аланип
29 - -аминофенил
3,5 Дихлор- ГлицилX
30 - -аминофе- хглицил
НИЛ
12 Таблица
Т.пл, 130-ЙО°С
Вычислено, %: С 7,7, Н 5,8j N 7,6. С„ у эОз-2НВг.О,5Н.10 Найдено, %; С 7,8; Н 6,0-, N 8,1.
Т.пл. 72-75°С Свободное основание
Пена
Свободное основание
Т.пл. 120-125°С. Вычислено, %: С 38,7; Н 5,0, N 7,8 Найдено, %: С Зб,3; Н 4,7; N 7,; Вг 27,6.
Т.пл. 1б5-1б9С.
Свободное основание Вычислено, %: С 5,5; Н 6 ,1 ; N 11 ,1 , (;j y 403CbO,25HiO Найдено, %: С 5,2; Н 6,0; N 10,8.
Т.пл. 105-108°С
Свободное основание 13 где R имеет указанное значение, подвергают взаимодействию с амином общей формулы 1И Hfj MCR QrANH(COVNH)Q , где значения радикалов соответствуют указанным, в присутствии боргидрида щелочного металла с последующим выделением целевого продукта в свободном виде или а биде соли. Источники информации, принятые во внимание при экспертизе 1.Заявка ФРГ Jf 27 15222, кл. С 07 С 103/76, опублик. 1976. 2.Borch R.F. Lithium Cyanohydrtdoborate, a New Reagent.J. Am. chem. Soc. 91, f k, 3996, 1969
Авторы
Даты
1982-07-07—Публикация
1980-01-02—Подача