Изобретение относится к новым биологически активным химическим соединениям группы замещенных арилалкиламинов конкретно к гидрохлоридам N-(арилалкил)-3-(2,4-диметоксифенил)-1-пропиламинов, проявляющим блокирующее действие на нейрональный и экстранейрональный захват катехоламинов.
Известны структурные аналоги описываемых соединений гидрохлориды N-(3-(3', 4'-диметоксифенил)-3-фенил)-пропил-N-арилалкиламинов, проявляющие блокирующее действие на адренорецепторы и на проведение импульсов через симпатические нервы.
Аналогами по биологическому действию описываемых соединений являются метанефрин-гидрохлорид-1-(3-метокси-4-окси- фенил)- 2-метиламино-этанола (2) и мелипрамин-гидрохлорид 10,11-дигидро-5-(3-диметиламинопропил)-5Н-дибензо (b,f)азепина:
HO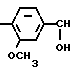 -CH2-
-CH2- CH3
CH3
Метанефрин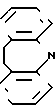 -CH2-CH2-CH2-
-CH2-CH2-CH2-
Мелипрамин
Метанефрин оказывает выраженное блокирующее действие на экстранейрональный захват катехоламинов и практически не влияет на их нейрональный захват. Мелипрамин, наоборот, оказывает выраженное блокирующее влияние на нейрональный захват катехоламинов и мало влияет на экстранейрональный захват.
Цель изобретения расширение арсенала соединений, влияющих как на нейрональный, так и на экстранейрональный захват катехоламинов.
Поставленная цель достигается новыми соединениями гидрохлоридами N-(арилалкил)-3-(2,4-диметоксифенил)-1-пропиламинов общей формулы:
CH3O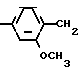 -CH2-CH2-
-CH2-CH2- CnH2nAr где CnH2nAr -CH2C6H5 (I), -CH2-CH2C6H5 (II),
CnH2nAr где CnH2nAr -CH2C6H5 (I), -CH2-CH2C6H5 (II),
-CH2CH2CH2C6H5 (III),
-CH(CH3)CH2C6H5 (IV),
-CH(CH3)CH2CH2C6H5 (V),
-CH2CH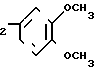 (VI)
(VI)
-CH2CH2CH(C6H5)2 (VII) проявляющими блокирующее действие на нейрональный и экстранейрональный захват катехоламинов.
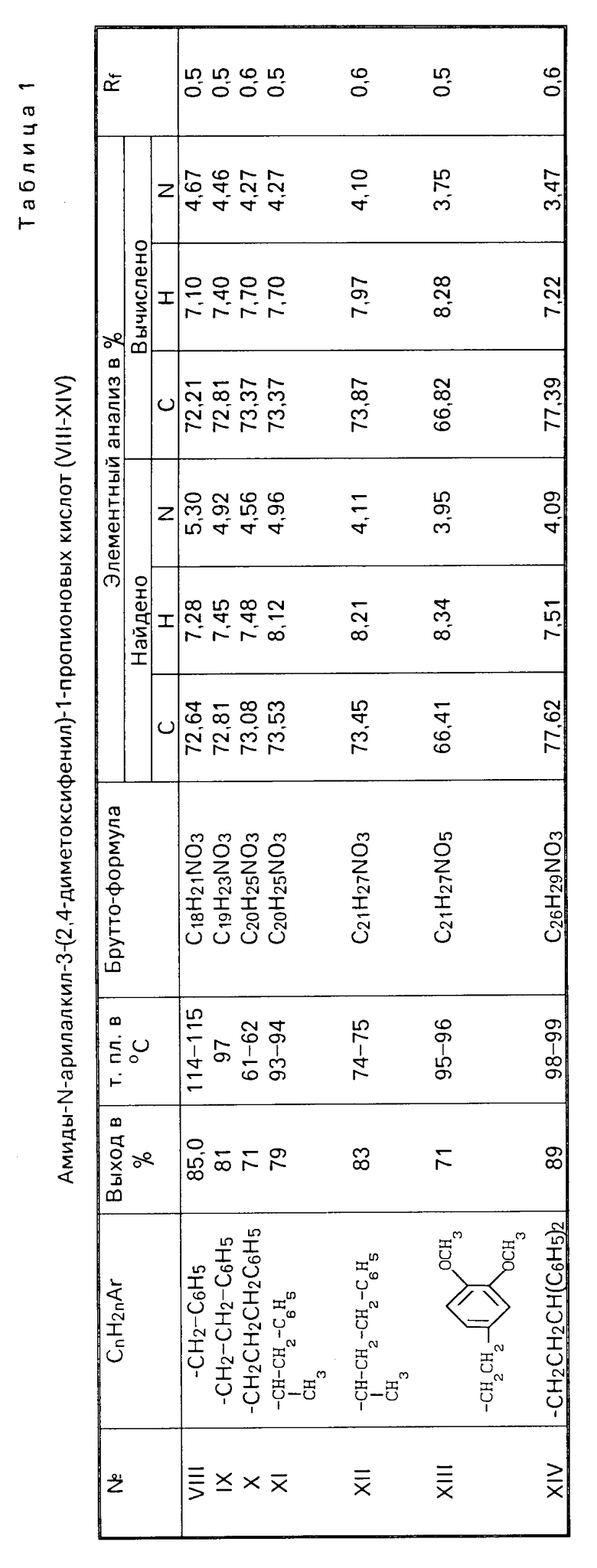
Описываемые соединения (I-VII) получают гидрированием соответствующих амидов (VIII-XIV) алюмогидридом лития с последующим осаждением гидрохлоридов эфирным раствором хлористого водорода. Исходные амиды (VIII-XIV) получают взаимодействием хлорангидрида 3-(2,4-диметоксифенил)-пропионовой кислоты с арилалкиламинами (4):
CH3O CH
CH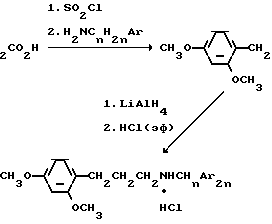 CH2CONHCnH2nAr
CH2CONHCnH2nAr
Чистота и структура соединений I-XIV доказана ТСХ и ИК-спектроскопией. ТСХ проведена на силуфоле "UV-254". Проявитель пары йода. Подвижная фаза для амидов VIII-XIV бензол-ацетон-метанол (4:1:1), для гидрохлоридов I-VII-бутанол-уксусная кислота-вода (4:1:1).
П р и м е р 1. N-бензиламид 3-(2,4-диметоксифенил)-пропионовой кислоты (VIII). Смесь 3,15 г (0,015 моль) 3-(2,4-диметоксифенил)-пропионовой кислоты, 1,8 г (0,015 моль) хлористого тионила и 100 мл абсолютного бензола кипятят в течение 6 ч. После отгонки растворителя к полученному хлорангидриду прибавляют 1,6 г (0,015 моль) бензиламина и 1,2 г (0,015 моль) пиридина в 100 мл бензола. Смесь перемешивают при комнатной температуре 30 мин и кипятят 4 ч на водяной бане. После охлаждения бензольный слой промывают 5%-ным водным раствором карбоната натрия и высушивают над сульфатом магния. После отгонки растворителя, остаток закристаллизовывают и очищают перекристаллизацией из смеси эфир-бензол (2: 1). Выход 3,8 г (85%) амида VIII, т.пл. 112-113оС.
Найдено, C 72,64; H 7,28, N 4,81.
C18H21NO3.
Вычислено, C 72,21; H 7,10; N 4,64; Rf 0,56.
Аналогично получены амиды IX-XIV (таблица 1).
П р и м е р 2. Гидрохлорид N-бензил-3-(2,4-диметоксифенил)-1-пропиламина (I). К раствору 0,68 г (0,02 моль) алюмогидрида лития в 100 мл абсолютного тетрагидрофурана прибавляют по каплям раствор 30 г (0,01 моль) N-бензиламида 3-(2,4-диметоксифенил)-пропионовой кислоты (VIII) в 50 мл тетрагидрофурана при комнатной температуре. Затем реакционную смесь кипятят 6-8 ч. После охлаждения до комнатной температуры разлагают 10 мл воды. Отфильтровывают осадок и промывают горячим тетрагидрофураном. Фильтрат высушивают над сернокислым магнием. После отгонки растворителя маслообразный продукт растворяют в абсолютном эфире и эфирным хлористым водородом переводят в гидрохлорид N-бензил-3-(2,4-диметоксифенил)-1-пропиламина, который перекристал- лизовывают из смеси спирт-эфир (1:10). Выход 2,0 г (65%), белые кристаллы с т. пл. 122-124оС.
Найдено, Cl 10,50; N 4,04.
C18H24ClNO2.
Вычислено, Cl 11,03; N 4,35. Rf 0,62.
Аналогично получены гидрохлориды аминов II-VII (табл.2).
Изучено влияние соединений I-VII на нейрональный и экстранейрональный захват катехоламинов. В качестве контрольных препаратов использованы: блокатор нейронального захвата катехоламинов мелипрамин и блокатор экстранейронального захвата катехоламинов метанефрин.
Опыты проводились на белых крысах породы Вистар весом 180-200 г. Крыс оглушали электрическим током и декапитировали.
Семявыносящие протоки инкубировали в растворе Тироде в камере с объемом 5 мл при 37оС и насыщении кислородом. После 30-минутной инкубации и смены раствора Тироде проводили преинкубацию с исследуемыми соединениями в течение 30 мин, затем еще 30 мин инкубировали органы в свежем растворе Тироде в присутствии исследуемых соединений и норадреналина -Н3 в концентрации 0,2 мккюри/мл. В опытах использовали норадреналин -Н3 с удельной активностью 5 кюри/ммоль. По окончании инкубации проводили пятикратную промывку органов раствором Тироде. Затем органы помещали в сцинтилляционные кюветы, заливали 1 мл этилового спирта и оставляли на 16-18 ч, после чего добавляли в кюветы 10 мл сцинтилляционной жидкости 4 г ППО (2,5-дифенилоксазол) и 100 мг ПОПОП [1,4-ди-(5-фенил-2-оксазолил)-бензол] на 1 л толуола. Радиоактивность измеряли на жидкостном сцинтилляционном счетчике.
Исследования показали, что соединения I-VII оказывают блокирующее действие на нейрональный захват норадреналина Н3. Так, в концентрации 10 мкмоль описываемые соединения достоверно блокируют захват норадреналина Н3.
Статистическая обработка полученных результатов показала также, что по блокирующей активности соединения I-VII не отличаются от мелипрамина (Р > 0,1). При концентрации 1 мкмоль пять соединений (II, III, IV, V, VII) вызывают достоверную блокаду нейронального захвата норадреналина -Н3 на 41-69% а соединение VI превосходит мелипрамин (Р < 0,05). Как и следовало ожидать, влияние метанефрина на нейрональный захват норадреналина -Н3 статистически недостоверно.
Влияние соединений на экстранейрональный захват катехоламинов изучали в несколько измененных условиях опыта:
1. Вместо норадреналина -Н3 использовали адреналин-Н3, так как сродство адреналина к местам экстранейронального захвата больше чем у норадреналина. 2. Увеличили количество добавляемого в инкубационную среду адреналина -Н3 за счет разбавления адреналина-Н3 немеченным (холодным) адреналином в концентрации 2,5 ˙ 10-6 М. В опытах был использован адреналин -Н3 в концентрации 0,2 мккюри/мл, с удельной активностью 14 кюри/ммоль. 3. Оставив условия предварительной инкубации органов с соединениями прежними, сократили инкубацию с адреналином -Н3до 5 мин, так как для полного осуществления экстранейронального захвата катехоламинов в опытах с перфузией сердца достаточно 2-3 мин. 4. Вместо семявыносящих протоков в опыт были взяты срезы стенки левого желудочка сердца крысы.
Исследования действия производных диметоксифенилпропиламина и метанефрина в концентрации 10 мкмоль на экстранейрональный захват адреналина-Н3 срезами стенки левого желудочка сердца крысы показали, что соединения II, III, VI, которые в низкой концентрации наиболее выражено блокируют нейрональный захват норадреналина -Н3, блокируют также экстранейрональный захват адреналина -Н3 на 38-43% По этому показателю они достоверно не отличаются (Р > 0,1) от известного блокатора экстранейронального захвата катехоламинов метанефрина.
Определяли острую токсичность некоторых соединений. Опыты проводили на белых мышах обоего пола весом 18-23 г. Соединения вводили внутрибрюшинно. Каждую дозу вводили шести животным. Результаты опытов отмечали через 24 ч после введения.
LD50 соединения II равна 135 (127-144) мг/кг, соединения III 160 (134,4-189,4) мг/кг, соединения VII 127 (102,4-157,7) мг/кг и мелипрамина 91 (84-98,7) мг/кг. Разница в токсичности описываемых соединений и мелипрамина статистически достоверна (Р < 0,05), т. е. описываемые соединения менее токсичны, чем мелипрамин.
Таким образом, описываемые производные диметоксифенил-пропиламина обладают выраженным блокирующим действием на нейрональный захват норадреналина -Н3 и на экстранейрональный захват адреналина -Н3. По этим свойствам они существенно отличаются от блокатора захвата катехоламинов метанефрина, тем, что блокируют не только экстранейрональный захват, но и нейрональный захват катехоламинов. Блокада захвата катехол- аминов, являющегося основным процессом инактивизации выделившегося в синаптическую щель медиатора, может привести к повышению тонуса симнато-адреналовой системы, снятию утомления и депрессии.
Описываемые соединения могут представить интерес также как анализаторы процесса захвата катехоламинов.
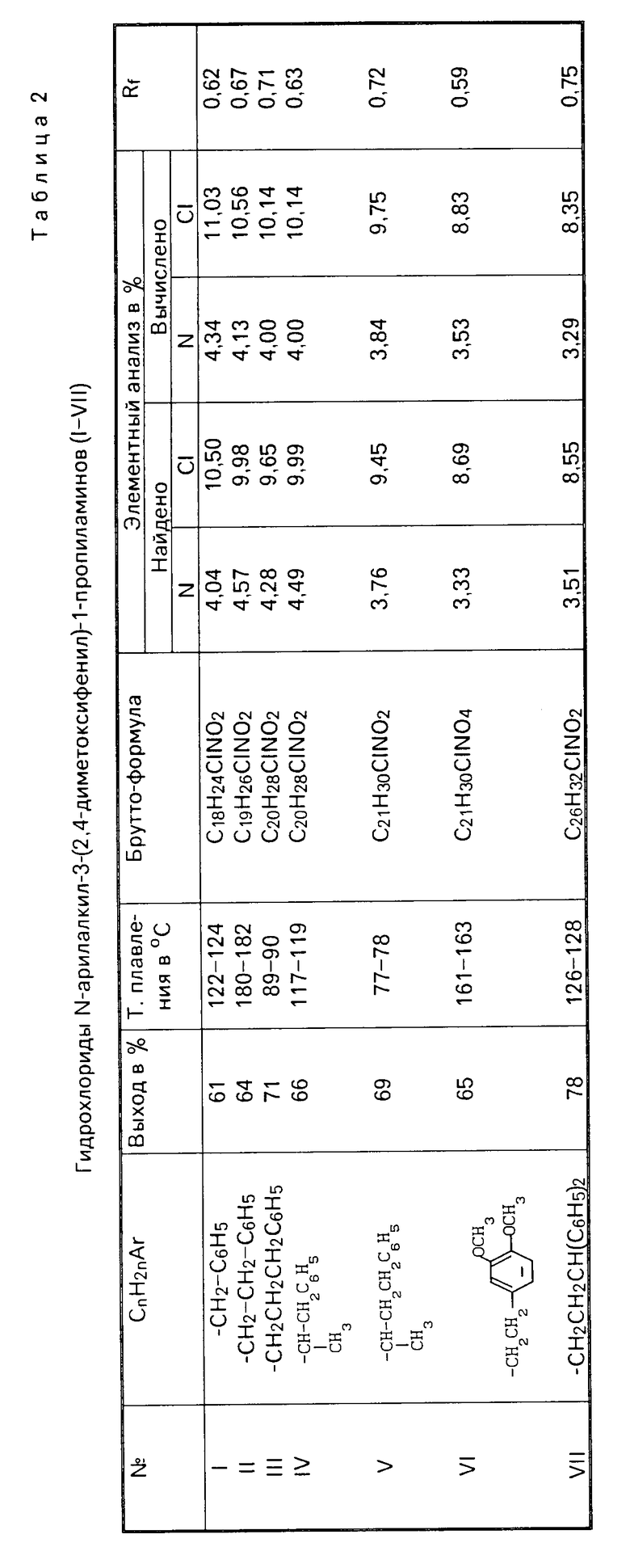
Гидрохлориды N-(арилалкил)-3- (2,4-диметоксифенил)-1- пропиламинов общей формулы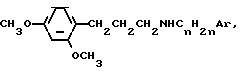
где CnH2nAr -СН2С6Н5, -СН2СН2С6Н5, -СН2СН2СН2С6Н5, -СН(СН3)СН2С6Н5,
-СН(СН3)СН2СН2С6Н5,
-СН2СН2СН(С6Н5)2,
проявляющие блокирующее действие на нейрональный и экстранейрональный захват катехоламинов.
| C.Will | |||
| Ber, 16.2106 (1883) T.S.Buck., J.Am.Chem.Soc.,54.3661(1932). |
Авторы
Даты
1995-10-20—Публикация
1981-01-04—Подача