Изобретение относится к новым химическим соединениям гидрохлоридам 1-(м-гидроксифенокси)-3 -N-(арилалкил)-амино β-2-пропанолов общей формулы: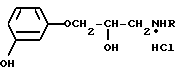 где R представляет собой группы I CH(CH3)CH2C6H5, II (CH2)3-С6H5, III CH(CH3)CH2CH2C6H5, IV CH(CH3)CH2CH2-C6H3(OCH3)2, V CH2CH2CH(C6H5)2 или VI CH(CH3)CH2CH(C6H5)2, которые обладают β -адреноблокирующими свойствами и могут найти применение в медицине.
где R представляет собой группы I CH(CH3)CH2C6H5, II (CH2)3-С6H5, III CH(CH3)CH2CH2C6H5, IV CH(CH3)CH2CH2-C6H3(OCH3)2, V CH2CH2CH(C6H5)2 или VI CH(CH3)CH2CH(C6H5)2, которые обладают β -адреноблокирующими свойствами и могут найти применение в медицине.
В литературе известны производные феноксиаминопропанолов, например, 1-(1-нафтилокси)3-изопропиламино-2-пропанол (пропранолол или анаприлин);
1-(2-аллилфенокси)3-изопропиламино-2-пропанол (алпренолол или алфепрол); 1-(4-ацетамидофенокси)-3-изопропиламино-2-пропанол(практолол или эралдин), которые обладают β -адреноблокирующей активностью и используются в медицине (I).
Однако, имеющиеся в настоящее время адреноблокаторы не полностью отвечают требованиям клинической практики и обладают некоторыми нежелательными эффектами. Например: пропранолол вызывает угнетение сокращений сердца, практолол вызывает воспаление серозных оболочек конъюктивит, перитонит, плеврит.
Цель изобретения расширение арсенала средств эффективно и избирательно действующих на сердечно-сосудистую систему.
Поставленная цель достигается синтезом новых неизвестных ранее 1-(м-гидроксифенокси)-3-(N-(арилалкил)-амино)-2-про- панолов структуры в виде гидрохлоридов, обладающих β -адреноблокирующей активностью. Синтезированные вещества отличаются от химического аналога 1-(м-гидроксифенокси)-3-(N-изопропиламино)-2-пропано- ла (2) наличием ароматического фрагмента у алкильного заместителя аминогруппы. Сочетание ароматического и алифатического заместителей у атома азота придает веществам β-адреноблокирующие свойства, превосходящие известные препараты подобного действия практолол и пропранолол (см. сравнительные биологические данные).
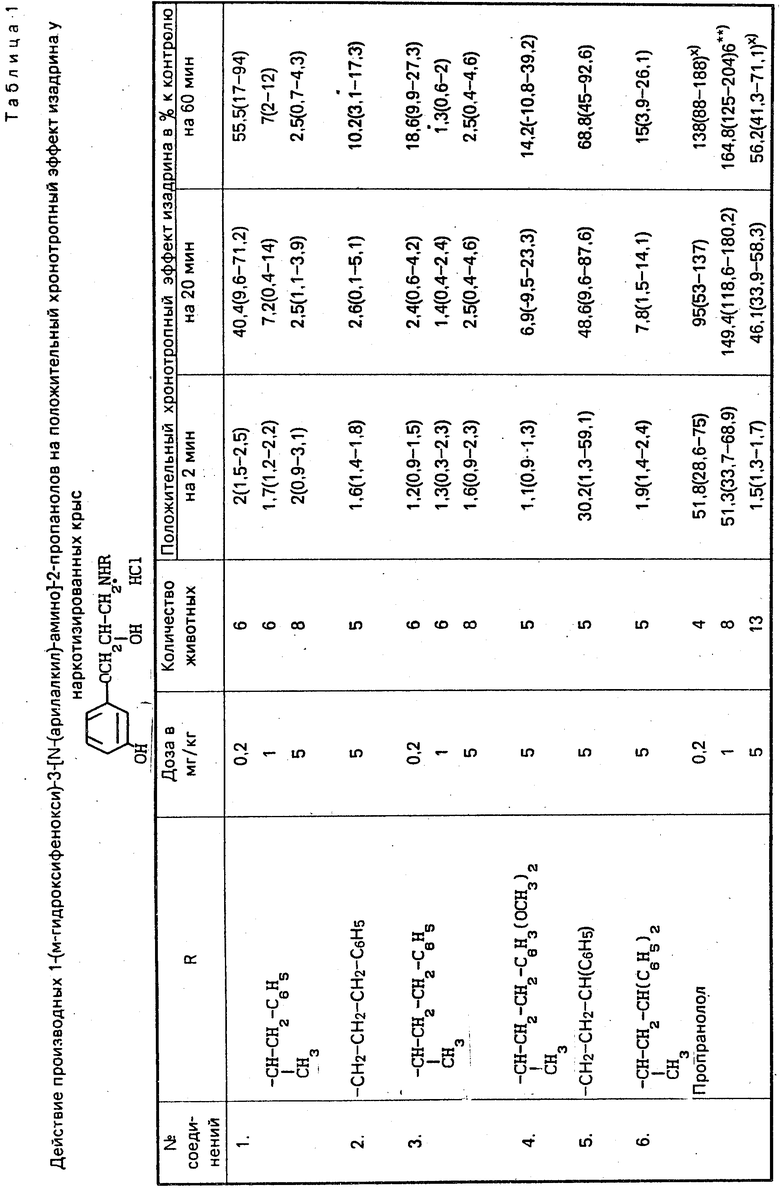
О β -адpеноблокирующих свойствах соединений общей формулы I судят по устранению положительного хронотропного и гипотензивного эффектов изадрина, введенного внутривенно в дозе 0,5 мг/кг у наркотизированной крысы.
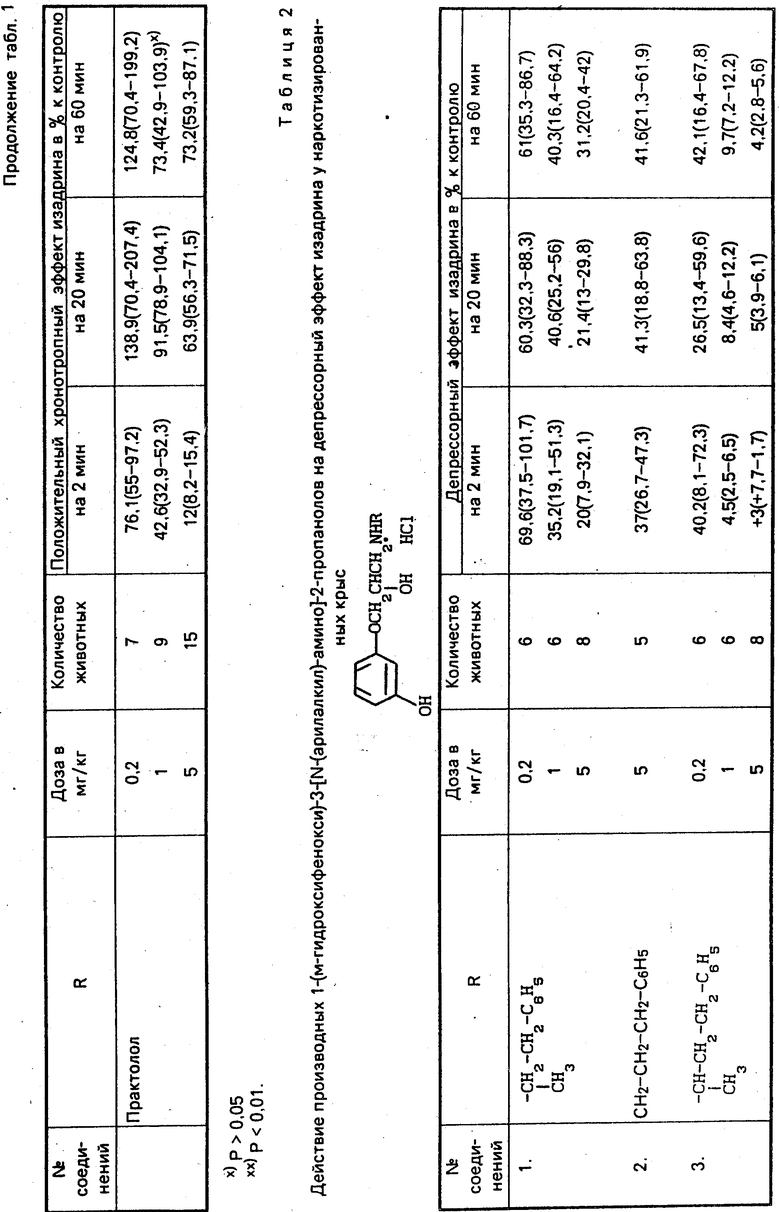
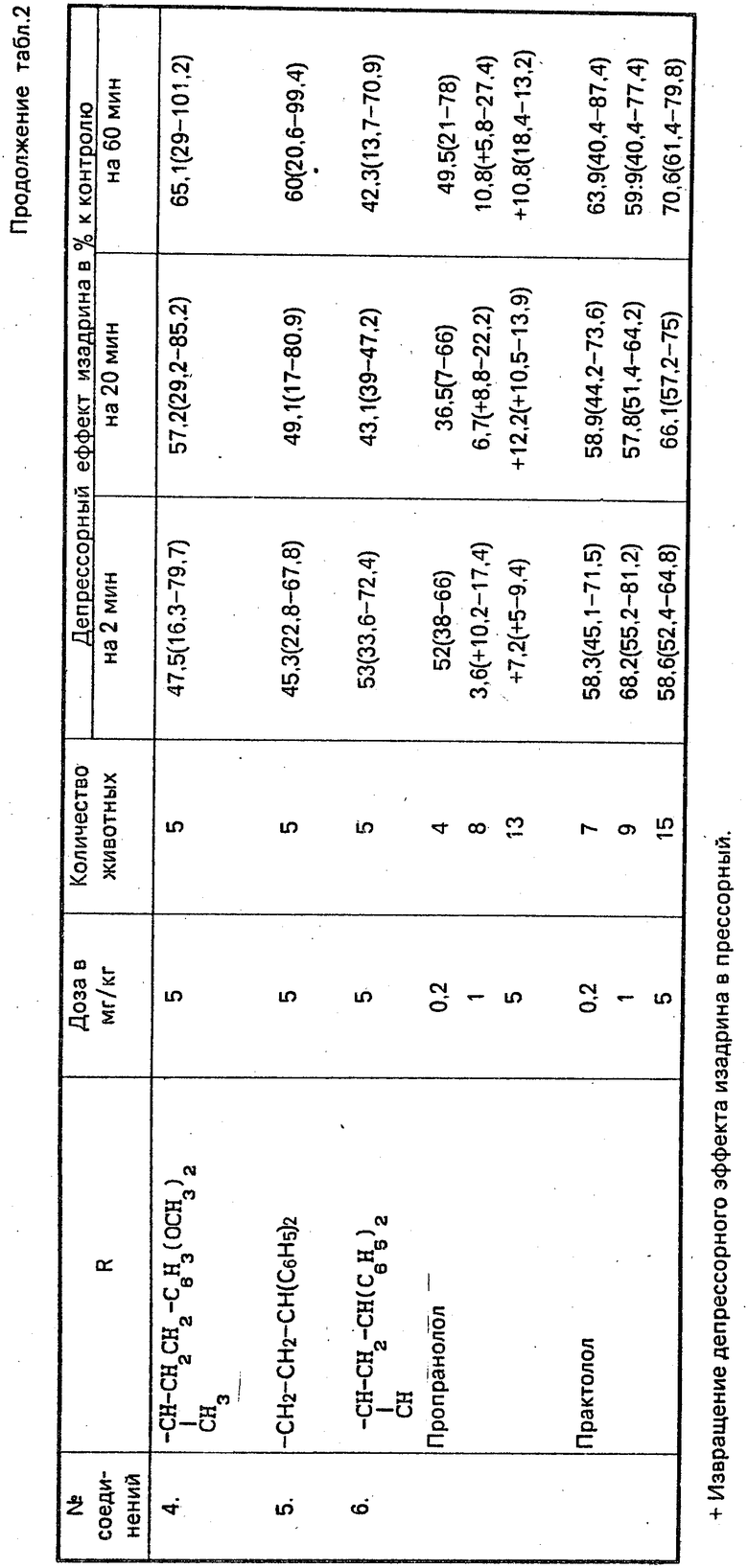
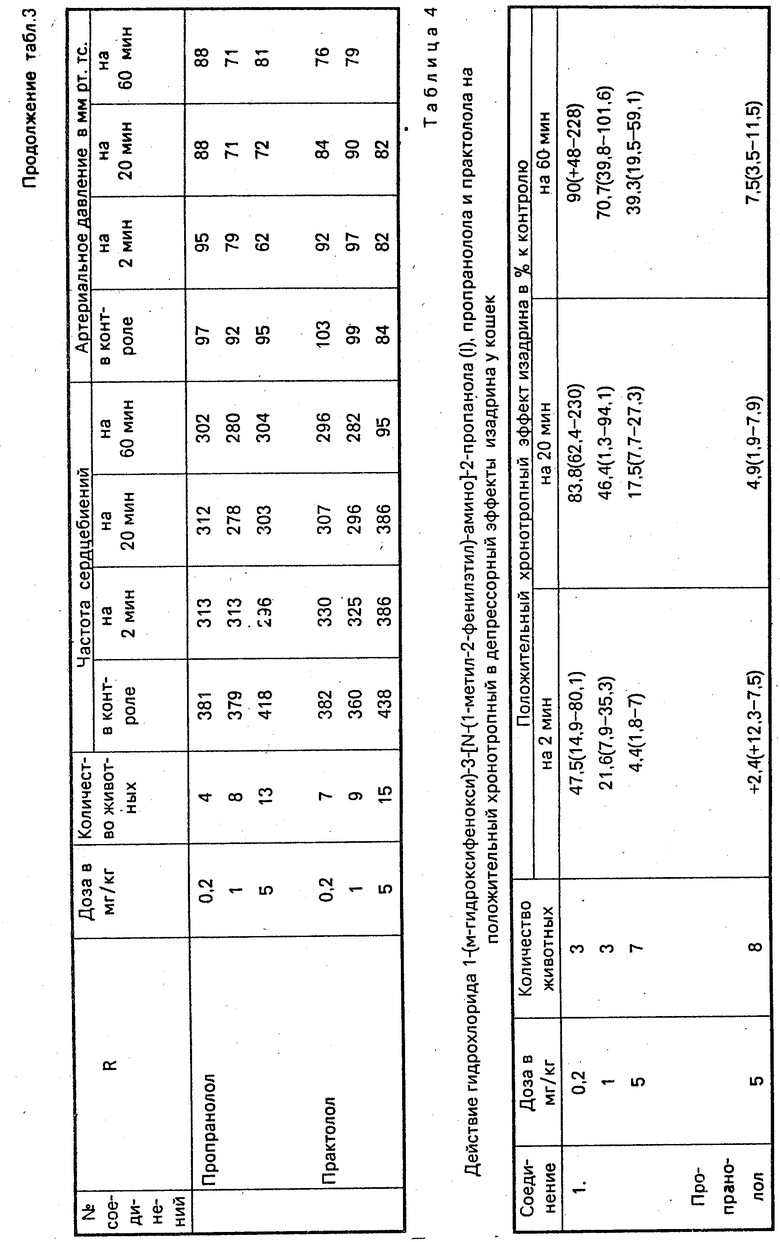
Установлено, что гидрохлориды 1-(м-гидроксифенокси)-3-(N-(арилалкил)-амино)-2-пропанолов проявляют выраженное блокирующее действие на β-адренорецепторы сердца (устранение положительного хронотропного эффекта изадрина) и относительно умеренное действие на β -адренорецепторы сосудов (уменьшение депрессорного эффекта изадрина (табл. 1 и 2). Блокирующее действие соединений на адренорецепторы сердца сопровождается увеличением частоты сердцебиений (табл. 3).
В ряду изученных соединений наибольшую β-адреноблокирующую активность проявляют гидрохлорид 1-(м-гидроксифенокси)-3-[N-(фенилизопропил)-амино)амино] -2-пропанола (1) и гидрохлорид 1-(м-гидроксифенокси)-3-[N-(1-метил-3-фенилпропил)-амино] -2-пропанола (III). Поэтому в опытах на наркотизированных крысах и кошках проводили сравнительное исследование активности этих соединений с известными β -адреноблокаторами пропранололом и практололом. В опытах на крысах установлено, что через 60 мин после введения соединений I и III в дозе 0,2 мг/кг положительный хронотропный эффект изадрина восстанавливается на 55,5% и 18,6% соответственно (табл. 1). В аналогичных условиях эксперимента через 60 мин после введения пропранолола в дозе 1 мг/кг наступает даже достоверное усиление положительного хронотропного эффекта изадрина.
Восстановление положительного хронотропного эффекта изадрина на 60-й мин после введения пропранолола и практолола в дозе 5 мг/кг составила 56,2% и 73,2% исходного соответственно (табл. 1).
Таким образом, соединения I и III по силе и длительности блокирующего действия на β -адренорецепторы сердца почти в 25 раз превосходят пропранолол и практолол.
В опытах на кошках соединение I по блокирующему действию на β-адренорецепторы сердца превосходит практолол, не уступает пропранололу (табл. 4). Аналогичным образом, по блокирующему действию на β-адренорецепторы сосудов крысы и кошки соединения I и III также превосходят практолол и уступают пропранололу (табл. 2 и 4).
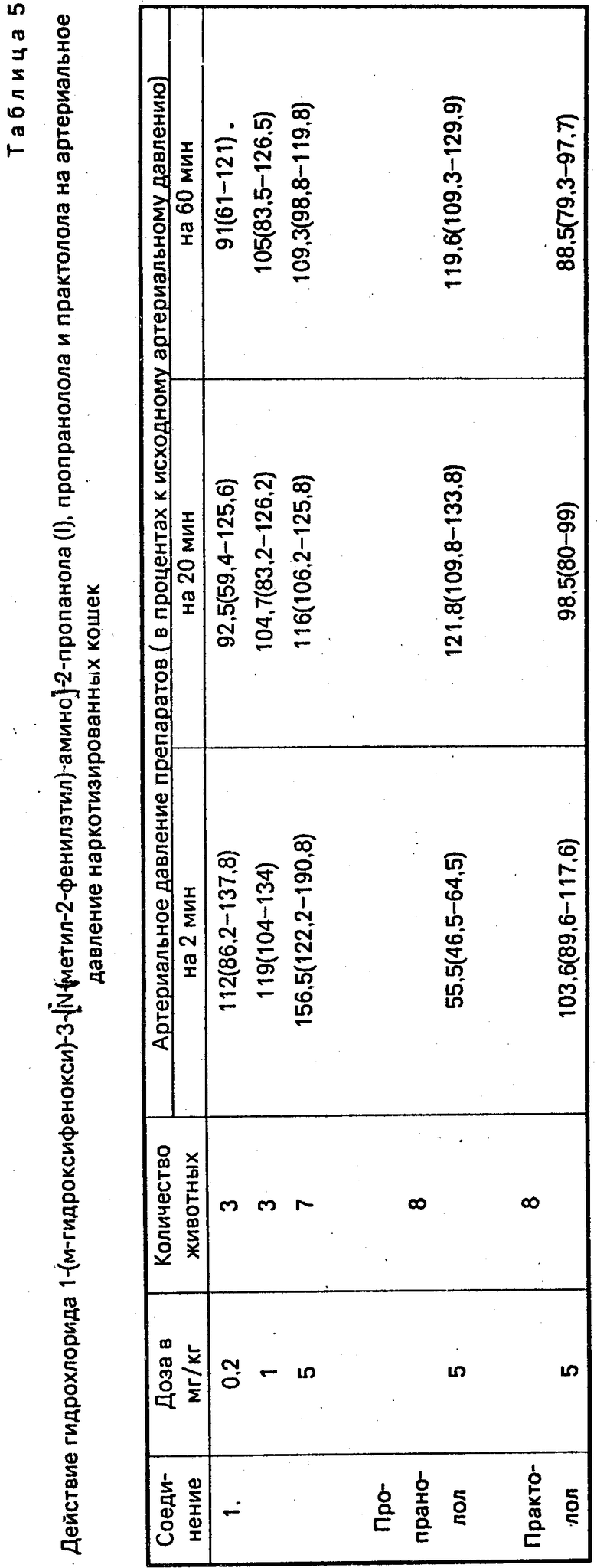
В вышеприведенных опытах на наркотизированных крысах и кошках учитывалось также действие соединений на артериальное давление и частоту сердцебиений. Установлено, что у крыс соединение I и его аналоги по силе и длительности гипотензивного действия существенно не отличаются от пропранолола и практолола (табл. 3). Принципиальное отличие соединения I от пропранолола и практолола заключается в том, что оно а) вызывает учащение сердцебиений как у крыс так и у кошек (табл. 3 и 6); б) у кошек вместо понижения вызывает кратковременное повышение артериального давления (табл. 5).
Повышение артериального давления кошки вызывают те соединения, изученного ряда, у атома азота которых имеются изоалкиларил-радикалы (соединение I, III, IV).
В опытах на изолированном семеновыносящем протоке крысы соединения I и III в концентрации 0,05 мкмоль/мл вызывают сильное и длительное угнетение реакции органа на трансмуральное электрическое раздражение (табл. 7). В этом отношении они превосходят практолол и действуют подобно пропранололу и алпренололу. После введения соединения 1 через короткий промежуток времени наступает выраженное повышение реакции семевыносящего протока на адреналин (адреномиметическое действие).
Острую токсичность гидрохлорида 1-(м-гидроксифенокси)-3-[N-(1-метил-2-фенилэ-тил)-амино] -2-пропанола (соединение 1) и гидрохлорида 1-(м-гидроксифенокси)3-[N-(1-метил-фенилпропил)-амино] -2-пропано-ла (соединение III) изучали в опытах на белых мышах (18-22 гр.). Вещества вводили внутрибрюшинно. На каждую дозу использовали по 6 животных. LD50соединения I вычисленная по Литчфилду-Уилкоксону равна 125 (100-156) мг/кг, а соединения III-78 (55,8-102,2) мг кг. LD50 пропранолола в опытах на белых мышах при внутрибрюшинном введении составляет 100 (92 109) мг/кг.
Таким образом, гидрохлорид 1-(м-гидроксифенокси)-3-[N-(фенилизопропилами-но]-2-пропанола (I) в опытах на крысах и кошках проявляет выраженное блокирующее действие на β-адренорецепторы сердца. Одновременно, он вызывает увеличение частоты сердцебиений, а в опытах на кошках приводит даже к кратковременному повышению артериального давления.
Соединение I может представить интерес при патологических состояниях, когда требуется блокада β-адренорецепторов сердца без понижения артериального давления.
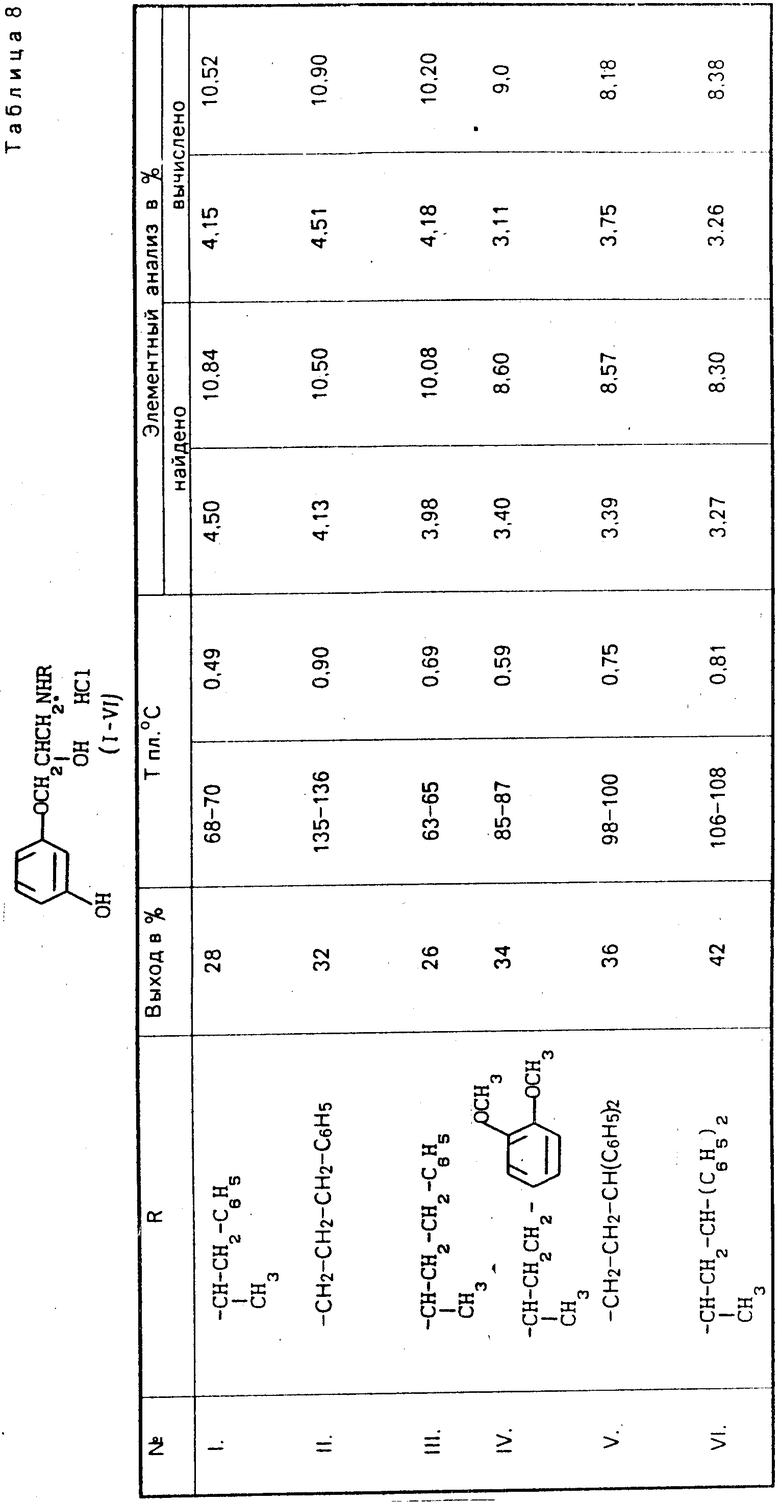
Соединения общей формулы I (соединения I-VI) согласно изобретению получают взаимодействием 1-(м-гидроксифенокси)-3-хлор-2-пропанола с арилалкиламинами в среде амилового спирта при нагревании в запаянных ампулах при 110-120оС. Целевой продукт выделяют известными приемами в виде гидрохлоридов.
Чистоту гидрохлоридов (I-VI) проверяли тонкослойной хроматографией на силуфоловых пластинках марки UV-254 в системе бутанол-уксусная кислота-вода (10: 1: 3) в ИК-спектрах I-VI найдены полосы поглощения, характерные для ассоциированных -ОН и NH-групп при 3000-3500 см-1 и для ароматической С=С связи при 1600-1610 см-1.
П р и м е р. Гидрохлорид 1-(м-гидроксифенокси)-3-[N-(1-метил-2-фенилэтил)-ами-но] -2-пропанола (1). Смесь 2,0 г (0,01 моль) 1-(м-гидроксифенокси)-3-хлор-2-пропанола (3)- и 4,0 г (0,03 моль) фенилизопропиламина в 50 мл амилового спирта нагревают в течение 10 ч при 110-120оС в запаянных ампулах. Затем отгоняют амиловый спирт и к остатку добавляют сухой эфир. Выпавшие кристаллы гидрохлорида части исходного амина отфильтровывают, осадок трижды промывают водой. После отгонки эфира из оставшейся массы отгоняют непрореагировавший исходный амин т. кип. 68-70оС/1 мм, 1,5175. Остаток растворяют в 5 мл абсолютного этилового спирта и добавляют эфирный НCl до слабо кислой реакции. Образовавшийся в начале маслообразный продукт кристаллизуется многократным промыванием абсолютным эфиром. После переосаждения из смеси спирт-эфир (1: 6) получают 0,9 г (28,0%) гидрохлорида 1-(м-гидроксифенокси)-3-(N-(1-метил-2-фенил- этил)амино)-2-пропанола (I) т. пл. 68-70оС.
Анализ. Найдено, N 4,50; Cl 10,84.
С18Н23О3N
Вычислено, N 4,15; Cl 10,52.
Остальные соединения получены аналогично и их физико-химические данные представлены в табл. 8.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОКСАЛАТЫ 2-[1-(3-АЛКИЛАМИНО-2-ОКСИПРОПИЛОКСИИМИНО)ЭТИЛ]1,4-БЕНЗОДИОКСАНОВ, ОБЛАДАЮЩИЕ β -АДРЕНОБЛОКИРУЮЩЕЙ АКТИВНОСТЬЮ | 1981 |
|
SU1009051A1 |
| Гидрохлорид 1-(2-карбэтокси-3-метилбензофуран-4-илокси-3-изопропиламино)-2-пропанола,обладающий антиаритмическим и @ -адреноблокирующим действием | 1977 |
|
SU671256A1 |
| ГИДРОХЛОРИДЫ ПРОИЗВОДНЫХ 5-ФЕНОКСИМЕТИЛ-1,2,4-ОКСАДИАЗОЛА, ОБЛАДАЮЩИЕ β И a -АДРЕНОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 1982 |
|
SU1132505A1 |
| Производные 1-амино-3-(1,2,3,4-тетрагидро-или 1,2,3,4,4 @ ,9 @ -гексагидродибензофуранил-8-окси)-пропанолов-2,обладающие @ -адреноблокирующим,гипотензивным,спазмолитическим,нейротропно-депримирующим и бронхолитическим свойствами | 1980 |
|
SU869278A1 |
| ПРОИЗВОДНЫЕ 1-(4-ФЕНИЛАЗОФЕНОКСИ)-3-АМИНОПРОПАНОЛА-2, ОБЛАДАЮЩИЕ ПОТЕНЦИАЛЬНОЙ СТРЕСС-ПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 1982 |
|
RU1031137C |
| ГИДРОХЛОРИДЫ N- (АРИЛАЛКИЛ)-3- (2,4-ДИМЕТОКСИФЕНИЛ) -1-ПРОПИЛАМИНОВ, ПРОЯВЛЯЮЩИЕ БЛОКИРУЮЩЕЕ ДЕЙСТВИЕ НА НЕЙРОНАЛЬНЫЙ И ЭКСТРАНЕЙРОНАЛЬНЫЙ ЗАХВАТ КАТЕХОЛАМИНОВ | 1981 |
|
SU944285A1 |
| АНТИАРИТМИЧЕСКОЕ СРЕДСТВО | 1983 |
|
RU2068261C1 |
| БРОМИД 1-(β--ФЕНИЛЭТИЛ)-4-(П-ДИМЕТИЛАМИНОБЕНЗИЛИДЕНАМИНО)-1,2,4-ТРИАЗОЛИЯ, ОБЛАДАЮЩИЙ АНТИОКСИДАНТНЫМ, ПРОТИВОИШЕМИЧЕСКИМ, β--АДРЕНОБЛОКИРУЮЩИМ, УТЕРОТОНИЧЕСКИМ И СНИЖАЮЩИМ ВНУТРИГЛАЗНОЕ ДАВЛЕНИЕ ДЕЙСТВИЕМ | 1997 |
|
RU2136669C1 |
| Гидрохлориды производных 3(5)-феноксиметилизоксазола, обладающие @ и @ -адренолитической активностью | 1980 |
|
SU979343A1 |
| ПРОИЗВОДНЫЕ 2-МЕРКАПТОБЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ ПРОТИВОИШЕМИЧЕСКОЙ, АНТИАРИТМИЧЕСКОЙ И ПРОТИВОФИБРИЛЛЯТОРНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2136667C1 |




Гидрохлориды 1-(м-гидроксифенокси)-3-[N-(арилалкил)-амино]-2-пропанолов общей формулы: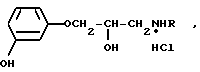
где R(I) CH(CH3) -CH2-C6H5;
R(II) (CH2)3 C6H5;
R(III) CH(CH3) CH2CH2C6H5;
R(IV) CH(CH3) CH2CH2C6H3 (OCH3)2;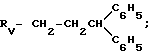
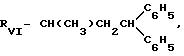
обладающие β -адреноблокирующей активностью.
| Ablad B., Brogard M., Corrodi H., |
Авторы
Даты
1995-10-27—Публикация
1978-06-27—Подача