Область техники, к которой относится изобретение
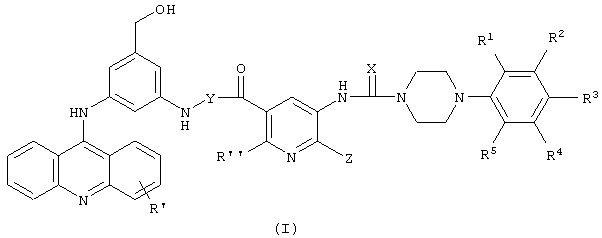
Настоящее изобретение относится к новым производным 9-аминоакридина общей формулы (I)

где Y обозначает связь или представляет собой

где Х означает кислород или серу, R1, R2, R3, R4 и R5 независимо представляют собой водород, галоген, нитро, амино, гидрокси, C1-C4 низший алкиламино, С1-С4алкил или C1-C4 низший алкокси, R' и R'' независимо представляют собой С1-С4алкил или C1-C4 низший алкокси, и Z означает C1-C4 низший алкил, C1-C4 низший алкокси или C1-C4 низший алкиламино.
В вышеприведенных определениях C1-C4 низший алкил означает линейные или разветвленные алкильные группы, такие, как метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил или т.п. С1-С4
Низший алкокси означает метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси или т.п.
С1-С4 Низший алкиламино означает метиламино, этиламино, пропиламино, бутиламино или т.п.
Известный уровень техники
В WO 00/37447 описаны производные 9-аминоакридина и способ получения соединений формулы (1)

где А означает водород или группу

(где Х означает кислород или серу, R1, R2, R3, R4 и R5 независимо представляют собой водород, галоген, нитро, амино, гидрокси, С1-С4 низший алкилгидрокси, С1-С4 низший алкиламино, С1-С8алкил, С1-С4 низший алкокси или С1-С4 низший алкилоксикарбонил, и m и n независимо означают целое число 0, 1 или 2), R6, R7, R8 и R9 независимо представляют собой С1-С8алкил или С1-С4 низший алкокси и Y означает водород, аминогруппу, -N=CHR` (где R` означает водород, бензил, С1-С8алкил или С1-С6 низший алкиламино), 
(где R`` означает водород, бензил, С1-С8алкил или С1-С6 низший алкиламино, и R``` означает водород, бензил, С1-С8алкил или аминозащитную группу) или

(где Х имеет те же значения, что представлены выше, R1`, R2`, R3`, R4` и R5` независимо представляют собой водород, галоген, нитро, амино, гидрокси, С1-С4 низший алкилгидрокси, С1-С4 низший алкиламино, С1-С8алкил, С1-С4 низший алкокси или С1-С4 низший алкилоксикарбонил, и q и r независимо означают целое число 0, 1 или 2) или его фармацевтически приемлемая соль и способ его получения.
В вышеприведенных соединениях формулы (1), где Y означает группу 
(R`` и R``` имеют те же значения, что даны выше), могут быть изомерами l-формы и d-формы или в рацемической форме.
Однако соединения по настоящему изобретению не описаны в WO 00/37447.
Подробное описание изобретения
Авторы изобретения провели длительные исследования, чтобы выявить новые соединения, обладающие интенсивным противораковым действием. В результате авторы установили, что соединения общей формулы (I) или их аддитивные соли кислоты, как определено выше, обладают не только заметным противораковым действием, но также очень низкой токсичностью.

где Y означает связь или представляет собой группу

(где Х означает кислород или серу, R1, R2, R3, R4 и R5 независимо представляют собой водород, галоген, нитро, амино, гидрокси, C1-C4 низший алкилгидрокси C1-C4 низший алкиламино, С1-С8алкил или C1-C4 низший алкокси, R' и R'' независимо представляют собой C1-C8алкил или C1-C4 низший алкокси, и Z представляет собой C1-C4 низший алкил, C1-C4 низший алкокси или C1-C4 низший алкиламино.
Соответственно объектом настоящего изобретения является соединение общей формулы (I) или его аддитивная соль кислоты, обладающее не только заметным противораковым действием, но также и очень низкой токсичностью.
Другим объектом изобретения является способ получения соединения общей формулы (I) или его аддитивной соли кислоты.
Соединения по настоящему изобретению могут быть смешаны с фармацевтически приемлемыми разбавителями обычным способом с получением фармацевтических препаратов, предназначенных для использования в целях предупреждения или лечения различного вида опухолей.
Поэтому другим объектом настоящего изобретения являются фармацевтические препараты, содержащие эффективное количество соединения общей формулы (I) или его аддитивную соль кислоты в качестве активного компонента.
Кислоты, которые могут взаимодействовать с соединением общей формулы (I) с образованием его аддитивной соли кислоты, представляют собой фармацевтически приемлемые неорганические кислоты, органические кислоты, аминокислоты или сульфоновые кислоты; например, неорганические кислоты, такие как соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и азотная кислота; органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, лимонная кислота, малеиновая кислота и малоновая кислота; аминокислоты, такие как серин, цистеин, цистин, аспарагин, глутамин, лизин, аргинин, тирозин и пролин; сульфоновые кислоты, такие как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и толуолсульфоновая кислота.
Разбавители, используемые при составлении фармацевтических препаратов, содержащих соединение общей формулы (I) в качестве активного компонента, представляют собой подслащивающие агенты, связующие агенты, растворители, добавки, облегчающие растворение, смачивающие агенты, эмульгаторы, изотонические агенты, адсорбенты, агенты деструкции, антиоксиданты, консерванты, умягчители, наполнители, отдушки или т.п.; примеры могут включать такие вещества, как лактоза, декстроза, сахароза, маннитол, сорбит, целлюлоза, глицин, диоксид кремния, тальк, стеариновая кислота, стеарин, стеарат магния, стеарат кальция, алюмосиликат магния, крахмал, желатин, смола трагаканта, альгининовая кислота, альгинат натрия, метилцеллюлоза, натрий карбоксиметилцеллюлоза, агар, вода, этанол, полиэтиленгликоль, поливинилпирролидон, хлорид натрия, хлорид калия, апельсиновая эссенция, клубничная эссенция и аромат ванили.
Суточная доза соединения общей формулы (I) может меняться в зависимости от возраста, пола и степени заболевания, но предпочтительно может быть введено от 1 мг до 5000 мг в день один или несколько раз в день.
Соединение общей формулы (I) согласно настоящему изобретению может быть получено по следующим схемам I, II.
Схема I


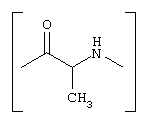
где R1, R2, R3, R4, R5, R', R'', X, Y и Z такие, как указано выше, и Y1 означает водород или группу

Соединения общей формулы (а) и (b) подвергают взаимодействию в присутствии конденсирующего агента и кислоты в обычном органическом растворителе с эффективным образованием соединения общей формулы (I).
Реакцию можно осуществлять предпочтительно в обычном органическом растворителе, таком, как тетрагидрофуран, дихлорметан, хлороформ, ацетонитрил, диметилформамид, пиридин и т.п.
Реакцию можно предпочтительно осуществлять в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (DCC), HOBT или WSCD, в обычной кислоте, такой как неорганическая кислота или органическая кислота.
Соединение общей формулы (а) или (b) является известным соединением, которое описано в J. Med. Chem. 1995, 38, 3226 или в РСТ/КR99/00787, или может быть получено и использовано аналогичным образом.
Реакцию также можно осуществлять при температуре от 3°С до точки кипения растворителя, предпочтительно при 25-50°С, в течение 5-24 часов, предпочтительно в течение 10-24 часов.
Кислота может быть использована в количестве 1-1,5 эквивалента, предпочтительно, 1-1,1 эквивалента.
Схема II


где R1, R2, R3, R4, R5, R', R'', X, Y и Z такие, как указано выше, и Y2 означает -ОН или группу
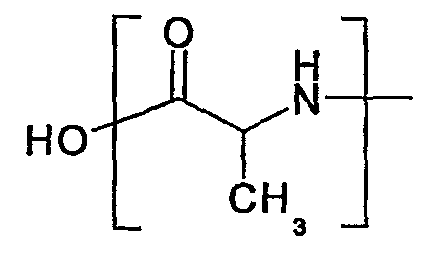
Соединения общей формулы (с) и (d) подвергают взаимодействию в присутствии конденсирующего агента и кислоты в обычном органическом растворителе с успешным получением соединения общей формулы (I).
Реакцию можно осуществлять предпочтительно в обычном органическом растворителе, таком, как тетрагидрофуран, дихлорметан, хлороформ, ацетонитрил, диметилформамид, пиридин и т.п.
Реакцию можно осуществлять предпочтительно в присутствии такого конденсирующего агента, как дициклогексилкарбодиимид (DCC), HOBT или WSCD, в обычной кислоте, такой как неорганическая кислота или органическая кислота.
Соединение общей формулы (с) или (d) является известным соединением и описано в J. Med. Chem., 1995, 38, 3226 или в РСТ/KR99/00787, или может быть получено и использовано аналогичным образом.
Реакцию можно осуществлять при температуре от 3°С до точки кипения растворителя, предпочтительно, при 25 -50°С, в течение 5-24 часов, предпочтительно в течение 10-24 часов.
Кислота может быть использована в количестве 1-1,5 эквивалента, предпочтительно, 1-1,1 эквивалента.
Примеры
Соединения общей формулы (I) получают согласно вышеуказанному способу по настоящему изобретению.

Примеры 1-17: Соединения общей формулы (I), где

Примеры 18-29: Соединения общей формулы (I), где Y = 0(нулю)

Пример 1
(5-{1-[3-(Акридин-9-иламино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-метил-2-метоксипиридин-3-ил)амид 4-фенилпиперазин-1-карбоновой кислоты
2-Этил-6-метокси-5-[(4-фенилпиперазин-1-карбонил)амино]никотиновую кислоту (0,5 г, 1,24 ммоль) растворяют в пиридине (30 мл) и добавляют к ней DCC (0,26 г, 1,24 ммоль), DMAP (0,15 г, 1,24 ммоль) и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид. После перемешивания полученной смеси в течение 24 часов при комнатной температуре образующийся продукт очищают колоночной хроматографией с получением указанного в заголовке соединения.
Выход: 68,2%
Т.пл.: 218-220°С.
1H ЯМР (ДМСО-d6): 1,20 (3H, т), 1,38 (3H, д), 2,79 (2H, кв.), 3,19 (4H, м), 3,61 (4H, м), 3,96 (3H, с), 4,45 (2H, с), 4,53 (1Н, м), 6,50 (1Н, м), 6,85 (1Н, т), 7,01 (4H, д), 7,28 (4H, м), 7,62 (4H, м), 8,00 (3H, д), 8,51 (1Н, д), 9,97 (1Н, с)
Пример 2
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-диметилфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,5-диметилфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 52,3%, Т.пл.: 205-207°С;
1H ЯМР (ДМСО-d6): 1,20 (3H, т), 1,38 (3H, д), 2,79 (2H, кв.), 3,19 (4Н, м), 3,59 (4H, м), 3,75 (6H, с), 3,96 (3H, с), 4,45 (2H, с), 4,53 (1Н, м), 5,18 (1Н, м), 6,03 (1Н, с), 6,14 (2H, с), 6,48 (1Н, с), 7,01 (2H, м), 7,30 (3H, м), 7,56 (3H, м), 7,96 (2H, д), 8,18 (1Н, м), 8,50 (1Н, д), 9,95 (1Н, с)
Пример 3
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-диметоксилфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,5-диметоксифенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 49,1%, Т.пл.: 231-233°С;
1H ЯМР (ДМСО-d6): 1,13 (3H, т), 1,38 (3H, д), 2,12 (1Н, с), 2,79 (2H, кв.), 3,19 (4H, м), 3,59 (4H, м), 3,75 (6H, с), 3,96 (3H, с), 4,46 (2H, с), 4,53 (1Н, м), 5,19 (1Н, м), 6,03 (1Н, с), 6,15 (2H, с), 6,50 (1Н, с), 7,04 (2H, м), 7,32 (2H, с), 7,60 (4H, м), 7,96 (1Н, с), 8,00 (1Н, с), 8,25 (1Н, м), 8,51 (1Н, д), 9,97 (1Н, с)
Пример 4
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-дифторфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,5-дифторфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 48,7%, Т.пл.: 202-204°С;
1H ЯМР (ДМСО-d6): 1,20 (3H, т), 1,38 (3H, д), 2,78 (2H, кв.), 3,30 (4H, м), 3,59 (4Н, м), 3,96 (3H, с), 4,45 (2H, с), 4,53 (1Н, м), 5,20 (1Н, с), 6,54 (2H, м), 6,69 (2H, д), 7,09 (2H, м), 7,33 (2H, с), 7,61 (4H, м), 7,94 (1Н, с), 8,04 (1Н, с), 8,25 (1Н, с), 8,51 (1Н, д), 9,99 (1Н, с)
Пример 5
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-дихлорфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,5-дихлорфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 47,8%, Т.пл.: 184-186°С;
1H ЯМР (ДМСО-d6): 1,20 (3H, т), 1,38 (3H, д), 2,79 (2H, кв.), 3,32 (4H, м), 3,59 (4H, м), 3,96 (3H, с), 4,46 (2H, с), 4,54 (1Н, м), 5,18 (1Н, с), 6,45 (1Н, с), 6,92 (1Н, с), 7,02 (3H, с), 7,34 (3H, м), 7,50 (3H, м), 7,94 (1Н, с), 8,04 (1Н, с), 8,22 (1Н, м), 8,50 (1Н, м), 9,96 (1Н, с)
Пример 6
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3-фторфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3-фторфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 53,4%, Т.пл.: 208-210°С;
1H ЯМР (ДМСО-d6): 1,16 (3H, т), 1,48 (3H, д), 2,80 (2H, кв.), 3,09 (4H, с), 3,48 (4H, м), 3,96 (3H, с), 4,34 (2H, с), 4,81 (1Н, м), 6,41 (1Н, м), 6,53 (3Н, м), 6,86 (1H, м), 6,98 (2H, м), 7,15 (1Н, м), 7,17 (2H, м), 7,38 (3H, м), 7,86 (3H, м), 8,35 (1Н, м), 9,49 (1Н, с)
Пример 7
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3-гидроксифенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3-гидроксифенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 41,9%, Т.пл.: 207-209°С;
1H ЯМР (ДМСО-d6): 1,21(3Н, т), 1,49 (3H, д), 2,81 (2H, кв.), 3,18 (4Н, м), 3,60 (4H, м), 4,02 (3H, с), 4,52 (2H, с), 4,75 (1Н, м), 6,41 (3H, м), 6,67 (1Н, с), 7,06 (2H, м), 7,16 (2H, м), 7,24 (1Н, с), 7,35 (1Н, с), 7,47 (1Н, д), 7,58 (2H, м), 7,86 (2H, м), 8,08 (2H, д), 8,36 (1Н, с), 9,55 (1Н, с)
Пример 8
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3,4,5-триметоксифенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,4,5-триметоксифенил) пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 44,3%, Т.пл.: 205-207°С;
1H ЯМР (ДМСО-d6): 1,23 (3H, т), 1,50 (3H, д), 2,81 (2H, кв.), 3,76 (3H, с), 3,83 (6H, с), 4,05 (3H, с), 4,54 (2H, с), 4,73 (1Н, м), 6,75 (2H, м), 7,20 (2H, м), 7,37 (1Н, с), 7,41 (1Н, с), 7,50 (1Н, д), 7,66 (2H, м), 7,88 (2H, м), 8,09 (1Н, с), 8,14 (2H, м), 8,48 (1Н, с), 9,01 (1Н, с), 9,77 (1Н, с)
Пример 9
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-2-метокси-6-пропилпиридин-3-ил)амид 4-(3,5-диметоксифенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-пропил-5-{[4-(3,5-диметоксифенил) пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 41,2%, Т.пл.: 220-222°С;
1H ЯМР (ДМСО-d6): 0,88 (3H, т), 1,38 (3H, д), 1,68 (2H, м), 2,76 (2H, кв.), 3,19 (4H, м), 3,59 (4H, м), 3,75 (6H, с), 3,95 (3H, с), 4,45 (2H, с), 4,54 (1Н, м), 5,19 (1Н, с), 6,04 (1Н, с), 6,15 (2H, с), 6,50 (1Н, с), 7,04 (2Н, м), 7,31 (2H, с), 7,59 (4Н, м), 7,98 (3H, д), 8,25 (1Н, м), 8,50 (1Н, д), 9,56 (1Н, с)
Пример 10
(5-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-2-метокси-6-пропилпиридин-3-ил)амид 4-(3,5-диметилфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-пропил-5-{[4-(3,5-диметилфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 42,3%, Т.пл.: 195-197°С;
1H ЯМР (ДМСО-d6): 0,88 (3H, т), 1,38 (3H, д), 1,67 (2H, м), 2,25 (6H, с), 2,76 (2H, м), 3,15 (4Н, м), 3,36 (6H, с), 3,59 (4H, м) 3,95 (3H, с), 4,45 (2H, с), 4,54 (1Н, м), 5,19 (1Н, м), 6,49 (2H, с), 6,62 (2H, с), 7,05 (2H, м), 7,31 (2H, с), 7,58 (3H, м), 7,96 (3H, д), 8,23 (1Н, м), 8,50 (1Н, д), 9,96 (1Н, с)
Пример 11
N-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этил}-5-{[4-(3,5-диметоксифенил)пиперазин-1-карботионил]амино}-6-метокси-2-метилникотинамид
Реакцию осуществляют тем же способом, что и в примере 1, используя 5-{[4-(3,5-диметоксифенил)пиперазин-1-карботионил]амино}-2-метил-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 58,2%, Т.пл.: 181-183°С;
1H ЯМР (ДМСО-d6): 1,40 (3H, д), 2,54 (3H, с), 3,28 (4H, м), 3,75 (6H, с), 3,90 (3H, с), 4,07 (4H, м), 4,45 (2H, с), 4,55 (1Н, м), 5,18 (1Н, м), 6,03 (1Н, с), 6,15 (2H, с), 6,49 (1Н, м), 7,03 (2H, м), 7,31 (3H, м), 7,60 (2H, м), 7,67 (2H, м), 8,25 (2H, м), 8,52 (1Н, д), 9,08 (1Н, с), 9,99 (1Н, с)
Пример 12
N-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этил}-5-{[4-(3,5-диметоксифенил)пиперазин-1-карботионил]амино}-2-этил-6-метоксиникотинамид
Реакцию осуществляют тем же способом, что и в примере 1, используя 5-{[4-(3,5-диметоксифенил)пиперазин-1-карботионил]амино-2-этил-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 43,9%, Т.пл.: 177-179°С;
1H ЯМР (ДМСО-d6): 1,20 (3H, т), 1,43 (3H, д), 2,82 (2Н, м), 3,19 (2H, м), 3,29 (2H, м), 3,79 (6H, с), 3,93 (3H, с), 4,12 (4H, м), 4,38 (1Н, м), 4,45 (1Н, м), 4,60 (1Н, м), 6,25 (1Н, с), 6,58 (3H, д), 7,08 (3H, м), 7,45 (2Н, м), 7,84 (6H, м), 8,34 (1H, м), 8,72 (1Н, с), 9,77 (1Н, с)
Пример 13
N-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этил}-5-{[4-(3,5-диметоксифенил)пиперазин-1-карботионил]амино}-6-метокси-2-пропилникотинамид
Реакцию осуществляют тем же способом, что и в примере 1, используя 5-{[4-(3,5-диметоксифенил)пиперазин-1-карботионил]амино}-2-пропил-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 46,5%, Т.пл.: 168-170°С;
1H ЯМР (ДМСО-d6): 0,90 (3H, т), 1,38 (3H, д), 1,69 (2H, м), 2,83 (2H, м), 3,28 (4H, м), 3,75 (6H, с), 3,91 (3H, с), 4,13 (4H, м), 4,46 (2H, с), 4,55 (1Н, м), 6,03 (1Н, с), 6,15 (2H, с), 6,53 (1Н, с), 7,08 (3H, м), 7,31 (2H, с), 7,60 (3Н, м), 7,66 (2H, м), 7,76˜8,35 (2Н, м), 8,53 (1Н, д), 9,07 (1Н, с), 9,99 (1Н, с)
Пример 14
N-{1-[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этил}-5-{[4-(3,5-диметилфенил)пиперазин-1-карботионил]амино}-2-этил-6-метоксиникотинамид
Реакцию осуществляют тем же способом, что и в примере 1, используя 5-{[4-(3,5-диметилфенил)пиперазин-1-карботионил]амино}-2-метил-6-метоксиникотиновую кислоту и N-[3-(акридин-9-ил-амино)-5-гидроксиметилфенил]-2-аминопропанамид с получением указанного в заголовке соединения.
Выход: 47,7%, Т.пл.: 198-200°С;
1H ЯМР (ДМСО-d6): 1,21 (3H, т), 1,41 (3H, д), 2,30 (6H, с), 2,82 (2H, кв.), 3,17 (2H, м), 3,27 (2H, м), 3,90 (3H, с), 4,07 (4H, м), 4,32 (2H, с), 4,45 (1Н, м), 4,60 (1Н, м), 6,25 (1Н, с), 6,58 (3H, д), 7,08 (3H, м), 7,45 (2H, м), 7,84 (6H, м), 8,34 (1Н, м), 8,72 (1Н, с), 9,77 (1Н, с)
Пример 15
(6-этил-5-{1-[3-гидроксиметил-5-(2-метилакридин-9-ил-амино) фенилкарбамоил]этилкарбамоил}-2-метоксипиридин-3-ил)амид 4-(3,5-диметилфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,5-диметилфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и 2-амино-N-[3-гидроксиметил-5-(2-метилакридин-9-ил-амино)фенил]пропионамид с получением указанного в заголовке соединения.
Выход: 51,3%, Т.пл.: 164-166°С;
1H ЯМР (ДМСО-d6): 1,18 (3H, т), 1,52 (3H, д), 2,05 (1Н, с), 2,17 (2Н, м), 2,22 (1Н, с), 2,28 (6H, с), 2,82 (2H, м), 3,10 (4H, м), 3,63 (4H, м), 4,00 (3H, с), 4,42 (2H, с), 4,85 (1Н, м), 6,51 (3H, м), 6,56 (1Н, с), 7,00 (3H, м), 7,43 (2H, м), 7,78 (4H, м), 8,48 (1Н, м), 9,53 (1Н, с)
Пример 16
(5-{1-[3-(3,4-Диметилакридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,5-диметилфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и 2-амино-N-[3-(3,4-диметилакридин-9-ил-амино)-5-гидроксиметилфенил]пропионамид с получением указанного в заголовке соединения.
Выход: 53,9%, Т.пл.: 176-178°С;
1H ЯМР (ДМСО-d6): 1,21 (3H, т), 1,52 (3H, д), 2,28 (6H, с), 2,39 (3H, с), 2,74 (3H, с), 2,83 (2H, кв.), 3,05 (4H, м), 3,48 (4H, м), 3,99 (3H, с), 4,30 (2H, с), 4,89 (1Н, м), 6,41 (1Н, м), 6,49 (2H, с), 6,56 (1Н, с), 6,85 (1Н, м), 7,05 (4H, м), 7,54 (1Н, м),7,73 (1Н, м), 7,92 (2H, м), 8,42 (1Н, с), 9,31 (1Н, с)
Пример 17
(5-{1-[3-(4-Метоксиакридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]этилкарбамоил}-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-диметилфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 1, используя 2-этил-5-{[4-(3,5-диметилфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и 2-амино-N-[3-(4-метоксиакридин-9-ил-амино)-5-гидроксиметилфенил]пропионамид с получением указанного в заголовке соединения.
Выход: 50,8%, Т.пл.: 178-179°С;
1H ЯМР (ДМСО-d6): 1,18 (3H, т), 1,50 (3H, т), 2,27 (6H, с), 2,82 (2H, кв.), 3,12 (4H, м), 3,53 (4Н, м), 3,98 (3H, с), 4,14 (1Н, м), 4,42 (2H, с), 4,81 (1Н, м), 6,52 (4Н, м), 6,89 (4H, м), 7,18 (2H, м), 7,41 (3Н, м), 7,93 (1Н, м), 8,37 (1Н, с), 9,33 (1Н, с)
Пример 18
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-3-ил)амид 4-фенилпиперазин-1-карбоновой кислоты
2-этил-6-метокси-5-[(4-фенилпиперазин-1-карбониламино]никотиновую кислоту (6,48 г, 15,7 ммоль) растворяют в ДМФ (100 мл), добавляют WSCD (3 г, 15,7 ммоль) HOBT (2,12 г, 15,7 ммоль) и [3-(акридин-9-ил-амино)-5-аминофенил]метанол. Образующуюся смесь перемешивают в течение 24 часов при комнатной температуре и использованный растворитель удаляют при пониженном давлении. Затем образующийся продукт очищают методом колоночной хроматографии и получают указанное в заголовке соединение.
Выход: 73,2%, Т.пл.: 187-189°С;
1H ЯМР (ДМСО-d6): 1,24 (3Н, т), 2,82 (2Н, кв.), 3,02 (4Н, м), 3,62 (4Н, м), 3,99 (3Н, с), 4,49 (2Н, с), 5,28 (1Н, т), 6,85 (2Н, м), 7,02 (2Н, м), 7,27 (4Н, м), 7,45 (1Н, м), 7,55 (2Н, м), 7,77 (4Н, м), 8,03 (2Н, с), 8,09 (2Н, м), 10,39 (1Н, с)
Пример 19
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-диметилфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 18, используя 2-этил-5-{[4-(3,5-диметилфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 69,5%. Т.пл.: 178-180°С.
1H ЯМР (ДМСО-d6): 1,89 (3Н, т), 2,28 (6Н, с), 2,70 (2Н, кв.), 3,31 (4Н, м), 3,71 (4Н, м), 3,99 (3Н, с), 451 (2Н, с), 5,28 (1Н, т), 6,69 (1Н, с), 6,89 (1Н, с), 7,08 (1Н, с), 7,53 (2Н, м), 7,71 (1Н, с), 7,87 (1Н, с), 8,04 (3Н, м), 8,18 (3Н, м), 8,37 (2Н, м), 10,46 (1Н, с), 11,55 (1Н, с), 12,28 (1Н, с), 14,88 (1Н, с)
Пример 20
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-диметоксифенил)-пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 18, используя 2-этил-5-{[4-(3,5-диметоксифенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 70,2%. Т.пл.: 170-172°С.
1H ЯМР (ДМСО-d6): 1,25 (3Н, т), 2,84 (2Н, кв.), 3,24 (4Н, м), 3,66 (4Н, м), 3,76 (6Н, с) 4,04 (3Н, с), 4,58 (2Н, с), 5,28 (1Н, т), 6,02 (1Н, с), 6,08 (1Н, с), 6,90 (1Н, с), 7,26 (2Н, м), 7,34 (1Н, м), 7,42 (1Н, м), 7,58 (1Н, с), 7,62 (2Н, м), 7,75 (2Н, м), 7,88 (1Н, д), 8,03 (2Н, м), 8,23 (2Н, м), 8,37 (1Н, с), 10,06 (1Н, с)
Пример 21
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-З-ил)амид 4-(3,5-дифторфенил)-пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 18, используя 2-этил-5-{[4-(3,5-дифторфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 68,8%. Т.пл.: 184-186°С.
1H ЯМР (ДМСО-d6): 1,24 (3Н, т), 2,79 (2Н, кв.), 3,31 (4Н, м), 3,59 (4Н, м), 3,98 (3Н, с), 4,47 (2Н, с), 5,19 (1Н, т), 6,53 (2Н, м), 6,70 (2Н, д), 7,07 (1Н, м), 7,38 (3Н, м), 7,51 (3Н, м), 8,05 (3Н, м), 10,23 (1Н, с), 10,93 (1Н, с)
Пример 22
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-3-ил)амид 4-(3,5-дихлорфенил)пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 18, используя 2-этил-5-{[4-(3,5-дихлорфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 71,2%. Т.пл.: 210-212°С.
1H ЯМР (ДМСО-d6): 1,25 (3Н, т), 2,83 (2Н, кв.), 3,30 (4Н, м), 3,66 (4Н, м), 4,03 (3Н, с), 4,53 (2Н, с), 5,41 (1Н, т), 6,63 (1Н, с), 6,79 (3Н, м), 7,11 (2Н, м), 7,23 (1Н, м), 7,42 (1Н, м), 7,55 (4Н, м), 7,71 (1Н, с), 8,09 (2Н, м), 8,32 (1Н, с), 9,74 (1Н, с)
Пример 23
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-3-ил)амид 4-(3-фторфенил)-пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 18, используя 2-этил-5-{[4-(3-фторфенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 72,1%. Т.пл.: 186-188°С.
1H ЯМР (ДМСО-d6): 1,25 (3Н, т), 2,84 (2Н, кв.), 3,28 (4Н, м), 3,67 (4Н, м), 4,04 (3Н, с), 4,55 (2Н, с), 5,39 (1Н, т), 6,63 (2Н, м), 6,69 (2Н, м), 7,22 (4Н, м), 7,33 (1Н, м), 7,44 (1Н, м), 7,63 (4Н, м), 8,17 (2Н, м), 8,37 (1Н, с), 9,66 (1Н, с)
Пример 24
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-3-ил)амид 4-(3-гидроксифенил)-пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 18, используя 2-этил-5-{[4-(3-гидроксифенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 70,6%. Т.пл.: 196-198°С.
1H ЯМР (ДМСО-d6): 1,25 (3Н, т), 2,80 (2Н, кв.), 3,14 (4Н, м), 3,59 (4Н, м), 3,98 (3Н, с), 4,47 (2Н, с), 5,21 (1Н, т), 6,28 (1Н, д), 6,37 (1Н, с), 6,45 (1Н, д), 6,61 (1Н, м), 7,04 (1Н, т), 7,22 (2Н, м), 7,44 (2Н, м), 7,58 (1Н, м), 7,71 (2Н, м), 7,75 (1Н, м), 8,06 (3Н, м), 9,20 (1Н, с), 10,27 (1Н, с)
Пример 25
{5[3-(Акридин-9-ил-амино)-5-гидроксиметилфенилкарбамоил]-6-этил-2-метоксипиридин-З-ил)амид 4-(3,4,5-триметоксифенил)-пиперазин-1-карбоновой кислоты
Реакцию осуществляют тем же способом, что и в примере 18, используя 2-этил-5-{[4-(3,4,5-триметоксифенил)пиперазин-1-карбонил]амино}-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 66,8%. Т.пл.: 190-192°С.
1H ЯМР (ДМСО-d6): 1,26 (3Н, т), 2,85 (2Н, кв.), 3,14 (4Н, м), 3,59 (4Н, м), 3,78 (3Н, с), 3,84 (6Н, с), 4,11 (3Н, с), 4,57 (2Н, с), 5,34 (1Н, т), 6,71 (1Н, с), 6,77 (2Н, с), 7,21 (2Н, с), 7,35 (1Н, м), 7,65 (4Н, м), 7,88 (3Н, м), 8,04 (1Н, с), 8,14 (2Н, м), 8,56 (1Н, с), 8,92 (1Н, с), 9,07 (1Н, с)
Пример 26
N-(3-(Акридин-9-ил-амино)-5-гидроксиметилфенил]-5-{[4-(3,5-диметоксифенил)-пиперазин-1-карботионил]амино}-2-этил-6-метоксиникотинамид
Реакцию осуществляют тем же способом, что и в примере 18, используя 5-{[4-(3,5-диметоксифенил)пиперазин-1-карбонил]амино}-2-метил-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 69,8%. Т.пл.: 176-178°С.
1H ЯМР (ДМСО-d6): 1,27 (3Н, т), 2,90 (2Н, кв.), 3,32 (4Н, м), 3,99 (3Н, с), 4,10 (4Н, м), 4,53 (2Н, с), 5,35 (1Н, с), 6,03 (1Н, с), 6,05 (2Н, д), 6,61 (1Н, с), 7,19 (3Н, м), 7,39 (1Н, м), 7,55 (2Н, м), 7,72 (2Н, м), 8,11 (4Н, м), 9,16 (1Н, с)
Пример 27
N-(3-(Акридин-9-ил-амино)-5-гидроксиметилфенил]-5-{[4-(3,5-диметилфенил)-пиперазин-1-карботионил]амино}-2-этил-6-метоксиникотинамид
Реакцию осуществляют тем же способом, что и в примере 18, используя 5-{[4-(3,5-диметилфенил)пиперазин-1-карботионил]амино-2-метил-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 71,2%. Т.пл.: 170-172°С.
1H ЯМР (ДМСО-d6): 1,28 (3Н, т), 2,27 (6Н, с), 2,90 (2Н, кв.), 3,28 (4Н, м), 3,99 (3Н, с), 4,11 (4Н, м), 4,55 (2Н, с), 5,39 (1Н, т), 6,54 (3Н, м), 6,70 (1Н, с), 7,15 (2Н, м), 7,32 (1Н, м), 7,47 (1Н, м), 7,60 (2Н, м), 7,76 (2Н, м), 8,02 (1Н, с), 8,13 (2Н, м), 8,42 (1Н, с), 9,70 (1Н, с)
Пример 28
N-(3-(Акридин-9-ил-амино)-5-гидроксиметилфенил]-5-{[4-(3-фторфенил)-пиперазин-1-карбитионил]амино}-2-этил-6-метоксиникотинамид
Реакцию осуществляют тем же способом, что и в примере 18, используя 5-{[4-(3-фторфенил)пиперазин-1-карбонил]амино}-2-метил-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 70,8%. Т.пл.: 176-178°С.
1H ЯМР (ДМСО-d6): 1,26 (3Н, т), 2,87 (2Н, кв.), 3,36 (4Н, м), 3,94 (3Н, с), 4,09 (4Н, м), 4,46 (2Н, с), 5,21 (1Н, т), 6,61 (2Н, м), 6,82 (2Н, м), 7,26 (4Н, м), 7,46 (1Н, с), 7,66 (3Н, м), 7,71 (1Н, с), 8,05 (2Н, м), 9,10 (1Н, с), 10,27 (1Н, с)
Пример 29
N-(3-(Акридин-9-ил-амино)-5-гидроксиметилфенил]-5-{[4-(3,5-дихлорфенил)-пиперазин-1-карбитионил]амино}-2-этил-6-метоксиникотинамид
Реакцию осуществляют тем же способом, что и в примере 18, используя 5-{[4-(3,5-дихлорфенил)пиперазин-1-карботионил]амино}-2-метил-6-метоксиникотиновую кислоту и [3-(акридин-9-ил-амино)-5-аминофенил]метанола с получением указанного в заголовке соединения.
Выход: 69,8%. Т.пл.: 174-176°С.
1H ЯМР (ДМСО-d6): 1,26 (3H, т), 2,86 (2H, кв.), 3,42 (4Н, м), 3,93 (3H, с), 4,07 (4H, м), 4,47 (2H, с), 5,2 (1Н, т), 6,54 (1Н, с), 6,91 (1Н, с), 6,99 (2H, м), 7,11 (2H, м), 7,43 (2H, с), 7,58 (3H, м), 7,72 (2Н, м), 8,03 (2H, м), 9,09 (1Н, с), 10,24 (1Н, с)
Соединения, полученные в примерах согласно настоящему изобретению, испытывают на фармакологическое действие против опухолей. Противораковое действие соединений определяют in vitro в отношении 5 типов клеточных рядов человеческой опухоли и 2 типов клеточных рядов лейкемии.
Методы испытаний и результаты испытаний следующие.
Эксперимент 1: In vitro противоопухолевое действие против клеточных рядов опухоли человека.
А. Клеточные ряды рака:
А549 (не малая легочная клетка человека)
SKOV-3 (клетка яичников человека)
НСТ-15 (клетка толстой кишки человека)
XF-498 (клетка CNS человека)
SKMEL-2 (клетка меланомы человека)
В. Метод: Анализ SRB
а. Клеточный ряд солидной опухоли человека, А549 (не малые легочные клетки), SKMEL -2 (меланома), НСТ-15(толстая кишка), SKOV-3 (яичниковые) и XF-498(CNS) культивировали в 5% СО2-инкубаторах с использованием RPMI 1640 среды, содержащей 10% FBS, при 37°С, с последовательным переносом культуры один или два раза в неделю. Клеточные культуры растворяли в растворе 0,25% тризина и 3 ммоль CDTA PBS(-) для отделения клеток, налипших на культурную среду.
b. 5х103-2х104 клеток добавляли в каждую ячейку 96-ячеечного планшета и культивировали в 5% СО2-инкубаторе при 37°С в течение 24 часов.
с. Каждый образец лекарства растворяли в небольшом количестве ДМСО и разбавляли используемой средой до заданной концентрации для проведения эксперимента до достижения концентрации ДМСО ниже 0,5%.
d. Среду каждой ячейки, культивированной в течение 24 часов, как указано выше в пункте b, удаляли отсасыванием. Каждые 200 мкл образцов лекарств, приготовленных по пункту с, добавляли в каждую ячейку, и ячейки культивировали в течение 48 часов. Пластины, соответствующие Tz(нулевому времени), собирали в момент добавления лекарства.
е. Согласно методу анализа SRB, фиксацию клетки с помощью ТСХ, проявление 0,4% раствором SRB, промывание 1% уксусной кислотой и элюирование красителя 10 ммоль Tris раствором осуществляли на пластинах Tz и пластинах с конечной культурой, а затем определяли величины OD при 520 нм.
С. Расчет результатов
а. Величины, соответствующие нулевому времени (Tz), определяли измерением величины SRB протеина в момент добавления лекарства.
b. Контрольную величину (С) определяли по величине OD ячейки, не обработанной лекарством.
с. Величину пробы, обработанной лекарством (Т), определяли по величине OD обработанной лекарством ячейки.
d. Эффекты действия лекарств определяли по стимулированию роста, ингибированию чистого роста и чистого умерщвления, рассчитанных по величинам Tz, C и Т.
е. Если Т ≥ Tz, функцию клеточного отклика рассчитывали по уравнению 100х(Т-Tz)/(С-Tz), а если Т < Tz, то по уравнению 100(Т-Tz)/Tz. Результаты представлены в следующей таблице 1.
* ССЫЛКИ
1) P. Skehan, R.Strong, D.Scudiero, A.Monks, J.B.Mcmahan, D.T. Vistica, J.Warren, H.Bokesh, S.Kenney и M.R.Boyd: Proc. Am.Assoc. Cancer Res., 30, 612 (1989).
2) L.V. Rubinstein, R.H. Shoemaker, K.D. Paull, R.M.Simon, S. Tosini, P. Skehan, D. Scudiero, A. Monks and M.R. Boyd; J. natl. Cancer Inst., 82, 1113 (1990).
3) P. Skehan, R. Strong, D. Scudiero, A. Monks, J.B. Mcmahan, D.T. Vistica, J. Warren, H. Bokesch, S. Kenney and M.R. Boyd; J. Natl. Cancer Inst., 82, 1107 (1990).
D. Результаты
Установлено, что соединения по настоящему изобретению обладают равным или превосходящим противоопухолевым действием ED50 (мг/мл) по сравнению с цисплатином, контрольным препаратом против клеточных рядов солидного рака человека.
ED50 (мкг/мл)
Эксперимент 2: In vitro противоопухолевое действие против клеток лейкемии животных.
А. Материал:
Клеточные ряды опухоли: Р388 (лимфоидные клетки неоплазмы мыши)
В. Метод: Анализ по исключению красителя
1) Концентрацию Р388 клеток, культивируемых в среде RPMI 1640, содержащей 10% FBS, доводят до 1х106 клеток/мл.
2) Каждый образец лекарства с концентрацией, разбавленной в отношении log дозы, добавляют в среду клеточной культуры, культивируют при 37°С в течение 48 часов в 50% СО2 инкубаторе и затем определяют степень исключения красителя с использованием трипана голубого.
3) Определяют концентрацию образца каждого соединения, показывающую 50% ингибирование роста клеток (IC50) в сравнении с контрольным, и представляют в таблице 2, приведенной ниже.
* ССЫЛКА
1) Р. Skehan, R. Strong, D. Scudiero, A. Monks, J.B. Mcmahan, D.T. Vistica, J. Warren, H. Bokesch, S. Kenney and M.R. Boyd.: Proc. Am. Assoc. Cancer Res., 30, 612 (1989).
2) L. V. Rubinstein, R.H. Shoemaker, K.D. Paull, R.M. Simon, S. Tosini, P. Skehan, D. Scudiero, A. Monks and M.R. Boyd.: J. Natl. Cancer Inst., 82, 1113 (1990)
3) P. Skehan, R. Strong, D. Scudiero, J.B. Mcmahan, D.T. Vistica, J. Warren, H. Bokensch, S. Kenney and M.R. Boyd.: J. Natl. Cancer Inst., 82, 1107(1990).
C. Результаты
Как результат измерений противоопухолевого действия IC50 (мг/мл) против Р388 раковых клеток мыши соединений по настоящему изобретению установлено, что испытанные соединения обладают равным или более высоким противораковым действием, чем соединения контрольного лекарства, митомицина С.
Эксперимент 3: in vivo противораковое действие против клеток мышиной лейкемии Р388
А. Материал эксперимента
Использованы мыши BDF1.
В. Метод проведения эксперимента
1) Клетки лейкемии Р388, последовательно культивированные с переносом культуры в DBA/2 мыши, прививают каждой группе мышей, включающей 8 мышей BDF1 возрастом 6 недель, при дозе 1 х 106 клеток/0,1 мл.
2) Образцы лекарств растворяют в PBS или суспендируют в 0,5% растворе tween 80, а затем делают инъекцию в брюшную полость мыши с каждой заданной концентрацией на 1, 5, 9 день, соответственно.
3) При ежедневном наблюдении определяют время выживания опытных мышей. Противораковое действие определяют таким образом, что возрастающее отношение (Т/С%) среднего срока дней выживания обработанных лекарством групп в сравнении с контрольной группой рассчитывают с использованием среднего времени выживания каждой из групп испытания.
Результаты представлены ниже в таблице 3.
Эксперимент 4. Проба на острую токсичность (LD50):
a) Метод испытания: метод Литчфильда-Уилкоксона
6-недельных мышей ICR (самцы, 30 ± 2,0 г) свободно кормили твердой пищей и водой при комнатной температуре, 23±1°С, и относительной влажности 60±5%. Образцы лекарств вводили в виде инъекции в брюшную полость мышей. Каждая группа включала 6 мышей. При наблюдении в течение 14 дней вели оценку внешнего вида, срока жизни или смерти животных, а также фиксировали видимые поражения мертвых мышей при препарировании. Величины LD50 рассчитывали методом Литчифилда-Уилкоксона.
b) Результаты
Как показано в нижеприведенной таблице, соединения согласно настоящему изобретению преимущественно безопасны по сравнению с цисплатином, при этом многие проблемы, связанные с использованием известных соединений, такие, как ограничение дозы, нежелательные побочные эффекты за счет токсичности и т.д., могут быть в значительной степени преодолены.
Промышленная применимость
Как описано выше, соединения согласно настоящему изобретению значительно более безопасны, а также обладают значительно превосходящим противоопухолевым действием по сравнению с известными противораковыми лекарствами, и, следовательно, ожидается, что соединения по настоящему изобретению могут быть использованы в качестве нового противоопухолевого лекарства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИАМИНОТРИАЗОЛЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2003 |
|
RU2350606C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2146254C1 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
| ЗАМЕЩЕННЫЙ 2-АМИНОПИРИДИН В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ | 2014 |
|
RU2671212C2 |
| АКТИВАТОРЫ ГЛЮКОКИНАЗЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2008 |
|
RU2450001C2 |
| 5-ЧЛЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕКАРСТВЕННЫХ ЦЕЛЕЙ | 2008 |
|
RU2515968C2 |
| ИНГИБИТОРЫ МЕТАЛЛОПРОТЕИНАЗ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2002 |
|
RU2288228C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОВ | 2002 |
|
RU2319699C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ ИНДОЛЫ | 2003 |
|
RU2288914C2 |
| ПРОИЗВОДНЫЕ ДИАМИНА | 2002 |
|
RU2314303C2 |
Настоящее изобретение относится к новым производным 9-аминоакридина, которые обладают выраженным противоопухолевым действием, низкой токсичностью и имеют формулу I
где Y обозначает связь или представляет собой

Х означает кислород или серу, R1-R5 независимо означает водород, галоген, C1-С4алкил или С1-С4алкокси, R' и R'' представляют собой С1-С4алкил или С1-С4алкокси, Z означает С1-C4алкокси, и их фармацевтически приемлемые соли. Описан также способ получения соединений I. 1 н.п. ф-лы, 4 табл.

где Y обозначает связь или группу
где Х означает кислород или серу, R1, R2, R3, R4 и R5 независимо означают водород, галоген, С1-С4алкил или С1-С4алкокси, R' и R'' независимо представляют собой С1-С4алкил или C1-C4алкокси и Z означает C1-C4 алкокси, или их фармацевтически приемлемые соли.

где R1, R2, R3 R4, R5, R', R'', X, Y и Z такие, как указано в п.1, a Y1 означает водород или группу

| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2126001C1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2006-02-10—Публикация
2002-03-07—Подача