Изобретение относится к органическому синтезу, в частности, к способу получения β -хлоропрена.
В промышленных условиях [1] β -хлоропрен получают дегидрохлорированием 3,4-дихлорбутена-1 20% -ным водным раствором NaOH при 85-90оС с одновременной отгонкой образующегося β -хлоропрена. Выход β -хлоропрена на поданный 3,4-дихлорбутен-1 составлляет 78%, при этом до 1,9% образуется α -хлоропрен, 2% ацетальдегида и гидроксилсодержащих соединений. Наряду с этим, в виду жестких температурных условий проведения процесса и рецикла непрореагировавшего 3,4-дихлорбутена-1 и частично β -хлоропрена образуется значительное количество полимерных продуктов. Кроме того, высокая температура процесса приводит к гидролизу исходного 3,4-дихлорбутена и выделению хлористого водорода, и следовательно к коррозии оборудования. Проведение процесса дегидрохлорирования по этой технологии требует применения реакторов большого объема. Например, при проектной мощности в 75 тыс. т в год на Ереванском МПО "Наирит" используется реактор объемом 128,8 м3, обслуживание которого, по вышеуказанным причинам, технически затруднено.
Таким образом, основными недостатками способа являются:
низкий выход β -хлоропрена;
проведение процесса при высокой температуре, что приводит к недостаточно высокой селективности и образованию полимерных соединений;
образование большого количества побочных продуктов, в частности:α -хлоропрен, ацетальдегид и ряд гидроксилсодержащих соединений, которые загрязняют как целевой продукт, так и сточные воды, которые не подвергаются утилизации;
применение специальных материалов при изготовлении технологического оборудования, в виду агрессивности реакционной среды.
Известен способ получения β -хлоропрена [2] дегидрохлорированием 3,4-дихлорбутена-I водным NaOH, взятого в виде 20%-ного раствора на пилотной установке периодического действия. Процесс проводят в присутствии катамина АБ(R1R2(CH3)2N+CI-, где R1 - С10-С18, R2 - бензил, в количестве 5 мас.% от исходного хлорида при 90оС.
Конверсия 3,4-дихлорбутена-1 составляет 99% , выход β-хлоропрена по израсходованному хлориду 96%, выход побочного α -хлоропрена 0,7%.
Описанному способу характерны следующие недостатки:
использование большого количества катализатора (5%) от 3,4-дихлорбутена-I, что указывает на его невысокую каталитическую активность,
низкий выход целевого продукта (96%),
реакция осуществляется при высокой температуре, что приводит как и в предыдущей работе к образованию большого количества отходов.
Применение для реакции щелочного агента низкой концентрации приводит к гидролизу исходного продукта и соответственно к соединениям, представляющим повышенную опасность в экологическом и пожаровзрывоопасном отношениях.
В работе [3] найдены катализаторы, отличающиеся более высокой каталитической активностью и селективностью при дегидрохлорировании 3,4-дихлорбутена-I. Разработанные катализаторы описываются общей формулой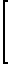 R2
R2
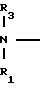 R
R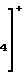 OR
OR
В присутствии этих катализаторов дегидрохлорирование 3,4-дихлорбутена-I 45% -ной водной гидроокисью натрия при их мольном соотношении 1:2, температуре 45-50оС приводит к β -хлоропрену с полным превращением субстрата за 10-15 мин. При этом выход β -хлоропрена достигает 99,8-99,9% при практически полном отсутствии побочных продуктов. Достоинством этих катализаторов является высокая каталитическая активность, приводящая практически к количественному выходу целевого продукта.
Недостатком этих катализаторов является применение металлического натрия при их получении.
Необходимо отметить, что в этой работе процесс дегидрохлорирования осуществлялся в периодическом режиме, что также можно отнести к недостаткам разработки.
Практический интерес представляет работа [4] (прототип), в которой β -хлоропрен получают дегидрохлорированием 3,4-дихлорбутена-1 в каскаде из восьми реакторов, 20%-ным водным раствором NаОН, взятого в молярном соотношении 3,4-дихлорбутен-1: NaOH, равном 1,0:(1,08-1,09). В качестве катализатора используют четвертичные соли аммония, в частности, бензил-бис ( β -оксипропил)2 аммонийхлорида в виде 60%-ного водного раствора, взятого в количестве 0,033% от хлорида или 0,01% в случае рецикла использованного катализатора. Степень конверсии 3,4-дихлорбутена-1 составляет 99,6-99,8%. Селективность и выход β-хлоропрена авторы не указывают. При воспроизводстве этого способа найдено, что α -хлоропрен образуется с выходом не менее 1,6-2,1%. Кроме того, образуется до 1,2-1,6% ацетальдегида.
Недостатками способа являются:
использование щелочного агента низкой концентрации, в связи с этим низкая скорость реакции, образование побочных продуктов;
большое количество высокоминерализованных, загрязненных органикой сточных вод, которые не утилизируются;
избыток щелочи от стехиометрии, который не регенерируется, что требует создания специального узла нейтрализации.
Целью изобретения является создание непрерывной, малоотходной, энергосберегающей, экологически чистой и высокоселективной по целевому продукту технологии получения β -хлоропрена из 3,4-дихлорбутена-1.
Поставленная цель достигается тем, что β -хлорпрен получают в непрерывном режиме в каскаде из двух реакторов, взаимодействием 3,4-дихлорбутена-1 с 25-50% -ной водной NаОН, с применением и рециклом каталитической системы, получаемой взаимодействием водного раствора третичных аминов (формулы R1R2R3N, где R1R2R3 - алкил С1-С5; R3 - аллил, хлораллил, бензил, непредельные С4-С5 - углеводороды), галоидалкила (преимущественно аллильного или бензильного типа), спирта (преимущественно содержащих непредельную или ароматическую группу в положении к атому кислорода) и 3,4-дихлорбутена-1, при их молярном соотношении соответственно 1:1:(3-4):(2-4).
Сущность изобретения заключается в следующем.
В первый реактор подается расчетное количество 3,4-дихлорбутена-1, 25-50% -ная водная NaOH, при их молярном соотношении 1:(2-3) или 1:(0,25-0,4) соответственно и 0,005-0,008 мас.% указанная каталитическая система. Расход каталитической системы ведется в расчете на исходный субстрат и третичный амин, применяемый для по- лучения каталитической системы. Процесс ведут при 20-50оС, в каскаде из двух реакторов, общее время реакции не более 15 мин. Конверсию 3,4-дихлорбутена-1 поддерживают в пределах 75-85%. Реакционная масса направляется в смеситель, где образовавшийся кристаллический NaCl растворяется водой до насыщенного раствора и получаемая реакционная масса подается в фазоразделитель, где отделяется органическая фаза, которая поступает в осушителную колонну. Из верха колонны отбирается β -хлоропрен, кубовый остаток, содержащий небольшое количество β -хлоропрена, 3,4-дихлорбутен-1 и каталитическую систему направляют в первый реактор каскада. Водная фаза из фазоразделителя поступает в выпарной аппарат, в котором щелочь укрепляется до 30-50% и возвращается в рецикл. Выделившийся кристаллический NaCl отфильтровывается, разбавляется водой, отогнанной из выпарного аппарата и направляется на электролиз. Особо следует отметить, что получаемый по предлагаемой технологии NaCl не требует дополнительной очистки.
Предлагаемая технология получения β -хлоропрена в отличие от известных обладает следующими преимуществами:
проведение процесса в мягких температурных условиях, при высокой скорости реакции, что обеспечивает высокую селективность по целевому продукту;
использование стандартного малогабаритного оборудования;
низкий расход катализатора, при этом реализуется возможность утилизации всех образующихся продуктов.
П р и м е р 1. Синтез каталитической системы.
В термостатируемый реактор, снабженный мешалкой, обратным холодильником, термометром, помещают 50,6 г (0,5 моль) триэтиламина. При перемешивании и комнатной температуре прибавляют 38,6 г (0,5 моль) бензилхлорида, 162,16 г (0,5 моль) бензилового спирта и 250 г (2 моль) 3,4-дихлорбутена-1. Смесь при перемешивании и температуре 80оС выдерживают 1 ч. После охлаждения получают гомогенную прозрачную жидкость.
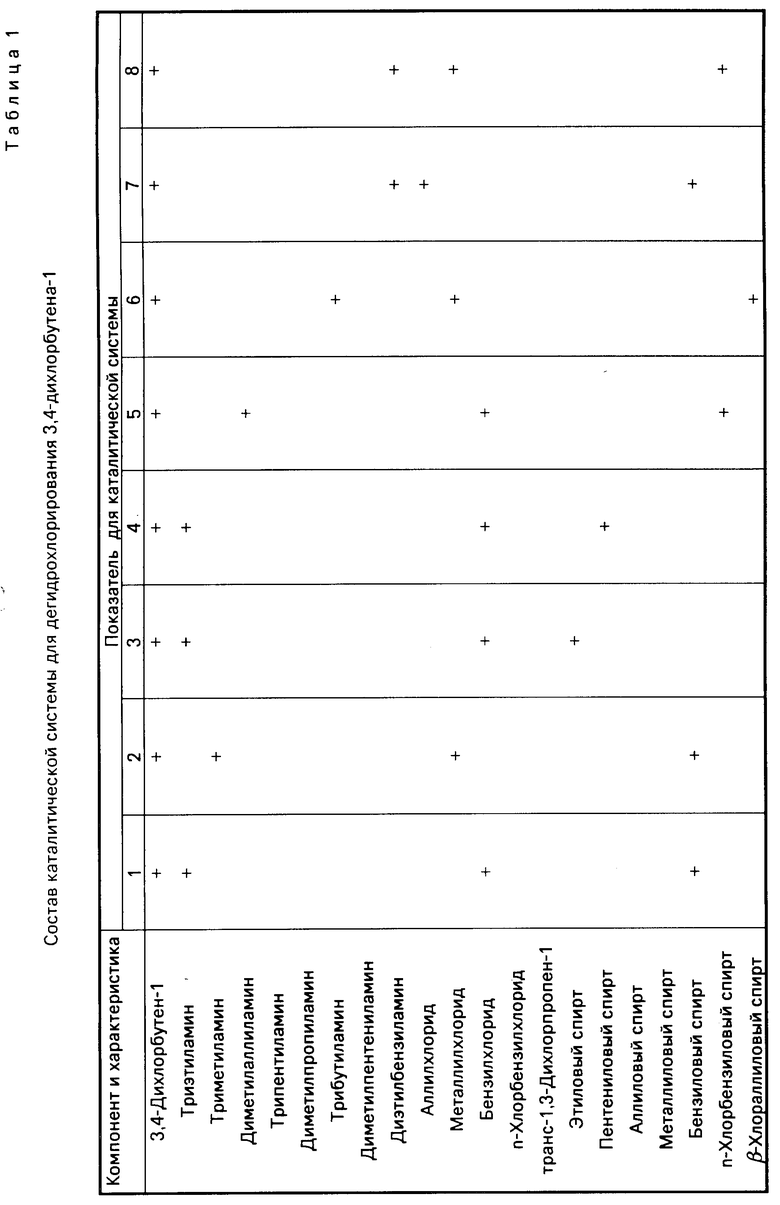
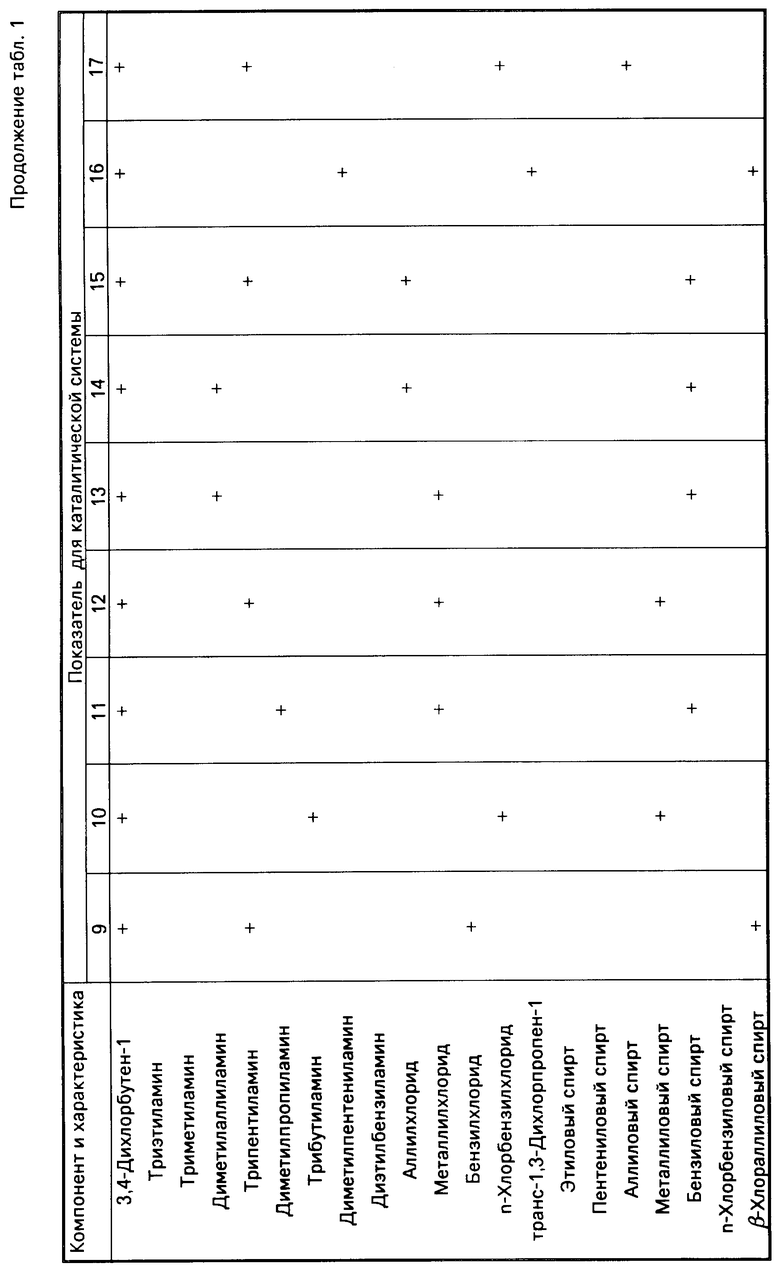
Другие примеры и составы каталитических систем щелочного дегидрохлорирования 3,4-дихлорбутена-1 приведены в табл.1.
П р и м е р 1а. Синтез β -хлоропрена.
Дегидрохлорирование 3,4-дихлорбутена-1 проводили в каскаде из двух реакторов емкостью 1000 мл каждый.
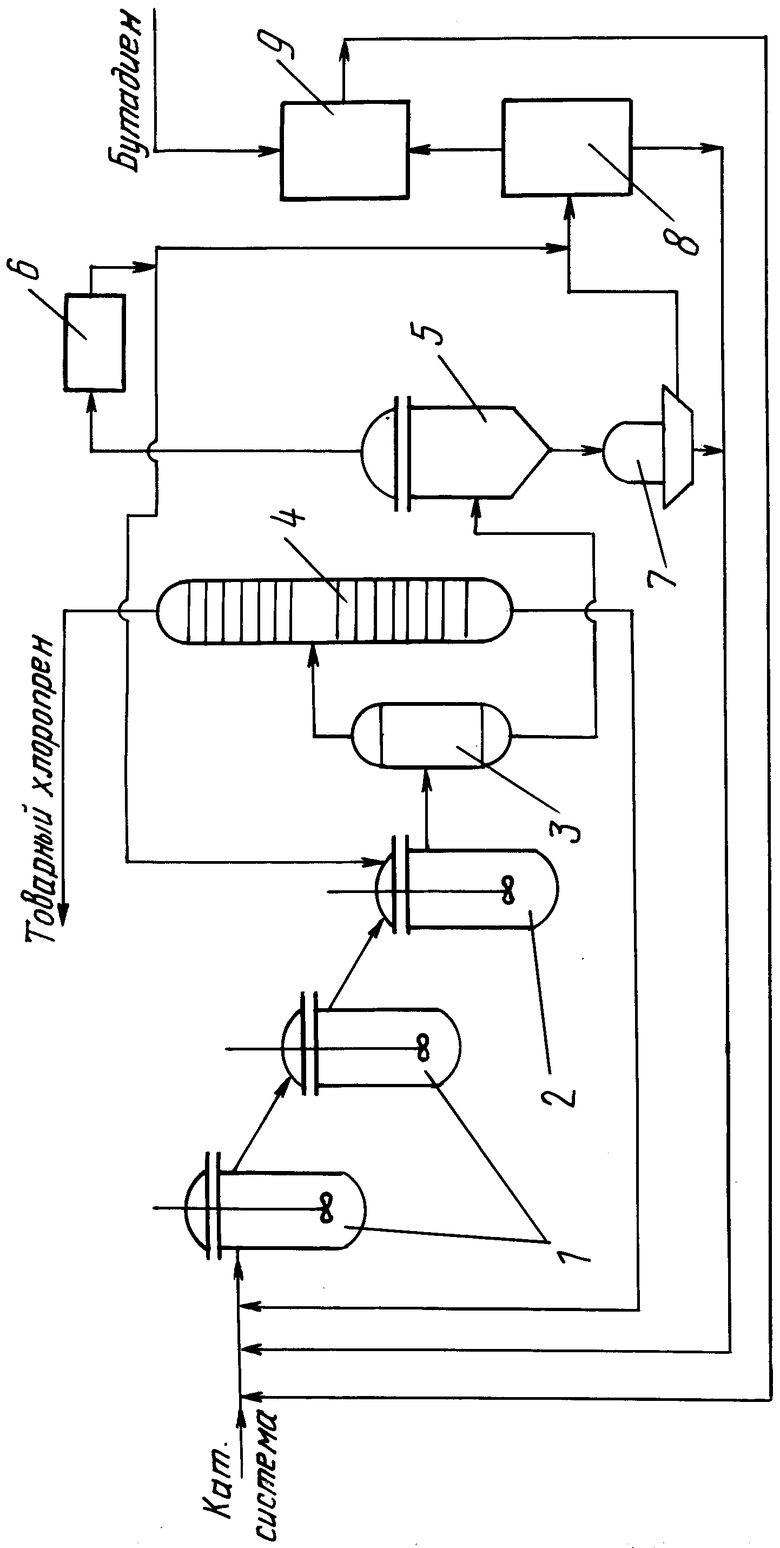
Принципиальная схема сбалансированного по хлору способа получения β -хлоропрена приведена на чертеже.
1-реактор; 2 - смеситель; 3 - фазоразделитель; 4 - осушительная колонна; 5 - выпарной аппарат; 6 - конденсатор; 7 - центрифуга; 8 - узел электролиза; 9 - узел хлорирования бутадиена.
В синтезе β -хлоропрена использовался 3,4-дихлорбутен-1 чистотой 99,8%, 40% NаОН и катализатор приготовленный в условиях примера 1.
3,4-Дихлорбутен-1, 40% NаОН и катализатор дозирующими насосами подаются в первый реактор соответственно 19,2, 12,3, 0,002 г/мин. Туда же подают регенерированный 40% -ный NаОН в количестве 33,6 г. Температура в реакторах поддерживалась 50оС. Время пребывания в каждом реакторе составляло 5-8 мин. Реакционная масса со второго реактора поступает в смеситель, куда подают воду в количестве 15,6 г/мин для растворения кристаллической соли. В фазоразделителе органическая фаза отделяется от водной. Органическая фаза в количестве 14,7 г/мин подается в осушительную колонну, водная фаза в количестве 65,75 г/мин подается в выпарной аппарат. Щелочь в выпарном аппарате укрепляется до 40%, отфильтровывается от выпавшего NaCl и подается в первый реактор в количестве 33,6 г/мин. Часть отогнанной воды (15,6 г/мин) подается в смеситель, остальная часть (9,6 г/мин) подается для приготовления рассола из отфильтрованной соли. Селективность по β-хлоропрену 99,9%.
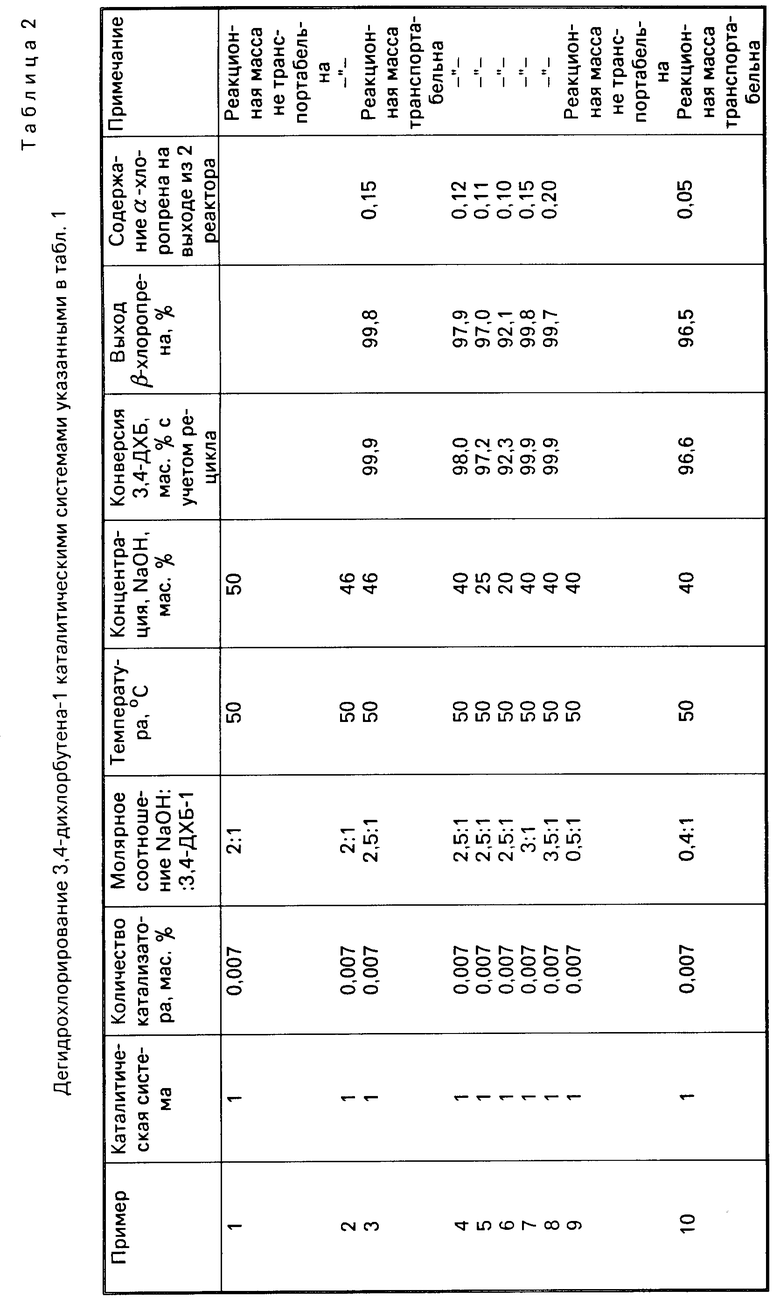
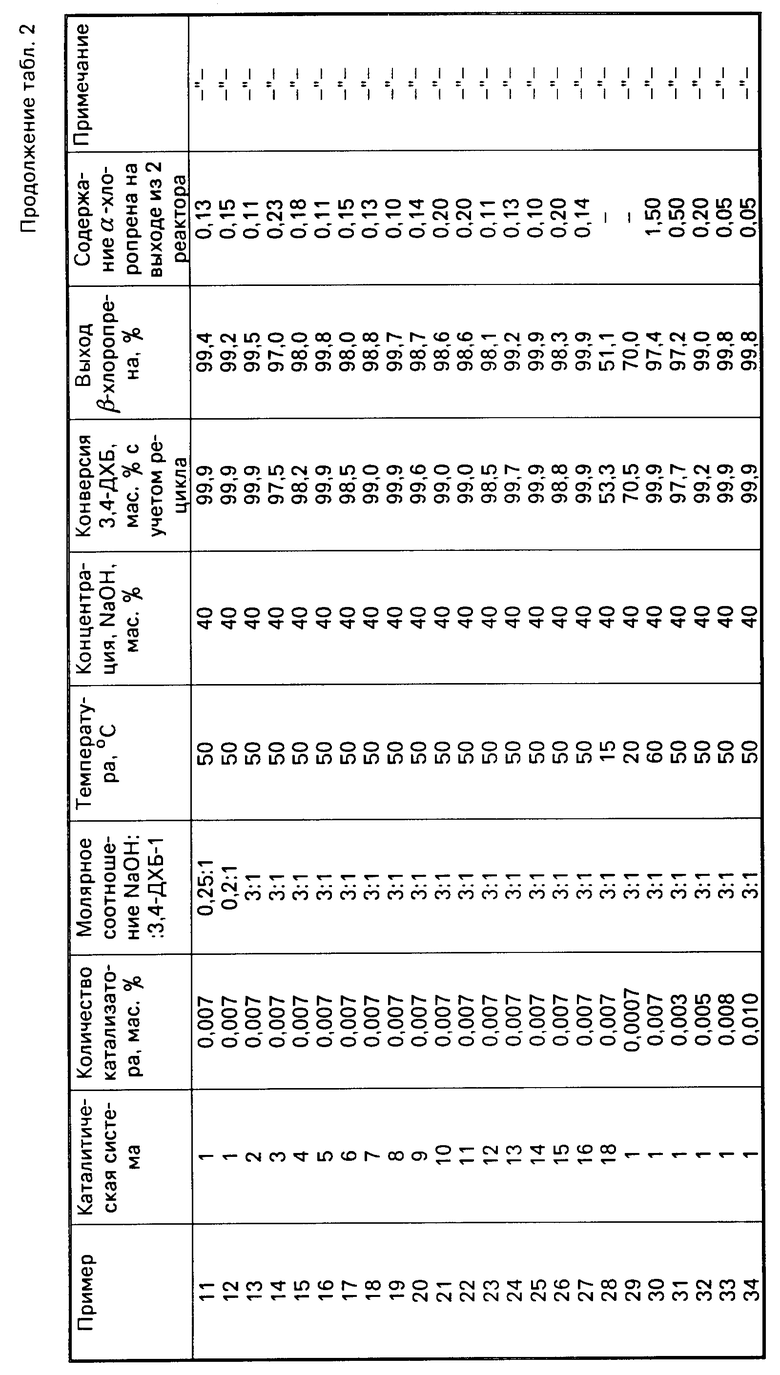
Другие примеры представлены в табл.2.
Предлагаемое изобретение имеет следующие преимущества:
высокая селективность реакции;
малоотходность и экологическая чистота;
низкая энергоемкость технологического процесса;
простое технологическое оформление, позволяющее получать с высокой производительностью и чистотой не только β -хлорпрен, но и NаСl, используемой далее в электролизе,
высокая каталитическая активность и простота получения применяемых каталитических систем.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИСТОГО ВИНИЛА | 1991 |
|
RU2024475C1 |
| СПОСОБ ВЫДЕЛЕНИЯ 1,4-ДИХЛОРБУТЕНА-2 | 1996 |
|
RU2125978C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОПОЛИМЕРОВ ХЛОРДИЕНОВЫХ УГЛЕВОДОРОДОВ | 1996 |
|
RU2137786C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРОПРЕНА | 1993 |
|
RU2119904C1 |
| Способ получения хлоропрена | 1979 |
|
SU775101A1 |
| Способ получения 2-хлорбутадиена-1,3 | 1983 |
|
SU1277888A3 |
| КАТАЛИЗАТОР ДЛЯ ВОДНО-ЩЕЛОЧНОГО ДЕГИДРОХЛОРИРОВАНИЯ ПОЛИХЛОРАЛКАНОВ | 1991 |
|
RU2017521C1 |
| СПОСОБ ПОЛУЧЕНИЯ НЕПРЕДЕЛЬНЫХ ХЛОРУГЛЕВОДОРОДОВ | 1998 |
|
RU2149155C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ ВОДНО-ЩЕЛОЧНОГО ДЕГИДРОХЛОРИРОВАНИЯ ПОЛИХЛОРАЛКАНОВ | 1999 |
|
RU2174441C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРОПРЕНА (ВАРИАНТЫ) | 1994 |
|
RU2121474C1 |

Использование: в производстве галоидуглеводородов, в частности в способе получения бета-хлоропрена-мономера для синтеза полимерных материалов. Сущность изобретения: способ предусматривает реакцию 3,4-дихлорбутена с водным раствором гидроксида натрия в присутствии каталитической системы. Последнюю получают из третичных аминов, галоидалкилов и спиртов при 20 - 50°С с конверсией 70,5 - 99,9%. 2 з.п. ф-лы, 1 ил., 2 табл.
R1 R2 R3 N,
где R1-R3 - C1-C5-алкил, аллил, пентенил, бензил, галоидалкилов аллильного или бензильного типа и спиртов - этилового спирта или спирта, содержащего непредельную или ароматическую группу в β -положении к гидроксильной группе, замещенного в случае необходимости хлором, в количестве 0,005 - 0,008 мас.% в расчете на 3,4-дихлорбутен-1, при молярном соотношении третичный амин : галоидалкил : спирт : 3,4-дихлорбутен-1, равном соответственно 1 : 1 : (2 - 4) : (2 - 4), процесс проводят при 20 - 50oС до конверсии 3,4-дихлорбутена-1 70,5 - 99,9% с последующим добавлением в реакционную массу воды до растворения образующегося в реакции NaCl, отделением органической фазы и выделением из нее β-хлоропрена, используя получаемые при выпаривании неорганической фазы NaOH, NaCl и дистилляционную воду соответственно в рецикле для электролиза и растворения образующегося NaCl и получаемой реакционной массы.
| Тренировочное чучело | 1957 |
|
SU114643A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1994-08-15—Публикация
1991-09-24—Подача