Изобретение относится к химии и медицине, в частности касается соединений на основе палладия и производных ароматических аминов и способа их получения, и может быть использовано в радиационной медицине для защиты организмов млекопитающих от ионизирующего облучения, при введении предлагаемых соединений в органы как до, так и после ионизирующего облучения, а также в условиях хронического ионизирующего облучения малыми дозами.
Результаты ликвидации последствий аварии на Чернобыльской АЭС и другие аварийные радиационные ситуации в разных странах убедительно показали существующую до настоящего времени ограниченность базы биологически активных веществ, обладающих радиомодифицирующей активностью.
Известны, например, серосодержащие радиопротекторы, действующие непосредственно на клетки-мишени или на условия существования этих клеток.
Известны также радиопротекторы, уменьшающие радиационное поражение организма за счет гемической тканевой или циркуляторной гипоксии (индолилалкиламины, цианиды).
Однако все известные радиопротекторы обладают рядом существенных недостатков. Препараты на их основе характеризуются высокой токсичностью, что не позволяет обеспечить значительного радиозащитного эффекта, который напрямую связан c дозой вводимого препарата. Кроме того, высокая токсичность исключает возможность их частого многократного применения. Особенностью существующих радиопротекторов является значительное снижение их радиозащитного действия при многократном фракционировании дозы облучения и практическое его отсутствие при облучении с низкой мощностью дозы.
Существенной особенностью радиопротекторов является также то, что радиозащитное действие проявляется только при их введении до облучения. Это делает невозможным применение их для лечения лучевых повреждений, которые уже возникли в организме в результате облучения.
В настоящее время в связи с рядом обстоятельств (авария на Чернобыльской АЭС и другие) интенсивно разрабатываются иные способы коррекции лучевых повреждений. В этом плане предлагается использование комплекса витаминов и микроэлементов, как правило, в виде веществ растительного происхождения и других биологических активных соединений. Препараты на их основе обычно работают опосредованно через организм и способствуют ускорению процессов пострадиационного восстановления тканей облученного организма. Однако, терапевтический эффект этих препаратов слабо выражен.
Соединений на основе палладия, обладающих радиомодифицирующей активностью, в литературе не обнаружено. Таким образом, наиболее актуальной проблемой радиационной медицины по-прежнему остается разработка соединений, обладающих радиомодифицирующей активностью, действие которых проявляется при введении в организм как до, так и после ионизирующего облучения, а также в условиях хронического ионизирующего облучения малыми дозами.
Целью изобретения является получение эффекта защиты организма от ионизирующего облучения при введении соединений в организм как до, так и после ионизирующего облучения, а также в условиях хронического облучения малыми дозами.
В основу изобретения положена задача разработать новые соединения, обладающие радиомодифицирующей активностью при введении их в организм как до, так и после ионизирующего облучения, а также в условиях хронического ионизирующего облучения малыми дозами, и кроме того, разработать способ получения этих соединений.
Цель достигается тем, что согласно изобретению предлагаются новые соединения на основе палладия и производных ароматических аминов общей формулы I
[NH2R1R2]2 PdCl4 , где R1=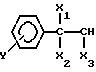
R2=CH3; C2H5;
Y=H; OH; NO2;
X1=H; OH;
X2=OH; CH3;
X3= H; CH3; CH2OH; кроме случая, когда Y=X1=H; X3=R2=CH3; X2=OH, обладающие радиомодифицирующей активностью.
Кроме того, заявляется способ получения соединений общей формулы (I), заключающийся в том, что согласно изобретению соединения общей формулы
[NH2R1R2] Cl (II), подвергают взаимодействию с дихлоридом палладия при стехиометрическом соотношении компонентов при температуре 30-80оС и из полученной реакционной массы выделяют целевой продукт. Рекомендуется при этом выделение целевого продукта проводить при температуре 30-80о.
Предлагаемые соединения обладают радиомодифицирующей активностью при введении в организм как до, так и после ионизирующего облучения, а также в условиях хронического ионизирующего облучения малыми дозами.
При этом терапевтический эффект при использовании предлагаемых соединений достигается при введении доз вещества на порядок ниже максимально переносимых организмом. Кроме того, предлагаемые соединения малотоксичны, в терапевтических дозах не дают побочных эффектов, таких как аллергенность, тератогенность, нежелательное воздействие на почки и другие эффекты.
Предлагаемые соединения апирогенны, обладают бактерицидными свойствами по отношению к некоторым бактериям и микробам.
Предлагаемые соединения (общей формулы I) представляют собой кристаллические вещества желто-коричневого цвета, негигроскопичны, растворимы в воде и изотоническом растворе (0,9%-ный NaCl), без запаха, выше 100-120оС начинают разлагаться без плавления, фотостабильны, как в твердом состоянии, так и в виде растворов, растворы предлагаемых соединений в 0,9%-ный NaCl имеют кислую реакцию, например 0,25%-ный раствор эфазола в 0,9%-ный NaCl через 15 мин после приготовления имеет рН от 3,6-4,1.
Предлагаемые соединения при 25-35оС сохраняют без изменения физико-химические свойства и биологическую активность в течение более 3 ч.
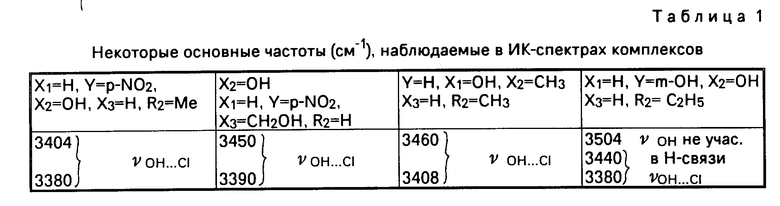
Строение предлагаемых соединений общей формулы I установлено методом ИК-спектроскопии.
Вывод о строении заявляемых соединений сделан на основании анализа ИК-спектров комплексов и свободных лигандов в области частот 100-4000 см-1, измеренных на ИК Фурье-спектрометре "Bruker-IFS-113V".
ИК-спектры комплексов и лигандов в области 1500-4000 см-1 различны, что позволяет по ИК-спектрам выделить спектральные изменения, происходящие при образовании комплекса. Для лигандов наблюдаются ИК-полосы, характерные для солянокислых солей этих лигандов с водородной связью типа
Z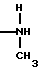 . . . Cl , где Z =
. . . Cl , где Z =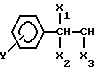 , для которой характерна ИК-полоса
, для которой характерна ИК-полоса  2470 см-1. Дублетная полоса
2470 см-1. Дублетная полоса 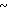 3340/3300 см-1, обусловлена внутримолекулярной водородной связью OH ... Cl.
3340/3300 см-1, обусловлена внутримолекулярной водородной связью OH ... Cl.
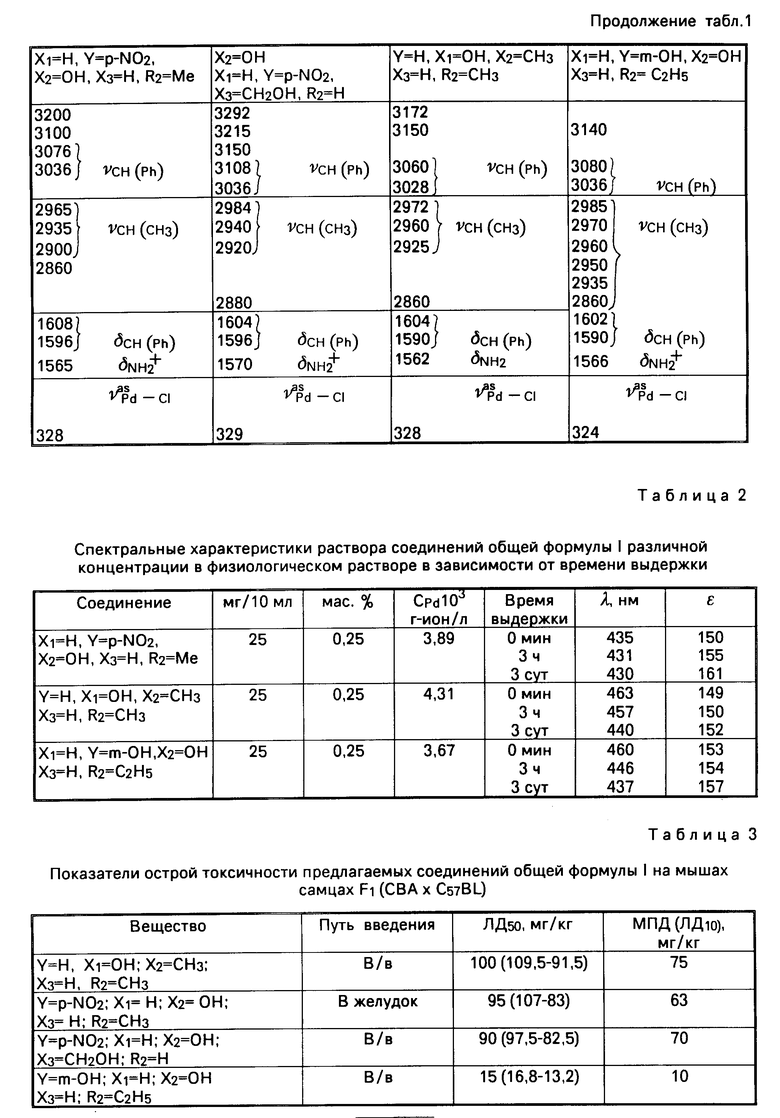
Основные частоты, наблюдаемые в ИК-спектрах предлагаемых соединений, и их отнесение приведены в табл. 1.
В ИК-спектрах комплексов исчезает полоса 2470 см-1, относящаяся к водородной связи NH . .. Cl и появляются полосы катиона R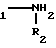 с частотами 2860-2880 см-1 и 1562-1570 см-1 ( δ NH+2) см. табл. 1).
с частотами 2860-2880 см-1 и 1562-1570 см-1 ( δ NH+2) см. табл. 1).
Интенсивная дублетная полоса 3404-3460/3380-3408 см-1 относится к валентному колебанию ОН-группы, участвующей во внутримолекулярной водородной связи HO ... Cl с атомами хлора ацидоаниона.
Сложный характер ИК-спектров комплексов в области 2300-3400 см-1свидетельствует о существовании в этих соединениях как межмолекулярных, так и внутримолекулярных водородных связей NH ... Cl.
Наличие в исследованных соединениях аниона [PdCl4]2- подтверждается интенсивной ИК-полосой с частотой 324-329 см-1 (ν Pd-Cl), характерной для плоскоквадратного аниона [PdCl4]2-. В соединениях K2PdCl4 и (NH4)2[PdCl4] νPdCl=326 см-1. Наличие аниона [PdCl4]2- в (NH4)2PdCl4 подтверждено данными ренгтеноструктурного анализа.
Таким образом, по данным ИК-спектроскопии предлагаемые соединения представляют собой катионно-анионные комплексы строения
(NH2R2R1)2 [PdCl] 4, в которых, существуют два типа водородных связей: внутримолекулярная водородная связь NH ... Cl и OH ... Cl и межмолекулярная водородная связь NH ... Cl.
Методом электронной спектроскопии на спектрометре "Specord" M-40" исследовано состояние предлагаемых соединений в 0,9%-ных растворах NaCl и в водных растворах в зависимости от их концентраций и времени выдержки.
Электронные спектры поглощения записывали сразу после приливания 0,9% -ного раствора NaCl к навеске исследуемого соединения. Из экспериментальных данных следует, что в начальный момент времени в электронных спектрах поглощения в области 350-500 нм наблюдается широкая полоса с λ= 460-463 нм ( ε = 149-153). Следует отметить, что для раствора H2PdCl4 в 0,9%-ном растворе NaCl в электронном спектре поглощения полоса поглощения аниона [PdCl4] 2- имеет λ = 468 нм (ε=160). Небольшой гипсохромный сдвиг этой полосы в электронных спектрах предлагаемых соединений связан, по-видимому, с влиянием объемного органического катиона.
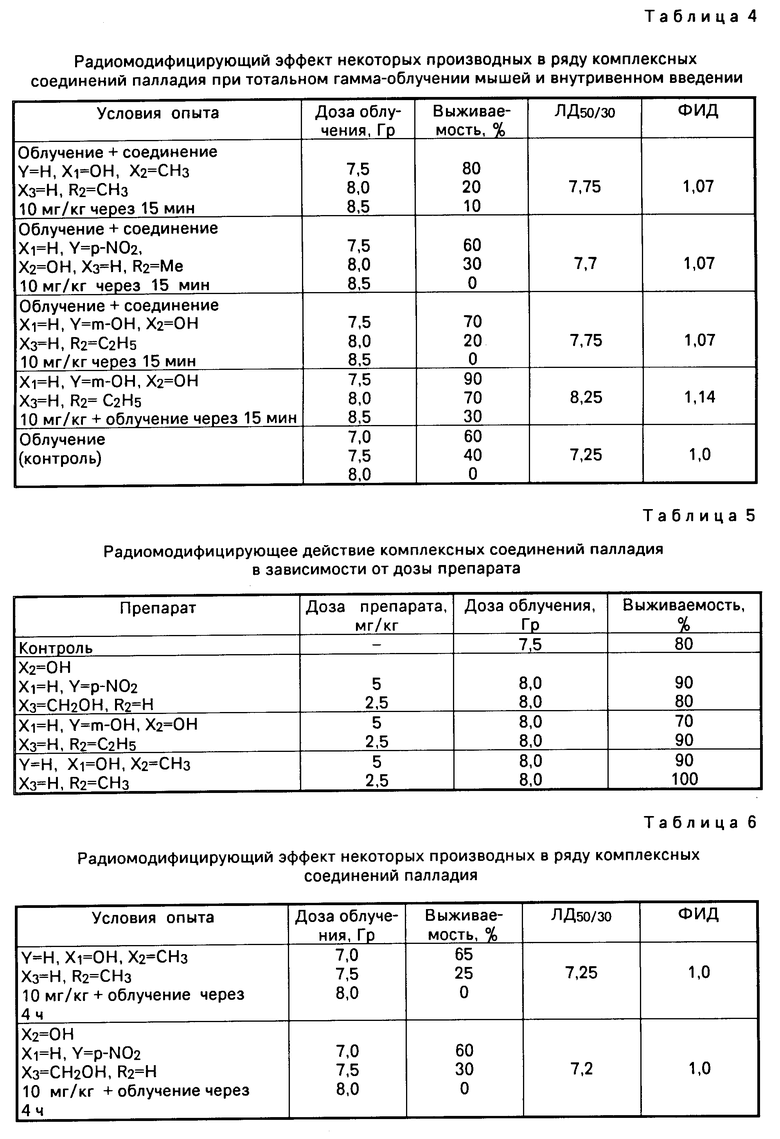
Спектральные характеристики растворов предлагаемых соединений общей формулы I различной концентрации в физиологическом растворе в зависимости от времени выдержки приведены в табл. 2.
Как следует из данных табл. 2, во времени наблюдается изменение электронных спектров поглощения растворов соединений общей формулы I в 0,9%-ном растворе NaCl: наблюдается сдвиг максимума поглощения в коротковолновую область практически без изменения интенсивности этой полосы. Наблюдаемое изменение связано с акватацией аниона [PdCl4]2- и установлением в физиологическом растворе равновесия: тетраацидоформа 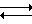 триацидоакваформа комплекса
триацидоакваформа комплекса
[PdCl4]2-+H2O 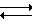 [PdCl3(H2O)]-+Cl- (1).
[PdCl3(H2O)]-+Cl- (1).
В соответствии со спектрохимическим рядом замещение хлориданиона на молекулу воды должно приводить к смещению в коротковолновую область. Этот процесс образования триацидоакваформы более заметен в растворах с меньшей концентрацией палладия. Полученные результаты не противоречат известным данным по акватации аниона [PdCl4]2-. Используя данные по константам равновесия (1), был проведен расчет, который показал, что в системе соединения общей формулы I 0,9% NaCl при установившемся равновесии находится 75% [PdCl4]2- и 25% [PdCl3(H2O)]-.
Изучена стабильность растворов предлагаемых соединений в 0,9%-ном растворе NaCl при различных температурах: 4oC, 25oC, 40oC, 100oC. Показано, что растворы не могут быть нагреты выше 40оС. Понижение температуры до 4оС стабилизирует растворы этих соединений, поэтому при практическом применении целесообразно хранить приготовленные растворы в холодильнике.
Измерены электронные спектры поглощения растворов некоторых соединений общей формулы I в воде концентрацией 20 мг/10 мл, 40 мг/10 мл. Найдено, что в этих спектрах в области 350-500 нм наблюдается интенсивная полоса поглощения с λ= 424 нм (ε= 207). Через сутки электронный спектр растворов претерпевает существенные изменения: сдвиг максимума поглощения в коротковолновую область с λ= 411 нм, при этом существенно увеличивается интенсивность этой полосы (ε= 247). Наблюдаемые результаты позволяют сделать вывод, что в воде эти соединения претерпевают более глубокие изменения, гидролиз аниона [PdCl4]2- идет до диацидоакваформы [PdCl2(H2O)2], либо до ацидотриакваформы [PdCl(H2O)3]+.
Таким образом, исследование методом электронной спектроскопии состояния предлагаемых соединений в водном и физиологическом растворах позволяет сделать вывод, что вода не может быть использована для приготовления растворов этих соединений из-за идущих в водных растворах процессов глубокого гидролиза.
Для приготовления растворов предлагаемых соединений следует употреблять только 0,9%-ный раствор NaCl. Использование физиологического раствора стабилизирует в растворе равновесие тетраацидоформа триацидоакваформа. Для практических целей пригодны растворы с концентрацией этих соединений 0,05-0,2% .
Проведены испытания предлагаемых соединений на токсичность и биологическую активность. Эксперименты проведены на мышах - гибридах F1(CBA x C57BL) самцах. Всего использовано около двух тысяч животных. Острую токсичность предлагаемых соединений общей формулы I определяли на мышах при однократном внутривенном и внутрибрюшинном введении. Вещества вводили в виде 0,1 мас. % - 1,0 мас.% растворов при помощи шприца и инъекционной иглы. В желудок вводили взвесь веществ в 1%-ном крахмальном клейстере при помощи шприца и металлического зонда. Животных наблюдали в течение месяца после введения веществ. Отмечали количество павших и сроки их гибели, следили за состоянием и поведением животных. Дозы, характеризующие токсичность, рассчитывали при помощи метода Литчфилда и Уилкоксона в модификации З.Ротта.
Результаты определения острой токсичности предлагаемых соединений представлены в табл. 3.
Субхроническую токсичность предлагаемых соединений общей формулы I исследовали на крысах и собаках при ежедневном пятикратном или десятикратном внутривенном введении.
Показано, что при введении в терапевтических дозах предлагаемые соединения не влияют на основные механизмы клеточного и гуморального иммунитета, не оказывают патологического действия на биохимический и морфологический состав крови. При попадании в паравенозную клетчатку заявляемые соединения могут вызвать местно-тканевые реакции, сходные с действием широко применяемых лекарств, таких как хлористый кальций, бикарбазин и другие. В высоких, летальных и близких к ним дозах соединения могут вызвать изменения со стороны сосудов головного мозга (мидриаз, экзофтальм, урежение дыхания, рвота), могут патологически влиять на сердечно-сосудистую систему, изменяя величину зубцов R и S электрокардиограммы, вызывать синусовую аритмию.
Тотальное гамма-облучение животных осуществляли при помощи установки "Стебель-3-А" с мощностью дозы 8,3 Р/с (Цезий-137).
Контрольным группам перед облучением внутривенно вводили изотонический раствор хлорида натрия в объеме 0,3 мл на мышь. Опытным группам внутривенно вводили (в хвостовую вену) 0,35%-ный раствор предлагаемого соединения в изотоническом растворе хлорида натрия в дозах 2,5-80 мг/кг.
Мышей помещали в стеклянные камеры по 3-4 животных и вводили в зону облучения установки с расположением источников по типу "беличьего колеса". Дозы облучения устанавливали временем нахождения животных в активной зоне. Дозиметрический контроль фиксировал перепад доз внутри контейнера не более 10%. Облучение животных производили в диапазоне доз 4,0-10 Гр.
Наблюдение за животными проводили в течение 30 сут. Следили за состоянием и поведением животных, отмечали количество павших и сроки их гибели. Выживаемость животных определялась в % на 8-й и 30-й дни наблюдения. На основании данных наблюдения получали кривые выживаемости мышей по шкале пробит-процентов в зависимости от дозы облучения и путем экстраполяции на шкалу доз определяли ЛД50/8 и ЛД50/30.
Радиомодифицирующий эффект предложенного соединения оценивали определением величины фактора изменения дозы (ФИД), получаемого отношением ЛД50 в опыте к ЛД50 в контроле.
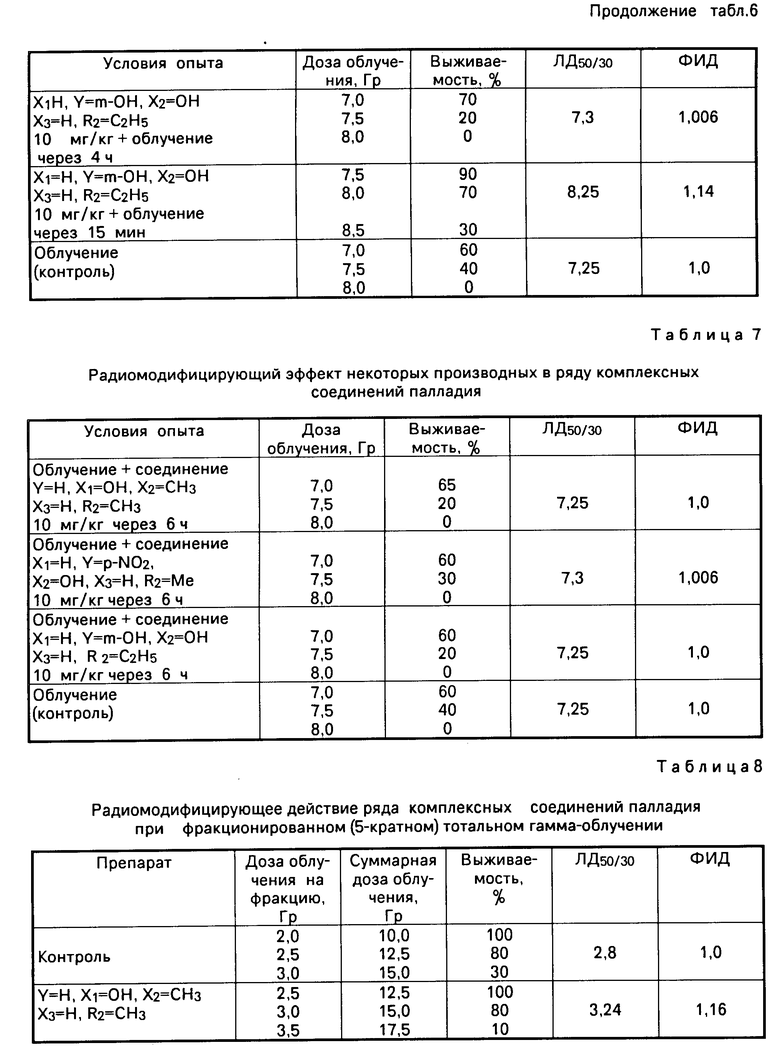
Полученные данные для предлагаемых соединений общей формулы I представлены в табл. 4-8. Всего использовано от 10 до 40 животных на каждую "точку" (дозу облучения).
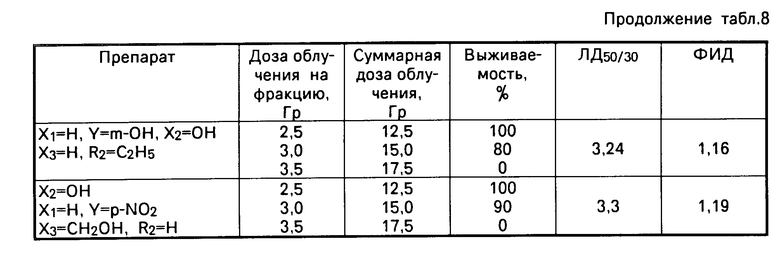
Радиомодифицирующий эффект предлагаемых соединений общей формулы I проявляется при введении в организм как непосредственно перед облучением, так и непосредственно после него с ФИД 1,07-1,14 при дозах препарата 10 мг/кг, выявляемых как по кишечной, так и по костно-мозговой гибели животных (см. табл. 4).
По костно-мозговой гибели животных радиомодифицирующий эффект предлагаемых соединений начинает проявляться уже с дозы 2,5 мг/кг (см. табл. 5).
Применение препаратов в дозе 10 мг/кг за 4 ч перед облучением показало отсутствие радиомодифицирующего действия, как и введение препарата в этой дозе через 4 и 6 ч после облучения (см. табл. 6, 7).
Равноэффективное радиомодифицирующее действие предлагаемых соединений, полученное как непосредственно перед облучением, так и сразу после него показывает, что эффект действия наступает после облучения (см. табл. 4).
Таким образом, исходя из полученных данных следует, что предлагаемые соединения общей формулы I не являются классическими радиопротекторами. Эффективное их применение за 15 мин до облучения, казалось бы, наводит на мысль о радиопротекторных свойствах. Однако, отсутствие усиления эффекта при увеличении дозы препарата в этом режиме не подтверждает этот постулат. Очевидно, что радиомодифицирующее действие растянуто во времени и связано с усилением репарации сублетальных повреждений. Отсутствие радиомодифицирующего действия предлагаемых соединений при введении за 4 ч перед облучением демонстрирует, что биологическое действие препаратов не превышает этого срока. Так, значительное снижение радиомодифицирующего действия этих препаратов при их введении через 4 ч после облучения и полное его отсутствие при введении через 6 ч после облучения также показывает, что эффект реализуется благодаря усилению репарации сублетальных лучевых повреждений. Отсутствие радиомодифицирующего действия препаратов при их введении через 4 ч перед облучением, через 6 ч после облучения практически исключает его реализацию через организм облученного животного по типу усиления тканевого восстановления. Попытка объяснить радиомодифицирующее действие препаратов через механизм "кислородного эффекта" несостоятельна, ввиду отмечаемой эффективности препаратов при их введении после облучения и зависит от состояния стволовых клеток костного мозга и кишечника.
В эксперименте при применении заявляемых соединений в дозе 10 мг/кг через 15 мин после каждой фракции при пятикратном фракционировании дозы, в которых показана возможность увеличения эффективности терапии (см. табл. 8) ФИД=1,16-1,19.
Приведенные данные показывают эффективность использования препаратов при низких дозах облучения. Учитывая низкую токсичность препаратов и значительную широту терапевтического эффекта от 10 до 80 мг/кг при МПД 110 мг/кг, можно эффективно использовать предлагаемые соединения общей формулы I при длительном (хроническом) облучении с низкими мощностями доз.
Анализируя полученные данные можно придти к следующим заключениям:
Заявляемые соединения относятся к новому классу соединений, обладающих радомодифицирующим действием. Радиомодифицирующее действие осуществляется как во время, так и после облучения и принципиально отличает предлагаемые соединения от известных радиопротекторов, эффективность которых проявляется только при введении их перед облучением.
Механизм действия предлагаемых соединений или их метаболитов в организме млекопитающих осуществляется путем увеличения уровней репараций сублетальных лучевых повреждений стволовых клеток кишечника и костного мозга облученных животных. При этом величина радиомодифицирующего эффекта не зависит от дозы облучения в интервале от 4,0 до 10,0 Гр (кривые выживаемости в контроле и в опыте идут параллельно).
Существенным отличием радиомодифирующего действия предлагаемых соединений от действия известных радиопротекторов является практически неизменная его величина в интервалах доз препарата от 10,0 до 80,0 мг/кг (ФИД=1,1). Это позволяет применять низкие, далекие от токсичности дозы препаратов на их основе и создает возможность для многократного применения при хроническом облучении с низкими мощностями доз, при которых все существующие радиопротекторы неэффективны.
Все указанные отличия делают перспективным применение предлагаемых соединений для профилактики и лечения лучевых повреждений животных и человека, так как при фракционированном облучении удается повысить ФИД.
Лечебная эффективность препаратов, применяющихся в настоящее время в радиологии, падает при фракционировании дозы облучения и практически отсутствует при применении сверхнизких доз облучения. Эффект при применении предлагаемых соединений увеличивается при увеличении количества фракций облучения.
Предлагаемый способ получения заявляемых соединений осуществляется следующим образом. Соединения общей формулы II подвергают взаимодействию с дихлоридом палладия при стехиометрическом соотношении компонентов, используя стандартное оборудование. Для этого навеску соединения общей формулы II смешивают с навеской дихлорида палладия и полученную смесь выдерживают до полного взаимодействия исходных реагентов при температуре 30-80оС. При этом температура реакционной массы не должна превышать 80оС для того, чтобы реакция шла в нужном направлении без разложения продуктов реакции. Если же температура будет меньше 30оС, то исходные компоненты могут не взаимодействовать. Выделяют целевой продукт из реакционной массы в виде кристаллического осадка, используя традиционные методы.
Полученный в виде кристаллов целевой продукт сушат и анализируют методами элементного анализа, ИК-спектроскопии и другими широко используемыми методами. Выход целевого продукта составляет 88,2-97,5% от теоретического в расчете на введенный палладий.
П р и м е р 1. Навеску дихлорида палладия 1,00 г (5,64 ммоль) растворяют в 10 мл воды, подкисленной 0,2 мл 10 н. HCl, раствор фильтруют в плоскодонную колбу объемом 50 мл. К этому раствору приливают профильтрованный раствор 2,21 г (11,28 ммоль) 1-(4-нитрофенил)-2-метиламиноэтанола в 10 мл 2 н. HCl. Практически сразу выпадает кристаллический осадок продукта. Реакционную смесь выдерживают в течение 1 ч при перемешивании при температуре 30-40оС и отфильтровывают при комнатной температуре. Осадок сушат в сушильном шкафу при температуре 60оС при атмосферном давлении до постоянной массы.
Получают соединение формулы I, где X1=H; Y=p-NO2; X2=OH; X3=H; R2=CH3.
Выход 3,20 г, что составляет 88,3% от теоретического на введенный в реакцию палладий.
Для C18H26N4O6PdCl4 состава вычислено %: Pd 16,56; Cl 22,06; N 8,12.
Найдено, %: Pd 16,54; Cl 22,12; N 8,28.
П р и м е р 2. Навеску дихлорида палладия 1,13 г (6,35 ммоль) растворяют в 20 мл воды, подкисленной 0,2 мл 10 н. HCl, раствор фильтруют в плоскодонную колбу объемом 50 мл. К этому раствору приливают профильтрованный раствор 3,16 г (12,7 ммоль) 1-(4-нитрофенил-2-аминопропан-1,3-диола гидрохлорида, растворенного в 20 мл воды. Полученную смесь нагревают при перемешивании на водяной бане при температуре 80оС почти досуха. Остаток заливают 25 мл воды и упаривают до минимального объема (эту операцию повторяют два раза). При охлаждении получают кристаллическое вещество, которое сушат в сушильном шкафу при температуре 60оС при атмосферном давлении до постоянного веса.
Получают соединение формулы I, где X1=H; Y=p-NO2; X2=OH; R2=H; X3= CH2OH.
Выход 4,00 г, что составляет 93,5% от теоретического на введенный в реакцию палладий.
Для состава C9H12N2O4PdCl4 вычислено %: Pd 15,77; Cl 21,02; N 8,30.
Найдено, %: Pd 15,96; Cl 20,97; N 8,37.
П р и м е р 3. Навеску дихлорида палладия 0,99 г (5,35 ммоль) растворяют в 30 мл воды, подкисленной 0,2 мл 10 н. HCl, раствор фильтруют в плоскодонную колбу объемом 100 мл. К этому раствору приливают профильтрованный раствор 2,42 г (11,1 ммоль) гидрохлорида 2-(3-гидроксифенил)-2-этиламиноэтанола в 20 мл воды. Полученную смесь упаривают при периодическом перемешивании на водяной бане при температуре 60оС до минимального объема. К остатку приливают 25 мл воды и упаривают почти доcуха (эту операцию повторяют два раза). При охлаждении получают густой кристаллический осадок, который сушат в сушильном шкафу при температуре 60оС при атмосферном давлении до постоянной массы.
Получают соединение формулы I, где X1=H; Y=m-OH; X2=OH; X3=H; R2=C2H5.
Выход 3,00 г, что составляет 88,2% от теоретического в расчете на введенный палладий.
Для состава C20H32O4N2PdCl4 вычислено, %: Pd 17,37; Cl 23,15; N 4,57.
Найдено, %: Pd 18,24; Cl 24,56; N 4,90.
П р и м е р 4. Навеску дихлорида палладия 0,44 г (2,5 ммоль) растворяют в 30 мл воды, подкисленной 0,2 мл 10 н. HCl, раствор фильтруют в плоскодонную колбу объемом 100 мл. К этому раствору приливают профильтрованный раствор 1,07 г (5 ммоль) гидрохлорида 2-фенил-1-метиламинопропан-2-ола в 20 мл воды. Полученную смесь упаривают при периодическом перемешивании на водяной бане при температуре 60оС до минимального объема. Раствор охлаждают и образующийся кристаллический осадок отфильтровывают и сушат в сушильном шкафу при температуре 60оС при атмосферном давлении до постоянной массы.
Получают соединение формулы I, где X1=OH; Y=H; X2=CH3; X3=H; R2=CH3.
Выход 1,35 г, что составляет 93% от теоретического в расчете на введенный палладий.
Для состава C20H32O2N2PdCl4 вычислено, %: Pd 18,32; Cl 24,42; N 4,83.
Найдено, %: Pd 18,58; Cl 24,83; N 4,82.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАЩИТЫ ОРГАНИЗМА ПРИ МНОГОКРАТНОМ ОБЛУЧЕНИИ ИОНИЗИРУЮЩЕЙ РАДИАЦИЕЙ | 1993 |
|
RU2089186C1 |
| КОМПЛЕКСЫ ПАЛЛАДИЯ С ГЕТЕРОЦИКЛИЧЕСКИМИ ЛИГАНДАМИ | 2002 |
|
RU2291872C2 |
| Катионно - анионные комплексы палладия | 2018 |
|
RU2699809C1 |
| ЦИС-ХЛОРДИАММИН-1,3-ДИМЕТИЛКСАНТИНПЛАТИНЫ (II) ХЛОРИД ДИГИДРАТ, ПРОЯВЛЯЮЩИЙ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 1990 |
|
SU1790190A1 |
| СПОСОБ КОРРЕКЦИИ ВТОРИЧНОГО ИММУНОДЕФИЦИТА | 1996 |
|
RU2138258C1 |
| СПОСОБ СТИМУЛЯЦИИ ЛЕЙКОПОЭЗА | 1993 |
|
RU2078581C1 |
| СПОСОБ ПОВЫШЕНИЯ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА | 2003 |
|
RU2235543C1 |
| КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ЗАМЕЩЕННЫХ ИМИДАЗОЛОВ, ПРОЯВЛЯЮЩИЕ АНТИДОТНУЮ И АНТИГИПОКСАНТНУЮ АКТИВНОСТЬ | 1995 |
|
RU2115653C1 |
| СПОСОБ КОРРЕКЦИИ ПОБОЧНЫХ ЭФФЕКТОВ ХИМИОЛУЧЕВОЙ ТЕРАПИИ | 1995 |
|
RU2110995C1 |
| БЕНЗО[b]ТИОФЕНОВЫЕ АГОНИСТЫ STING ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2771811C2 |
Сущность изобретения: соединения ф-лы [NH2R1R2]2PdCl4, где R1 соединение ф-лы 1 представленной в описании, где R2= CH3, C2H5; Y= H,OH; NO2; X1=H, OH; X2-OH, CH3; X3-H, CH3, CH2OH. Реагент 1 : дихлорид палладия. Реагент 2: 1-(4-нитрофенил)-2-метиламиноэтанол, 1-(4-нитрофенил)-2-аминопропан-1,3-диол или 2-(3-гидроксифенил)-2-этиламиноэтанол 2-фенил-1-1метиламинопропан-2-ол. Условия реакции в водной среде, подкисленной соляной кислотой, при стехиометрическом соотношении компонентов при 30 - 80°С. 2 с.п. ф-лы, 8 табл.
(NH2 R1R2)2PdCl4
где
R1=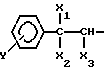
R2 = CH3, C2H5;
Y - H, OH, NO2;
X1 = H, OH;
X2 = OH, CH3;
X3 - H, CH3, CH2OH;
кроме случая, когда Y = X1 - H, X3 = R2 - CH3, X2 = OH.
(NH2R1R2)2PdCl4,
где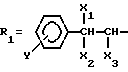
R2 = CH3, C2H5;
Y = H, OH, NO2;
X1 = H, OH;
X2 = OH, CH3;
X3 = H, CH3, CH2OH;
кроме случая, когда Y = X1 - H, X3 H = R2 - CH3, H2 - OH,
отличающийся тем, что соединение общей формулы
(NH2R1R2)Cl,
где R1 и R2 имеют указанные значения,
подвергают взаимодействию с дихлоридом палладия при стехиометрическом соотношении компонентов при температуре 30 - 80oС с последующим выделением целевого продукта.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Там же, Т.В.Пономарева и др | |||
| Новые средства для селективной противорадиационной защиты кишечника, с.756-757 | |||
| /// J | |||
| Shem | |||
| Soc, 1961, p.3240 | |||
| ///J | |||
| Phys | |||
| Shem, 1978, 82, N 1, p.69. | |||
Авторы
Даты
1994-11-15—Публикация
1992-05-12—Подача