Изобретение относится к новым соединениям со структурой, близкой к структуре 15-деоксиспергуалина. Оно также относится к способу их получения и к их применению в фармацевтической композиции, обладающей иммунодепрессантной активностью.
Известно, что 15-деоксиспергуалин является производным спергуалина, последний является антибиотиком, выделенным из культуры Bacillus laterosporus. Первые исследования 15-деоксиспергуалина показали его противоопухолевую активность, а позже исследования показали его иммуноподавляющую активность.
По этому поводу можно, например, сослаться на следующие публикации: G. Dickneite "15-Деоксиспергуалин: от цитостаза до иммуноподавления", Behring Inst. Mitt. , N 82, 231- 239 (1988), G. Dickneite "Влияние (±)-15-Деоксиспергуалина на экспериментальную трансплантацию и его иммунофармакологический способ действия", Behring Inst. Mitt. N 80, 93-102 (1986), и K. Nemoto "Дезоксиспергуалин при летальном заболевании мыши пересадка-к-хозяину", Transplantation, т.51, 712-715, N 3 март 1991.
Несмотря на реальную активность в области иммуноподавления 15-дезоксиспергуалин не обладает достаточной химической стабильностью. Поэтому исследования касались получения более стабильных производных путем замены остатка альфаоксиглицина в дезоксиспергуалине на другие α - W - аминокислоты.
В этом отношении можно, например, сослаться на K. Nishizawa "Синтез и биологическая активность аналогов спергуалина", J. Antibiotic, 1988, 42(П), 1629-1643 и EP-A-O 105 193.
С этой же целью заявителем разработаны новые аналоги 15-дезоксиспергуалина, которые структурно отличаются от продуктов, предложенных в EP-A-O 105193, и являются химически стабильными и обладают иммуноподавляющей активностью, превышающей аналогичную активность известных соединений.
Продукты согласно изобретению отличаются от известных продуктов инверсией связи CO-NH, соединяющей остаток гуанидингексила или гуанидиноктила с центральной аминокислотой.
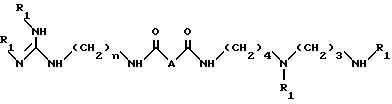
Соединения-аналоги 15-дезоксиспергуалина согласно изобретению представляют собой соединения общей формулы I: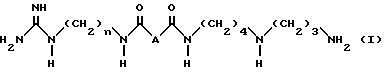
в которой
n равно 6 или 8;
A - простая связь, группа CH2, группа CH(OH), группа CHF, группа CH(OCH3), группа CH2NH или группа CH2O,
их аддитивные соли.
Среди аддитивных солей можно назвать соли с кислотами, полученными при взаимодействии минеральной кислоты или органической кислоты с соединением формулы I. Предпочтительными для солеобразования минеральными кислотами являются соляная, бромистоводородная, серная и фосфорная кислоты. Предпочтительными органическими кислотами для солеобразования являются фумаровая, малеиновая, метансульфоновая, щавелевая, лимонная и трифторуксусная кислоты.
Соединения формулы I могут быть получены по известным способам при применении классических реакций, например, образования амидной связи, и в частности, применяя методы, известные в химии пептидов.
Согласно изобретению способ получения соединений формулы I и их аддитивных солей заключается в том, что он включает стадию снятия защиты с соединения формулы VII: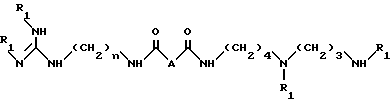
в которой
n и A имеют указанные выше значения;
R1 - защитная группа типа алкоксикарбонила,
например путем реакции с сильной кислотой, с заменой R1 на H.
Среди защищающих групп, которые пригодны для этой цели, можно упомянуть остатки, приведенные ниже с их классическими сокращениями:
Ados = адамантилоксикарбонил
Aos = трет.-амилоксикарбонил
Boc= трет. -бутоксикарбонил/другая номенклатура: (1,1= диметилэтокси/карбонил)
Fmoc=9-фторенилметилоксикарбонил
Foc=фурфурилоксикарбонил
Iboc=изоборнилоксикарбонил
Z =бензилоксикарбонил
Z (p-Cl)=п-хлорбензилоксикарбонил
Z (p-OMe) - п-метоксибензилоксикарбонил
Среди этих групп, называемых далее "аминозащитными", группа R1 предпочтительно представляет собой группу Boc.
На практике способ получения соединения формулы I или одной из аддитивных солей заключается в том, что его осуществляют согласно одному из указанных вариантов:
- вариант A, который включает стадии, состоящие из:
(a) взаимодействия соединения формулы II: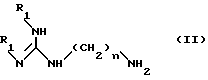
в которой
n равно 6 или 8;
R1 - аминозащитная группа, например группа (1,1-диметилэтокси)карбонил,
с кислотой или хлорангидридом кислоты формулы III: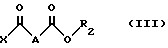
в которой
X - хлор или группа OH;
A - простая связь, группа CH2, группа CHF, группа CH(OCH2C6H5) или группа CH(OCH3);
R2 - C1-C3-алкил, линейный или разветвленный или фенилметильная группа,
в органическом растворителе (например, хлорированном растворителе, например дихлорметане или хлороформе), в присутствии активатора карбоксильной группы (например, карбодиимида, такого как, например, 1,3-дициклогексилкарбодиимида) и в присутствии нуклеофильного агента (а именно 1-оксибензотриазола), при температуре между 0oC и примерно 40oC, в соотношении примерно 1 моль соединения II на примерно 1 моль соединения III, чтобы получить соединение формулы IV: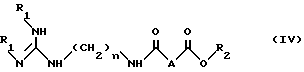
в которой
R1, R2 и n имеют указанные выше значения;
A - прямая связь, CH2, CHF, CH(OCH2C6H5) или CH(OCH3)
б) омыления соединения формулы IV, полученного таким образом, в органическом растворителе в присутствии сильного основания с получением соединения формулы V: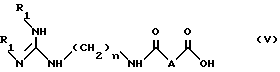
в которой
R1 и n имеют указанные выше значения;
A - простая связь, CH2, CHF, CH(OCH2C6H5) или CH(OCH3),
в) конденсации полученного таким образом соединения V с амином формулы VI: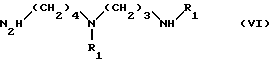
в которой
R1 имеет значения, указанные выше,
в условиях, идентичных условиям стадии (a) с получением соединения формулы VII: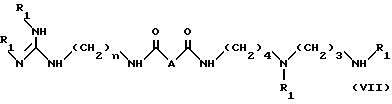
в которой
R1 и n имеют значения, указанные выше;
A - простая связь, CH2, CHF, CH(OCH2C6H5) или CH(OCH3),
г) при необходимости, снятия защиты с соединения формулы VII, в которой A является группой CH(OCH2C6H5) с помощью каталитического гидрирования, чтобы получить соединение формулы VII, в которой A является группой CH(OH),
д) снятия защиты с соединения УП, полученного на стадии в) или на стадии г), где A является простой связью, CH2, CHF, CH(OH), или CH(OCH2), чтобы удалить защитную группу R1, например, при действии сильной кислоты, например, трифторуксусной кислоты, и получить таким образом аддитивную соль соединения формулы I, где A является простой связью, CH2, CHF, CH(OH) или CH(OCH3), и
е) при необходимости, получение соединения формулы 1 в виде свободного основания при действии сильного основания, с последующим переводом свободного основания, в соли присоединения;
- вариант B, который включает стадии:
(a) взаимодействия соединения формулы VI: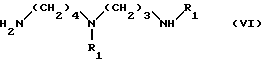
в которой
R1 - аминозащитная группа, указанная выше, например (1,1-диметилэтокси)карбонил)
с кислотой или хлорангидридом кислоты формулы III: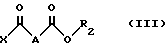
в которой
X - атом хлора или группа OH;
A - простая связь, группа CH2, группа CH(OCH2C6H5), группа CH(OCH3), или группа CHF;
R2 - C1-C3-алкил, линейный или разветвленный, или фенилметильная группа,
в органическом растворителе (а именно, хлорированном растворителе, например, дихлорметане или хлороформе), в присутствии активатора карбоксильной группы (а именно, карбодимиида, например, 1,3- дициклогексилкарбодиимида) и в присутствии нуклеофильного агента (а именно, 1-оксибензотриазола), при температуре между 0oC и примерно 40oC, при соотношении примерно 1 моль соединения VI на примерно 1 моль соединения III, с получением соединения формулы VIII: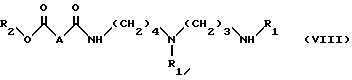
в которой
R1 и R2 имеют указанные выше значения;
A - простая связь, группа CH2, группа CH(OCH2C6H5), группа CH(OCH3) или группа CHF,
б) омыление соединения формулы VIII, полученного таким образом, в органическом растворителе в присутствии сильного основания с получением соединения формулы IX: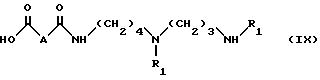
в которой
R1 имеет значения, указанные выше;
A - простая связь, группа CH2, группа CH(OCH2C6H3), группа CH(OCH3) или группа CHF,
в) конденсацию соединения формулы IX, полученного таким образом, с амином формулы II: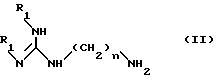
в которой
n равно 6 или 8, и R1 имеет значения, указанные выше,
в условиях, идентичных условиям стадии (a) с получением соединения формулы VII: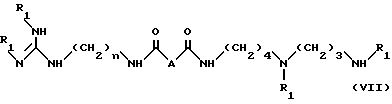
в которой
R1 и n имеют указанные выше значения;
A - простая связь, группа CH2, группа CH(OCH2C6H5, группа CH(OCH3) или группа CHF,
г) при необходимости, снятие защиты с соединения формулы VII, в которой A является группой CH(OCH2C6H5), путем каталитического гидрирования, чтобы получить соединение формулы VII, в которой A является группой CH(OH),
д) снятие защиты с полученного таким образом соединения формулы VII под действием сильной кислоты (например, трифторуксусной кислоты), чтобы получить аддитивную соль соединения формулы I, где A является простой связью, группой CH2, группой CH(OH), группой CH(OCH3) или группой CHF,
е) при необходимости, получение соединения формулы I в виде свободного основания под действием сильного основания с последующим переводом свободного основания в соль присоединения,
- вариант C, который включает следующие стадии:
(а) ацилирование NH2-конца основания формулы X: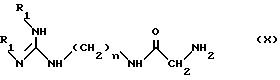
в которой
R1 - защитная группа, указанная выше, например (1,1-диметилэтокси)карбонил;
n равно 6 или 8,
с помощью хлорформиата или симметричного карбоната (например, бис-(4-нитрофенил/карбоната), в инертном растворителе при комнатной температуре 15-25oC,
(б) аминолиз полученного таким образом соединения амином формулы VI: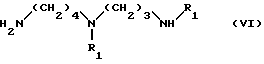
в которой
R1 имеет указанные выше значения,
чтобы получить соединение формулы VII: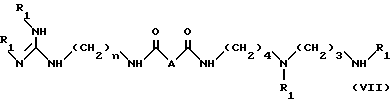
в которой
R1 и n имеют указанные выше значения;
A - группа CH2NH,
в) снятие защиты с полученного таким образом соединения VII при действии сильной кислоты (например, трифторуксусной кислоты), чтобы получить соль присоединения соединения формулы I, где A является CH2NH, и
г) при необходимости, получение соединения формулы I в виде свободного основания при действии сильного основания, с последующим переводом свободного основания в соль присоединения, и
- вариант D, который включает следующие стадии:
(a) взаимодействие соединения формулы VI: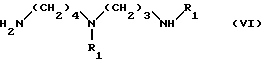
в которой
R1 - амино-защитная группа, указанная выше, например 1,1-диметилэтокси/карбонил),
с карбонатом формулы III':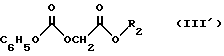
в которой
R2- C1-C3-алкил линейный или разветвленный, или фенилметил,
в инертном органическом растворителе (например, таком ароматическом растворителе, как толуол), при температуре кипения с обратным холодильником при соотношении примерно 1 моль соединения VI на примерно 1 моль соединения III', чтобы получить соединение формулы: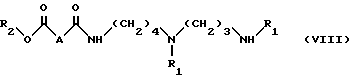
в которой
R1 и R2 имеют указанные выше значения; A - группа CH2O,
б) омыление соединения формулы VIII, полученного таким образом, в органическом растворителе в присутствии сильного основания, чтобы получить соединение формулы IX: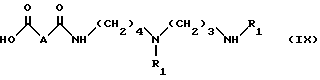
в которой
R1 имеет указанные выше значения;
A - группа CH2O,
в) конденсацию полученного таким образом соединения формулы IX с амином формулы II: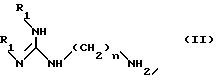
в которой
R1 имеет указанные выше значения;
n равно 6 или 8,
в органическом растворителе (например, хлорированном растворителе, например, дихлорметане или хлороформе), в присутствии активатора карбоксильной группы (например, карбодиимида, такого как 1,3-дициклогексилкарбодиимида) и в присутствии нуклеофильного агента (например, 1-оксибензотриазола) при температуре между 0oC и примерно 40oC, при соотношении примерно 1 моль соединения IX на примерно 1 моль соединения II, чтобы получить соединение формулы VII: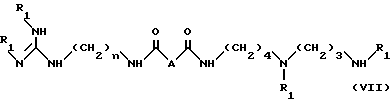
в которой
R1 и n имеют указанные ранее значения;
A - группа CH2O,
г) снятие защиты с соединения VII, полученного таким образом, при действии сильной кислоты (например, трифторуксусной кислоты), чтобы получить соль присоединения соединения формулы I, где А является CH2O, и
д) при необходимости, получение соединения формулы I в виде свободного основания при действии сильного основания, с последующим переводом свободного основания в соль присоединения.
Соединение VI, где R1 является группой (1,1-диметилэтокси)карбонилом, может быть получено по методике, предложенной Раймондом Дж.Бержероном, "Общий синтез (±)-15-дезоксиспергуалина", J. Org. Chem. 1987, 52, 1700-1703.
Соединения формулы IV можно получить образованием смешанного ангидрида с последующим аминолизом: кислоту формулы III вводят во взаимодействие с хлорформиатом, например, изобутипхлорформиатом, в присутствии одного эквивалента третичного основания, например, N-метилморфолина, в инертном растворителе при температуре около -30oC в течение примерно 0,5 ч, потом добавляют в реакционную среду основание II.
Образование амидной связи также может быть осуществлено по известным для специалистов методикам, например, ацилированием соответствующего амина хлорангидридом кислоты в инертном растворителе в присутствии сильного органического основания.
Промежуточные соединения формулы VII, в которой R1 является амино-защитной группой, например, типа оксикарбонила, n равно 6 или 8 и A является простой связью, группой CH2, группой CH(OH), группой CH(OCH3), группой CH2NH, группой CH2O, группой CHF или группой CH(OCH2C6H5), являются новыми соединениями.
Соединения согласно изобретению могут входить в фармацевтические композиции, проявляющие иммунодепрессантные свойства, в которые вводят фармацевтически допустимые добавки. Активный ингредиент вводят в фармакомпозицию в терапевтически эффективном количестве.
Изобретение иллюстрируется примерами и результатами фармакологических испытаний соединений изобретения и сравнительными результатами, полученными с известными из уровня техники продуктами. Использованная ниже номенклатура является номенклатурой, употребляемой в Chemical Abstracts, согласно этой номенклатуре сложный диэфир типа трет. бутил- и этил-алкандиоата обозначен как "алкандиовая кислота, (1,1-диметил-этил) этиловый эфир".
Приготовление 1
(((6-Аминогексил)имино)метилен)бис-карбаминовая кислота, бис-(1,1-диметилэтиловый)эфир.
При перемешивании при комнатной температуре прибавляют 17,23 г (0,148 моль) 1,6-гександиамина к раствору 43 г (0,148 моль) N,N'-бис(трет.бутоксикарбонил-S-метилизотиомочевины в 300 мл тетрагидофурана. Реакционную среду перемешивают в течение 16 ч. После выпаривания растворителя полученный остаток хроматографируют на оксиде кремния, элюируя смесью хлороформ/этанол 3: 1 (объем/объем), потом смесью этилацетат/метанол/раствор аммиака концентрацией 32% в воде 6:3:0,1 (объем/объем/объем). Таким образом получают 19,7 г (выход 37%) желтого масла.
1H-ЯМР (CDCl3): 1,25-1,60 (м, 28Н), 2,7 (т, 2Н), 3,5 (к, 2Н), 8,3 (т, 1Н), 11,5 (с, 1Н).
Работая по аналогичной методике, получают следующий продукт:
(((8-Аминооктил)имино)метилен)бис-карбаминовая кислота, бис-(1 1-диметилэтиловый) эфир.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 32Н), 2,7 (т, 2Н), 3,4 (к, 2Н), 8,3 (т, 1Н), 11,5 (с, 1Н).
Приготовление II
6-((1,1-Диметилэтокси)карбонил)-12-оксо-2,6,11-триаза-тетрадекандиовая кислота, 1-(1,1-диметилэтил)-14-этиловый эфир.
Прибавляют 0,82 г (4•10-3 моль) 1,3-дициклогексилкарбодиимида к раствору, охлажденному до 0oC, из 0,53 г (4•10-3 моль) этилмалоната в 20 мл безводного хлороформа. После 0,5 ч перемешивания прибавляют по каплям при 0oC 1,04 г (3•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил-2,6-диазадекановой кислоты, 1,1-диметилэтилового эфира в растворе в 5 мл безводного хлороформа. Перемешивают 5 ч при комнатной температуре и прибавляют 1,06 г (8•10-3 моль) этилмалоната и 1,64 г (8•10-3 моль) 1,3-дициклогексилкарбодиимида. Перемешивают 1 ч и выпаривают растворитель при пониженном давлении. Полученный пастообразный остаток хроматографируют на оксиде кремния, элюируя смесью этилацетата/гексана 1: 1 (объем/объем) потом этилацетатом. Получают 0,95 г (выход 69%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,25 (т, 3Н), 1,40-1,70 (м, 24Н), 3,10-3,35 (м, 10Н), 4,2 (к, 2Н).
Приготовление III
6-((1,1-Диметилэтокси)карбонил)-12-оксо-2,6,11-триаза-тетрадекандиовая кислота, 1-(1,1-диметилэтиловый) эфир.
Растворяют 0,95 г (2,07•10-3 моль) продукта, полученного в приготовлении II, в смеси 20 мл 1Н гидроксида натрия и 20 мл диметоксиэтана 1:1 (объем/объем). Перемешивают 15 мин при комнатной температуре и уменьшают до трети объем реакционной среды, которую подкисляют затем до pH, лежащего между 2 и 3, 1Н соляной кислотой. Потом 2 раза экстрагируют 50 мл хлороформа. После упаривания при пониженном давлении органических фаз полученный остаток хроматографируют на оксиде кремния, элюируя смесью этилацетата:метанола 3:1 (объем/объем), потом метанолом. Таким образом получают 0,75 г (выход 84%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,40 (с, 18Н), 1,55 (м, 6Н), 2,90 (м, 4Н), 3,15 (м, 6Н).
Приготовление IV
3-(((1,1-Диметилэтокси)карбонил)амино)-20-((1,1-диметилэтокси) карбонил)-12,14-диоксо-2,4,11,15,20, 24-гексаазапентакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый)эфир
Прибавляют при перемешивании при 0oC к раствору 0,5 г (1,16•10-3 моль) продукта, полученного в приготовлении III, в 30 мл безводного хлороформа 0,46 г (2,32•10-3 моль) 1,3-дициклогексилкарбодиимида и 0,0155 г (0,1•10-3 моль) гидрата-1-оксибензотриазола. После 0,5 ч перемешивания реакционной среды прибавляют по каплям при 0oC 0,42 г (1,16•10-3 моль) (((6-аминогексил)имино)метилен)бис-карбаминовой кислоты, бис-(1,1-диметилэтилового) эфира (полученного по методике приготовления 1 выше). Снова перемешивают реакционную смесь при 0oC в течение 1,5 ч, потом прибавляют 0,23 г (1,16•10-3 моль), 1,3-дициклогексилкарбодиимида и продолжают перемешивание в течение 24 ч при комнатной температуре. Растворитель выпаривают при пониженном давлении и полученный остаток хроматографируют на оксиде кремния, элюируя смесью этилацетата/гексана 1:1 (объем/объем), потом этилацетатом и, наконец, смесью этилацетата/метанола 9: 1 (объем/объем). Таким образом получают 0,7 г (выход 73%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 50Н). 3,1-3,3 (м, 12Н), 3,4 (к, 2Н), 4,8 и 5,3 (с шир, 1Н), 6,8 и 7,15 (с шир, 2Н), 8,3 (т, 1Н), 11,5 (с, 1Н).
Пример 1
N-(4-((3-(Амино)пропил)амино)бутил)-N'-(6-((аминоиминометил)- -амино)гексил)-пропандиамид, транс-(трифторацетат)
Растворяют 0,7 г (0,9•10-3 моль) продукта, полученного в приготовлении IV, в 10 мл трифторуксусной кислоты и 10 мл безводного дихлорметана. Реакционную смесь перемешивают 24 ч при комнатной температуре, потом выпаривают растворитель при пониженном давлении. Полученный остаток поглощают 150 мл дистиллированной воды и лиофилизуют. Остаток очищают ЖХСД (жидкостной хроматографией при среднем давлении) на обратимой фазе (оксид кремния RP 18) элюируя смесью вода (ацетонитрил) трифторуксусная кислота 7:2:1 (объем/объем/объем). Получают 0,43 г (выход 66%) очень гигроскопичного твердого продукта.
1H-ЯМР (диметилсульфоксид-d6): 1,2-1,6 (м, 12Н), 1,9 (м, 2Н), 2,9-3,1 (м, 14Н), 7,2 (с шир 4Н), 7,7 (т, 1Н), 8 (м, 5Н), 8,7 (с шир. 2Н).
13H-ЯМР (диметилсульфоксид-d6): 22,5, 23,4, 25,4, 25,6, 25,7, 28,0, 28,5, 35,8, 37,6, 38,2, 40,3, 43,0, 43,5, 46,1, 156,6, 166,9(2C).
Приготовление V
3-(((1,1-Диметилэтокси)карбонил)амино)-14-оксо-2,4,13- -триазагексадек-2-ендиовая кислота, 1-(1,1-диметилэтил)-16-этиловый эфир
Работают по методике приготовления IV и исходя из 1,32 г (10•10-3 моль) этилмалоаната и 2 г (5,18•10-3 моль) (((8-аминооктил)имино)метилен)-бис-карбаминовой кислоты, бис-(1,1-диметилэтилового) эфира, получают 1,96 г (выход 75%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,25-1,70 (м, 33Н), 3,25 (к, 2Н), 3,30 (с, 2Н), 3,40 (к, 2Н), 4,2 (к, 2Н), 7,25 (с, 1Н), 8,3 (с, 1Н), 11,5 (с, 1Н).
Приготовление VI
3-(((1,1-Диметилэтокси)карбонил)амино)-14-оксо-2,4,13-триазагексадек-2-ендиовая кислота, 1-(1,1- диметилэтиловый) эфир
Работают по методике приготовления III и исходя из 1,96 г (3,92•10-3 моль) продукта, полученного в приготовлении V, получают 1,92 г (выход: 100%) целевого продукта в виде масла
1H-ЯМР: (CDCl3): 1,25-1,70 (м, 3OH), 3,27-3,39 (м, 6Н), 7,25 (с, 1Н), 8,40 (с, 1Н).
Приготовление VII
3-(((1,1-Диметилэтокси)карбонил)амино-22-((1,1-диметилэтокси) карбонил)-14,16-диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый)эфир
Работают по методике приготовления IV и исходя из 1,85 г (3,92•10-3 моль) продукта, полученного в приготовлении VI, и 1,35 г (3,92•10-3 моль) 10-амино-6-((1,1-диметилэтокси) карбонил)-2,6-диазадекановой кислоты, 1, 1-(диметилэтилового) эфира, получают 0,41 г (выход 13%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,30-1,70 (м, 54H), 3,1-3,5 (м, 14H), 4,8 и 5,3 (с шир., 1H), 6,7 и 7,1 (с шир., 2H), 8,3 (т, 1H), 11,5 (с, 1H).
Пример 2
N-(4-((3-амино)пропил)амино)бутил)-N'-(8-((аминоиминометил) амино)октил)-пропандиамид, трис-(трифторацетат).
Работают по методике примера 1 и исходя из 0,41 г (0,51•10-3 моль) продукта, полученного в приготовлении VII, получают 0,24 г (выход 65%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид)-d6): 1,2-1,6 (м, 16Н), 1,9 (м, 2Н), 2,9-3,1 (м, 14Н), 7,2 (с шир., 4Н), 7,7 (т, 1Н), 8 (м, 5Н), 8,7 (с шир. 2Н).
13С-ЯМР (диметилсульфоксид)-d6): 22,9, 23,7, 26,0, 26,1, 26,3, 28,4, 28,5, 28,6, 36,2, 37,9, 38,6, 40,7, 43,3, 43,8, 46,4, 156,8, 166,7, 166,9.
Приготовление VIII
3-(((1,1-Диметилэтокси)карбонил)амино)-13-метокси-12-оксо-2,4,11- триазатетрадек-2-ендиовая кислота, 1-(1,1-диметил-этил)-14-метиловый эфир
Работают по методике приготовления IV и исходя из 1,8 г (12•10-3 моль) 2-метоксипропандиовой кислоты, метилового эфира, и 4 г (11,10-3 моль) (((6-аминогексил)имино)метилен)бис-карбаминовой кислоты, бис-(1,1-диметилэтилового)эфира, и заменив хлороформ на дихлорметан, получают 4,8 г (выход 87%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,35-1,65 (м, 26H), 3,2 (м, 2H), 3,35 (к, 2H), 3,45 (с, 3H), 3,8 (с, 3H), 4,3 (с, 1H), 6,7 (т, 1H), 8,3 (т, 1H), 11,5 (с, 1H).
Приготовление IX
3-(((1,1-Диметилэтокси)карбонил)амино)-13-метокси-12-оксо-2,4,11-триазатетрадек-2-ендиовая кислота, 1-(1,1-диметилэтиловый) эфир
Работают по методике приготовления III и исходя из 4,6 г (9,4•10-3 моль) продукта, полученного в приготовлении VIII, получают 4 г (выход 89%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,65 (м, 26H), 3,1-3,5 (м, 4H), 3,6 (с, 3H), 4,3 (с, 1H), 6,7 (т, 1H), 8,4 (т, 1H), 11,5 (с шир., 1H).
Приготовление X
3-(((1,1-Диметилэтокси)карбонил)амино)-20-((1,1-диметилэтокси) карбонил)-13-метокси-12,14-диоксо-2,4,11,15, 20, 24-гексаазапентакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир
Работают по методике приготовления IV и исходя из 3,77 г (8•10-3 моль) продукта, полученного в приготовлении IX, и 2,7 г (8•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил)-2,6-диазадекановой кислоты, 1,1-(диметилэтилового) эфира, и заменив хлороформ на дихлорметан, получают 4 г (выход 63%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,8 (м, 5OH), 3,0-3,45 (м, 12H),3,6 (с, 3H), 4,1 (м, 1H), 4,8 и 5,3 (с шир.1H), 6,9 (с шир., 2H), 8,3 (т, 1H), 11,5 (с, 1H).
Пример 3
N-(4-((3-(амино)пропил)амино)бутил)-N'-(6-((аминоиминометил)амино) гексил)-2-метоксипропандиамид, трис-(трифторацетат)
Работают по методике примера 1 и исходя из 3,47 г (4,3•10-3 моль) продукта, полученного в приготовлении X, получают 2,86 г (выход 89%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,25-1,70 (м, 12H), 1,9 (м, 2H), 2,85-3,2 (м, 12H), 3,25 (с, 3H), 4,1 (с, 1H), 6,8-8,7 (м, 12H).
13C-ЯМР (CD3OD): 24,2, 25,3, 27,36, 27,37, 29,9, 30,2, 37,9, 39,2, 40,2, 42,5, 45,7, 58,6, 158,7, 169,4, 169,8.
Приготовление XI
6-((1,1-Диметилэтокси)карбонил)-13-метокси-12-оксо-2,6,11- триазатетрадекандиовая кислота, 1-(1,1-диметилэтил)-14-метиловый эфир.
Работают по методике приготовления IV и исходя из 2,62 (17,7•10-3 моль) 2-метоксипропандиовой кислоты, метилового эфира, и 3,45 г (10,0•10-3 моль) 10-амино-6-((1,1-диметилэтокси) карбонил)-2,6-диазадекановой кислоты, 1,1-(диметилэтилового) эфира, получают 1,5 г (выход 18%) продукта, целевого в виде масла.
1H-ЯМР (CDCl3): 1,4-1,8 (м, 24H), 3,1-3,4 (м, 8H), 3,5 (с, 3H), 3,8 (с, 3H), 4,3 (с, 1H), 4,8 и 5,3 (с, шир., 1H), 5,7 (с, 1H).
Приготовление XII
6-((1,1-Диметилэтокси)карбонил)-13-метокси-12-оксо-2,6-11- триазатетрадекандиовая кислота, 1-(1,1-диметилэтиловый) эфир
Работают по методике приготовления III и исходя из 1,5 г (3,1•10-3 моль) продукта, полученного в приготовлении XI, получают 1,18 г (выход 81%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,4-1,8 (м, 24H), 3,15-3,35 (м, 8H), 3,5 (с, 3H), 4,3 (с, 1H), 5,2-5,7 (с двойной, 1H), 6,3-6,9 (с двойной, 1H).
Приготовление XIII
3-(((1,1-Диметилэтокси)карбонил)амино)-22-((1,1-диметилэтокси)-карбонил) -15-метокси-14,16-диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый эфир
Работают по методике приготовления IV и исходя из 1,18 г (2,56•10-3 моль) продукта, полученного в приготовлении XII; получают 1,4 г (выход 65%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,8 (м, 54H), 3,1-3,7 (м, 15H), 4,1 (с, 1H), 4,8 и 5,3 (с шир., 1H), 6,9 (с шир. 2H), 8,3 (т,1H), 11,5 (с, 1H).
Пример 4
N-(4-((3-(амино)пропил)амино)бутил)-2-метокси-N'-(8-((аминоиминометил) амино)октил)-пропандиамид, трис-(трифторацетат)
Работают по методике примера 1 и исходя из 1,37 г (1,65•10-3 моль) продукта, полученного в приготовлении XIII, получают 0,89 г (выход 70%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,2-1,7 (м, 16H), 1,9 (м, 2H), 2,9-3,10 (м, 12H), 3,3 (с, 3H), 4,1 (с, 1H), 6,8-8,7 (м, 12H).
13C-ЯМР (D2O): 23,8, 25,0, 26,5, 27,0, 27,3, 28,5, 29,1, (2C), 37,5, 39,8, 40,2, 42,5 45,1, 48,2, 58,4, 63,9, 82,5, 157,8, 169,8, 170,2.
Приготовление XIV
6-((1,1-Диметилэтокси)карбонил-13-окса-12-оксо-2,6,11-триазапентадекандиовая кислота, 1-(1,1-диметилэтил)-15-метиловый эфир
К раствору 4,5 г (21,4•10-3 моль) ((феноксикарбонил)окси)-уксусной кислоты, метилового эфира, в 100 мл толуола прибавляют при перемешивании 7,4 г (21,4•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил-2,6-диазадекановой кислоты, 1,1-(диметилэтилового) эфира, в растворе в 20 мл толуола. Реакционную среду кипятят с обратным холодильником в течение 15 ч. Выпаривают растворитель при пониженном давлении и полученный остаток очищают хроматографией на оксиде кремния, элюируя смесью метилциклогексан/этилацетат 7:3 (объем/объем), потом этилацетатом. Получают 8,4 г (выход 85%)целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,45-1,65 (м, 24H), 3,05-3,25 (м, 8H), 3,8 (с, 3H), 4,7 (с, 2H), 4,9 и 5,3 (с шир., 1H).
Приготовление XV
6-((1,1-Диметилэтокси)карбонил)-13-окса-12-оксо-2,6,11- триазапентадекандиовая кислота, 1-(1,1-диметилэтиловый) эфир
Работают по методике приготовления III и исходя из 8,45 г (18,3•10-3 моль) продукта, полученного в приготовлении ХIV, получают 6,7 г (выход 81%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,8 (м, 24H), 3,10-3,25 (м, 8H), 4,7 (с, 2H), 5,0 (т, 1H), 6,8 (с, 1H).
Приготовление XVI
3-(((1,1-Диметилэтокси)карбонил)амино)-21-((1,1-диметилэтокси)-карбонил)-14-окса-12,15- диоксо-2,4,11,16,21,25-гексаазагексакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир
Работают по методике приготовления IV и исходя из 3 г (6,7•10-3 моль) продукта, полученного в приготовлении XV, и 2,4 г (6,7•10-3 моль) (((6-аминогексил)имино)метилен)бис-карбаминовой кислоты, бис-(1,1-диметилэтилового) эфира, получают 3,85 г (выход 73%) целевого продукта в виде масла.
1H-ЯМР (CDCl3, D2O): 1,35-1,65 (м, 5OН), 3,10-3,30 (м, 12H), 4,55 (с, 2H), 5,2-5,5 (с шир. 1H), 6,4 (с. шир., 1H).
Приготовление XVII
3-(((1,1-Диметилэтокси)карбонил)амино)-23-((1,1-диметил-этокси)-карбонил)-16-окса-14,17-диоксо-2,4,13,18,23,27-гексаазаоктакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый)эфир
Работают по методике приготовления IV и исходя из 1,5 г (3,35•10-3 моль) продукта, полученного в приготовлении XV, и 1,3 г (3,35•10-3 моль) (((8-аминооктил)имино)метилен)-бис-карбаминовой кислоты, бис-(1,1-диметилэтилового)эфира, получают 1,56 г (выход 57%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,40-1,80 (м, 54H), 3,10-3,40 (м, 12H), 4,5 (с, 2H), 5,1-5,4 (с шир., 1H), 6,3 (с шир., 1H), 5,3 (т, 1H), 11,5 (с шир., 1H).
Пример 5
2-(((4-((3-(Амино)пропил)амино)бутил)амино)карбонилокси)-N-(6-((аминоиминометил)амино)гексил)-ацетамид, трис-(трифторацетат).
Работают по методике примера 1 и исходя из 3,85 г (4,9•10-3 моль) продукта, полученного в приготовлении XVI, получают 2,61 г (выход 72%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,25-1,55 (м, 12H), 1,9 (м, 2H), 2,80-3,10 (м, 12H), 4,35 (с, 2H), 5,5-8,6 (м, 12H).
13С-ЯМР (D2O): 23,6, 24,5, 26,2, 26,3, 26,7, 28,6, 29,0, 37,3, 39,8, 40,6, 41,9, 45,2, 48,2, 63,7, 157,5, 159,2, 174,4.
Пример 6
2-(((4-((3-(Амино)пропил)амино)бутил)амино)карбонилокси-N-(8-((аминоиминометил)амино)октил)-ацетамид, трис-(трифторацетат)
Работают по методике примера 1 и исходя из 1,56 г (1,9•10-3 моль), продукта, полученного в приготовлении XVII, получают 0,96 г (выход 66%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,2-1,6 (м, 16H), 1,9 (м, 2H), 2,8-3,2 (м, 12H), 4,35 (с, 2H), 6,8-8,6 (м, 12H).
13C-ЯМР (D2O): 23,6, 24,5, 26,5, 26,6, 26,7, 28,6, 28,9, (2С), 29,0, 37,9, 40,0, 40,6, 41,9, 45,2, 48,2, 64,7, 158,0, 159,0, 172,1.
Приготовление XVIII
3-(((1,1-Диметилэтокси)карбонил)амино)-13-фенилметокси-12-оксо-2,4, 11-триазатетрадек-2-ендиовая кислота, 1-(1,1-диметилэтил)-14-этиловый эфир
Работают по методике приготовления IV и исходя из 1,3 г (5,46•10-3 моль) 2-фенилметоксипропандиовой кислоты, этилового эфира, и 1,95 г (5,46•10-3 моль (((6-аминогексил)имино)-метилен)-бис-карбаминовой кислоты, бис-(1,1-диметилэтилового) эфира, получают 1,57 г (выход 50%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,2-1,8 (м, 29H), 3,25 (к, 2H), 3,4 (к, 2H), 4,2 (к, 2H), 4,4 (с, 1H), 4,5-4,8 (двойной д, 2H), 6,7 (с, 1H), 7,3 (с, 5H), 8,3 (т, 1H), 11,5 (с, 1H).
Приготовление XIX
3-(((1,1-Диметилэтокси)карбонил)амино-13-фенилметокси-12-оксо-2,4, 11-триазатетрадек-2-ендиовая кислота, 1-(1,1-диметилэтиловый) эфир
Работают по методике приготовления III и исходя из 1,57 г (2,7•10-3 моль) продукта, полученного в приготовлении XVIII, получают 1,4 г (выход 94%) целевого продукта в виде желтоватого масла.
1H-ЯМР (CDCl3): 1,2-1,8 (м, 26H), 3,2-3,5 (м, 4H), 4,4 (с, 1H), 4,6-5,0 (двойной д, 2H), 6,8 (с, 1H), 7,3 (с, 5H), 8,3 (т, 1H).
Приготовление XX
3-(((1,1-Диметилэтокси)карбонил)амино-20-((1,1-диметил-этокси) карбонил)-12,14-диоксо-13-фенилметокси-2,4,11,15,20, 24-гексаазапентакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый)эфир
Работают по методике приготовления IV и исходя из 1,4 г (2,54•10-3 моль) продукта, полученного в приготовлении XIX, и из 0,88 г (2,54•10-3 моль) 10-амино-6-((1,1-диметилэтокси)- карбонил)-2,6-диазадекановой кислоты, 1,1-(диметилэтилового) эфира, получают 2,1 г (выход 94%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,8 (м, 5OН), 3,1-3,5 (м, 12H), 4,3 (с, 1H), 4,8 (с, 2H), 6,8-7,0 (м, 2H), 7,3 (с, 5H), 8,3 (т, 1H), 11,5 (с, 1H).
Приготовление XXI
3-(((1,1-Диметилэтокси)карбонил)амино)-20-((1,1-диметил-этокси) карбонил)-13-окси-12,14-диоксо-2,4,11,15,20, 24-гексаазапентакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир
К раствору 1,27 г (1,45•10-3 моль) продукта, полученного в приготовлении XX, в 120 мл этанола, прибавляют 0,1 г 10%-ного палладия на угле. Перемешивают при комнатной температуре и в атмосфере водорода при атмосферном давлении в течение 2 ч. Затем отфильтровывают катализатор и выпаривают органическую фазу. Таким образом получают 1 г (выход 88%) маслянистого остатка, который используют без дополнительной очистки для получения продукта примера 7.
1H-ЯМР (CDCl3): 1,2-1,8 (м, 50Н), 3,1-2,6 (м, 12H), 4,3 (с, 1H), 4,6-5,3 (с шир., 3H), 8,3 (с, 1H), 11,5 (с, 1H).
Пример 7
N-(4-((3-(амино)пропил)амино)бутил)-2-окси-N'-(6-((амино-иминометил) амино)гексил)-пропандиамин, трис-(трифторацетат).
Работают по методике примера 1 и исходя из 1 г (1,27•10-3 моль) продукта, полученного в приготовлении XXI, получают 0,6 г (выход 65%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,2-1,6 (м, 12H), 1,85 (м, 2H), 2,7-3,2 (м, 12H), 4,3 (с, 1H), 6,8-8,6 (м, 12H).
13C-ЯМР (D2O): 23,5, 24,4, 26,0, 26,2, 28,4, 28,8, 37,2, 39,1, 39,9, 41,7, 45,1, 48,0, 73,0, 154,8, 171,1, 171,4.
Приготовление XXII
3-(((1,1-Диметилэтокси)карбонил)амино)-12-оксо-2,4,11,14- -тетраазапентадек-2- ендиовая кислота, 1-(1,1-диметилэтил)-15-фенилметиловый эфир.
К раствору, охлажденному до -30oC, 3 г (14•10-3 моль) карбобензилоксиглицина и 2,8 г (28•10-3 моль) N-метилморфолина в 50 мл тетрагидрофурана прибавляют по каплям 1,6 г (14•10-3 моль) изобутилхлорформиата в растворе в 5 мл тетрагидрофурана. Реакционную смесь перемешивают 0,5 ч и прибавляют 5,4 г (14•10-3 моль) (((6-аминогексил)имино)метилен)-бис-карбаминовой кислоты, бис-(1,1-диметилэтилового) эфира в растворе в 20 мл тетрагидрофурана. Перемешивают еще 2 ч при -30oC, потом 24 ч при комнатной температуре. После фильтрации реакционной смеси и выпаривания фильтрата при пониженном давлении полученный остаток очищают хроматографией на оксиде кремния, элюируя смесью этилацетата/метилциклогексана 1:1 (объем/объем). Таким образом получают 7,16 г (выход 91%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 26H), 3,2 (к, 2H), 3,4 (к, 2H), 3,8 (д, 2H), 5,15 (с, 2H), 5,5 (с шир., 1H), 6,0 (с шир., 1H), 7,3 (с. 5H).
Приготовление XXIII
13-амино-3-(((1,1-диметилэтокси)карбонил)амино-12-оксо-2,4-11- триазатридек-2-еновая кислота, 1,1-диметилэтиловый эфир.
Работают по методике приготовления XXI и исходя из 7,1 г (13•10-3 моль) продукта, полученного в приготовлении XXII, получают 5,3 г (выход 98%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,6 (м, 28H), 3,25-3,45 (м, 6H), 7,3 (с, 1H), 8,3 (т, 1H), 11,5 (с, 1H).
Приготовление XXIV
3-(((1,1-Диметилэтокси)карбонил)амино-21-((1,1-диметил-этокси)- -карбонил)-12,15-диоксо-2,4,11,14,16,21,25-гектаазагексакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир.
К раствору 5,3 г (12•10-3 моль) продукта, полученного в приготовлении XXIII, в 50 мл безводного тетрагидрофурана прибавляют 4,3 г (13•10-3 моль) бис-(4-нитрофенил) карбоната маленькими порциями. Реакционную смесь перемешивают 1 ч при комнатной температуре и прибавляют по каплям 4,5 г (13•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил)-2,6-диазадекановой кислоты, 1,1(диметилэтилового) эфира в растворе в 50 мл безводного тетрагидрофурана. Снова перемешивают 24 ч при комнатной температуре и выпаривают растворитель при пониженном давлении. Полученный остаток очищают хроматографией на оксиде кремния, элюируя этилацетатом. Таким образом получают 6,01 г (выход 64%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 50Н), 3,1-3,35 (м, 12H), 3,8 (д, 2H), 4,8 и 5,8 (с шир., 3H), 6,9 (т, 1H), 8,3 (т, 1H), 11,5 (с, 1H).
Пример 8
N-(4-((3-(амино)пропил)амино)бутил-N'-((((6-((аминоиминометил) амино)гексил)амино)карбонил)метил)мочевина, трис-(трифторацетат)
Работают по методике примера 1 и исходя из 6 г (7,6•10-3 моль) продукта, полученного в приготовлении XXIV, получают 4,75 г (выход 86%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,2-1,65 (м, 12H), 1,9 (м, 2H), 2,9-3,15 (м, 12H), 3,6 (д, 2H), 6,1 (т, 1H), 6,3 (т, 1H), 6,8-9,0 (м, 11H).
13C-ЯМР (диметилсульфоксид-d6): 22,8, 23,7, 25,6, 25,8, 27,0, 28,3, 28,9, 36,1, 40,5, 38,3, 38,5, 42,7, 43,7, 46,5, 156,7, 157,9, 169,6.
Приготовление XXV
3-(((1,1- Диметилэтокси)карбонил)амино)-14-оксо-2, 4, 13, 16-тетраазагептадек-2-ендиовая кислота, 1-(1,1-диметилэтил)-17-фенилметиловый эфир
Работают по методике приготовления IV и исходя из 1,35 г (6,47•10-3 моль) карбобензилоксиглицина и 2 г (5,18•10-3 моль) (((8-аминооктил)имино)метилен)бис-карбаминовой кислоты, бис(1,1-диметилэтилового) эфира, получают 2,33 г (выход 74%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,25-1,70 (м, 3ОН), 3,25 (к, 2H), 3,4 (к, 2H), 3,8 (д, 2H), 5,15 (с, 2H), 5,5 (с шир., 1H), 6,0 (с шир., 1H), 7,3 (с, 5H), 8,3 (т, 1H), 11,5 (с, 1H).
Приготовление XXVI
15-Амино-3-(((1,1-диметилэтокси)карбонил)амино)-14-оксо-2,4,13-триазапентадек-2-еновая кислота, 1,1-диметилэтиловый эфир
Работают по методике приготовления XXI и исходя из 2,33 г (4,04•10-3 моль) продукта, полученного в приготовлении XXV: получают 2,16 г (выход 100%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,8 (м, 32H), 3,25-3,45 (м, 6H), 7,3 (с, 1H), 8,3 (т, 1H), 11,5 (с, 1H).
Приготовление XXVII
3- (((1, 1-Диметилэтокси)карбонил)амино)-23-((1,1-диметилэтокси) карбонил)-14,17-диоксо-2,4,13,16,18,23,27-гептаазаоктакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир.
Работают по методике приготовления XXIV и исходя из 1,79 г (4,04•10-3 моль) продукта, полученного в приготовлении XXVI, получают 1,5 г (выход 45%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 54H), 3,1-3,4 (м, 12H), 3,8 (д, 2H), 4,8, 5,2 и 5,7 (с шир., 2H), 6,0 и 6,7 (с шир., 1H), 8,3 (т, 1H), 11,5 (с. 1H).
Пример 9
N-(4-((3-(амино)пропил)амино)бутил)-N'-((((8-((аминоиминометил)амино) октил)амино)карбонил)метил)-мочевина, трис-(трифторацетат)
Работают по методике примера 1 и исходя из 1,5 г (1,84•10-3 моль) продукта, полученного в приготовлении XXVII, получают 1,14 г (выход 82%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,25-1,55 (м, 16H), 1,9 (м, 2H), 2,9-3,10 (м, 12H), 3,6 (с, 2H), 6,0-6,3 (с шир., 2H), 6,8-8,6 (м, 11H).
13C-ЯМР (диметилсульфоксид-d6): 22,9, 23,8, 26,0, 26,3, 27,1, 28,4, 28,5, 28,6, 29,1, 36,2, 38,4, 38,7, 40,7, 42,7, 43,8, 46,6, 156,7, 158,0, 169,6.
Приготовление XXVIII
3-(((1,1-Диметилэтокси)карбонил)амино)-12-оксо-2,4,11-триазатридек-2- ендиовая кислота, 1-(1,1-диметилэтиловый) эфир
К раствору 1,6 г (4,5•10-3 моль) (((6-аминогексил)имино)-метилен)бис-карбаминовой кислоты, бис-(1,1-диметилэтилового) эфира, и 0,6 г (6•10-3 моль) триэтиламина в 10 мл безводного дихлорметана, прибавляют по каплям 0,67 г (5•10-3 моль) хлорангидрида этилоксалата в растворе в 5 мл дихлорметана. Перемешивают 1 ч при комнатной температуре, потом выпаривают растворитель при пониженном давлении, полученный остаток хроматографируют на оксиде кремния, элюируя смесью гексан/этилацетат 2:1 (объем/объем). Таким образом получают 1,68 г (выход 82%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 29H), 3,3-3,4 (м, 4H), 4,4 (к, 2H), 7,1 (т, 1H), 8,3 (т, 1H), 11,5 (с, 1H).
Приготовление XXIX
3-(((1,1-Диметилэтокси)карбонил)амино)-12-оксо-2,4,11-триазатридек -2-ендиовая кислота, 1-(1,1-диметилэтиловый) эфир
Работают по методике приготовления III и исходя из 1,67 г (3,7•10-3 моль) продукта, полученного в приготовлении XXVIII, получают 1,2 г (выход 75%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,25-1,7 (м, 26H), 3,3-3,5 (м, 4H), 7,4 (т, 1H), 8,5 (т, 1H), 11,5 (с шир., 1H).
Приготовление XXX
3-(((1,1-Диметилэтокси)карбонил)амино)-19-((1,1-диметилэтокси) карбонил)-12,13-диоксо-2, 4,11,14,19,23-гексаазатетракоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир.
Работают по методике приготовления XXII и исходя из 1,4 г (3,5•10-3 моль) продукта, полученного в приготовлении XXIX и 1,05 г (3•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил) 2,6-диазадекановой кислоты, 1,1-(диметилэтилового) эфира, получают 1,2 г (выход 63%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 50Н), 3,1-3,4 (м, 12H), 4,8 и 5,3 (с шир., 1H), 7,5 (м, 2H), 8,3 (т, 1H), 11,5 (с. 1H).
Пример 10
N-(4-(3-(амино)пропил)амино)бутил)-N'-(6-((аминоиминометил) амино)гексил)-этандиамид, трис-(трифторацетат).
Работают по методике примера 1 и исходя из 1,2 г (1,6•10-3 моль) продукта, полученного в приготовлении XXX, получают 1,05 г (выход 95%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,3-1,65 (м, 12H), 1,9 (м, 2H), 2,8-3,3 (м, 12H), 6,8-9,9 (м, 12H).
13C-ЯМР (диметипсульфоксид-d6): D2O: 23,9, 24,7, 26,3, 26,4, 26,5, 28,7, 29,0, 37,5, 39,7, 40,4, 42,0, 45,4, 48,1, 157,7, 161,8, 162,1.
Приготовление XXXI
6-((1,1-Диметилэтокси)карбонил)-12-оксо-2,6,11-триазатридекандиовая кислота, 1-(1,1-диметилэтил)-13-этиловый эфир.
Работают по методике приготовления XXVIII и исходя из 2 г (5,8•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил)- 2,6-диазадекановой кислоты, 1,1-(диметилэтилового) эфира и 0,3 г (7,54•10-3 моль) хлорангидрида этилоксалата, получают 2,31 г (выход 89%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,25-1,65 (м, 27H), 3,1-3,35 (м, 8H), 4,35 (к, 2H), 4,75 и 5,25 (с шир., 1H), 7,2 (с, 1H).
Приготовление XXXII
6-((1,1-Диметилэтокси)карбонил)-12-оксо-2,6,11-триазатридекандиовая кислота, 1-(1,1-диметилэтиловый) эфир
Работают по методике приготовления III и исходя из 2,31 г (5,19•10-3 моль) продукта, полученного в приготовлении XXXI, получают 2,16 г (выход 100%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,25-1,70 (м, 24H), 3,1-3,4 (м, 8H), 4,8-5,25 (двойной с, 1H), 7,5 (с шир., 1H).
Приготовление XXXIII
3-(((1,1-Диметилэтокси)карбонил)амино)-21-((1,1-диметилэтокси) карбонил)-14,25-диоксо-2,4,13,16,21,25-гексаазагесакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир.
Работают по методике приготовления IV и исходя из 1 г (2,4•10-3 моль) продукта, полученного в приготовлении XXXII, и 0,92 г (2,4•10-3 моль) (((8-аминооктил)имино)метилен)бискарбаминовой кислоты, бис-(1,1-диметилэтилового) эфира, получают 0,9 г (выход 48%) целевого продукта в виде масла.
1H-ЯМР (CDCl3): 1,3 (т, 3H), 1,4-1,7 (м, 24H), 3,0-3,4 (м, 8H), 4,25 (к, 2H), 4,4 (с, 1H), 4,5-4,7 (2д, 2H), 5,0 (с, 1H), 6,7 (с, 1H), 7,3 (м, 5H).
Пример 11
N-(4-((3-(амино)пропил)амино)бутил)-N'-(8-((аминоиминометил)амино) октил)-этандиамид, трис-(трифторацетат)
Работают по методике примера 1 и исходя из 0,9 г (1,15•10-3 моль) продукта, полученного в приготовлении XXXIII, получают 0,15 г (выход 18%) целевого продукта в виде масла.
1H-ЯМР (диметилсульфоксид-d6): 1,25-1,50 (м, 16Н), 1,9 (м, 2H), 2,9-3,15 (м, 12H), 6,9-8,8 (м, 12H).
13C-ЯМР (D2O): 23,8, 24,5, 26,1, 26,5, 26,7, 28,6, 28,92, 28,95, 29,0, 37,3, 39,5, 40,4, 42,0, 45,2, 48,1.
Приготовление XXXIV
6-((1,1-Диметилэтокси)карбонил)-12-оксо-13-фенилметокси-2,6, 11-триазатетрадекандиовая кислота, 1-(1,1-диметилэтиловый) 14-этиловый эфир
Работают по методике приготовления IV и исходя из 3 г (12,6•10-3 моль) 2-(фенилметокси)пропандиовой кислоты, этилового эфира, и 4,4 г (12,6•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил)-2,6-диазадекандиовой кислоты, 1,1-диметил-этилового эфира, получают после очистки хроматографией на оксиде кремния (элюент: метилциклогексан 8/этилацетата 2), целевой продукт с выходом 35%.
1H-ЯМР (CDCl3): 1,3 (т, 3H), 1,4-1,7 (м, 24H), 3,0-3,4 (м, 8H), 4,25 (к, 2H), 4,4 (с, 1H), 4,5-4,7 (2д, 2H), 5,0 (с, 1H), 6,7 (с, 1H), 7,3 (м, 5H).
Приготовление XXXV
6-((1,1-Диметилэтокси)карбонил)-12-оксо-13-фенилметокси-2, 6-11-триазатетрадекандиовая кислота, 1-(1,1-диметилэтиловый) эфир
Растворяют 2,46 г (4,3•10-3 моль) продукта, полученного в приготовлении XXXIV, в смеси этанол/вода 1: 1 по объему и прибавляют 258 мг гидроксида натрия. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, потом прибавляют 10 мл воды и 20 мл хлороформа, подкисляют до pH 2 1H соляной кислотой. Экстрагируют хлороформом и после сушки над сульфатом магния органическую фазу концентрируют при пониженном давлении. Таким образом получают целевой продукт с выходом 76%.
1H-ЯМР (CDCl3): 1,4-1,7 (м, 24H), 3,0-3,3 (м, 8H), 4,4-4,5 (м, 1H), 4,7-5,1 (2д, 2H), 5,0 (с, 1H), 6,65 (с, 1H), 7,4 (м, 5H).
Приготовление XXXVI
3-(((1,1-Диметилэтокси)карбонил)амино-22-((1,1-диметилэтокси) карбонил)-14,16-диоксо-15-фенилметокси-2,4,13,17,22,26-гексаазагептакоз-2- ендиовая кислота, бис-(1,1-диметилэтиловый) эфир
Работают по методике приготовления IV и исходя из 1,67 г (3,11•10-3 моль) продукта приготовления XXXV и 1,20 г (3,11•10-3 моль) (((8-аминооктил)имино)метилен)бис-карбаминовой кислоты, бис-(1,1-диметилэтилового) эфира, получают после очистки хроматографией на оксиде кремния (элюант: метипциклогексан 7/этилацетат 3) целевой продукт с выходом 59% в виде масла.
1H-ЯМР (CDCl3), 1,2-1,8 (м, 54H), 3,0-3,5 (м, 12H), 4,3 (с, 1H), 4,8 (м, 2H), 5,1 (с, 1H), 6,9-7,1 (м, 2H), 7,4 (м, 5H), 8,3 (т, 1H), 115 (с, 1H).
Приготовление XXXVII
3-(((1,1-Диметилэтокси)карбонил)амино)-22-((1,1-диметилэтокси) карбонил)-14,16-диоксо-15-окси-2,4,13,17,22,26-гекса-азагептакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир
Работают по методике приготовления XXI и исходя из 1,64 г продукта, полученного в приготовлении XXXVI, получают целевой продукт с выходом 55%.
1H-ЯМР (CDCl3): 1,3-1,7 (м, 54H), 3,0-3,4 (м, 12H), 4,4 (с, 1H), 5,0 (с, 1H), 7,2 (с, 1H), 7,35 (с, 1H), 8,3 (т, 1H), 11,5 (с, 1H).
Пример 12
N-(4-((3-амино)пропил)амино)бутил)-2-окси-N'-(8-((аминоиминометил) амино)октил)-пропандиамид, трис-(трифторацетат)
Работают по методике примера 1, исходя из 0,81 г продукта, полученного в приготовлении XXXVII, получают после очистки хроматографией ЖХСД на привитом оксиде кремния RP18 (элюент: вода 7,5/ацетонитрил 1,5/трифторуксусная кислота 1), целевой продукт с выходом 67% в виде масла.
1H-ЯМР (DMCO-d6): 1,1-1,7 (м, 16H), 1,9 (м, 2H), 2,8-3,2 (м, 12H), 4,3 (с, 1H), 6,9-8,7 (м, 12H).
13C-ЯМР (DMCO-d6): 14,8, 20,9, 22,2, 23,1, 25,3, 25,9, 25,5, 28,7, 28,9, 36,8, 38,1, 43,8, 46,2, 60,1, 71,8, 157,3, 166,2, 166,5.
Приготовление XXXVIII
6-((1,1-Диметилэтокси)карбонил)-13-фтор-12-оксо-2,6,11- триазатетрадекандиовая кислота, 1-(1,1-диметилэтиловый) эфир
Готовят раствор 1,7 г (11•10-3 моль) 2-фторпропандиовой кислоты, этилового эфира, и 2,22 г (22•10-3 моль) N-метилморфолина в 50 мл безводного тетрагидрофурана (ТГФ) и 5 мл безводного диметилформамида. Потом смесь охлаждают до -20oC и прибавляют 1,6 мл (12•10-3 моль) изобутилхлорформиата в растворе в 5 мл ТГФ. Перемешивают 30 мин при -20oC, потом прибавляют 3,9 г (11•10-3 моль) 10-амино-6-((1,1-диметилэтокси)карбонил) -2,6-диазадекановой кислоты, 1,1-диметилэтилового эфира, в растворе в 30 мл ТГФ. Продолжают перемешивать 2 ч при -20oC, потом 12 ч при комнатной температуре. Реакционную смесь фильтруют и концентрируют фильтрат при пониженном давлении. Полученный остаток очищают хроматографией на оксиде кремния (элюент: метилциклогексан 7/этилацетат 3). Получают целевой продукт с выходом 34% в виде масла.
1H-ЯМР (CDCl3): 1,34 (т, 3H), 1,4-1,7 (м, 24H), 3,0-3,4 (м, 8H), 4,3 (м, 2H), 5,0 (с, 1H), 5,25 (д, 1H), 6,55 (с, 1H).
Приготовление XXXIX
6-((1,1-Диметилэтокси)карбонил)-13-фтор-12-оксо-2,6,11- триазатетрадекандиовая кислота, 1-(1,1-диметилэтиловый)эфир
Готовят раствор 1,8 г (3,8•10-3 моль) продукта, полученного в приготовлении XXXVIII, в 6 мл 1H водного гидроксида натрия и 20 мл диметоксиэтана. После часа перемешивания при комнатной температуре прибавляют 10 мл воды и 20 мл дихлорметана, подкисляют до pH 2 1H соляной кислотой. Экстрагируют два раза 20 мл дихлорметана, органическую фазу сушат над сульфатом магния и концентрируют при пониженном давлении. Таким образом получают 1,55 г целевого продукта в виде масла (выход 91%).
1H-ЯМР (CDCl3): 1,4-1,7 (м, 24H), 3,0-3,35 (м, 8H), 5,0 (д, 1H), 5,3 (д, 1H), 6,5 (с, 1H).
Приготовление XL
3-(((1,1-Диметилэтокси)карбонил)амино)-20-((1,1-диметилэтокси)карбонил) -12,14-диоксо-13-фтор-2,4,11,15 20,24-гексаазапентакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир
К раствору 1 г (2,2•10-3 моль) продукта, полученного в приготовлении XXXIX, и 4,5 г (4,4•10-3 моль) N-метилморфолина в 30 мл безводного ТГФ, охлажденному до -20oC, прибавляют по каплям 0,29 мл (2,2•10-3 моль) изобутилхлорформиата, растворенного в 5 мл ТГФ. Перемешивают 30 мин при -20oC, потом прибавляют 0,876 г (2,2•10-3 моль) (((6-аминогексил)имино)-метилен)бис-карбаминовой кислоты, бис-(1,1-диметилэтилового эфира и 0,34 мл (2,2•10-3 моль) триэтиламина, растворенного в 5 мл ТГФ. Поддерживают температуру при -20oC в течение 2 ч, потом поднимают температуру до комнатной и продолжают перемешивать в течение 12 ч. Реакционную смесь фильтруют, потом концентрируют при пониженном давлении. Остаток затем очищают хроматографией на оксиде кремния (элюент:этилацетат 7/циклогексан 3) и получают 1,43 г целевого продукта в виде масла (выход 81%).
1H-ЯМР (CDCl3): 1,3-1,7 (м, 50Н), 3,0-3,45 (м, 12H), 5,0 (с, 1H), 5,2 (д, 1H), 6,8-7,1 (м, 2H), 8,3 (т, 1H), 11,5 (с, 1H).
Пример 13
N-(4-((3-(амино)пропил)амино)бутил)-N'-(6-((аминоиминометил) амино)гексил)-2-фторпропандиамид, трис-(трифторацетат)
Работают по методике примера 1 и исходя из 0,4 г (0,5•10-3моль) продукта, полученного в приготовлении XL, получают после очистки хроматографией ЖХСД на привитом оксиде кремния RP18 (элюент: вода 7,5/ацетонитрил 2/трифторуксусная кислота 0,5) 263 мг целевого продукта в виде масла (выход 71%).
1H-ЯМР (DMCO-d6): 1,25-1,55 (м, 12H), 1,9 (м, 2H), 2,7-3,15 (м, 12H), 5,2 (д, 1H), 6,9-8,7 (м, 12H).
13C-ЯМР (D2O/диоксан-d8): 23,65, 24,53, 26,17, 26,25, 28,55, 28,79, 37,34, 39,32, 40,08, 41,86, 45,22, 48,09, 87,00, 89,66, 157,0, 166,2, 166,7.
Приготовление XLI
3-(((1,1-Диметилэтокси)карбонил)амино)-22-(1,1-диметилэтокси)карбонил) -15-фтор-14,16-диоксо-2,4,13,17,22,26- гексаазагептакоз-2-ендиовая кислота, бис-(1,1-диметилэтиловый) эфир
Работают по методике приготовления XXII и исходя из 0,460 г (1,02•10-3 моль) продукта, полученного в приготовлении XXXIX, и 0,395 г (1,02•10-3 моль) (((8-аминооктил)имино)-метилен)бис-карбаминовой кислоты, бис- (1, 1-диметилэтилового) эфира, получают после очистки хроматографией на оксиде кремния (элюент: этилацетат 6/циклогексан 4) 0,513 г целевого продукта в виде масла (выход 61%).
1H-ЯМР (CDCl3): 1,2-1,7 (м, 54H); 3,0-3,4 (м, 12Н); 5,0 (с, 1Н); 5,2 (д, 1H); 6,8-7,1 (м, 2H); 8,3 (т, 1H); 11,5 (с, 1H).
Пример 14
N-(4-((3-амино)пропил)амино)бутил)-2-фтор-N'-(8-((аминоиминометил)амино) октил)-пропандиамид, трис-(трифторацетат)
Работают по методике приготовления XXII и исходя из 0,460 г (1,02•10-3 моль) продукта, полученного в приготовлении XLI, получают после очистки хроматографией ЖХСД на привитом оксиде кремния RP18, целевой продукт в виде масла.
1H-ЯМР (DMCO-d6): 1,25-1,50 (м, 1H), 1,84 (м, 2H), 2,7- 3,15 (м, 12H), 5,20 (д, 1H), 6,9-8,7 (м, 12H).
13C-ЯМР (D2O/диоксан-d8): 23,66, 24,55, 26,18, 26,28, 26,57, 27,48, 28,86, 37,35, 39,31, 40,21, 40,33, 45,23, 48,10, 87,26-89,86, 157,0, 166,2, 166,7.
Пример 15
N-(4-((3-амино)пропил)амино)бутил)-N'-(6-((аминоиминометил) амино)гексил)-пропандиамид, три-хлоргидрат
Способ A:
Растворяют 1 г (1,4•10-3 моль) продукта, полученного в примере 1, в смеси 7 мл 10 М соляной кислоты и 50 мл дистиллированной воды, потом лиофилизуют полученный раствор. Эту операцию повторяют два раза. Остаток лиофилизации обрабатывают смесью 9 мл этанола и 1 мл метанола. Кристаллы, полученные после 24 ч при комнатной температуре, отфильтровывают, промывают изопропиловым эфиром и сушат в вакууме. Таким образом получают целевой продукт с выходом 68% в виде белых кристаллов. Т.пл. 130oC.
Способ Б:
Растворяют 2,5 г (3,28•10-3 моль) продукта, полученного в приготовлении IV, в 25 мл метанола, насыщенного хлористым водородом. После ночи перемешивания при комнатной температуре раствор концентрируют при пониженном давлении, остаток переводят в раствор в 10 мл воды, потом лиофилизируют. Полученное таким образом соединение перекристаллизовывают из смеси этанол/метанол (9:1). Таким образом получают кристаллический продукт с выходом 52%.
Пример. 16
2-(((4-((3-Амино)пропил)амино)бутил)амино)карбонилокси)-N-(6- ((аминоиминометил)амино)гексил)-ацетамид, трис-хлоргидрат.
Работают по методике примера 15 (способ Б) исходя из продукта, полученного в приготовлении XVI, получают целевой продукт в виде кристаллов с выходом 58%. Т.пл. 148oC.
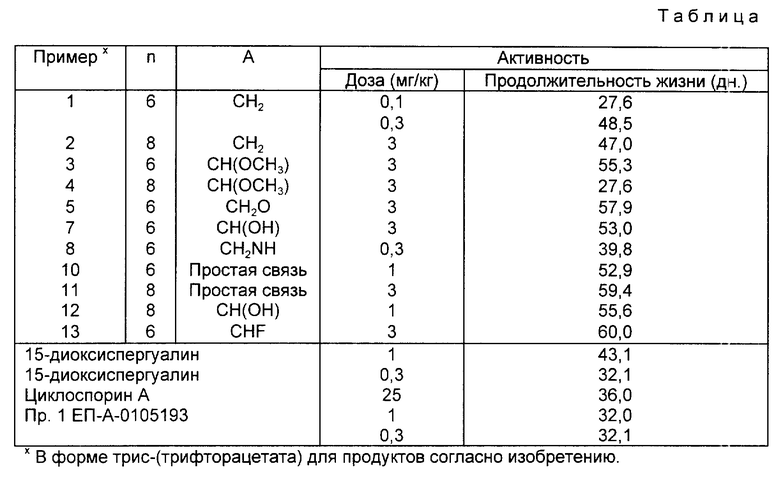
Иммунодепрессивная активность продуктов согласно изобретению была доказана с помощью теста реакции трансплантата против хозяина. Самцы мышей B6D2F1 (гибриды первого поколения C57B1/6 x DBA/2) были иммунодепрессированы интраперитональной инъекцией (и.п.) циклофосфамида. Три дня спустя (день 0 эксперимента: D0) они получили внутривенно 4•107 спленоцитов мыши C57B1/6. Животных затем разделили на группы минимум по 8 животных и подвергли ежедневной обработке с D1 до D5 и с D7 по D10 интраперитонеальным путем. Контрольная группа получала только носитель. Смертность отслеживали до D60. Результаты, выраженные как средняя величина выживших за это время при указанной дозе, приведены в таблице, где приведенные величины являются показательными согласно тесту Логранка (низкие значения вероятности являются показательными согласно тесту Логранка (вероятность ниже или равна 5%). Для сравнения в таблице также указаны величины, полученные с известными на данном уровне техники продуктами: 15-деоксиспергуалин (DSG), циклоспорин A, который в настоящее время является стандартным иммунодепрессантом, применяемым в терапии, и с продуктом примера 1, описанным в EP-A-O 105 193. Из этого сравнения следует, что продукты согласно изобретению являются до 250 раз более активными, чем известные продукты. А именно, продукт примера 1 согласно изобретению обладает заметной активностью, начиная с 0,1 мг/кг, тогда как продукт сравнения из примера 1 EP-A-O 105 193 обладает заметной активностью только начиная с 1 мг/кг, 15-деоксиспергуалин, начиная лишь с 0,3 мг/кг и циклоспорин A, начиная с 25 мг/кг.
Кроме того, соединения согласно изобретению обладают намного большей стабильностью в растворе, чем известные продукты, например 15-деоксиспергуалин.
Продукты согласно изобретению являются полезными терапевтическими агентами в качестве иммунодепрессантов при лечении или профилактике, например, для предотвращения отторжения органов, аллогенных или ксеногенных, васкуляризованных или нет, реакции трансплантата против хозяина после пересадки сосудов, при лечении аутоиммунных заболеваний, генетически определенных или приобретенных, хронических воспалительных заболеваний, а также при всех патологиях, где иммунное расстройство может быть причиной или фактором, ответственным за сохранение ухудшенного клинического состояния.
Продукты согласно изобретению также могут быть введены вместе с противораковым цитотоксическим лекарством, чтобы ограничить их побочные эффекты, и дополнительно вводиться с продуктами, полученными биотехнологическим путем, например, с рекомбинантным цитокином, моно- и поликлональным антителом, чтобы уменьшить возникновение у пациента антител, производимых пациентом.
Продукты согласно изобретению могут быть использованы при лечении болезней, вызываемых паразитами, в частности, малярии.
Продукты согласно изобретению могут быть введены орально, инъекциями, например, внутримышечно или внутривенно, местно, например, в виде крема для местного нанесения, глазных капель, трансдермальным путем, с помощью свечей или ингаляций.
Ниже приведены примеры на различные виды формулировок на основе соединений формулы I для введения их внутривенным путем.
Формула 1.
а) Флакон
Соединение 1, [в виде трис(хлоргидрата)] - 50 мг
Глюкоза - 150 мг
б) Ампула
Дистиллированная вода - 5 мл
Вводят сначала с помощью шприца воду из ампулы во флакон, затем взбалтывают. Полученный раствор вводят в перфузионную жидкость. Ежедневная доза вливаемого активного ингредиента составляет 1-2 мг/кг. Можно использовать две или четыре пары флакон/ампула на одно вливание.
Формула 2
а) Флакон
Соединение 1, в виде трис(хлоргидрата) - 40 мг
б) Ампула
Дистиллированная вода, содержащая NaCl (50 г/л) - 5 мл
Применяют так, как указано выше для инъекцией.
Формула 3
а) Флакон
Соединение 1, в виде трис(хлоргидрата) - 30 мг
б) Ампула
Дистиллированная вода, содержащая глюкозу (40 г/л) - 5 мл
Применяют так, как указано выше для инъекций.
Настоящее соединение относится к новым промышленным продуктам, соединениям со структурой, подобной 15-дезоксиспергуалину. Эти новые структуры имеют формулу: 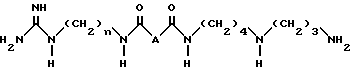 где n=6 или 8; A является простой связью, группой CH2, группой CHF, группой CH(OH), группой CH(OCH3), группой CH2NH или группой CH2O; и их соли соединения. Эти новые соединения являются полезными в качестве иммунодепрессантов. 3 с. и 7 з.п. ф-лы, 1 табл.
где n=6 или 8; A является простой связью, группой CH2, группой CHF, группой CH(OH), группой CH(OCH3), группой CH2NH или группой CH2O; и их соли соединения. Эти новые соединения являются полезными в качестве иммунодепрессантов. 3 с. и 7 з.п. ф-лы, 1 табл.
Аналоги 15-деоксиспергуалина общей формулы I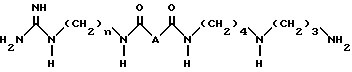
где n = 6 или 8;
A - простая связь, CH2-группа, CHF-группа, CH(OH)-группа, CH(OCH3)-группа, CH2NH-группа или CH2O-группа,
или их соли присоединения.
| EP, патент, 0105193, C 07 C 129/12, 1984. |
Авторы
Даты
1998-07-10—Публикация
1993-12-01—Подача