Изобретение относится к новым соединениям - аналогам 15-дезоксиспергуалину, к способу их получения и к применению их фармакомпозиции в качестве иммунодепрессивных агентов.
Известно, что 15-дезоксиспергуалин, первоначальные исследования которого относились к противоопухолевой активности, обладает хорошей иммунодепрессивной активностью. Эта активность констатируется в многочисленных публикациях, особенно: "Deоxyspergualin in lethal murine graft-versus-host disease", Transplantation. т. 51, 712 - 715, N. 3 (март, 1991 г.) и "15-deoxyspergualin: From Cytostasis to Immunosuppression", Behring Inst. Mitt., No. 82, 231 - 239 (1988).
Однако 15-дезоксиспергуалин не обладает химической стабильностью, поэтому пытались разработать более стабильные производные, например, заменяя α-гидроксиглициновый остаток 15-дезоксиспергуалина различными α- или ω-аминокислотами, или модифицированную цепь, несущую гуанидиновую функцию. Примеры таких модификаций изложены в европейских заявках на патент А-О 181 592 или А-О 105 193.
В настоящем изобретении предлагаются новые соединения, общая структура которых остается аналогичной 15-дезоксиспергуалину, но которые химически стабильны и обладают иммунодепрессивной активностью, выше таковой известных продуктов уровня техники.
Соединения, согласно изобретению, отличаются, в частности, от известных продуктов уровня техники инверсией амидной связи, соединяющей гуанидино-гексильный остаток с центральной цепью молекулы, природой центральной цепи и введением разветвленной цепи, содержащей хиральный центр в спермидиновой части молекулы.
Более конкретно, изобретение относится к аналогам 15-дезоксиспергуалина общей формулы I: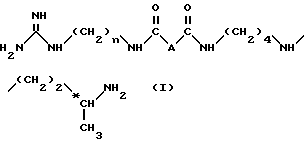 ,
,
в которой
A обозначает простую связь, группу -CH2-, группу -CH2O-, группу -CH2NH-, группу -CH(OH)-, группу -CHF- или группу -CH(OH3)-;
n равно 6 или 8 и
к их кислотно-аддитивным солям.
В формуле (I) и в других формулах, т. е. (II), (IV), (VI), (XI), (XI') и (XII), которые следуют ниже, C обозначает асимметрический атом углерода, т. е. хиральный атом углерода.
Согласно изобретению, способ получения соединений формулы (I) и их кислотно-аддетивных солей включает удаление защитных групп из соединений формулы II: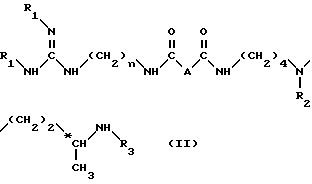 ,
,
в которой
A и n имеют вышеуказанные значения и
R1, R2 и R3, одинаковые или разные, каждый обозначает защитную группу аминной функции,
путем одной или нескольких реакций, известных специалисту, для замены всех групп R1, R2 и R3 атом водорода.
Изобретение относится также к использованию соединений формулы (I) и их нетоксичных аддитивных солей в фармацевтических композициях, предназначенных для использования в терапии против иммунных нарушений или против малярии, или в качестве фармакологического реагента.
Под аддитивными солями понимают соли присоединения кислоты, получаемые за счет взаимодействия неорганической или органической кислоты с соединением формулы (I). Предпочтительными неорганическими кислотами для солеобразования являются соляная, бромоводородная, серная и фосфорная кислоты. Предпочтительными для солеобразования органическими кислотами являются фумаровая, малеиновая, метансульфоновая, щавелевая, лимонная и трифторуксусная кислоты.
Принимая во внимание наличие асимметрического атома углерода и природу группы A, соединения формулы (I) могут содержать один или два хиральных атома углерода. Когда A означает -CH2-, -CH2O- или CH2NH-, то соединения формулы (I) могут находиться в форме рацематов, где *C имеет конфигурацию (R, S), и энантиомеров, где *С имеет конфигурация (R) или (S). Когда A обозначает -CH(OH)-, -CHF- или -CH(OCH3)-, соединения формулы (I), которые содержат два хиральных центра, могут находиться в виде эквимолекулярной смеси четырех диастереоизомеров, "полурацематов" (R,S)-A-(R)-*C, (R,S)-A-(S)-*C, (R)-A-(S, R)-*C и (S)-A-(S,R)-*C и каждого из четырех диастереомеров.
Практически предпочитают, чтобы асимметрический атом углерода *C, имел конфигурацию (S, R) или (R).
Соединение формулы (I) можно получать известными способами, основанными на классических реакциях с образованием амидной связи, а также на основе методов химии пептидов.
Способ получения, который предлагается согласно изобретению, включает удаление защитных групп из соединения формулы (II).
Практически защитные группы R1, R2, R3, которые нужно заменить на атом водорода, представляет собой группы, защищающие аминофункции, и известны в области химии пептидов для временного блокирования неполностью замещенных "аминных" функций.
Из групп, которые пригодны для этой цели, можно использовать:
(а) группы оксикарбонильного типа, например алкоксикарбонильные и бензилоксикарбонильные группы:
Boc = трет-бутилоксикарбонил (или (1,1-диметилэтокси)карбонил)
Fmoc = 9-флуоренилоксикарбонил;
Foc = фурфурилоксикарбонил;
Z - бензилоксикарбонил;
Z(p-Cl) = 4-хлорбензилоксикарбонил или
Z(p-OMe) = 4-метоксибензилоксикарбонил;
(б) группы бензильного типа, например:
Bn = фенилметил.
Из этих амино-защитных групп предпочтительными группами являются Boc и Bn.
Способ получения соединения формулы (I) или одной из его кислотно-аддитивных солей заключается в том, что он включает удаление защитных групп из соединения формулы (II):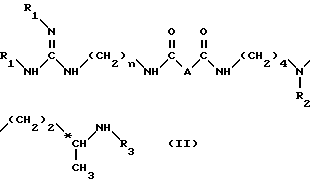 ,
,
в которой
A обозначает простую связь, группу -CH2-, группу -CHF-, группу -CH(OH3)-, группу -CH(OH)-, группу -CH(OH2C6H5), группу -CH2O- или группу -CH2NH-.
n равно 6 или 8
R1, R2, R3, идентичные или разные, представляют каждый аминозащитную группу, такую как алкилоксикарбонильная, где (алкил является низшим алкилом) или арилоксикарбонильная группа; путем одной или нескольких обработок в зависимости от природы амино-защитных групп, например, если, по крайней мере, один из R1, R2 или R3 обозначает алкилоксикарбонильную группу, где радикал алкил является низшим алкилом, то обработку вышеуказанного соединения формулы II ведут с помощью сильной кислоты, такой как трифтоуксусная кислота, или, если по крайней мере один из R1, R2 или R3 обозначает арилоксикарбонильную группу или если A обозначает группу -CH(OCH2C6H5)-, то осуществляют каталитическое гидрирование в присутствии палладия-на-угле или соли палладия для получения соединения формулы (I) в форме свободного основания или одной из его кислотно-аддитивных солей и затем при необходимости полученную соль переводят в форму свободного основания путем обработки сильным основанием, затем полученное свободное основание переводят в другие кислотно-аддитивные соли.
Для получения соединения формулы (II) работают согласно одному из следующих методов.
Метод А. Осуществляют конденсацию кислоты формулы (III):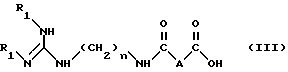 ,
,
в которой
n равно 6 или 8;
A обозначает группу -CH2-, группу -CH(OCH3)-, группу -CH(OCH2C6H5)-, группу -CHF- или простую связь;
R1 обозначает амино-защитную группу, выбранную из алкоксикарбонильной группы, где радикал алкил означает низший алкил, или арилоксикарбонильной группы, где радикал арил означает 9-флуоренилметил, фурфурил, бензил, 4-хлорбензил или 4-метоксиметил,
с амином общей формулы IV: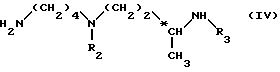 ,
,
в которой
R2 и R3 одинаковые или разные, каждый обозначает амино-защитную группу, указанную выше, путем активации кислоты:
- либо с помощью агента сочетания карбодиимидного типа (в частности, 1,3-дициклогексилкарбодиимид), в присутствии нуклеофильного агента (например, 1-гидроксибензотриазола), в органическом растворителе, в частности в хлорированном растворителе, таком как хлороформ или дихлорметан, и при температуре 0 - 40oC;
- либо путем образования смешанного ангидрида, например, с помощью изобутилхлорформиата в присутствии основного агента, такого как N-метилформолин, в органическом растворителе, например в тетрагидрофуране, и при температуре от -35 до +20oC;
используя по 1 моль соединения формулы (III) примерно на 1 моль соединения формулы (IV) для получения соединения формулы (II):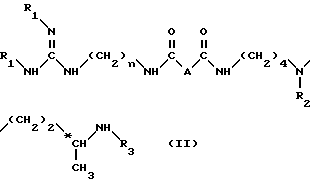 ,
,
в которой
n, A, R1, R2 и R3 имеют вышеуказанные значения.
Метод Б. Осуществляют взаимодействие соединения формулы (IV):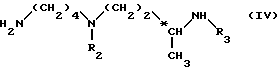 ,
,
в которой
R2 и R3 идентичные или разные, и представляет каждый амино-защитную группу, выбранную из алкилоксикарбонильной группы, где радикал алкил означает низший алкил, или арилоксикарбонильной группы, где радикал означает 9-флуоренилметил, фурфурил, бензил, 4-хлорбензил или 4-метоксибензил с кислотой или хлорангидридом кислоты формулы (V):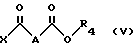 ,
,
в которой
X обозначает атом хлора или группу OH;
A обозначает простую связь, группу -CH2-, группу -CHF-, группу -CH(OCH3)-, или группу -CH(OCH2C6H5)-;
R4 обозначает алкильную группу с 1 - 3 C-атомами, линейную или разветвленную, или фенильную группу;
в органическом растворителе, в частности в хлорированном растворителе, таком как дихлорметан или хлороформ, в присутствии активатора карбонильной группы, такого как карбодиимид (в частности, 1,3-дициклогексилкарбодиимид или карбонилдиимидазол), и нуклеофильного агента (в частности, 1-гидроксибензотриазола), когда X обозначает группу OH, или в присутствии третичного амина (например, триэтиламин), когда X обозначает атом хлора, при температуре 0 - 40oC, используя по 1 моль соединения формулы (IV) примерно на 1 моль соединения формулы (V), для получения соединения формул (VI):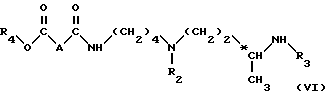 ,
,
в которой
A, R2, R3 и R4 имеют вышеуказанные значения;
омыляют полученное соединение формулы (VI) в органическом растворителе в присутствии сильного основания для получения соединения формулы (VII):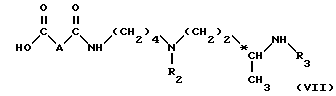 ,
,
в которой
A, R2 и R3 имеют вышеуказанные значения и
конденсируют полученное соединение формулы (VII) с амином формулы (VIII):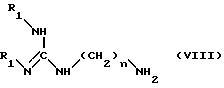 ,
,
в которой
n равно 6 или 8; а R1 обозначает амино-защитную группу, указанную выше,
в условиях, идентичных условиям вышеуказанного метода A, для получения соединений формулы (II):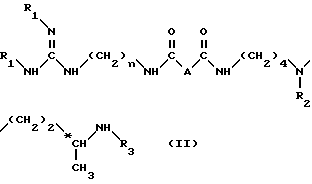 ,
,
в которой
A, n, R1, R2 и R3 имеют вышеуказанные значения.
Метод В. Ацилируют концевую группу NH2 основания формулы (IX):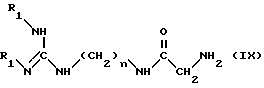 ,
,
в которой
R1 означает амино-защитную группу, указанную выше, в частности, Boc-группу, и n равно 6 или 8;
с помощью хлорформиата или симметричного карбоната (например, бис-(4-нитрофенио)карбоната), в инертном растворителе (например, дихлорметан), при комнатной температуре ( 15 - 25oC); и
осуществляют аминолиз полученного соединения с помощью амина формулы (IV):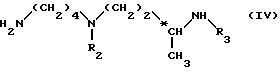 ,
,
в которой
R2 и R3, идентичны или разные, представляют каждый амино-защитную группу, указанную выше, в частности, Boc-группу или фенилметильную группу;
в инертном растворителе, таком как дихлорметан, для получения соединения формулы (II):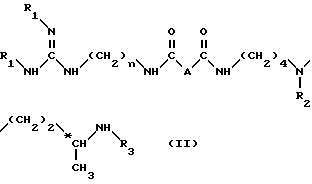 ,
,
в которой
n, R1, R2 и R3 имеют вышеуказанные значения и A обозначает группу -CH2-NH-.
Метод Г. Осуществляют взаимодействие амина формулы (IV):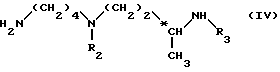 ,
,
в которой
R2 и R3, идентичные или разные, представляют каждый амино-защитную группу, указанную выше, с карбонатом формулы (Х):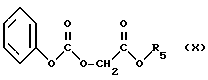 ,
,
в которой R5 обозначает алкильную группу с 1-3 C-атомами или фенилметильную группу,
в инертном растворителе (в частности, ароматическом растворителе, например, толуол), при температуре от комнатной до температуры рефлюкса реакционной смеси, используя по 1 моль соединения формулы (IV) примерно на 1 моль соединения формулы (X), для получения соединения формулы (XI):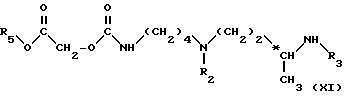 ,
,
в которой
R2, R3 и R5 имеют вышеуказанное значение, или соединения формулы (XI'):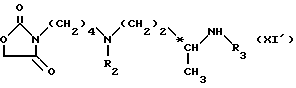 ,
,
в которой
R2 и R3 имеют вышеуказанное значение:
омыляют полученное соединение формулы (XI) или (XI') в органическом растворителе в присутствии сильного основания для получения соединения формулы (XII): ,
,
в котором
R2 и R3 имеют вышеуказанное значение, и
конденсируют полученное соединение формулы (XII) с амином формулы (VIII):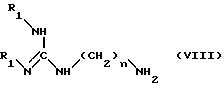 ,
,
в которой
n равно 6 или 8 и R1 означает указанную выше амино-защитную группу, например, Boc-группу;
в условиях, идентичным условиям, описанным для метода A, для получения соединения формулы (II):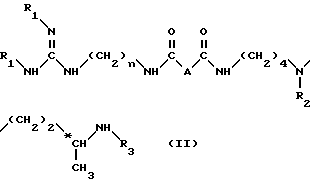 ,
,
в которой
n, R1, R2 и R3 имеют вышеуказанные значения, а A обозначает группу -CH2O-.
Изобретение относится также к аминозащищенным соединениям формулы II: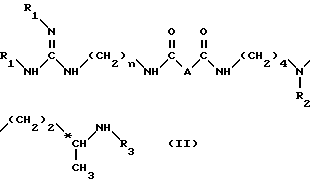 ,
,
где
A обозначает простую связь, группу -CH2-, группу -CHF-, группу -CH(OH)-, группу -CH(OCH3)-, группу -CH(OCH2C6H5)-, группу -CH2O- или группу -CH2NH-,
n равно 6 или 8,
R1, R2, R3, идентичные или разные, и каждая является алкилоксикарбонильной группой, где радикал алкил означает низшую алкильную группу, и арилоксикарбонильной группой, где арил означает 9-флуоренилметил, фурфурил, бензил, 4-метоксибензил, в качестве промежуточного соединения в синтезе соединений формулы I.
Новые соединения формулы I обладают иммунодеприссивной активностью и могут использоваться в качестве активного начала для фармацевтических композиций иммунодепрессивного действия.
Таким образом, другим объектом настоящего изобретения является фармацевтическая композиция иммунодепрессивной активности, содержащая активное начало и фармацевтически приемлемые добавки, отличающаяся тем, что в качестве активного начала она содержит, по крайней мере, одно соединение формулы I в эффективном количестве,.
Изобретение подробнее поясняется нижеследующими примерами и результатами фармакологических испытаний, получаемыми при использовании соединений согласно изобретению, по сравнению с результатами, получаемыми с известными продуктами уровня техники. Используемая в примерах номенклатура соответствует таковой, предлагаемой в Chemical Abstracts; согласно этой номенклатуре сложный моноэфир акландикислоты с трет-бутанолом называется "1,1-диметилэтиловый эфир алкандикислоты", а сложный диэфир типа трет-бутил- и этилалкандиоата называется здесь "(1,1-диметилэтил)этиловый эфир алкандикислоты".
В экспериментальной части "приготовления" относятся к промежуточным продуктам, а примеры относятся к продуктам согласно изобретения.
Когда соединения содержат в своей структуре асимметрический атом углерода, то отсутствие специального указания означает, что речь идет о практически эквимолекулярной смеси двух энантиомеров (рацемической смеси).
Когда те же соединения обозначаются указанием (R) или (S) непосредственно после идентификации положения заместителя, то это означает, что содержащий этот заместитель углерод имеет (R) или (S)-конфигурацию, согласно правилам Cahn, Ingold и Prelog.
Когда соединения содержат в своей структуре два центра асимметрии, то отсутствие специального указания означает, что речь идет о смеси диастереоизомеров.
Спектральные характеристики сигналов ядерного магнитного резонанса (ЯМР) даются для протона (1H) или для изотопа 13 углерода (13C): указывается химсдвиг по отношению к сигналу TMC, форма сигнала (с. для синглета; д. для дублета; т. для триплета; к. для квадруплета; м. для мультиплета; с.ш. - для сигнала уширенного) и число протонов, относящихся к сигналу. Для сведения 1H-ЯМР-спектры снимают при 300 мГц.
Приготовление 1. 4-[N-(3-Гидроксибутил)-N-(фенилметил)амино]бутаннитрил.
5 г (28•10-3 моль) 3-[N-(фенилметил)амино]-1-метилпропанола растворяют в 60 мл бутанола и добавляют 3,56 г (34•10-3 моль) карбоната натрия, 1,06 г (7•10-3 моль) иодида калия, затем 7,4 г (70•10-3 моль) 4-хлорбутиронитрила в виде раствора в 10 мл бутанола. Реакционную смесь при перемешивании кипятят с обратным холодильником в течение 20 часов. После охлаждения отфильтровывают и нерастворимые части промывают с помощью 60 мл диэтилового эфира. Объединенные фильтраты концентрируют при пониженном давлении и полученный остаток обрабатывают с помощью 100 мл дихлорметана.
Полученный раствор экстрагируют с помощью 50 мл 1M соляной кислоты; полученную водную кислую фазу промывают 2 раза 50 мл дихлорметана, затем подщелачивают путем медленного добавления 50 мл 5н. раствора гидроксида натрия. Продукт экстрагируют из водной фазы 3 раза по 50 мл дихлорметана. Полученную органическую фазу сушат над карбонатом калия, затем концентрируют при пониженном давлении. Полученную желтую жидкость (7 г) затем перегоняют в вакууме, получая 6,02 г (выход 87%) целевого продукта. Т.кип. = 160-170oC /0,05 мм рт.ст. (0,05 мм рт.ст. соответствуют примерно 0,066 Па).
Приготовление 2. 3 -[N-(3-цианопропил)-N-(фенилметил)амино]-1-метипропиловый эфир метансульфокислоты.
Готовят раствор 9,11 г (37•10-3 моль) полученного согласно приготовлению 1 продукта в 150 мл безводного диэтилового эфира и охлаждают до 0oC. После этого добавляют 11, 23 г (111•10-3 моль) триэтиламина, затем прикапывают 4,66 г (40•10-3 моль) метансульфонилхлорида. По окончании добавления перемешивают при 0oC в течение 1 часа, затем в течение 15 часов при комнатной температуре. Медленно добавляют 120 мл насыщенного раствора бикарбоната натрия, затем реакционную среду экстрагируют 3 раза по 50 мл диэтилового эфира. Органические фазы объединяют и сушат над карбонатом калия, после чего концентрируют при пониженном давлении. Таким образом получают 11,7 г (выход 98% в расчете на сырой продукт) целевого продукта в виде желтого вязкого масла. Продукт используют без дополнительной очистки в следующей стадии, однако его можно очищать путем хроматографии на диоксиде кремния и элюирования с помощью смеси н-гептана с диэтиловым эфиром (7:3 по объему).
1H-ЯМР-спектр (CDCl3 : 1,33 (д., 3H); 1,76 (м., 3H); 1,86 (м., 1H); 2,37 (т. , 2H); 2,53 (м. 4H); 2,89 (с., 3H); 3,48 (д., 1H); 3,57 (д., 1H); 4,84 (м., 1H); 7,28 (м., 5H).
Приготовление 3. 3-[N-(3-цианопропил)-N-(фенилметил)-амино]-1-метил-1-азидопропан.
Готовят раствор 10,59 г (33•10-3 моль) продукта из приготовления 2 в 70 мл диметилсульфоксида и добавляют 6,43 г (100•10-3 моль) азида натрия. Реакционную смесь перемешивают в течение 15 часов при 45-50oC, затем охлаждают, добавляют 100 мл воды, затем экстрагируют с помощью 100 мл диэтилового эфира. Водную декантированную фазу снова экстрагируют 3 раза по 30 мл диэтилового эфира и объединенные органические фазы промывают 50 мл водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния. После удаления растворителя при пониженном давлении, остаточную жидкость очищают путем хроматографии на диоксиде кремния и элюирования смесью н-гептана с диэтиловым эфиром (7: 3 по объему). Таким образом получают 7,8 г (выход 78%) целевого продукта в форме бесцветного вязкого масла.
1H-ЯМР-спектр (CDCl3): 1,11 (д., 3H); 1,58 (м., 2H); 1,77 (м., 2H); 2,34 (т., 2H); 2,52 (м., 4H); 3,50 (м., 3H); 7,26 (м., 5H).
Приготовление 4. 1,1-Диметиловый эфир 9-циано-3-метил-6-(фенилметил)-2,6-диазононановой кислоты.
В колбу для гидрирования емкостью 250 мл вводят 3,00 г (11•10-3 моль) продукта, полученного согласно приготовлению 3, и 2,85 г (13•10-3 моль) ди-трет-бутилдикарбоната (продукт структуры: O[CO C(CH3)3]2 в виде раствора в 30 мл безводного этилацетата и добавляют 0,3 г 10%-ного палладия-на-угле. Смесь гидрируют при перемешивании при комнатной температуре и под давление 2•105 Па в течение 15 часов. Затем катализатор удаляют путем отфильтровывания, после чего фильтрат концентрируют при пониженном давлении.
Остаточный продукт очищают путем хроматографии на силикагеле, элюируя смесью н-гептана с диэтиловым эфиром (45:55 по объему). Таким образом получают 3,47 г (выход 91%) целевого продукта в форме бесцветного вязкого масла.
1H-ЯМР-спектр (CDCl3): 1,06 (д., 3H); 1,44 (с., 9H); 1,45-1,80 (м.4H); 2,33 (т. , 1H); 2,48 (м., 3H); 3,50 (к., 2H); 3,70 (с.ш., 1H); 5,08 (с.ш., 1H); 7,27 (м., 5H).
Приготовление 5. 1,1-Диметиловый эфир 10-амино-3-метил-6-(фенилметил)-2,6-диазадекановой кислоты.
В аппарат для гидрирования вводят суспензию 2 г никеля Ренея в 180 мл безводного этанола. Эту суспензию насыщают путем барботирования в течение 10 мин газообразным аммиаком, затем добавляют 2,95 г (8•10-3 моль), полученного в приготовлении 4 продукта в виде раствора в 20 мл безводного этанола. Затем реакционную смесь подвергают гидрированию под давлением 106 Па в течение 15 часов при 40oC.
После охлаждения катализатор удаляют путем отфильтровывания и фильтрат концентрируют при пониженном давлении. Остаточное масло очищают путем хроматографии на силикагеле, элюируя смесью метанола с 32% аммиака (100:1 по объему). Таким образом получают 2,7 (выход 91%) целевого продукта в форме бесцветного вязкого масла.
1H-ЯМР-спектр (CDCl3): 1,04 (д. , 3Н); 1,31 (с., 2H); 1,44 (с., 9H); 1,30-1,75 (м., 6H); 2,63 (е., 2H); 2,25-2,70 (м., 4H); 3,43 (д., 1 H); 3,60 (д., 1H); 3,60-3,75 (м., 1H); 5,74 (с.ш., 1H); 7,30 (м., 5H).
Приготовление 6. 1-(1,1-Диметилэтил)-14-этиловый эфир 3-[[(1,1-диметилэтокси)карбонил]-амино]-12-оксо-2,4, 11-триазатетрадец-2-ен-дикислоты.
1,05 г (8•10-3 моль) моноэтилового эфира малоновой кислоты растворяют в 15 мл безводного хлороформа, затем охлаждают до 0oC и добавляют 1,65 г (8•10-3 моль) 1,3-дициклогексилкарбодиимида и 0,108 г (0,8•10-3 моль) 1-гидроксибензотриазол-гидрата. После перемешивания в течение 0,5 часа при 0oC, добавляют раствор 1,5 г (4,19•10-3 моль) бис-(1,1-диметилэтилового) эфира [[(6-аминогексил)имино] -метилен] -бискарбаминовой кислоты в виде раствора в 5 мл безводного хлороформа. Затем оставляют при перемешивании в течение 48 часов при комнатной температуре, после чего реакционную среду концентрируют при пониженном давлении. Полученный сырой продукт очищают путем хроматографии на диоксиде кремния при среднем давлении и элюировании с помощью смеси гексана с этилацетатом (1:1 по объему). Таким образом получают 1,95 г (выход 99%) целевого продукта в форме желтого масла.
1H-ЯМР-спектр (CDCl3): 1,30 (т., 3H); 1,35-1,65 (м., 26H); 3,2-3,35 (м., 4H); 3,4 (т. д., 2H); 4,2 (к., 2H); 7,1-7,2 (с.ш., 1H); 3,3 (т., 1H); 11,5 (с., 1H).
Приготовление 7. 1-(1,1-Диметиловый)эфир 3-[/(1,1-диметилэтокси)карбонил]амино]-12-оксо-2,4,11-триаза тетрадец-2-ендикислоты.
1,95 г (4,15•10-3 моль) полученного в приготовлении 6 продукта растворяют в 15 мл диметоксиэтана и добавляют 8,5 мл водного 1н. раствора NaOH. Перемешивают при комнатной температуре в течение 15 мин, затем добавляют 25 мл и 25 мл хлороформа и осторожно подкисляют до pH 2 с помощью 1н. водного раствора HCl. Экстрагируют несколько раз хлороформом, затем органическую фазу сушат и концентрируют при пониженном давлении. Таким образом получают 1,8 г (выход 100%) целевого продукта в форме желтого цвета густого масла.
1H-ЯМР-спектр (CDCl3): 1,35 - 1,65 (м., 26H); 3,3-3,45 (м., 6H); 7,05 (с.ш., 1H); 8,3 (т., 1H); 9-11,5 (с.ш., 2H).
Приготовление 8. бис-(1,1-Диметилэтиловый) эфир 3-{[(1,1-диметилэтокси)карбонил] амино} -23-метил-12,14-диоксо-20 (фенилметил)-2,4,11,15,20,24-гексаазапентакоз-2-ен-дикислоты.
Поступая аналогичным приготовлению 6 образом, но исходя из 6,21 г (14•10-3 моль), полученного в приготовлении 7 продукта и 4,7 г (13,5•10-3 моль) 1,1-диметилэтилового эфира 10-амино-3-метил-6-(фенилметил)-2,6-диазадекановой кислоты и после очистки путем хроматографии на диоксиде кремния при элюировании смесью этилацетата с этанолом (9:1 по объему), получают 8,5 г (выход 81%) целевого продукта в форме оранжевого масла.
1H-ЯМР-спектр (CDCl3): 1,01-1,03 (д., 3H); 1,23-1,70 (м., 41H); 2,4-2,7 (м., 4H); 3,05-3,3 (м., 6H); 3,35-3,45 (т.д., 2H); 3,6-3,8 (м., 3H); 5,1-5,4 (с. ш. , 1H); 7,1-7,4 (м., 5H); 7,55 (с.ш., 1H); 7,75 (с.ш., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 9. Хлоргидрат бис-(1,1-диметилэтилового) эфира 3-[[(1,1-диметиэтокси)карбонил] -амино]-23-метил-12,14-диоксо-2,4,11,15,20, 24-гексаазапентакоз-2-ен-дикислоты.
8,5 г (10,9•10-3 моль) полученного в приготовлении 8 продукта растворяют в 100 мл этанола и добавляют 0,57 г хлорида палладия и 0,7 мл концентрированной соляной кислоты. Смесь затем гидрируют при атмосферном давлении в течение 8 часов. Катализатор отфильтровывают, споласкивают его небольшим количеством этанола, затем полученный фильтрат концентрируют при пониженном давлении. Таким образом получают 7,8 г (выход 98%) целевого продукта в форме бесцветного масла.
1H-ЯМР-спектр (CDCl3): 1,20 (д., 3H); 1,25-1,9 (м., 41H): 2,55-2,80 (м., 2H); 2,80-3,55 (м., 10H); 3,75 (с.ш., 1H); 4,9 (д., 1H); 7,9 (м., 1H); 8,23 (с.ш., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Пример 1. Трис-(трифторацетат) N-{4-[[3-(амино)бутил]амино]бутил}-N'-[6-[(аминоиминометил)амино]гексил] пропандиамида.
7,8 г (10,8 • 10-3 моль) полученного согласно приготовлению 9 продукта растворяют в 40 мл дихлорметана и добавляют 40 мл трифторуксусной кислоты. Реакционную смесь перемешивают в течение 5 часов при комнатной температуре, затем концентрируют при пониженном давлении. Остаточное масло очищают путем хроматографии на привитом диоксиде кремния RP 18 (гранулометрия 5-20 мкм) при среднем давлении и элюировании смесью воды с ацетонитрилом и трифторуксусной кислотой (8:1:1 по объему). Таким образом, полученные чистые фракции объединяют и лиофилизируют. После этого лиофилизат обрабатывают с помощью 100 мл воды и раствор промывают два раза 100 мл этилацетата, затем водную фазу снова лиофилизируют. Эту операцию повторяют два раза для удаления трифторуксусной кислоты. Таким образом получают 4,5 г (выход 57%) целевого продукта в виде аморфного твердого вещества.
1H-ЯМР-спектр (DMCO-d6): 1,15-1,20 (д., 3H); 1,25-1,5 (м., 8H); 1,5-1,85 (м., 4H); 1,85-2,0 (м., 2H); 2,85-3,2 (м., 12H); 3,25-3,35 (м., 1H);6,8-7,55 (с.ш., 3H); 7,6 (т., 1H); 7,09-8,1 (м., 5H); 8,5-8,76 (с.ш., 3H);
13C-ЯМР-спектр (D2O): 18,01; 13,71; 26,21; 26,24; 26,35; 28,56; 28,84; 31,22; 39,51; 40,31; 41,88; 44,30; 44,60; 46,10; 48,14; 157,55; 170,01; 170,34.
Приготовление 10. 1,1-Диметилэтиловый эфир 3-метил-10-[2,4-диоксооксазолидин-3-ил)-6-(фенилметил)-2,6-диазадекановой кислоты.
Готовят раствор из 3 г (8,6 • 10-3 моль) 1,1-диметилэтилового эфира 10-амино-3-метил-6-фенилметил-2,6-диазадекановой кислоты в 50 мл безводного толуола и добавляют раствор 1,8 г (8,6 • 10-3 моль) метилового эфира феноксикарбонилоксиуксусной кислоты в 10 мл безводного толуола, затем 1,08 г (10,7 • 10-3 моль) триэтиламина. Доводят до температуры 60oC и выдерживают при этой температуре при перемешивании в течение 48 часов. Реакционную среду концентрируют затем при пониженном давлении и остаток, полученный таким образом, очищают на диоксиде кремния, элюируя смесью метилциклогексана с этилацетатом (1: 1 по объему). Таким образом получают 3,1 г (выход 82%) продукта в виде вязкого желтого масла.
1H-ЯМР-спектр (CDCl3): 1,0-1,1 (д., 3H); 1,4-1,7 (м., 15H); 2,35-2,50 (м. , 3H); 2,50-2,65 (м., 1H); 3,40-3,60 (м., 4H); 3,60-3,75 (м., 1H); 4,65 (с., 2H); 5,35 (с.ш., 1H); 7,2-7,3 (м., 5H).
Приготовление 11. 1-(1,1-Диметилэтиловый) эфир 3-метил-6-(фенилметил)-13-окса-12-щксщ-2,6,11-триазапентадекандикислоты.
3,1 г (7,1 • 10-3 моль) полученного согласно приготовлению 10 продукта растворяют в 20 мл диметоксиэтана, затем добавляют 21 мл водного 1н. раствора NaOH. Перемешивают при комнатной температуре в течение 4 часов, затем добавляют 75 мл воды и 75 мл дихлорметана. Подкисляют до pH2 с помощью 1 н. раствора соляной кислоты и экстрагируют дихлорметаном. Органические фазы промывают один раз раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют при пониженном давлении. Таким образом получают 3 г (выход 93%) целевого продукта в виде густого желтого масла.
1H-ЯМР-спектр (CDCl3): 1,15 (д., 3H); 1,2-2,2 (м., 15H); 2,35-2,55 (т., 2H); 2,7-2,9 (т. , 2H); 2,9-3,3 (м., 4H); 3,5-3,75 (м., 1H); 4,0-4,3 (м., 2H); 4,9 (д., 1H); 5,1 (д., 1H); 7,4-7,8 (м., 5H); 12,3 (с.ш., 1H).
Приготовление 12. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -24-метил-21-(фенилметил)-14-окса-12, 15-диоксо - 2, 4, 11, 16, 21, 25-гексаазагексакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 6, но используя дихлорметан в качестве растворителя и исходя из 3 г (6,65 • 10-3 моль) полученной согласно приготовлению 11 сложного эфира и 2,61 г (6,65 • 10-3 моль) бис-(1,1-диметилэтилового) эфира [[(6-аминогексил)имино]метилен]-бискарбаминовой кислоты, после очистки путем хроматографии на диоксиде кремния и элюирования с помощью смеси метилциклогексана с этилацететом (3:7 по объему) получают 4 г (выход 76%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 0,9-1,1 (д., 3H); 1,25-1,75 (м., 41H); 2,3-2,5 (м., 3H); 2,6 (м., 1H); 3,1-3,2 (с.ш., 2H); 3,2-3,35 (к., 2H); 3.35-3,45 (т. , 2H); 3,5 (к., 2H); 3,7 (м., 1H); 4,5 (с., 2H); 5,3-5,6 (с.ш., 2H); 6,3 (с. ш., 1H); 7,2-7,3 (м., 5H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 13. 2-{[[4-[N'-[3-(амино)бутил]-N'-(фенилметил)амино]бутил] амино]карбонилокси}-N-{6-[(аминоиминометил)амино]гексил}ацетамид-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, но исходя из 4 г полученного согласно приготовлению 12 продукта и после очистки путем хроматографии на колонке с привитым диоксидом кремния RP 18 и элюирования с помощью смеси воды с ацетонитрилом и трифторуксусной кислотой (7,5:2:0,5 по объему), получают 4,2 г (выход 99%) целевого продукта в виде густого масла.
1H-ЯМР-спектр (CDCl3): 1,1-1,2 (д., 3H); 1,2-1,6 (м., 10H); 1,65-2,2 (м. , 4H); 2,9-3,2 (м., 12H); 3,2-3,35 (м., 1H); 4,35 (с., 2H); 6,8-7,3 (с.ш., 1H); 7,35 (т., 1H); 7,45-7,65 (м., 5H); 7,85-8,1 (м., 3H); 9,8 (с., 1H).
Пример 2. 2-{[[4-[[3-(амино)бутил]амино]бутил]амино]карбонилокси]-N- -{ 6-[(аминоиминометил)амино]гексил}ацетамид-трис-(трифторацетат).
4,2 г (5,05 • 10-3 моль) продукта, полученного в приготовлении 13, растворяют в 275 мл метанола, затем добавляют 0,25 мл концентрированной соляной кислоты, после чего добавляют 0,25 г хлорида палладия. Смесь затем гидрируют при атмосферном давлении и при комнатной температуре в течение 14 часов. Реакционную среду отфильтровывают, затем фильтрат концентрируют при пониженном давлении. Полученное масло обрабатывают с помощью 100 мл воды и 1 мл трифторуксусной кислоты, затем раствор промывают 3 раза по 75 мл этилацетата и лиофилизуют. Таким образом получают 3,9 г (выход 99%) целевого продукта в виде аморфного твердого вещества.
1H-ЯМР-спектр (DMCO-d6):1,2(д.,3H);1,25 - 1,70 (м.,12H); 1,70 - 1,9 (м., 1H); 1,9 - 2,05 (м., 1H); 2,85 - 3,15 (м.,11H); 4,3 (с.,2H); 4,3(с.,2H); 6,8-7,5 (м., 5H); 7,6-7,75(т.,1H); 7,85 - 7,95(т., 1H); 7,95-8,20(с.ш.,3H); 8,70-8,90(с.ш., 2H);
13C-ЯМР-спектр (D2O): 18,02; 23,65; 26,19; 26,28; 26,76; 28,56; 28,93; 31,22; 39,77; 40,59; 41,88; 44,61; 46,11; 48,22; 63,76; 157,54; 158,21; 171,45.
Приготовление 14. Бис-(1,1-диметилэтиловый)эфир 3-[[(1,1-диметилэтокси)карбонил] -амино] -25-метил-22-фенилметил-14,16- диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ен-дикислоты
Следуя методике, идентичной приготовлению 6, но исходя из 2,1 г (4,45•10-3 моль) 1-(1,1-диметилэтилового) эфира 3-[[(1,1-диметилэтокси)карбонил] амино] -14-оксо-2,4,13-триазагексадец-2-ен- дикислоты и 1,55 г (4,45•10-3 моль) соединения, полученного в приготовлении 5, после очистки путем хроматографии на силикагеле и элюирования с помощью смеси этилацетата с этанолом и гидроксидом аммония (7:3:0,1 по объему), получают 3,26 г (выход 93%) целевого продукта в виде аморфного твердого вещества желтого цвета.
1H-ЯМР-спектр (CDCl3):1,02 (д.,3H); 1,2-1,8 (м.,45H); 2,55-2,8 (м.,4H); 3,1-3,3 (м.,6H); 3,38 (т.д.,2H); 3,5-3,7 (м.,1H); 3,7-3,9 (м.,2H); 5-5,3 (с. ш.,1H); 7,1-7,45 (м.,5H); 7,5-7,6 (с.ш.,1H); 7,7-7,8 (с.ш.,1H); 8,3 (т.,1H); 11,5 (c.,1H).
Приготовление 15. Бис-(1,1-диметилэтиловый)эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -25-метил-14,16-диоксо- 2,4,13,17,22,26-гексаазогептакоз-2-ен-дикислоты.
3,2 г (4,06•10-3моль) полученного согласно приготовлению 14 соединения растворяют в 75 мл этанола и добавляют 0,25 г 5%-ного палладия-на-угле. Смесь подвергают гидрированию при комнатной температуре и при атмосферном давлении в течение 12 часов. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении. Таким образом получают 2,15 г (выход 74%) целевого продукта в виде аморфного твердого вещества.
1H-ЯМР-сектр (CDCl3): 1,15 (д. , 3H); 1,55-2,7 (м.,4H); 3,11 (с.,2H); 3,2-3,3 (м.,4H); 3,39 (т.д.,4H); 3,65-3,8 (м.,1H); 4,8-4,9 (м.,1H); 7,05 (с. ш.1H); 7,55 (с.ш.1H); 8,3 (т.,1H); 11,5 (с.,1H).
Пример 3. N-[4-[[3-(амино)бутил]амино]бутил]-N'-[8-[(аминоиминометил)амино]октил] пропандиамид-трис-(трифторацетат)
Следуя методике, аналогичной примеру 1, но исходя из 2,15 г (3,01•10-3моль) соединения, полученного согласно приготовлению 15, и после очистки на силикагеле RP 18 и элюирования с помощью смеси воды с ацетоном и трифторуксусной кислотой (7,5:2:0,5 по объему) получают 2,05 г (выход 90%) целевого продукта в виде аморфного твердого вещества.
1H-ЯМР-спектр (DMCO-d6): 1,18 (д.,3H); 1,2-1,65 (м.,16H); 1,65-1,8 (м., 1H); 1,8-2 (м.,1H); 2,8-3,1 (м.,12H); 3,25-3,3 (м.,1H); 6,8-7,5 (с.ш.,3H); 7,55 (т.1H); 7,85-8,1 (м.,5H); 8,45-8,65 (м.,3H).
13C-ЯМР-спектр (D2O): 18,01; 23,69; 26,24; 26,51; 26,69; 28,60; 28,92; 28,96; 32,21; 39,49; 40,46; 41,97; 44,31; 44,59; 46,10; 48,14; 157,89; 169,96; 170,34.
Приготовление 16. Бис-(1,1-диметилэтиловый)эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -23-метил-20-(фенилметил)-13- (фенилметокси)12,14-диоксо-2,4,11,15,20,24-гексаазапентакоз-2-ен-дикислоты.
2,78 г (5,05•10-3моль)1-(1,1-диметилэтилового) эфира 3-[[(1,1-диметилэтокси)карбонил] амино] -13-(фенилметокси)-12-оксо-2,4,11- триазатетрадец-2-ан-дикислоты растворяют в 50 мл безводного тетрагидрофурана (ТГФ). Раствор охлаждают до -25oC и добавляют 1,02 г (10,1•10-3 моль) N-метилморфолина и 0,69 г (5,05•10-3моль) изобутилхлорформиата. Немедленно выпадает белого цвета осадок. Перемешивают в течение 0,5 часа, затем добавляют 1,76 г (5,05•10-3моль) полученного согласно приготовлению 5 соединения, в виде раствора в 10 мл ТГФ. Перемешивают в течение 1 часа, затем концентрируют при пониженном давлении. Продукт очищают путем хроматографии на силикагеле и элюирования смесью метилциклогексана с этилацетатом (7,5:2,5 по объему. Таким образом получают 3,76 г (выход 86%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3):1,04 (дд.,3H); 1,2-1,8 (м.,41H); 2,3-2,7 (м.,4H); 3,1-3,3(м. , 4H); 3,3-3,5 (м.,3H); 3,5-3,75 (м.,2H); 4,28 (с.,1H); 4,79 (с., 2H); 5,3-5,5 (с.ш.1H); 6,95 (с.ш.1H); 7,2-7,4 (м.,10H); 8,3 (т.1H); 11,5 (с. ,1H).
Приготовление 17. Бис-(1,1-диметиловый)эфир 3-{ [(1,1-диметилэтокси)карбонил] амино} -13-гидрокси-23-метил-12,14- диоксо-2,4,11,15,20,24-гексаазапентакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 15, но исходя из 3,76 г (4,35•10-3 моль) продукта, полученного согласно приготовлению 16, получают 3,05 г (выход количественный) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,15 (д.,3H); 1,25-1,75 (м.,42H); 2,55-2,7 (м., 4H); 3,1-3,35 (м.,4H); 3,35-3,45 (тд.,2H); 3,6-3,8 (м., 1H); 4,42 (с.,1H); 4,75-4,85 (м.,1H); 7,2-7,45 (м.,3H); 8,3 (т.,1H); 11,5 (c.,1H).
Пример 4. N-{4-[[3-(амино)бутил]амино]бутил}-N'-[6-[ (аминоиминометил)амино]гексил]-2-гидроксипропандиамид-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 3,03 г (4,32•10-3 моль) соединения, полученного согласно приготовлению 17, и после очистки путем хроматографии на силикагеле RP 18 и элюирования смесью воды с ацетонитрилом и трифторуксусной кислотой (8:1:1 по объему) получают 1,89 г (выход 60%) аморфного белого твердого вещества.
1H-ЯМР-спектр (DMCO-d6):1,18 (д.,3H); 1,2-1,65 (м., 12H); 1,65-1,85 (м., 1H); 1,85-2 (м. , 1H); 2,8-3,15 (м.,10H); 3,2-3,35 (м., 1H); 4,31 (c.,1H); 6,7-7,4 (м.,3H); 7,6 (т., 1H); 7,85-8,05 (м.,5H); 8,45-8,65 (м.,3H).
13C-ЯМР-спектр (D2O): 18,01; 23,66; 26,19; 26,28; 26,31; 28,55; 28,94; 31,21; 39,22; 40,00; 41,87; 44,59; 46,09; 48,12; 73,13; 157,23; 171,50; 171,53.
Приготовление 18. 1-(1,1-Диметилэтил)-16-этиловый эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -15-фенилметокси-14-оксо-2,4,13- триазагексадец-2-ен-дикислоты.
2,6 г (10,9•10-3моль) этилового эфира 2-фенилметоксипропан-дикислоты растворяют в 50 мл дихлорметана и смесь охлаждают до 0oC. Добавляют 4,34 г (22•10-3 моль) N,N' -дициклогексилкарбодиимида и 0,57 г (4•10-3 моль) 1-гидроксибензотриазола и выдерживают при перемешивании в течение 0,5 часа, после чего добавляют 4,21 г (10,9 • 10-3 моль) бис-(1,1-диметилэтиленового) эфира [[(8-аминооктил)имино]метилен]-бис-карбаминовой кислоты в виде раствора в 15 мл дихлорметана и оставляют при перемешивании и при комнатной температуре в течение 48 часов. Реакционную смесь концентрируют при пониженном давлении, затем остаток очищают путем хроматографии на диоксиде кремния, элюируя смесью метилциклогексана с этилацетатом (7:3 по объему). Таким образом получают 2,7 г (выход 40,8%) целевого продукта в виде масла бледно-желтого цвета.
1H-ЯМР-спектр (CDCl3): 1,25-1,6 (м., 33H); 3,25 (т д., 2H); 3,39 (тд., 2H); 4,25 (к., 2H); 4,44 (с., 1H); 4,54 (д., 1H); 4,70 (д., 1H); 6,62 (т., 1H); 7,3-7,45 (м., 5H); 8,28 (т.1H); 11,5 (с., 1H).
Приготовление 19. 1-(1,1-Диметилэтиленовый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -15-фенилметокси-14-оксо-2,4,13 -триазагексадец-2-ендикислоты.
Следуя методике, аналогичной приготовлению 7, исходя из 2,7 г (4,45 • 10-3 моль) соединения, полученного согласно приготовлению 18, получают 2,55 г (выход 99%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,2-1,7 (м., 3 OH); 3,2-3,4 (м., 4H); 4,41 (с., 1H); 4,71 (д., 1H); 5,11 (д. 1H); 6,99 (т., 1H); 7,35-7,5 (м., 5H); 8,3 (т., 1H); 11,3-11,8 (с.ш., 1H).
Приготовление 20. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -15-фенилметокси-25-метил-22- фенилметил-14,16-диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 16, исходя из 2,55 г (4,4 • 10-3 моль) продукта, полученного согласно приготовлению 19, и 1,54 (4,4 • 10-3 моль) соединения, полученного согласно приготовлению 5, получают 3,5 г (выход 89%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,04 (дд., 3H); 1,2-1,7 (м., 45H); 2,3-2,65 (м., 4H); 3,1-3,3 (м., 4H); 3,39 (тд., 2H); 3,44 (д., 1H); 3,57 (д., 1H); 3,6-3,75 (м. , 1H); 4,28 (с., 1H); 4,79 (с., 2H); 5,35-5,5 (с.ш., 1H); 6,85-7,1 (с.ш., 2H); 7,2-7,4 (м., 10H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 21. Бис-(1,1-диметилэтиленовый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -15-гидрокси-25-метил-14,16 -диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 15, исходя из 3,5 г (3,92 • 10-3 моль) соединения, полученного согласно приготовлению 20, получают 2,4 г (выход 85%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,15 (д., 3H); 1,2-1,8 (м., 46H); 2,55-2,75 (м., 4H); 3,2-3,45 (м., 6H); 3,65-3,8 (м., 1H); 4,42 (с. 1H); 4,75-4,9 (д., 1H); 7,2 (т., 1H); 7,4 (т., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Пример 5. N-{4-[[3-амино)бутил]амино]бутил}-2-гидрокси-N'-[8-[ (аминоиминометил)амино]октил]пропандиамид-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 2,4 г (3,29 • 10-3 моль) соединения, полученного согласно приготовлению 21, после очистки путем хроматографии на силикагеле RP 18, элюируя смесью воды с ацетонитрилом и трифторуксусной кислотой (8:1,5:0,5), получают 2,27 г (выход 89,5%) целевого продукта в виде аморфного твердого вещества белого цвета.
1H-ЯМР-спектр (DMCO-d6 ): 1,15-1,65 (м. , 19H); 1,65-1,85 (м., 1H); 1,85-2 (м. , 1H); 2,85-3,2 (м. , 10H); 3,2-3,35 (м., 1H); 4,31 (с., 1H); 6,7-7,5 (с.ш., 3H); 7,59 (т., 1H); 7,8-8,05 (м., 6H); 8,45-8,7 (м., 2H).
13C-ЯМР-спектр (D2O): 18,01; 13,65; 26,32; 26,49; 26,61; 28,60; 28,95; 29,04; 31,21; 39,20; 40,15; 41,97; 44,59; 46,09; 48,12; 7,14; 157,56; 171,15; 171,53.
Приготовление 22. Бис-(1,1-диметилэтиловый)эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -13-метоксил-20-метил-20-фенилметил- 12,14-диоксо-2,4,11,15,20-24-гексаазапентакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 16, исходя из 3 г (6,3 • 10-3 моль) 1-(1,1-диметилэтилового) эфира 3-[[(1,1-диметилэтокси)карбонил]амино] -13-метокси-12-оксо-2,4,11 -триазатетрадец-2-ен-дикислоты и 2,2 г (6,3 • 10-3 моль) соединения, полученного согласно приготовлению 5, получают 3,6 г (выход 68%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,05 (дд., 3H); 1,2-1,8 (м., 41H); 2,3-2,7 (м., 4H); 3,1-3,8 (м., 12H); 4,1 (с., 1H); 5,5 (м., 1H); 6,9 (м, 2H); 7,29 (м., 5H); 8,29 (т., 1H); 11,5 (с., 1H).
Приготовление 23. Хлоргидрат бис-(1,1-диметилэтилового) эфира 3-[[(1,1-диметилэтокси)карбонил] амино] -13-метокси-23-метил-12,14-диоксо-2,4, 11,15,20,24-гексаазацепткаоз-2-ен-дикислоты.
Готовят раствор из 3,3 г (4,1 • 10-3 моль) соединения, полученного согласно приготовлению 22, в 100 мл этанола и добавляют 0,2 мл концентрированной соляной кислоты и 300 мг 10%-ного палладия-на-угле. Смесь гидрируют при комнатной температуре и при атмосферном давлении в течение 2 часов. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении. Таким образом получают 2,92 г (выход 94,8%) целевого продукта в виде твердого белого вещества.
1H-ЯМР-спектр (CDCl3): 1,1-2,3 (м., 44H); 2,8-3,6 (м., 11H); 3,4-3,6 (с. , 3H); 4,4 (с., 1H); 4,9 (м., 1H); 7,6 (м., 1H); 7,9 (т., 1H); 9,3 (м., 1H); 9,9 (м., 1H); 11,4 (с., 1H).
Пример 6. N-{4-[[3-(амино)бутил]амино]бутил}-N'[6[(аминоиминометил)амино]гексил] -2-метокси-пропандиамид-трис(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 2,7 г (3,6 • 10-3 моль) соединения, полученного согласно приготовлению 23, и после очистки путем хроматографии на силикагеле RP 18 и элюирования смесью воды с ацетонитрилом и трифторуксусной кислотой (8:1,5:0,5 по объему) получают 2,11 г (выход 78%) целевого продукта в виде аморфного твердого вещества.
1H-ЯМР-спектр (DMCO-d6): 1,2 (д. , 3H); 1,4 (м., 12H); 1,75-1,95 (2м, 1H); 3,0 (м. , 11H); 3,3 (с., 3H); 4,1 (с., 1H); 7,1 (с.ш., 3H); 7,6 (т., 1H); 8,0 (м., 4H); 8,6 (м., 2H).
13C-ЯМР-спектр (D2O): 18,01; 23,68; 26,18; 26,29; 26,32; 28,55; 28,92; 31,21; 39,21; 39,99; 41,87; 44,60; 46,10; 48,11; 58,65; 82,43; 157,54; 165,65; 169,96.
Приготовление 24. 1-(1.1-Диметилэтил)-16-метиловый эфир 3-[[(1,1-диметилэтокси)карбонил]амино]-15-метокси-14-оксо-2,4,13 -триазагексадец-2-ен-дикислоты
Следуя методике, аналогичной приготовлению 18, исходя из 3,5 г (23,65 • 10-3 моль) метилового эфира 2-метоксипропандикислоты и 7 г (18,1 • 10-3 моль) бис-(1,1-диметилэтилового) эфира [[(8-аминооктил)имино]метилен]бискарбаминовой кислоты, получают 8,6 г (выход 95%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,2-1,65 (м., 30H); 3,2-3,35 (м., 2H); 3,38 (тд., 2H); 3,47 (с. , 3H); 3,82 (с., 3H); 4,30 (с., 1H); 6,6 (т., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 25. 1-(1,1-Диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил]амино]-15-метокси-14-оксо-2,4,13 -триазагексадец-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 7, исходя из 8,6 г (16,7 • 10-3 моль) соединения, полученного согласно приготовлению 24, получают 8,2 г (выход 98%) целевого продукта в виде аморфного твердого вещества желтого цвета.
1H-ЯМР-спектр (CDCl3: 1,25-1,7 (м., 30H); 3,2-3,45 (м., 4H); 3,69 (с., 1H); 6,9-7,1 (с.ш., 1H); 8,25-8,45 (с.ш., 1H); 11,3-11,9 (с.ш., 1H).
Приготовление 26. Бис-(1,1-диметилэтиловый) эфир 3-[1,1- диметилэтокси)карбонил амино]-15-метил-22-фенилметил-14,16- диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 16, исходя из 4 г (8•10-3 моль) соединения, полученного согласно приготовлению 25, получают 4,8 г (выход 72%) целевого продукта в виде светло-желтого масла.
1H-ЯМР (CDCl3): 1,05 (дд. , 3H); 1,2-1,8 (м., 45H); 2,3-2,7 (м.,4H); 3,1-3,3 (м. , 4H); 3,3-3,6 (м.,7H); 8,6-3,75 (м.,1H); 4,09 (с., 1H); 5,35-5,55 (с. ш. , 1H); 6,75-7 (м.,2H); 7,2-7,35 (м.,5H); 8,3 (т.,1H); 11,5 (с., 1H).
Приготовление 27. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил]амино]-15-метокси-25-14,16- диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ен-дикислоты
Следуя методике, аналогичной приготовлению 23, исходя из 4,8 г (5,76•10-3 моль) соединения, полученного согласно приготовлению 26, получают 4,15 г (выход 97%) целевого продукта в виде масла.
1H-ЯМР-спектр (CDCl3): 1,15 (д., 3H); 1,25-1,8 (м.,45H); 1,9-2,1 (с.ш., 1H); 2,6-2,75 (м., 4H); 3,2-3,35 (м., 4H); 3,35-3,45 (м.,2H); 3,57 (с.,3H); 3,65-3,8 (м.,1H); 4,8-4,9 (с.ш., 1H); 6,85 (т., 1H); 7.2-7,35 (м., 1H); 8,3 (т.,1H); 11,5 (с.,1H).
Пример 7. N-{ 4-[[3-(амино) бутил] амино] бутил}-2-метокси- N,-[8-[(аминоиминометил)амино]октил]пропандиамид-трис- (трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 4,15 г (5,58•10-3 моль) соединения, полученного согласно приготовлению 27, получают 3,8 г (выход 86,5%) целевого продукта в виде аморфного твердого вещества белого цвета.
1H-ЯМР-спектр (DMCO-d6): 1,18 (д.,3H); 1,2-1,35 (м.,8H); 1,35-1,65 (м., 8H); 1,65-1,85 (м.,1H); 1.85-2 (м.,1H); 2,8-3,2 (м.,10H); 3,25-3,4 (м.,4H); 4,08 (с.,1H); 6,6-7,5 (с.ш.,3H); 7,62 (т.,1H); 7,9-8,1 (м.,6H); 8,5-8,7 (с. ш.,2H).
13C-ЯМР (D2O; 18,01; 23,67; 26,50; 26,63; 28,60; 28,94; 28,93; 29,01; 31,21; 39,18; 40,14; 41,97 44,59; 46,09; 48,11; 58,68, 82,44; 157,54; 169,60; 169,97.
Приготовление 28. 1-(1,1-Диметилэтил)-14-этиловый эфир 13-фтор- 6-фенилметил-12-оксо-2,6,11-триазатетрадикандикислоты.
Готовят раствор из 1,3 г (8,7•10-3 моль) этилового эфира 2-фторпропандикислоты в 30 мл дихлорметана и 3 мл диметилформамида и добавляют 2,2 г (13,5•10-3 моль) 1,1-карбонилдиимидазола. В течение 3 часов при комнатной температуре перемешивают, затем добавляют 3 г (8,7•10-3 моль) соединения, полученного согласно приготовлению 5, в виде раствора в 10 мл дихлорметана. Выдерживают при перемешивании и при комнатной температуре в течение 48 часов. Реакционную среду концентрируют при пониженном давлении и очищают путем хроматографии на силикагеле, элюируя смесь этилацетата с циклогексаном (6:4 по объему). Таким образом получают 2,3 г (выход 55,6%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,04 (д.,3H); 1,2-1,7 (м.,18H); 2,3-2,5 (м.,2H); 2,5-2,65 (м.,2H); 3,4-3,8 (м.,5H); 4,25-4,4 (м.,2H); 5,25 (д.,2H); 6,7 (с.ш. , 1H); 7,3 (м.,5H).
Приготовление 29. 1-(1,1-Диметилэтиловый) эфир 13-фтор-6-фенилметил-12-оксо-2, 6,11-триазатетрадекандикислоты.
Следуя методике, аналогичной приготовлению 7, исходя из 2,25 г (4,7•10-3 моль) продукта, полученного согласно приготовлению 28, получают 1,44 г (выход 68%) целевого продукта в виде порошка белого цвета. Т.пл. 50oC.
1H-ЯМР-спектр (CDCl3): 1,1 (д.,3H); 1,4-2,1 (м.,15H); 2,7-3,5 (м.,7H); 4,0-4,3 (м.,2H); 4,8 (м.,1H); 5,4 (м.,1H); 6,3-6,8 (м.,1H); 7,4 (м.,5H).
Приготовление 30. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1- диметилэтокси)карбонил]амино]-13-фтор-23-метил-20-фенилметил-12,14- диоксо-2,4,11,15,20,24-гексаазацептакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 16, исходя из 670 мг (1,5•10-3 моль) соединения, полученного согласно приготовлению 29, и 530 мг (1,5•10-3 моль) бис- (1,1-диметилэтилового эфира [[6-(аминогексил)имино] метилент] -бис- карбаминовой кислоты, получают 570 мг (выход 49%) целевого продукта в виде масла светло-желтого цвета.
1H-ЯМР-спектр (CDCl3): 1,0-1,1 (д.,3H); 1,2-1,7 (м.,41H); 2,3-2,7 (м., 4H); 3,2-3,8 (м.,9H); 5,07-5,2 (дд.,1H); 6,8-7,1 (м.,2H); 7,2-7,4 (м.,5H); 8,29 (т.,1H); 11,5 (с.1H).
Приготовление 31. Хлоргидрат бис-(1,1-диметилэтилового) эфира 3-[[(1,1-диметилэтокси)карбонил] амино] -13-фтор-23-метил-12,14- диоксо-2,4,11,15,20,24-гексаазапентакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 23, исходя из 560 мг (0,7•10-3 моль) продукта, полученного согласно приготовлению 30, получают 484 мг (выход 93%) целевого продукта в виде твердого вещества белого цвета.
1H-ЯМР-спектр (CDCl3): 1,1-2,1 (м.,44H); 3,0-3,8 (м.,11H); 4,8 (м.,1H); 5,4-5,6 (д.,1H); 8 (м.,1H); 8,5 (м.,1H); 9,7 (м.,1H); 10,7 (м.,1H); 11,3 (с. ,1H).
Пример 8. N-{4-[[3-(амино)-бутил]амино]бутил}-2-фтор-N,- [6-[(аминоиминометил)амино]гексил]пропандиамид-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 460 мг (0,62•10-3 моль) соединения, полученного согласно приготовлению 31, получают 350 мг (выход 67%) целевого продукта в виде аморфного твердого вещества белого цвета.
1H-ЯМР-спектр (DMCO-d6): 1,1 (д., 3H); 1,2-1,6 (м.,12H): 1,7-1,9 (2м., 2H); 2,8-3,2 (м.,10H); 3,27 (м.,1H); 5,1-5,28 (д.,1H); 7,1 (м.,4H); 7,6 (т. 1H); 7,95 (с.,3H); 8,35-8,65 (м.,4H).
13C-ЯМР-спектр (D2O): 17,89; 22,83; 25,67; 25,81; 25,86; 28,34; 28,68; 30,40; 37,87; 38,45; 40,64; 43,17; 44,38; 46,43; 86,46; 156,51; 170,12; 170,14.
Приготовление 32. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1- диметилэтокси) карбонил]амино]-15-фтор-25-метил-22-фенилметил-14,16- диоксо-2,4,13,17,22,26-генксаазагептакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 16, исходя из 670 мг (1,5•10-3 моль) соединения, полученного согласно приготовлению 29, и 571 мг (1,5•10-3 моль) бис-(1,1- диметилэтилового) эфира [[(8-аминооктил)имино] метилен] -бис- карбаминовой кислоты, получают 1 г (выход 83,3%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,06 (д. , 3H); 1,2-1,8 (м.,45H); 2,5 (м.,4H); 3,2-3,8 (м. , 9H); 5,1-5,2 (д.,1H); 5,2 (м.,1H); 6,9 (м.,2H); 7,3 (м.,5H); 8,23 (т.,1H); 11,5 (с.,1H).
Приготовление 33. Хлоргидрат бис-(1,1-диметилэтилового) эфира 3-[[(1,1-диметилэтокси)карбонил] амино] -15-фтор-25-метил-14,16- диоксо-2,4,13,17,22,26-гексаазагептакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 23, исходя из 1 г (1,2•10-3 моль) соединения, полученного согласно приготовлению 32, получают 746 мг (выход 81%) целевого продукта в виде гигроскопичного вещества белого цвета.
1H-ЯМР-спектр (CDCl3) : 1,1-2,1 (м., 48H); 2,8-3,5 (м., 9H); 3,6-3,8 (м. , 2H); 4,9 (с.ш., 1H); 5,6 (д., 2H); 7,9 (с.ш., 1H); 8,5 (м., 1H); 11,4 (м., 1H).
Пример 9. N-{ 4-[[3-(амино)бутил]амино]бутил}-2-фтор-N'-[8- [(амино-иминометил)аминооктил]пропандиамид-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 740 мг (0,96 • 10-3 моль) соединения, полученного согласно приготовлению 33, получают 400 мг (выход 54%) целевого продукта в виде аморфного твердого вещества белого цвета.
1H-ЯМР-спектр (DMCO-d6): 1,1-1,6 (м., 19H); 1,75-1,95 (2м., 2H); 2,8-3,2 (м. , 10H); 3,3 (м., 1H); 5,12-5,28 (д., 1H); 7,1 (с.ш., 1H); 7,6 (т., 1H); 7,94 (с., 3H); 8,3-8,6 (м., 4H).
13C-ЯМР-спектр (D2O): 18,01; 23,65; 26,19; 26,48; 26,57; 28,59; 28,88; 28,91; 28,94; 31,21; 39,30; 40,22; 41,97; 44,59; 46,10; 48,09; 87,27; 89,87; 156,81; 170,12; 170,14.
Приготовление 34. 1-(1,1-диметилэтил)-13-этиловый эфир 3-метил-6-фенилметил-12-оксо-2,6,11-триазатридекандикислоты.
7 г (20 • 10-3 моль) соединения, полученного согласно приготовлению 5, растворяют в 100 мл безводного дихлорметана и добавляют 5,25 г (52 • 10-3 моль) триэтиламина, затем медленно добавляют 3,56 г (26 • 10-3 моль) этоксалилхлорида, охлаждая на водяной бане до 10oC. По окончании добавления перемешивают в течение 15 минут, затем концентрируют при пониженном давлении. Очищают путем хроматографии на силикагеле и элюирования смесью метилциклогексана с этилацетатом (4:6, затем 1:9 по объему). Таким образом получают 6,8 г (выход 75,7%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,0 (д., 3H); 1,3-1,8 (м., 18H); 2,3-2,65 (м., 4H); 3,2-3,35 (м., 2H); 3,4 (д., 1H); 3,58 (д., 1H); 3,6-3,8 (м., 1H); 4,3 (к., 2H); 5,2-5,4 (с.ш., 1H); 7,2-7,5 (м., 6H).
Приготовление 35. 1-(1,1-Диметилэтиловый) эфир 3-метил-6-фениламин-12-оксо-2,6-11-триазатридекандикислоты
Следуя методике, аналогичной приготовлению 7, исходя из 6,8 г (15,14 • 10-3 моль) соединения, полученного согласно приготовлению 34, получают 6,4 г (выход количественный) целевого продукта в виде аморфного твердого вещества белого цвета.
1H-ЯМР-спектр (CDCl3): 1,1 (д., 3H); 1,3-1,9 (м., 15H); 2,5-3,45 (м., 8H); 3,5-3,7 (м., 1H); 5,3-5,6 (с.ш., 1H); 7,25-7,6 (м., 5H); 7,7-8 (с.ш., 1H).
Приготовление 36. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -22-метил-19-фенилметил-12,13- диоксо-2,4,11,14,19,23-гексаазатетракоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 18, исходя из 4 г (9,5 • 10-3 моль) соединения, полученного согласно приготовлению 35, и 3,4 г (9,5 • 10-3 моль) бис-(1,1-диметилэтилового) эфира [[(6-аминогексил)имино]метилен] -бис-карбаминовой кислоты, получают 1,46 г (выход 20%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,05 (д., 3H); 1,3-1,8 (м., 41H); 2,3-2,6 (м., 4H); 3,1-3,35 (м., 4H); 3,40 (тд., 1H); 3,45 (д., 1H); 3,6 (д., 1H); 3,6-3,8 (м. , 1H); 5,3-5,5 (с.ш., 1H); 7,2-7,35 (м., 5H); 7,4-7,6 (м., 2H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 37. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1- диметилэтокси)карбонил] амино] -22-метил-12,13-диоксо-2,4,14,19,23- гаксаазатетракоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 15, исходя из 1,46 г соединения, полученного согласно приготовлению 36, получают 1,25 г (выход 97,5%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,2 (д. , 3H); 1,3-1,8 (м., 41H); 2,6-2,8 (м., 4H); 3,25-3,85 (м. , 8H); 4,85 (д., 1H); 7,45 (т.. 1H); 7,85 (т., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Пример 10. N-{4-[[3-(амино)бутил]амино]бутил}-N'-[6- [(аминоиминометил)амино]гексил]этандиамин-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 1,25 г соединения, полученного согласно приготовлению 37, получают 580 мг (выход 43%) целевого продукта в виде амфотерного твердого вещества белого цвета.
1H-ЯМР-спектр (DMCO-d6): 1,2 (д., 3H); 1,25-1,65 (м., 12H); 1,65-1,85 (м. , 1H); 1,85-2,0 (м., 1H); 2,8-3,2 (м., 10H); 3,2-3,4 (м., 1H); 6,8-7,5 (с.ш., 3H); 7,65 (т., 1H); 7,9-8,1 (с.ш., 4H); 8,5-8,7 (с.ш., 2H); 8,71 (т., 1H); 8,77 (т., 1H).
13C-ЯМР-спектр (D2O): 18,00; 23,77; 27,13; 26,23; 26,41; 28,54; 28,82; 31,21; 39,54; 40,31; 41,88; 41,61; 46,09; 48,12; 157,55; 161,65; 161,98.
Приготовление 38. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] -амино]-24-метил-21-фенил-метил- 14,15-диоксо-2,4,13,16,21,25-гексаазагексакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 18, исходя из 2,73 г (6,47 • 10-3 моль) соединения, полученного согласно приготовлению 35, и 2,5 г (6,47 • 10-3 моль) бис-(1,1- диметилэтилового) эфира [[(8-аминооктил)имино]метилен]-бис- карбаминовой кислоты, получают 2 г (выход 39%) целевого продукта в виде желтого масла.
1H-ЯМР-спектр (CDCl3): 1,05 (д., 3H); 1,1-1,8 (м., 45H); 2,3-2,7 (м., 4H); 3,15-3,30 (м., 4H); 3,4 (тд., 2H); 3,45 (д., 1H); 3,6 (д., 1H); 3,6-3,75 (м., 1Н); 5,3-5,5 (с.ш., 1H); 7,2-7,35 (м., 5H); 7,35-7,6 (м., 2H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 39. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -24-метил-14,15-диоксо- 2,4,13,16,21,25-гексааза-гексакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 15, исходя из 2 г (2,53 • 10-3 моль) соединения, полученного согласно приготовлению 38, получают 1,75 г (выход 99%) целевого продукта в виде бесцветного масла.
1H-ЯМР-спектр (CDCl3): 1,2 (дд., 3H); 1,2-1,8 (м., 45H); 2,45-2,9 (м., 4H); 3,1-3,8 (м., 8Н); 4,7-4,85 (с.ш., 1H); 7,4-7,5 (с.ш., 1H); 7,7-7,85 (с. ш., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Пример 11. N-{4-[[3-(амино)бутил]амино]бутил}-N'-[8- [(аминоиминометил)амино]октил]этандиамид-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 1,75 г (2,5 • 10-3 моль) соединения, полученного согласно приготовлению 39, получают 250 мг (выход 13,5%) целевого продукта в виде амфотерного твердого вещества белого цвета.
1H-ЯМР-спектр (DMCO-d6): 1,2 (д., 3H); 1,2-1,6 (м., 16H); 1,6-1,8 (м., 1H); 1,8-2,0 (м., 1H); 2,8-3,2 (м., 10H); 3,2-3,35 (м., 1H); 6,7-7,4 (с.ш., 3H); 7,55 (т., 1H); 7,85-8,05 (с.ш., 4H); 8,4-8,6 (с.ш., 2H); 8,7 (т., 1H); 8,77 (т., 1H).
13С-ЯМР-спектр (D2O): 15,00; 20,77; 23,12; 23,51; 23,74; 25,60; 25,91; 25,94; 25,98; 28,20; 36,53; 37,45; 38,97; 41,60; 43,09; 45,11; 157,45; 161,55; 161,88.
Приготовление 40. Бис-(1,1-диметилэтиловый) эфир. 3-[(1,1-диметилэтокси)карбонил]амино]-24-метил-21-фенилметил-12,15- диоксо-2,4,11,14,16,21,25-гептаазагексакоз-2-ен-дикислоты.
2 г (4,8•10-3 моль)1,1-диметилэтилового эфира 13-амино-3-[[(1,1-диметилэтокси)карбонил] амино]-12-оксо-2,4, 11-триазатридец-2-еновой кислоты растворяют в 50 мл дихлорметана и добавляют порциями при комнатной температуре, 1,6 г (5,3•10-3 моль) бис-(4-нитрофенил)карбоната. Выдерживают при перемешивании в течение 5 часов при комнатной температуре, затем добавляют 1,68 г (4,8•10-3 моль) соединения, полученного согласно приготовлению 5, в виде раствора в 15 мл дихлорметана. Реакционную среду перемешивают при комнатной температуре в течение 16 часов, затем концентрируют при пониженном давлении. Очищают путем хроматографии на силикагеле, элюируя смесью этилацетата с циклогексаном (4:6 по объему), затем смесью этилацетата с этанолом (9:1 по объему). Таким образом получают 2,59 г (выход 68%) целевого продукта в виде твердого вещества желтого цвета.
1H-ЯМР-спектр (CDCl3): 1,0 - 1,1 (д.,3H); 1,2 - 1,8 (м.,41H); 2,3 - 2,7 (2м. , 4H); 3,1 - 3,4 (м., 8H); 3,5 - 3,6 (м.,1H); 3,9 (м.,2H); 5,2 (м.,1H); 5,7 (м..1H); 6,4 (м..1H); 6,8 (м.,1H); 7,3 (м.,5H); 8,3 (т.,1H); 11,45 (с., 1H).
Приготовление 41. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -24-метил-12,15-диоксо-2,4,11, 14,16,21,25-гептаазагексакоз-2-ен-дикислоты, хлоргидрат.
Раствор 2,52 г (3,2•10-3 моль) соединения, полученного согласно приготовлению 40, в 40 мл этанола подвергают гидрированию при атмосферном давлении в присутствии 200 мг 10%-ного палладия-на-угле и 0,1 мл соляной кислоты. После протекания реакции в течение 5 часов катализатор удаляют путем отфильтровывания и раствор концентрируют при пониженном давлении. Остаток обрабатывают и дихлорметаном и подкисляют до pH 2. После двух экстракций водой объединенные водные фазы лиофилизируют. Полученное аморфное твердое вещество (2,2 г) обрабатывают без всякой другой очистки в следующем приготовлении.
1H-ЯМР-спектр (CDCl3):1,0 - 1,1 (д., 3H); 1,15 - 1,7 (м., 39H); 1,8 (м., 1H); 2,1 (м. , 1H); 2,8 - 3,1 (м., 9H); 3,2 - 3,4 (2м., 2H); 3,6 (с., 2H); 7,3 (м., 2H); 8,2 (т., 2H); 8-7,8 (т., 1H); 9 (м., 1H); 11 (с., 1H).
Пример 12. Трис-(трифторацетат)-N{4-[[3-(амино)бутил]амино]бутил}-N'- { [[[6-[(аминоиминометил)амино]карбонил]метил}мочевины.
Следуя методике, аналогичной примеру 1, исходя из 2,2 г соединения, полученного согласно приготовлению 41, получают 1 г (выход 43%) целевого продукта в виде аморфного твердого вещества белого цвета.
1H-ЯМР-спектр (DMCO-d6): 1,1 - 1,65 (м., 15H); 1,7 (м., 1H); 1,9 (м., 1H); 3,0 (м., 10H); 3,3 (м., 1H); 3,6 (с., 2H); 4,5 - 5,5 (4с.ш., 3H); 6,0 - 6,4 (м. , 2H); 6,9 - 7,5 (м., 2H); 7,6 (т., 1H); 7,8 (т., 1H); 8 (с., 2H); 8,6 (м., 2H).
13C-ЯМР-спектр (D2O): 18,01; 23,69; 26,20; 26,31; 27,20; 28,56; 29,02; 31,22; 39,85; 39,95; 41,87; 43,98; 44,59; 46,10; 48,26; 157,90; 161,07; 173,72.
Приготовление 42. 1,1-Диметилэтиловый эфир (2-гидрокси-1(R) метилэтил)карбамиловой кислоты
Готовят раствор из 24,3 г (0,323 моль) 2-(R) аминопропанола в 450 мл тетрагидрофурана и 8 мл воды. Добавляют 32,6 г (0,323 моль) триэтиламина, затем медленно приливают раствор 70,5 г (0,323 моль) ти-трет-бутилдикарбоната (т.е. O[COC(CH3)3]2) в 150 мл ТГФ. Реакционную среду выдерживают при перемешивании в течение 1 часа при комнатной температуре, затем концентрируют при пониженном давлении. Маслянистый остаток обрабатывают с помощью 400 мл диэтилового эфира и промывают 2 раза по 100 мл 0,1н. раствора соляной кислоты, содержащего хлорид натрия, затем раствором бикарбоната натрия. Органическую фазу сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток обрабатывают с помощью 200 мл циклогексана и кристаллизуют. Сырой продукт затем перекристаллизовывают из 350 мл циклогексана и получают 49,3 г (выход 87%) целевого продукта в виде кристаллов белого цвета. Т. пл. 60oC. (α)
Приготовление 43. 1,1-Диметилэтиловый эфир[2-(метилсульфонилокси)-1(R)-метилэтил]карбаминовой кислоты
55 г (0,314 моль) продукта, полученного согласно приготовлению 42, растворяют в 600 мл дихлорметана и добавляют 90 г (0,89 моль) триэтиламина. Смесь охлаждают до -5oC и медленно добавляют раствор 51 г (0,445 моль) метансульфонилхлорида в 100 мл дихлорметана. Затем оставляют температуру повышаться до комнатной и выдерживают при перемешивании в течение 15 часов. Реакционную среду затем выливают в 200 мл воды со льдом. Органическую фазу промывают раствором хлорида натрия, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Таким образом получают 79 г (выход количественный) сырого целевого продукта в виде оранжевого цвета кристаллов, которые используют также для следующей операции, продукт может быть очищен путем перекристаллизации из гептана. Т.пл. 76oC.
(α)
Приготовление 44. 1,1-Диметилэтиловый эфир (2-циано-1(R)-метилэтил)карбаминовой кислоты
79 г (0,31 моль) соединения, полученного согласно приготовлению 43, растворяют в 600 мл диметилсульфоксида и добавляют 40,5 г (0,62 моль) цианида калия. Затем реакционную среду перемешивают при 50oC в течение 15 часов. После этого охлаждают и гидролизуют в 600 мл воды со льдом. Экстрагируют 4 раза 500 мл диэтилового эфира и органические фазы сушат над сульфатом магния. После концентрирования при пониженном давлении сырой продукт очищают путем хроматографии на силикагеле, элюируя смесью метилциклогексана с этилацетатом (8:2 по объему). Таким образом получают 42 г масла, которое кристаллизуется. После перекристаллизации из смеси метилциклогексана с диизопропиловым эфиром получают 33 г (выход 57%) целевого продукта в виде белых кристаллов. Т.пл. 70oC.
(α)
Приготовление 45. 1,1-Диметилэтиловый эфир (3-амино-1(R)-метилпропил)карбаминовой кислоты
Готовят раствор из 23,64 г (0,128 моль) соединения, полученного согласно приготовлению 44, в 500 мл этанола и добавляют 10 мл 1 н. раствора NaOH и 7 г никеля Ренея. Смесь перемешивают в течение 48 часов под давлением водорода 20•105. После отфильтровывания катализатора фильтрат нейтрализуют путем добавления 1 н. соляной кислоты и концентрируют при пониженном давлении. Остаток очищают путем хроматографии на силикагеле, элюируя смесью метилциклогексана с этилацетатом и гидроксидом аммония (7,5:2:0,5 по объему). Таким образом получают 22,1 г (выход 91,5%) чистого целевого продукта, который кристаллизуется. Т. пл. 73oC.
(α)
Приготовление 46. 1,1-Диметилэтиловый эфир[3-(фенилметиламино)-1(R)-метилпропил]карбаминовой кислоты
Готовят раствор из 22,1 г (0,117 моль) соединения, полученного согласно приготовлению 45, в 300 мл диэтилового эфира и добавляют 20 г молекулярных сит 3  , затем 12,47 г (0,117 моль) бензальдегида. Смесь перемешивают в течение 15 часов при комнатной температуре, затем удаляют молекулярные сита путем отфильтровывания, и фильтрат концентрируют при пониженном давлении. Таким образом получают 32,6 г промежуточного имина, который растворяют в 350 мл этанола. К раствору добавляют порциями 6,7 г (0,177 моль) боргидрида натрия, поддерживая температуру около 10oC. Затем перемешивают 3 часа, после чего концентрируют при пониженном давлении. Остаток обрабатывают с помощью 500 мл диэтилового эфира и органическую фазу промывают водой, сушат над сульфатом магния и концентрируют при пониженном давлении. После перекристаллизации остатка из циклогексана получают 32,5 г (выход 98%) целевого продукта в виде желтых кристаллов. Т. пл. = 79oC.
, затем 12,47 г (0,117 моль) бензальдегида. Смесь перемешивают в течение 15 часов при комнатной температуре, затем удаляют молекулярные сита путем отфильтровывания, и фильтрат концентрируют при пониженном давлении. Таким образом получают 32,6 г промежуточного имина, который растворяют в 350 мл этанола. К раствору добавляют порциями 6,7 г (0,177 моль) боргидрида натрия, поддерживая температуру около 10oC. Затем перемешивают 3 часа, после чего концентрируют при пониженном давлении. Остаток обрабатывают с помощью 500 мл диэтилового эфира и органическую фазу промывают водой, сушат над сульфатом магния и концентрируют при пониженном давлении. После перекристаллизации остатка из циклогексана получают 32,5 г (выход 98%) целевого продукта в виде желтых кристаллов. Т. пл. = 79oC.
(α)
Приготовление 47. 1,1-Диметилэтиловый эфир 9-циано-3(R)-метил-6-фенилметил-2,6-диазанонановой кислоты
Готовят раствор из 32 г (0,115 моль) соединения, полученного согласно приготовлению 46, и 18,2 г (0,175 моль) 4-хлорбутиронитрила в 300 мл бутанола. Добавляют 14,6 г (0,138 моль) карбоната натрия и 4,6 г иодида калия и кипятят с обратным холодильником при перемешивании в течение 15 часов. Концентрируют при пониженном давлении и остаток очищают путем хроматографии на силикагеле, элюируя смесью метилциклогексана с этилацетатом (8,2, затем 1:1 по объему). Таким образом получают 39 г (выход 98%) целевого продукта в виде очень вязкого желтого масла. (α)
Приготовление 48. 1,1-Диметилэтиловый эфир 10-амино-3(R)-метил- 6-фенилметил-2,6-диазадекановой кислоты.
Следуя методике, аналогичной приготовлению 45, работая под давлением водорода 3,5•105 Па и исходя из 32,8 г (95•10-3 моль) соединения, полученного согласно приготовлению 45, получают 33 г (выход 99%) целевого продукта в виде вязкого бесцветного масла.
(α)
1H-ЯМР-спектр (CDCl3): 1,04 (д., 3H), 1,35-1,08 (м., 17H), 2,3-2,5 (м., 4H), 2,64 (т., 2H), 3,44 (д., 1H), 3,61 (д., 1H), 3,62-3,8 (м., 1H), 5,6-5,8 (с.ш., 1H), 7,2-7,35 (м., 5H).
Приготовление 49. 1,1-Диметилэтиловый эфир 10-амино-3(S)-метил- 6-фенилметил-2,6-диазадекановой кислоты.
Вследствие реакций, аналогичных приготовлениям 42-48, исходя из 2(S)-аминопропанола, получают хиральное производное целевой конфигурации (S).
(α)
Приготовление 50. 1,1-Диметилэтиловый эфир 3-(R)-метил-10-[2,4- диоксооксазолидин-3-ил]-6-фенилметил-2,6-диазадекановой кислоты.
Следуя методике, аналогичной приготовлению 10, исходя из 1,8 г (5,5•10-3 моль) соединения, полученного согласно приготовлению 48, получают целевой продукт в виде белых кристаллов с выходом 90%. Т.пл. 62oC.
(α)
Приготовление 51. 1,1-Диметилэтиловый эфир 3(S)-метил-10[2,4- диоксооксазолидин-3-ил]-6-фенилметил-2,6-диазадекановой кислоты.
Согласно способу, идентичному приготовлению 50, исходя из соединения приготовления 49, получают целевой продукт в виде бесцветного масла. (α)
1H-ЯМР-спектр CDCl3): 1,05 (д., 3H); 1,35-1,65 (м., 15H); 2,35-2,65 (м., 4H); 3,4-3,75 (м., 5H); 4,67 (с., 2H); 5,2-5,4 (с.ш., 1H); 7,2-7,4 (м., 5H).
Приготовление 52. 1-(1,1-Диметилэтиловый) эфир 3(R)-метил- 6-фенилметил-13-окса-12-оксо-2,6,11-триазапентандикислоты
Согласно методике, аналогичной приготовлению 11, исходя из 2 г (4,6•10-3 моль) соединения, полученного согласно приготовлению 50, получают 2,1 г (выход 99%) целевого продукта в виде аморфных белых кристаллов. (α)
1H-ЯМР-спектр CDCl3): 1,17 (д., 3H); 1,25-2,1 (м., 15H); 2,35-3,3 (м., 8H); 3,45-3,7 (м. , 1H); 4-4,35 (м., 2H); 4,8-5,2 (м., 1H); 7,15-7,8 (м., 6H), 12,1-12,7 (с., 1H).
Приготовление 53. 1-(1,1-Диметилэтиловый эфир 3(S)-метил-6- фенилметил-13-окса-12-оксо-2,6,11-триазапентандикислоты
Следуя методике, аналогичной приготовлению 52, исходя из соединения, полученного согласно приготовлению 51, получают целевой продукт в виде аморфного твердого вещества белого цвета. (α)
Приготовление 54. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил]амино]-24(R)-метил-21-фенилметил-14- окса-12,15-диоксо-2,4,11,16,21,25-гексаазагексакоз-2-ен-дикислоты
Следуя методике, аналогичной приготовлению 16, исходя из 2,8 г (4,61•10-3 моль) соединения, полученного в приготовлении 52, получают 3,6 г (выход 99%) целевого продукта в виде бесцветного масла. (α)
1H-ЯМР-спектр (CDCl3): 1,01 (д. , 3H); 1,3-1,8 (м., 41H); 2,3-2,5(м., 3H); 2,5-2,65 (м., 1H); 3,05-3,2 (м., 2H); 3,2-3,3 (м., 2H); 3,35-3,5 (м., 3H); 3,6 (д. , 1H); 3,65-3,8 (м., 1H); 4,5 (с., 2H); 5,35-5,6 (м., 2H); 6,25-6,4 (с.ш., 1H); 7,2-7,35 (м., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 55. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -24(S)-метил-21-фенилметил-14- окса-12,15-диоксо-2,4,11,16,21,25-гексаазагексакоз-2-ен-дикислоты
Следуя методике, аналогичной приготовлению 54, исходя из 1,56 г соединения, полученного согласно приготовлению 53, получают целевой продукт в количестве 2,02 г (выход 74%) в виде бесцветного масла. (α)
Приготовление 56. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -24(R)-метил-14-окса-12,15- диоксо-2,4,11,16,21,25-гексаазагексакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 15, исходя из 3,6 г (4,5•10-3 моль) соединения, полученного согласно приготовлению 54, получают 3,2 г целевого продукта (выход 99%) в виде светло-желтого масла.
(α)
1H-ЯМР-спектр (CDCl3): 1,18 (д., 3H); 1,25-1,95 (м., 42H); 2,6-2,8 (м., 4H); 3,1-3,45 (м. , 6H); 3,7-3,9 (м., 1H); 4,54 (с., 2H); 4,65-4,8 (с.ш., 1H); 5,8-6,1 (с.ш., 1H); 6,4-6,6 (с.ш., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 57. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1-диметилэтокси)карбонил] амино] -24(S)-метил-14-окса-12,15- диоксо-2,4,11,16,21,25-гексаазагексакоз-2-ен-дикислоты.
Следуя методике, аналогичной приготовлению 56, исходя из 2,0 г (2,5•10-3 моль) соединения, полученного согласно приготовлению 55, получают целевого продукт в виде желтого масла. (α)
Пример 13. 2-{[[4-[[3(R)-(амино)бутил]амино]бутил]амино] карбонил}-N-[6-[(аминоиминометил)амино]гексил]ацетамид-трис (трифторацетат).
Следуя методике, аналогичный примеру 1, исходя 3,2 г (4,56•10-3) соединения, полученного согласно приготовлению 56, получают 2,48 г (выход 73%) целевого продукта в виде аморфного твердого белого вещества.
(α)
1H-ЯМР-спектр (DMCO-d6): 1,18 (д., 3H); 1,25-1,65 (м., 12H); 1,65-1,85 (м. , 1H); 1,85-2,0 (м., 1H); 2,85-3,15 (м., 10H); 3,2-3,35 (м., 1H); 4,33 (с. , 2H); 6,8-7,3 (с.ш., 3H); 7,32 (т., 1H); 7,62 (т., 1H); 7,86 (т., 1H); 7,9-8,05 (с.ш., 4H); 8,5-8,7 (с.ш., 2H).
13C-ЯМР-спектр (D2O): 18,01; 23,64; 26,19; 26,28; 26,76; 28,56; 28,93; 31,21; 39,77; 40,58; 41,87; 44,60; 46,10; 48,21; 63; 75; 157,55; 157,89; 171,44.
Полученное соединение в форме тристрифторацетата преобразуют в свободное основание, растворенное в органическом растворителе, затем в соль с помощью избытка соляной кислоты в этаноле и выделяют в форме твердого белого гигроскопического вещества путем кристаллизации в этаноле. Полученный таким образом хлоргидрат имеет следующие характеристики: Т.пл. 125oC и (α)
Пример 14. 2-{[[4-[[3(S)-(амино)бутил]амино]бутил]амино] карбонил}-N-[6-[(аминоиминометил)амино]гексил]ацетамид-трис- (трифторацетат)
Следуя методике примера 13 и исходя из 1,75 г (2,5•10-3 моль) соединения, полученного согласно приготовлению 57, получают 1,5 г (выход 82%) целевого продукта в виде аморфного твердого вещества. (α)
Приготовление 58. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1- диметилэтокси)карбонил]амино]-23(R)-метил-12,14-диоксо-20-фенилметил- 2,4,11,15,20,24-гексаазапентакоз-2-ен-дикислоты.
Следуя методике приготовления 18 и исходя из 4,88 г (11•10-3 моль) соединения, полученного согласно приготовлению 7 и 2,75 г (7,88•10-3 моль) соединения, полученного в приготовлении 48, получают 4,9 г (выход 80%) целевого продукта в виде вязкого масла,
(α)
1H-ЯМР-спектр (CDCL3): 1,02 (д., 3H); 1,25-1,85 (м., 41H); 2,25-2,7 (м., 4H); 3,05-3,8 (м., 11H); 5,2-5,4 (с.ш., 1H); 7-7,15 (с.ш., 1H); 7,15-7,4 (м. , 6H); 8,3 (т., 1H); 11,5 (с., 1H).
Приготовление 59. Бис-(1,1-диметилэтиловый) эфир 3-[[(1,1- диметилэтокси)карбонил] амино] -23(R)-метил-12,14-диоксо-2,4,11,15,20, 24-гексаазапентакоз-2-ен-дикислоты.
Следуя методике приготовления 15, но исходя из 4,9 г (6,32•10-3 моль) соединения, полученного согласно приготовлению 58, получают 4,32 г (выход 99%) целевого продукта в маслянистой форме.
(α)
1H-ЯМР-спектр CDCl3): 1,2 (д. , 3H); 1,25-2,0 (м., 42H); 2,6-2,8 (м., 4H); 3,16 (с., 2H); 3,2-3,55 (м., 6H); 3,6-3,85 (м., 1H); 4,75-4,95 (с.ш., 1H); 7,1-7,35 (с.ш., 1H); 7,65-7,8 (с.ш., 1H); 8,3 (т., 1H); 11,5 (с., 1H).
Пример 15. N-{4-[[3(R)-(амино-бутил]амино]бутил-N'-[6- (аминоиминометил)аминогексил]пропандиамид-трис-(трифторацетат).
Следуя методике, аналогичной примеру 1, исходя из 4,3 г (6,27•10-3 моль) соединения, полученного согласно приготовлению 59, после очистки путем хроматографии на силикагеле RP 18 и элюирования смесью воды с ацетонитрилом и трифторуксусной кислотой (8:1:1 по объему) получают 2,1 г (выход 46%) целевого продукта в виде прозрачного аморфного твердого вещества. (α)
1H-ЯМР-спектр (DMCO-d6): 1,2 (д., 3H); 1,2-1,65 (м., 12H); 1,65-1,85 (м. , 1H); 1,85-2,0 (м., 1H); 2,8-3,15 (м., 12H); 3,2-3,35 (м., 1H); 6,7-7,5 (с. ш., 3H); 7,62 (т., 1H); 7,7-8,2 (м., 6H); 8,3-8,8 (с.ш., 2H).
13C-ЯМР-спектр (D2O): 18,02; 23,71; 26,23; 26,35; 28,56; 28,74; 28,84; 31,23; 39,50; 40,31; 41,88; 44,30; 44,61; 46,10; 48,15; 115,25; 119,11; 158,30; 170,02; 170,34.
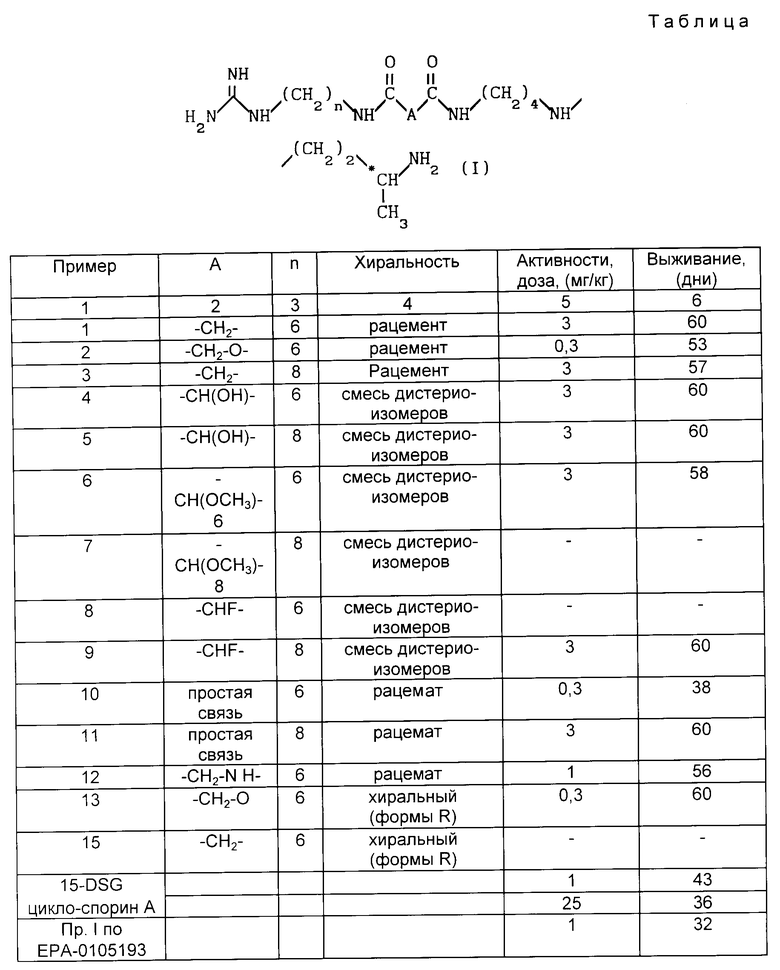
Иммунодепрессивная активность соединения согласно изобретения демонстрируется с помощью теста реакции трансплантата против хозяина. Самцов мышей B6D2F1 (гибриды первой генерации C57B1/6 x DBA/2) иммуноугнетают за счет интраперитональной (и.п.) инъекции циклофосфамида. Спустя три дня (день 0 эксперимента: ДО) они получают внутривенно 4•107 селезеночных клеток мышей C57B1/6. Животных затем распределяют на партии минимально по 8 особей и проводят ежедневную обработку в течение дней Д1-Д5 и Д7-Д10 путем интрапоритональных инъекций. Контрольной группе вводят только эксципиент. Наблюдают за гибелью мышей до дня Д60. Результаты, выражаемые в виде среднего значения выживания в виде количества дней на указанную дозу, представлены в таблице 1, где указанные величины являются показательными согласно тесту Логранка (вероятность ниже или равна 5%). Для сравнения в конце таблицы 1 приводятся значения, полученные при применении известных продуктов уровня техники: 15-дезоксиспергуалин (15-DSG) (циклоспорин А), который представляет собой в настоящее время стандартный иммунодепрессант, используемый в терапии, и продукт примера 1, описанный в европейской заявке на патент A-O 105 193. Из этого сравнения следует, что продукты согласно изобретению в 100 раз более активны, чем известные продукты уровня техники. Особенно продукты согласно изобретению обладают значительной активностью, начиная с 0,3 мг/кг (наиболее слабая испытуемая доза), тогда как сравнительный продукт примера 1 европейской заявки на патент A-O 105 193 обладает значительной активностью только начиная с 1 мг/кг, а циклоспорин A - начиная с 25 мг/кг.
Более того, соединения согласно изобретению обладают более высокой стабильностью в растворе, чем известные продукты уровня техники, в частности 15-дезоксиспергуалин.
Соединения, согласно изобретению, могут использоваться в терапии в качестве иммунодепрессивных лечебных или профилактических агентов, в частности для предупреждения отторжения аллогенных или ксеногенных органов, в том числе васкуляризованных; реакции трансплантата против хозяина в результате трансплантации, в том числе васкуляризованной; для лечения аутоиммунных заболеваний, генетических или приобретенных (например, диссеминированная эритематозная волчанка, бляшечный склероз, ревматоидный полиартрит); хронических воспалительных заболеваний, таких как, например, ревматизм суставов, а также для лечения любых патологий, где появляющееся иммунное нарушение является причиной или фактором, ответственным за сохранение ухудшенного клинического состояния.
Соединения согласно изобретению также можно вводить в дополнение к цитотоксическим противораковым лекарственным средствам, чтобы ограничивать их вторичные эффекты, и вводить дополнительно с продуктами, полученными методом биотехнологии, в частности с рекомбинантными цитокинами, моно- и поликлональными антителами, чтобы уменьшить появление защитных антител, продуцируемых пациентом.
Соединения, согласно изобретению, могут быть использованы для лечебной обработки паразитов, в особенности в случае малярии.
Соединения, согласно изобретению, можно вводить орально, путем инъекции (в частности, внутримышечно или внутривенно), топически (например, в виде крема для локального нанесения, в виде глазных капель), черескожно, ректально в виде свечей или путем ингаляции.
Соединения, согласно изобретению, также могут быть полезны в качестве фармакологических реактивов, особенно при исследовании аутоиммунных заболеваний.
Ниже приводятся примеры предпочтительных форм композиций согласно изобретению:
1. Раствор для инъекций:
активное начало - 2 г
(соединение примера 13)
хлорид натрия - 0,3 г
вода для инъекций - 100 мл
Раствор получают смешиванием указанных компонентов.
Полученный раствор стабилен в течение 6 месяцев при хранении его в холодильнике при температуре 2-6oC.
Для перфузионного вливания полученный раствор разводят перфузионной жидкостью и вводят из расчета ежедневной дозы активного начала 0,1-1 мг/кг.
Раствор может быть также помещен в шприцы емкостью 0,5 мл для подкожного введения, тогда осуществляют 1-5 инъекцией в течение суток.
2. Раствор для инъекций:
активное начало - 1 г
(соединение примера 1)
глюкоза - 1 г
вода для инъекций - 50 мл
Раствор получают смешиванием компонентов.
Полученный раствор стабилен в течение 6 месяцев при температуре 2-6oC.
3. Таблетка 0,2 г
активное начало (соединение примера 7) - 0,001 г
крахмал - 0,114 г
дикальций фосфат - 0,020 г
двуокись кремния - 0,020 г
лактоза - 0,030 г
тальк - 0,010 г
стеарат магния - 0,005 г
Твердую композицию в виде таблеток готовят путем смешивания активного начала с фармацевтическими добавками и подвергают таблетированию. На таблетки можно наносить покрытие из сахарозы, производного целлюлозы или других аналогичных веществ.
Изобретение относится в качестве новых промышленных продуктов к соединениям структуры, аналогичной таковой 15-дезоксиспергуалина, формулы I NH2C(= NH)NH(CH2)n - NHC(= О)AC(= О)NH(CH2)4NH(CH2)
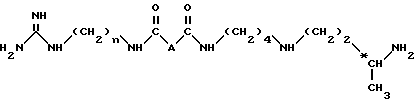
в которой А - простая связь, группа -CH2-, группа -CH2O-, группа - CH2NH-, группа -CH(OH)-, группа -CHF- или группа -CH(OCH3)-;
n = 6 или 8,
их кислотно-аддитивные соли.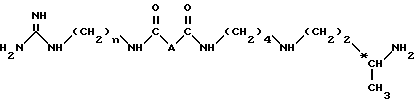
где А - простая связь, группа -CH2-, группа -CH2-O-, группа -CH2NH-, группа -CH(OH), группа -CHF- или группа -CH(OCH3)-;
n = 6 или 8,
или их кислотно-аддитивных солей, отличающийся тем, что он включает удаление защитных групп из соединения общей формулы II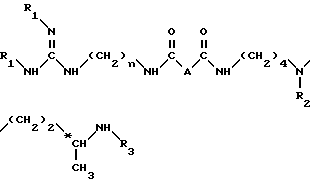
в которой А - простая связь, группа -CH2-, группа -CHF-, группа -CH(OCH3)-, группа -CH(OH)-, группа -CH(OCH2C6H5), группа -CH2O- или -CH2NH-;
n = 6 или 8:
R1, R2 и R3, идентичные или разные, представляют каждый алкоксикарбонильную группу, где радикал алкил является низшим алкилом, или арилоксикарбонильную группу, где радикал арил является 9-флуоренилметилом, фурфурилом, бензилом, 4-хлорбензилом или 4-метоксибензилом,
причем указанное удаление защитных групп включает в частности (а) обработку соединения общей формулы II с помощью сильной кислоты, если по крайней мере один из R1 - R3 обозначает алкоксикарбонильную группу, где радикал алкил является низшим алкилом, и/или (б) каталитическое гидрирование соединения общей формулы II, если по крайней мере один из R1 - R3 обозначает арилоксикарбонильную группу, где радикал арил обозначает 9-флуоренилметил, фурфурил, бензил, 4-хлорбензил или 4- метоксибензил, или если А - группа -CH(OCH2C6H5).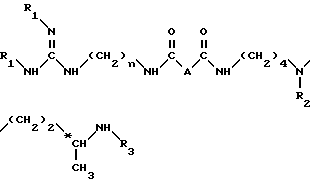
в которой А - простая связь, группа -CH2-, группа -CHF-, группа -CH(OCH3) группа -CH(OCH2C6H5);
n = 6 или 8;
R1 - R3, идентичные или разные, представляют каждый алкоксикарбонильную группу, где радикал алкил является низшим алкилом, или арилоксикарбонильную группу, где радикал арил является 9-флуоренилметилом, фурфурилом, бензилом, 4-хлорбензилом или 4-метоксибензилом,
отличающийся тем, что осуществляют конденсацию кислоты общей формулы III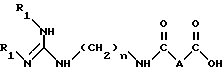
в которой n, А и R1 имеют указанные значения,
с амином общей формулы IV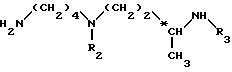
в которой R2 и R3, одинаковые или разные, каждый обозначает аминозащитную группу, указанную выше
путем активации кислоты либо с помощью агента сочетания карбодиимидного типа в присутствии нуклеофильного агента в органическом растворителе при 0 - 40oC, либо путем образования смешанного ангидрида, в частности, с помощью изобутилхлорформиата в присутствии основного агента, в органическом растворителе при -30 - +20oC, при этом используют 1 моль соединения общей формулы III на 1 моль соединения общей формулы IV для получения соединения общей формулы II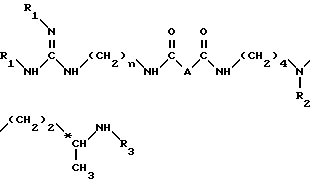
в которой n, А, R1 - R3 имеют указанные значения.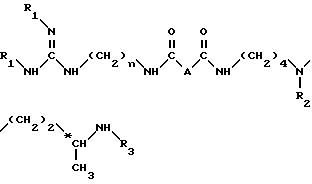
в которой А - простая связь, группа -CH2-, группа -CHF-, группа -CH(OCH3)-, группа -CH(OCH2C6H5)-;
n = 6 или 8;
R1 - R3, идентичные или разные, представляют каждый алкилоксикарбонильную группу, где радикал алкил является низшим алкилом, или арилоксикарбонильную группу, где радикал арил является 9-флуоренилметилом, фурфурилом, бензилом, 4-хлорбензилом или 4-метоксибензилом,
отличающийся тем, что осуществляют взаимодействие соединения общей формулы IV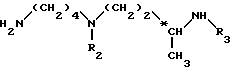
в которой R2 и R3, одинаковые или разные, каждый обозначает аминозащитную группу, указанную выше,
с кислотой или хлорангидридом кислоты общей формулы V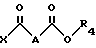
в которой Х - хлор или группа OH;
А имеет указанные значения;
R4 - алкильная группа с 1 - 3 атомами углерода линейная или разветвленная, или фенилметильная группа;
в органическом растворителе в присутствии активатора карбоксильной группы и нуклеофильного агента, если Х - группа OH, или в присутствии третичного амина, если Х - хлор, при 0 - 40oC, причем используют 1 моль соединения общей формулы IV на 1 моль соединения общей формулы V для получения соединения общей формулы VI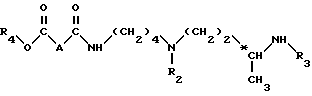
в которой А, R2 - R4 имеют указанные значения
омыляют полученное соединение в органическом растворителе в присутствии сильного основания для получения соединения общей формулы VII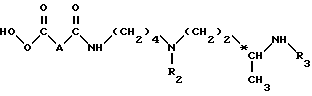
в которой А, R2 и R3 имеют указанные значения;
конденсируют соединения общей формулы VII с амином общей формулы VIII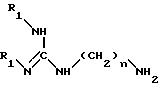
в которой n = 6 или 8;
R1 - аминозащитная группа, указанная выше,
в условиях, идентичных условиям конденсации по п.7, для получения соединения общей формулы II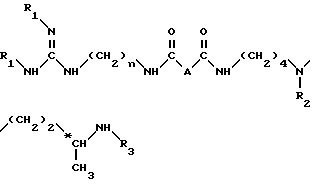
в которой А, n, R2 и R3 имеют указанные значения.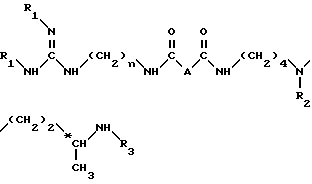
в которой А - группа -CH2NH-;
n = 6 или 8;
R1 - R3, идентичные или разные, представляют каждый алкилоксикарбонильную группу, где радикал алкил является низшим алкилом, или арилоксикарбонильную группу, где радикал является 9-флуоренилметилом, фурфурилом, бензилом, 4-хлорбензилом или 4-метоксибензилом,
отличающийся тем, что ацилируют концевую NH2-группу основания общей формулы IX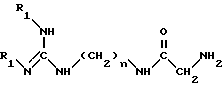
в которой R1 - аминозащитная группа, указанная выше;
n = 6 или 8,
с помощью хлорформиата или симметричного карбоната в инертном растворителе при комнатной температуре (15 - 25oC), полученное соединение подвергают аминолизу с помощью амина общей формулы IV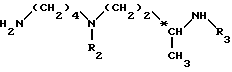
в которой R2 и R3, одинаковые или разные, каждый обозначает аминозащитную группу, указанную выше, в частности BOC-группу или фенилметильную группу,
в инертном растворителе для получения соединения общей формулы II
в которой n, R1 - R3 имеют указанные значения;
А - группа -CH2NH-.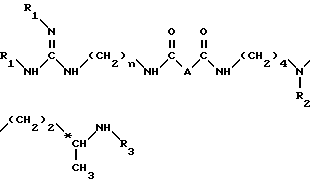
в которой А - группа -CH2O-;
n = 6 или 8;
R1 - R3, идентичные или разные, представляют каждый алкилоксикарбонильную группу, где радикал алкил является низшим алкилом, или арилоксикарбонильную группу, где радикал арил является 9-флуоренилметилом, фурфурилом, бензилом, 4-хлорбензилом или 4-метоксибензилом,
отличающийся тем, что вводят во взаимодействие амин общей формулы IV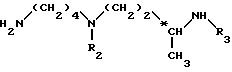
в которой R2 и R3 имеют значения, указанные выше,
с карбонатом общей формулы X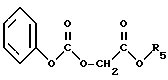
в которой R5 - алкильная группа с 1 - 3 атомами углерода или фенилметильная группа,
в инертном растворителе при температуре от комнатной до температуры кипения с обратным холодильником реакционной среды, при этом используют 1 моль соединения общей формулы IV на 1 моль соединения общей формулы X для получения соединения общей формулы XI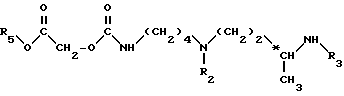
в которой R2, R3 и R5 имеют указанное значение,
или соединения общей формулы XI'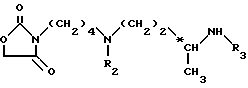
в которой R2 и R3 имеют указанное значение,
омыляют соединения общей формулы XI или XI' в органическом растворителе в присутствии сильного основания для получения соединения общей формулы XII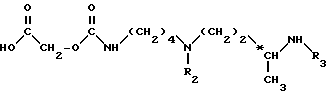
в которой R2 и R3 имеют указанное значение,
полученное соединение конденсируют с амином общей формулы VIII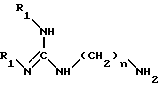
в которой n = 6 или 8;
R1 - аминозащитная группа, указанная выше,
в условиях, идентичных условиям конденсации по п.7, для получения соединения общей формулы II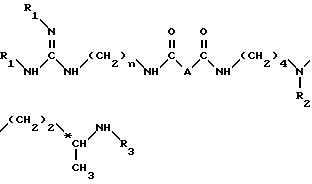
в которой n, R1 - R3 имеют указанные значения;
А - группа -CH2O.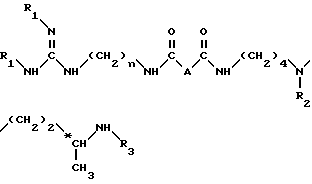
где А - простая связь, группа -CH2-, группа -CHF-, группа -CH(OH), группа -CH(OCH3)-, группа -CH(OCH2C6H5)-, группа -CH2O- или группа -CH2NH-;
n = 6 или 8;
R1 - R3, идентичные или разные, каждая является алкилоксикарбонильной группу, где радикал алкил - низшая алкильная группа, и арилоксикарбонильной группой, где арил - 9-флуоренилметил, фурфурил, бензил, 4-хлорбензил или 4-метоксибензил,
в качестве промежуточного соединения в синтезе соединений формулы I.
Приоритет по пунктам и признакам:
24.02.94 по пп.1, 6, 7, 11, 12, 2, 4, 5, 10, соединения формулы I, где А - группа -CH2- и -CH2O-;
01.06.94 по пп.1, 6, 7, 11, 12, 3, 8, 9, соединения формулы I, где А - группа -CH2-, -CH2O, -CH2NH-, CH(OH), -CHF, -CH(OCH3) и к энантиомерам.
| СПОСОБ ОБРАБОТКИ ВОДНО-СПИРТОВЫХ РАСТВОРОВ (СОРТИРОВОК) В водочном ПРОИЗВОДСТВЕ | 0 |
|
SU181592A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Прессоточка для круговой затяжки заготовки обуви с предварительно пришитым к ней рантом | 1955 |
|
SU105193A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-06-20—Публикация
1995-02-23—Подача