Изобретение относится к способу получения известного (Ia) и новых (Iб,в) соединений 2,6-дифтор-н-алкилбензолов общей формулы I, которые могут найти применение в синтезе N-ароил-N'-арилмочевиндействующих веществ гербицидов и инсектицидов, например дифлубензурона, хлорфлуразона, СМЕ-134, XRD-473 [1]
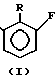 R=Me(a), Et(б), H-Ви(в)
R=Me(a), Et(б), H-Ви(в)
Близким по технической сущности и достигаемому результату является способ получения соединения (Ia) [2] заключающийся в последовательном действии на м-дифторбензол эквивалента амида натрия в среде жидкого аммиака (8%-ный раствор м-дифторбензола) при -33оС в течение 0,5 ч и иодистого метила (1,3 эквивалента) в течение 2 ч. Целевой продукт выделяют перегонкой остатка реакционной массы после испарения аммиака, промывания ее водой и сушки прокаленным сернокислым магнием. Выход соединения (Ia) составляет 70% Дополнительно 6% продукта выделяют экстракцией промывных вод хлористым метиленом, осушения экстракта, его упаривания и перегонки остатка. Полученное этим способом соединение (Ia) содержит 95% основного вещества (анализ методом ГЖХ).
Основными недостатками прототипа являются: применение в качестве алкилирующего агента дорогостоящего и малодоступного иодистого метила; получение только простейшего представителя 2,6-дифторалкилбензолов, тогда как возможность получения гомологического ряда соединений формулы (I) не установлена.
Оба указанных недостатка существенно снижают ценность способа в отношении его использования в практике: первый невысокая экономичность за счет использования СН3I; второй отсутствие универсальности может иметь принципиальное значение в синтезе N-ароил-N'-арилмочевин, поскольку известно, что алкилароматические соединения с числом атомов углерода в алкильном фрагменте большим, чем один, более предпочтительны для синтеза соответствующих бензонитрилов по реакции окислительного аммонолиза [3] имея ввиду последующий гидролиз 2,6-дифторбензонитрила с получением 2,6-дифторбензамида ключевого полупродукта в синтезе БАВ [1]
Цель изобретения разработка универсального и экономичного способа получения 2,6-дифтор-н-алкилбензолов.
Поставленная цель достигается способом получения соединений формулы (I), заключающимся в действии эквивалента амида натрия на м-дифторбензол в среде жидкого аммиака и затем хлористого алкила формулы н-AlkCl(Alk Me, Et, н-Bu).
Для достижения поставленной цель к суспензии амида натрия в жидком аммиаке, полученной взаимодействием растворенного натрия с аммиаком в присутствии каталитических количеств FeCl3 ˙ 6H2O, добавляют м-дифторбензол при -33оС и по прошествии 5-15 мин перемешивания в реакционную массу приливают хлористый алкил. Непрореагировавший амид натрия гасят хлористым аммонием и удаляют аммиак из реакционной массы самопроизвольным испарением. Конечный продукт соединение формулы (I) выделяют в индивидуальном состоянии путем перегонки с паром (Ia), расслаиванием разбавленной водой реакционной массы и перегонкой органической фазы (Iб), экстракцией реакционной массы хлористым метиленом с последующим упариванием экстракта и перегонкой продукта (Iв).
Отличительным признаком процесса является то, что для получения соединений формулы (I) раствор Nа-соли 2,6-дифторфенильного аниона в среде жидкого аммиака, полученный взаимодействием м-дифторбензола и амида натрия, обрабатывают хлористыми алкилами формулы н-AlkCl (н-AlkMe, Et, н-Bu). В отличие от йодистого метила в прототипе процесса н-AlkCl гораздо более доступны и дешевы. Возможность реализации заявляемого процесса не являлась очевидной, поскольку известно, что подвижность атома галогена в реакциях нуклеофильного замещения в алифатическом ряду резко уменьшается при переходе от йод- к хлорпроизводным, а также с увеличением длины алкильного фрагмента [4]
Новизна заявляемого способа состоит в установлении возможности получения гомологического ряда соединений формулы (I), при этом используется универсальная технология, а м-ДФБ доступен.
Поскольку аммиак после проведения процесса испаряют из реакционной массы, имеется возможность регенерировать его или поглощать водой. В заявляемом процессе показана возможность его переконденсации и повторного использования без ущерба для качества получаемых соединений.
П р и м е р 1. В круглодонную стеклянную колбу емкостью 1 л, снабженную лопастной мешалкой, термометром и газоотводной трубкой, помещают 500 мл жидкого аммиака, 0,33 г хлористого железа и 23,3 г металлического натрия, порциями по 1-2 г с интервалом 5 мин. После образования амида натрия прибавляют 88,9 г м-дифторбензола по каплям. Реакционную массу перемешивают в течение 15 мин, затем прибавляют по каплям 55,5 мл жидкого хлористого метилена и выдерживают при перемешивании 20 мин. Гашение непрореагировавшего амида натрия осуществляют добавлением 10,7 г твердого хлористого аммония к реакционной массе. Отгоняют аммиак самопроизвольным испарением. Остаток перегоняют с паром. Полученный дистиллят расслаивают в делительной воронке, нижний органический слой сушат гранулированным CaCl2 и перегоняют. Получают 85,0 г (выход 84,5% ) 2,6-дифтортолуола (СОВ 99,0% 0,7% дифторэтилбензола, 0,3% высококипящих примесей), т. кип. 110-112оС, плотность 1,062 г/см3, nD20 1,4518.
П р и м е р 2. Эксперимент проводят с использованием тех же количеств реагентов аналогично описанному в примере 1 с использованием 435 мл возвратного аммиака из предшествующих экспериментов и 65 мл свежего аммиака. Получают 83,6 г (выход 83,1%) 2,6-дифтортолуола (СОВ 99,4% 0,6% высококипящих примесей).
П р и м е р 3. К 150 мл жидкого аммиака в двугорлой колбе емкостью 300 мл, снабженной мешалкой, добавляют при перемешивании 3,35 г натрия и 0,01 г хлористого железа. После исчезновения синей окраски по каплям прибавляют в течение 5 мин 15,9 г м-дифторбензола и в течение 20 мин 12,6 г хлористого этила. После испарения аммиака к остатку добавляют 150 мл воды, отделяют в делительной воронке нижний органический слой, который сушат сульфатом магния и фильтруют. Получают 16,9 г 2,6-дифторэтилензола (СОВ 95% м-дифторбензол 4% ) с выходом 85% Перегонкой получают 15,5 г продукта с т. кип. 129-130оС, содержащего 99% основного вещества (данные ГЖХ). Найдено, C 67,9; H 4,72; F 26,8. C8H8F2. Вычислено, C 67,6; H 5,05; F 26,7. Спектр ПМР (р-р в ацетоне-d6), δ, м. д. 1,19 (триплет, J 7,5 Гц, СН3), 2,70 (квартет, J 7,5 Гц, СН2), 6,96 и 7,27 (мультиплеты, протоны ароматического кольца). Соотношение интенсивностей сигналов 3:2:2:1.
П р и м е р 4. К суспензии амида натрия, приготовленной аналогично описанному в примере 3 из 0,7 г натрия в 100 мл жидкого аммиака, прибавляют 3,0 г м-дифторбензола и через 10 мин 5,4 г 1-хлорбутана. После испарения аммиака при постоянном перемешивании добавляют 70 мл воды и экстрагируют хлористым метиленом 3х50 мл. Сушат сульфатом магния, растворитель отгоняют на ректификационной колонке, остаток перегоняют в вакууме водоструйного насоса, собирая фракцию с т. кип. 63-73оС. Получают 4,0 г 2,6-дифторбутилбензола. Выход 89,5% (СОВ > 99%). Найдено, C 69,6; H 6,90; F 22,4. C10H12F2. Вычислено, C 70,6; H 7,06; F 22,3. Спектр ПМР (без растворителя), δ, м.д. 0,8-1,6 (β, γ-СН2, СН3), 2,6 (триплет, J 7,0 Гц α-СН2), 6,3-7,1 (мультиплет, протоны ароматич. кольца).
Таким образом, предлагаемый способ получения соединений формулы (I) обладают по сравнению с прототипом следующими преимуществами:
универсальностью, поскольку позволяет в рамках одной технологии осуществить синтез гомологического ряда соединений формулы (I);
экономичностью, поскольку предполагает использование более дешевых и доступных хлористых алкилов.
Использование: 2,6-дифтор-н-алкилбензолы используется в синтезе действующих веществ гербицидов и инсектицидов. Сущность изобретения: реагент 1 - 1,3-дифторбензол; реагент 2 - алкил (метил, этил, н-бутил) хлорид. Условия реакции: алкилирование в присутствии амида натрия в среде жидкого амиака. Преимущество способа заключается в универсальности способа и использовании дешевых хлоралкилов.
СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИФТОР-Н-АЛКИЛБЕНЗОЛОВ общей формулы 2,6-F2C6H3-Alk-H(h-Alk Me, Et, h-Bu) алкилированием 1,3-дифторбензола галоидным алкилом в присутствии амида натрия в среде жидкого аммиака, отличающийся тем, что в качестве галоидных алкилов используют соответствующие h-AlkCl.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Ингольд К | |||
| Теоретические основы органической химии | |||
| М.: Мир, 1973, с.362, 376. | |||
Авторы
Даты
1995-05-20—Публикация
1992-06-30—Подача