Изобретение относится к новым химическим соединениям, конкретно к производным 1,2-бис-(5-фенилоксазолил-2)бен- зола формулы I
R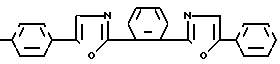 где R H (a); C6H5 (b); N(CH3)2 (c); CH3 (d).
где R H (a); C6H5 (b); N(CH3)2 (c); CH3 (d).
1,2-бис-(5-Фенилоксазолил-2)бензол проявляет свойства органического люминофора синего свечения с аномально большим стоксовым сдвигом, у которого спектр люминесценции практически не перекрывается со спектром поглощения. Поэтому в его спектрах практически отсутствует реабсорбция, снижающая прозрачность полученных из него полимерных материалов к собственному излучению. Наличие указанных свойств позволяет эффективно использовать соединения формулы I в сцинтилляционных системах, имеющих большую протяженность.
Среди люмионофоров наиболее близким по полосе испускания света к заявляемому соединению является 1,3,5-трифенил-2-пиразолин (II) ( λmax поглощения 390 нм, λmax люминесценции 450 нм) [1]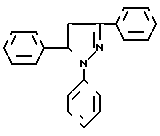
Это соединение широко используется в качестве оптического отбеливателя, активирующей добавки в жидких и пластмассовых сцинтилляторах. 1,2,3-Трифенил-2-пиразолин является одним из лучших активаторов для жидких сцинтилляторов. Сцинтилляторы на его основе обладают высокой сцинтилляционной эффективностью и устойчивостью к излучению. Кроме того, он относительно доступен и дешев в производстве.
Недостатком 1,2,3-трифенил-2-пиразолина является его небольшой стоксов сдвиг (60 нм) и значительное перекрывание спектров поглощения и испускания, что приводит к снижению прозрачности в сцинтилляторах большой протяженности и ограничивает его применение.
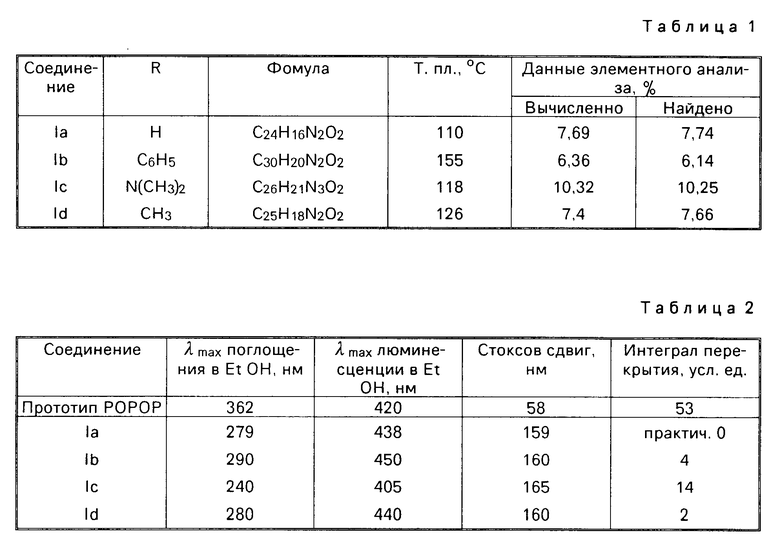
Наиболее близким по структуре и заявляемым химическим соединениям является 1,4-бис-(5-фенилоксазолил-2)бензол (III), известный по торговым названием (РОРОР), выпускаемый промышленностью и широко применяемый как добавка в пластмассовых сцинтилляторах.
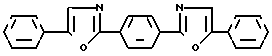
РОРОР является эффективным люминофором синего свечения (λmax поглощения 362 нм, λmax люминесценции 420 нм, стоксов сдвиг 58 нм).
РОРОР получают конденсацией дихлорангидрида терефталевой кислоты с ω-аминоацетофеноном гидрохлоридом с последующей циклодегидратацией полученного соединения в серной кислоте [2]
РОРОР обладает теми же недостатками, что и 1,3,5-трифенил-2-пиразолин, это небольшой (58 нм) стоксов сдвиг и также значительное перекрытие спектров люминесценции и поглощения, а так как доля теряемого флуоресцентным красителем света пропорциональна числу актов перепоглощения, то в его спектрах наблюдается реабсорбция, отрицательно сказывающаяся на прозрачности окрашенных им полимерных материалов к свету собственного излучения. Для эффективного использования люминофора в полимере его спектры люминесценции и поглощения должны быть достаточно разнесены (иметь большой стоксов сдвиг) и минимальный интеграл перекрытия. Это особенно важно при создании сцинтилляционных полимерных систем, где прозрачность материала к собственному излучению красителя играет основную роль. Описанное соединение выбрано в качестве прототипа как наиболее близкое по структуре и области свечения.
Целью изобретения является выявление новых химических соединений в ряду структурных аналогов, обладающих интенсивной флуоресценцией, большим стоксовым сдвигом и меньшим перекрытием спектров поглощения и флуоресценции.
Поставленная цель достигается новой химической структурой, выраженной формулой I
R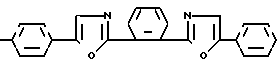 где R H (a); C6H5 (b); N(CH3)2 (c); CH3 (d).
где R H (a); C6H5 (b); N(CH3)2 (c); CH3 (d).
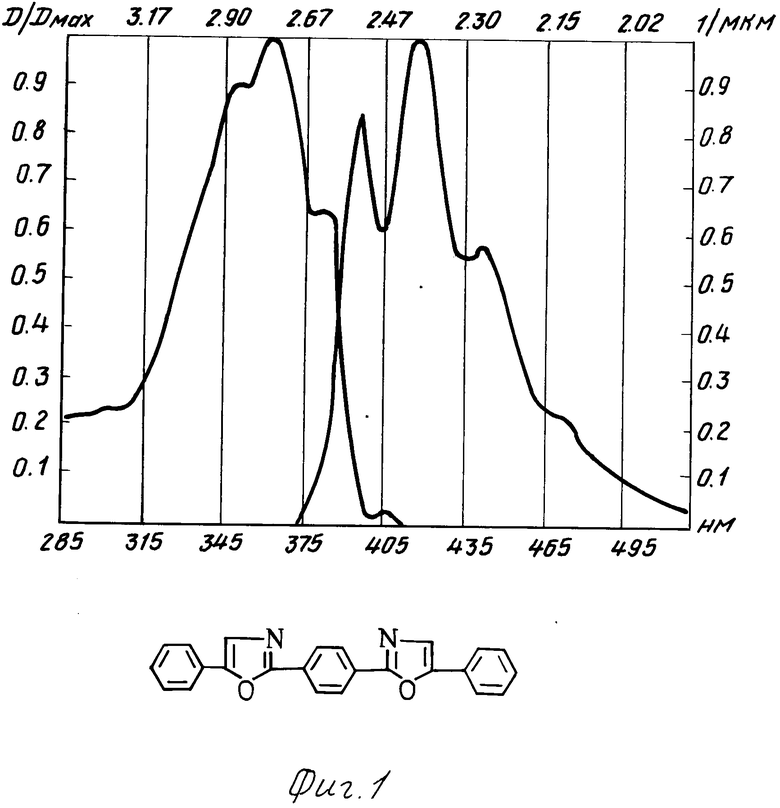
Неожиданным для данной структуры является тот факт, что, например в соединении (I)a положение полосы флуоресценции практически совпадает с положением полосы флуоресценции РОРОРа, а полоса поглощения соединения (I)a в сравнении с РОРОРом значительно смещена в коротковолновую область, причем она является даже боле коротковолновой, чем полоса поглощения 2,5-дифенилоксазола (РРО). Это связано с тем, что в невозбужденном состоянии молекула соединения I испытывает значительные стерические затруднения. В результате взаимного отталкивания фенилоксазольных фрагментов плоское строение нарушается, что приводит к потере сопряжения между фрагментами молекулы. При возбуждении молекула упрощается и сопряжение восстанавливается. Таким образом, поглощают свет отдельные несопряженные фрагменты, п-электронная система которых значительно отличается от п-электронной системы РОРОРа, этим объясняется большая разница в их спектрах поглощения. В то же время в возбужденном состоянии п-электронная система упрощенной молекулы соединения I аналогична п-электронной системе изначально плоской молекулы РОРОРа, поэтому их полосы испускания практически совпадают. Интересным является тот факт, что введение заместителей в пара-положение концевого фенильного кольца вызывает общее изменение положения полос поглощения люминесценции и поглощения соединений I (a-d), но стоксов сдвиг при этом практически не меняется (около 160 нм).
Соединения I(a-d) получают конденсацией хлорангидрида 2-(5-фенилоксазолил-2)бензойной кислоты с соответствующим ω-аминоацетофеноном гидрохлоридом и последующей циклодегидратацией полученного соединения в серной кислоте. В свою очередь 2-(5-фенилоксазолил-2)бензойную кислоту синтезируют из фенациламида фталевой кислоты, полученного взаимодействием ω-аминоацетофенона гидрохлорида с фталевым ангидридом, циклодегидратацией в серной кислоте.
П р и м е р 1. Получение 1,2-бис-(5-фенилоксазолил-2)бензола.
В круглодонной колбе емкостью 400 мл, снабженной обратным холодильником, кипятят 26,9 г (0,1 моль) 2-(5-фенилоксазолил-2)бензойной кислоты в 300 мл хлористого тионила в течение 2 ч. Затем отгоняют избыток хлористого тионила (до объема 60-80 мл), добавляют 100 мл бензола, отгоняют азеотроп бензола и хлористого тионила. Добавление бензола и отгонку азеотропа повторяют еще дважды. Затем в колбу добавляют 100 мл бензола. Образующийся бензольный раствор хлорангидрида используют в следующей стадии синтеза. В круглодонной колбе, емкостью 400 мл, снабженной механической мешалкой, растворяют в минимуме воды 17,1 г ω-аминоацетофенона гидрохлорида. Затем при комнатной температуре в интенсивном перемешивании в один прием добавляют весь бензольный раствор хлорангидрида и приливают небольшими порциями насыщенный раствор соды до рН 8. После этого раствор при той же температуре выдерживают 2 ч. Выпавший осадок отфильтровывают, промывают водой и сушат. Затем в круглодонной колбе емкостью 500 мл высушенный продукт растворяют при интенсивном перемешивании и комнатной температуре в концентрированной серной кислоте. Перемешивают раствор в течение 2 ч при этой же температуре. Образовавшийся темно-коричневый раствор выливают на лед. Выпавший осадок отфильтровывают, промывают водой и сушат. Выход 23,8 г (64%). Очищают полученный 1,2-бис-(5-фенилоксазолил-2)бензол на хроматографической колонке непрерывного действия (сорбент силохром, элюент гексан). Т.пл. 110оС.
Остальные соединения получают аналогично.
Температуры плавления и данные элементного анализа приведены в табл. 1.
Строение полученных соединений подтверждено данными ИК-спектроскопии. На спектрограммах, записанных в твердой фазе (таблетки КВr), проявляется большое число полос, связанных с наличием оксазольного (770-780 и 1530-1600 см-1) и бензольного (600-650, 800-840, 1000-1030 и 1600-1620 см-1) циклов.
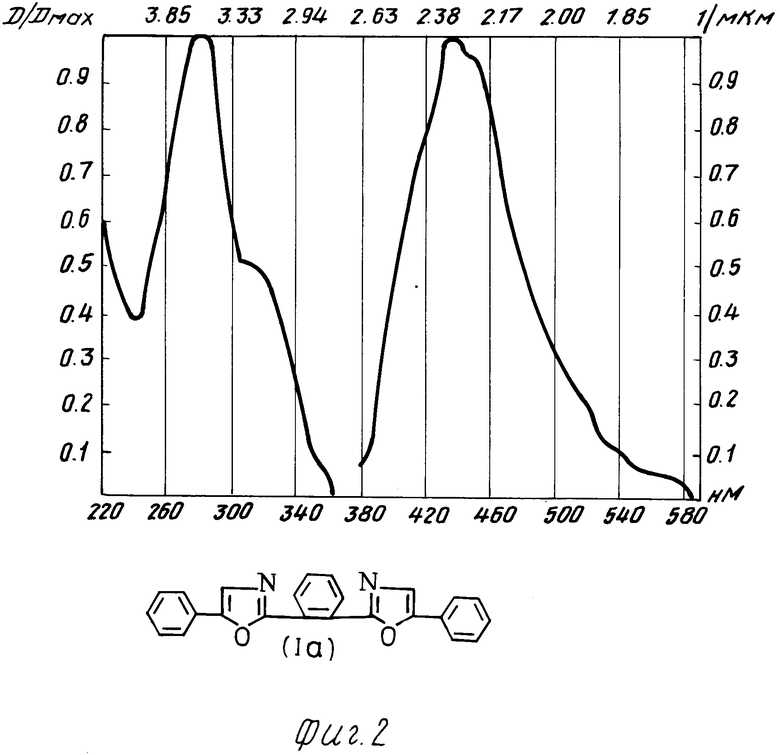
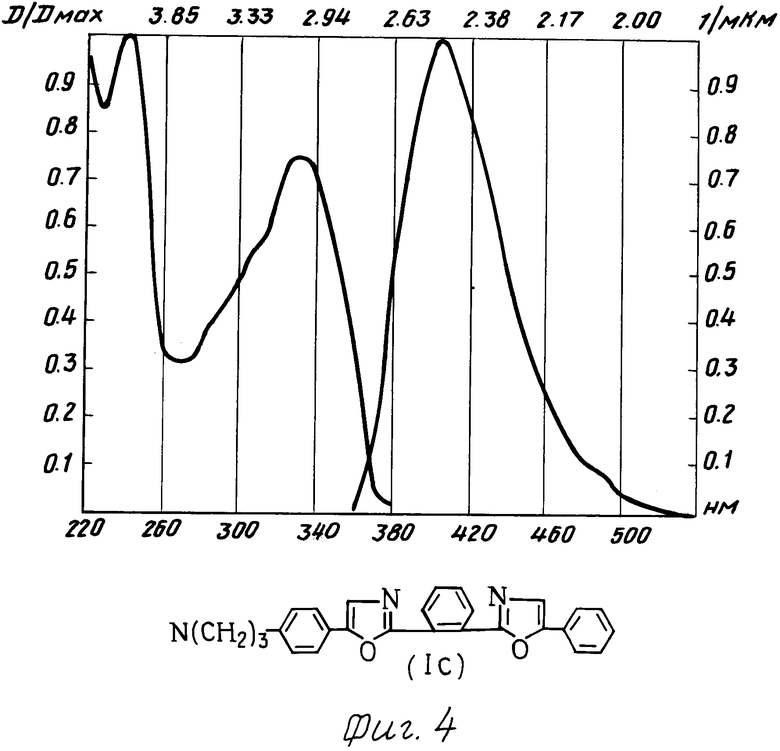
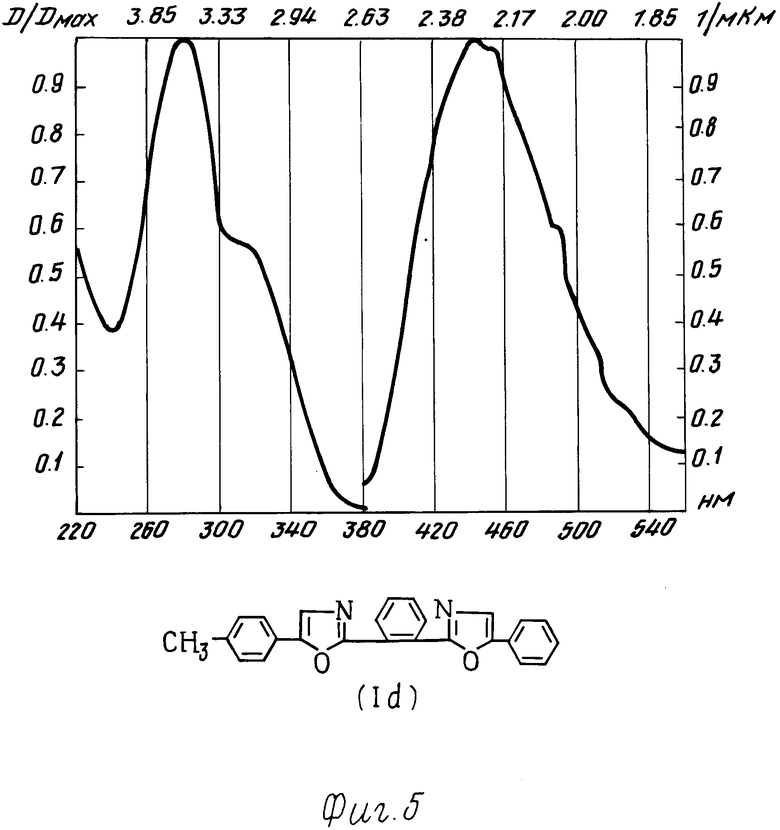
Испытания производных 1,2-бис-(5-фенилоксазолил-2)бензола в качестве органического люминофора: были измерены спектры поглощения и люминесценции и определен стоксов сдвиг заявляемых химических соединений и для сравнения прототипа (см. фиг. 1 прототип, фиг. 2-5 соединения I a-d).
Спектры поглощения измеряли на спектрофотометре "Specord М-40"; спектры люминесценции на установке, состоящей из зеркального монохроматора ЗМР-3, приемника оптического излучения ФЭУ-18, микроамперметра М-95. Фотолюминесценция возбуждалась лампой СВДШ-500, из спектра которой кварцевым монохроматором ДМР-4 выделяли свет с длиной волны 313 нм. Величину стоксова сдвига определяли как разницу максимумов полос люминесценции и поглощения.
Интеграл перекрытия вычисляли как площадь перекрытия спектров поглощения и люминесценции. Данные испытания приведены в табл. 2.
Как видно из таблицы, заявляемые химические соединения имеют существенные преимущества перед прототипом. Так, стоксов сдвиг его в эталоне примерно в 3 раза превышает стоксов сдвиг ранее известного соединения аналогичного строения (прототипа). Интеграл перекрытия его спектров поглощения и люминесценции значительно меньше (примерно в 5-10 раз) соединения аналогичного строения (прототипа).
Указанные преимущества заявляемых соединений позволяет их эффективно использовать в сцинтилляционной технике. Изготовление крупногабаритных блоков на их основе позволит значительно увеличить светопередачу и тем самым увеличить их эффективность. Использование указанных соединений даст возможность значительно повысить качество выпускаемых люминесцентных материалов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИАРИЛОКСАЗОЛОВ | 1992 |
|
RU2057127C1 |
| ЖИДКИЙ СЦИНТИЛЛЯТОР | 1995 |
|
RU2094824C1 |
| ПЛАСТМАССОВЫЙ СЦИНТИЛЛЯТОР | 1991 |
|
RU2012904C1 |
| ПЛАСТМАССОВЫЙ СЦИНТИЛЛЯТОР | 1990 |
|
RU1722158C |
| 2-(5-ФЕНИЛОКСАЗОЛИЛ-2)-5-(5-АРИЛОКСАЗОЛИЛ-2)-БЕНЗОЙНЫЕ КИСЛОТЫ В КАЧЕСТВЕ ОРГАНИЧЕСКИХ ЛЮМИНОФОРОВ СИНЕ-ЗЕЛЕНОГО СВЕЧЕНИЯ В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ И ВОДНОЙ СРЕДЕ | 1982 |
|
SU1078859A1 |
| СПОСОБ ОТБОРА ПАРАТЕРФЕНИЛА ДЛЯ ПЛАСТМАССОВЫХ СЦИНТИЛЛЯТОРОВ | 1990 |
|
RU2025716C1 |
| Производные 1,4-бис-(5-арилоксазолил-2)-бензола в качестве органических люминофоров сине-зеленого свечения | 1983 |
|
SU1082787A1 |
| 1-(5-Фенилоксазолил-2)-4-[5-(X-пиридил)-1,3,4-оксадиазолил-2]бензолы в качестве люминесцирующих добавок органических сцинтилляторов | 1982 |
|
SU1063053A1 |
| СПОСОБ ПОЛУЧЕНИЯ КРУПНОГАБАРИТНЫХ ПЛАСТМАССОВЫХ СЦИНТИЛЛЯТОРОВ | 1991 |
|
RU2031902C1 |
| 2-(2-Карбоксифенил)-5-арилоксазолы в качестве органических люминофоров сине-фиолетового свечения в органических растворителях и водной среде и способ их получения | 1981 |
|
SU1051083A1 |
Использование: в качестве органического люминофора синего свечения. Сущность изобретения: продукт-производные 1,2-бис- (5-фенилоксазолил-2)бензола ф-лы I, где a) R=H,БФ C24H16N2O2, выход 64% т.пл. 110°С. b) R- C6H5, БФ C30H20N2O2, т.пл. 155°С. c) R N(CH3)2, БФ C26H21N3O2, т.пл. 118°С. d)R CH3, БФ C25H18N2O2, т. пл. 126°С. Реагент 1: 2-(5-фенилоксазолил 2)бензойной кислоты. Реагент 2: SOCl2 с последующей обработкой образовавшимся хлорангидридом соответствующего ω -аминоацетофенона гидрохлорида. Условия реакции: 2 ч при кипячении, дальнейшая обработка хлорангидридом проводится при 20°С. 5 ил. 2 табл. Ф-ла I: 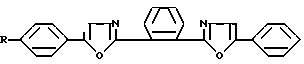
Производные 1,2-бис(5-фенилоксазолил-2)бензола общей формулы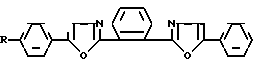
где R H, C6H5, N(CH3)2, CH3,
в качестве органического люминофора синего свечения.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Люминесцентные материалы и химические вещества | |||
| Каталог - Отделение НИИТЭХим, Черкассы, 1975. | |||
Авторы
Даты
1995-07-20—Публикация
1992-01-09—Подача