00
оо Изобретение относится к нооым хи мическим сое динениям, в частности к 2--(2-кярбоксифенил)-5-лрилокслгшлам общей формулы Соон где Аг - фенил, t1 -биф нилил, 1-нафтил,И -толил, 2,4,5-триметилфенил или ц-анизил, обладающим свойствами органических люминофоров, а также к способу их получения. Указанный соединения ИНТРНСИВИО флуоресцируют в органических раство рителях, а при растворении в водньгх растворах телочей или аммиака образуют хорошо растворимые в воде и ин тенсивно люминесцируюпше соли. Эти свойства позволяют предполагать воз можность применения 2-(2-карбокси V ,фенил;-5-арилоксазолов для создания целого ряда высокоэффективных органических люминесцентных материалов, таких как жидкие или пластмассовые сцинтилляторы или оптические отбеливатели. Ближайшими структурными аналогами соединений формулы I являются 2,5-диарилоксазолы, простейший из которых 2,5-диЛенилоксазол (РРО) формулы который представляет собой эффектив ный органический люминофор, широко используемый в сцинтилляционной технике Ij . 2,5-Дифенилоксазол получают конденсацией хлорангидрида бензойной кислоты с Со -аминоацетофеноном и последующей циклодегидратацией образующегося фенациламида в концентрированной серной кислоте или хлорокиси фосфора. 2,5-Дифенилоксазол применяют тол ко в органических средах, так как в водньгх средах он практически нераст ворим. Кроме того, исходный продукт его синтеза - хлористый бензоил малоустойчивое вещество, требущее для своего получения токсичных хлор производных фосфора или серы, таких как хлористый тионип, пяти- или треххлористый фосфор. 2 Известны также А-(5-арилоксазолил-2)-фталевые кислоты формулы dOOH .и dooH г которые являются органическими люминофорами, флуоресцирующими как в органических растворителях, так и в воде. Их получают длительным кипячением тримеллитовой кислоты в избытке хлористого тионила, образующийся ее монохлорангидрид подвергают реакции конденсации с GO -аминометиларилкетоном и полученный при этом ариламид npeBparuiWT в конечный продукт циклодегидратацией в концентрированной серной кислоте 2j , Исходный продукт - тримеллитовая кислота - является технологически труднодоступным продуктом. А-(5-Арилоксазолил-2 -Лталевые кислоты практически иерастворим г в углеводородньк растворителях и обладают лишь незначительной растворимостью в водных средах. В то же время для получения целого ряда люминесцентных материалов (оптических отбелинателей, органических сцинтилляторов, материалов для люминесцентной дефектоскопии ) необходимы люминофорьЛ с хорошей растворимостью как в органических растворителях, так и в водньгх средах. Способ получения этих соединений длительный и трудоемкий, требует использования труднодоступной тримеллитовой кислоты, токсичного хлористого тионила и идет через промежуточное образование легкоразлагающегося моиохлорангидрида тримеллитовой кислоты. Цель изобретения - органические люминофоры сине-фиолетового свечения, люминесцирующие как в органических растворителях, так и в водных средах, с повьшенной растворимостью, а также способ их получения, исключающий использование из процесса токсичных и легкоразлагающихся веществ. Поставленная цель достигается тен, что соединение формулы Г применяют в качестве органических люминофоров сине-фиолетового свечения в органических растворителях и водной среде. Соединения формулы I получают вз имодействием фталевого ангидрида с соответствующимW-амииометиларилкет ном в органическом растворителе и последующей циклодегидратацией полу чениого при этом ариламида в концентрированной серной кислоте. Лучшие выходы достигаются в ацетоне. Соединения формулы I интенсивно люминесцируют как в органических растворителях, так и в водных средах. Наличие в структуре соединений формулы Т карбоксильной группы в оположении к оксазольному циклу обуславливает их хорошую растворимость как в углеводородных растворителях, так и в водной среде. Так, например, растворимость их в водной ереде в 8-20 раз превышает растворигюсть ранее известных 4- 5-арилоксазолил-2) -фталевых кислот .Полученные соединения могут быть широко использованы в качестве эффектинных органических лю в нoфopoв, как в органических растворителях, так и в водной среде. Преимуществами способа получения соединений формулы I являются доступность исходного сырья и технологичность процесса. Использование фталевого ангидрида в качестве исходного продукта синтеза 2-(2-карбоксифенил)-5-арилоксазолов вме то хлористого бензоила при получении РРО или монохлораигидрида триметиллитовой кислоты при получении 4-(5-арилоксазолил-2 -фталевых кислот позволяет не только улучшить их люминесцентные свойства, но и исключить из производства легкоразлагакнциеся и токсичные вещества (хлористьй беизоил, монохлорангидрид тримеллитовой кислоты, хлористый тионил). Поскольку фтапевый ангидрид и ()-аминометш1арилкетоны не относятся к числу токсичных и легко разлагающихся веществ, отпадает необходимость в сложном технологическом вформлении процесса. Пример 1. Получеиие 2-{2-карбоксифенил)-5-фенилоксазола. К смеси растворов 16 г (0,11 мол фталевого ангидрида в 160 мл хлороЛорма и 17 г (о, 1 моль) гндрозЫорида (ij-аминоацетофенона в 170 мл воды пр интенсивном перемешивании и 20-г25 с по каплям прибавляют 10%-ный раствор соды до слабощелочной реакции на . Смесь перемешивают в течение 1 ч подкисляют 10%-ным раствором соляной кислоты, выпавший осадок отфильтровывает, промьшают водой, сушт. Высушенный сероватотбелый порошок ациламида фталевой кислоты растворяют при комнатной температуре в 10-кратном по весу) количестве серной кислоты. Полученный при этом темно-коричиевый раствор выдерживают при комнатной температуре в течение 2 ч и выпивают на лед. Выпавший осадок отфильтровывают, промывают водой до нейтральной реакции на лакмус, сушат. Выход 16 г (60%). Продукт очищают путем двукратной перекристаллизации из уксусной кислоты. Т.ПЛ.. Найдено,%: С 72,3; Н 4,4;N 5,2, С(ьН,МПз Вычислено,%: С 72,5; Н 4,2; N 5,3. Ащд юминесценции в толуоле 392 им. Абсолютный квантовый выход в толуоЛе П р и м е р 2. Получение 2-(2-карбоксифенил -5-фенилоксазолл. К раствору 16 г (0,11 моль) фталевого ангидрида и 17 г(0,1 моль) 1-идрохлорида Oil -аминоацетофенрна. в 300 мл ацетона при интенсивном перемешивании и 20-25 С по каплям прибавляют 10%-ный раствор соды до сла бощелочной реакции на лакмус. Смесь перемешивают в течение 1 ч,разбавляют 500 МП воды, подкисляют раствором соляной кислоты, выпавший осадок отфильтровьшают, промывают водой, сушат. Выпавший серовато-белый поропок ациламида фталевой кислоты растворяют при комнатной температуре в течение 2 ч и выливают на лед,.Вьтавший осадок отфильтровывают, промывают водой до иейтральной реакции на лакмус, сушат. Выход 21,2г (80%). Продукт очищают путем двукратной перекристаллизации из уксусной кислоты. Т.пл. 182-1ЙЗ С. Найдено,%: С 72,7; Н 4,lj N5,5. Н N0, Вычислеио,%: С 72,5; Н 4,2; N 5,3. люминесценции в толуоле 393 нм. Абсолютный квантовый выход в толуоле 0,35. П р и м е р 3. Получение 2-(2-к арбоксифенил)-5-(А-бифенил)-оксазола . Реакцию проводят аналогично примеру 2 исхидя из 16 г (р,II моль) фталевого ангидрида и 24,5 (о, 1 моль) гидрохлорида CJ -аминометил-4-бифенилилкетона, растворенных в 300 мл ацетона. Выход целевого продукта 30,3 г (85%). Продукт, очищают двойHbiM переосаждением из 5%-ного раствора аммиака 5%-ным раствором соляной кислоты. Т.пл, 308-309 С. Найдено.,%: С 77,6; Н 4,3; N 4,2, Cj,H,,NO, Вычислено,%: С 77,4; Н 4,4; N 4, мацс люминесценции в толуоле 410 нм. Абсолютный квантовый выход в толуоле 0,50. П р и м е р 4. Получение 2-(2-ка боксифенил)-5- 4-толил)-оксазола. Реакцию проводят аналогично примеру 2 исходя из 16 г (о,11 моль) фталевого ангидрида и 18,5 г(0,1мол гидрохлорида W -аминометил-4-толипкетона, растворенных в 300 мл ацето на. Выход целевого продукта 23,2 г (83/). Продукт очищают путем двукра ной перекристаллизации ия уксусной кислоты. Т.пл. 216-217-с. Найдено,%: С 72,8; Н 4,9; N 5,1 .НП, Вычислено,%: С 73,0; Н 4,7; N 5, лю1 несценции в толуоле 395 нм. Абсолютный квантовый выход толуоле 0,45. П р и м е р 5. Получение 2-(2-ка боксифенил)-5-(2,4,5-триметилфенил) -оксазола. Реакцию проводят аналогично Примеру 2 исходя из 16 г (0,11 моль) фталевого аигидрида и 21,2 г(0,1 мо гидрохлорида 2,4,5-триметил-Ы -амин ацетофенона, растворенных в 300 мл ацетона. Выход целевого продукта 27,7 г (01%). Продукт очищают путем двукратной перекристаллизации из ук сусной кислоты. Т.пл. 157-J58 С. Найдено,%: С 74,2; Н 5,6; N 4,7 ЧNT Вычислено,.: С 74,3; Н 5,5;N 4, WCTKc люминесценции в толуоле 400 нм. Абсолютный квантовый выход в толуоле 0,45. Пример 6. Получение 2-(2-ка боксифенил)-5-(4-анизил)-оксазола. Реакцию проводят аналогично примеру 2 исходя из 16 г (0,1 моль) фталевого ангидрида и 20 г(0,1 моль) гидрохлорида 4-метоксч-(,о-аминоацетофенона, растворенных в 300 Мл ацетона. Выход целевого продукта 25,1 г (85%). Продукт очищают путем последовательной перекристаллизации из уксусной кислоты и хлорбензола. Т.пл. 212-.. Найдено,%: С 69,1; Н 4,6; N 4,9. Вычислено,%: С 69,2; Н 4,4; N 4,7. люминесценции в толуоле 410 нм. Абсолк1тный квантовый выход в толуоле 0,40, П р и м е р 7. Получение 2-(2-карбоксифенил)-5-( 1-нафтил)-окса. зола. Синтез проводят аналогично примеру 2 исходя из 16 г (о,11 моль) фталевого ангидрида и 23,4 г(0,1 моль) гидрохлорида-W-аминометил-1-нафтилкетона, растворенных в 300 мл ацетона. Вьосод целевого продукта 23,4г t90%). Продукт очищад)т путем двукратной перекристаллизации из 50%-ного водного раствора этилового спирта. Т.пл. 144-145 С. Найдено,%: С 76,4; Н 4,0; N 4,6. Вычислено,%: С 76,2; Н 4,1;N 4,4. макс поминесценции в толуоле 410 нм. Абсолютный квантовый выход в толуоле 0,54. Проводят испытания 2-(2-карбоксифенил)-5-арилаксазолов в качестве органических люминофоров в органических растворителях. Измеряют спектры люминесценции в толуоле, определяют абсолютные квантовьш выходы. Одновременно проводят анапогичнретизмерения для ближайшего структурного аналога (базового .образца, соединение 10) и аналогов по использованию 4-(5-арилоксазолил-21-фталевых кислот (соедине11ИЯ 7,8,9). Спектры люминесценции измеряют на установке, состоящей из зеркального монохромата ЗМР-3, фотозлектронного умножителя ФЭУ-18, микроамперметра -94; источ| йком возбуждения служит лампа ДРШ-500, из спектра которой выделяют линию возбуждения 365 нм. Абсолютный квантовый выход определяют методом равного поглощения. Константы люминесценции в толуо;те и водной среде приведены в табл.1.
т я б л и ц я 1



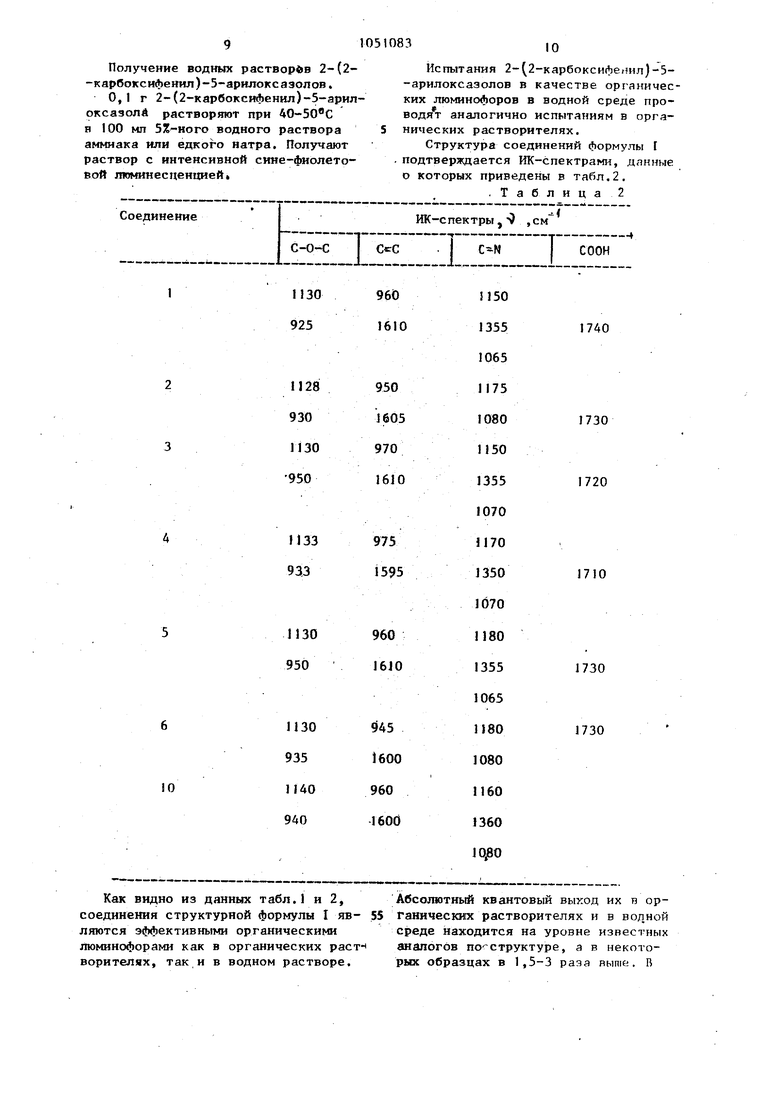

I. 2-
3930,35 1,100,50397 3950,45 4000,4Ь (6ед: 4100,40 395 405 410 430 0,30 0.90.1 0.1 {). ) 7 0,35
4100,54
Слабое свечение
3650,50
4100,68
12
4050,36
4300,47
0,5
365
Не растворимИэ-эа низкой растворимости положение максимума выход определить не удается. лгмииесиенцнн и абсолюттй квантовый
Получение водных раствор в 2-(2-карбоксифенил)-5-арилоксаэолов,
0,1 г 2-(2-карбоксифенил)-5-арилоксазолА растворяют при 40-50С н 100 МП 5%-Ного водного раствора аммиака или едкого натра. Получают раствор с интенсивной сине-фиолетовой люминесценцией.
Как видно из данных табл.1 и 2,Абсолютный квантовый выход их тз орсоединения структурной формулы I яв- 55ганическнж растворителях и в водной
ляются эффективными органическимисреде находится на уровне известных
Люминофорами как в органических раст- аналогов по структуре, а в некотоворителях, так и в водном растворе.рых образцах в 1,5-3 раза выше;. В
Испытания 2-(2-карбоксиЛе ил)-5-арилоксазолов в качестве органических люминофоров в водной среде проводят аналогично испытаниям в органических растворителях.
Структура соединений формулы подтверящается ИК-спектрами, данные о которых приведены в табл.2. , Таблица 2 11 отличие от своих аналогов, они обладают хорогаей растворимостью как в оргаиических, так и в водной средах Порастворимости в водной среде они в 8-20 раз превышают аналоги по использованию. Кроме того, способ получения соединений предлагаемой структуры простой и использует доступное, неток3сичное исходное сырье, устойчивое при хранении Указанные преимутцества позволяют широко использовать соединения I для получения целого ряда люминесцентных материалов: жидких сцинтилляторов, дневных флуоресцентных пигментов, люминесцентных жидкостей для дефектоскопии, оптических отбеливателей и т.п.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Чехута В.Г.,Кузьменков А.А | |||
| Методы получения химических реактивов и препаратов, 5970, с.,98-100 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| 3-(5-Арилоксазолил-2)фталевые кислоты или их ангидриды или соли в качестве люминофоров | 1975 |
|
SU558914A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1983-10-30—Публикация
1981-09-18—Подача