Изобретение относится к новым производным бензо(b)нафтиридина общей формулы
R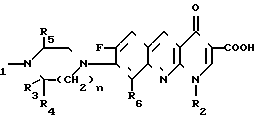 (I) где R1 водород, алкильный или гидроксильный радикал;
(I) где R1 водород, алкильный или гидроксильный радикал;
R2 водород, линейный или разветвленный С1-С4-алкил, фторалкил, циклоалкил, алкилоксильный или алкиламиновый радикал;
R3 С1-С4-алкил, а R4 и R5 различные и означают водород или С1-С4-алкил;
или R3 водород или алкил, или циклоалкил и R4 и R5 каждый в отдельности означает водород;
R6 водород или фтор;
n 1 или 2, или их солей, обладающих антибактериальным свойством.
Известны производные нафтиридина со структурой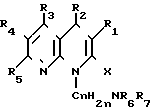 в которой Х может быть кислород и два смежных радикала R1R5 могут образовывать бензольный цикл.
в которой Х может быть кислород и два смежных радикала R1R5 могут образовывать бензольный цикл.
Эти соединения можно применять в качестве ингибиторов кислотных желудочных секреций.
Известны гипотензивные средства с общей формулой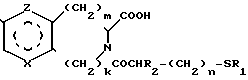 в которой радикалы Х, Y и Z могут быть 0 или радикалом NR4 или CR5 CR5, в котором R5 могут образовывать бензольный цикл.
в которой радикалы Х, Y и Z могут быть 0 или радикалом NR4 или CR5 CR5, в котором R5 могут образовывать бензольный цикл.
Цель изобретения разработка на основе известных приемов новых соединений, обладающих более высокой антибактериальной активностью при низкой токсичности.
Соединения общей формулы (I) могут существовать в гидратированной форме, и эти гидраты входят в рамки изобретения.
В соответствии с изобретением соединения общей формулы (I) можно получить путем замещения пиперазина с общей формулой
R (II) в которой R1, R3, R4, R5 и n определены выше, на 1,8-бензо[b]нафтиридин общей формулы
(II) в которой R1, R3, R4, R5 и n определены выше, на 1,8-бензо[b]нафтиридин общей формулы (III) в которой R2 определен выше и Hal является атомом фтора хлора или брома, если R6 атом водорода, или Hal и R6 одновременно являются атомами фтора, а затем, если R1 является атомом водорода и если хотят получить производное 1,8-бензо[b]нафтиридина, в котором R1 является метилом, производят превращение полученного продукта в 8-(4-метил-1-пиперазинил)-бензо[b]нафтиридин.
(III) в которой R2 определен выше и Hal является атомом фтора хлора или брома, если R6 атом водорода, или Hal и R6 одновременно являются атомами фтора, а затем, если R1 является атомом водорода и если хотят получить производное 1,8-бензо[b]нафтиридина, в котором R1 является метилом, производят превращение полученного продукта в 8-(4-метил-1-пиперазинил)-бензо[b]нафтиридин.
Действие производного пиперазина общей формулы (II) обычно производится в присутствии избытка этого производного в качестве акцептора кислоты или в присутствии акцептора органической или неорганической кислоты в подходящих органических растворителях. Можно проводить операции с растворителем или без растворителя при 30-120оС. Когда работают в присутствии растворителя, то реакцию проводят предпочтительно в таких растворителях, как пиридин, диметилформамид, диметилсульфоксид, ацетонитрил.
Подразумевается, что в случае, когда символ R2 в соединении с общей формулой (III) обозначает атом водорода, то предпочтительно предварительно осуществить защиту этого соединения. Защита и элиминирование защитного радикала после реакции осуществляются обычными методами.
Защиту можно осуществить при помощи любой совместимой группы, введение и элиминирование которой не затрагивает остатка молекулы.
В качестве примера защитные группировки можно выбирать из радикалов триметилсилил, метоксиметил, этоксиметил, бензгидрил, тритил, тетрагидропиранил, формил, ацетил, хлорацетил, трихлорацетил, трифторацетил, метоксикарбонил, этоксикарбонил, т-бутоксикарбонил, трихлорэтоксикарбонил.
В случае необходимости последовательная операция метилирования пиперазинильного радикала осуществляется предпочтительно путем действия формалина в присутствии муравьиной кислоты. Реакцию обычно проводят в водной среде при 90-100оС.
Производные 1,8-бензо[b] нафтиридина общей формулы (I) могут быть также получены из соответствующего эфира общей формулы
R N
N (IV) в которой R1, R2, R3, R4, R5, R6 и n определены выше, или R2 означает алкиламиновый защищенный радикал и Alk означает алкильный радикал, содержащий 1-4 атомов углерода в линейной или разветвленной цепи, любым известным методом получения кислоты из эфира без затрагивания остатка молекулы, а затем, в случае необходимости, производят элиминирование защитной группы алкиламинового радикала и/или, если получают продукт общей формулы (I), в которой R1 является атомом водорода, и если хотят получить соответствующее соединение, в котором R1 является метилом, то производят превращение полученного продукта в 8-(4-метил-1-пиперазинил)-бензо[b]нафтиридин.
(IV) в которой R1, R2, R3, R4, R5, R6 и n определены выше, или R2 означает алкиламиновый защищенный радикал и Alk означает алкильный радикал, содержащий 1-4 атомов углерода в линейной или разветвленной цепи, любым известным методом получения кислоты из эфира без затрагивания остатка молекулы, а затем, в случае необходимости, производят элиминирование защитной группы алкиламинового радикала и/или, если получают продукт общей формулы (I), в которой R1 является атомом водорода, и если хотят получить соответствующее соединение, в котором R1 является метилом, то производят превращение полученного продукта в 8-(4-метил-1-пиперазинил)-бензо[b]нафтиридин.
Получение кислоты из эфира обычно производится путем кислого гидролиза. Предпочтительно работают в среде смеси уксусная кислота соляная кислота, серная кислота или метансульфокислота при 20-100оС. Можно также производить омыление в присутствии поташа или соды, в водно-спиртовой среде, при 20-80оС. Метилирование пиперазинилового радикала осуществляется, как описано выше.
Когда R2 означает защищенный алкиламиновый радикал, то защитным радикалом может быть любая защитная группа аминогруппы, совместимая с молекулой. Особенно предпочтительно выбирать защитный радикал, который может быть удален одновременно с гидролизом эфира (например, формальный радикал).
В соответствии с изобретением, когда R3 и R4 различные, производные бензо[b]нафтиридина общей формулы (I) находятся в форме изомеров.
Для получения изомеров производных бензо[b]нафтиридина общей формулы (I) производят разделение изомерных форм пиперазинов общей формулы (II) любым известным и совместимым с молекулой методом. В качестве примера разделение производится ацилированием при помощи хиральной кислоты, разделением изомеров жидкостной высокоразрешающей хроматографией, затем проводят дезацилирование при помощи кислого гидролиза.
Новые соединения в соответствии с изобретением, а также промежуточные соединения их синтеза, могут очищаться физическими методами, как, например, кристаллизацией или хроматографией.
Соединения в соответствии с изобретением могут быть превращены в соли металлов или соли соединения с азотсодержащими основаниями известными методами. Эти соли получают путем действия основания металла (например, щелочного или щелочноземельного), аммиака или амина на соединение формулы (I) в соответствующем растворителе (спирт, эфир или вода), или путем реакции обмена с солью органической кислоты. Образованная соль выпадает в осадок после концентрирования раствора, она выделяется фильтрованием, декантированием или вакуумной сушкой.
Новые соединения могут быть также превращены в аддитивные соли с кислотами. Соединения общей формулы (I), полученные в виде таких солей, могут быть выделены и превращены в соли других кислот обычными методами.
В качестве примера фармацевтически приемлемых солей можно перечислить соли щелочных металлов (натрий, калий, литий) или щелочноземельных металлов (магний, кальций), соли аммония, соли азотсодержащих оснований (этаноламин, диэтаноламин, триметиламин, триэтиламин, метиламин, пропиламин, диизопропиламин, N, N-диметилэтаноламин, бензиламин, дициклогексиламин, N-бензил- β-фенэтиламин, N, N-дибензилэтилендиамин, дифенилендиамин, бензгидриламин, хинин, холин, аргинин, лизин, лейцин, дибензиламин, а также соли добавления минеральных кислот (хлоргидраты, бромгидраты, сульфаты, нитраты, фосфаты) или органических кислот (сукцинаты, фумараты, малеаты, паратолуосульфонаты).
П р и м е р 1. Суспензию 3,5 г 8-хром-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин- 3-карбоновой кислоты и 4,6 г 2-метилпиперазина в 40 см3 пиридина нагревают при 115оС, при перемешивании в течение 13 ч. Реакционную смесь концентрируют досуха при пониженном давлении 20 кПа при 60оС. Остаток поглощают 2 раза 30 см3 этанола и концентрируют при пониженном давлении при указанных выше условиях. Полученное твердое вещество обрабатывают 60 см3 воды и 10 см3 30%-ного водного раствора щелочи калия. Водную фазу промывают 2 раза 100 см3 трихлорметана, добавляют 10,28 г метансульфокислоты, промывают снова 2 раза 100 см3 трихлорметана, добавляют 10 см3 30%-ного водного раствора щелочи калия. Образованный осадок обезвоживают промывают 3 раза 10 см3 воды и 2 раза 10 см3этанола. Получают 2,7 г 7-фтор-1-метил-8-(3-метил-1-пиперазинил)-4-оксо-1,4-дигидро-1,8- бензо[b]нафтиридин-3-карбоновой кислоты в виде твердого вещества желтого цвета с температурой плавления 360-363оС.
П р и м е р 2. 7-Фтор-1-метил-оксо-8- (1-пиперазинил)-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновую кислоту получают при условии примера 1, но берут 10 г 8-хлор-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8-бензо[b]нафтиридин- 3-карбоновой кислоты и 28 г пиперазина в 100 см3 пиридина. Получают 5,5 г полугидрата 7-фтор-1-метил-4-оксо-8(1-пиперазинил)-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновой кислоты в виде твердого вещества желтого цвета с температурой плавления 370-375оС.
П р и м е р 3. 7-Фтор-1-метил-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях, аналогичных примеру 1, но берут 5 г 8-хлор-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8-бензо[b]нафтиридин-3- карбоновой кислоты и 16 г 1-метил пиперазина в 50 см3 пиридина. После концентрирования реакционной смеси при пониженном давлении остаток суспендируют в 100 см3 воды и добавляют 25 см3 уксусной кислоты. Удаляют нерастворимые вещества на диатомитовой окиси кремния. К фильтрату добавляют 200 см3 3Н водного раствора окиси калия, снова удаляют нерастворимое вещество путем фильтрования на диатомитовой окиси кремния. К фильтрату добавляют 5 см3 уксусной кислоты. Образованный осадок обезвоживают, промывают 3 раза 50 см3 воды. После 2 перекристаллизаций из 17 см3 диметилформамида каждый раз получают 3,2 г 7-фтор-1-метил-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8- бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 356оС.
П р и м е р 4. 8-(4-Этил-1-пиперазинил)-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях, описанных ниже в примере 3, но берут 1,85 г 8-хлор-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8-бен- зо[b] нафтиридин- 3-карбоновой кислоты и 2,75 г 1-этил-пиперазина в 20 см3 пиридина. Получают 1,3 г 8-(4-этил-1-пиперазинил)-7-фтор-1-метил-4-оксо-1,4 дигидро-1,8- бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 285-286оС.
П р и м е р 5. 7-Фтор-8-[4-(2-гидрокси-этил)-1-пиперазинил]-1-метил-4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3-карбо-новую кислоту получают при условиях примера 1, но берут 1,6 г 8-хлор-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин- 3-карбоновой кислоты и 6,8 г 1-(2-гидрокси-этил)пиперазина в 16 см3пиридина. После концентрирования досуха реакционной смеси при пониженном давлении остаток поглощают 50 см3 воды. Величину рН смеси доводят до 6,9 путем добавления 0,4 см3 уксусной кислоты. Полученный осадок обезвоживают, промывают 2 раза 10 см3 воды, перекристаллизовывают 2 раза из 10 см3 диметилформамида. Получают 1,1 г 7-фтор-8-[4-(2-гидрокси-этил)-1-пиперазинил] -1-ме- тил-4-оксо-1,4- дигидро-1,8-бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 275-276оС.
П р и м е р 6. 8-3,5-Диметил-1-пиперазинил)-7-фтор-1-метил-4-оксо-1,4-дигидро- -1,8- бензо[b]нафтиридин-3-карбоновую кислоту получают при условии примера 3, но берут 1,7 г 8-хлор-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8-бензо[b]нафтиридин- 3-карбоновой кислоты и 2,5 г 2,6-диметилпиперазина в 20 см3 пиридина. Получают 1,1 г полугидрата 8-(3,5-диметил-1-пиперазинил)-7-фтор-1-ме-тил-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 294-295оС.
П р и м е р 7. 1-Этил-7-фтор-8-(1-пиперазинил)-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 1,6 г 8-хлор-1-этил-7-фтор-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин- 3-карбоновой кислоты и 4,3 г пиперазина в 20 см3пиридина. После 3 перекристаллизаций в общем количестве из 300 см3диметилформамида получают 0,94 г тригидрата 1-этил-7-фтор-8-(1-пиперазинил)-4-оксо-1,4-дигидро-1,8-бен- зо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 320-322оС.
8-Хлор-1-этил-7-фтор-4-оксо-1,4-дигид- ро-1,8-бензо[b]нафтиридин-3- карбоновую кислоту получают при условиях примера 1, но берут 10,5 г 8-хлор-7-фтор-3-этоксикарбонил-1-этил-4-оксо-1,4-дигидро-1,8- бензо[b] нафтиридина. Получают 9,3 г 8-хлор-1-этил-7-фтор-оксо-1,4-дигидро-1,8- бензо[b]нафтиридин-3- карбоновой кислоты в виде твердого вещества бежевого цвета с температурой плавления 380оС, которое используется на дальнейших этапах без дополнительной очистки.
П р и м е р 8. 1-Этил-7-фтор-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 1,6 г 8-хлор-1-этил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин- 3-карбоновой кислоты и 4,5 г 4-метилпиперазина в 16 см3 пиридина. После 4 перекристаллизаций в общем количестве из 120 см3 диметилформамида получают 1,2 г 1-этил-7-фтор-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро-1,8- бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 285-286оС, которое сольватируется 1% воды.
П р и м е р 9. 1-Этил-7-фтор-8-(3-метил-1-пиперазинил)-4-оксо-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 1, но берут 2,1 г 8-хлор-1-этил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин- 3-карбоновой кислоты, 20 см3 пиридина и 2,4 г 2-метилпиперазина. После поглощения этанолом и концентрирования досуха при пониженном давлении (20 кПа) при 50оС твердый остаток поглощают 20 см3 воды и 10 см3 2N раствора щелочи калия. Полученный водный раствор промывают 2 раза 20 см3трихлорметана, добавляют 10 см3 уксусной кислоты, промывают 2 раза 40 см3 трихлорметана. Добавляют 23 см3 4,5N раствора щелочи калия, нагревают полученную суспензию до 90оС. После охлаждения до температуры около 20оС осадок обезвоживают, промывают 3 раза 10 см3 воды, 2 раза 10 см3 этанола. После 2 перекристаллизаций из 120 см3 диметилформамида каждый раз получают 1,7 г 1-этил-7-фтор-8-(3-метил-1-пиперазина)-4-оксо-1,4-дигидро-1,8- бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 310-312оС.
П р и м е р 10. 1-Этил-8-(4-этил-1-пиперазинил)-7-фтор-4-оксо-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 1,6 г 8-хлор-1-этил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b]нафтиридин- 3-карбоновой кислоты и 2,3 г 1-этилпиперазина в 16 см3 пиридина. Получают 1,4 г 1-этил-8-(4-этил-1-пиперазинил)-7-фтор-4-оксо-1,4-дигидро-1,8- бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 287-288оС, которое сольватируется 1,6% воды.
П р и м е р 11. 1-Этил-7-фтор-8[4-(2-гидроксиэтил)-1-пиперазинил]-4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 8, но берут 1,6 г 8-хлор-1-этил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3- карбоновой кислоты и 2,6 г 1-(2-гидроксиэтил)-пиперазина в 16 см3пиридина. Получают 1,3 г 1-этил-7-фтор-8-[4-(2-гидроксиэтил)-1-пиперазинил] -4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 264-265оС.
П р и м е р 12. 7-Фтор-1-метиламин-4-оксо-8-(1-пиперазинил)-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 2,25 г 8-хлор-7-фтор-1-метиламин-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты и 2,4 г пиперазина в 30 см3 пиридина. После 3 перекристаллизаций в общем количестве из 400 см3диметилформамида получают 0,82 г 7-фтор-1-метиламин-4-оксо-8-(1-пиперазинил)-1,4-дигидро--1,8- бензо[b] нафтиридин-3-карбоновой кислоты в виде темно-желтого твердого вещества с температурой плавления 322-324оС, которое сольватируется 13,6% диметилформамида.
П р и м е р 13. 7-Фтор-1-метиламино-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях, аналогичных примеру 1, но берут 1,93 г 8-хлор-7-фтор-1-метиламино-4-оксо-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновой кислоты, 2,4 г 1-метилпиперазина в 20 см3пиридина. После 2 перекристаллизаций из 15 см3 диметилформамида каждый раз, получают 0,9 г 7-фтор-1-метиламин-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого вещества с температурой плавления 263-264оС.
П р и м е р 14. 7-Фтор-1-метиламино-8-(3-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 3,2 г 8-хлор-7-фтор-1-метиламино-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты и 4 г 2-метилпиперазина в 40 см3пиридина. Полученный продукт поглощают 30 см3 воды и 7 см3 2N водного раствора щелочи калия. Удаляют нерастворимую часть фильтрованием через диатомитовую окись кремния. Фильтрат промывают 2 раза 20 см3 этилового эфира, поток осаждают добавлением 3,5 см3 4N метансульфокислоты. Полученный осадок обезвоживают, промывают 3 раза 20 см3 воды, 3 раза 20 см3 этанола. Получают 2,2 г 7-фтор-1-метиламино-8-(3-метил-1-пиперази- нил)-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде темно-желтого твердого вещества с температурой плавления при 343-345оС, которое сольватируется 3,7% воды.
П р и м е р 15. 1-Циклопропил-7-фтор-4-оксо-8-(1-пиперазинил)-1,4-дигидро-1,8- бензо[b] нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 1 г 8-хлор-1-циклопропил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты и 2,6 г пиперазина в 10 см3 пиридина. Получают 0,6 г дигидрата 1-циклопропил-7-фтор-4-оксо-8-(1-пиперазинил)- 1,4-дигидро-1,8- бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 342-343оС.
П р и м е р 16. 1-Циклопропил-7-фтор-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 1 г 8-хлор-1-циклопропил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты, 3 г 1-метилпиперазина и 10 см3пиридина. После перекристаллизации в 10 см3 диметилформамида получают 0,63 г 1-циклопропил-7-фтор-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 250оС.
П р и м е р 17. 1-Циклопропил-7-фтор-8-(3-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновую кислоту получают при условиях примера 1, но берут 1 г 8-хлор-1-циклопропил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты и 3 г 2-метилпипера- зина в 10 см3пиридина. Чистый продукт очищают после дополнительной очистки путем перекристаллизации из 200 см3 диметилформамида. Получают 0,5 г полугидрата 1-циклопропил-7-фтор-8-(3-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 343оС.
П р и м е р 18. 1-Циклопропил-8-(4-этил-1-пиперазинил)-7-фтор-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 2 г 8-хлор-1-циклопропил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты и 2,74 г 2-этилпиперазина в 20 см3пиридина. Чистый продукт выделяют после первой перекристаллизации из 105 см3 этанола 25% диметилформамида, после чего проводят вторую перекристаллизацию из 75 см3 этанола с 50% диметилформамида. Получают 0,67 г 1-циклопропил-8-(4-этил-1-пиперазинил)-7-фтор-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновой кислоты в виде желто-зеленого твердого вещества с температурой плавления 254оС.
П р и м е р 19. 1-Циклопропил-7-фтор-8-[4-(2-гидрокси-этил)-1-пиперазинил]-4-оксо- 1,4-дигидро-1,8-бензо[b]нафтиридин-3-кар- боновую кислоту получают при условиях, аналогичных примеру 5, но берут 4 г 8-хлор-1-циклопропил-7-фтор-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты и 6,2 г 1-(2-гидрокси-этил)пиперазина в 40 см3 пиридина. Реакционную смесь нагревают при температуре около 115оС в течение 22 ч. Чистый продукт выделяют после 3 перекристаллизаций из 200 см3 этанола с 10% диметилформамида каждый раз. По- лучают 0,94 г 1-циклопропил-7-фтор-8-[4-(2-гидроксиэтил)-1-пиперазинил] -4-оксо- 1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 255оС.
П р и м е р 20. 7-Фтор-4-оксо-8-(1-пиперазинил)-1-трет.бутил-1,4-дигидро-1,8-бен- зо [b]нафтиридин-3-карбоновую кислоту получают при условиях примера 5, но берут 1,7 г 8-хлор-7-фтор-4-оксо-1-трет.бутил-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты и 4,3 г пиперазина в 20 см3 пиридина. Чистый продукт получают после одной перекристаллизации из 20 см3диметилформамида. Выделяют 1,25 г 7-фтор-4-оксо-8-(1-пиперазинил)-1-трет. бутил-1,4-ди- гидро-1,8- бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 290оС, которое сольватируется 4,5% воды.
П р и м е р 21. Суспензию 2 г 8-хлор-7-фтор-1-метил-4-оксо-1,4-дигидро-1,8-бензо[b]нафтиридин- 3-карбоновой кислоты в 7,44 г 2,2-диметилпиперазина и 20 см3 пиридина нагревают при 115оС в течение 44 ч. Реакционную смесь концентрируют досуха при пониженном давлении (20 кПа) при 60оС. Остаток поглощают 50 см3 этанола и снова концентрируют при пониженном давлении, при указанных выше условиях. По- лученное твердое вещество поглощают 50 см3 этанола эфира, обезвоживают, промывают 2 раза 30 см3 того же растворителя и поглощают 120 см3 воды и 2 г метансульфокислоты. Очень малорастворимую часть удаляют путем фильтрования через диатомитовую окись кремния. К полученному раствору добавляют 2 см3 50%-ного водного раствора щелочи калия. Образуемый осадок обезвоживают, промывают 3 раза 25 см3 воды и 1 раз 50 см3 этанола при 50оС. Получают 1,6 г 8-(3,3-диметил-1-пиперазинил)-7-фтор-1-метил-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 362-365оС, которое сольватируется 4,9% воды.
П р и м е р 22. Суспензию 1,2 г 8-хлор-7-фтор-1-(2-фторэтил)-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты в 12 см3 пиридина и 3,52 г 1-метилпиперазина нагревают, при перемешивании, при температуре около 110оС в течение 6 ч. Реакционную смесь концентрируют при пониженном давлении (20 кПа) при 60оС. Остаток поглощают 15 см3 воды и 2 см3уксусной кислоты. Удаляют нерастворимое вещество фильтрованием через диатомовую окись кремния. К фильтрату добавляют 6 см3 20%-ного водного раствора щелочи калия. Снова отфильтровывают малорастворимое вещество через диатомовую окись кремния. К фильтрату добавляют 0,6 см3уксусной кислоты. Полученный осадок обезвоживают, промывают 2 раза 5 см3воды, 2 раза 5 см3 этанола и перекристаллизовывают 2 раза каждый раз из 10 см3 диметилформамида. Получают 0,6 г 7-фтор-1-(2-фтор-этил)-8-(4-метил-1-пиперазинил)-4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 306-308оС.
П р и м е р 23. Суспензию 2 г 7,8-дифтор-1-метокси-4-оксо-1,4-дигидро-1,8-бен-зо[b] нафтиридин- 3-карбоновой кислоты в 2,8 г пиперазина и 40 см3 диметилсульфоксида перемешивают в течение 15 мин при температуре около 40оС. После охлаждения приблизительно до 20оС реакционную смесь выливают в 150 см3воды, добавляют 27,75 см3 2N метансульфокислоты. Малорастворимую фракцию удаляют фильтрованием через диатомовую окись кремния. К полученному раствору добавляют 15 см3 2N водного раствора щелочи калия. Образованный осадок обезвоживают, промывают 3 раза 15 см3 воды, поглощают 100 см3 диметилформамида и нагревают, при перемешивании, в течение 10 мин при температуре около 150оС. Суспензию охлаждают приблизительно до 100оС, нерастворимую часть обезвоживают, поглощают 100 см3 этанола нагревают при температуре около 75оС в течение 1 ч. Нерастворимую часть обезвоживают при температуре около 50оС и промывают 40 см3 того же растворителя при той же температуре, что и раньше. Получают 1,8 г 7-фтор-1-метокси-4-оксо-8-(1-пиперазинил)-1,4-дигидро-1,8-бензо- [b] нафтиридин-3-карбоновой кислоты в виде коричневого твердого вещества с температурой плавления 298-300оС, которое сольватируется 2,4% воды.
П р и м е р 24. Суспензию 0,93 г 7,8-дифтор-1-метокси-4-оксо-1,4-дигидро-1,8-бензо[b] нафтиридин-3- карбоновой кислоты в 0,6 г 1-метилпиперазина и 20 см3 диметилсульфоксида нагревают при 80оС в течение 5 мин. После охлаждения приблизительно до 20оС реакционную смесь выливают в 30 см3 воды, добавляют 1,5 см3 2N метансульфокислоты, обезвоживают, промывают 3 раза 5 см3 воды. После перекристаллизации из 30 см3 диметилформамида с 30% этанола получают 0,55 г 7-фтор-1-метокси-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде коричневого твердого вещества с температурой плавления 270оС.
П р и м е р 25. Суспензию 0,47 г 1-циклопропил-7,8-дифтор-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин- 3-карбоновой кислоты и 0,6 г 1-метилпиперазина в 7 см3диметилсульфоксида нагревают при 80оС в течение 15 мин. Реакционную смесь выливают в 25 см3 воды, добавляют 9 см3 N-соляной кислоты. Полученное твердое вещество обезвоживают, промывают 3 раза 5 см3 воды. После 1 перекристаллизации из смеси 4,5 см3 этанола и 4,5 см3диметилформамида получают 0,29 г 1-циклопропил-7-фтор-8-(4-метил-1-пиперазинил)-4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 250оС.
П р и м е р 26. Суспензию 4 г 7,8,9-трифтор-1-метил-4-оксо-1,4-дигидро-1,8-бензо [b]нафтиридин- 3-карбоновой кислоты в 60 см3 диметилсульфоксида и 3 г 1-метил-пиперазина нагревают при 80оС в течение 1,5 ч. После охлаждения приблизительно до 20оС добавляют 150 см3 воды. К полученному раствору добавляют 18 см3 10%-ной уксусной кислоты. Образованный осадок обезвоживают, промывают 3 раза 50 см3 воды и перекристаллизовывают из 50 см3 диметилформамида. Получают 4 г 7,9-дифтор-1-метил-8-(4-метил-1-пиперазинил)-4- оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температуpой плавления 316оС.
П р и м е р 27. Суспензию 2 г 6,7,8-трифтор-1-метокси-4-оксо-1,4-дигидро-1,8-бен-зо[b] нафтиридин -3-карбоновой кислоты и 2,8 г пиперазина в 40 см3 диметилсульфоксида нагревают, при перемешивании при 50оС в течение 45 мин. После охлаждения до 20оС полученную суспензию выливают в 100 см3 воды, добавляют 9,22 г метансульфокислоты. Малорастворимую часть удаляют путем фильтрования через диатомовую окись кремния. К фильтрату добавляют 32 см3 2N водного раствора щелочи калия. Полученный осадок обезвоживают, промывают 3 раза 50 см3 воды и перекристаллизовывают из 80 см3 диметилформамида. Получают 1,4 г 7,9-дифтор-1-метокси-4-оксо-8-(1-пиперазинил)-1,4-дигидро-1,8-бензо [b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 305-308оС.
П р и м е р 28. Раствор 1,15 г 7-фтор-1-метил-8-(3-метил-1-пиперазинил)-4-оксо-1,4-дигидро-1,8- бензо[b]нафтиридин-3-карбоновой кислоты в 1,35 г 98%-ной муравьиной кислоты и 3,25 см3 30%-ного водного раствора формальдегида нагревают приблизительно при 100оС в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении (20 кПа) при 50оС, затем добавляют 5 см3 воды, полученный раствор доводят до рН 7 путем добавления 0,5 см32N водного раствора щелочи калия и нагревают при 100оС в течение 2 мин. Кристаллизующийся продукт обезвоживают при 20оС, промывают 2 раза 10 см3воды. Полученный неочищенный продукт перекристаллизовывают 2 раза из 10 см3 диметилформамида каждый раз. Получают 0,55 г 8-(3,4-диметил-1-пиперазинил)-7-фтор-1- метил-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления при 306-308оС.
П р и м е р 29. Проводят операции как в примере 28, но берут 2,3 г 1-этил-7-фтор-8-(3-метил-1-пиперазинил)-4-оксо-1,4-диги- дро-1,8- бензо[b]нафтиридин-3-карбоновой кислоты, 2,26 см3 98% муравьиной кислоты и 5,6 см3 30%-ного водного раствора формальдегида, получают 1,75 г 8-(3,4-диметил-1-пиперазинил)-1-этил-7-фтор-4-оксо-1,4-ди- гидро-1,8-бензо[b]нафтиридин-3-карбоновой кислоты в виде желтого твердого вещества с температурой плавления 293-294оС.
П р и м е р 30. Проводят операции, как в примере 28, но берут 1,9-1-циклопропил-7-фтор-8-(3-метил-1-пиперазинил)-4-оксо-1,4- дигидро-1,8-бензо[b]нафтиридин-3-карбо-новой кислоты, 1,38 см3муравьиной кислоты и 3,30 см3 30% -ного водного раствора формальдегида. После перекристаллизации неочищенного продукта в 50 см3 этанола получают 1,3 г 1-циклопропил-8-(3,4-диметил-1-пиперазинил)-7-фтор-4-оксо-1,4- дигидро-1,8-бензо[b]нафтиридин-3-карбоно-вой кислоты в виде желтого твердого вещества с температурой плавления 219оС.
Работая таким же образом, как в примерах 1-27, получают:
П р и м е р 31. 1-Циклопропил-7-фтор-8-(4-метил-1-пиперазинил)-4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3-карбоновую кислоту, плавящуюся при 250оС.
П р и м е р 32. 7-Фтор-1-метокси-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновую кислоту, плавящуюся при 270оС.
П р и м е р 33. 7,9-Дифтор-1-метил-4-оксо-8-(1,4-пергидродиазепин-1-ил)-1,4- дигидро-1,8-бензо[b]нафтиридин-3-карбоновую кислоту, плавящуюся при 340-342оС.
П р и м е р 34. 7,9-Дифтор-1-метил-4-оксо-8-(1-пиперазинил)-1,4-дигидро-1,8-бен-зо[b]нафтири дин-кислоту, плавящуюся при 345-347оС.
П р и м е р 35. 7,9-Дифтор-1-метил-8-(3-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b]нафтиридин-3(Р)-карбоновую кислоту, плавящуюся при 380-382оС.
П р и м е р 36. 1-Этил-7,9-дифтор-4-оксо-8-(1-пиперазинил)-1,4-дигидро-1,8-бен-зо[b]нафтирид ин-3кислоту, плавящуюся при 340-342оС.
П р и м е р 37. 7,9-Дифтор-1-этил-8-(4-метил-1-пиперазинил)-4-оксо-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновую кислоту, плавящуюся при 308оС.
П р и м е р 38. 1-Этил-7,9-дифтор-4-оксо-8-(1,4-пергидродиазепин-1-ил)-1,4-диги- дро-1,8-бензо[b] нафтиридин-3-карбоновую кислоту, плавящуюся при 274оС.
П р и м е р 39. 7,9-Дифтор-4-оксо-8-(1-пиперазинил)-1-трет.бутил-1,4-дигидро- 1,8-бензо[b]нафтиридин-3-карбоновую кислоту, плавящуюся при 318оС.
П р и м е р 40. 1-Циклопропил-7,9-дифтор-4-оксо-8-(1-пиперазинил)-1,4-дигидро- 1,8-бензо[b] нафтиридин-3-карбоновую кислоту, плавящуюся при 305-307оС.
П р и м е р 41. 1-Циклопропил-7,9-дифтор-8-(4-метил-1-пиперазинил)-4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3-карбо-новую кислоту, плавящуюся при 248оС.
П р и м е р 42. 1-Циклопропил-7,9-дифтор-8-(3-метил-1-пиперазинил)-4-оксо-1,4- дигидро-1,8-бензо[b] нафтиридин-3(RS)кар- боновую кислоту, плавящуюся при 309оС.
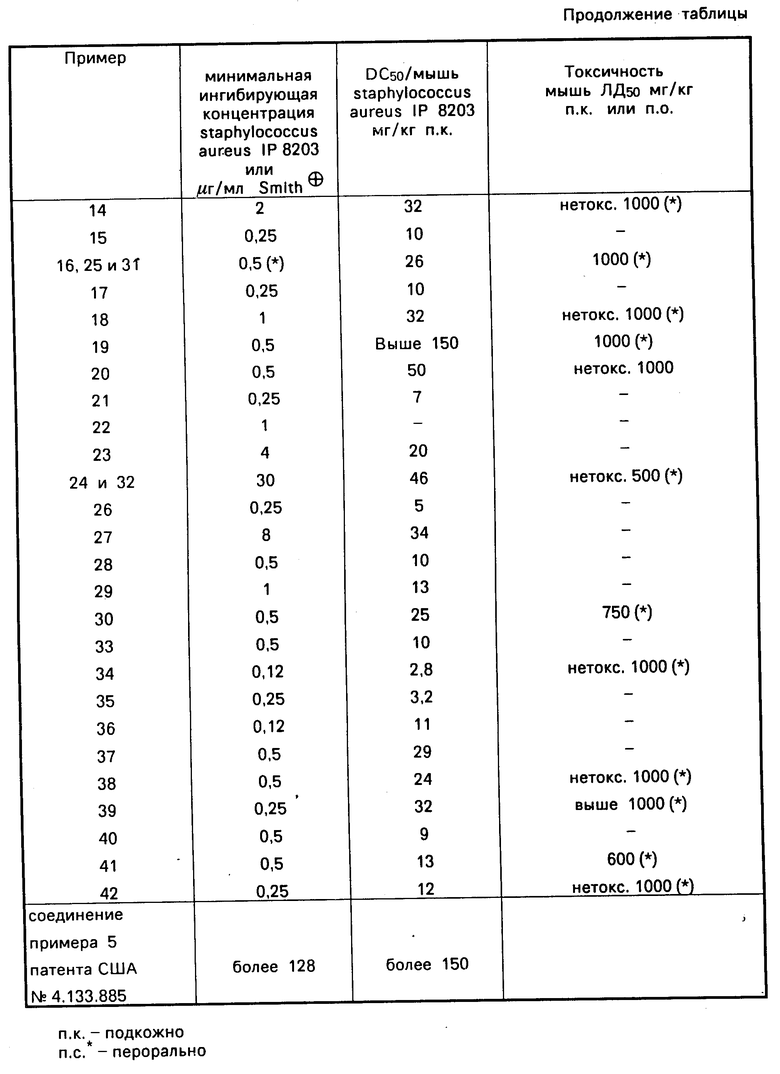
Производные 1,8-бензо[b] нафтиридина общей формулы (I) в соответствии с изобретением и их фармацевтически приемлемые соли имеют особенно интересные антибактериальные свойства. Они проявляют активность ин витро и ин виво на грамположительные штаммы и, как общее правило, на штаммы, ответственные за большинство инфекций через верхние и нижние дыхательные пути.
Ин витро соединения общей формулы (I) проявили активность при концентрации 0,12-50 мкг/см3 в отношении стафилококка IP 8203.
Ин виво, соединения общей формулы (I) проявили активность в отношении экспериментальных инфекций на мышах стафилококком IP 8203 при дозах в пределах 2-150 мг/кг при оральном или подкожном введении.
Другой интерес соединений в соответствии с изобретением представляет их малая токсичность. Их коэффициент LD50 обычно больше 500 мг/кг при подкожном введении у мышей.
Известен 1,3-диметилбензо (С) (1,8) нафтиридин-6(5Н)ОН, который относится к продуктам, наиболее близким к предлагаемым. Ниже приведены данные биологических испытаний этого продукта и полученных в примерах соединений.
Фармакологические испытания.
Бактериостатическая активность ин витро.
К серии чашек Петри, содержащих объем 20 см3 культуральной среды Muller-Hinton agar добавляют серии разбавленных в геометрической прогрессии (коэффициент 2) исcледуемого продукта. Чашки инокулируют с помощью многоточечного инокулянта, происходящего от колонии микроорганизма, образованной 104 единицами в триптированном бульоне соп, инкубированном в течение 18 ч при 37оС и разбавленном 1/100 той же самой средой. После инокуляции чашки инкубируют в течение 24 ч при 37оС.
Минимальная ингибирующая концентрация это наименьшая концентрация, при которой ингибируется развитие микроорганизма.
Активность против интраперитональной инфекции на мыши.
Мышам вводят интраперитонально 0,5 см3 соответствующую культуру в возрасте 18 ч исследуемого микроорганизма в среде Brain Heart Infusion (Difco), соответствующим образом разбавленную с помощью 5% свиного муцина. Эта инокуляция приводит к смерти контрольных животных в течение 24-48 ч. Исследуемый продукт вводят дважды подкожно с интервалом 5 ч в день инокуляции, первую дозу животное получает 1 ч спустя после инокуляции микроорганизмом. Единичная вводимая доза содержит объем 50 см3/кг.
Лечебная доза (DC50) является дозой исследуемого соединения, когда при каждом его введении половина обработанных животных выживает в течение исследуемого пеpиода (8 дней).
Результаты испытаний cведены в таблицу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 1,8-БЕНЗО(B)НАФТИРИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2047613C1 |
| Способ получения производных 1,8-бензол [ @ ]нафтиридина или их солей | 1990 |
|
SU1836370A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗО(B)НАФТИРИДИНОВ И ПРОИЗВОДНЫЕ БЕНЗО(B)НАФТИРИДИНОВ | 1992 |
|
RU2105007C1 |
| ПРОИЗВОДНЫЕ 1,8-БЕНЗО/B/НАФТИРИДИНА В ФОРМЕ СТЕРЕОИЗОМЕРОВ ИЛИ РАЦЕМИЧЕСКИХ СМЕСЕЙ И ИХ СОЛИ С МЕТАЛЛАМИ, АЗОТСОДЕРЖАЩИМИ ОСНОВАНИЯМИ ИЛИ С КИСЛОТАМИ, А ТАКЖЕ ИХ ГИДРАТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2105006C1 |
| Способ получения производных 1,8-бензо/в/нафтиридина | 1991 |
|
SU1811530A3 |
| ПРОИЗВОДНЫЕ ФТОРХИНОЛИН-3-КАРБОНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2109014C1 |
| Способ получения производных 1,8-бензо(в)нафтиридина | 1990 |
|
SU1746883A3 |
| Способ получения 8-алкил-5-оксо-5,8дигидропиридо/2,3- /пиримидин-6-карбоновых кислот | 1973 |
|
SU691091A3 |
| АНТИБИОТИЧЕСКИЕ ПРОИЗВОДНЫЕ 2-ОКСО-ОКСАЗОЛИДИН-3, 5-ДИИЛА | 2012 |
|
RU2616609C2 |
| Способ получения производных пиперазинопиридопиримидина | 1974 |
|
SU552032A3 |

Использование: антибактериальные вещества. Сущность изобретения: производные 1,8-бензо / в нафтиридинов ф-лы 1, где R1 H, алкил, гидроксиалкил; R2 H, алкил, фторалкил, циклоалкил, алкилокси, алкиламина, R3 -алкил, H, циклоалкил; R4 и R5 разные водород или алкил; R6 H, F, n 1 или 2; или их соли или гидраты. Реагент 1: соединение ф-лы 2. Реагент 2: соединение ф-лы 3. Условия реакции: в присутствии акцептора органической или неорганической кислоты в среде растворителя. Структура соединений ф-лы I, II, III: (см. ниже). 1 ил.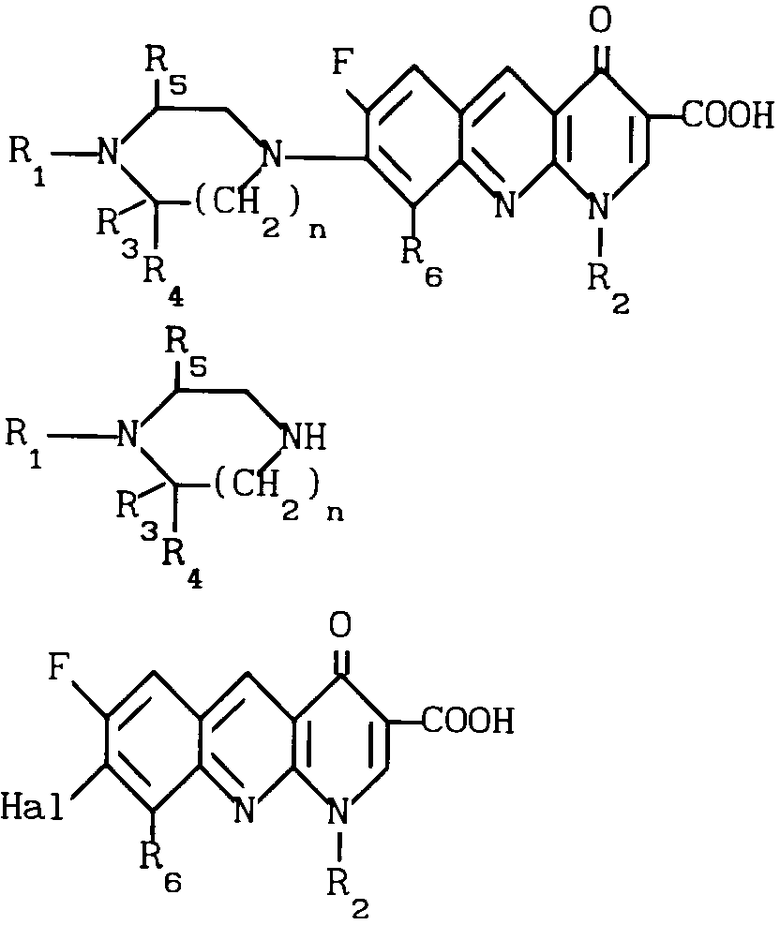
Производные 1,8-бензо(в)нафтиридина общей формулы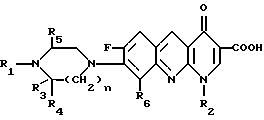
где R1- водород, алкил или гидроксиалкил;
R2 водород, алкил, фторалкил, циклоалкил, алкилокси или алкиламино;
R3 алкил;
R4 и R5 различные, водород или алкил;
или R3 водород, алкил или циклоалкил;
R4 и R5 водород;
R6 водород или фтор;
n=1 или 2,
причем алкильные радикалы содержат 1-4 атома углерода в прямой или разветвленной цепи, циклоалкильные радикалы содержат 3-6 атомов углерода,
или их соли с металлами, азотными основаниями или кислотами, или их гидраты, обладающие антибактериальной активностью.
Приоритет по признакам:
16.01.89 при R1- водород, алкил или гидроксиалкил,R2 - водород, алкил, циклопропил или алкиламина,R3 водород или алкил,R4,R5,R6 водород, n=1;
28.07.89 при R1 водород, алкил или гидроксиалкил,R2 - водород, алкил, циклопропил, алкилокси, алкиламино, R3 водород, R4,R5 каждый в отдельности водород или алкил, или R2 - алкилокси, R3 водород или алкил, R4,R5 водород, n 1;
15.01.90 при R6 фтор, n 2.
| Патент США N 4133885, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-08-27—Публикация
1992-07-07—Подача