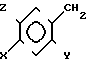
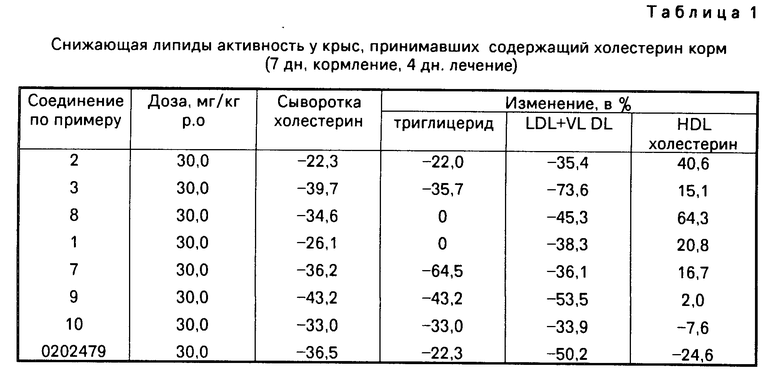
Изобретение относится к антигиперлипопротеиневымически активным новым производным замещенного 5-бензилом бензимидазолин-2-тиона общей формулы I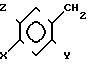
 = S где Х галоген, метил-, этил-, метокси-, или этоксигруппа;
= S где Х галоген, метил-, этил-, метокси-, или этоксигруппа;
Y в случае Х метокси или этоксигруппа гидроксилгруппа,
а в другом случае метокси или этоксигруппа,
Z для случая, когда Х или Y означает метокси- или этоксигруппу, а в других случаях водород, а также к способу их получения.
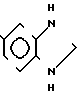
Соединения общей формулы I могут быть описаны также в таутомерных формах общей формулы (Ia) (Ib).
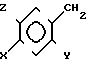
Для упрощения соединения в последующем будут рассматриваться таким образом, как если бы их структура соответствовала бы изображенной в формуле (I) форме "тиона".
К изобретению относятся также и содержащие соединения общей формулы I, предотвращающие обизвествление артерии и образования тромбов, антигиперлипопротеинемически активные лекарственные препараты, а также их изготовление и их применение в лечении гиперлипопротеинемии.
Атеросклероз представляет собой медленно прогрессирующий процесс, при этом одним из его главных признаков является то, что происходит накопление липидных компонентов плазмы, например, сложного холестеринового эфира, в повреждениях стенок кровяного сосуда. Процесс начинается с повреждения эндотельной выстелки сосудистой стенки. В месте повреждения прилипают кровяные пластинки, из которых выделяются различные вещества, которые способствуют увеличению клеток гладкой мускулатуры сосудистой стенки.
В 1984 году специалисты пришли к общему мнению, что причиной коронарных сердечных заболеваний наряду с прочими факторами риска, как например, высоким давлением крови, курением, сахарной болезнью и т.д. в первую очередь, является наличие в сыворотке крови высокого уровня холестерина (Consensus development Conference: YAMA 1985, 2080-2086). Поскольку у большинства больных повышение уровня холестерина происходит не само по себе, было сделано предложение (National Choleroterol Education Program Expert Panel on Detection, Evaluation and Treatment og High Blood Cholesterol in Aduls: Arch. Intern. Med. 1988, 148, 36-39), поддерживать уровень холестерина в сыворотке крови, равным 200 мг/дл. В крови холестерин находится связанным с липопротеинами. С этой точки зрения особо важное значение имеет фракция LDL (Iow density lipoprotein) которая составляет 60-75% циркулирующего в крови холестерина и представляет собой самый опасный компонент. По этой причине очень желательно снижение этого компонента. При уровне холестерина LDL стремятся достигнуть в зависимости от прочих факторов риска значения 130-160 мг/дл. Таких строгих условий можно достичь только при помощи лекарственных средств. Этим объясняется возросшая потребность в лекарственных препаратах, которые способны снижать уровень холестерина в крови. Поскольку целью является не только снижение общего содержания холестерина в сыворотке крови, а также и в выгодном изменении соотношения протеиновых фракций, несущих холестерин, появилась необходимость не только в новых современных лекарствах, тормозящих биосинтез холестерина, но также и в активных веществах, которые наряду с уменьшением общего количества холестерина и LDL-холестерина вызывают повышение фракции HDL (high density fraction), оказывающей защитное действие. В результате новейших исследований кажется желательным снижение уровня триглицерида, рассматриваемого в качестве независимого фактора риска.
Для снижения уровня холестерина и триглицерида в терапевтическую практику внедрились определенные арилоксиалканкарбоновые кислоты, из которых клофибрат, то есть 2-(хлорфенокси)-2-метилэтиловый эфир пропионовой кислоты, следует рассматривать как первое соединение. Кроме того, в продаже появились также соединения аналогичной структуры. Эта структура однако очень далеко от соединений изобретения.
Соединения структуры, аналогичной структуре соединений изобретения, известны из венгерского патента N 193 951. Описанные в этом патенте содержащие серу бензимидазолы отличаются от соединений согласно изобретению тем, что они во 2-ом положении несут заместитель S-алкил, в то время как соединения согласно изобретению содержат атом серы S. Кроме того, соединения согласно настоящему изобретению в 5-ом положении несут в качестве заместителя всегда замещенную в кольце бензильную группу. Вследствие этого различия также и действие новых соединений сильнее, как это показывают результаты проведенных фармакологических исследований.
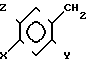
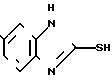
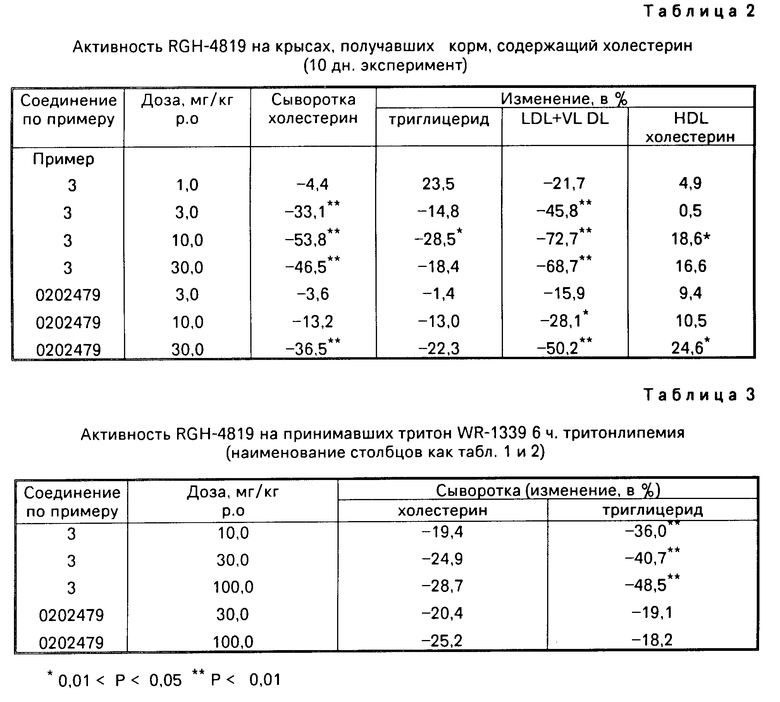
Соединения общей формулы I получают согласно изобретению следующим образом. Замещенные в 4-ом положении 1,2-диаминобензолы общей формулы II.
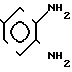 где X,Y и Z имеют указанные значения, приводят во взаимодействие с производным тиоугольной кислоты общей формулы III
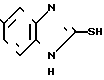
где X,Y и Z имеют указанные значения, приводят во взаимодействие с производным тиоугольной кислоты общей формулы III C= S где V и W независимо друг от друга атом хлора или аминогруппа или V группа общей формулы Me-S-, в которой Ме щелочной металл, а W-метокси- или этоксигруппа, или же V и W вместе другой атом серы или в отдельности каждый имидазолилгруппа.
C= S где V и W независимо друг от друга атом хлора или аминогруппа или V группа общей формулы Me-S-, в которой Ме щелочной металл, а W-метокси- или этоксигруппа, или же V и W вместе другой атом серы или в отдельности каждый имидазолилгруппа.
Особая выгода заключается в том, что соединения общей формулы II приводят во взаимодействие с соединениями общей формулы III, в которой V имеет значение группы общей формулы Ме-S-, а W означает группу метокси- или этокси. Таким соединением является, например, калийэтилксантогенат, представляющий собой твердую стабильную субстанцию. Синтез осуществляют в соответствии с Org. Synth. Coll. Vol. 4,569, (1963). Исходные вещества общей формулы II можно получать восстановлением из соединений, содержащих вместо -СН2- группы -СО-группу. Синтез 3,4-диаминобензофенона известен из литературных источников, когда также содержащие в качестве X, Y и Z указанные заместители диаминобензофеноны являются новыми соединениями.
Кроме того, к предмету изобретения относятся далее препараты лекарственных средств, содержащие в качестве активных веществ соединения общей формулы I, а также способ их получения. Для получения лекарственных препаратов одно или несколько соединений общей формулы I смешивают с традиционными для изготовления лекарственных средств наполнителями, примесями и разбавителями, стабилизаторами, вкусовыми и ароматическими веществами, растворителями, смачивателями, поверхностно-активными веществами и вспомогательными формовочными веществами и формуют формы введения, содержащие каждая единицу дозы, равную преимущественно 20-500 мг активного вещества.
Активность соединений согласно изобретению исследовали следующим образом.
Крыс вида "Ганновер-Вистар" массой 140-160 г кормили в течение 7 дней кормом для крыс "LATI" (Schurr, P.E. Schulze, J.R. Day, C.E. Atheroscherosis Drug Discovery, Ed: C.E.Day; Plenum Puss, vew York, 215 (1976), который содержит 1,5% холестерина и 0,5% хлората натрия. Под действием корма уровень холестерина у животных повысился на 200-250% а количество HDL-холестерина понизилось на 50%
Животных разделили на шесть групп. Лечение было начато на четвертый день с начала кормлений животных содержащим холестерин кормом и продолжалось до конца проведения эксперимента. Соединения вводили крысам в форме суспензии или per os. По истечении времени лечения животных в течение 18 ч не давали корма и после этого их обескровили под эфирным наркозом. В сыворотке крови определили общее содержание холестерина. НDL-холестерин, а также триглицериды при помощи энзимного теста по Бекману. LDL + YLDL были заполнены гепаринмарганцем и определены турбидиметрическим способом (Scgurr, P.E. Schulz, I. P. Day, C.E. Atherosclerosis Drug Discovery, Ed: C.E Day Plenum Press, New York, 215 (1976).
С самым активным соединением, то есть с соединением согласно примеру 3 (в последующем PGH-4819) были проведены исследования, предметом которых было изучение механизма активности. К исследованиям были привлечены при помощи тритона WR-1339 (полимер из октилфенолполиэтиленгликоевого эфира и формальдегида, изготовитель: Serva Feinbiochemica Gmbn et Co. Heidelberg, ФРГ) гиперлипидемически обработанные крысы. Животных лечили в течение 10 дней per os соответствующими дозами соединений и за 6 ч до их умерщвления получили внутривенно тритон в виде одноразовой дозы. В результате введения тритона МР-1339 уровень холестерина в сыворотке крови повышается до 1,5-крат, а уровень триглицерида возрастает от нормальной величины, равной 60-70 мг/дл, до 800-1500 мг/дл. Уровень холестерина повышается в течение шестичасового эксперимента вследствие интенсификации биосинтеза. При таком промежутке времени можно прийти к заключению о торможении биосинтеза холестерина. Высокие величины триглицерида можно объяснить торможением процесса расщепления, поскольку тритон WR-1339 в качестве поверхностно-активного вещества оказывает тормозящее влияние на функцию энзима липопротеинлипазы, участвующего в катаболизме глицеридов.
В качестве базовой субстанции в исследованиях использовали известное из венгерского патента N 193 951 соединение 5-бензил-2-/2-пропенилтио/-бензимидазол-гидрохлорид/ в последующем: 0202479), которое в химическом отношении является структурным аналогом новых соединений.
Результаты исследований приведены в табл. 1,2 и 3. В табл. 1 содержатся результаты исследований, проведенных на крысах, которых кормили содержащим холестерин кормом. В табл. 2 представлена связь доза-активность, изученная в течение 10-дневного эксперимента на крысах, получавших корм, который содержал холестерин. В табл. 3 приведены экспериментальные данные из описанного эксперимента, касающиеся механизма активности.
Короткие эксперименты (7-дневное кормление содержащим холестерин кормом, 4-дневное лечение) свидетельствуют о том, что соединения согласно изобретению оказывают ярко выраженное снижающее уровень холестерина действие. Кроме того, они существенно снижают уровень триглицерида и LDL + LDL. В изменении уровня оказывающего защитное действие HDL проявили соединения различное действие (см.табл.1).
Результаты проведенных на различных уровнях доз исследованиях с целью выяснения взаимосвязи доза-активность (см.табл.1) указывают на тот факт, что соединение согласно изобретению снижают уровень холестерина в крови пропорционально дозе. Аналогично хорошие результаты можно было отметить также и в случае атерогенно действующей фракции LDL YLDL. Несколько возросло также и количество проявляющей защитное действие фракции HDL. Снижение уровня триглицеридов было умеренным. Эти действия превосходили по своей активности действие базовой субстанции.
Результаты исследований, проведенные с тритоном WR-1339 на гиперлипидемически сделанными крысами для выяснений механизма действия, свидетельствуют о том, что соединение согласно изобретению обладает большей активностью по сравнению с базовой субстанцией. Большая активность проявляется прежде всего в снижении уровня триглицерида, но также и снижение уровня холестерина находится в зависимости от дозы. Данные исследований позволяют сделать заключение о том, что активное вещество или тормозит биосинтез, или тормозит поглощение холестерина. Снижение уровня триглицерида можно с уверенностью объяснить тем, что активное вещество активизирует играющий важную pоль в расщеплении триглицеридов, заторможенный тритоном энзим липопротеинлипазы.
В табл. 1 дана снижающая липиды активность у крыс, принимавших содержащий холестерин корм (7-ми дневное кормление содержавшим холестерин кормом, 4-рех дневное лечение).
Перевод надписей на таблице 1:1 соединение, 2 доза мг/кг per os, 3 сыворотка, холестерин, 4 изменение в триглицерид, 5 пример.
Табл. 2. Активность RGH-4819 на крысах, кормивших содержащим холестерин кормом (10-дневный эксперимент). Надписи на таблице соответствуют надписям на табл.1.
В табл. 3 дана активность RGH-4819 на принимавших тритон WR-1339, 6-ти часовая тритонлипемия. Надписи на таблице соответствуют надписям на таблице 1. * 0,01 < <Р < 0,05; ** Р < 0,01.
П р и м е р 1. 5-[(4-Хлорфенил)-метил]-2,3-дигидро-1Н-бензимидазол-2-тион.
6,54 г (99 моль) 85%-ного гидрата окиси калия растворяют в смеси из 40 мл этанола и 18 мл воды и к раствору добавляют 13,75 г (45 мМоль) (4-[(4-хлорфенил)-метил] -o-фенилендиамин-дигидрохлорида. Смесь перемешивают при 60оС до полного растворения около 5 мин. После этого раствор смешивают с 8,65 г (54 мМоль) О-этил-S-дитиокарбонатом калия и кипятят в течение 9 ч. Затем реакционную смесь вливают в 400 мл и при непрерывном помешивании подкисляют небольшими порциями уксусной кислоты (около 10 мл). Суспензию перемешивают еще в течение 1 ч, после чего продукт отфильтровывают и промывают до полного отсутствия сульфида 5 х 80 мл воды. Нутч-влажный продукт растворяют в кипящем н-бутаноле и раствор осветляют активированным углем. Кристаллизованный продукт плавится при 275-280оС. Выход 10,3 (83%).
П р и м е р 2. 5-[(4-Метилфенил)-метил]-2,3-дигидро-1Н-бензимидазол-2-тион.
Титульное соединение получают описанным в примере 1 образом из 12,83 г (45 мМолей) 4-1 (4-метилфенил)-метил-1-о-фенилендиамин-дигидрохлорида. Сырой продукт перекристаллизуют из н-бутанола. Выход 9,77 (85%), т.пл. 258-260оС.
П р и м е р 3. 5-[(4-метоксифенил)-метил]-2,3-дигидро-1Н-бензимидазол-2-тион.
1,15 г (17 мМолей) 85%-ного твердого гидрата окиси калия растворяют в смеси из 70 мл этанола и 23 мл воды. К раствору добавляют 19 г (83,2 мМоля) 4-[(метоксифенил)-метил] -o-фенилендиамин-дигидрохло- рида и 15,4 г (95,8 мМоля) О-этил-О-дитиокарбоната калия. Смесь кипятят в течение 9 ч и затем выливают в 900 мл воды. Сырой продукт выделяют описанным в примере 1 образом и в нутч-влажном состоянии растворяют в 800 мл изопропанола. После проведенного при высокой температуре осветления активированным углем соединение кристаллизуют. Выход 18,0 г (80%), т.пл. 254-255оС.
П р и м е р 4. 5-[(4-Метоксифенил)-метил[-2,3-дигидро-1Н-бензимидазол-2-тион.
К смеси из 22 мл этанола, 3,5 мл воды и 0,83 г (12,6 мМоля) 85%-ного гидрата окиси калия добавляют 2,5 г (10,95 мМолей) 4-[(4-метоксифенил)-метил] -о-фенилендиамина и 0,96 г (0,76 мл, 12,6 мМолей) сероуглерода. Смесь кипятят в течение 5 ч с обратным холодильником, после чего охлаждают, смешивают с 25 мл воды и затем при охлаждении льдом снаружи и интенсивном помешивании подкисляют 2,80 г 59%-ной уксусной кислоты (23,3 мМолей). После перемешивания в течение одного часа продукт отфильтровывают и промывают 3 х 20 мл водой. Нутч-влажный продукт растворяют в 70 мл изопропанола и после проведенного при высокой температуре осветления активированным кристаллизуют. Выход 1,64 г (55,4%) белого кристаллического титульного соединения, т. пл. 254-255оС.
П р и м е р 5. 5-[(4-Метоксифенил)-метил]-2,3-дигидро-1Н-бензимидазол-2-тион.
Смесь из 0,35 г (1,16 мМоля) 4-[(4-метоксифенил)-метил]-o-фенилендиамин-дигидрохлорида и 0,286 г (3,75 мМоля) тиомочевины расплавляют на масляной ванне при 150-169оС и при этой температуре выдерживают в течение 2 ч. После охлаждения смесь растворяют с 10%-ным водным раствором карбоната натрия и полученную таким образом суспензию перемешивают в течение 1 ч. Сырой продукт отфильтровывают, четыре раза промывают водой и затем кристаллизуют из изопропанола после проведенного при высокой температуре осветления. Выход 88 мг (28%), т.пл. 252-254оС.
П р и м е р 6. 5-[(4-Метоксифенил)-метил]-2,3-дигидро-1Н-бензимидазол-2-тион.
К раствору 1,14 г (5,0 мМолей) 4-[(4-метоксифенил)-метил]-о-фенилендиамин в 30 мл безводного тетрагидрофурана добавляют при наружном охлаждении водой каплями раствор 0,98 г (5,5 мМолей) N,N'-тиокарбонил-имидазола в 15 мл безводного тетрагидрофурана. Реакционную смесь перемешивают при окружающей температуре в течение 5 ч, после чего смешивают с 1,5 мл воды и затем продолжают перемешивать еще в течение получаса. После перемешивания растворитель удаляют в вакууме и сгущенный остаток обрабатывают водой. Сырой продукт отфильтровывают и трижды промывают водой, после чего описанным в примере 5 образом перекристаллизуют из изопропанола. Выход 0,9 г (51,0%), т.пл. 253-255оС.
П р и м е р 7. 5-[(4-Метоксифенил)-метил]-2,3-дигидро-1Н-бензимидазол-2-тион.
К раствору 0,51 г (5,0 мМолей) триэтиламина и 1,14 мг (5,0 мМолей) 4-[(4-метокси-фенил)-метил] -o-фенилендиамина в 35 мл хлороформа при наружном охлаждении водой добавляют по каплям раствор 0,58 г (5,0 мМолей) тиофосгена в 10 мл хлороформа. Реакционную смесь перемешивают в течение 1 ч при температуре среды окружающей, после чего растворитель удаляют в вакууме. Сгущенный остаток растирают с 5%-ным раствором карбоната натрия и после двухчасового перемешивания отфильтровывают. Сырой продукт трижды промывают водой и затем перекристаллизовывают из изопропанола описанным в примере 5 образом. Выход 0,68 г (50,3%), т.пл. 254-255оС.
П р и м е р 8. 5-[(3,4-Диметоксифенил)-метил]-2,3-дигидро-1Н-бензимидазол-2- тион.
Целевое соединение получают из 18,30 г (70,9 мМолей) 4-[(3,4-диметоксифенил)-метил] -o-фенилендиамина при соблюдении указанного в примере 3 молярного соотношения и реакционных условий. Сырой продукт очищают из н-бутанола перекристаллизацией. Выход 7,1 г (33%), т.пл. 253-256оС.
П р и м е р 9. 5-[(2-Гидрокси-4-метоксифенил)-метил]-2,3-дигидро- 1Н-бензимидазол-2-тион.
Целевое соединение получают из 22,83 г (50,0 мМолей) 4-[(2-гидрокси-4-метоксифенил)-метил] -o-фенилендиамина при соблюдении указанного в примере 3 молярного соотношения и условий реакции. Сырой продукт очищают из н/бутанола перекристаллизацией. Выход 14,0 г (49%), т.пл. 248-250оС.
П р и м е р 10. 5-[(4-Этоксифенил)-метил]-l2,3-дигидро-1Н-бензимидазол-2-тион.
Титульное соединение получают из 12,1 г (50,0 мМолей) 4-[(этоксифенил-метил] -o-фенилендиамина при соблюдении указанного в примере 3 молярного соотношения и реакционных условий. Сырой продукт очищают перекристаллизацией из н-бутанола. Выход 11,6 г (82%), т.пл. 243-246оС.
П р и м е р 11. 5-[(2,5-Диметоксифенил)-метил]-2,3-дигидро- 1Н-бензимидазол-2-тион.
Титульное соединение получают из 18,30 г (70,9 мМолей) 4-[2,5-диметоксифенил-метил] -o-фенилендиамина при соблюдении указанного в примере 3 молярного соотношения и реакционных условий. Сырой продукт очищают из н-бутанола перекристаллизацией. Выход 15,5 г (73%), т.пл. 210-211оС.
П р и м е р 12. Изготовление таблеток, содержащих 30 г активного вещества. Пользуясь традиционными методами таблетирования изготавливают таблетки диаметром 9 мм и массой 250 мг согласно следующему составу, мг:
5-[(4-Метоксифенил)-ме-
тил]-2,3-дигидро-
1Н-бензимидазол- 2-тион 30,0 Лактоза 130,0 Крахмал 64,0
Поливинилпирро- лидон (поливидон) 5,0
Микрокристалли- ческая целлюлоза 10,0 Тальк 7,5 Стеарат магния 2,5
Коллоидная крем- невая кислота 1,0
П р и м е р 13. Изготовление капсул, содержащих 125 мг активного вещества.
Самозакрывающиеся капсулы из твердой желатины величины 1 заполняют смесью следующего состава, мг:
5-[(4-Метоксифенил)-
метил]-2,3-дигидро-
1Н-бензимидазол-2- тион 150,0
Поливинилпирро- лидон (поливидон) 5,0
Микрокристалли- ческая целлюлоза 58,0 Тальк 6,0 Стеарат магния 5,0
Коллоидная крем- невая кислота 1,0
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИДНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2271361C2 |
| ПЕНТАПЕПТИД И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИНГИБИТОР ПРОЛИФЕРАЦИИ ЭПИДЕРМАЛЬНЫХ КЛЕТОК | 1991 |
|
RU2018510C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ СОЛИ ПРИСОЕДИНЕНИЯ КИСЛОТ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2037499C1 |
| ПРОИЗВОДНЫЕ АНДРОСТАНА, ЗАМЕЩЕННЫЕ ПО 16-ПОЛОЖЕНИЮ ЧЕТВЕРТИЧНОЙ АММОНИЕВОЙ ГРУППОЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124021C1 |
| ПРОИЗВОДНЫЕ АМИДА АКРИЛОВОЙ КИСЛОТЫ ИЛИ ИХ СОЛИ С ОРГАНИЧЕСКИМ ИЛИ НЕОРГАНИЧЕСКИМ ОСНОВАНИЕМ, ОБЛАДАЮЩИЕ ЦИТОПРОТЕКТОРНОЙ И ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ, И СОСТАВ, ОБЛАДАЮЩИЙ ЦИТОПРОТЕКТОРНОЙ И ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 1990 |
|
RU2021259C1 |
| ПРОИЗВОДНЫЕ 17-ГАЛОГЕН-4-АЗААНДРОСТЕНА | 1993 |
|
RU2103275C1 |
| СПОСОБ ПОЛУЧЕНИЯ β- ЗАМЕЩЕННОГО 4-АЗААНДРОСТАНА | 1993 |
|
RU2109746C1 |
| СОЛИ АКРИЛОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ ЦИТОПРОТЕКТОРНУЮ И ПРОТИВОЯЗВЕННУЮ АКТИВНОСТЬ, И СОСТАВ, ОБЛАДАЮЩИЙ ЦИТОПРОТЕКТОРНОЙ И ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 1990 |
|
RU2021260C1 |
| ПРОИЗВОДНЫЕ ПРОПАН-2-ОЛА | 1994 |
|
RU2127277C1 |
| Способ получения производных стероидспирооксатиазолидинов в виде их стереоизомеров или их смесей или их солей | 1981 |
|
SU1079177A3 |
Использование: в химии гетероциклических веществ, в частности в способе получения производных замещенного 5-бензилом бензимидазолин-2-тиона. Сущность изобретения: способ получения производных замещенного 5-бензилом бензимидазолин-2-тиона ф-лы 1, где заместители Z, X, Y,V, W соответствующие значения, предусматривает взаимодействие соединения ф-лы 2 с соединением ф-лы 3. Структура соединений ф-лы 1, 2 и 3. 
 3 с. и 5 з.п.ф-лы, 3 табл.
3 с. и 5 з.п.ф-лы, 3 табл.
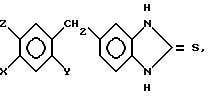
где X галоген, метил, этил, метокси, этокси;
Y водород, метокси, этокси;
Z водород,
в случае, когда X водород, Y метокси или этокси, Z метокси или этокси, если X метокси или этокси, то Y гидрокси, если X метокси или этокси, то Y метокси или этокси, Z метокси или этокси.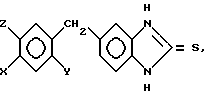
где X галоген, метил, этил, метокси, этокси;
Y водород, метокси, этокси;
Z водород, в случае, когда X водород, Y метокси или этокси, Z - метокси или этокси, то Y гидрокси, если X метокси или этокси, то Y - метокси или этокси, Z метокси или этокси, отличающийся тем, что проводят взаимодействие замещенных в 4-ом положении 1,2-диаминобензолов общей формулы II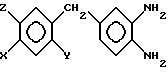
где X,Y,Z имеют указанные значения,
с производным тиоугольной кислоты общей формулы III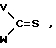
где V и W, независимо друг от друга, хлор или аминогруппа, или V - группа общей формулы Me -S -, где Me щелочной металл, а W метокси- или этоксигруппа, или V и W вместе сера или каждый группа имидазолина.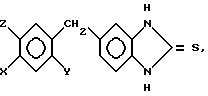
где Х галоген, метил, этил, метокси, этокси;
Y водород, метокси, этокси;
Z водород,
в случае, когда X водород, Y метокси или этокси, Z метокси или этокси, если X метокси или этокси, то Y гидрокси, если X метокси или этокси, то Y метокси или этокси, Z метокси или этокси,
в эффективном количестве.
| 0 |
|
SU193951A1 | |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-09-10—Публикация
1991-09-02—Подача