Изобретение относится к пищевой промышленности, а именно к способам определения переваримости белков пищевых продуктов.
Известен способ определения переваримости белков "in vitro" по нарастанию продуктов их ферментативного гидролиза. Способ предусматривает проведение двухстадийного ферментативного гидролиза в условиях, приближенных к естественному процеcсу в желудочно-кишечном тракте человека. На первой стадии ферментативный гидролиз осуществляют пепсином в кислой среде (рН 1,2), на второй трипсином в слабощелочной среде (рН 8,2). Температура гидролиза 37оС. Количество низкомолекулярных продуктов гидролиза белка определяют методом Лоури и выражают в мг тирозина на мл раствора [1]
Недостатком способа является несопоставимая информативность, предопределенная тем, что одинаковые количества белка пищевых продуктов, взятые для определения переваримости, содержат различные массовые доли тирозина.
Известна другая модификация данного способа, предусматривающая для полного определения низкомолекулярных продуктов пепсинтрипсинового гидролиза осуществление диализа гидролизуемой субстанции в отношении дистиллированной воды [2]
Этому способу присущ недостаток предыдущего.
Наиболее близким к предлагаемому техническому решению по условиям проведения гидролиза является способ, предусматривающий использование для осуществления пепсиновой стадии гидролиза глицинового буфера с рН от 1,5 до 2,5 и для осуществления трипсиновой стадии гидролиза глицинового буфера с рН 8,4 [3]
Этому способу присущ недостаток двух предыдущих.
Данным изобретением решается задача повышения точности определения переваримости белков "in vitro" пищевых продуктов.
Для этого в способе определения переваримости белков "in vitro" пищевых продуктов, предусматривающем проведение двух стадий ферментативного гидролиза в условиях, приближенных к естественному процессу в желудочно-кишечном тракте человека, кислыми и щелочными протеазами, количество накапливающихся низкомолекулярных продуктов гидролиза определяют в мг тирозина на мл раствора, при этом дополнительно определяют массовую долю тирозина в белке исходного пищевого продукта и о переваримости судят по процентному отношению массовой доли тирозина в гидролизате к массовой доле тирозина в белке исходной пробы продукта.
Способ осуществляют следующим образом.
Пищевой продукт, содержащий приблизительно 150 мг белка, помещают во внутренний сосуд. Туда же вносят 15 мл глицинового буферного раствора (рН 2,2). В наружный сосуд в целях соблюдения изоионии вводят 60 мл того же раствора. Внутренний сосуд вставляют в наружный так, чтобы нижняя поверхность его дна погружалась в раствор при условии равенства уровней жидкости во внутреннем и наружном сосудах. Пробы инкубируют в термостате при 37оС. Когда наступает уравнивание температуры во всей системе, во внутренний сосуд добавляют 15 мг кристаллического пепсина. Концентрация фермента при этом равна 1 мг/мл, т. е. соответствует средней его концентрации в желудочном содержимом на высоте переваривания. Реакцию проводят при перемешивании жидкости мешалкой со скоростью 60 об/мин. Через 3 ч из наружного сосуда отбирают 1 мл жидкости.
В случае проведения дальнейшего гидролиза продуктов пепсинового переваривания трипсином жидкость из наружного сосуда заменяют равным объемом 0,05 М "щелочного" глицинового буферного раствора, имеющего рН 8,4. Пробы во внутренних сосудах нейтрализуют добавлением 2,0 н. раствора NaOH. Затем добавляют 0,2 н. раствор NaOH, доводя до щелочной реакции среды, близкой к оптимальной для действия трипсина.
После этого во внутренний сосуд добавляют 15 мл буферного раствора (рН 8,4). Пробы термостатируют и, выравнив температуры, вносят 15 мг кристаллического трипсина.
Концентрация фермента при этом равна 0,5 мг/мл, т.е. соответствует средней концентрации его в кишечном содержимом человека. Пробы отбирают также, как и при работе с пепсином. Продукты гидролиза определяют методом Лоури и выражают в мкг тирозина.
Для определения массовой доли тирозина в белке исходной пробы к исследуемой навеске белка добавляют 25 мл 6 н. HCl и выдерживают его в запаянной ампуле 24 ч при температуре 110оС, фильтруют через стеклянный фильтр. 10 мл гидролизата нейтрализуют сначала 6 н. раствором NaOH, затем доводят рН до 7,0. Продукты гидролиза определяют методом Лоури. Величину оптической плотности измеряют на ФЭК-56.
Переваримость определяют отношением массовой доли тирозина в гидролизате к массовой доле тирозина в белке исходной пробы, выраженным в
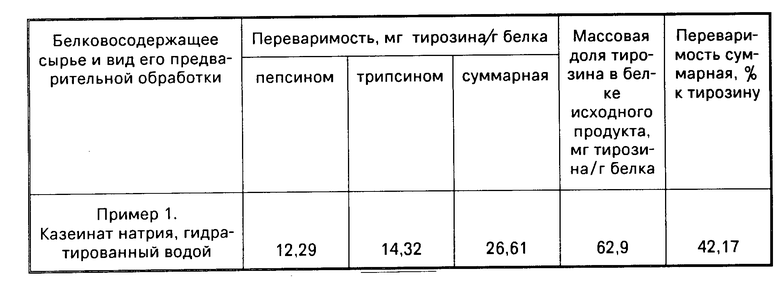
П р и м е р 1. 0,172 г казеината натрия гидратированного водой (1:4), содержащего 150 мг белка, помещают во внутренний сосуд прибора. Вносят 15 мл глицинового буфера (рН 2,2). В наружный сосуд в целях соблюдения изоионии вводят 60 мл того же раствора. Пробы инкубируют в термостате при температуре 37оС. Когда наступает уравнивание температуры во всей системе, во внутренний сосуд добавляют 15 мг кристаллического пепсина. Реакцию проводят при перемешивании жидкости мешалкой со скоростью 60 об/мин. Через 3 ч из наружного сосуда отбирают 1 мл жидкости.
В случае проведения дальнейшего гидролиза продуктов пепсинового переваривания трипсином жидкость из наружного сосуда заменяют равным объемом "щелочного" глицинового буферного раствора, имеющего рН 8,4. Пробы во внутренних сосудах нейтрализуют NaOH, после этого добавляют 15 мл буферного раствора (рН 8,4). Пробы термостатируют и, выравнив температуры, вносят 15 мг трипсина.
Количество низкомолекулярных продуктов гидролиза белка определяют методом Лоури и выражают в условных единицах мг тирозина на 1 мл раствора.
Для проведения полного гидролиза к исследуемой навеске белка добавляют 25 мл 6 н. HCl и выдерживают в запаянной ампуле 24 ч при температуре 110оС, фильтруют через стеклянный фильтр. 10 мл гидролизата нейтрализуют сначала 6 н. раствором NaOH, доводят рН до 7,0. Затем определяют массовую долю тирозина в белке исходного продукта, величину оптической плотности измеряют на ФЭК. Переваримость определяют отношением массовой доли тирозина в гидролизате к массовой доле тирозина в белке исходной пробы, выраженным в
Экспериментальные данные, характеризующие переваримость белка "in vitro" казеината натрия, приведены в таблице.
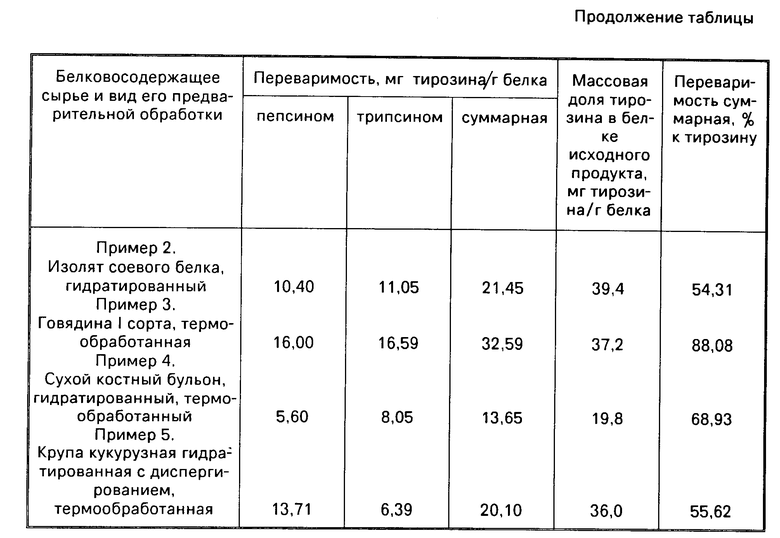
П р и м е р 2. По примеру 1 для определения переваримости белка "in vitro" берут 0,166 г изолята соевого белка, гидратированного водой в соотношении (1:4).
Экспериментальные данные, характеризующие переваримость белка "in vitro" изолята соевого белка, приведены в таблице.
П р и м е р 3. По примеру 1 для определения переваримости белка "in vitro" берут 0,75 г говядины, предварительно термообработанной в течение 40 мин при температуре 72оС.
Экспериментальные данные, характеризующие переваримость белка "in vitro" говядины, приведены в таблице.
П р и м е р 4. По примеру 1 для определения переваримости берут 0,172 г сухого костного бульона, предварительно гидратированного и термообработанного при температуре 72оС в течение 40-45 мин.
П р и м е р 5. По примеру 1, для определения переваримости белка берут 1,807 г крупы кукурузной, гидратированной водой (1:4), диспергированной и термообработанной 20-25 мин при температуре 90-95оС.
Экспериментальные данные, характеризующие переваримость белка "in vitro" крупы кукурузной, приведены в таблице.
Из таблицы видно, что массовая доля тирозина в белке исходного продукта различна, так как в сухом костном бульоне содержание тирозина в белке 19,8 мг тирозина/г белка, а в изоляте соевого белка 39,4 мг тирозина/г белка.
Из таблицы очевидно, что задача повышения точности определения переваримости белков "in vitro" пищевых продуктов достигается.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ ПИЩЕВОЙ ЦЕННОСТИ МОЛОЧНЫХ ПРОДУКТОВ | 1992 |
|
RU2035873C1 |
| СПОСОБ ПОДГОТОВКИ МЯСА ДЛЯ ПРОИЗВОДСТВА МЯСОПРОДУКТОВ | 1992 |
|
RU2035881C1 |
| СОСТАВ ЗАЩИТНОГО СЪЕДОБНОГО ПЛЕНКООБРАЗУЮЩЕГО ПОКРЫТИЯ ДЛЯ МЯСА И МЯСНЫХ ПРОДУКТОВ | 2009 |
|
RU2411738C1 |
| СПОСОБ ПРОИЗВОДСТВА МЯСНОГО ПРОДУКТА | 1998 |
|
RU2142724C1 |
| ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКАЯ ПАШТЕТНАЯ МАССА ДЛЯ ПИТАНИЯ ЖЕНЩИН В ПЕРИОД ЛАКТАЦИИ | 1994 |
|
RU2077233C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОИЗВОДСТВА ГЕРОДИЕТИЧЕСКОГО ПРОДУКТА | 1993 |
|
RU2035882C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО ЭМУЛЬСИОННОГО ПРОДУКТА ДЛЯ ЭНТЕРАЛЬНОГО ПИТАНИЯ, СОДЕРЖАЩЕГО ДИЕТИЧЕСКИЕ ВОЛОКНА | 2001 |
|
RU2199925C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПЕРЕВАРИМОСТИ БЕЛКОВ | 1991 |
|
RU2022021C1 |
| Способ определения качества кулинарных изделий после хранения | 1984 |
|
SU1388793A1 |
| СПОСОБ ВЫДЕЛЕНИЯ АНГИОГЕНИНА | 1996 |
|
RU2109748C1 |
Использование: изобретение относится к пищевой промышленности, а именно к способам определения переваримости белков пищевых продуктов in vitro. Сущность изобретения: способ определения переваримости белков пищевых продуктов in vitro предусматривает проведение двухстадийного ферментативного гидролиза в условиях, приближенных к естественному процессу в желудочно-кишечном тракте человека, кислыми и щелочными протеазами и дополнительное определение массовой доли тирозина в белке исходного пищевого продукта, а о переваримости судят по процентному отношению массовой доли тирозина в гидролизате к массовой доле тирозина в белке исходной пробы продукта. 1 табл.
СПОСОБ ОПРЕДЕЛЕНИЯ ПЕРЕВАРИМОСТИ БЕЛКОВ ПИЩЕВЫХ ПРОДУКТОВ IN VITRO, предусматривающий проведение двухстадийного ферментативного гидролиза продукта кислыми и щелочными протеазами в условиях, приближенных к естественному процессу в желудочно-кишечном тракте человека, и последующее определение количества накапливающихся низкомолекулярных продуктов гидролиза в мг тирозина на 1 мл раствора, отличающийся тем, что дополнительно определяют массовую долю тирозина в белке исходного продукта и о степени переваримости судят по процентному отношению массовой доли тирозина в гидролизате к массовой доле тирозина в белке исходной пробы продукта.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Соловьев В.И | |||
| и др | |||
| Специфические методы оценки ферментированного мяса | |||
| Труды ВНИИМПа, вып | |||
| XXII, 1969, с | |||
| Соломорезка | 1918 |
|
SU157A1 |
Авторы
Даты
1995-10-20—Публикация
1993-04-16—Подача