Изобретение относится к области биотехнологии и может быть использовано для получения моноклональных антител (мкАТ) к фенобарбиталу.
Лекарственный препарат фенобарбитал незаменим в противосудорожной терапии, однако он обладает узким терапевтическим интервалом, из-за чего при его применении возможны нежелательные побочные токсические явления. Кроме того, фенобарбитал обладает способностью стимулировать собственный метаболизм, из-за чего его концентрации могут сильно отличаться у разных больных. Для повышения безопасности и эффективности терапии необходим контроль за концентрацией препарата в организме больного и индивидуальный подбор дозы. Это стало возможным после появления доступных иммуноаналитических методов для измерения концентрации этого препарата в крови. Для иммуноанализа фенобарбитала необходимы высокоспецифические антитела. Большие возможности для получения антител нужной специфичности открываются при использовании гибридомной технологии. Кроме того моноклональные антитела всегда предпочтительнее для использования в иммуноанализе из-за их гомогенности и доступности в неограниченных количествах, что позволяет стандартизировать условия анализа. Поэтому в настоящее время все ведущие фирмы по производству иммуодиагностикумов переходят с поликлональных антител на моноклональные.
Описано несколько способов получения поликлональных антител к фенобарбиталу, позволяющих получить антитела хорошей специфичности пригодные для иммуноанализа (Res. Commun.Chem. Pathol. Pharmacol. 28,2,309-317,(1980); J. Biochem. 73,5,1115-1118, (1973); US Patent 3995021 (1976), но данных по получению моноклональных антител к фенобарбиталу в литературе не обнаружено.
Целью изобретения является получение гибридных культивируемых клеток мыши линии ВАLB/с, продуцирующих мкАТ, обладающие высокой аффинностью и специфичностью и пригодные для разработки иммуноаналитических тест-систем для определения концентрации фенобарбитала в биологических жидкостях.
Для получения гибридомных клеток, продуцирующих мкАТ сливали клетки мышиной миеломной линии Х63.Ag 8.653. и сплентоциты мыши линии ВАLB/c, иммунизированной коньюгированным антигеном фенобарбитала с гемоцианином из моллюска keyhole limpet.
Мыши иммунизировались в течение 3-4 месяцев, периодически сыворотка животных анализировалась на присутствие антител к фенобарбиталу.
Анализ осуществляли твердофазным иммуноферментным методом, в качестве антигена использовали коньюгированный антиген фенобарбитала с бычим сывороточным альбумином. У животных с высоким титром антител к дигоксину брали селезенки и выделяли из них клетки для слияния.
Миеломная линия Х63.Аg8.653. стабильная миеломная линия не секретирующая иммуноглобулины, была выбрана в качестве второго партнера для слияния. Слияние клеток проводили с использованием полиэтиленгликоля. Отношение числа селезеночных клеток к числу миеломных клеток варьировали от 5:1 до 1:1. После слияния клетки разбавлялись и культивировались в селективной среде, содержащей аминоптерин, гипоксантин и тимидин до появления растущих клонов. Супернатанты анализировали твердофазным иммуноферментным методом, в качестве антигена использовали коньюгат фенобарбитал-БСА, антитела обнаруживали с помощью кроличьих антител к IgG мыши, меченных пероксидазой хрена, так что выявились только клоны, продуцирующие антитела класса G.
Дополнительный анализ синтезируемых антител производили по ингибированию фенобарбиталом и его аналогами связывания антител с сорбированным конъюгатом фенобарбитал-БСА. Положительные клоны повторно клонировали. Из положительных клонов был выбран клон 1А9, продуцирующий антитела наиболее аффинные и с минимальной перекрестной реактивностью по отношению к аналогам фенобарбитала. Кафф антител 1А9 составляет 1,6˙109 м-1. Клон продуцирует антитела, относящиеся к подклассу IgG2b.
Важной характеристикой гибридомы 1А9 является ее стабильность и способность расти в асцитных опухолях.
Для получения больших количеств антител гибридные клетки вводили внутрибрюшинно мышам, предварительно сенсибилизированным пристаном. Антитела из асцитных жидкостей выделяли ионообменной хроматографией на ДЕАЕ-целлюлозе. На основе полученных мкАТ разработаны два метода определения фенобарбитала, основанные на поляризации флуоресценции и на применении в качестве метки пероксидазы хрена, позволяющие определять фенобарбитал в минимальном объеме сыворотки крови (10-20 мкл) с большой точностью и специфичностью.
Штамм получают следующим образом.
1. Получение гаптен-белковых конъюгатов.
м-Аминофенобарбитал синтезировали нитрованием фенобарбитала азотной кислотой и последующим восстановлением 5-этил-5-нитрофенилбарбитуровой кислоты водородом в присутствии палладия на угле как катализатора (J.Amer. Chem. Soc. 1953, V75, P.700-704). Конъюгат фенобарбитала с гемоцианином (ФБ-КLH) получали реакцией диазониевой соли м-аминофенобарбитала с белком-носителем по известному методу (J. Biochem, 1973, V73, P.115-1118). Cодержание гаптена в этом конъюгате было определено по УФ-спектру и составляло 230 моль гаптена на 1 моль белка. Конъюгат фенобарбитала с бычьим сывороточным альбумином (ФБ-БСА) синтезировали добавляя к смеси 30 мг м-аминофенобарбитала в 50 мкл диметилформамида и 90 мг БСА в 12 мл физиологического раствора, забуференного до pH 7,4 (ЗФР), по каплям в течение 30 мин 80 мкл 25%-ного глутарового альдегида. После инкубации при перемешивании в течение 2 ч реакционную смесь диализовали против ЗФР. Затем добавляли 4 мг NaBH и смесь инкубировали 3 ч при 20оС. После диализа против воды конъюгат лиофилизовали. Полученный конъюгат содержал 19 моль гаптена на 1 моль белка.
2. Иммунизация.
Мышей линии ВАLB/c, самок, иммунизировали внутрибрюшинно 100 мкг коньюгированного антигена фенобарбитал-гемоцианин, суспендированного в 100 мкл физиологического раствора и 200 мкл полного адьюванта Фрейнда. Инъекцию повторяли через 6 недель и далее через 2-4 недели с неполным адьювантом. Через 7 дней после последней иммунизации у мышей брали кровь и сыворотки анализировали на присутствие антител твердофазным иммуноферментным методом. Для завершающей иммунизации отбирали мышей, в сыворотках которых обнаруживали наибольший титр антител к фенобарбиталу. За 3 дня до гибридизации таким мышам вводили по 100 мкг антигена без адьюванта.
3. Твердофазный иммуноферментный метод обнаружения антител к фенобарбиталу.
Конъюгированный антиген фенобарбитал-БСА растворяли в 0,05 М карбонат-бикарбонатном буфере, pH 9,6 в концентрации 1 мкг/мл и сорбировали на полистироловых 96-луночных планшетах по 100 мкл на лунку, при 4оС в течение ночи, затем твердую фазу отмывали 0,05%-ным раствором тритона Х-100 и водой. В лунки вносили по 90 мкл 0,01 М натрий-фосфатного буфера, содержащего 0,15 М NaCl, 0,05% твин-20 и 0,2% БСА (буфер А). В первую лунку вносили 10 мкл сыворотки и далее делали серию десятикратных разведений до конца ряда. После инкубации в течение 1 ч при комнатной температуре планшет промывали и вносили в каждую лунку по 90 мкл кроличьих антител против иммуноглобулинов мыши, меченых пероксидазой хрена, растворенных в буфере А. Планшет инкубировали 45 мин, отмывали и для измерения ферментной активности добавляли субстратный раствор (4 мкл 30% Н2О2 и 4 мг ортофенилендиамина на 10 мл 0,1 М натрий цитратного буфера pH5), по 90 мкл, через 10 мин для остановки ферментативной реакции добавляли по 45 мкл 10%-ного раствора серной кислоты и измеряли поглощение при 492 нм.
4. Гибридизация.
У иммунизированной мыши брали селезенку в стерильных условиях и готовили суспензию спленоцитов. Клетки миеломной линии Р3-Х63.Ag 865.3. отмывали средой без сыворотки и сливали со спленоцитами в соотношении 1:1, используя 30% полиэтиленгликоль 6000, 1 мл. Слившиеся клетки отмывали бессывороточной средой суспендировали в 50 мл среды RPM1 1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 5˙10-5 М 2-меркаптоэтанола, 1 мМ пируват натрия, 100 единиц пенициллина и стрептомицина4˙10-7 М аминоптерина, 10-4 М гипоксантина, 1,6˙10-5 тимидина и разливали в 96-луночные планшеты, содержащие фиддерный слой мышиных перитониальных макрофагов по 50 мкл в лунку. Через неделю планшеты начинали сканировать ежедневно, супернатанты от активно растущих клонов отбирали и анализировали на присутствие антител к фенобарбиталу. Активные клоны переносили в 24-луночные планшеты, часть клеток замораживали.
5. Отбор положительных клонов.
Для отбора положительных клонов использовали твердофазный иммуноферментный метод. Конъюгированный антиген фенобарбитал-БСА сорбировали в 96-луночных планшетах, как описано в п.3. В качестве положительных контролей использовали сыворотки мышей, содержащие антитела к фенобарбиталу (разведение 1: 200), в качестве отрицательных контролей сыворотки неиммунизированных мышей и супернатанты от миеломных линий. Был выявлен 41 положительный клон. Далее была изучена способность антител, продуцируемых этими клонами, связывать свободный фенобарбитал. Сродство антител к фенобарбиталу определяли по ингибированию связывания антител с иммобилизованным антигеном в присутствии свободного фенобарбитала. Было отобрано 3 клона, активно секретирующих антитела к фенобарбиталу. Эти клоны были проанализированы аналогичным образом на способность связывать аналоги фенобарбитала. п-оксифенобарбитал, веронал и мединал.
Для дальнейшей работы был выбран клон 1А9, обладающий наименьшей перекрестной реакций по отношению к аналогам фенобарбитала.
6. Клонирование методом предельных разведений.
Клетки выбранного клона клонировали методом предельных разведений в 96-луночном планшете, содержащем фиддерный слой макро-фагов, из расчета 0,3 клетки на лунку. После появления клонов супернатанты тестировали на присутствие моноклональных антител. Все выросшие клоны пpодолжали продуцировать антитела к фенобарбиталу.
7. Производство моноклональных антител в виде асцита.
Для получения больших количеств антифенобарбиталовых антител гибридомные клетки вводили внутрибрюшинно мышам линии ВАLB/c, за 10 дней до того получившим инъекции 0,5 мл пристана, по 3х106 клеток на животное. После появления у мышей асцитных опухолей (через 5-14 дней) собирали асцитную жидкость, клетки удаляли центрифугированием, асцитную жидкость замораживали и хранили при -20оС. От каждой мыши получали по 5-10 мл асцита, содержащего от 5 до 8 мг/мл антител.
Полученный штамм гибридных культивируемых клеток 1А9 хранится в Специализированной коллекции перевиваемых соматических клеток позвоночных Всесоюзной коллекции клеточных культур под номером ВСКК(П) 621 Д.
Штамм характеризуется следующими признаками.
Культуральные свойства клона 1А9.
Клетки культивируются в монослое в концентрации 5-10 клеток/мл, время субкультивирования составляло около 48 ч.
Криоконсервирование.
Криоконсервирование гибридомы осуществляли в смеси равных объемов среды RPM1 1640 и телячьей эмбриональной сыворотки, содержащей 15% диметилсульфоксида по 10 клеток в ампуле. Первые трое суток ампулы хранили при -70оС, затем переносили в жидкий азот. После разморозки клетки не теряли своих ростовых свойств.
Характеристика моноклональных антител:
Константа аффинности антител 1,6x x109 М-1.
Антитела из асцитов выделялись солевым осаждением сульфатом аммония и последующей хроматографией на ДЭАЭ-целлюлозе с использованием градиента 0,01 М фосфатного буфера, pH 7,2 от 0 до 0,5 М NaCl. Гомогенность выделенных антител проверялась с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия. Антитела синтезируемые клоном 1А9, относятся к подклассу IgG2b, что было определено твердофазным иммуноферментным методом с использованием козьих антител к подклассам мышиного иммуноглобулина G, меченых пероксидазой.
Для изучения специфичности антифенобарбитальных антител фенобарбитал и его аналоги раститровывали в лунках планшета с иммобилизованным антигеном ФБ-БСА в концентрациях от 10-6 М до 10-12 М. К 100 мкл разведений препаратов добавляли по 100 мкл антифенобарбиталовых антитела из асцита в разведении 1: 10 000. После инкубации смеси 18 ч при 4оС планшеты отмывали и количество антител, связавшихся с твердой фазой оценивали как описано в пункте 2. Перекрестные реакции измерялись как отношение концентраций фенобарбитала и его аналога, вызывающих 50% ингибирование связывания антител с иммобилизованным антигеном фенобарбитал-БСА (таблица).
Использование штамма иллюстрируется следующими примерами.
П р и м е р 1. Использование полученных моноклональных антител для определения фенобарбитала в сыворотке методом РFIA (метод, основанный на поляризации флюоресценции).
Для работы использовали автоматический анализатор Abbott TDx (USA).
Для построения калибровочной кривой использовали стандартные растворы фенобарбитала в лошадиной сыворотке с концентрацией фенобарбитала 0; 5; 10; 20; 50 и 100 мкг/мл.
Аликвоты по 10 мл из сывороток больных, получавших фенобарбитал и аликвоты стандартов, содержащих известное количество препарата, вносили в стеклянные кюветы. Добавляли туда же по 500 мкл раствора меченого флуоресцеином фенобарбитала (фирма Abbott) концентрацией 100 нмоль/л и по 500 ml раствора моноклональных антител 1А9 в виде асцитной жидкости в разведении 1:10. В ходе конкурентной реакции в смеси прибор фиксирует показатели поляризации флюоресценции. Все измерения проводили в дубликатах, для расчетов использовали среднее значение.
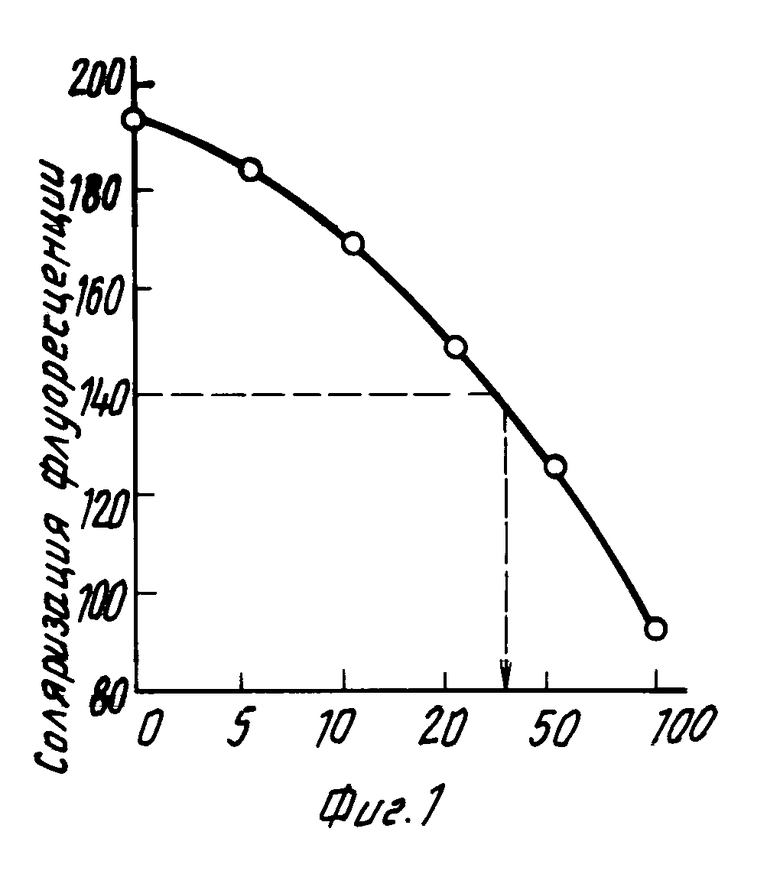
На основании показателей поляризации флуоресценции для стандартных растворов строили калибровочную кривую (фиг.1). Для определения содержания фенобарбитала в сыворотке крови по калибровочной кривой находили значение концентрации препарата, соответствующее полученной величине поляризации для данной сыворотки. Например, значению поляризации 140 единиц соответствует концентрация фенобарбитала в сыворотке 28 мкг/мл. Из калибровочной кривой следует, что данный метод позволяет определять концентрацию фенобарбитала в диапазоне от 0 до 100 мкг/мл. Чувствительность анализа 2,6 мкг/мл. Коэффициент вариации результатов анализа определяли для сыворотки с концентрацией фенобарбитала 20 мкг/мл, повторяя измерение 20 раз. Коэффициент вариации не превышал 6,5% Результаты анализа для 30 сывороток сравнивались с методом фирмы Abbott. Коэффициент корреляции составлял 0,97.
П р и м е р 2. Использование полученных моноклональных антител для определения фенобарбитала в сыворотке иммуноферментным методом.
Антитела выделяли из асцитов ионообменной хроматографией как описано выше и сорбировали в концентрации 1 мкг/мл в 0,05 М карбонат-бикарбонатном буфере pH 9,6 на полистироловые планшеты в течение 3 ч при комнатной температуре, планшеты промывали и высушивали.
Фенобарбитал метили пероксидазой хрена. Для этого 1 мг пероксидазы окисляли перйодатом натрия и смешивали с 1 мг м-аминофенобарбитала в 0,2 мл карбонат-бикарбонатного буфера, pH 9,5. Конъюгат очищали диализом против дистиллированной воды.
Готовили стандартные растворы фенобарбитала в сыворотке с концентрацией 0; 2,5; 5; 10; 20; 40; 80 мкг/мл.
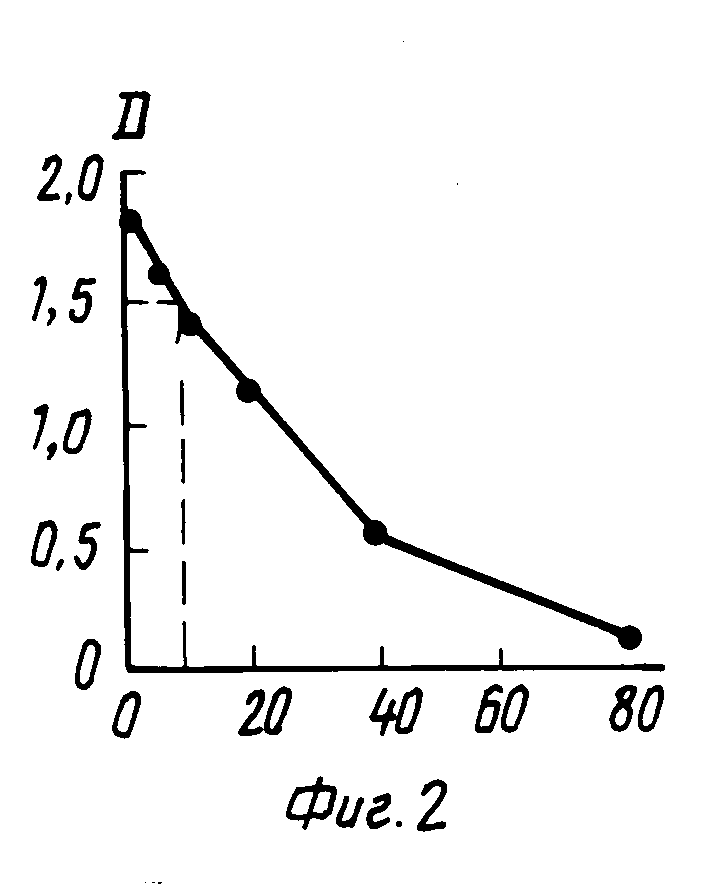
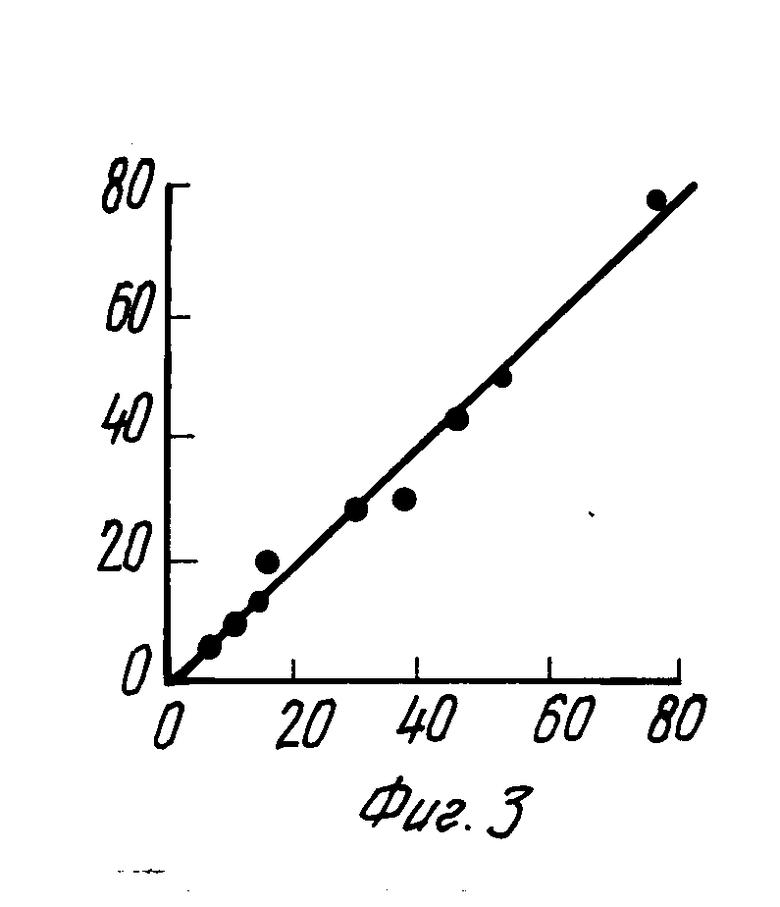
Анализ проводили следующим образом. В лунки планшета с сорбированными антителами вносили по 20 мкл сыворотки крови больных, получавших фенобарбитал и стандартные растворы фенобарбитала в сыворотке. Добавляли по 200 мкл раствора конъюгата фенобарбитал-пероксидаза и инкубировали 20 мин. Затем содержимое планшета выливали, планшет промывали и вносили в лунки раствор субстрата (4 мкл 30% Н2O2 и 4 мг ортофенилендиамина на 10 мл 0,1 М натрий цитратного буфера pH5), по 200 мкл, через 10 мин для остановки ферментативной реакции добавляли по 100 мкл 10%-ного раствора серной кислоты и измеряли поглощение при 492 нм. Содержание фенобарбитала определяли по калибровочной кривой (фиг. 2), в диапазоне от 0 до 80 мкг/мл. Например, поглощению 1,5 соответствовала концентрация в сыворотке 10 мкг/мл. Была измерена концентрация фенобарбитала в сыворотках 48 больных. Чувствительность метода составляла 1,5 мкг/мл, коэффициент вариабельности 6,4% Для 10 сывороток было проведено сравнение полученных результатов с данными, полученными методом поляризации флуоресценции с реагентами фирмы Abbott, было показано, что результаты хорошо коррелируют друг с другом, коэффициент корреляции 0,98 (фиг. 3).

Использование: клиническая биотехнология, разработка тест-систем для определения фенобарбитала в крови. Сущность изобретения: получение штамма гибридных культивируемых клеток мыши mus musculus l. который продуцирует моноклональные антитела (МКЛ) к фенобарбиталу. Штамм получают гибридизацией спленоцитов мышей линии BALB/с с клетками миеломы Р3 Х63. Ag 865.3. МКА относятся к подклассу IgGI и специфически связываются с фенобарбиталом. Концентрация МКА в асцитной жидкости составляет 5 8 мг/мл. 3 ил. 1 табл.
Штамм гибридных культивируемых клеток мыши Mus musculus L. ВСКК (II) N 621 D, используемый для получения моноклональных антител к фенобарбиталу.
Авторы
Даты
1995-12-10—Публикация
1993-04-05—Подача