Изобретение относится к ветеринарии, а именно к получению биологически активных препаратов. Известен способ получения лейкоцитарной плазмы (ЛП) из крови свиней.
Способ заключается в том, что кровь стабилизирует раствором следующего состава, г: Трилон Б 10,0 Риванол 0,012 Хлористый натрий 0,85 Вода дистиллированная 100,0 после чего добавляют 5%-ный поливиниловый спирт и отстаивают, в результате происходит отделение надосадочной жидкости, содержащей плазму крови с лейкоцитами (не менее 16 тыс./мм3), раствор стабилизатора и поливинилового спирта. К надосадочной жидкости для консервирования добавляют 10%-ный мертиолат натрия в количестве 1 мл на 1000 мл жидкости и термостатируют ее в течение 48-72 ч при температуре 37оС, а в последующем охлаждают при температуре 2-4оС 24 ч, центрифугируют в течение 15 мин при 2,5-3,0 тыс. об. в 1 мин, образовавшийся осадок отбрасывают.
Известен способ получения лейкоцитарной плазмы из крови крупного рогатого скота. Способ заключается в том, что к стабилизированной, указанным раствором крови добавляют при соотношении 1:10 гомогенизат селезенки обмытой 1% -ным раствором формалина, консервируют раствором мертиолата или хинозола из расчета 1 мл 10%-ного раствора на 1 л крови (100 мкг/мл) инкубируют 48 ч, целевой продукт получают после центрифугирования и отбрасывания осадка.
Недостатком известных способов является использование при стабилизации и консервировании крови и плазмы веществ, блокирующих обменные процессы и обладающих высокой степенью цитотоксичности (ЦПД). Трилон обладает блокирующим действием на некоторые ферментные процессы в клетках и тканях организма. Мертиолат, риванол и формальдегид среди применяемых в биологических препаратах химических средств обладают наиболее высокой степенью цитотоксического действия и с учетом приведенных данных содержание только одного мертиолата в 1 мл плазмы лейкоцитарной содержится в 10,2 раза больше, чем его ЦПД 8 мкг/мл. Поливиниловый спирт блокирует диффузию тканевых ферментов.
Согласно рекомендациям Комитета экспертов ВОЗ по стандартизации биологических веществ, в готовой продукции должны отсутствовать потенциально опасные химические вещества. Кроме абиотичности, указанные компоненты не обладают биоэнергетической активностью, и при получении препарата значительное его количество выбрасывается с осадком.
Целью изобретения является повышение биоэнергетической активности и выхода целевого продукта. Это достигается тем, что при способе получения лейкоцитарной плазмы из крови животных, включающем ее стабилизацию, консервирование, инкубирование, центрифугирование и отделение плазмы, стабилизацию крови проводят раствором, содержащим цитрат натрия трехзамещенный, хлористый натрий, глюкозу, янтарную кислоту, калий фосфорно-кислый двузамещенный при следующем соотношении компонентов, мас.
Натрия цитрат трех- замещенный 3,0-3,02 Натрия хлорид 0,87-0,9 Глюкоза 4,5-5,0 Кислота янтарная 0,34-0,40
Калий фосфорно-кислый двузамещенный 2,02-2,05 Вода дистиллированная Остальное
После отделения плазмы осадок ресуспендируют в объеме 1:1 стабилизирующего раствора, центрифугируют, отделяют плазму.
Готовят плазмотрансфузин-1 следующим способом. Цельную кровь от животного донора, благополучного по инфекционным заболеваниям, в количестве 9 ч отбирают в стерильных условиях в стерильный стеклянный или пластиковый мерный сосуд, содержащий 1 часть стабилизирующего раствора.
Нефракционированную стабилизированную кровь инкубируют 48 ч при температуре тела животного, центрифугируют при 1500 об/мин 15 мин. Плазму крови собирают, а осадок ресуспендируют в равном объеме стабилизирующего раствора, центрифугируют и собирают надосадок, объединяют его с плазмой, а промытый осадок отбрасывают.
В качестве компонентов стабилизирующего раствора при приготовлении плазмотрансфузина-1 используются вещества, которые обладают биоэнергетической активностью и находятся в растворе в физиологических концентрациях: глюкоза 4,5-5,0% натрия хлорид 0,87-0,9%
В раствор введен также лимитирующий компонент цикла Кребса ион-сукцинат (янтарная кислота в физиологических для клеток и тканей концентрациях, необходимый для изолированных из организма органов и тканей.
Цитрат натрия в растворе находится в количестве, необходимом для стабилизирования крови, как энергетический, буферный компонент и корректор других ионных компонентов раствора.
Для поддержания активной реакции крови (рН 7,44-7,47) в раствор введен двузамещенный фосфорно-кислый калий нормальный составной компонент крови в количествах, осуществляющих необходимую буферную функцию и сохраняющий физиологическое соотношение калия и натрия в крови (1:1,26) и тем самым обеспечивающий необходимый мембранный потенциал клеток крови, т.е. чтобы рН и соотношения ионов калия и натрия было физиологичным для крови свиньи.
Таким образом, количество компонентов раствора, их соотношения, необходимые для стабилизирования крови, повышающие биоэнергетические свойства и обеспечивающие условия для метаболических процессов при ее изоляции из организма, и находящейся (инкубируемой длительное время при температуре тела (тепловая ишемия), минимально и не нарушает физиологические константы крови в отличие от стабилизирующего раствора препарата аналога.
При сравнительном изучении свойств известного препарата и препарата, полученного предложенным способом, кровь отбирали от одних и тех же животных доноров в количестве не менее 3-х голов. В плазме крови получаемых препаратов в процессе приготовления в начале и в последующие каждые 24 ч инкубации определяли активность АСТ и АЛТ общепринятым методом. Количество общего белка в ЛП, плазме крови и жидкости, получаемой после промывания осадка предложенным способом, определяли рефрактометрически, а фракции белка по методу С.А. Карпюка (1981). Водородный показатель плазмы крови определяли р-метром.
Биоэнергетическую активность рассчитывали с учетом содержания компонентов стабилизирующего раствора в препарате (в ккал) и пересчитывали в количество молекул АТФ. В процессе изготовления препаратов измеряли объем получаемых жидкостей и осадка и вычисляли выход целевого продукта в процентах. Биометрическую обработку результатов проводили по методу А.В. Садовского (1975).
П р и м е р 1. К 100 г стабилизирующего раствора следующего состава, мас.
Натрия цитрат трех- замещенный 3,0 Натрия хлорид 0,87 Глюкоза 4,5 Кислота янтарная 0,34
Калий фосфорно-кислый двузамещенный 2,02 Вода дистиллированная Остальное приливают стерильную донорскую кровь взрослой свиньи в количестве 900 мл, инкубируют 48 ч при температуре 38-40оС, центрифугируют 15 мин 1500 об/мин, плазму собирают, осадок ресуспендируют в равном объеме стабилизирующего раствора, центрифугируют, как указано выше, надосадок сливают и объединяют с плазмой для получения целевого продукта.
В приведенном составе стабилизирующего раствора количество цитрата натрия минимально, ниже которого отмечается свертывание крови или ее осадка в процессе инкубации. Количество хлорида натрия, глюкозы, янтарной кислоты также минимально и обеспечивает их физиологическую концентрацию в растворах. Для компенсации физиологического состояния калия и натрия (1:1,26) и обеспечения необходимого рН (7,44) крови взято минимальное количество двузамещенного калия фосфорно-кислого. Биоэнергетическая активность 100 г раствора составляет 16,5 ккал или 1,3 моль АТФ.
П р и м е р 2. К 100 г стабилизирующего раствора следующего состава, мас.
Натрия цитрат трех- замещенный 3,01 Натрия хлорид 0,88 Глюкоза 4,7 Кислота янтарная 0,37
Калий фосфорно-кислый двузамещенный 2,03 Вода дистиллированная Остальное приливают стерильную донорскую кровь взрослой свиньи в количестве 900 мл, инкубируют 48 ч при температуре 38-40оС, центрифугируют 15 мин 1500 об/мин, плазму собирают, осадок ресуспендируют в равном объеме стабилизирующего раствора, центрифугируют, как указано выше, надосадок сливают и объединяют с плазмой для получения целевого продукта.
В приведенном составе стабилизирующего раствора количество компонентов их соотношение оптимально и обеспечивает необходимый биоэнергетический уровень для изолированной из организма крови, находящейся в условиях тепловой ишемии при инкубации, ионный состав и активную среду.
Биоэнергетическая активность 100 г раствора составляет 17,1 ккал или 1,4 моль АТФ.
П р и м е р 3. К 100 г стабилизирующего раствора следующего состава, мас.
Натрия цитрат трех- замещенный 3,02 Натрия хлорид 0,9 Глюкоза 5,0 Кислота янтарная 0,40
Калий фосфорно-кислый двузамещенный 2,05 Вода дистиллированная Остальное приливают стерильную донорскую кровь взрослой свиньи в количестве 900 мл, инкубируют 48 ч при температуре 38-40оС, центрифугируют 15 мин 1500 об/мин, плазму собирают, осадок ресуспендируют в равном объеме стабилизирующего раствора, центрифугируют, как указано выше, надосадок сливают и объединяют с плазмой для получения целевого продукта.
В приведенном составе стабилизирующего раствора количество хлорида натрия, глюкозы и ион-сукцината максимально обеспечивающее их физиологическую концентрацию в растворах, а для компенсации рН в крови введена предельная концентрация двузамещенного фосфорно-кислого калия, компенсирует избыток калия (чтобы не нарушать физиологическое соотношение калия и натрия в крови) цитрат натрия (1:1,26), который при этой концентрации надежно обеспечивает стабилизацию крови.
Биоэнергетическая активность 100 г раствора 19,3 ккал или 1,6 моль АТФ.
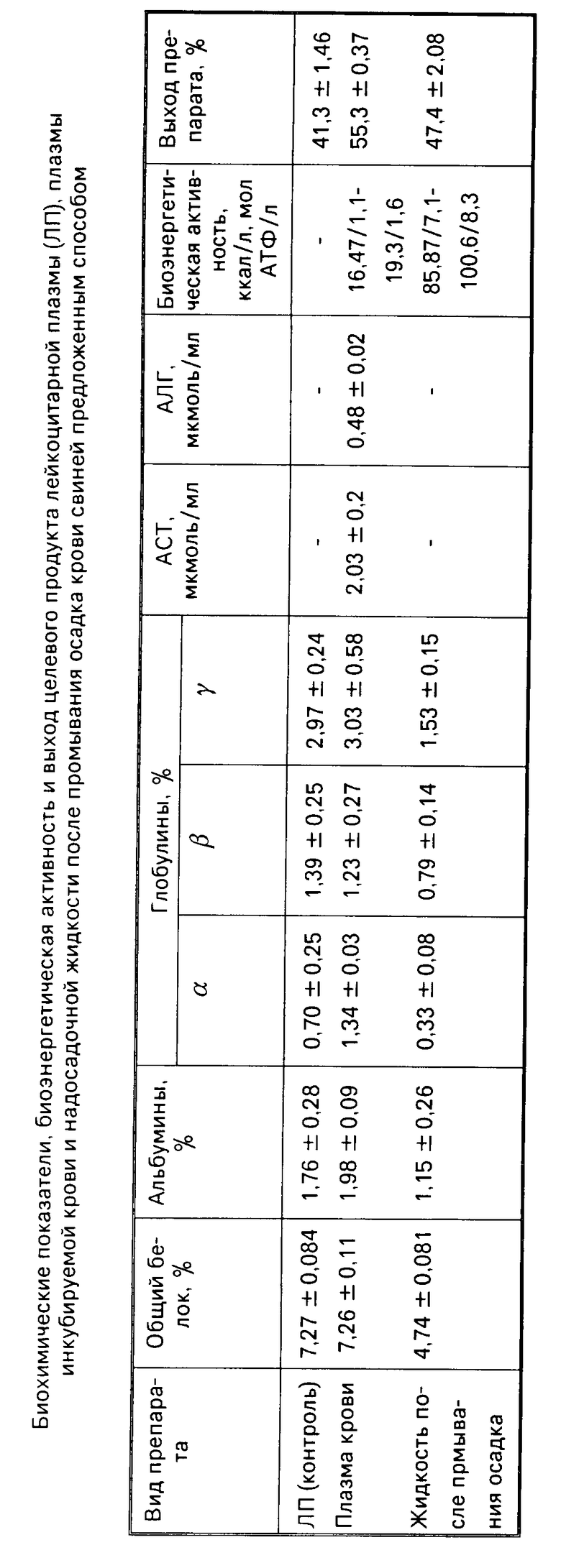
При этом из приведенной таблицы видно, что при сравнительно одинаковом содержании белковых компонентов выход плазмы из инкубируемой крови свиней выше на 14% чем выход готовой ЛП, что обусловлено длительным сроком седиментации инкубируемой крови (48 ч), тогда как надосадок крови из плазмы и лейкоцитов для получения ЛП собирают после нескольких часов отстаивания форменных элементов.
В растворе после промывания осадка инкубируемой крови содержится значительное количество белка, в том числе глобулина, компонента, обладающего иммунными свойствами, во многом определяющим биологическую активность препарата.
При объединении плазмы инкубируемой крови и надосадочной жидкости после промывания осадка форменных элементов, кроме дополнительного внесения компонентов плазмы крови, объем плазмотрансфузина повышается и в среднем составляет 980,0 ± 2,08 мл (из 1 л крови), в то время как выход ЛП в полученных опытах составил 41,3,0 ± 14,6 мл из 1 л крови). При этом биоэнергетическая активность плазмотрансфузина составляет 119,9 ккал, что соответствует 9,9 моль АТФ. Наличие этих компонентов, рН 7,4-7,47 способствуют метаболическим процессам в крови, что подтверждается в ней ферментативной активности в течение всего периода инкубации, тогда как активность АСТ и АЛТ не обнаруживается при приготовлении ЛП уже в плазме крови с лейкоцитами перед инкубацией. Это связано с антиферментной и цитонатогенной активностью компонентов стабилизирующего и консервирующего растворов ЛП и кислой реакцией препарата (рН ЛП 6,8-6,82). Следует отметить, что цитопатогенной активностью обладает и готовый препарат ЛП, ее ЦПД100 на культуре клеток почки проявляется в разведении 1:80.
Таким образом, в отличие от лейкоцитарной плазмы плазмотрансфузин ветеринарный из крови свиней обладает большей биоэнергетической активностью, выход препарата выше, в нем нет цитопатогенных компонентов и он может широко использоваться в свиноводстве в качестве средства, повышающего резистентность организма и сохранность свиней.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОКОРРИГИРУЮЩЕГО ПРЕПАРАТА ИЗ КРОВИ МЛЕКОПИТАЮЩИХ | 1992 |
|
RU2121843C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕГИДРАТАЦИОННОГО СРЕДСТВА "РЕГИДРАТОН СВФ" | 2001 |
|
RU2195938C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО СРЕДСТВА - МАЗИ "СВФ" | 2001 |
|
RU2218167C2 |
| КОНСЕРВАНТ ДЛЯ ОТМЫТЫХ ЭРИТРОЦИТОВ | 2002 |
|
RU2225692C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНСЕРВАНТА ДЛЯ ЭРИТРОЦИТОВ | 1995 |
|
RU2098959C1 |
| СПОСОБ РАЗДЕЛЕНИЯ СВИНОЙ КРОВИ НА ПЛАЗМУ И ЭРИТРОЦИТАРНУЮ МАССУ | 2010 |
|
RU2457847C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТА VIII ФАКТОРА СВЕРТЫВАНИЯ КРОВИ ЧЕЛОВЕКА И ПРОДУКТ ЕГО СОДЕРЖАЩИЙ | 2007 |
|
RU2326689C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕНИНГОКОККОВОГО СЕРОГРУППЫ В ЛИПООЛИГОСАХАРИДА | 1993 |
|
RU2089215C1 |
| СРЕДА ДЛЯ ХРАНЕНИЯ КЛЕТОК | 2006 |
|
RU2396748C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pPBS-St9, КОДИРУЮЩАЯ ПОЛИПЕПТИД СОМАТОТРОПИНА, И ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE ДЛЯ ПРОДУКЦИИ РЕКОМБИНАНТНОГО СОМАТОТРОПИНА | 2011 |
|
RU2465315C1 |
Использование: в ветеринарии, в частности в процессах получения биологически активных препаратов. Сущность изобретения: способ предусматривает стабилизацию крови раствором, содержащим цитрат натрия, хлорид натрия, глюкозу, янтарную кислоту и калий фосфорно-кислый двузамещенный. После отделения плазмы осадок крови ресуспендируют в объеме 1 1 стабилизирующего раствора, центрифугируют и отделяют осадок.
Способ получения плазмы из крови свиней, включающий ее стабилизацию раствором, содержащим цитрат натрия, хлорид натрия, глюкозу, воду дистиллированную, консервирование, инкубирование, центрифугирование и отделение целевого продукта, отличающийся тем, что раствор для стабилизации крови дополнительно содержит янтарную кислоту и калий, фосфорнокислый двузамещенный при следующем соотношении компонентов, мас.
Цитрат натрия 3,0 3,02
Хлорид натрия 0,87 0,90
Глюкоза 4,50 5,00
Янтарная кислота 0,34 0,40
Калий фосфорнокислый двузамещенный 2,02 2,05
Вода дистиллированная Остальное
причем после отделения плазмы осадок крови ресуспензируют в объеме 1:1 стабилизирующего раствора, а после центрифугирования сливают надосадок и объединяют с плазмой.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Виноходов В.Ф | |||
| и др | |||
| ТЕЛЕФОННЫЙ АППАРАТ, ОТЗЫВАЮЩИЙСЯ ТОЛЬКО НА ВХОДЯЩИЕ ТОКИ | 1921 |
|
SU275A1 |
| Ростов-на-Дону, 1982, с.2. | |||
Авторы
Даты
1995-12-20—Публикация
1991-11-26—Подача