Изобретение относится к биотехнологии, а именно к промышленному производству эритропоэтина человека, касается создания нового штамма клеток китайского хомячка, продуцирующих эритропоэтин человека, который может быть использован для лечебных и исследовательских целей в медицине и биологии.
Гликопротеид эритропоэтин (ЭПО) является гормоном, регулирующим синтез эритроцитов у млекопитающих. Он продуцируется преимущественно клетками почки в постнатальном периоде, а также эмбриональной печенью. Синтез и секреция ЭПО стимулируется при снижении концентрации кислорода в тканях и/или при уменьшении эритроцитарной массы. Показано, что ЭПО действует на узкую популяцию коммиттированных предшественников эритроидных клеток, локализованных в костном мозге и селезенке, и являются фактором терминальной дифференцировки этого типа клеток. Высокоочищенный гормон не влияет на эритроидные предшественники, миелоидные и стволовые клетки. Однако пролиферация и дифференцировка поздних эритроидных предшественников зависит от ЭПО, поэтому при дефиците гормона развиваются тяжелые формы анемии. Обычно подобная потология связана с поражением паренхимы почек, т.е. при диагнозе "почечная недостаточность".
ЭПО является перспективным терапевтическим средством, однако получение его в достаточных количествах из природных источников (сыворотки крови животных с индуцированной анемией и др.) задача нереальная в связи с крайне низким содержанием гормона в сырье и сложностью технологии очистки. Единственная альтернатива производство ЭПО с помощью генноинженерной технологии. Однако биологическая активность ЭПО зависит не только от правильной последовательности аминокислот в белковой молекуле, но также и от посттрансляционной модификации гликозилирования молекулы ЭПО. На долю углеводной части приходится около 40% молекулярной массы ЭПО, причем особенно важным для сохранения активности in vivo является сиалирование (наличие остатков N-ацетилнейраминовой кислоты) молекулы ЭПО. Адекватная модификация ЭПО с полным сохранением специфической активности достигается созданием продуцента рекомбинантного ЭПО на основе некоторых линий клеток млекопитающих.
Прототипом изобретения является штамм CHO Epo-1 [1] продуцирующий до 50 ЕД ЭПО в 1,0 мл среды.
Известен штамм продуцент эритропоэтина человека с активностью до 1600 ЕД/мл, созданный на основе линии клеток китайского хомячка фирмой AMGEN (США) [2] Этот продуцент получен в результате амплификации интегрированной плазмиды, содержащей гены ЭПО и дигидрофлатредуктазы, методом культивирования клеток в присутствии метатрексата. Копийность гена ЭПО в клетках достигает 1000, соответственно достигается и высокий уровень синтеза гормона. Однако метатрексат является дорогим реактивом (в РФ не производится), а для поддержания высокой степени копийности введенного гена в клетках продуцентах необходимо наличие высокой концентрации этого агента в среде культивирования. Кроме того, метатрексат является сильным цитостатиком, что удорожает очистку и контроль качества конечного продукта. Поэтому только маточные клетки продуцента культивируются в присутствии метатрексата, тогда как клетки, используемые для крупномасштабного культивирования, выращивают на нормальной среде. При этом копийность гена ЭПО уменьшается и уровень синтеза продукта падает в несколько паз. Таким образом, реальная продуктивность клеток при промышленном производстве ниже, чем заявляемого штамма-продуцента.
Кроме того, имеются существенные различия в способе получения штамма-продуцента ЭПО:
AMGEN Зеленин М.Г и др.
1. Ген ЭПО в составе вектора pDSVL-dHuEPO клонирован в виде BstE11/BamH1 фрагмента длиной 4,8 кВ. 1. Ген ЭПО в составе вектора pSVdEpoLMo клонирован в виде BstE11/Bgl11 фрагмента длиной 2,8 кВ.
2. Экспрессия ген ЭПО регулируется промотором поздних генов вируса SV40.
2. Экспрессия гена ЭПО регулируется промотором ранних генов вируса SV40.
3. В гене ЭПО сохранены регуляторные последовательности, содержащие сайты терминации и полиаденилирования. 3. Терминация и полиаденилирование ЭПО-специфического транскрипта обеспечивается за счет регуляторных последовательностей гена Т-антигена вируса SV40.
4. Вектор pDSVL-dHuEPO не содержит гена neor и каких-либо усиливающих транскрипцию последовательности кроме промотора вируса SV40. 4. Вектор pSVDEpoLMo содержит ген neor и LTR вируса MoMuLV.
5. В качестве клеток-реципиентов использованы CHOdgfr-. 5. В качестве клеток-реципиента использованы CHOtk-.
6. При трансфекции клеток-реципиентов использована плазмида, содержащая ген дигидрофолатредуктазы. Последующая амплификация гена ЭПО проводилась в присутствии метатрексата (МТХ). 6. При трансфекции клеток-реципиентов использована плазмида, содержащая ген тимидинкиназы. Последующая амплификация гена ЭПО проводилась в присутствии гипоксантин-аминоптеринтимидин (ГАТ).
7. Копийность гена ЭПО в клетках-продуцентах примерно 1000. 7. Копийность гена ЭПО в клетках-продуцентах примерно 200.
8. Высокий уровень продукции ЭПО стабилен только в селективных условиях.
8. Высокий уровень продукции ЭПО стабилен в неселективных условиях.
Технической задачей изобретения является удешевление процесса получения эритропоэтина человека за счет повышения продуктивности клеточного штамма.
Предлагаемый штамм клеток CHO Epo-2 стабильно продуцирует эритропоэтин в количестве 1500-1800 ЕД/мл среды, адаптирован к средам и сыворотке крупного рогатого скота отечественного производства.
Штамм получен введением рекомбинантной плазмиды pSVdEpoLMo в геном клеток CHO tk-. Клетки CHO tk- представляют собой клон клеток яичника китайского хомячка (CHO), дефектных по гену тимидинкиназы. Клетки CHO tk- не ревертируют к нормальному фенотипу при длительном пассировании в неселективных условиях и культивируются на средах Игла-199 (в отношении 1:1) с добавлением 10% сыворотки крупного рогатого скота и с высокой эффективностью трансфецируются экзогенным ДНК [3]
Условное наименование штамма CHO Epo-2.
Штамм депонирован в специализированной коллекции перевываемых соматических клеток позвоночных Всесоюзной коллекции клеточных культур под номером ВСКК (П)637Д от 26.04.94.
Штамм клеток CHO Epo-2 характеризуется следующими признаками.
Морфологические признаки. Под фазоконтрастным и световым микроскопами культура представлена монослоем эпителио- и фибробластоподобных клеток с овальными ядрами, содержащими мелкие ядрышки. По мере увеличения плотности слоя клетки уменьшаются в размерах и приобретают сферическую форму.
Культуральные свойства. Штамм CHO Epo-2 поддерживается на отечественных средах Игла-199 (в отношении 1:1) с добавлением 10% сыворотки крупного рогатого скота в виде монослойной культуры. Отделение клеток от стекла или пластика проводят смесью 0,25% -ного раствора трипсина и 0,02%-ного раствора Версена (1:10), кратность рассева 1:6-1:8, посевная доза 2•104 - 3•104 клеток на 1 см2 площади сосуда. Плотность монослоя культура достигает к 4-му дню после пассажа.
Криоконсервация. Криоконсервирование проводят на среде Игла-199 (1:1) с 20% сыворотки крупного рогатого скота и 7%-ного диметилсульфоксида в качестве криопротектора. Концентрация клеток 2-3•106 в 1,0 мл. Жизнеспособными после восстановления остаются 75±5% клеток.
Кариологическая характеристика. Кариологический анализ штамма CHO штамма CHO Epo-2 проводили на 8,17 и 36 пассажах. Модальный класс клеточной линии определен подсчетом числа хромосом в 100 метафазных пластинах. Модальное число хромосом 33. Интервал изменчивости 29-34; процент полиплоидии 2. Распределение клеток по числу хромосом следующее: 29 хромосом 6 клеток, 30 хр. 8 клеток, 31 хр. 10 клеток, 32 хр. 32 клетки, 33 хр. 38 клеток, 34 хр. 6 клеток.
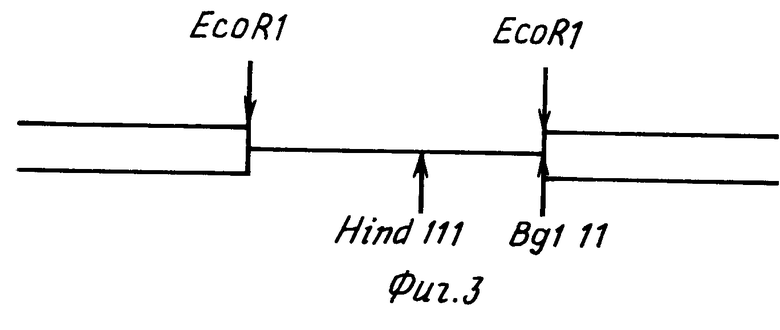
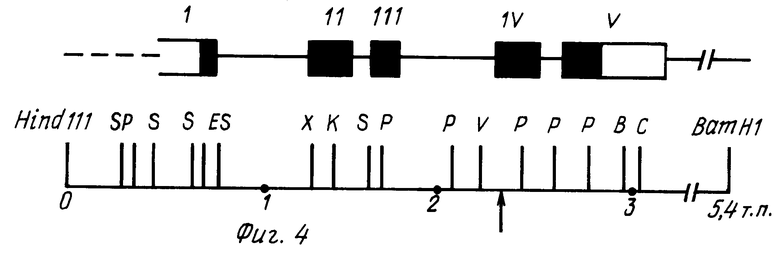
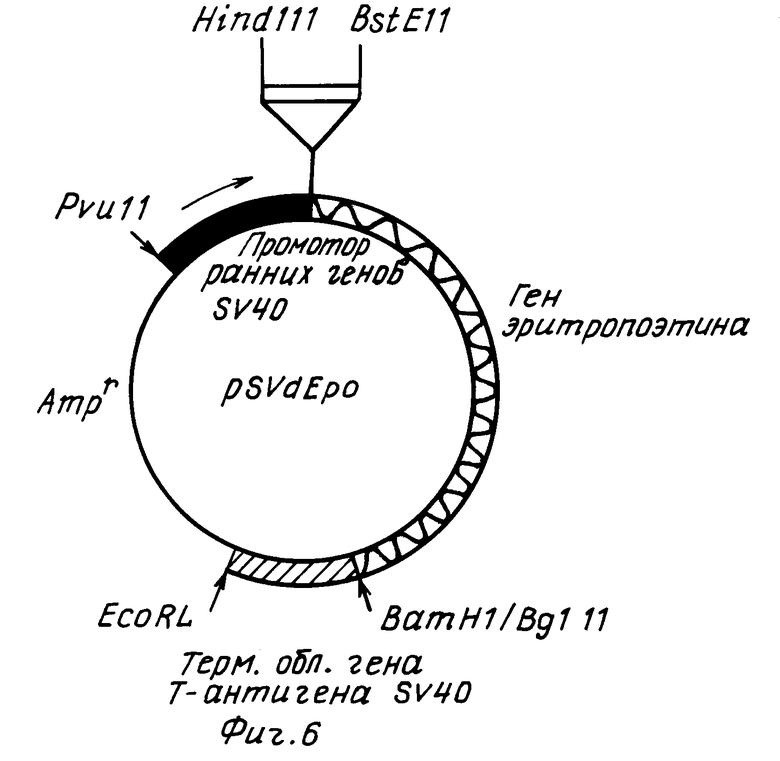
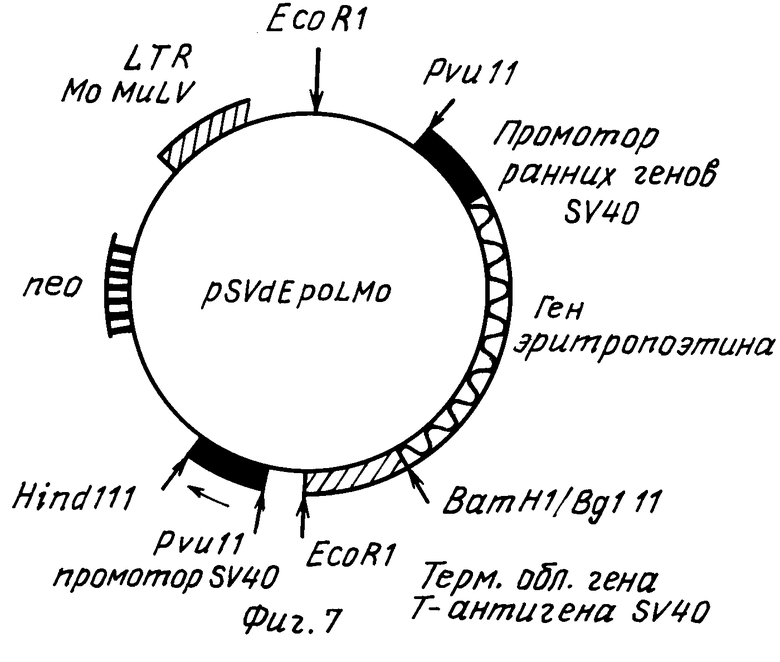
На фиг. 1 показан кариотип линии CHO Epo-2. Стрелками отмечены маркеры, несущие амплифицированный ген ЭПО; на фиг. 2 фрагменты метафаз линии CHO Epo-2 с гибридизацией in situ; на фиг. 3 схема структурной организации ДНК рекомбинантного фага, содержащего ген эритропоэтина человека. Ген эритропоэтина человека в составе HindIII-BgIII фрагмента длиной 3 т.п.н. Прямоугольниками обозначены плечи фагового вектора; на фиг. 4 рестриктная карта гена эритропоэтина человека и ее соответствие структуре транскрипционной единице. Цифрами обозначены экзоны; заштрихованы белок кодирующие области. Стрелкой указан сайт локализации последовательности, гомологической олигонуклеотидному зонду N 2. Обозначение рестриктаз: B BgIII; C Sacl; E - BstEII; K KpnI; P PstI; S SmaI; V PruLL; X XbalI; на фиг. 5 - рестриктная карта плазмиды pSVEpo. Плазмида pSVEpo содержит ген эритропоэтина человека под контролем промотора ранних генов вируса SV-40. Длина плазмиды - 6,8 т.п.н; на фиг. 6 плазмида pSvdEpo, несущая ген эритропоэтина человека с делецией 5'-фланкирующей области (HindIII-BgIII-фрагмент). Длина плазмиды - 6,2 т.п.н. на фиг. 7 плазмида pSVdEpoLMo, несущая ген эритропоэтина под контролем промотора ранних генов SV-40 и регуляторных последовательностей длинного концевого повтора вируса лейкоза мышей Молони (LTR MoMuLV). Длина плазмиды 12 т.н.н.
С помощью гибридизации нуклеиновых кислот in situ был проведен анализ линии на наличие в ней маркерных хромосом, несущих трансформированную плазмиду с геном ЭПО. Такой анализ показал, что 100% клеток имеют как обязательный маркер субтелоцентрическую хромосому с районом амплификации гена ЭПО, захватывающим 2/3 длинного плеча (маркер N 6, фиг. 1,2).
При этом 90% клеток в дополнение к этой хромосоме имеют еще маркер N 9, несущий небольшой по степени амплификации участок на дистальном конце длинного плеча субметацентрической хромосомы среднего размера (фиг.2).
Следует отметить, что маркер N 9 можно обнаружить только с помощью метода гибридизации in situ.
Онкогенность клеток линии CHO Epo-2. При введении 10 млн клеток подкожно иммунодефицитным мышам линии nude, образования опухолей не обнаружено при наблюдении в течение 1 месяца.
Контроль штамма CHO Epo-2 на контаминацию. При обследовании клеток штамма на контаминацию (наличие бактерий, грибов, микопаз) были получены отрицательные результаты на уровня 6,18 и 34 пассажей. Цитопатогенные и онкогенные вируса не обнаружены.
Продукция эритропоэтина человека штамм CHO Epo-2. Продукцию эритропоэтина клетками штамма CHO Epo-2 тестировали методом включения 3H-тимидина мышиными эритробластами, иммунобиологическим методом, методом стимуляции образования эритроидных колоний при культивировании клеток костного мозга в метилцеллюлозе, максимальный уровень продукции эритропоэтина клетками штамма CHO Epo-2 достигается на 4-е сутки культивирования и составляет 1500-1800 ЕД на 1 мл культуральной среды.
Характеристика продукта. Синтезируемый клетками штамма CHO Epo-2 эритропоэтин исследован в следующих тестах:
1. Индукция включения 3H-тимидина в эритробласты мышиной селезенки.
2. Индукция образования эритроидных колоний в метилцеллюлозе клетками костного мозга.
3. Индукция ретикулоцитов у мышей.
4. Тест in vivo на полицитемических мышах с использованием радиоактивного железа-59.
Эритропоэтин выделяли из культуральной среды клеток CHO Epo-2 методом ионнообменной и адсорбционной хроматографии. В качестве стандарта использовали как коммерческие препараты Eprex (Cilag) и Recormon (Boehringer Mannheim), так и стандарт ЭПО N 87/684, полученный от World Health Organisation International Laboratory for Biological Standarts (Англия).
Использование штамма CHO Epo-2 иллюстрируется следующими примерами:
Пример 1. Клонирование и характеристика гена эритропоэтина человека.
Для клонирования гена эритропоэтина человека был использован олигонуклеотидный зонд, нуклеотидная последовательность которого соответствует фрагменту гена эритропоэтина человека в начале 4-го экзона. последовательность зонда: GCAGGCCGTAGAAGTCT. Зонд метили с помощью полинуклеотидкиназы и 32P АТФ до удельной активности 1-2х106 имп/мин/мкг и использовали для скрининга библиотеки геномной ДНК человека в фаговом векторе Charon 4A. Фильтры для скрининга готовили, используя метод амплификации in situ (Woo and O'Malley) [4] Рекомбинантные фаги, дающие сигнал гибридизации с олигонуклеотидным зондом, были очищены до индивидуального состояния путем повторного рескрининга и фаговую ДНК анализировали с помощью рестрикционного картирования и блот-гибридизации с олигонуклеотидным зондом. Фаговый клон 7-2, содержащий полноразмерную копию гена эритропоэтина, был детально охарактеризован (фиг. 3).
Методом рестриктного картирования показано, что рекомбинантный фаг 7-2 содержит ген эритропоэтина, полностью соответствующий гену ЭПО, описанному в работе Lin F.K. с соавт. [5] (фиг.4).
Было проведено определение нуклеотидной последовательности гена эритропоэтина из фага 7-2 и показано ее полное соответствие приведенной ранее последовательности (см.схему в конце описания).
Таким образом, рекомбинантный фаговый клон 7-2 содержит полную кодирующую последовательность гена эритропоэтина человека в рамках HindIII-BglII фрагмента.
Пример 2. Получение плазмидных конструкций для экспрессии гена ЭПО.
Фрагмент HindIII-BglII, содержащий ген ЭПО, был реклонирован в вектор pSV2gpt (Berg and Mulligan) [6] по сайтам HindIII и BamHI. Структура полученной плазмиды pSVEpo представлена на фиг.5. Плазмида pSVEpo содержит ген эритропоэтина человека под контролем промотора ранних генов вируса SV 40 и терминирующих сигналов гена большого T антигена SV 40.
У большинства эукариотических генов 5'-фланкирующие последовательности содержат регуляторные элементы транскрипции, которые могут в том числе ингибировать экспрессию гена в непермиссивной клеточной системе.
Для усиления транскрипционной активности гена ЭПО из вектора pSVEpo был делецирован HindIII-BstEII фрагмент длиной приблизительно 600 п.н. В результате был получен вектор pSVdEpo (фиг.6). Промотор ранних генов вируса SV40 был приближен к структурной части гена эритропоэтина, а также удалена собственная 5'-фланкирующая последовательность гена.
Плазмида pSVdEpoLMo (фиг.7) получена на основе плазмиды pSVdEpo, в которую встроен EcoRI-фрагмент, содержащий ген устойчивости к антибиотику G418 (ген "neor") под контролем промотора ранних генов вируса SV40 и длинный концевой повтор вируса лейкоза мышей Молони (MoMuLV), расположенный на расстоянии примерно 3 т.п.н. от начала кодирующей части гена эритропоэтина.
Пример 3. Амплификация гена ЭПО в клетках CHO tk-.
Клетки-реципиенты трансфецировали смесью плазмид pSVdEpoLMo и pTK- (1: 1). Вектор pTK- содержит ген тимидинкиназы (tk) вируса) простого герпеса (HSV) с делецированным промотором. Для получения делеции вектор pAGO, содержащий полный ген tkHSV переваривали смесью рестриктаз BglII и BamHI, и проводили лигирование. При этом элиминировался фрагмент ДНК длиной примерно 2,5 кВ, содержащий промотор гена tk, тогда как структурная часть гена сохранялась в составе плазмиды pTK-. В результате делеции промотора резко уменьшалась транскриционная активность гена tk, что позволило применить полученную плазмиду для селекции трансфектантов с амплификонами в системе ГАТ (гипоксантин-аминопрерин-тимидин).
Схема амплификации плазмид в трансфектантах была следующая:
1. Селекция клеток с фенотипом neor (ген устойчивости к антибиотику G-418).
Через 18 ч после трансфекции среду сливали, клетки промывали средой Игла без сыворотки и заливали ростовой средой (среда Игла-199 (1:) плюс 10% сыворотки крупного рогатого скота), содержащей антибиотик G-418 в конечной концентрации 400 мкг/мл среды. Среду меняли каждые 4 дня. Через 12-14 дней появляются колонии клеток, устойчивые к данному антибиотику. Выделенные клоны клеток размножали до концентрации 104/см2.
2. Амплификация интегрированных плазмид в системе ГАТ.
Чашки Петри с клетками после селекции на среде с G-418 заливали средой, содержащей гипоксантин-аминоптерин-тимидин (10-4M, 2•10-7M и 104M соответственно), т. е. концентрация аминоптерина в этом случае равняется 0,01 от обычно используемой в среде ГАТ. Среда меняется каждые 4 дня. Через 12-16 дней появляются клоны клеток, устойчивые к данной концентрации аминоптерина. Клетки размножали и переводили на среду, содержащую 4х10-7М аминоптерина. Полученные клоны клеток размножали и тестировали иммуноферментным и методом включения 3H-тимидина в спленоциты анемических мышей. Клетки с большей продуктивностью ЭПО переводили в среду, содержащую 2•10-6M аминоптерина (0,1 от обычной концентрации). Полученные клоны также тестировали по продукции ЭПО, клетки отбирали, размножали и переводили в среду, содержащую 2•10-5M аминоптерина. В результате такой селекции в среде, содержащей ступенчатое повышение аминоптерина (от 0,01 → 0,02 → 0,1 → 1, т.е. до обычно используемой концентрации ГАТ), концентрация секретируемого клетками ЭПО возрастает в 100-200 раз.
Пример 4. Культивирование клеток штамма CHO Epo-2 на матрасах.
Клетки штамма CHO Epo-2 засевали в количестве 3•104 клеток/см2 на матрасы (объем 1,5 л), заливали 170 мл ростовой среды и культивировали при 37oC. Каждые 24 ч проводили отбор проб из 5 параллельно ведущихся матрасов (по 0,5 мл среды), аликвоты объединяли и использовали для изучения концентрации эритропоэтина как в примере 3. В качестве контроля использовали клетки CHO tk-, засеянные с такой же плотностью и культивируемые в аналогичных условиях. Результаты определения приведены в табл.1.
Как видно из табл.1, максимальная продукция эритропоэтина клетками штамма CHO Epo-2 достигается на 4-е сутки культивирования и составляет около 1000 ЕД/мл. В дальнейшем происходит истощение питательной среды и клетки начинают гибнуть. Увеличение концентрации эритропоэтина на 6-е сутки можно объяснить разрушением клеток и выходом в среду внутриклеточного эритропоэтина.
Пример 5. Культивирование клеток штамма CHO Epo-2 на роллерных установках.
Для работы использовали роллерные бутыли из стекла (длина 22 см, диаметр 11 см, рабочая поверхность 760 см2). В бутыль заливали 200 мл ростовой среды и добавляли 1,5•107 клеток. Бутыль вращали со скоростью 15 оборотов в 1 ч при 37oC в течение 6 ч для обеспечения равномерного распределения клеток на фазе прикрепления. Затем скорость вращения снижали до 8 оборотов в 1 ч и культивировали в течение 4-5 суток. Через каждые 24 ч проводили отбор проб. Концентрацию ЭПО определяли так же, как в примере 4. Результаты представлены в табл.2.
Пример 6. Культивирование клеток штамма CHO Epo-2 в ферментере на микроносителях "Цитодекс-3" ("Pharmacia", Швеция).
В ростовую среду объемом 100 мл, содержащую микроносители с суммарной площадью 700 см2, добавляли 107 клеток и заливали во флаконы емкостью 300 мл с подвесным эксцентричным магнитом ("Belco" США). Посадка клеток на носитель осуществлялась в течение 4 ч в прерывистом режиме (перемешивание 5 мин, пауза 25 мин) при скорости вращения 30 оборотов в 1 мин. В дальнейшем культивирование проводили при непрерывном перемешивании при скорости вращения 30 оборотов в 1 мин. В течение 4-5 дней концентрация клеток возрастала до 106 клеток на 1 мл среды. Через каждые 24 ч проводили отбор проб. Концентрация ЭПО определялась так же, как в примере 4. Результаты представлены в табл.3.
Источники информации
1. Патент 1555359 A 1 СССР, МКИ 4 C 12 N 5/00. Штамм культивируемых клеток китайского хомячка продуцент эритропоэтина человека/Зеленин М.Г. Крамерова И.А. Колобков С.Л. Филякина Н.С. Егоров Б.Б. (СССР). N 4394247/30-13. Заявл. 17.03.88.
2. WO 86/03520 A1, Int.Cl.4 C 12 P 21/00. Method for the production of erythropoietin. /E. Fritsch, R. M.Hewick, K.Jacobs.-PCT/US85/02405; Filing 03.12.85; Priority 04.12.84 US 677813; Publ. 19.06.86.
3. А.с. 1522745 A1 СССР, МКИ 4 C 12 N 5/00. Штамм культивируемых клеток яичника китайского хомячка для трансфекции плазмидной ДНК/Зеленин М.Г. Колобков С.Л. (СССР). -N 4394066/30-13. Заявл. 17.03.88.
4. Woo S.L.C. and O'Malley B.W.// Proc. Natl. Acad.Sci.USA. 1978, v.75, N 7, p.3688-3691.
5. Lin F.-K. Suggs S. LIn C.-H. Browne J.K. Smalling R. Egrie J.C. Chen K. K. Fox G.M. Martin F. Stabinsky Z. Badrawi S.M. Lai P.-H. Goldwasser E.// Proc. Natl. Acad.Sci. USA. 1985,v.82, N 22, p.7580-7584.
6. Berg R. Mulligan R.C.// Proc. Natl. Acad. Sci. USA.-1981,v.48, N 4, p.2072-2076.


Использование: биотехнология, а именно промышленное производство эритропоэтина человека. Сущность: методом введения клонированного гена эритропоэтина человека в составе плазмиды PSVdepoL Mo в клетки перевиваемой линии яичника китайского хомячка CHO tk получен штамм ВСКК/П/637Д. Показано, что штамм CHO Epo-2 обладает высокой (1500-1800 ед/мл) и стабильной в неселективных условиях продукцией эритропоэтина человека и может быть использован для промышленного производства. 7 ил.
Штамм СНО культивируемых клеток китайского хомячка ВСКК(П) 637 Д - продуцент эритропоэтина человека.
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Штамм культивируемых клеток китайского хомячка - продуцент эритропоэтина человека | 1988 |
|
SU1555359A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1997-09-10—Публикация
1995-07-13—Подача