Изобретение относится к новым замещенным дипептидам пролилтирозинам, которые могут быть полезными как фармацевтические агенты, а также к фармацевтическим композициям, которые включают эти соединения.
Новые соединения являются психотропными веществами, которые в зависимости от структуры проявляют либо дофаминонегативное, либо дофаминопозитивное действие.
Предлагаемые соединения могут найти применение соответственно для лечения шизофрении как антипсихотические средства или для лечения депрессий как антидепрессанты.
Известны следующие источники:
Tadashi Yoshimoto et. al. J. Biol. chem. 253(10), 3708 3716 (1978) -описаны дипептиды общей формулы: Y-Pro-D, L-X, где Y определенная N-защитная группа, например Z (бензилоксикарбонил), X часть аминокислоты, Glu, Glu (α-OBzl), Glu (g OBzl), Trp, Phe, Tyr, Leu, Gly, Lys, как ингибиторы постпролинрасщепляющего фермента. Так для Z Pro Tyr OH показана Ki (M) 4,8•10-4;
PCT Int. Appl. 8000, 216; US Appl. 923, 187 (Walter R.W.) предложены определенные пептиды, которые эффективны в предупреждении развития толерантности и физической зависимости от морфина. Наряду с очень активными пептидами (цикло-Leu-Glu, Z-МИФ, Z-Pro-D-Leu, Z-Pro-L-Leu) описан малоактивный пекптид Z-Pro-Tyr-OH;
Dive V. et al, Eur. J. Biochem. 191, 685 693 (1990) дан синтез некоторых производных пролилтирозина (Z-L-Pro-L-Tyr(OBzl)-OCH3, L-Pro-L-Tyr-JCH3HCl), которые были использованы для получения фосфонамидов пептидов, ингибиторов бактериальной коллагеназы;
Spaaaartaco A. Bizzozero al. Helv. Chimica Acta. 65(6), 1707 1719 (1982) описали синтез Boc-Pro-Tyr-OMe, Pro-Tyr-OMe HCl, последний из которых был использован как карбоксильная компонента для получения олигопептидов структуры: Ac-Lxn- -Lxi-Lye- -Lym-NH2 с Lxi Tyr, сконструированных как субстраты a-химотрипсина;
Fuju Nobutaka et al. J. Chem. Soc. Per. Trans. 1 (3), 798 796 (1981) описан дипептид Z-Pro-Tyr-OMe, используемый как промежуточное соединение в синтезе фрагмента (110 124) бычьей панкреатической рибонуклеазы;
Aubry A. et. al. J. Am. Chem. Soc. 107 (25), 7640 7647 (1985) описан дипептид Boc-L-Pro-D-Tyr-NHMe как модельное соединение для изучения конформаций в гетерохиральных пролилсодержащих дипептидах;
Breslow E. et al. Biochemistry, 12(23), 4644 4653 описан некоторые тирозинсодержащие ди- и трипептиды как аналоги окситоцина и вазопрессина в их взаимодействии с бычьим нефрофизином-II. В том числе был изучен Pro-Tyr-NH2, синтезированный фирмой "Cyclo Chemikal Corp".
Однако соединения, описанные в вышеприведенных ссылках, не открывают и не предполагают новых структурных вариаций патентуемых соединений и тем более их антипсихотических или антидепрессантных свойств.
Соединения с нейролептическими или антидепрессантными свойствами, предлагаемые в изобретении, являются замещенными дипептидами формулы
R1-X-Pro-Y-Tyr-R2,
где R1 H, (C4-C8)алкилкарбонил, аралкилкарбонил, арилкарбонил, алкоксикарбонил, аралкоксикарбонил, ароксиалкилкарбонил;
R2 NH2, NHAlk, OAlk(C1-C3);
X т Y независимо L или D-конфигурация аминокислот.
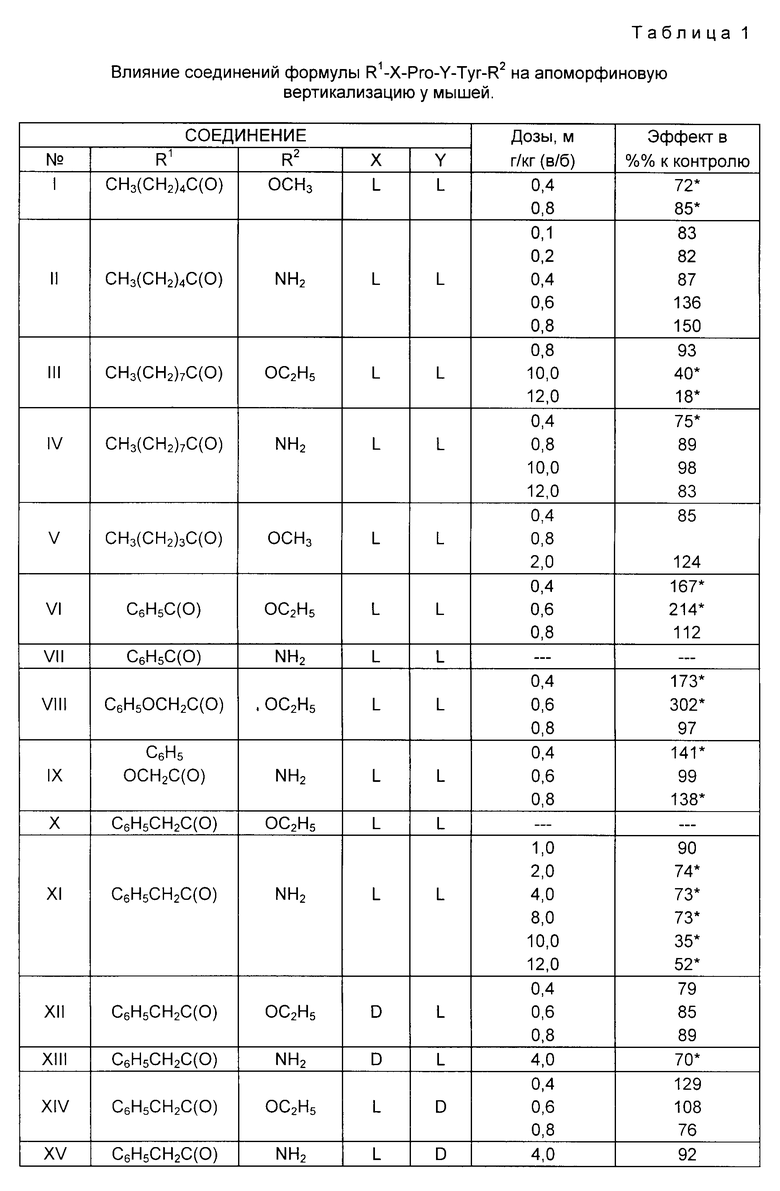
Изучение нейротропной активности показало, что наиболее активными соединениями являются соединения формулы 1, где R1=H, капроил, нонаноил, бензоил, феноксиацетил, фенилацетил, бензилоксикарбонил, трет.бутилоксикарбонил; R2 NH2, OCH3, OC2H5; X Y L, X Y D, X D при Y L.
Некоторые из предлагаемых соединений ослабляют вызванную апоморфином вертикализацию, стереотипию и нарушение экстраполяционного поведения, вызванные L-дофа, уменьшают выраженность локомоторной гиперактивности, вызванной фенамином. Совокупность указанных эффектов позволяет прогнозировать наличие у этих соединений нейролептического действия. Важным отличительным признаком предлагаемых соединений от типичных нейролептиков (фенотиазиновой, бутирофеноновой структуры) является отсутствие каталептогенного, миорелаксантного и седативного эффектов. В отношении соединения XI, отобранного для более подробного изучения, показана также способность ослаблять интенсивность стереотипии, вызванной N,N-диметокситриптамином, что позволяет прогнозировать отсутствие у этого соединения экстрапирамидных расстройств, свойственных типичным нефролептикам. Важное отличие заявляемых соединений от атипичных нейролептиков, например, деривата бензамида, сульпирида, состоит в существенно более высоком уровне активности. Изученные соединения характеризуются низкой токсичностью. В отличие от пептидов более сложной структуры предлагаемые дипептиды сохраняют активность в условиях перорального введения.
Предлагаемые дипептиды были получены рутинными методами, описанными, например, в книгах "Пептиды" (Основные методы образования пептидных связей)/ Под редакцией Э. Гросса и И. Майнехофера. Пер. с англ. М. Мир, 1983; Химический синтез пептидов. Гершкович А. А. Кибирев В. К. Киев: Наукова Думка, 1992.
Предпочтительно применяли метод смешанных ангидридов с использованием изобутилхлорформиата в качестве конденсирующего агента и метил- или этилморфолина как третичного основания. Химическая чистота веществ подтверждалась элементным анализом и тонкослойной хроматографией. Диастереомерная чистота полученных дипептидов проверялась методом ПМР.
Предлагаемые вещества были изучены по тесту вертикализации, вызываемой апоморфином (пример 29). Этот тест наиболее широко применяется в настоящее время для скрининга вследствие своей избирательной чувствительности к дофаминопозитивным и дофаминонегативным веществам (Worms P. Lloyd K. Predictability and specificity of dehavioral screening test for neuroleptics. Pharmacol. Therap. 1979, 5, 495 450; Protais P. Costentin J. Schwartz F.C. Climbing behavior induced apomorhine in mice-a simple test for the study of dopamine receptors in striatum. Psychopharmacology, 1976, 50, 1 6; Раевский К.С. и др. Экспериментальное доклиническое изучение специфической активности новых соединений, предлагаемых для клинических испытаний в качестве нейролептиков (антипсихотических средств). Методические рекомендации. Тарту. 1988).
В изучаемом ряду выявлено несколько соединений которые отчетливо ослабляют апоморфиновую вертикализацию: соединения I, III, IV, XI, XIII, XVI, XXI, XXIV. Наряду с этим был выявлен ряд соединений, усиливающих апоморфиновую вертикализацию (VI, VIII, IX, XIX) или оказывающих в зависимости от дозы как ослабляющее, так и усиливающее действие (II, XIV, XXV, XVII) (пример 29). Таким образом, в группе заявляемых пролил-тирозинов выявлены как вещества с дофамин-негативным действием, позволяющим прогнозировать нейролептический эффект, так и вещества с дофамин-позитивным действием характерным для многих потенциальных антидепрессантов. Для уточнения спектра дофаминергического действия этих соединений они были изучены в ряде других тестов. При этом было показано, что большинство перечисленных выше соединений, ослабляющих вертикализацию, вызванную апоморфином, ослабляет также стереотипию, вызванную L-ДОФА (пример 30). Эти же соединения отчетливо ослабляли степень нарушений экстраполяционного поведения, вызванных L-ДОФА. Если тесты вертикализации и стереотипии, как и подавляющее большинство тестов, используемых для скрининга нейролептиков, основаны на выявлении способности ослаблять влияния, оказываемые дофамино-позитивными веществами на моторные реакции, тест экстраполяционного избавления (ТЭИ) отражает принципиально иной эффект веществ влияние на познавательные функции и способность к принятию решения для избавления из нестандартной ситуации. Дофаминопозитивные вещества снижают число животных, способных к реакции избавления, и увеличивают количество нецелесообразных стереотипных движений. Изучение широкого спектра нейротропных веществ выявило избирательность действия нефролептиков различной химической структуры их способность ослаблять нарушение этой реакции, вызванное l-дофа (Бондаренко Н. А. Избирательное влияние нейролептиков на дофаминзависимое нарушение поведение крыс в тесте экстраполяционного избавления, Бюлл. эксп. биол. мед. 1990, 11.506 509).
Результаты изучения предлагаемых соединений в тесте ТЭИ (пример 31) свидетельствуют о том, что в предлагаемом ряду выявлены вещества, уменьшающие выраженность нарушений экстраполяционной реакции, вызванных l-дофа, по такому показателю, как уменьшение числа животных, совершивших реакцию избавления (соединения I, IV, XI, XIII, XVI, XXI, XXIV). Все эти соединения, а также соединения II, VII, VIII, XIV, XV, XXII, XXV проявили дофаминонегативное действие также и в отношении моторной активации, вызванной l-дофа. При этом важно подчеркнуть, что пороговые дозы, в которых начинают проявлять активность заявляемые соединений, составляют от 0,4 до 2 мг/кг, сульпирида, пороговая доза равна 8 16 мг/кг. Поскольку для многих нейролептиков характерно наличие каталептогенного эффекта, представляло интерес изучить с этой точки зрения предлагаемые соединения (пример 32). При этом показано, что ни представители группы дофамино-негативных соединений (I, XI, XXI XXIII), ни дофамино-позитивное соединение (XIX) не обнаружили признаков каталептогенного действия, будучи введены как в пороговых дозах, так и в дозах, значительно превышающих пороговые (500 мг/кг).
В этой же высокой дозе указанные соединения не вызывали миорелаксации в тесте вращающегося стержня, не проявляли седативного действия и не обнаруживали каких-либо токсических эффектов (пример 33). Выявив в числе предлагаемых группу соединений, проявляющих признаки дофаминогенативного действия, характерного для эффекта потенциальных нейролептиков, и установив отсутствие у них каталептогенного и миорелаксантного действия, представлялось целесообразным изучить некоторые из этих соединений более подробно. В качестве одного из соединений было отобрано соединение XI, проявляющее активность в широком диапазоне доз.
Известно, что одним из характерных эффектов нейролептиков является способность ослаблять степень локомоторной гиперактивности, вызванной фенамином (Раевский К. С. 1973 Антагонизм с фенамином как тест для экспериментальной оценки нейролептиков. Фармакология и токсикология, 1973, 2, 149 154). Соединение XI отчетливо ослабляет фенаминовую гиперактивность уже в дозе 2 мг/кг, тогда как сульпирид проявляет антифенаминовое действие лишь в дозе 75 мг/кг. Одним из характерных свойств нейролептиков является способность потенцировать эффект барбитуратов (Lambert P. Revol L. Ckassification psychopharmacologuigue et clinigue des differents neuroleptigues. Presse med. 1960, 68, 1509 1511). Для соединения XI была также продемонстрирована способность удлинять продолжительность гексеналового сна (пример 34). Веществам, содержащим структуру нейролептического фармакофора, присуща способность устранять торможение тирозингидроксилазы избытком субстрата (М.Ф. Минеева, 1985). Изучение влияния соединения XI на кинетические параметры тирозингидроксилазной реакции выявило его способность устранять субстратное торможение тирозингидроксилазы (пример 34). Соединение XI ослабляет интенсивность стереотипных движений головы, вызванных N,N-диметил-5-метокситриптамином. Известно, что антагонизм с серотонино-позитивными веществами характерен для нейролептиков, не вызывающих экстрапирамидных нарушений.
В сочетании с перечисленными выше фактами отсутствия у соединения XI собственного каталептогенного, миорелаксантного и селдативного эффектов эти данные свидетельствуют о том, что соединение XI является потенциальным нейролептиком избирательного действия, не проявляющим побочных эффектов, в том числе экстрапирамидных. В экспериментах с апоморфиновой вертикализацией было выявлено ряд веществ с дофамино-позитивным эффектом, указывающим на возможное антидепрессантное действие. Часть из этих веществ проявила активность и по показателю, более специфическому для выявления антидепрессантной активности в тесте "неизбегаемого плавания". Наибольшую активность в этом тесте так же как и в тесте апоморфиновой вертикализации проявляло соединение XIX как потенциального антидепресанта является его способность потенцировать стимулирующий эффект l-дофа в отношении моторной активности у крыс, ослаблять каталепсию, вызванную галоперидолом, и снижать интенсивность встряхиваний головы, вызванных серотониномиметиком.
Изобретение иллюстрируется следующими специфическими примерами, в которых температура плавления химических соединений определялась в открытых капиллярах и не корректировалась. Оптическое вращение измеряли на автоматическом поляриметре Perkin-Elmer 241. Спектры ПМР регистрировали на спектрометре AC-250 Briken в растворах CDCl3 и ДМСО-d6, внутренний стандарт ME4Si. Для резонансных сигналов была использована следующая аббревиатура: с синглет; д дублет; т триплет; кв квадруплет; м - мультиплет.
Тонкослойную хроматографию проводили на пластинках DS-Altfolien Kieselgel 60 F254 (Merk) или на пластинках silica gel (Eastman Kodak), пятна проявляли в йодной камере, нингидрином или под УФ7
В экспериментах in vivo использовались белые беспородные мыши-самцы массой 22 25 г и мыши-самцы C 57 Bl 6 такой же массы, а также белые беспородные крысы-самцы массой 250 280 г.
Пример 1. Получение метилового эфира N-капроил-L-пролил-L-тирозина, N-CH3(CH2)4C(O)-L-Pro-L-Tyr-OMe (I).
а) N-капроил-L-пролин.
К раствору 2,74 г (0,024 моль) L-пролина в 12 мл 2 н. гидроокиси натрия при 0oC и перемешивании медленно добавляют попеременно 7 мл. 4н. гидроокиси натрия и 3,31 мл (0,024 моль) хлорангидрида капроновой кислоты. Через 15 мин реакционную смесь подкисляют соляной кислотой до pH-3. Затем экстрагируют хлороформом, экстракт промывают водой. Высушивают над безводным сульфатом магния. Осушитель отфильтровывают, хлороформ упаривают. Остаток сушат над P2O5. Получают 2,75 г (54%) N-капроил-L-пролина в виде масла, [α]
Найдено, C 62,27; H 12,4; N 12,1. C11H19NO3.
Вычислено, C 61,94; H 11,9; N 11,7.
б) Метиловый эфир N-капроил-L-пролил-L-тирозина.
К раствору 1,06 г (0,005 моль) L-капроил-L-пролина в 25 мл хлороформа при охлаждении (-10oC) и перемешивании добавляют по каплям 0,55 мл (0,005 моль) N-метилморфолина и 0,67 мл (0,005 моль) изобутилхлорформиата из разных капельных воронок. Через 2 3 мин медленно добавляют смесь 1,16 г (0,005 моль) хлоргидрата метилового эфира L-тирозина и 0,55 мл (0,005 моль) N-метилморфолина в 10 мл хлороформа и 10 мл ДМФА. Затем перемешивают 1 ч при охлаждении и оставляют на ночь при комнатной температуре. Осадок отфильтровывают, растворитель упаривают. Остаток растворяют в хлороформе, промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой и сушат безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. Остаток перекристаллизовывают из гексана. При этом получают 1 г (54% ) эфира I в виде кристаллов с т. пл. 113 116oC, ([α]
Найдено, C 64,19; H 7,9; N 6,9. C21H30N2O5.
Вычислено, C 64,6; H 7,8; N 7,2.
Пример 2. Получение амида N-капроил-L-пролил-L-тирозина, N-CH3(CH2)4C(O)-L-Pro-L-Tyr-NH2 (II).
0,52 г эфира I растворяют в 5 мл этанола и насыщают газообразным аммиаком при 0oC. Оставляют на 2 дн при комнатной температуре. Растворитель упаривают. Остаток перекристаллизовывают из хлороформа. Получают 0,29 г (59% ) амида II в виде кристаллов с т. пл. 150oC (возг.), [α]
Пример 3. Получение этилового эфира N-нонаноил-L-пролил-L-тирозина, N-CH3(CH2)7C(O)-L-Pro-L-Tyr-OEt (III).
а) N-Нонаноил-L-пролин.
К раствору 1,15 г (0,01 моль) L-пролина в 5 мл 2 н. гидроокиси натрия при перемешивании и охлаждении (0oC) медленно добавляют попеременно 1,9 мл (0,01 моль) хлорангидрида нонановой кислоты и 5 мл 2 н. гидроокиси натрия, перемешивают 20 мин. Примеси экстрагируют ЭА. Затем подкисляют 4 н. раствором соляной кислоты до pH-2. Выпавшее масло экстрагируют хлороформом, сушат над безводным сульфатом магния. Осушитель отфильтровывают, хлороформ упаривают. Получают 1,8 г (68%) N-нонаноил-L-пролина в виде масла с [α]
Найдено, C 65,7; H 10,0; N 5,7. C14H25NO3.
Вычислено, C 65,9; H 9,9; N 5,5.
б) Этиловый эфир N-нонаноил-L-пролил-L-тирозина.
К раствору 0,95 г (0,037 моль) N-нонаноил-L-пролина в 5 мл абсолютного хлороформа при охлаждении (-5oC) и перемешивании медленно прибавляют 0,42 мл (0,037 моль) N-метилморфолина и 0,5 мл (0,037 моль) изобутилхлорформиата из разных капельных воронок. Через 2 3 мин. по каплям прибавляют смесь 0,9 г (0,037 моль) хлоргидрата этилового эфира L-тирозина и 0,42 мл (0,037 моль) N-метилморфолина в 3 мл ДМФА. Реакционную смесь перемешивают 30 мин. при охлаждении и 1,5 ч при комнатной температуре. Осадок отфильтровывают, растворитель упаривают. Остаток растворяют в хлороформе, промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой, затем сушат над безводным сульфатом магния. Осушитель отфильтровывают, растворитель упаривают. Остаток перекристаллизовывают из эфира. При этом получают 1 г (60% ) белого кристаллического вещества с т. пл. 115 117oC, [α]
Найдено, C 67,0; H 8,7; N 6,0. C25H38N2O5.
Вычислено, C 67,2; H 8,6; N 6,3.
Пример 4. Получение амида N-нонаноил-L-пролил-L-тирозина, N-CH3(CH2)7C(O)-L-Pro-L-Tyr-NH2 (IV).
0,75 г эфира III растворяют в 20 мл метанола, насыщенного газообразным аммиаком, затем оставляют на 2 нед при комнатной температуре. Растворитель упаривают. Кристаллический остаток растворяют в смеси хлолформ-этанол и хроматографируют на колонке с силикагелем, элюируют хлороформом, смесью хлороформэтанол. Получают 0,15 г (22%) амида (IV) с т.пл. 178 180o (с 0,3; метанол), Rf 0,7 (кизельгель, хлороформ-метанол, 9: 1). ПМР спектр в ДМСО-d6 (δ м. д.): 0,86 (т, CH3-CH2-, 3H); 1,10 2,27 (м, CH3-(CH2)7-, 14H); 1,5 2,1 (м, CβH2-CγH2Pro, 4H); 2,6 3,0 (м, CβH2Tyr, 2H); 3,2 3,5 (м, CδH2Pro, 2H); 4,16 и 4,26 (каждый м, CαHPro, 1H); 4,26 и 4,42 (каждый м, CαHTyr, 1H); 6,62 6,97 и 7,01 (каждый м, Ar Tyr, 4H); 6,95.7,15 (четыре с, NH2, 2H); 7,67 и 8,10 (каждый д, NH Tyr, 1H); 9,17 и 9,18 (каждый с, OH Tyr, 1H).
Найдено, C 66,4; H 8,1; N 10,2. C23H35N3O4.
Вычислено, C 66,15; H 8,5; N 10,1.
Пример 5. Получение метилового эфира N-валерил-L-пртлил-L-тирозина, N-C4H9C(O)-L-Pro-L-Tyr-OMe (V).
а) N-валерил-L-пролин.
К раствору 3,8 г (0,033 моль) L-пролина в 16,5 мл 2 н. раствора гидроокиси натрия при перемешивании и охлаждении (0oC) медленно добавляют попеременно 4,1 г (0,033 моль) хлорангидрида валериановой кислоты и 16,5 мл 2 н. раствора гидроокиси натрия. Перемешивают еще 20 мин. Примеси экстрагируют этилацетатом (ЭА). Подкисляют 4 н. раствором соляной кислоты до pH≈2. Выпавшее масло экстрагируют хлороформом, сушат над безводным сульфатом магния. Осушитель отфильтровывают, хлороформ упаривают. Получают 6 г (94%) N-валерил-L-пролина в виде масла, [α]
Найдено, C 59,9; H 8,3; N 7,2. C10H17NO3.
Вычислено, C 60,3; H 8,6; N 7,0.
б) Метиловый эфир N-валерил-L-пролил-L-тирозина.
К раствору 1,82 г (0,005 моль) N-валерил-L-пролина в 25 мл ЭА при охлаждении (-5oC) и перемешивании добавляют медленно из разных капельных воронок 0,55 мл (0,005 моль) N-метилморфолина и 0,67 мл (0,005 моль) изобутилхлорформиата. Через 2 3 мин медленно прикапывают смесь 1,16 г (0,005 моль) хлоргидрата метилового эфира L-тирозина и 0,55 мл (0,005) N-метилморфолина в 12 мл диметилформамида (ДМФА). Перемешивают 1 ч при охлаждении и 2 ч при комнатной температуре. Осадок отфильтровывают. Растворитель упаривают. Остаток растворяют в хлороформе. Промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой. Сушат над безводным сульфатом магния. Осушитель отфильтровывают, растворитель упаривают. Остаток хроматографируют на колонке с кизельгелем, элюируют смесью хлороформ-этанол. Получают 1,8 г (51% ) эфира V в виде масла, [α]
Найдено, C 63,5; H 7,6; N 7,0. C20H28N2J5.
Вычислено, C 63,8; H 7,5; N 7,4.
Пример 6. Получение этилового эфира N-бензоил-L-пролил-L-тирозина, Bz-L-Pro-L-Tyr-OEt (VI).
а) N-бензоил-L-пролин.
К раствору 5,75 г (0,05 моль) L-пролина в 25 мл 2 н. раствора гидроокиси натрия при 0oC и перемешивании медленно прибавляют попеременно 12,5 мл 4 н. раствора гидроокиси натрия и 5,8 мл (0,05 моль) хлористого бензоила. Через 15 мин реакционную смесь подкисляют 1 н. раствором соляной кислоты до pH≈3. Выделившееся масло экстрагируют хлороформом. Сушат над безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. Остаток заливают эфиром и оставляют на 2 сут при комнатной температуре. Получают 9,42 г (86%) N-бензоил-L-пролина в виде кристаллов, т. пл. 152 - 154oC, [α]
б) Этиловый эфир N-бензоил-L-пролил-L-тирозина.
К раствору 1,2 г (0,0052 моль) N-бензоил-L-пролина в 15 мл ЭА и 3 мл ДМФА при охлаждении (-5oC) и перемешивании прибавляют по каплям 0,42 мл (0,0052 моль) N-метилморфолина и 0,5 мл (0,0052 моль) изобутилхлорформиата из разных воронок. Через 2 3 мин добавляют по каплям смесь 0,9 г (0,0052 моль) хлоргидрата этилового эфира L-тирозина, 0,42 мл N-метилморфолина в 3 мл ДМФА (при этом температура реакционной смеси не должна превышать -5oC). Реакционную смесь перемешивают 1 ч. и оставляют на ночь при комнатной температуре. Осадок отфильтровывают. Растворитель упаривают. Остаток растворяют в хлороформе. Промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой. Сушат над безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. Остаток хроматографируют на колонке с силикагелем, элюируют хлороформом, смесью хлороформ-этанол. Полученное масло заливают эфиром, кристаллы отфильтровывают, сушат над P2O5. Получают 0,7 г (42%) эфира VI с т. пл. 63 - 67oC (гигр.), [α]
Найдено, C 66,94; H 6,65; N 6,88. C23H26N2O5.
Вычислено, C 67,29; H 6,4; N 6,82.
Пример 7. Получение амида N-бензоил-L-пролил-L-тирозина, Bz-L-Pro-L-Tyr-NH2 (VII).
0,61 г эфира VII растворяют в 15 мл метанола, насыщенного газообразным аммиаком и оставляют при комнатной температуре на 2,5 недели. Растворитель упаривают, остаток перекристаллизовывают из метанола. Сушат над P2O5. Получают 0,3 г (53%) амида VII в виде кристаллов, т. пл. 88 93oC, [α]
Найдено, C 66,25; H 6,33; N 11,01. C21H23N3O4.
Вычислено, C 66,12; H 6,09; N 11,01.
Пример 8. Получение этилового эфира N-феноксиацетил-L-пролил-L-тирозина, PhOAc-L-Pro-L-Tyr_OEt (VIII).
а) N-Феноксиацетил-L-пролин.
К раствору 5,75 г (0,05 моль) L-пролина в 25 мл 2 н. раствора гидроокиси натрия при 0oC и перемешивании медленно прибавляют 12,5 мл 4 Н7 раствора гидроокиси натрия и 6,9 мл (0,05 моль) хлорангидрида фенилуксусной кислоты из разных капельных воронок. Через 15 мин реакционную смесь подкисляют 1 н. раствором соляной кислоты до pH≈3. Выделившееся масло экстрагируют хлороформом, сушат над безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. Остаток заливают эфиром и оставляют на холоде. Выпавшие кристаллы отфильтровывают и получают 12,33 (98%) N-феноксиацетил-L-пролина с т. пл. 100 103oC, [α]
Найдено, C 63,1; H 6,12; N 5,6. C13H15NO3.
Вычислено, C 62,63; H 6,08; N 5,62.
б) Этиловый эфир N-феноксиацетил-L-пролил-L-тирозина.
К раствору 0,92 г (0,0037 моль) N-феноксиацетил-L-пролина в 16 мл ЭА и 3 мл ДМФА при охлаждении (-5oC) и перемешивании попеременно прибавляют 0,43 мл (0,0037 моль) N-метилморфолина и 0,51 мл (0,0037 моль) изобутилхлорформиата. Через 2 3 мин медленно прибавляют смесь 0,92 г (0,0037 моль) хлоргидрата этилового эфира L-тирозина и 0,43 мл N-метилморфолина в 3 мл ДМФА. Перемешивают при охлаждении 1 ч. и при комнатной температуре еще 2 ч. Осадок отфильтровывают, растворитель упаривают в вакууме. Остаток растворяют в хлороформе, промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой. Сушат над безводным сульфатом натрия. Осушитель отфильтровывают, хлороформ упаривают. Остаток хроматографируют на колонке с силикагелем, элюируют хлороформом, смесью хлороформ-этанол. Получают 0,6 г (45% ) эфира VIII в виде кристаллов с т. пл. 55 58oC, [α]
Пример 9. Получение амида N-феноксиацетил-L-пролил-L-тирозина, PhOAc-L-Pro-L-Tyr-NH2 (IX).
0,5 эфира VIII растворяют в 11 мл метанола, насыщенного газообразным аммиаком и оставляют при комнатной температуре на 2 нед. Растворитель упаривают. Остаток хроматографируют на колонке с силикагелем, элюируют хлорофором, смесью хлороформ-этанол. Получают 0,41 г (87%) амида IX с т.пл. 16 112oC, [α]
Найдено, C 64,4; H 6,42; N 1,32. C22H25N3O5.
Вычислено, C 64,54; H 6,13; N 1,27.
Пример 10. Получение этилового эфира N-фенилацетил-L-пролил-L-тирозина, PhAc-L-Pro-L-Tyr-OEt (X).
К охлажденному до -1oC раствору 0,862 г (0,0037 моль) N-фенилацетил-L-пролина (т.пл. 150-151oC, [α]
Найдено, C 68,23; H 6,94; N 6,43. C24H28N2O5.
Вычислено, C 67,91; H 6,66; N 6,59.
Пример 11. Получение амида N-фенилацетил-L-пропилил-L-тирозина, PhAc-L-Pro-L-Tyr-NH2 (XI).
1 г эфира X растворяют в 10 мл метанола, предварительно насыщенного газообразным аммиаком при 0oC и отставляют на 18 дн при комнатной температуре. Растворитель упаривают, маслообразный остаток растворяют в спирте и высаживают эфиром. Выпавший осадок отфильтровывают и получают 0,71 г (75%) амида XI с т. пл. 201 203oC, Rf0,75 (кизельгель, хлороформ-этанол, 9:3), [α]
Найдено С 66,8; H 6,34; N 10,69. C22H25N3J4.
Вычислено, C 66,82; H 6,37; N 10,63.
Пример 12. Полученное этилового эфира N-фенилацетил-D-пролил-L-тирозина, PhAc-D-Pro-L-Tyr-OEt (XII).
а) N-Фенилацетил-D-пролин.
К раствору 1,15 г (0,01 моль) D-пролина (Reanal) в 5 мл 2 н. раствора гидроокиси натрия при 0oC и перемешивании медленно прибавляют 2,5 мл 4н. раствора гидроокиси натрия и 1638 мл (0,01 моль) хлорангидрида фенилуксусной кислоты. Через 15 мин реакционную смесь подкисляют 1 н. раствором соляной кислоты до pH ≈3 4. Выпавшие белые кристаллы отфильтровывают, промывают водой. Сушат над КОН и над P2O5. Получают 1,05 г (83%) N-фенилацетил-D-пролина с т.пл. 147-149oC, [α]
Найдено, C 70,1; H 6,52; N 5,99. C13H15NO3.
Вычислено, C 66,93; H 6,49; N 6,00.
б) Этиловый эфир N-фенилацетил-D-пролил-L-тирозина.
К раствору 0,86 г (0,0037 моль) N-фенилацетил-D-пролина в 15 мл ЭА и 3 мл ДМФА при охлаждении (-5oC) и перемешивании медленно прибавляют 0,42 мл (0,0037 моль) N-метилморфолина и 0,5 мл (0,0037 моль) изобутилхлороформиата из разных капельных воронок. Через 2 3 мин добавляют смесь 0,9 г (0,0037 моль) хлоргидрата этилового эфира L-тирозина и 0,42 мл N-метилфорфолина в 3 мл ДМФА (при этом температура реакционной смеси не должна превышать -5oC). Осадок отфильтровывают, растворитель удаляют в вакууме. Остаток растворяют в, хлороформе и промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой. Сушат над безводным сульфатом натрия. Осушитель отфильтровывают, хлороформ упаривают. Выход неочищенного маслообразного продукта 0,8 г (94%). Масло покрывают гексаном и оставляют на холоду. Получают 0,56 г (66%) эфира XII c т. пл. 186-188oC, [α]
Найдено, C 68,13; H 6,54; N 6,44. C24H28N2O5.
Вычислено, С 67,91; H 6,54; N 6,59.
Пример 13. Получение амида N-фенилацетил-D-пролил-L-тирозина,N-PhAc-D-Pro-L-Tyr-NH2 (XIII).
0,24 г эфира XIII растворяют в 5 мл метанола, насыщенного газообразным аммиаком, и оставляют при комнатной температуре на 2 нед. Растворитель упаривают, полученный остаток перекриситаллизовывают из смеси метанол-эфир. Получают 0,13 г (54%) амида XIII с т. пл. 195 197oC, [α]
Найдено, C 67,0; H 6,44; N 10,71. C22H25N3O4.
Вычислено, С 66,82; H 6,37; N 10,63.
Пример 14. Получение этилового эфира N-фенилацетил-L-пролил-D-тирозина, N-PhAc-L-Pro-D-Tyr-OEn (XIV).
К раствору 0,86 г (0,0037 моль) N-фенилацетил-L-пролина в 15 мл ЭА и 3 мл ДМФА при охлаждении (-10oC) и перемешивании медленно прибавляют 0,42 мл (0,0037 моль) N-метилморфолина и 0,5 мл (0,0037 моль) изобутиохлорформиата из разных капельных воронок. Через 2 3 мин прикапывают смесь 0,9 г (0,0037 моль) хлоргидрата этилового эфира D-тирозина и 0,42 мл N-метилморфолина в 3 мл ДМФА. Перемешивают при охлаждении 1 ч и при комнатной температуре 2 ч. Осадок отфильтровывают, фильтрат упаривают. Остаток растворяют в хлороформе и промывают 5% раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой. Сушат над безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. Маслообразный остаток заливают эфиром и оставляют на ночь. Выпавшие белые кристаллы отфильтровывают и получают 0,5 г (59% ) эфира XIV с т. пл. 187 188oC, [α]
Найдено, С 68,1; H 6,71; N 6,54. C24H28N2O5.
Вычислено, C 67,9; H 6,66; N 6,6.
Пример 15. Получение амида N-фенилацетил-L-пролил-D-тирозина, N-PhAc-L-Pro-D-Tyr-NH2 (XV).
0,17 г эфира XIV растворяют в 5 мл метанола, насыщенного газообразным аммиаком, и оставляют на 3 нед при комнатной температуре. Метанол упаривают, остаток очищают на колонке с силикагелем. Элюируют хлороформом, смесью хлороформ-метанол. Получают 0,1 г (64%) амида XV в виде белого кристаллического вещества с т.пл. 196-198oC, [α]
Найдено, C 66,85; H 6,44; N 11,01. C22H25N3O4.
Вычислено, C 66,82; H 6,37; N 10,63.
Пример 16. Получение метилового эфира N-фенилацетил-L-пролил-L-тирозина, N-PhAc-L-Pro-L-Tyr-OMe (XVI).
К раствору 3 г (0,013 моль) N-фенилацетил-L-пролина в 64 мл ЭА (0,013 моль) N-метилморфолина и 1,8 мл (0,013 моль) изобутилхлорформиата из разных капельных воронок. Через 2 3 мин прикапывают смесь 3,16 г (0,013 моль) хлоргидрата метилового эфира L-тирозина и 1,5 мл N-метилморфолина в 8 мл ДМФА. Перемешивают 1 ч при охлаждении и оставляют на ночь при комнатной температуре. Осадок отфильтровывают, растворитель упаривают. Остаток растворяют в хлороформе и промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой. Сушат над безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. Остаток хроматографируют на колонке с кизельгелем, элюируют хлорофором. Получают прозрачное масло, которое растворяют в метаноле с добавлением эфира. Выпавшие кристаллы отфильтровывают и получают 0,3 г (25% ) эфира XVI с т. пл. 148oC, [α]
Найдено, C 66,1; H 6,6; N 6,8. C23H26N2O5•0,5CH3OH.
Вычислено, C 66,19; H 6,56; N 6,53.
Пример 17. Получение амида N-карбобензокси-L-пролил-L-тирозина, Z-L-Pro-L-Tyr-NH2 (XVII).
а) Метиловый эфир N-карбобензокси-L-пролил-L-тирозина.
Раствор, содержащий 1,25 г (0,054 моль) N-карбобензокси-L-пролина (Reanal) в 25 мл ДМФА охлаждают до -10oC. К раствору при перемешивании попеременно добавляют 0,63 мл (0,054 моль) N-метилморфолина и 0,73 мл (0,054 моль) изобутилхлорформиата. Реакционную смесь перемешивают при охлаждении и 1,5 ч при комнатной температуре. Растворитель упаривают в вакууме, остаток растворяют в 50 мл ЭА и промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой, затем сушат над безводным сульфатом натрия. Осушитель отфильтровывают, ЭА упаривают. Остаток перекристаллизовывают из смеси абс. спирт-петролейный эфир (1:10). При этом получают 1,74 г (83% ) эфира в виде белого кристаллического вещества с т. пл. 76 78oC, [α]
Найдено, C 64,74; H 6,31; N 6,57. C23H26N2O6.
Вычислено, C 64,77; H 6,16; N 6,56.б) Амид N-карбобензокси-L-пролил-L-тирозина.
1 г Z-L-Prj-L-Tyr-OMe растворяют в 100 мл метанола, насыщенного газообразным аммиаком. Через 2 недели метанол упаривают. Остаток хроматографируют на колонке с силикагелем, элюируют смесью хлороформ-этанол. Получают 0,44 г (46% ) амида XVII с т. пл. 164 166oC, [α]
Найдено, C 64,27; H 6,23; N 10,57. C22H25N3O5.
Вычислено, C 64,17; H 6,12; 10,21.
Пример 18. Получение этилового эфира N-карбобензокси-L-пролил-D-тирозина, Z-L-Pro-D-Tyr-OEt (XVIII).
К раствору 1,24 г (0,05 моль) N-карбобензокис-L-пролина (Reanal) в 25 мл ЭА при перемешивании и охлаждении (-10oC) прибавляют попеременно 0,56 мл (0,05 моль) N-метилфорфолина и 0,67 мл (0,05 моль) изобутилхлорформиата так, чтобы температура реакционной смеси не была выше -5oC. Через 2 3 мин добавляют раствор 1,23 г (0,05 моль) хлоргидрата этилового эфира D-тирозина и 0,56 N-метилморфолина в 10 мл ДМФА. Перемешивают при охлаждении 30 мин и при комнатной температуре еще 2 ч. Растворитель упаривают, остаток растворяют в ЭА, промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой, затем сушат над безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. При этом получают 2,1 (95%) эфира XVIII в виде белого кристаллического вещества с т.пл. 149-152oC, [α]
Найдено, C 65,74; H 6,31; N 6,57. C24H28N2O6.
Вычислено, C 65,43; H 6,42; N 6,36.
Пример 19. Получение амида N-карбобензокси-L-пролил-D-тирозина, Z-L-Pro-D-Tyr-NH2 (XIX).
1 г эфира XVIII растворяют в 100 мл метанола, насыщенного газообразным аммиаком и оставляют на 3 сут при комнатной температуре. Растворитель упаривают, остаток перекристаллизовывают из смеси ЭА-петролейный эфир. При этом получают 0,6 г (60%) амида XIX с т. пл. 174 176oC, [α]
Найдено, C 64,27; H 6,41; N 9,98. C22H25N3O5.
Вычислено, C 64,17; H 6,12; N 10,21.
Пример 20. Получение этилового эфира N-трет.бутилоксикарбонил-L-пролил-L-тирозина, Boc-L-Pro-L-Tyr-OEt (XX).
а) N-трет.бутилоксикарбонил-L-пролин, Boc-L-Pro-OH
К раствору 2,88 г (0,025 моль) L-пролина в 50 мл 2-ного раствора гидроокиси натрия и 50 мл диоксана медленно прибавляют 5,45 г (0,025 моль) ди. трет. бутилоксикарбоната в 20 мл диоксана. Реакционную смесь перемешивают 18 ч, затем подкисляют 1 н. раствором соляной кислоты до pH-3. После этого экстрагируют хлороформом. Органический слой промывают водой, сушат над безводным сульфатом натрия; осушитель отфильтровывают, растворитель упаривают. При этом получают 3,88 г (78%) Boc-L-Pro-OH в виде белых кристаллов с т. пл. 130 -131oC, [α]
б) Этиловый эфир N-трет.бутилоксикарбонил-L-пролил-L-тирозина
К раствору 1,43 г (0,007 моль) Boc-L-Pro-OY в 33 мл ЭА при охлаждении (-10oC) и перемешивании прибавляют по каплям 0,8 мл (0,007 моль) N-метилморфолина и 0,94 мл (0,007 моль) изобутилхлорформиата. Через 2 3 мин медленно прибавляют смесь 1,62 г (0,007 моль) хлоргидрата этилового эфира L-тирозина и 0,8 мл N-метилморфолина в 6 мл ЭА и 7 мл ДМФА. Затем перемешивают при охлаждении 1 ч и оставляют на ночь при комнатной температуре. Осадок отфильтровывают, растворитель упаривают в вакууме. Остаток растворяют в хлороформе и промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой, а затем сушат над безводным сульфатом магния. Осушитель отфильтровывают, хлороформ упаривают. При этом получают 2,2 г (82%) эфира XX в виде масла, [α]
Найдено, C 62,5; H 7,6: N 7,33. C21H30N2O6.
Вычислено, C 62,04; H 7,45; N 6,89.
Пример 21. Получение амида N-трет.бутоксикарбонил-L-пролил-L-тирозина, Boc-L-Pro-L-Tyr-NH2 (XXI).
2,08 г эфира XX растворяют в 15 мл абсолютного этанола и насыщают газообразным аммиаком в течение 10 мин при 0oC, а затем оставляют на ночь при комнатной температуре. Растворитель упаривают, остаток очищают на колонке с силикагелем, элюируют хлороформом, смесью хлороформ-этанол. Получают 1,13 г (60% ) амида XII в виде кристаллов с т. пл. 72 75oC, [α]
Найдено, C 60,93; H 7,35; N 11,51. C19H27N3O5.
Вычислено, C 60,45; H 7,23; N 11,13.
Пример 22. Получение метилового эфира N-трет.бутоксикарбонил-D-пролил-L-тирозина, Boc-D-Pro-L-Tyr-OMe (XXII).
К раствору 2,15 г (0,01 моль) Boc-D-Pro в 50 мл ДМФА при охлаждении (-10oC) и перемешивании медленно прибавляют 1,09 мл (0,01 моль) N-метилморфолина и 1,34 мл (0,01 моль) изобутилхлорформиата. Через 2 3 мин прибавляют смесь 2,32 г (0,01 моль) хлоргидрата метилового эфира L-тирозина и 1,09 мл N-метилморфолина в 9 мл ДМФА. Затем перемешивают при охлаждении 3 ч, осадок отфильтровывают, растворитель упаривают. После этого остаток растворяют в хлороформе и промывают 5-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой, а затем сушат безводным сульфатом натрия. Осушитель отфильтровывают, растворитель упаривают. Остаток очищают на колонке с силикагелем, элюируют хлороформом, смесью хлороформ-этанол. При этом получают 0,153 г (86%) эфира XXII в виде масла, [α]
Найдено, C 61,62; H 7,2; N 7,15. C20H28N2O6.
Вычислено, C 61,2; H 7,21; N 7,13.
Пример 23. Получение амида N-трет.бутоксикарбонил-D-пролил-Lтирозина, Boc-D-Pro-L-Tyr-NH2 (XXIII).
Раствор 2,08 г Boc-D-Pro-L-Tyr-OMe в 15 мл этанола насыщают газообразным аммиаком при 0oC. Оставляют на 2 дн при комнатной температуре, затем растворитель упаривают на роторе, остаток хроматографируют на колонке с силикагелем, элюируют холороформом и смесью хлороформ-этанол. Получают 0,86 г (43%) амида XXIII в виде белых кристаллов с т. пл. 76 78oC; [α]
Найдено, C 56,19; H 6,95; N 9,93. C19H27N3O5•0,5C2H5OH.
Вычислено, C 56,33; H 6,70; N 10,37.
Пример 24. Получение амида D-пролил-L-тирозина, трифторацетат, D-Pro-L-Tyr-NH2COOH (XXIV).
Раствор 0,26 г Boc-D-Pro-L-Tyr-NH2 (XXIII) в 10 мл CF3COOH перемешивают 10 мин при комнатной температуре, затем упаривают на роторе, остаток затирают с эфиром. Отделившиеся кристаллы отфильтровывают и высушивают над КОН в эксикаторе. Получают 0,16 г (93%) трифторацетата XXIV с т. пл. 93 - 95oC (гигроск), Rf0,26 (кизельгель, бутанол-уксусная кислота-вода, 5:1:2). ПМР-спектр в (CD3)2SO (δ м.д.): 1,40; 2,13 (каждый М, CβH2Pro, 2h; 1,77 (каждый м, CγH2pRO, 2h); 2,60; 2,99 (каждый дд, CβH2Tyr, 2H); 3,21 (м, CδH2Pro, 2H); 4,12 (м, CαHPro, 1H); 4,47 (м, CαHTyr, 1H); 6,63; 7,01 (м, AA,XX, система, AR Tyr, 4H); 8,39 (с уш. OH, 1H); 8,69 (д, NH Tyr, 1H); 9,17 (с уш. NH Pro, 1H).
Найдено, N 10,32. C14H19N3O3•CF3COOH.
Вычислено, N 10,73.
Пример 25. Получение этилового эфира N-трет.бутоксикарбонил-D-пролил-D-тирозина, Boc-D-Pro-D-Tyr-OEt (XXV).
К раствору 1,43 г (0,007 моль) Boc-D-Pro-OH в 33 мл сухого ЭА при охлаждении (-10oC) и перемешивании прибавляют по каплям 0,8 мл (0,007 моль) N-метилморфолина и 0,94 мл (0,007 моль) изобутилхлорформиата. Через 2 - 3 мин медленно добавляют 1,62 г (0,007 моль) D-Tyr-OEt•HCl и 0,8 мл (0,007 моль) N-метилморфолина в смеси 6 мл ЭА и 7 мл ДМФА. Перемешивают 1 ч при охлаждении (-5 -10oC) и оставляют на ночь. Осадок отфильтровывают, растворитель упаривают в вакууме. Остаток растворяют в хлороформе, промывают 5-ным раствором NaHCO3, водой, 1 н. раствором соляной кислоты, водой, а затем сушат над безводным сульфатом магния. Осушитель отфильтровывают, растворитель упаривают. Получают 2,42 г (90%) эфира XXV в виде прозрачного масла, [α]
Найдено, C62,38; H 7,65; N 7,35. C21H30N2O6.
Вычислено, C 62,0; H 7,45; N 6,89.
Пример 26. Получение амида N-третюбутоксикарбонил-D-пролил-D-тирозина, Boc-D-Pro-D-Tyr-NH2 (XXVI).
Через раствор 2,08 г Boc-D-Pro-D-Tyr-OEt в 15 мл этанола пропускают NH3 (газ) при 0oC до насыщения. Реакционную смесь оставляют на 5 дней при комнатной температуре. Растворитель упаривают и остаток хроматографируют на колонке с силикагелем, элюируют хлороформом, смесью хлороформ-этанол. Получают 0,32 г (17%) амида XXVI в виде белого кристаллического вещества с т.пл. 72-75oC; [α]
Найдено, C60,77; H 7,43; N 11,42. C19H27N3O5.
Вычислено, C 60,45; H 7,23; N 11,13.
Пример 27. Получение амида D-пролил-D-тирозина, трифторацетата, D-Pro-D-Tyr-NH2•CF3COOH (XXVII).
0,1 г Boc-D0Pro-D-Tyr-NH2 растворяют в 10 мл CF3COOH и перемешивают 20 мин при комнатной температуре. Реакционную смесь упаривают, остаток заливают эфиром и отделившиеся кристаллы отфильтровывают, получают 0,09 г (96%) трифторацетата XXVII с. т. пл. 155-156oC, [α]
Найдено, N 12,09. C14H19N3O3•CT3COOH
Вычислено, N 11,89.
Пример 28. Получение метил амида L-пролил-L-тирозина трифторацетата, L-Pro-L-Tyr-NHCH3•CF2COOH (XXVIII).
а) Метиловый эфир N-трет.бутолоксикарбонил-L-пролил-L-тирозина, Boc-L-Pro-L-Tyr-OCH3
К раствору 2,15 г (0,01 моль) Boc-L-Pro-OH в 50 мл ДМФА при охлаждении (-10oC) и перемешивании прибавляют по каплям 1,09 мл (0,01 моль) N-метилморфолина и 1,34 мл (0,01 моль) изобутилхлорформиата. Через 2 3 мин к реакционной смеси прибавляют смесь 2,32 г (0,01 моль) L-Tyr-OCH3•HCl и 1,09 мл (0,01 моль) N-метилморфолина в 9 мл ДМФА. Перемешивают при охлаждении (-5oC) 1 ч, затем еще при комнатной температуре 1,5 ч. Растворитель упаривают, остаток растворяют в хлороформе и промывают по 3 раза 5-ным раствором NaHCO3, водой, 1 н. раствором соляной кислоты и водой. Сушат над безводным Na2SO4, осушитель отфильтровывают, растворитель упаривают. Остаток хроматографируют на колонке с силикагелем, используя в качестве элюента хлороформ и смесь хлороформ-этанол. Получают 0,153 г (86%) Boc-L-Pro-L-Tyr-OMe в виде кристаллизующегося масла, [α]
Найдено, C 61,62; H 7,2; N 7,15. C20H28N2O6.
Вычислено, C 61,20; H 7,21; N 7,13. Литературные данные [Bizzozero S.A. et al. Helv. Chimica Acta, 1982, 65(6), 1707] [α]
б) Метиламид N-трет.бутилоксикарбонил-L-пролил-L-тирозина, Boc-L-Pro-L-Tyr-NHCH3
Через раствор 3,36 г Boc-L-Pro-L-Tyr-OMe в 15 мл этанола пропускают при 0oC NH3 (газ) до насыщения и оставляют при комнатной температуре на 2 ч. Растворитель упаривают, маслообразный остаток заливают эфиром и оставляют на ночь. Отделившиеся кристаллы отфильтровывают, получают 3,6 г (98%) Boc-L-Pro-L-Tyr-NHCH3 с т. пл. 90-93oC, [α]
Найдено, C 60,23; H 7,54; N 11,39 C20H29N3O5.
Вычислено, C 60,13; H 7,49; N 11,73.
в) Метиламид L-пролил-L-тирозина трифторацетат, L-Pro-L-Tyr-NHCH3•CF3COOH
Раствор 0,3 г Boc-L-Pro-L-Tyr-NHCH3 в 15 мл трифторуксусной кислоты перемешивают при комнатной температуре 20 мин, затем реакционную смесь упаривают на роторе и остаток под эфиром оставляют на ночь. Кристаллы отфильтровывают, получают 0,23 г (97%) L-Pro-L-Tyr-NHCH3•CF3COOH с т.пл. 193-195oC, Rf0,35 (кизегель, бутанол-уксусная кислота-вода, 5:1:2), [α]
Найдено, N 10,48. C15H20N3O3•CF3COOH.
Вычислено, N 10,39.
Пример 29. Влияние предлагаемых соединений на апоморфиновую вертикализацию у мышей.
Тест апоморфиновой вертикализации является наиболее избирательным и чувствительным поведенческим методом скрининга нейролептиков (Protais P. Costantin J. Schwartz J.C. Climbiyg mbehavior inducer by apomorphine-simple test for the study of dopamin receptors in striatum. Psychopharmacology, 1976, v. 50, 1 6).
Эксперименты проводили на белых мышах самцах линии C57BL6 массой 22 25 г. Апоморфин гидрохлорид вводили подкожно в дозе 7,5 мг/кг за 10 мин до тестирования в цилиндрических проволочных клетках диаметром 13 см и высотой 16 см. Регистрировали вертикальную активность животных [climbing] в специальных проволочных клетках. Оценку вертикальной активности проводили по четырехбалльной системе. Изучаемые вещества суспензировали в 0,9%+Nacl с добавлением Твин-80 и вводили внутрибрюшинно за 10 мин до введения апоморфина. Число мышей в контрольной [NaCl, Твин-80 плюс апоморфин] и опытной [тестируемое соединение плюс апоморфин] составляло от 10 до 15. Статистическую обработку данных проводили по критерию Вилкоксона-Манна-Уитни [критерий U]
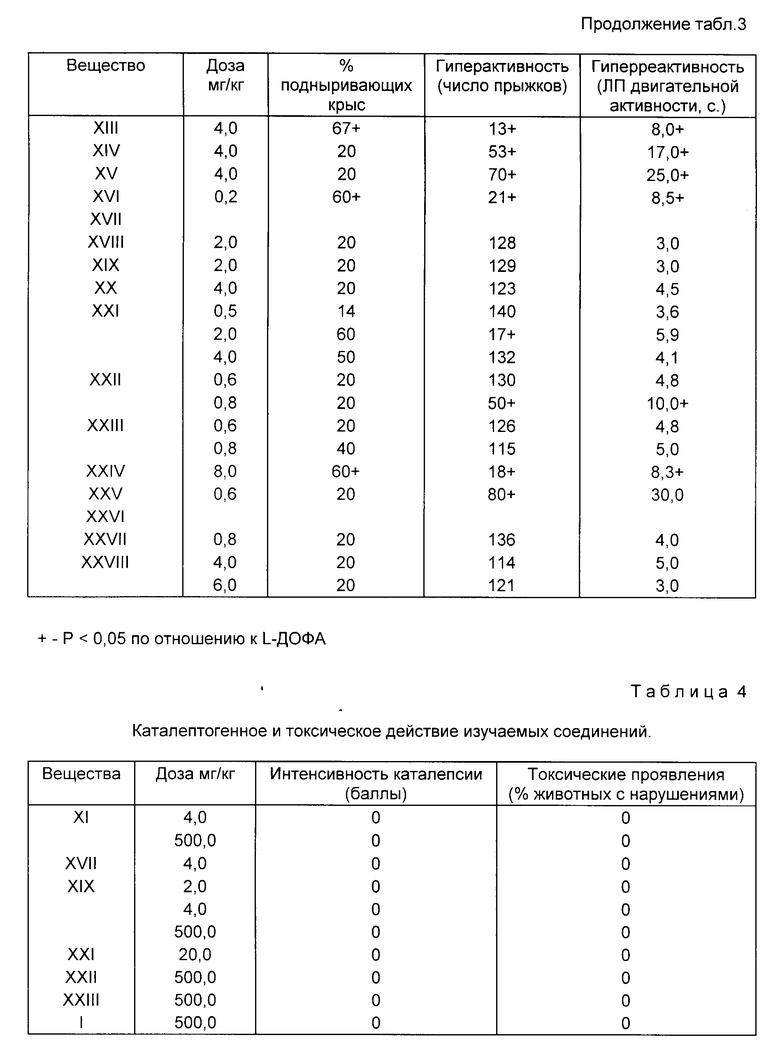
Исследования показали, что способность уменьшать интенсивность апоморфиновой вертикализации у мышей обладают соединения I, III, IV, XI, XII, XIII, XV, XVI, XXII, XXIII, XXIV (табл. 1), которые, таким образом, являются антагонистами амоморфина. Статистически достоверное снижение интенсивности вертикализации отмечалось при введении соединений в диапазоне доз от 0,4 до 12 мг/кг.
Соединения I, IV, XVI, XXII проявляли высокую активность в дозах 0,4-0,8 vu/ruб а соединения III, XI, XIII, XXI, XXIV в дозах 2 12 мг/кг. По глубине антиапоморфинового эффекта в этом тесте наибольшей активностью обладали соединения III, XI, XVI, XII и XXIV, которые снижали вертикализацию в широком диапазоне доз и более чем на 50% по сравнению с контролем.
Полученные данные позволяют высказать предложение о наличии у изученных соединений выраженной нейролептической активности. Большинство соединений превосходит по активности широко используемый эталонный атипичный нейролептик эглонил [сульпирид] который проявляет активность по этому тесту лишь в доле 8 мг/ кг (Worms P. Lloyd K. Predictability and specificity of behfvioral screening tests for neuroleptics. Pharmacology Ther. 1979, 5, 445 450).
Соединения VI, VIII, IX, XIX являются агонистами в отношении эффектов апоморфина и обладают способностью увеличивать интенсивность апоморфиновой вертикализации (табл. 1).
Соединения II, XXIV, XXV, XXVII в зависимости от дозы обладают свойствами агониста-антогониста: в одних дозах повышают, а в других уменьшают интенсивность апоморфиновой вертикализации.
Таким образом, модификация структуры может привести к появлению у соединений свойств агониста эффектов апоморфина, что позволяет предполагать у соединений последней группы наличие антидепрессантной активности.
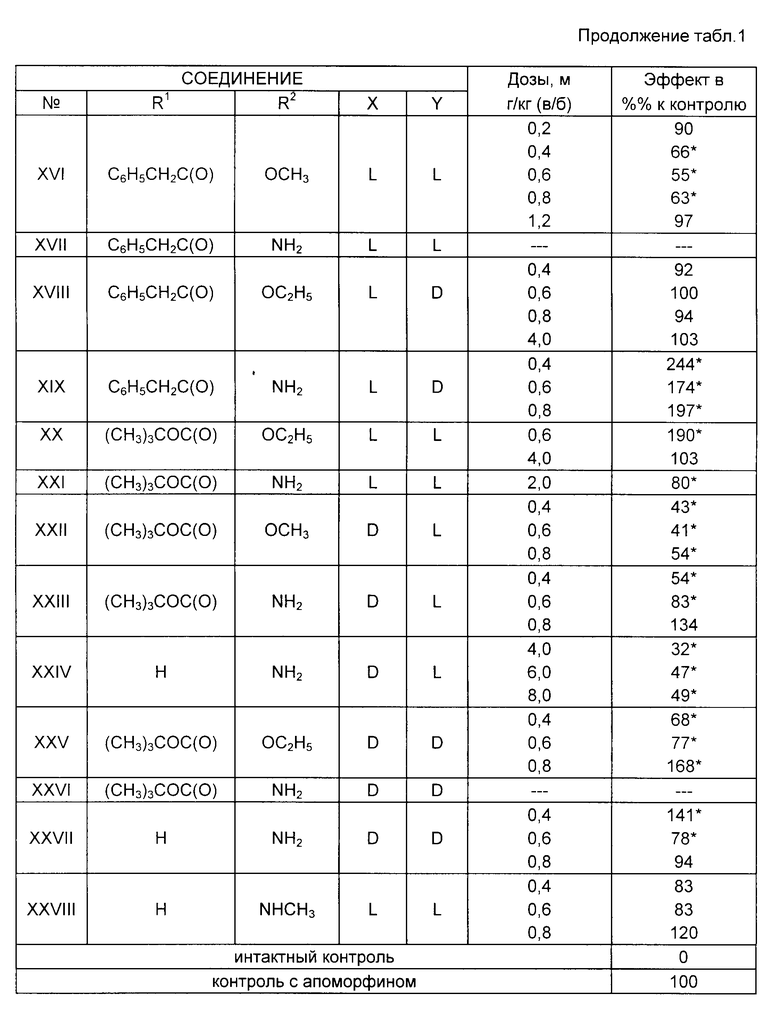
Пример 30. Влияние предлагаемых соединений на стереотипию, вызванную L-дофа у крыс.
Способность угнетать активность дофаминергической системы является одним из основных признаков веществ с нейрохимической активностью. В связи с этим было изучено влияние веществ на стереотипию, вызванную L-ДОФА [L-диоксифенилаланином]
Эксперименты проводили на белых беспородных крысах-самцах массой 220-250 г. L-ДОФА в дозе 100 мг/кг в комбинации с ингибитором периферической декарбоксилазы ароматических аминокислот бензеразидом [25 мг/кг] вводили внутрибрюшинно. Интенсивность стереотипии определяли через 1 ч после введения L-ДОФА и оценивали в баллах (максимальное число баллов равно 5) по методу BLUMSTEIN L.K. et fl. Neuropeptid modulation of apomorphine induced stereotyped behavior behavior 1987, 104, 293-300] Учитывая такие формы стереотипного поведения как принюхивание, укусы, горизонтальные покачивания головы, стойки, прыжки. Изучаемые вещества вводили внутрибрюшинно в виде суспензии с Твином-80, одновременно с введением L-ДОФА ибензеразида. Число животных в каждой из групп составляло от 10 до 15. Статистическую обработку данных проводили по методу Вилкоксона-Манна-Уитни [критерий U]
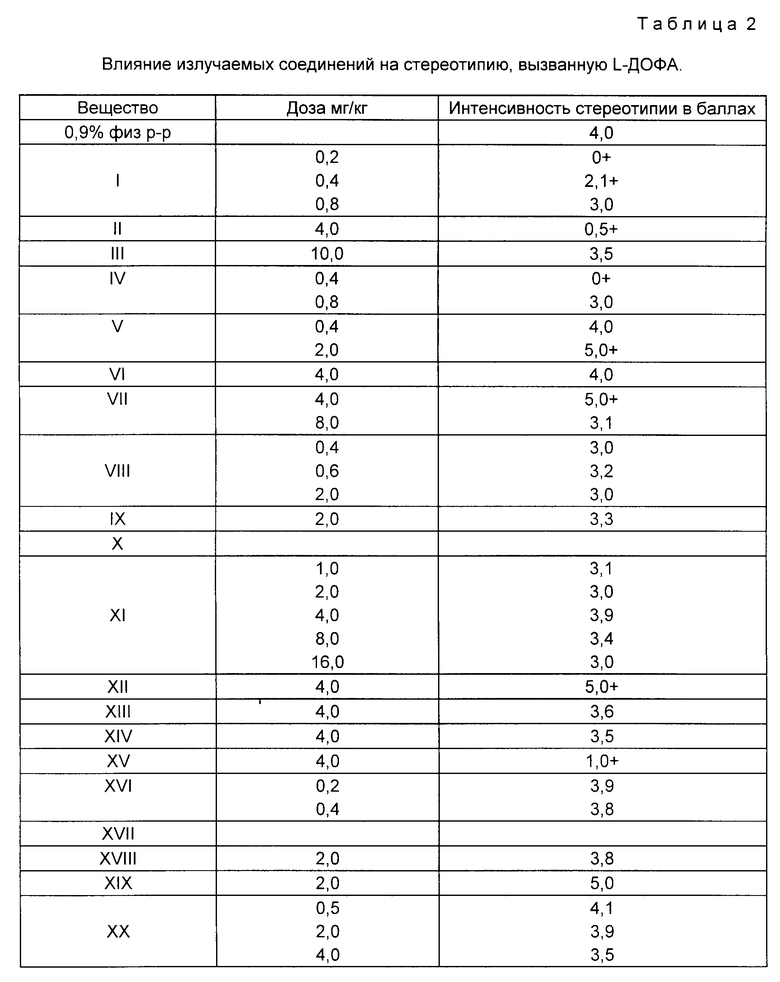
Установлено (табл. 2), что соединения I, II, IV, XI, XV, XXII, XXIII обладали способностью в той или иной степени ослаблять вызванную L-ДОФА стереотипию. Известно, что подобным эффектом обладают как типичные, так а атипичные нейролептики. Полученные данные свидетельствуют в пользу наличия у новых соединений признаков нейролертической активности. Соединения V, VII, XIII, XIX усиливали эффекты L-ДОФА, что предполагает наличие у них возможного антидепрессантного эффекта.
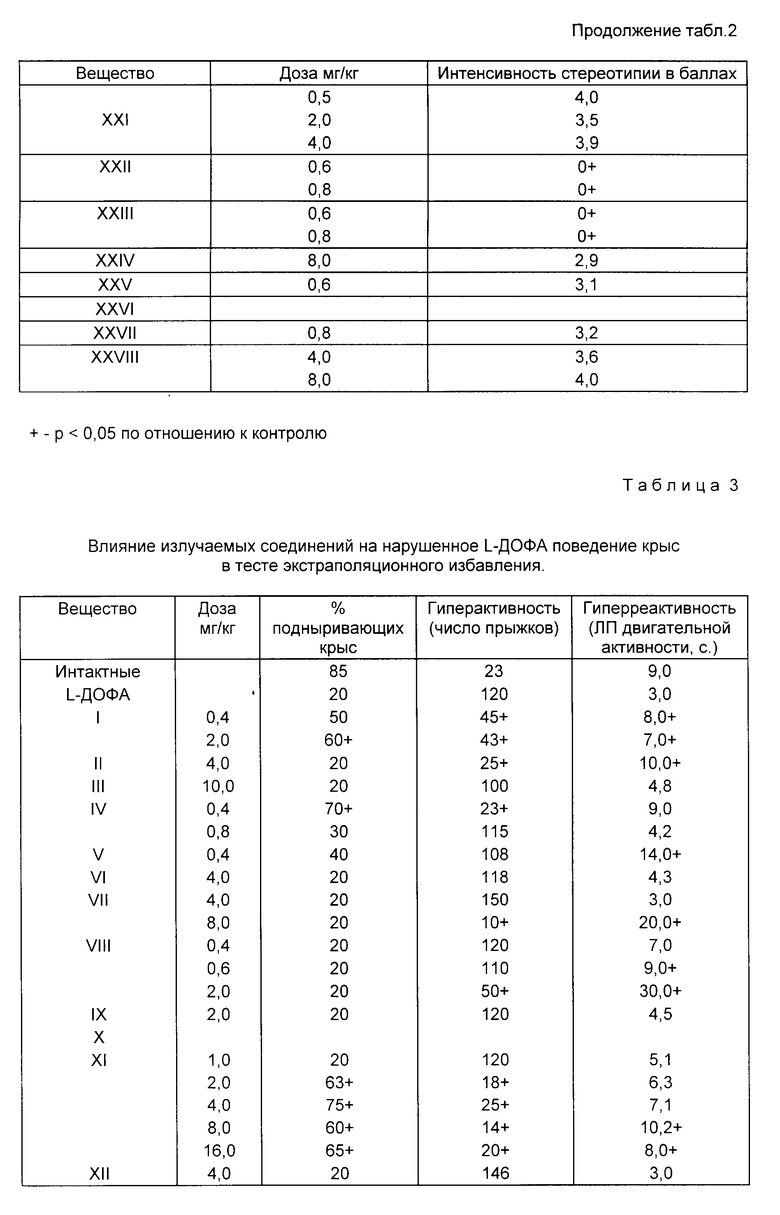
Пример 31. Влияние заявляемых соединений на вызванное L-ДОФА нарушение поведения в тесте экстраполяционного избавления у крыс.
Исследования проводили на белых беспородных крысах-самцах по методике (Бондаренко Н. А. Избирательное влияние нейролептиков на дофаминзависимое нарушение поведения крыс в тесте экстраполяционного избавления. Бюлл. эксп. биол. мед. 1990, 11, 506 509). Тест экстраполяционного избавления (ТЭИ) основан на способности животных находить выход из острой стресс-ситуации. При помещении крысы внутрь цилиндра без дна, нижним концом опущенного в емкость с водой, животное может избавиться из острой стресс-ситуации лишь путем подныривания под край цилиндра. В данном тесте регистрируется латентный период принятия животным правильного решения [подныривания] а также оценивается интенсивность моторной активности в форме прыжков [безуспешные попытки избегания] и реактивность на острое стресс-воздействие, которое определяется по латентному времени начала любой моторной реакции. В контрольной (интактной) группе животных способность к нахождению правильного выхода из острой стресс-ситуации обладает 85% крыс, L-ДОФА (100 мг/кг) вводили в комбинации с ингибитором периферической декарбоксилазы ароматических аминокислот бензеразидом (25 мг/кг), усиливающим центральные эффекты L-ДОФА, внутрибрюшинно за 1 час до эксперимента. L-ДОФА практически полностью [у 80% животных] нарушает способность к подныриванию, вызывает гиперреактивность (снижение латентного периода моторных реакций), а также гиперактивность (значительное увеличение числа безуспешных попыток избегания в форме прыжков).
Ранее было показано, что нейтролептики различных химических групп, как типичные, так и атипичные, препятствуют проявлению эффекта L-ДОФА, восстанавливая в первую очередь способность крыс к подныриванию. По чувствительности и избирательности к нейролептикам тест ТЭИ с L-ДОФА не уступает тесту апоморфиновой вертикализации (Бондаренко Н. А. Избирательное влияние нейролептиков на дофаминзависимое нарушение поведения крыс в тесте экстраполяционного избавления. Бюл. экс. биол. мед. 1990, 11, 506 509). Предлагаемые вещества вводили внутрибрюшинно в виде суспензии с Твин-80 1 ч до эксперимента. Число животных в опытной [вещество + L-ДОФА] и контрольной [NaCl+L-ДОФА] группах составляло 10 15. Результаты обрабатывали статистически по методу Фишера и Вилкоксона-Манна-Уитни.
Исследования показали (табл. 3), что соединения I, IV, XI, XIII, XVI, XXI, XXIV антагонизировали действие L-ДОФА по всем показателям, в том числе и по основному показателю [способности к подныриванию]
Соединения I, II, IV, VII, VIII, XI, XIII, XIV-XVIXXI, XXII, XXIV, XXV достоверно снижали гиперактивность, вызванную L-ДОФА, и увеличивали латентный период двигательных реакций.
Таким образом, заявляемые соединения антагонизируют все эффекты L-ДОФА в тесте ТЭИ подобно известным нейролептикам. Эти данные свидетельствуют о том, что предлагаемые соединения обладают выраженным антидофаминергическим действием.
Пример 32. Изучение способности заявляемых соединений вызывать каталепсию у крыс.
Изучаемые вещества вводили внутрибрюшинно в виде суспензии с ТВИН-80. Интенсивность каталепсии оценивали в баллах через 30-минутные интервалы на протяжении 2 ч после введения веществ. Животные контрольной группы вводили 0,9% NaCl с Твин-80. В качестве теста на каталепсию использовали установку Morpurgo. Полученные данные суммировали по 4 наблюдениям и сравнивали с контролем. Число особей в контрольной и опытной группах составляло 10 12.
Результаты обрабатывали статистически с применением критерия U. Как следует из данных представленных в табл. 4, вещества I, XI, XIX, XXII, XXIII в дозах 20 и 500 мг/кг не проявили способности вызывать каталепсию.
Пример 33. Изучение острой токсичности заявляемых соединений у мышей.
Острую токсичность изучали при постоянной (+20oС) температуре окружающей среды у индивидуально содержащихся белых беспородных мышей-самцов. Регистрацию гибели животных проводили через 24 ч после внутрибрюшинного введения соединений.
Соединения XI, XVII, XIX, XXI, XXII, XXIII (табл. 4) не оказывали токсического действия в дозах до 500 мг/кг. У экспериментальных животных не проявлялись такие симптомы как миорелаксация, седация, саливация, тремор, судорожная активность, гипотермия, гипертермия и не отмечалось гибели.
Пример 34. Изучение нейролептической активности по дополнитель ным тестам. соединения XI представлялось необходимым оценить его эффективность по отношению к действию серотониномиметиков. Опыты проводили на белых беспородных мышах-самцах. Изучаемые вещества вводили внутрибрюшинно за 30мин. перед внутрибрюшиным введением серотониномиметика N,N диметил-5- метокситриптамина, вводимого в дозе 16 мг/кг. Количество специфических встряхиваний головы подсчитывали за период с 3 по 7 мин после введения серотониномиметика. Результаты экспериментов обрабатывали статистически с применением критерии U.
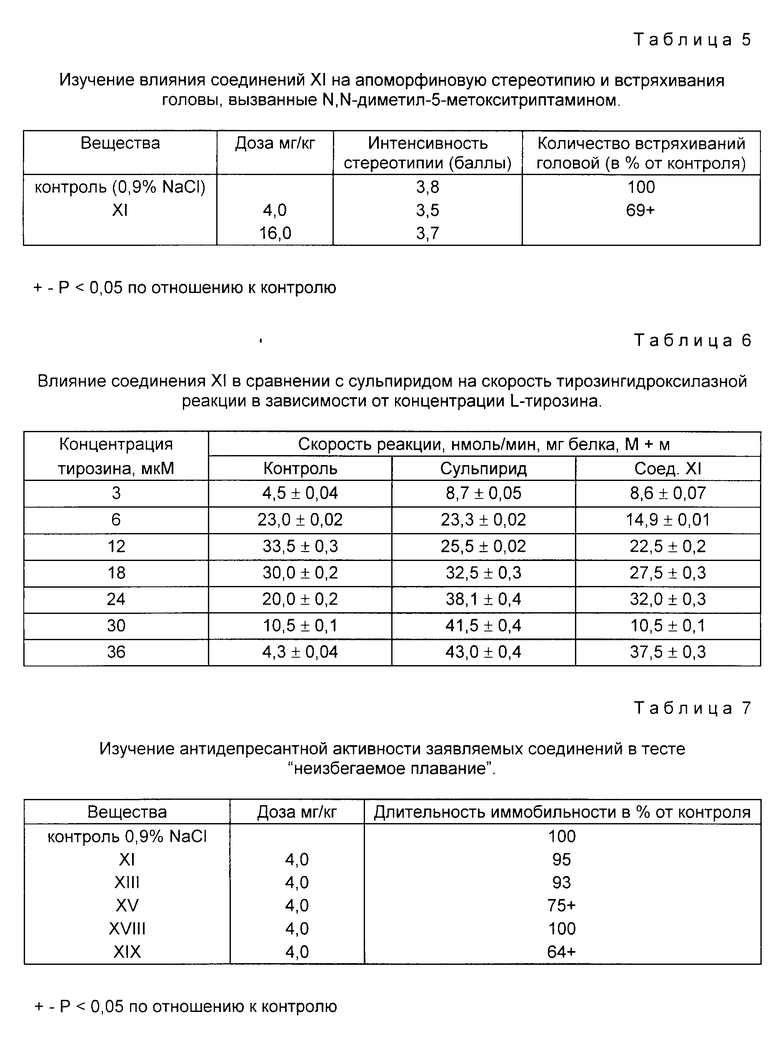
Обнаружено, что предлагаемое вещество XI в дозе 4 мг/кг снижало интенсивность встряхиваний головы (симптом возбуждения подтипа 2 центральных серотониновых рецепторов) на 31% (табл. 5).
Полученные данные демонстрируют наличие антисеротониновых свойств у данного соединения в дозах, специфичных для проявления нейтролептической активности. В связи с тем, что антагонизм с эффектами серотонина и его агонистов свойственен нейролептикам, наиболее безопасным в отношении экстрапирамидных расстройств, можно предполагать, что и заявляемое соединение XI в терапевтических дозах является безопасным в этом отношении.
б) Изучение влияния соединения XI на длительность гексеналового сна у мышей
Для изучения данного показателя изучаемое соединение вводили внутрибрюшинно за 30 мин до гексенала (вводимого также внутрибрюшинно в дозе 30 мг/кг). Далее определяли процент уснувших животных и длительность сохранения бокового положения [в минутах]
Соединение XI в дозе 4 мг/кг удлиняло продолжительность гексеналового сна на 38% по сравнению с контролем. Полученные данные указывают на потенцирование этим соединением наркотического действия барбитуратов, что свойственно многим нейролептикам.
в) Изучение влияния соединения XI на активность тирозингидроксилазы гипоталамуса крыс
Было изучено влияние соединения XI на кинетические параметры тирозингидроксилазной реакции in vitro с использованием спектрофотометрического метода измерения скорости тирозингидроксилазной реакции (Раевский К.С. и др. Экспериментальное доклиническое изучение специфической активности новых соединений, предлагаемых для клинических испытаний в качестве нейролептиков (антипсихотических средств). Методические рекомендации. Тарту, 1988).
Состав пробы: буфер-0,05 M трис-малеат pH 6,2; высокоочищенная тирозингидроксилаза из гипоталамуса мозга крысы 1 мкг/мл; L тирозин, 3-36 мкМ; 6,7- диметил 5, 6, 7, 8-тетрагидроптерин, 147 мкМ. Испытуемое вещество добавляли в пробу после регистрации начальной скорости реакции в течение двух минут, в конечной концентрации 10 М. Измеряли прирост поглощения при 335 нм. Ранее было показано, что способность устранять торможение тирозингидроксилазной реакции избытком субстрата [тирозина] характерна для веществ, содержащих структуру нейролептического фармакофора (Минеева М. Ф. Роль тирозингидроксилазы в механизме действия нейролептиков. Дисс. на соиск. докт. биол. наук).
Как следует из полученных данных, (табл. 6), соединение XI подобно сульпириду элиминирует субстратное торможение тирозингидроксилазы, не уменьшая при этом максимальной скорости реакции и увеличивая Км для тирозина, что свидетельствует о наличии у него свойств атипичного нейролептика.
Пример 35. Изучение антидепрессантной активности предлагаемых соединений в тесте неизбегаемое плавание- у мышей.
Изучаемые вещества вводили внутрибрюшинно за 30 мин. до тестирования. В опытную и контрольную группы входило от 10 до 15 животных. Пятиминутное неизбегаемое плавание проводили в соответствии с описанной ранее методикой (M. De Pablo/ A.Parra, S. Segovia, A. Guillamon. Learned immobility explains the behavior of rats in the forced swimming test. Physijl. and Behavior. 1989, 46, 229 237) в стеклянном сосуде, высотой 20 см, диаметром 10 см, наполовину заполненном водой с температурой 20oC. Определяли длительность аммобильности (в секундах) за период наблюдения 5 мин. Результаты обрабатывать статистически с применением критерия U.
Данные исследований приведены в табл. 7. Из нее следует, что среди предлагаемых соединений только соединения XV и XIX вызывали достоверное снижение длительности иммобильности у мышей. Это позволяет предположить, что указанные соединения обладают антидепрессантной активностью, притом у соединения XIX этот эффект более выражен.
Пример 36. Изучение антидепрессантной активности соединения XIX.
Известно, что многие антидепрессанты, в том числе имипрамин, усиливают локомоторную гиперактивность у крыс, получивших L-ДОФА, снижают интенсивность каталепсии, вызванной нейролептиками, а также ослабляют симптом востряхивания головы, наблюдаемый у животных при действии высоких доз агонистов серотониновых рецепторов. В связи с этим соединение XIX, проявившее наибольшую активность в тесте -неизбегаемое плавание-, было изучено нами в соответствующих тестах.
а) Влияние соединения XIX на локомоторную гиперактивность, вызванную L-ДОФА у крыс
Изучаемые вещества и L-ДОФА (100 мг/кг + ингибитор периферической декарбоксилазы ароматических аминокислот бензеразид в дозе 25 мг/кг) вводили внутрибрюшинно, одновременно, за 60 минут до тестирования. Животных опытной (вещество + L-ДОФА) и контрольной (L-ДОФА) групп в количестве 10 15 особей помещали индивидуально в автоматизированную экспериментальную установку -свободновращающийся барабан" непосредственно после введения веществ. Регистрацию двигательной активности осуществляли с 45 по 65 мин. Статическую обработку данных проводили с применением критерия U.
Как следует из данных, представленных в табл. 8, соединение XIX в дозе 2 мг/кг потенцировало локомоторную гиперактивность крыс, которым вводился L-ДОФА.
Влияние соединения XIX на каталепсию, вызванную галоперидолом у крыс.
Изучаемое вещество вводили одновременно с галоперидолом (1 мг/кг). Интенсивность каталипсии в опытной (вещество + галоперидол) и контрольной (NaCl 0,9% + галоперидол) группах оценивали по 4-бальной шкале. Соединение XIX в дозе 2 мг/кг ослабляло интенсивность каталепсии от галоперидола (табл. 8)/
в) Изучение влияния соединения XIX на встряхивания головы, вызванные серотониномиметиком
Как следует из данных, представленных в табл. 8, предлагаемое соединение XIX в дозе 2 мг/кг снижало интенсивность встряхиваний головы, вызванных введением серотининомиметика N,N- диметил-5 метокситриптамином до уровня 47% от контроля (табл. 8).
Таким образом, в экспериментах обнаружено, что заявляемое вещество XIX в дозе 2 мг/кг потенцирует локомоторную гиперактивность, вызванную L-ДОФА, ослабляет каталепсию, вызванную галоперидолом, а также снижает интенсивность серотониновой стереотипии. Эталонный антидепрессант имипрамин эффекты аналогичной направленности оказывает в дозе 100 мг/кг.
Полученные данные подтверждают, что соединение XIX обладает антидепрессантной активностью, причем проявляет ее в более низкой дозе, чем имипрамин. Глубина эффекта данного соединения не уступает таковой для имипрамина. Соединение XIX в связи с этим представляет интерес для дальнейшего изучения как потенциальный антидепрессант с активирующим компонентом действия.
Из числа веществ с потенциальной нейролиптической активностью наибольший интерес представляет соединение XI, которое судя по уровню пороговых доз превосходит по активности атипичный нейролептик сульпирид, а по отсутствию экстрапирамидных побочных эффектов, миорелаксирующего и седативного действия выгодно отличается от типичных нейролептиков.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ N-АЦИЛПРОЛИЛДИПЕПТИДОВ | 1993 |
|
RU2119496C1 |
| L-ПИРОГЛУТАМИЛ-L-АСПАРАГИН И ЕГО ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ РЕГУЛИРОВАТЬ ПРОЦЕССЫ ОБУЧЕНИЯ И ПАМЯТИ | 1988 |
|
RU1619684C |
| СПОСОБ ПОЛУЧЕНИЯ ИНДИВИДУАЛЬНЫХ СТЕРЕОИЗОМЕРОВ 4-ЗАМЕЩЕННЫХ ТИОПРОИЗВОДНЫХ ГЛУТАМИНОВОЙ КИСЛОТЫ | 1994 |
|
RU2083560C1 |
| ЗАМЕЩЕННЫЙ БИСДИПЕПТИД С НЕЙРОПРОТЕКТИВНЫМ И АНТИДЕПРЕССИВНЫМ ЭФФЕКТОМ | 2014 |
|
RU2559880C1 |
| Дипептидные лиганды TSPO, обладающие нейропсихотропной активностью | 2018 |
|
RU2756772C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2411248C2 |
| Малые молекулы с NGF-подобной активностью, обладающие антидиабетическими свойствами | 2013 |
|
RU2613314C2 |
| Новые глипролины с ноотропной, антигипоксической, нейропротективной и анксиолитической активностью | 2016 |
|
RU2646604C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАЦЕТАТА ТРИПЕПТИДА | 2014 |
|
RU2551276C1 |
| Лейцилтриптофановые лиганды TSPO, обладающие анксиолитической активностью | 2020 |
|
RU2757476C2 |

Предлагаются замещенные пролилтирозины общей формулы
R1-X-Pro-Y-Tyr-R2,
где R1 = H, (C4-C8)алкилкарбонил, трет.бутилоксикарбонил, бензоил, фенил(C1-C3)алкилкарбонил, бензилоксикарбонил, фенилокси(C1-C3)-алкилкарбонил;
R2 = O(C1-C3)алкил, NH2, NH(C1-C3)алкил;
X = L или D-конфигурация;
Y = L или D-конфигурация;
обладающие психотропной активностью, включающей нейролептическую и антидепрессантную в дозах 0,4 - 10 мг/кг. Дипептиды характеризуются отсутствием побочных экстрапирамидных эффектов и токсических проявлений в дозах, на 2 - 3 порядка превышающих пороговые дозы специфического эффекта, а также сохранением активности в условиях перорального введения. 10 з. п. ф-лы, 8 табл.
R1 X Pro Y Tyr R2,
где R1 H, С4 С8-алкилкарбонил, трет.бутилоксикарбонил, бензоил, фенил-С1 С3-алкилкарбонил, бензилоксикарбонил, фенилокси-С1 С3-алкилкарбонил;
R2 O- С1 С3-алкил, NH2, NH-C1 - C3-алкил;
X L- или D-конфигурация;
Y L- или D-конфигурация;
при этом если R1 H, X Y L-конфигурация, то R2 - NH-C1 C3-Alk, если R1 бензилоксикарбонил, X Y - L-конфигурация, то R2 NH2, если R1 - трет.бутилоксикарбонил, X Y L-конфигурация, то R2 NH2,
обладающие психотропной активностью.
| Гершкович А.А., Кибирев В.К | |||
| - Киев: Наукова Думка, 1992 | |||
| Бондаренко Н.А | |||
| Избирательное влияние нейролептиков на дофаминзависимое нарушение поведения крыс в тесте экстраполяционного избавления | |||
| Бюлл | |||
| эксп.биол.мед | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| Способ выделения сульфокислот из нефтяных масел | 1913 |
|
SU508A1 |
| Пептиды | |||
| Основные методы образования пептидных связей./ Под ред | |||
| Э.Гросса и И.Майнехофера | |||
| Пер | |||
| с англ | |||
| - М.: Мир, 1983 | |||
| Раевский К.С | |||
| с соавт | |||
| Экспериментальное доклиническое изучение специфической активности новых соединений, предлагаемых для клинических испытаний в качестве нейролпетиков (антипсихотических средств): Методические рекомендации | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| Раевский В.С | |||
| Антагонизм с фенамином как тест для экспериментальной оценки нейролептиков: Фармакология и токсикология | |||
| Приспособление для склейки фанер в стыках | 1924 |
|
SU1973A1 |
| Подъемник для выгрузки и нагрузки барж сплавными бревнами, дровами и т.п. | 1919 |
|
SU149A1 |
| Позднев В.Ф | |||
| Биоорганическая химия, 1977, 3, 1605 | |||
| Aubry A | |||
| et.al | |||
| G.Am.shem | |||
| Soc | |||
| Счетный сектор | 1919 |
|
SU107A1 |
| Breslow E | |||
| et.al | |||
| Biochemistry, 12 (23), 4644 - 4653 | |||
| Bizzozero S.A | |||
| et.al | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
| Davies j.s | |||
| et.al | |||
| J | |||
| Chem | |||
| Soc | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| De Pablo M.et.al | |||
| Learned immobilility exploins the behavior of rats in the forced swimmino test | |||
| Physiol | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Diue u.et.al | |||
| Eur.f | |||
| Biochem | |||
| Устройство непрерывного автоматического тормоза с сжатым воздухом | 1921 |
|
SU191A1 |
| Lambert P.et.al | |||
| Classification Psychopharmacoloque et | |||
| Пробочный кран | 1925 |
|
SU1960A1 |
| Nobutaka F.et.al | |||
| J.chem | |||
| Soc.Per | |||
| Trans | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Potais P.et.al | |||
| Climbing befavior induced by apomorphine in nuce-a simpl test for the study of defamine receptors in striatum | |||
| Планшайба для точной расточки лекал и выработок | 1922 |
|
SU1976A1 |
| Spartace A.et.al., Helv.chimica Acta 1982, 65 (6), 1707 - 1719 | |||
| Walter R.W., PCT Jut | |||
| Appl | |||
| Центрифуга непрерывного действия для разделения жидкостных смесей | 1926 |
|
SU8000A1 |
| Warme P.et.al | |||
| Pharmocol | |||
| Thesap | |||
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
| Joshimoto T.et.al | |||
| J.Biol.chem., 1978, 253(10), 3708 - 3716. | |||
Авторы
Даты
1997-09-27—Публикация
1995-02-28—Подача