Область изобретения
Изобретение относится к новому ряду биологически активных соединений - дипептидам общей формулы:
R1-C(O)-L-Leu-L-Trp-R2, (1)
где R1=С6Н5-СН2- или С6Н5-(СН2)2-;
R2=ОН, или ОСН3, или NH2, или NHCH3.
Новые соединения являются лигандами 18 кДа митохондриального транслокаторного протеина (TSPO) и обладают нейропсихотропными свойствами, в частности анксиолитической активностью.
Эпидемиологические данные свидетельствуют, что состояния тревоги, включающие генерализованные тревожные, фобические, панические и обсессивно-компульсивные расстройства, встречаются у 6-10% населения [Международная классификация болезней (10-й пересмотр). Класс V: Психические расстройства и расстройства поведения (F00-F99) (адаптирован для использования в Российской Федерации).- Ростов-на-Дону: Феникс, 1999.- С. 245-246.]. Тревожные состояния, коморбидные соматическим заболеваниям, отягощают последние, например, увеличивая летальность при сердечно-сосудистых заболеваниях вдвое. Существующие на данный момент лекарственные препараты для лечения тревожных расстройств не обладают достаточной эффективностью. Поэтому актуальной задачей является создание новых препаратов, обладающих широким спектром нейропсихотропной активности, в том числе анксиолитической. Эту задачу позволяет решить получение новых лигандов трансклокаторного белка TSPO, влияющих на регуляцию синтеза нейростероидов, модулирующих ГАМК-ергическую передачу и таким образом оказывающих быстрое анксиолитическое действие. Оригинальные лиганды TSPO предполагается создать на базе замещенных лейцилтриптофанов.
Уровень техники
TSPO, открытый в 1977 году [Braestrup С, Squires R.F.,Proc. Natl. Acad. Sci. USA. Sep 1977; 74(9): 3805-3809.] представляет собой трансмембранный полипептид, состоящий, в зависимости от вида, из 153-169 аминокислот, локализующийся преимущественно на внешней мембране митохондрий и отвечающий за перенос холестерина с внешней мембраны на внутреннюю. Этот процесс является лимитирующей стадией синтеза нейростероидов. Кроме того, TSPO задействован в транспорте порфиринов, митохондриальном дыхании, открытии митохондриальных пор, апоптозе и пролиферации клеток [Papadopolous V., Baraldi М., Guilarte T.R., Knudsen Т.В., Lacapere J.-J., Lindemann P. et al. Translocator protein (18kDa): new nomenclature for the peripheral-type benzodiazepine receptor based on its structure and molecular function. Trends Pharmacol. Sci.. 2006; 27, №8: 402-409]. Обнаруживается TSPO в основном в стероидгенерирующих клетках, но также присутствует и в других тканях и органах, таких как почки, легкие, сердце, а также в глиальных клетках головного мозга [Beurdeley-Thomas А., Miccoli L., Oudard S., Dutrillaux В., Poupon M.F., J. Neurooncol. 2000. V. 46. №1. P. 45-56.
Основными эндогенными лигандами TSPO являются холестерин, порфирины и нейропептиды семейства эндозепинов.
Холестерин является ключевым эндогенным лигандом TSPO, исходным веществом для биосинтеза нейростероидов. Холестерин обладает наномолярным сродством к TSPO (Kd<10 нМ) [Bordet Т, Buisson В, Michaud М, Drouot С, Galea Р, Delaage Р, et al. Identification and characterization of cholest-4-en-3-one, oxime (TR019622), a novel drug candidate for amyotrophic lateral sclerosis. J. Pharmacol. Exp.Ther 2007; 322(2): 709-20]. Связываясь с TSPO, холестерин переносится с внешней мембраны митохондрий на внутреннюю, где под действием ферментов цитохрома P450scc, 3-β гидроксистероиддегидрогеназы (3β-HSD), 5α-редуктазы, 3-αгидроксистероиддегидрогеназы (3α-HSD) происходит образование нейростероидов, которые модулируют функцию ГАМКА рецепторов.
Из порфиринов наибольшей аффинностью к TSPO обладают протопорфирин IX (Ki 14.5±10.7 нМ), дейтеропорфирин IX (Ki 31.3±2 нМ) и гем (Ki 40.6±13.7 нМ) [Verma A., Nye J.S., Snyder S.H. Porphyrins are endogenous ligands for the mitochondrial (peripheral-type) benzodiazepine receptor. PNAS 1987; 84(8): 2256-2260].
К пептидным эндогенным лигандам TSPO относится ингибитор связывания диазепама (DBI), который представляет собой 9 кДа полипептид. Он был открыт в 1983 году в мозге крысы при изучении белков, ингибирующих связывание бензодиазепиновых транквилизаторов с ГАМКА-рецептором. Также было показано, что основные посттрансляционные продукты DBI - октадеканейропептид DBI33-50 (octadecaneuropeptide, ODN) и триаконтатетронейропептид DBI17-50 (triakontatetraneuropeptide, TTN), также обладают сродством к TSPO [Ferrero P., Santi M.R., Conti-Tronconi В., Costa E., Guidotti A. Study of an octadecaneuropeptide derived from diazepam binding inhibitor (DBI): biological activity and presence in rat brain. PNAS 1986; 83: 827-831].
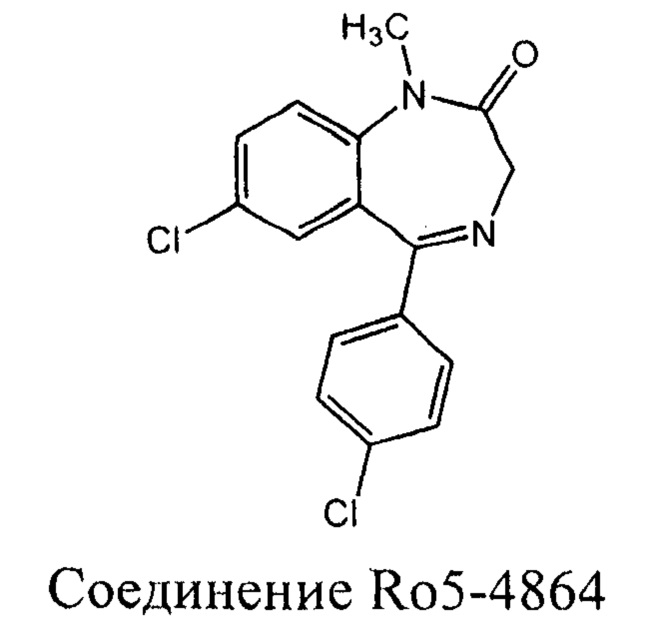
Первыми синтетическими лигандами TSPO считаются производные бензодиазепинов, в частности диазепама, однако сам диазепам связывается как с TSPO (IC50 40 нМ), так и с центральным бензодиазепиновым рецептором (IC50 3 нМ,) [Braestrup С, Squires R. F. Specific benzodiazepine receptors in rat brain characterized by high-affinity (3H) diazepam binding. PNAS 1977; 74: 3805-3809]. Классическим представителем этой группы является 4-хлордиазепам (соединение Ro5-4864), широко используемый для изучения биологических функций tspo [Gavioli в, е., Duaite Y. S., Bressan Е., Ferrara P., Farges, R. C, Monteiro De Lima Т. C. Antidepressant-like effect of Ro5-4864, a peripheral-type benzodiazepine receptor ligand, in forced swimming test. Eur. J. Pharmacol. 2003; 471: 21-26, Barron A. M., Garcia-Segura L. M., Caruso D., Jayaraman A., Lee J.-W., Melcangi R.C. et al. Ligand for translocator protein reverses pathology in a mouse model of Alzheimer's disease. The Journal of Neurosci. 2013; 33(20): P 8891-8897, Mills C, Makwana ML, Wallace A., Benn S., Schmidt H., Tegeder I. et al. Ro5-4864 promotes neonatal motor neuron survival and nerve regeneration in adult rats. Eur. J. Neurosci. 2008; 27: P.937-946, Leonelli E., Yague J.G., Ballabio M., Azcoitia I., Magnaghi V., Schumacher M. et al. Ro5-4864, a synthetic ligand of peripheral benzodiazepine receptor, reduces aging-associated myelin degeneration in the sciatic nerve of male rats. Mechanisms of Ageing and Development 2005; 126: 1159-1163,46. Soustiel J. F., Zaaroor M., Vlodavsky E., Veenman L., Weizman L., Gavish M. Neuroprotective effect of Ro5-4864 following brain injury. Exp.Neurol. 2008; 214: 201-208, Veiga S., Azcoitia L, Garcia-Segura, L. M. Ro5-4864, a peripheral benzodiazepine receptor ligand, reduces reactive gliosis and protects hippocampal hilar neurons from kainic acid excitotoxicity. J. Neurosci. Res. 2005; 80:129-137]
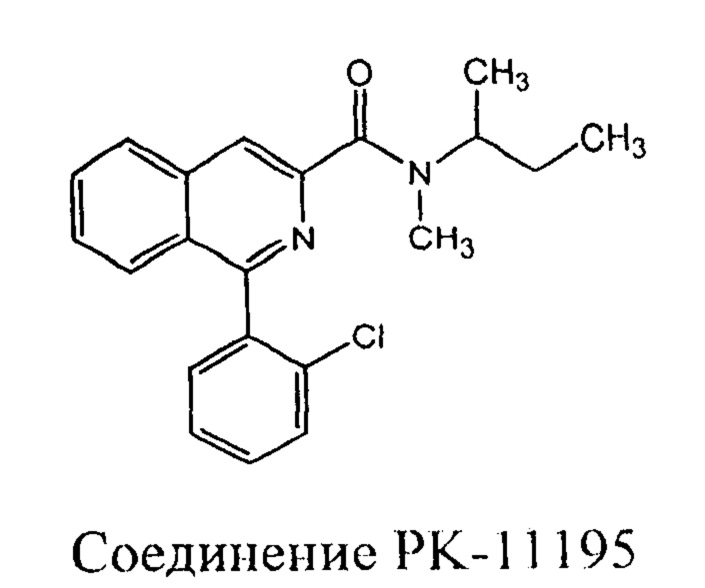
Производное изохинолина РК11195, открытое в 1983 году, явилось первым соединением, не относящимся к классу бензодиазепинов, способным связываться с TSPO с наномолярной аффинностью (Ki=9.3 нМ) [Le Fur G., Perrier ML., Vaucher К, Imbault F., Flamier A., Benavides J. et al. Peripheral benzodiazepine binding sites: effect of PK 11195, l-(2-chlorophenyl)-N-methyl-N-(l-methylpropyl)-3-isoquinolinecarboxamide. I. In vitro studies. Life Sci. 1983; 18; 32(16): 1839-47]. Исследование влияния РК-11195 на нейростероидогенез показало, что при одновременном введении РК-11195 и Ro5-4864 эффект от последнего снижался [Tiihonen J. et al. Cerebral benzodiazepine receptor binding and distribution in generalized anxiety disorder: a fractal analysis //Molecular psychiatry. - 1996. - T. 2. - №. 6. - C. 463-471]. Исходя из того, что Ro5-4864 является агонистом, был сделан вывод, что РК-11195 является антагонистом TSPO.
Группой ученых из компании Dainippon Sumitomo Pharma (Япония) была описана группа высокоаффинных и селективных лигандов TSPO, относящихся к классу бензоксазолоиов. Дизайн нового класса осуществлялся путем структурного преобразования бензодиазепинового лиганда Ro5-4864. При этом диазепиновый цикл был разомкнут, а иминный фрагмент был заменен на оксазолоновый гетероцикл. Заместители в образовавшемся остове были широко проварьированы [Fukaya Т., Kodo Т., Ishiyama Т., Kakuyama Н., Nishikawa Н., Baba S. et al. Design, synthesis and structure-activity relationships of novel benzoxazolone derivatives as 18 kDa translocator protein (TSPO) ligands. Bioorg. & Med. Chem. 2012; 20: 5568-5582].
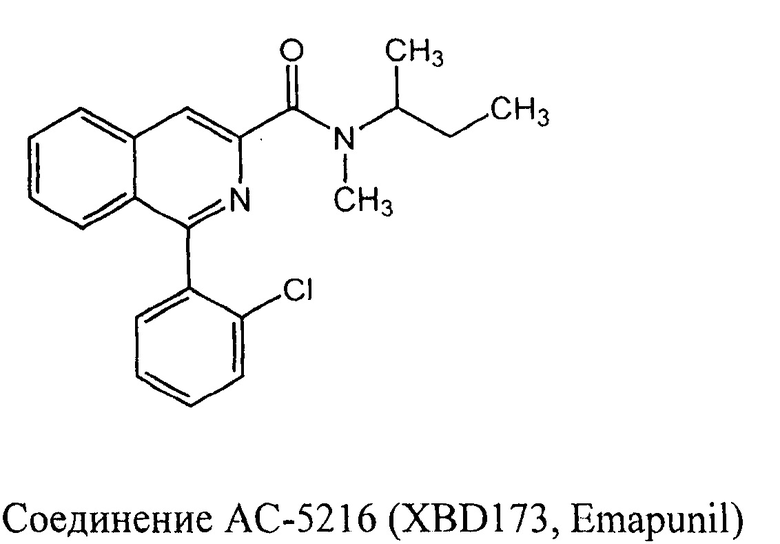
Также в компании Dainippon Sumitomo Pharma (Япония) совместно с компанией Novartis Pharmaceuticals (Швейцария) был создан лиганд TSPO, соединение АС-5216 (XBD173, Emapunil), производное оксопурина, проявившее анксиолитический и антидепрессивный эффект в тестах Фогеля и в тесте темно-светлая камера [Kita, A.; Kohayakawa, Н.; Kinoshita, Т.; Ochi, Y.; Nakamichi, К.; Kurumiya, S.; Furukawa, К.; Oka, M. Antianxiety and antidepressant-like effects of AC-5216, a novel mitochondrial benzodiazepine receptor ligand. Br. J. Pharmacol 2004, 142, 1059-1072]. Соединение AC-5216 доведено компанией Novartis до II фазы клинических исследований в качестве средства для лечения генерализованных тревожных расстройств (ClinicalTrials.gov identifier: NCT00108836). В этом исследовании АС-5216 не показал различий с плацебо в лечении тревожных расстройств. Отсутствие активности во II стадии, возможно, связано с выбором неподходящей модели.
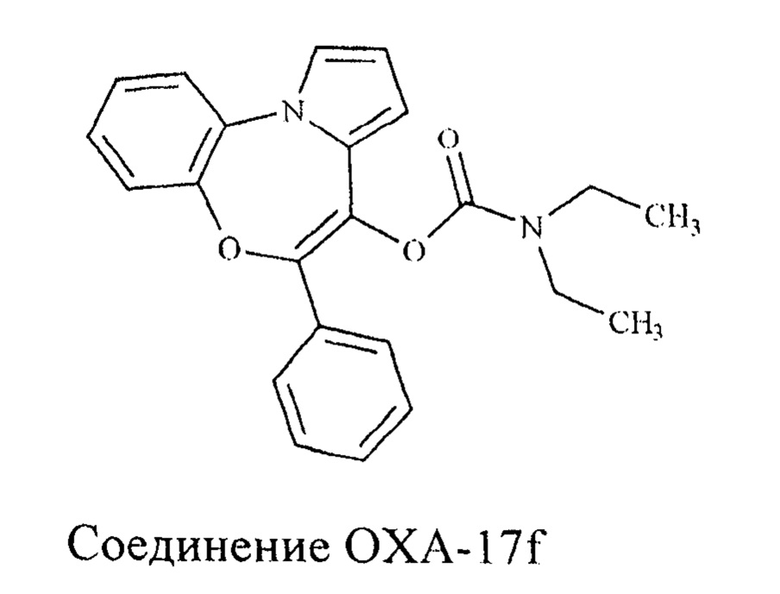
Авторами статьи [Campiani, G.; Nacci, V.; Fiorini, I.; De Filippis, M. P.; Garofalo, A.; Ciani, S. M; Greco, G.; Novellino, E.; Williams, D. C; Zisterer, D. M.; Woods, M. J.; Mihai, C; Manzoni, C; Mennini, T. J. Med. Chem., 1996, 39, 3435-3450] описаны бензоксазепиновые лиганды TSPO, способные конкурентно вытеснять РК-11195, среди которых соединение OXA-17f явилось самым селективным в отношении TSPO рецептора.
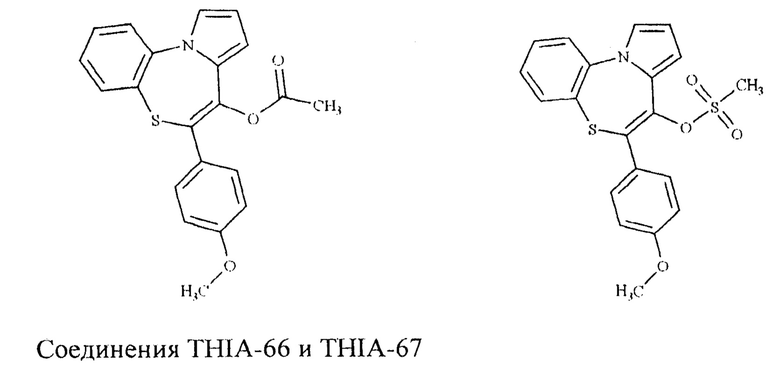
В 1990 году [Nacci, V.; Fiorini, I.; Garofalo, A.; Cagnotto, A. Farmaco, 1990, 45, 545-557.] был предложен новый класс лигандов TSPO -бензотиазепинов. Некоторые соединения этого ряда, такие как THIA-66 и THIA-67, имели высокое сродство и селективность по отношению к TSPO. [Fiorini I., Nacci V., Ciani S. M., Garofalo A., Campiani G., Savini L., Novellino E., Greco G., Bernasconi P., Mennini T.J. A comparative molecular field analysis model for 6-arylpyrrolo[2,l-d] [l,5]benzothiazepines binding selectively to the mitochondrial benzodiazepine receptor. // J Med Chem. -1994. -№37. -P. 4100-4108.
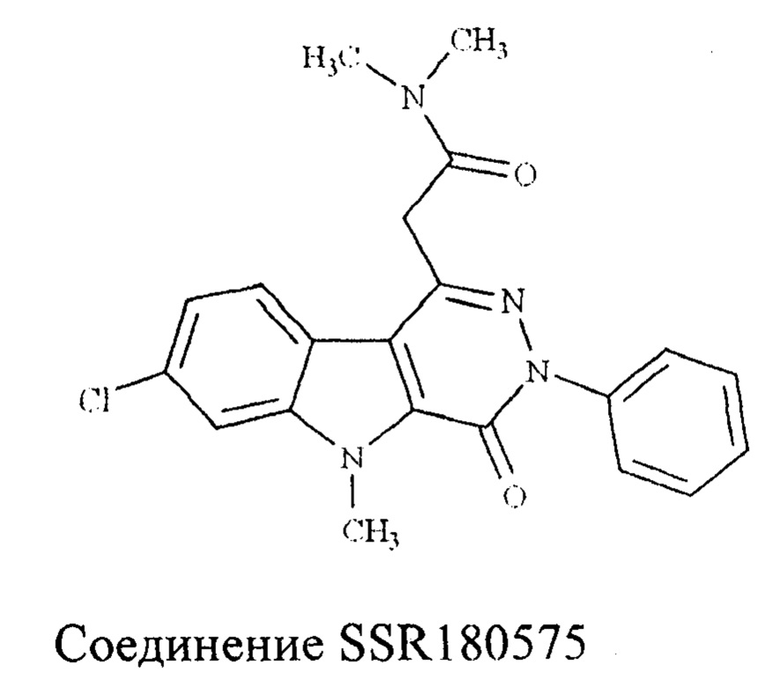
В статье [Romeo E., Auta J, Kozikowski AP, Ma D, Papadopoulos V, Puia G, Costa E, Guidotti A. 2-Aryl-3-indoleacetamides (FGIN-1): a new class of potent and specific ligands for the mitochondrial DBI receptor (MDR) J. Pharmacol. Exp.Ther., 1992, 262, 971-978] были описаны производные арилиндолацетамида, являющиеся агонистами TSPO. Арилиндолацетамид под шифром SSR180575 имел высокое сродство к TSPO (IC50 2,5 нМ) [Ferzaz В., Brault Е., Bourliaud G., Robert J.P., Poughon G, Claustre Y., Marguet F., Liere P., Schumacher M., Nowicki J.P., Fournier J., Marabout В., Sevrin M., George P., Soubrie P., Benavides J., Scatton B. SSR180575 (7-chloro-N,N,5-trimethyl-4-oxo-3-phenyl-3,5-dihydro-4H-pyridazino[4,5-b]indole-l-acetamide), a peripheral benzodiazepine receptor ligand, promotes neuronal survival and repair. J Pharmacol Exp Ther. 2002 Jun;301(3): 1067-78]. SSR180575 находится на второй стадии клинических испытаний, которые проводит фирма Sanofi-Aventis (Франция), (ClinicalTrials.gov identifier: NCT00502515), в качестве средства лечения диабетической нейроиатии.
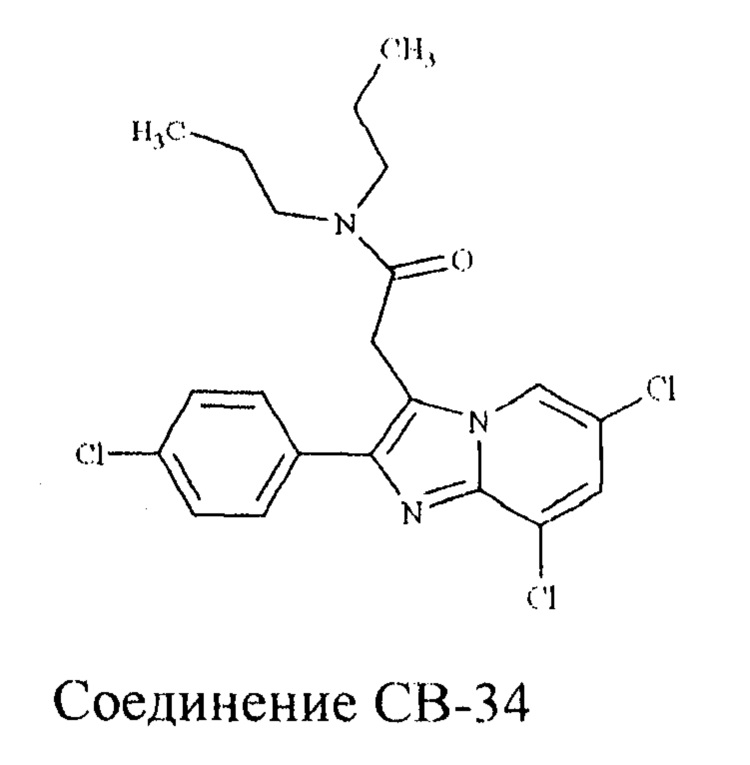
Фирмой Synthelabo (сейчас Sanofi-Aventis) в ходе широкого скрининга производных имидазо[1,2-а]пиридинов, в котором оценивались анксиолитические, гипнотические, снотворные и противосу дорожные свойства этих веществ на животных моделях на грызунах [Kaplan J-P., George P. US Patent 4382938 A, 1983] было отобрано соединение, получившее название Алпидем. Позже было установлено, что Алпидем обладает аффинными свойствами к TSPO [Langer S.Z., Arbilla S., Benavides J., Scatton B. Zolpidem and alpidem: two imidazopyridines with selectivity for omega 1- and omega 3-receptor subtypes. Adv. Biochem. Psychopharmacol.1990; 46: 61-72]. В 1997 авторы статьи [Trapani, G.; Franco, M.; Ricciardi, L.; Latrofa, A.; Genchi, G.; Sanna, E.; Tuveri, P.; Cagetti, E.; Biggio, G.; Liso, G. J. Med.Chem., 1997, 40, 3109-18] на основе производных имидазопиридина разработали соединение СВ-34, которое обладало высоким сродством, избирательностью к TSPO и способностью стимулировать стероидогенез в периферических тканях.
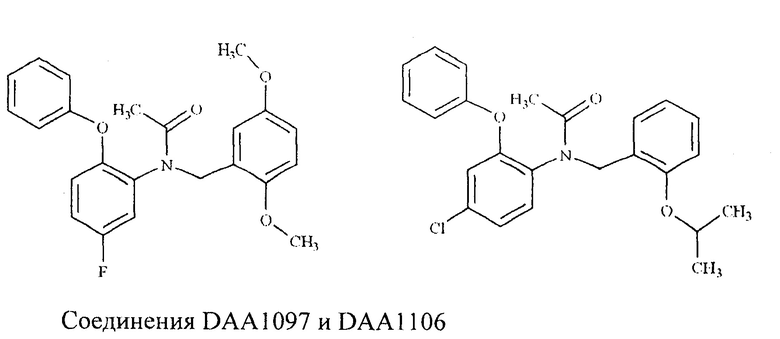
Авторами статьи [Chaki S., Funakoshi Т., Yoshikawa R., Okuyama S., Okubo Т., Nakazato A., Nagamine M., Tomisawa K. Neuropharmacological profile of peripheral benzodiazepine receptor agonists, DAA1097 and DAA1106. // Eur. J. Pharmacol. -1999. -№371. -P. 197-204] рассмотрены производные феноксифенилацетамида, N - (4-хлор-2- феноксифенил) - N - (2-
изопропоксибензил) - ацетамид, DAA1097 и N- (2,5-диметоксибензил)-N-(5-фтор-2-феноксифенил) ацетамид, DAA1106 как лиганды TSPO. Эти соединения проявили мощное анксиолитическое действие в экспериментах in vivo.
В патенте РФ 2572076 авторы раскрыли ряд производных пирроло[1,2-a]пиразина, лигандов TSPO, среди которых соединения ГМЛ-1 и ГМЛ-3 обладали анксиолитической и антидепрессивной активностью in vivo.
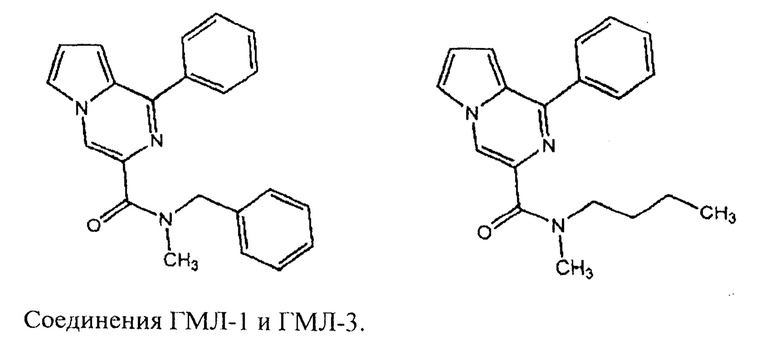
Авторы патента РФ 2573823 раскрыли дипептидные лиганды TSPO общей формулы R1-C(O)-X-Trp-Y-Ile-R2 обладающие анксиолитическими свойствами, где L или D конфигурация, Y=L конфигурация, R1=C6H5-СН2-O- или С6Н5-(СН2)5- или С6Н5-СН2-, R2=ОН или ОСН3 или NH2 или NHCH3. Однако, строение перечисленных в настоящем описании соединений не предполагает их новых структурных вариаций
Сущность изобретения
Нашей целью явилось получение дипептидных лигандов TSPO, обладающих нейропсихотропной активностью, в частности анксиолитической. Мы нашли, что эта цель может быть достигнута с помощью соединений общей формулы:
R1-C(O)-L-Leu-L-Trp-R2,
где R1=С6Н5-СН2- или С6Н5-(СН2)2-; R2=ОН, или ОСН3, или NH2, или NHCH3.
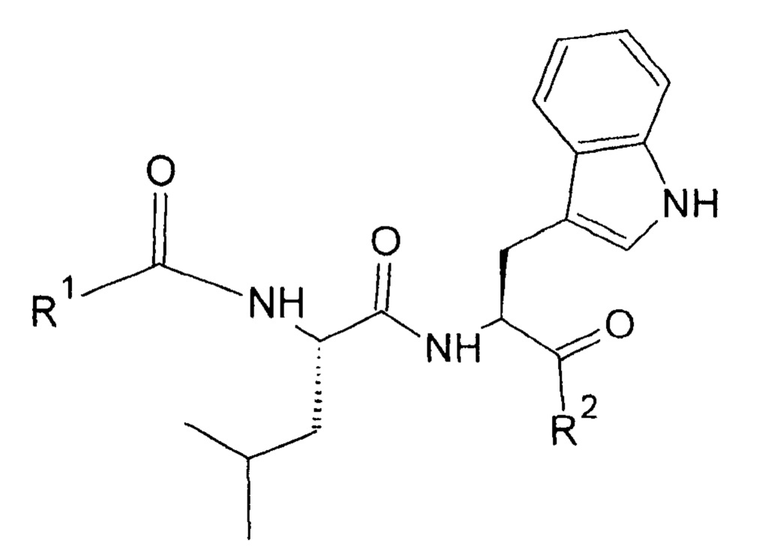
Примерами осуществления изобретения могут служить следующие соединения:
I амид N-фенилпропионил-L-лейцил-L-триптофана
II амид N-фенилацетил-L-лейцил-L-триптофана
III метиловый эфир L-лейцил-L-триптофана
IV N-фенилпропионил-L-лейцил-L-триптофана
V метиламид N-фенилпропионил-L-лейцил-L-триптофана
Представляемые в изобретении соединения дополнительно иллюстрирует табл. 1.

Приведенные в табл. 1 соединения были получены хорошо известными способами синтеза пептидов. Обычный процесс получения рассматриваемых соединений состоит в смешивании и конденсации требуемых аминокислот, как правило, в гомогенной фазе.
Конденсация в гомогенной фазе может быть выполнена следующим образом:
а) конденсация аминокислоты, имеющей свободную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, которая имеет свободную аминогруппу и защищенные другие реакционоспособные группы, в присутствии конденсирующего агента такого как карбодиимид;
б) конденсация аминокислоты, имеющей активированную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, которая имеет свободную аминогруппу и защищенные другие реакционноспособные группы;
в) конденсация аминокислоты, имеющей свободную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, имеющей активированную аминогруппу и защищенные другие реакционноспсобные группы.
Карбоксильная группа может быть активирована превращением ее в хлорангидридную, азидную, ангидридную группы или активированный эфир, такой как N-оксисукцинимидный, N-оксибензотриазольный, пентахлофениловый или паранитрофениловый эфиры.
Наиболее общими для рассмотренных выше реакций конденсации являются: карбодиимидный метод; азидный метод; метод смешанных ангидридов; метод активированных эфиров. Эти методы описаны в "The Peptides". Vol. 1. 1965 (Academic Press), E. Schroeder, K. Lubke, или в "The Peptides", Vol. 1, 1979 (Academic Press) E. Cross, L.Meinhofen.
Предпочтительными методами конденсации при получении пептидов формулы (1) является метод активации карбоксильной группы, который проводят преимущественно с применением сукцинимидных эфиров защищенных по аминогруппе аминокислот.Лучшими растворителями являются смесь этилацетата с дихлорметаном, чистый этилацетат и тетрагидрофуран.
Реакционноспособные группы, которые не должны участвовать в конденсации, могут быть защищены группами, которые легко удаляются, например, гидролизом или восстановлением. Так, карбоксильная группа может быть защищена этерификацией метанолом, этанолом, трет-бутанолом, бензиловым спиртом.
Аминогруппу обычно эффективно защищают кислотными группами, например остатками алифатических, ароматических, гетероциклических карбоновых кислот, такими как ацетил, бензоил, пиридинкарбоксил, кислотными группами, производными угольной кислоты, такими как этоксикарбонил, бензилоксикарбонил, трет-бутилоксикарбонил; или кислотными группами, производными сульфокислоты, такой как пара-толуолсульфониловая.
Защитные группы удаляют в соответствии с природой этих групп.Карбобензокси-группу удалялют каталитическим гидрогенолизом в токе водорода в метаноле с добавкой 10%-ного палладия на угле; трет-бутилоксикарбонильную группу удалялют в присутствии безводной трифторуксусной кислоты в дихлорметане.
При синтезе заявляемых соединений N-ацильные производные получали, используя активированные сукцинимидные эфиры фенилуксусной и фенилпропионовой кислот.
Амиды дипептидов по формуле (1) получают введением амидной группы в соответствующий дипептид обработкой активированного дипептида аммиаком. Алкиламиды пептидов получают аминолизом алкилэфира соответствующего дипептида или реакцией с аминокислотой в виде желаемого алкиламида. Эфиры пептидов согласно формуле (1) получают предпочтительно путем использования аминокислоты в форме желаемого эфира. Они могут быть получены также соответствующей этерификацией полученного пептида. Предпочтительны метиловые и этиловые эфиры. Соединения с открытой карбоксильной группой получают щелочным гидролизом соответствующего эфира дипептида.
Примеры осуществления изобретения
В дальнейшем используются следующие сокращения:
Вос - трет-бутилоксикарбонил
DCC - дициклогексилкарбодиимид
DIPEA - диизопропилэтиламин
DMAPA - диметилпропилендиамин
DMSO - диметилсульфоксид
Leu - лейцил
Me - метил
OSu - оксисукцинил
Ph - фенил
TFA - трифторуксусная кислота
Trp - триптофанил
Pd/C - катализатор: наночастицы палладия на поверхности активированного угля
Z - бензилоксикарбонил
ДМФА - диметилформамид
ДЦГМ - дициклогекилмочевина
ТГФ - тетрагидрофуран
ТСХ - тонкослойная хроматография
ЭА - этилацетат
ЯМР - ядерный магнитный резонанс
Исходные вещества и вспомогательные реагенты
Аминокислоты: L-лейцин (Alfa Aesar, США), Z-L-триптофан(GL-Biochem, Шанхай), гидрохлорид метилового эфира L-триптофана (Reanal, Венгрия).
Реагенты: N-гидроксисукцинимид (Sigma-Aldrich, Германия), дициклогексилкарбодиимид (Sigma-Aldrich, Германия), дитретбутилпирокарбонат (ООО «Кемикал лайн», Россия), трифторуксусная кислота (Химмед, Россия), катализатор Pd/C (Acros-organics, Германия), фенилпроиионовая кислота (Alfa Aesar, США), фенилуксусная кислота (Alfa Aesar, США), водный аммиак (ООО «Химмед», Россия).
Растворители: Этилацетат, диметилформамид, тетрагидрофуран, диэтиловый эфир, дихлорметан, хлороформ, гексан, метанол были получены от ООО ТД «Химмед» (Россия). ДМФА очищали двойной перегонкой в вакууме. Первая перегонка - над гидридом кальция, вторая перегонка - над нингидрином. Тетрагидрофуран выдерживали сутки над KOH, затем перегоняли при атмосферном давлении. Диэтиловый эфир выдерживали над CaCl2, затем фильтровали через бумажный фильтр. Дихлорметан и хлороформ Пропускали через колонку с Al2O3. Этилацетат и спирты использовали без дополнительной очистки.
Для определения физико-химических характеристик полученных веществ была использована следующая аппаратура:
- точки плавления определяли на приборе Optimelt МРА100 (Stanford Research Systems, Великобритания) в открытых капиллярах без корректировки;
- удельное вращение плоскости поляризации света измеряли на автоматическом поляриметре ADP 440 Polarimeter (Bellingham+Stanley Ltd., Великобритания) при длине волны линии D спектра натрия (589,3 нм) и длине кюветы 1 дм.
Величины удельных оптических вращений рассчитывали по формуле:
[α]D=(α×V)/(l×a), где
α - наблюдаемое оптическое вращение в градусах; V - объем раствора в мл; 1 - толщина слоя в дм; а - навеска вещества в г;
- 1H-ЯМР-спектры регистрировали в шкале δ, м.д., на спектрометре
Fourier-300 (Bruker, Германия) в растворах DMSO-d6, используя в качестве внутреннего стандарта тетраметилсилан. Для обозначения резонансных сигналов использовали следующие сокращения: с - синглет, д - дублет, д д -дублет дублетов, т - триплет, м - мультиплет;
- тонкослойную хроматографию (ТСХ) выполняли на силикагелевых пластинах DC Kieselgel 60 G/F254 (Merck, Германия) в системах растворителей хлороформ : метанол, 9:1 (А) или изопропиловый спирт : водный аммиак, 7:3 (Б). Соединения, содержащие амидные группы идентифицировали хлор-толидиновой пробой; соединения, содержащие ароматические группы - в ультрафиолетовых лучах, а соединения содержащие открытые карбоксильные группы и сложноэфирные группы - 5% спиртовым раствором бромкрезолового зеленого.
ПРИМЕР 1. Получение амида N-фенилнропионил-L-лейцил-L-триптофана (I), Ph(CH2)2-C(O)-L-Leu-L-Trp-NH2.
а) Сукцинимидный эфир N-карбобензокси-L-триптофана, Z-L-Trp-OSu.
К раствору 10,00 г (29.6 ммоль) Z-L-TrpOH в 300 мл этилацетата добавляли 3.98 г (34.6 ммоль, 17% избыток) N-гидроксисукцинимида, раствор охлаждали до +5° и затем прибавляли 7.25 г (35.2 ммоль, 19% избыток) дицилогексилкарбодиимида, следя за тем, чтобы температура не превышала +5°С. Реакционную массу перемешивали 30 мин при температуре +5 - +7°С и затем 12 ч при комнатной температуре. Осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали. Полученное вязкое масло растворяли в 200 мл дихлорметана. Раствор выдерживали 24 ч в холодильнике при +8°С, повторно образовавшийся осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали. Полученное масло промывали гексаном, гексан декантировали, масло упаривали досуха. Получали продукт в количестве 11.84 г (92%) в виде белой пены, которую измельчали до состояния порошка с т.пл. 137-140°С [α]25D -60.0° (с 1, ДМФА).
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 2.78 (4 Н, м, OSu), 3.01 и 3.25 (2 Н, два д.д., СβH Trp), 3.98 (1 Н, м, СαH Trp), 4.97 (2 Н, с, -ОСН2С6Н5), 6.73-7.62 (10 Н, м, -OCH2C6H5, индол), 8.56 (1 Н, д, NH Trp), 10.78 (1 Н, с, NH индол).
б) Амид N-карбобензокси-L-триптофана, Z-L-Trp-NH2.
Растворяли Z-L-Trp-OSu в 10 мл ДМФА, при перемешивании приливали 50 мл разбавленного до 10% раствора водного аммиака и 200 мл дистиллированной воды. Реакционную смесь перемешивали при комнатной температуре 0,5 часа, после чего выдерживали 3 ч в холодильнике при +5°С. Осадок отфильтровывали, промывали насыщенным раствором NaCl и дистиллированной водой до нейтральной реакции промывных вод. Сушили на воздухе до постоянной массы. Получали продукт в виде белого порошка, выход 90%; т.пл. 188-189°С, [α]D26=-27° (с 1, ДМФА). Спектр 1H-ЯМР ДМСО-d6, δ м.д.: 3,01 и 3,25 (2 Н, два д.д., СβH Trp), 3,98 (1 H, м, СαH Trp), 4,97 (2 Н, с, -ОСН2С6Н5), 6,73-7,62 (10 Н, м, -ОСН2С6Н5, индол), 6,89 и 7,19 (2 Н, два с, NH2 амид), 8,56 (1 Н, д, NH Trp), 10,78 (1 Н, с, NH индол).
в) Амид H-L-триптофана H-L-Trp-NH2.
К раствору 10.80 г (32,0 ммоль) Z-L-Trp-NH2 в 150 мл метанола добавляли 0,59 г 10% Pd/C (50%-ной влажн.) и перемешивали 3 ч в атмосфере водорода мри комнатной температуре. По исчезновении исходного вещества (ТСХ контроль) катализатор отфильтровывали, промывали 100 мл метанола. Метанольный раствор упаривали, Получали 6,17 г (95%) продукта в виде оранжевого масла, [α]D26=-25 0 (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 2.88-3.40 (2 Н, уш. с, NH2), 3,17 и 3,39(2 Н, два д.д., СβH Trp), 3,98 (1 Н, м, СαH Trp), 6,96-7,34 (10 Н, м, индол), 6,98 и 7,15 (2 H, два с, NH2 амид), 10,86 (1 Н, с, NH индол).
г) N-третбутилоксикарбонил-L-лейцин, Boc-L-Leu-OH. Растворяли 8.00 г (60.98 ммоль) L-лейцина в смеси 50 мл 1N NaOH, 100 мл воды, 200 мл изопропилового спирта. После полного растворения прибавляли 15.97 г (73.17 ммоль, 20% избыток) ди-трет-бутилпирокарбоната. Смесь перемешивали 2 ч при комнатной температуре, поддерживая рН 9 - 10 прикапыванием раствора 1N NaOH. Контроль за ходом реакции вели методом ТСХ в системе А. По окончании реакции реакционную массу упаривали в вакууме роторного испарителя до одной трети объема, при этом удалялся преимущественно изопропиловый спирт .Избыток ди-трет-бутилпирокарбоиата экстрагировали гексаном (2×100 мл). Водный раствор подкисляли 10% раствором H2SO4 до рН 4, продукт выпадал в виде белого «творожистого» осадка. Осадку давали выстоять в течение 12 ч, затем отфильтровывали, промывали дистиллированной водой до нейтральной реакции, сушили на воздухе в фарфоровой чашке до постоянной массы. Получали 11.14 г (79%) продукта в виде белого порошка с т.пл. 82-83° и [α]D20 -23° (с = 1, уксусная кислота), (лит.данные 83°C [α]D20 -24° (с = 1, уксусная кислота [А.А. Гершкович, В.К. Кибирев. Химический синтез пептидов. Киев: Наукова думка, 1992]).
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0,82-0,85 (6 Н, 2 д д, 2СδН3 Leu), 1,08-1,22 (1 Н, м, СγH2 Leu), 1.36 (9 Н, с, -ОС(СН3)3), 1,45 (2 Н, м, СβH Leu), 3,86-3,88 (1 Н, д.д., СαH Leu), 6,72 (1 Н, д, NH Leu).
д) Сукцинимидный эфир N-трет-бутилоксикарбонил-L-лейцина, Boc-L-Leu-OSu.
К раствору 8,00 г (34.63 ммоль) Boc-L-лейцина в 150 мл THF добавляли 4,73 г (39.88 ммоль, 15% избыток) N-гидроксисукцинимида, раствор охлаждали до +5°С на водяной бане со льдом, затем прибавляли 8.26 г (39.88 ммоль, 15% избыток) дицилогексилкарбодиимида. Реакционную массу перемешивали 30 мин при +5°С и 5 ч при комнатной температуре. Контроль за ходом реакции вели методом ТСХ в системе А. по окончании реакции осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали. Полученное вязкое масло растворяли в 30 мл дихлорметана. Раствор выдерживали 24 ч в холодильнике при +8°С, повторно образовавшийся осадок дициклогексилмочевины отфильтровывали, органическую фазу промывали 5% NaHCO3 (2×100 мл), и 100 мл дистиллированной воды. Сушили над Na2SO4, осушитель отфильтровывали, фильтрат упаривали, получали густое белое масло, которое закристаллизовывали в изопропиловом спирте. Полученные кристаллы выдерживали 12 ч в холодильнике при +8°С, получили продукт в количестве 8.31 г (73%) в виде стеклообразных кристаллов с т.пл. 110-112°С, [α]D26=-40° (с=2, диоксан). (Лит.данные: т.пл. 116°С (крист. из диизопропилового эфира), [α]D25 -41.8° (с=2, диоксан) [Anderson, G.W.; Zimmerman, J.E.; Callahan, F.M. The use of esters of N-hydroxysuccinimide in peptide synthesis../. Am. Chem. Soc, 1964, 86, 1839-1842]).
1Н-ЯМР (DMSO-d6) δ, м.д.: 0,82-0,88 (6 H, 2 д д, 2CδH3 Leu), 1,39 (9 H, с, -ОС(СН3)3), 1,45 (2 Н, т, СβH Leu), 1,56-1,73 (1 Н, м, CγН2 Leu), 2,82 (4 Н, м, OSu), 3,86-3,88 (1 Н, м., CαH Leu), 7,93 (1 Н, д, NH Leu).
е) Амид N-трет-бутилоксикарбонил-L-лейцил-L-трипофана, Boc-LLeu-L-Trp-NH2.
К раствору 3,3 г (16,2 ммоль) H-L-Trp-NH2 в 30 мл ДМФА прибавляли раствор 6,00 г (19,4 ммоль, 20% изб.) Boc-L-Leu-OSu в 30 мл ДМФА, перемешивали 12 ч при комнатной температуре, затем прибавляли 0,2 мл ДМАПА и перемешивали еще 30 мин. ДМФА упаривали, к еще подвижному желтому маслу приливали 300 мл дистиллированной воды, образовывался маслообразный осадок, воду над осадком декантировали, остаток растворяли в 250 мл ЭА, экстрагировали 5% NaHCO3 (2×150 мл) и насыщенным раствором NaCl (1×100 мл). Органический слой сушили над безводным Na2SO4, фильтровали, упаривали. Полученные после упаривания кристаллы последовательно промывали дистиллированной водой и гексаном, сушили на воздухе до постоянной массы. Получали продукт в виде кремовых кристаллов с выходом 5,18 г (76%); Rf=0,48 (А); т.пл. 165-166°С, [α]D24=-23 (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.83-0.88 (6 Н, м, 2СδН3 Leu), 1.06-1.35 (2 Н, т, СβH Leu), 1.58 (1 Н, м, СγH2 Leu), 2.92 и 3.08 (2 Н, два д.д., СβH Trp), 1.39 (9 Н, с, -ОС(СН3)3), 4.32 (1 Н, д.д., СαH Leu), 4,61 (1 Н, м, СαH Trp), 6.91-7.61 (5 Н, м, арил),), 6,98 и 7,15 (2 Н, два с, NH2 амид), 8.02 (1 Н, д, NH Trp), 8.35 (1 Н, д, NH Leu), 10.91 (1 Н, с, NH индол)
ж) Трифторацетат амида L-лейцил-L-трипофана, TFA*[H-L-Leu-L-Trp-NH2].
К суспензии 1,50 г (3,6 ммоль) Boc-L-Leu-L-Trp-NH2 в 15 мл CH2Cl2 приливали 4,5 мл TFA и перемешивали при комнатной температуре, (ТСХ-контроль в ситеме (В), раз в 1 ч). Реакцию вели 3 часа. Реакционную смесь упаривали, после чего дважды преупаривали в смеси с диэтиловым эфиром, еще подвижный остаток затирали под диэтиловым эфиром, эфир декантировали. Получали 1.49 г (99%) продукта в виде карамелеобразного вещества с т.пл. 188-191°С, [α]D26=-25 (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.83-0.88 (6 Н, м, 2СδН3 Leu), 1.06-1.35 (2 Н, т, СβH Leu), 1.58 (1 Н, м, СγH2 Leu), 2.92 и 3.08 (2 H, два д.д., СβH Trp), 4.32 (1 Н, д.д., СαH Leu), 4,61 (1 Н, м, СαH Trp), 6.91-7.61 (5 Н, м, арил),), 6,98 и 7,15 (2 Н, два c., NH2 амид), 8.02 (1 Н, д, NH Trp), 8.35 (1 Н, д, NH Leu), 10.91 (1 Н, с, NH индол)
з) Сукцинимидный эфир фенилпропионовой кислоты, Ph(СН2)2-C(O)-OSu
К раствору 4,00 г (26,66 ммоль) фенилпропионовой кислоты в 100 мл THF прибавили 3,68 г (32 ммоль) SuOH, затем 6,59 г (32 ммоль) DCC. Наблюдали выпадение белого осадка ДЦГМ. Оставляли смесь при перемешивании на 12 часов. По окончании реакции (ТСХ контроль в системе A, Rf=0,81) осадок ДЦГМ отфильтровали, растворитель удаляли в вакууме. Образовавшиеся кристаллы продукта сушили в вакуумированном эксикаторе над безводным Na2SO4. Выход продукта в виде белого воска составил 6,59 г (97%); Rf0,90 (А); т.пл. 113-114°С; Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 2.81 (4 Н, м, OSu), 2.97-3.01 (2 Н, м, СН2С6Н5), 3.34 (2 Н, с, СН2СО) 7.16-7.31 (5 Н, м, С6Н5).
и) Амид N-фенилпропионил-L-лейцил-L-триптофана (I), Ph(CH2)2C(O)-L-Leu-L-Trp-NH2 (ГД-136)
К раствору 1,49 г (3,46 ммоль) TFA* [L-Leu-L-Trp-NH2] в 10 мл ДМФА прибавляли 0,63 мл (3,63 ммоль, 5% изб.) ДИПЕА, перемешивали в течение 30 мин. Затем добавляли этот раствор к раствору 1,07 г Ph(CH2)2C(O)-OSu (4,32 ммоль, 25% изб.) в 10 мл, перемешивали 12 ч при комнатной температуре, затем прибавляли 0,1 мл N,N-диметил-1-аминопропана (ДМАПА) и перемешивали еще 30 мин. ДМФА упаривали, к еще подвижному желтому маслу приливали 200 мл дистиллированной воды, при этом выпадал осадок. Раствор с осадком оставляли на ночь, затем хорошо сформированный осадок отфильтровывали, последовательно промывали 5% NaHCO3, дистиллированной водой до рН 7 и гексаном, сушили в вакуумированном эксикаторе над Na2SO4, и парафином. Получали продукт в виде кремовых кристаллов с выходом 1,02 г (66%); Rf=0,41 (А); т.пл 168-169°С, [α]D26=-15° (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.82-0,88 (6 Н, 2 д д, 2СδН3 Leu), 1,45 (2 Н, т, СβH Leu), 1,56-1,73 (1 Н, м, СγH2 Leu), 2,38 (2 Н, т, СН2С6Н5), 2,69 (2 Н, т, CH2CO), 2,90 и 3,09 (2 Н, два д.д., СβH Trp), 4,22 (1 И, д.д., СαH Leu), 4,54 (1 Н, м, CαH Trp), 6,99-7,20 (10 Н, м, Ar), 7,33 и 7,60 (2 Н, два с, NH2 амид), 7,93 (1 Н, д, NH Leu), 8,08 (1 Н, д, NH TRp), 10,78 (1 Н, с, NH индол).
ПРИМЕР 2. Получение амида N-фенилацетил-L-лейцил-L-триптофана (II), PhCH2-C(O)-L-Leu-L-Trp-NH2 (ГД-141).
а) Сукцинимидный эфир фенилуксусной кислоты, PhCH2-C(O)-OSu
К раствору 5,00 г (37,0 ммоль) фенилуксусной кислоты в 50 мл тетрагидрофурана добавляли 5,07 г (44,0 ммоль, 20% избыток) N-гидроксисукцинимида, раствор охлаждали до 0°С, после чего в течение 5 мин прибавляли 9,08 г (44,0 ммоль, 20% избыток) дицилогексилкарбодиимида, следя за тем, чтобы температура не превышала +5°С. Реакционную массу перемешивали 30 мин при температуре 0 - +5°С и еще 5 ч при комнатной температуре. По окончании реакции (ТСХ контроль в системе A, Rf 0.83) осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали на роторном испарителе. Полученное вязкое масло растворяли в 50 мл дихлорметана. Раствор выдерживали 24 ч в холодильнике при +8°С, повторно образовавшийся осадок дициклогексилмочевины отфильтровывали, фильтрат упаривали, масло растирали с гексаном, гексан декантировали, остаток упаривали досуха. Получали чистый продукт в количестве 9,30 г (90%) в виде белого порошка с т. пл = 111-112°С, Rf 0,89 (А). Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 2.81 (4 Н, м, OSu), 4.10 (2 Н, с, СН2С6Н5), 7.20-7.42 (5 Н, м, С6Н5).
б) Амид N-фенилацетил-L-лейцил-L-триптофаиа (II) PhCH2C(O)-L-Leu-L-Trp-NH2 (ГД-141)
К раствору 1.50 г (3,48 ммоль) TFA[L-Leu-L-Trp-NH2], полученного как в Iж, в 10 мл ДМФА прибавляли DIPEA (0.63 мл, плотность 0,742, 5% изб.), перемешивали в течение 30 мин. Затем добавляли этот раствор к раствору 1,01 г Ph(CH2)2C(O)-OSu (4,36 ммоль, 25% изб.) в 10 мл, перемешивали 12 ч при комнатной температуре, затем прибавляли 0,1 мл N,N-диметил-1-аминопропана (ДМАПА) и перемешивали еще 30 мин. ДМФА упаривали подвижный маслообразный остаток растворяли в 75 мл ЭА, экстрагировали последовательно 3% H2SO4 (1×75 мл), 5% NaHCO3 (1×75 мл) и дистиллированной водой (1×75 мл). Органический слой сушили над безводным Na2SO4, фильтровали, упаривали, сушили в вакуумированном эксикаторе над Na2SO4, и парафином. Получали продукт в виде белого порошка с выходом 1,12 г (74%); Rf=0,41 (А); т.пл 219-221°С, [α]D23=-20° (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.82-0,88 (6 Н, м, 2СδН3 Leu), 1,45 (2 Н, т, СβH Leu), 1,56-1,73 (1 Н, м, СγH2 Leu), 2.95 и 3.09 (2 Н, два д.д., СβH Trp), 3.39 (2 H, с, СН2С6Н5), 4.15 (1 H, д.д., СαH Leu), 4,62 (1 Н, м, СαH Trp), 6.97-7.38 (10 Н, м, СН2С6Н5, индол), 7.07 и 7.58 (2 Н, 2 д, NH2 амид), 7.77 (1 Н, д, NH Leu), 8.28 (1 H, д, NH Trp), 10.81 (1 Н, с, NH индол).
ПРИМЕР 3. Получение метилового эфира N-фенилпропионил-L-лейцил-L-триптофана (III), Ph(CH2)2-C(O)-L-Leu-L-Trp-OCH3 (ГД-138).
а) Метиловый эфир N-трет-бутилоксикарбонил-L-лейцил-L-трипофана, Boc-L-Leu-L-Trp-ОСН3.
К раствору 2,15 г (8,44 ммоль) HCl*[H-L-Trp-OCH3] в 30 мл ДМФА прибавляли DIPEA 1,6 мл (10% изб.), перемешивали в течение 30 мин. После чего прибавляли раствор 3,15 г (19,4 ммоль, 20% изб.) Boc-L-Leu-OSu, полученного как в Iд, в 30 мл ДМФА, перемешивали 12 ч при комнатной температуре, затем прибавляли 0,2 мл ДМАПА и перемешивали еще 30 мин. ДМФА упаривали, подвижный маслообразный остаток растворяли в 250 мл ЭА, экстрагировали последовательно 3% H2SO4 (1×100 мл), 5% NaHCO3 (1×100 мл) и дистиллированной водой (1×100 мл). Органический слой сушили над безводным Na2SO4, фильтровали, упаривали. Полученное после упаривания карамелеобразное масло дважды переупаривали с метанолом, после чего затирали с диэтиловым эфиром, декантировали, сушили в вакуумированном эксикаторе над CaCl2 и парафином до постоянной массы. Получали продукт в виде кремовых кристаллов с выходом 3,37 г (76%); Rf=0,48 (А); т.пл. 84-86°С, [α]D24=-23 (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.83-0.88 (6 H, м, 2СδН3 Leu), 1.06-1.35 (2 Н, т, CβH Leu), 1.58 (1 H, м, CγH2 Leu), 2.92 и 3.08 (2 Н, два д.д., СβH Trp), 1.39 (9 Н, с, -ОС(СН3)3), 3.61 (3 Н, с, -ОСН3), 4.32 (1 Н, д.д., СαH Leu), 4,61 (1 Н, м, СαH Trp), 6.91-7.61 (5 Н, м, арил), 8.02 (1 Н, д, NH Trp), 8.35 (1 Н, д, NH Leu), 10.91 (1 Н, с, NH индол)
б) Трифторацетат метилового эфира N-L-лейцил-L-триптофана TFA*[H-L-Leu-L-Trp-ОСН3]
К суспензии 1,50 г (3,6 ммоль) Boc-L-Leu-L-Trp-OCH3 в 15 мл CH2Cl2 приливали 4,5 мл TFA и перемешивали при комнатной температуре, по исчезновению исходного вещества (ТСХ-контроль в ситеме (В), раз в 1 ч) реакционную смесь упаривали, после чего дважды преупаривали в смеси с диэтиловым эфиром, еще подвижный остаток затирали под диэтиловым эфиром, эфир декантировали. Получали 1.49 г (99%) продукта в виде кремового порошка с т.пл. 188-191°С, Rf=0,30 (Б), [α]D26=-25 (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.83-0.88 (6 Н, м, 2СδН3 Leu), 1.06-1.35 (2 Н, т, СβH Leu), 1.58 (1 Н, м, СγH2 Leu), 2.92 и 3.08 (2 Н, два д.д., СβH Trp), 3.61 (3H, с, -ОСН3), 4.32 (1 Н, д.д., CαH Leu), 4,61 (1 H, м, СαH Trp), 6.91-7.61 (5 Н, м, арил), 8.02 (1 Н, д, NH Trp), 8.35 (1 Н, д, NH Leu), 10.91 (1 Н, с, NH индол)
в) Метиловый эфир N-фенилпропионил-L-лейцил-L-триптофана Ph(CH2)2C(O)-L-Leu-L-Trp-OCH3 (ГД-138)
К раствору 2,27 г (5,09 ммоль) TFA*[H-L-Leu-L-Trp-OCH3] в 10 мл ДМФА прибавляли 0,97 мл ДИПЕА (5,60 ммоль, плотность 0,742, 10% изб.), перемешивали в течение 30 мин. Затем добавляли этот раствор к раствору 1, 58 г Ph(CH2)2C(O)-OSu (6,37 ммоль, 25% изб.) в 10 мл, перемешивали 12 ч при комнатной температуре, затем прибавляли 0,1 мл ДМАПА и перемешивали еще 30 мин. Растворитель упаривали, подвижный маслообразный остаток растворяли в 75 мл ЭА, экстрагировали последовательно 3% H2SO4 (1×75 мл), 5% NaHCO3 (1×75 мл) и дистиллированной водой (1×75 мл). Органический слой сушили над безводным Na2SO4, фильтровали, упаривали. Затем полученное масло дважды переупаривали с диэтиловым эфиром до состояния пены. Сушили в вакуумированном эксикаторе над Na2SO4 и парафином. Получали продукт в виде кремовой пены с выходом 2,25 г (93%); т.пл. 97-98°C;Rf=0,70 (А);°С, [α]D26=-12° (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.83-0.88 (6 Н, м, 2СδН3 Leu), 1.06-1.35 (2 Н, т, СβH Leu), 1.58 (1 Н, м, СγH2 Leu), 2.34 (2 Н, м, СН2 цепи), 2.69 (Н, м, СН2 цепи), 2.92 и 3.08 (2 Н, два д.д., СβH Trp), 3.61 (3 Н, с, -ОСН3), 4.32 (1 II, д.д., CαH Leu), 4,61 (1 Н, м, СαH Trp), 6.91-7.61 (10 Н, м, арил), 8.02 (1 Н, д, NH Trp), 8.35 (1 Н, д, NH Leu), 10.91 (1 Н, с, NH индол)
ПРИМЕР 4. Получение N-фенилпропионил-L-лейцил-L-триптофана (IV), Ph(CH2)2C(O)-L-Leu-L-Trp-OH (ГД-139).
Растворяли 1,20 г (2,60 ммоль) Ph(CH2)2C(O)-L-Leu-L-Trp-OCH3, полученного как в IIIв, в 20 мл МеОН, прибавляли при перемешивании раствор 0,21 г (5,20 ммоль, 100% изб.) NaOH в 5 мл воды. Перемешивали 24 часа. Реакционную массу разбавили дистиллированной водой до объема 70 мл, подкисляли 5% H2SO4 до рН 4, после чего переносили в делительную воронку и экстрагировали ЭА (2×70 мл). Органические фракции объединяли, и заново промывали насыщенным раствором NaCl. Органическую фракцию отделяли, сушили над безводным Na2SO4, фильтровали, упаривали, получали карамелеобразный продукт. Его дважды переупаривали с диэтиловым эфиром до состояния пены. Сушили в вакуумированном эксикаторе над Na2SO4 и парафином. Получали продукт в виде кремовой пены с выходом 1,14 г (97%) с т.пл. 107-109°С; Rf=0,70 (A); [α]D26=-8° (с 1, ДМФА). Спектр 1Н-ЯМР ДМСО-d6, δ м.д.: 0.83-0.88 (6 H, м, 2CδH3 Leu), 1.06-1.35 (2 Н, т, СβH Leu), 1.58 (1 Н, м, CγH2 Leu), 2.34 (2 Н, м, СН2 цепи), 2.69 (Н, м, СН2 цепи), 2.92 и 3.08 (2 Н, два д.д., СβH Trp), 3.61 (3 Н, с, -ОСН3), 4.32 (1 Н, д.д., СαH Leu), 4,61 (1 Н, м, СαH Trp), 6.91-7.61 (10 Н, м, арил), 8.02 (1 Н, д, NH Trp), 8.35 (1 Н, д, NH Leu), 10.91 (1 Н, с, NH индол) 12.63 (1 Н, ушир. с, ОН).
ПРИМЕР 5. Получение метиламида N-фенилпропионил-L-лейцил-L-триптофана (V), Ph(CH2)2C(O)-L-Leu-L-Trp-NHCH3 (ГД-140)
Растворяли 0,42 г (0,91 ммоль) Ph(CH2)2C(O)-L-Trp-L-Leu-OCH3, полученного как в IIIв, в 9 г раствора метиламина в этиловом спирте, содержащего 2,17 г (91 ммоль) чистого метиламина. Оставили в герметично закрытой посуде на 6 суток при комнатной температуре. Раствор упарили, затем переупарили дважды с Et2O. Получали 0,49 г (96%) продукта в виде белого порошка; т.пл. 174°С с разложением, [α]26D=+5°, с=1, DMFA. Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 0.83-0.88 (6 Н, м, 2СδН3 Leu), 1.06-1.35 (2 Н, т, СβH Leu), 1.58 (1 Н, м, СγH2 Leu), 2.37 (2Н, т, СН2С(O)), 2.57 (3 Н, д, -NHCH3), 2.69 (2Н, т, СН2С6Н5), 2.91 и 3.11 (2 Н, два д.д., СβH Trp), 4.12 (1 Н, д.д., СαH Leu), 4,35 (1 Н, м, СαH Trp), 4.93 и 4.99 (2 Н, 2 д, -ОСН2С6Н5), 6.91-7.28 (10 Н, м, -ОСН2С6Н5, индол), 7.60 (1 Н, д, NH Trp), 7.85 (1 Н, д, NH Leu), 10.83 (1 Н, с, NH индол).
Пример 6. Доказательство лигандных свойств заявляемых соединений методом молекулярного докинга
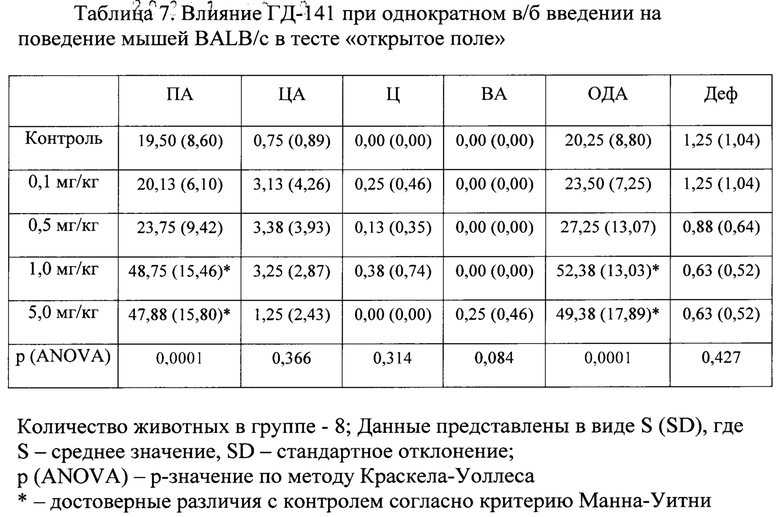
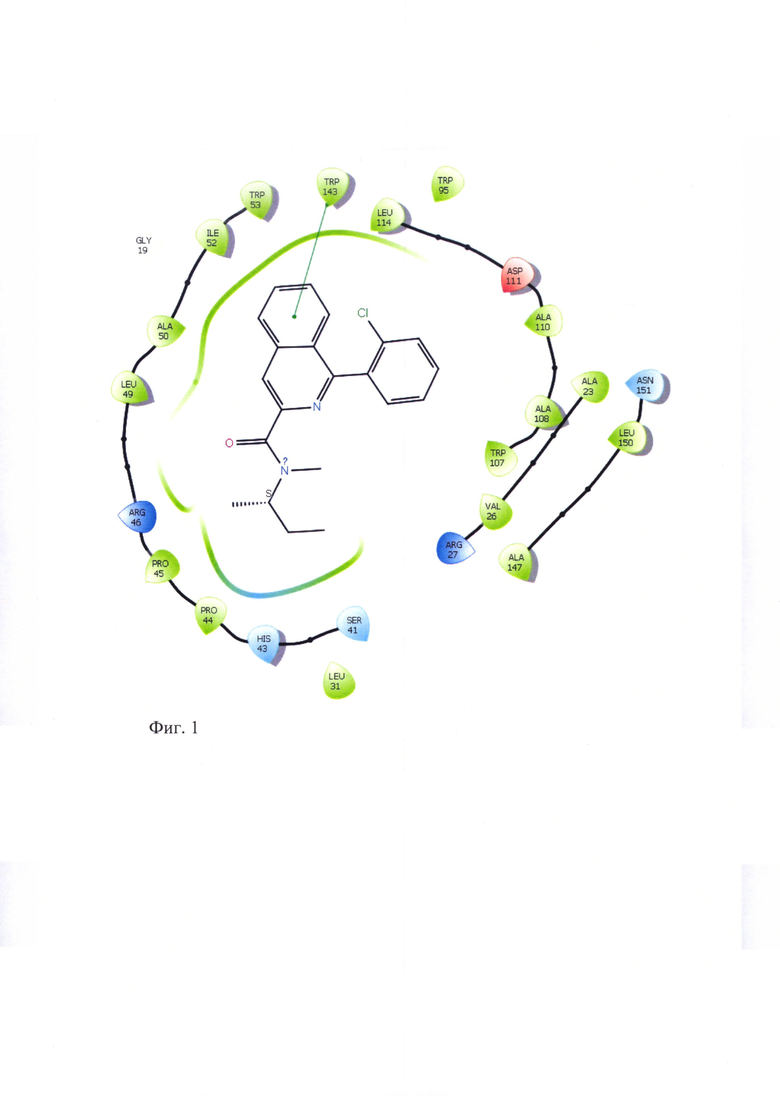
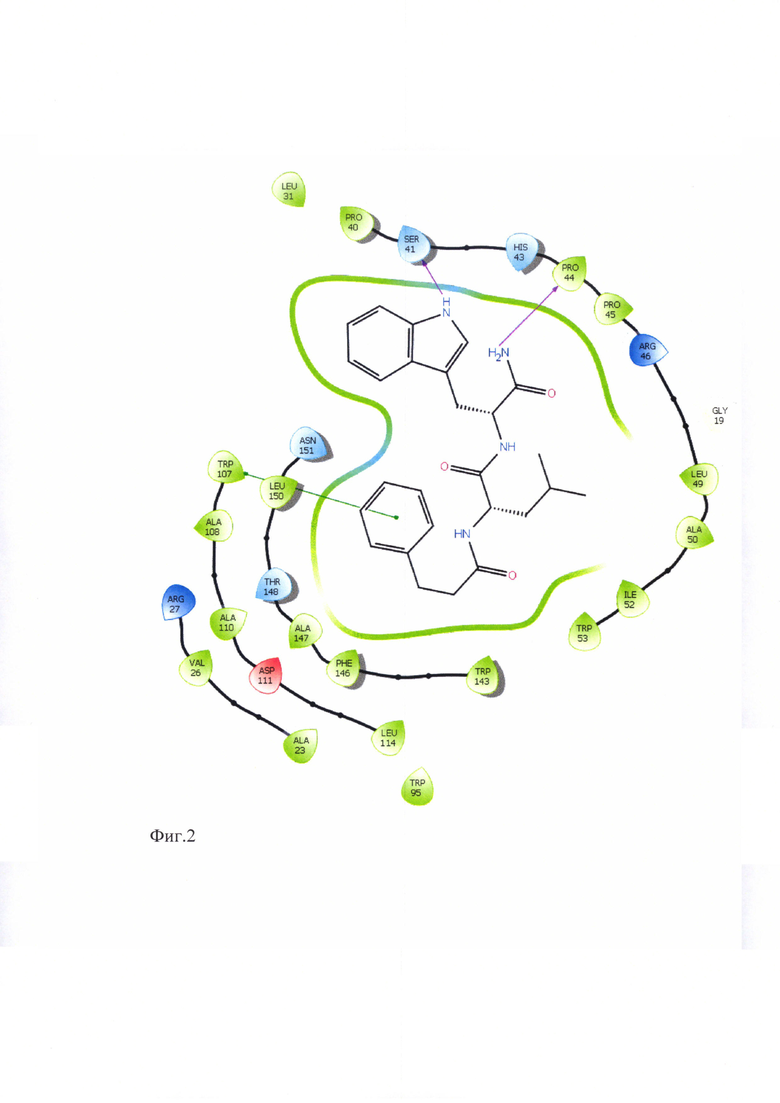
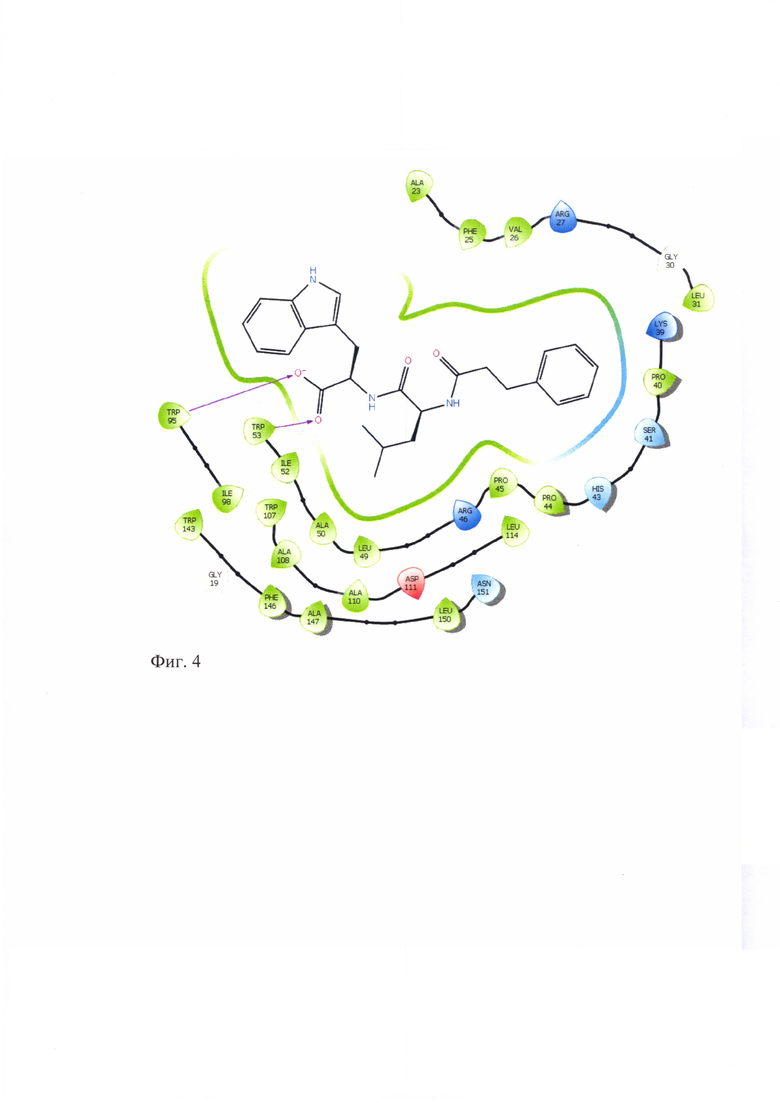
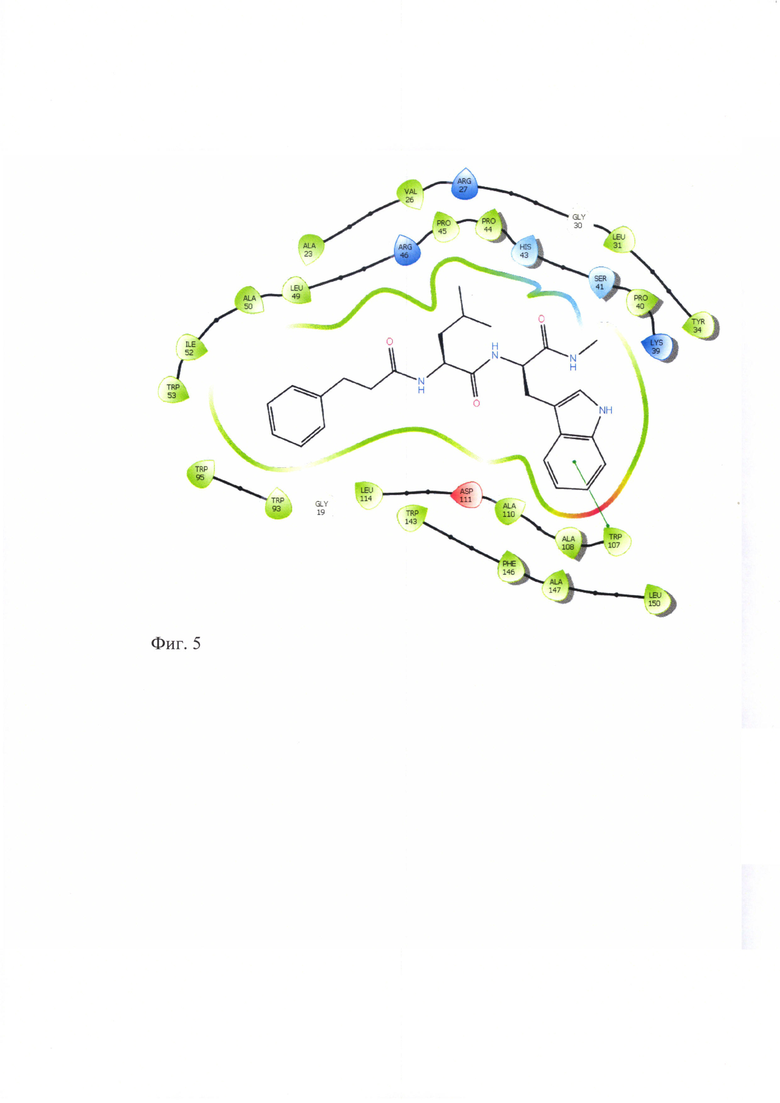
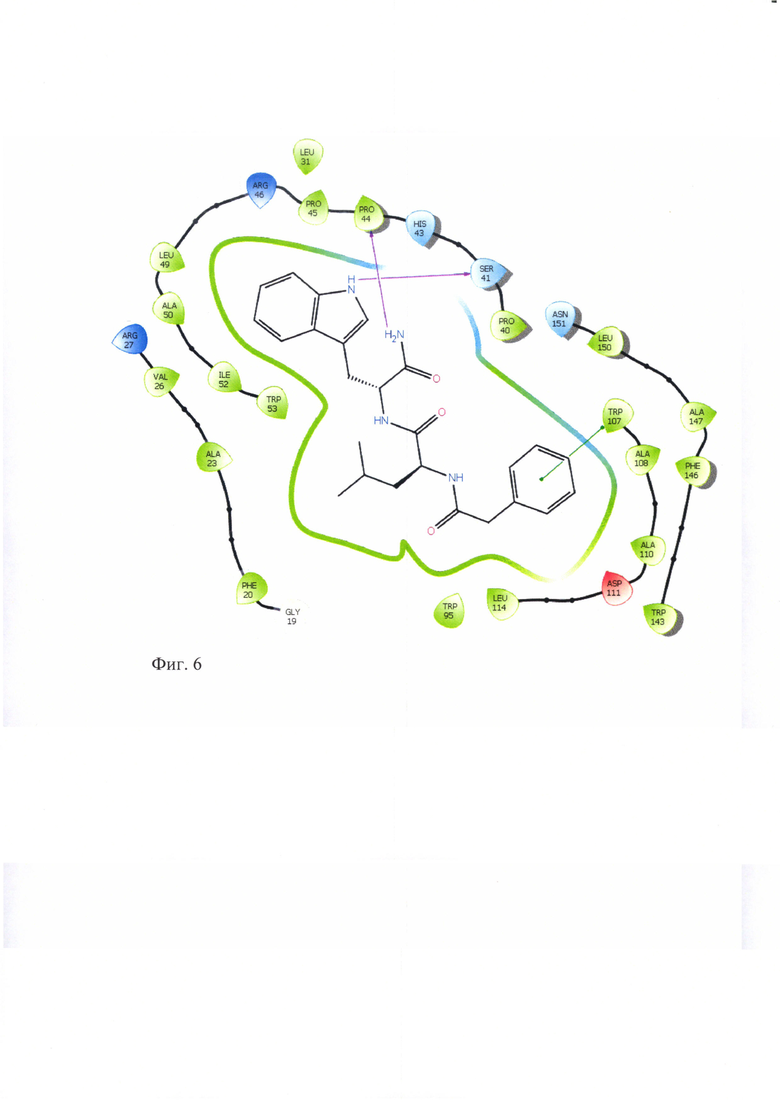
Для подтверждения лигандных свойств по отношению к TSPO для соединений ГД-136, ГД-138, ГД-139, ГД-140, ГД-141 нами осуществлен молекулярный докинг в активный центр TSPO, структура которого в комплексе с селективным лигандом РК-11195, полученная методом ЯМР-спектроскопии, взята из базы данных Protein Data Bank (PDB идентификатор 2MGY) [Jaremko L., Jaremko M., Giller K., Becker S., Zweckstetter M. Structure of the mitochondrial translocator protein in complex with a diagnostic ligand. Science, 2014, V343, p.1363-1366]. Соединения ГД-136, ГД-138, ГД-139, ГД-140, ГД-141 локируются в активный центр TSPO, показывая при этом характерную для всех лигандов TSPO высокую липофильность и энергию связывания (по оценочной функции DS), сопоставимую с таковой для селективного лиганда РК-11195 (см.табл. 2). Для соединений ГД-136, ГД-139, ГД-140, ГД-141 выявлено наличие тс -тс стэкинга между фенильным фрагментом лиганда и Trp-107 рецептора. У соединения ГД-140 выявлен также π-π стэкинг с Trp-95.
Схематическое изображение положения PK-11195, известного селективного лиганда TSPO, в активном центре TSPO по данным докинга представлено на фигуре 1. На фигурах 2-6 представлено схематическое изображение положений ГД-136, ГД-141, ГД-139, ГД-140, ГД-138 в активном центре TSPO по данным докинга.
Пример 7. Результаты фармакологического изучения заявляемых соединений
1. Влияние заявляемых соединений на поведение мышей линии BALB/c в условиях эмоционально-стрессового воздействия в тесте «открытое поле» со световой вспышкой.
Тест «открытое поле» - распространенная модель оценки поведения грызунов в условиях эмоционального стресса, формирующегося как реакция на новую обстановку и угрожающую ситуацию. В работе применена методика освещенного «открытого поля», при котором перенос животного из темноты на ярко подсвеченную арену создает дополнительный стрессирующий фактор, основанный на естественном стремлении грызунов избегать ярко освещенных мест (С.Б.Середенин, А.А.Ведерников. Влияние психотропных препаратов на поведение инбредных мышей в условиях открытого поля // Бюлл. Эксп.Биол. Мед. - 1979. - Т.88, №7, с. 38-40).
В исследовании использованы мыши-самцы инбредной линий BALB/c массой 19-25 г (НПП «Питомник лабораторных животных ФИБХ РАН). Животные содержались в условиях лабораторного вивария в контролируемых условиях окружающей среды (20-22°С и 30-70% относительная влажность, 12-часовой цикл освещения, 10-ти кратная смена объема воздуха комнаты в час), в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 20 мышей в каждой клетке, при постоянном доступе к экструдированному брикетированному корму ГОСТ Р 50258-92 [1993] и питьевой воде. Животные распределялись по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более чем на ±10%). Перед опытом животных выдерживали в экспериментальной комнате в «домашних» клетках в течение 24 часов.
Мышам вводили суспензию соединений с Твин-80 и дистиллированной водой однократно внутрибрюшинной (в/б) инъекцией. Через 30 минут после внутрибрюшинного введения животное сначала помещали на 1 мин в темную камеру, а затем - на один из периферических квадратов "открытого поля", которое представляет из себя белую круглую арену диаметром 1 метр с белыми бортами высотой 50 см. Арена равномерно освещена 4-мя бестеневыми лампами по 75 Вт каждая, расположенными на высоте 1 м над поверхностью поля. Все пространство арены равномерно разделено 4-мя концентрическими окружностями и разбиты радиусами на сектора так, что периферическое кольцо состоит из 16 одинаковых криволинейных квадратов. Наблюдение за животным производили в течение 3 минут, раздельно фиксировали число пересеченных квадратов на периферии (ПА), в центральных областях (ЦА), число заходов в центр (Ц), а также число вертикальных стоек (ВА). Суммарное число пересеченных квадратов вместе с числом вертикальных стоек обозначали как общую активность (ОДА), число болюсов, обнаруженное за время проведения эксперимента, служило характеристикой дефекации (Деф).
О наличии анксиолитического действия судили по выявлению активирующего эффекта на двигательную активность у животных с реакцией замирания в тесте «открытое поле» (линия BALB/c).
Статистическую обработку полученных результатов проводили, используя однофакторный дисперсионный анализ (ANOVA, критерий Краскела-Уоллиса) и непараметрический анализ для независимых переменных (U-критерий Манна-Уитни).
В условиях эмоционально-стрессового воздействия в тесте «открытое поле» при внутрибрюшинном (в/б) введении у соединения ГД-136 в дозах 0,1-5,0 мг/кг не обнаружено статистически значимое повышение периферической, центральной и общей двигательной активности мышей линии BALB/c по сравнению с контролем (табл. 3).
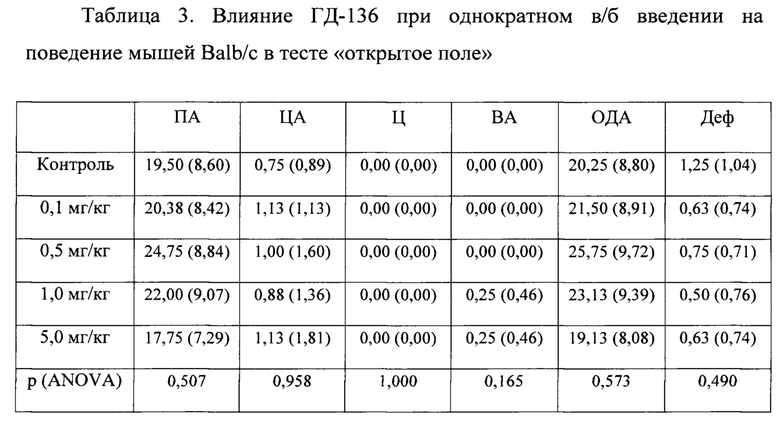
Количество животных в группе - 8; Данные представлены в виде S (SD), где S - среднее значение, SD - стандартное отклонение; р (ANOVA) - р-значение по методу Краскела-Уоллеса
В условиях эмоционально-стрессового воздействия в тесте «открытое поле» при внутрибрюшинном введении соединения ГД-138 в дозе 0,1 мг/кг обнаружено статистически значимое снижение периферической, центральной и общей двигательной активности мышей линии BALB/c по сравнению с контролем (табл.4). При введении соединения в дозах 0,5 и 5,0 мг/кг статистически значимого анксиолитического эффекта не обнаружено. При использовании его в дозе 0,1 мг/кг обнаружено статистически значимое повышение периферической двигательной активности мышей линии BALB/c по сравнению с контролем.
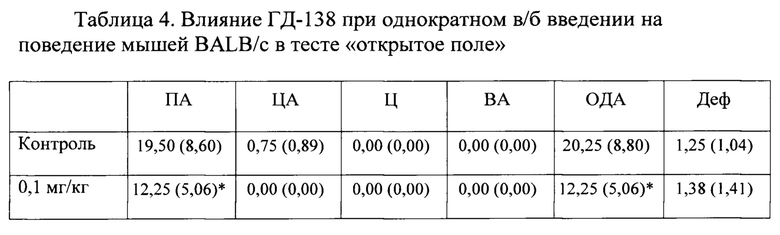
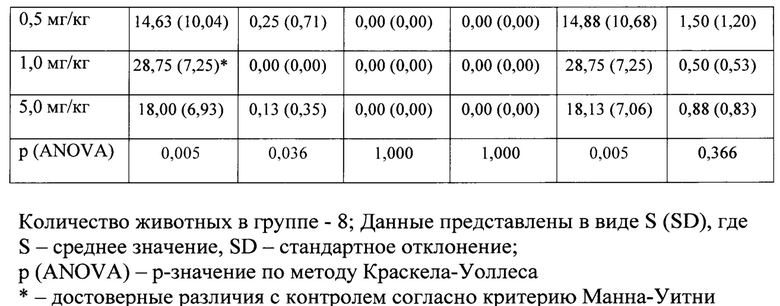
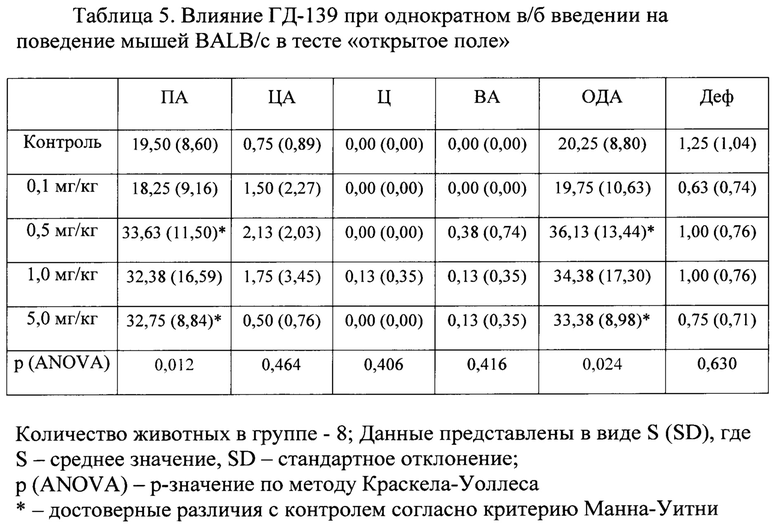
В условиях эмоционально-стрессового воздействия в тесте «открытое поле» при внутрибрюшинном введении соединения ГД-139 в дозах 0,5 и 5,0 мг/кг обнаружено статистически значимое повышение периферической, центральной и общей двигательной активности мышей линии BALB/c по сравнению с контролем (табл. 5).
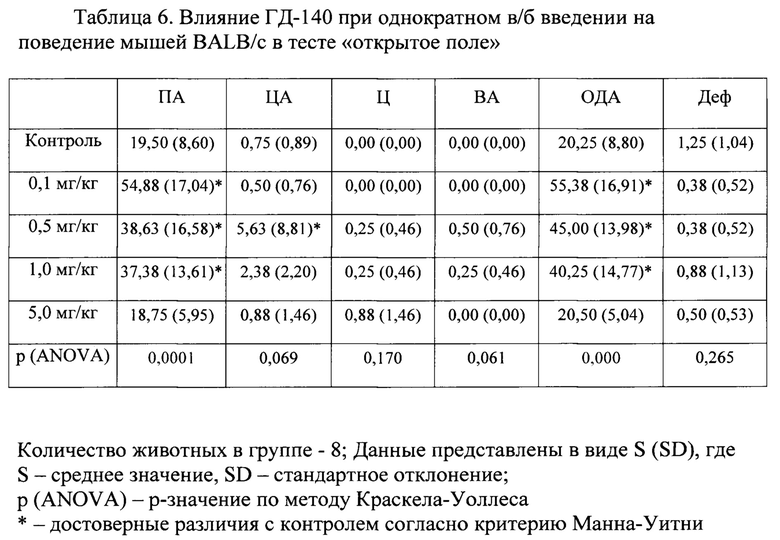
В условиях эмоционально-стрессового воздействия в тесте «открытое поле» при внутрибрюшинном введении соединения ГД-140 в диапазоне доз 0,1-1,0 мг/кг обнаружено статистически значимое повышение периферической, центральной и общей двигательной активности мышей линии BALB/c по сравнению с контролем (табл. 6).
В условиях эмоционально-стрессового воздействия в тесте «открытое поле» при внутрибрюшинном введении соединения ГД-141 в диапазоне доз 0,1-5,0 мг/кг обнаружено статистически значимое повышение периферической, центральной и общей двигательной активности мышей линии BALB/c по сравнению с контролем (табл. 7).
Таким образом, были получены 5 новых L-лейцил-L-триптофана, потенциальных лигандов TSPO. Анксиолитическая активность выявлена для соединений ГД-139, ГД-140 и ГД-141 в тесте «Открытое поле со световой вспышкой». Наиболее активно в этом ряду соединение ГД-140. Соединение ГД-138 проявило анксиогенную активность.
Описание чертежей
Фиг. 1 Схема положения РК-11195 в активном центре TSPO.
Фиг. 2 Схема положения ГД-136 в активном центре TSPO.
Фиг. 3 Схема положения ГД-138 в активном центре TSPO.
Фиг. 4 Схема положения ГД-139 в активном центре TSPO.
Фиг. 5 Схема положения ГД-140 в активном центре TSPO.
Фиг. 6 Схема положения ГД-141 в активном центре TSPO.
| название | год | авторы | номер документа |
|---|---|---|---|
| Дипептидные лиганды TSPO, обладающие нейропсихотропной активностью | 2018 |
|
RU2756772C2 |
| ЗАМЕЩЕННЫЕ ДИПЕПТИДЫ С НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2573823C2 |
| ТРИПЕПТИД, ОБЛАДАЮЩИЙ НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2023 |
|
RU2823022C1 |
| Пирроло[1,2-a]пиразин-содержащие лиганды транслокаторного белка 18 кДа, обладающие анксиолитической активностью | 2022 |
|
RU2812083C2 |
| СПОСОБ ПОЛУЧЕНИЯ БУСЕРЕЛИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2010 |
|
RU2442791C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОНАПЕПТИДЭТИЛАМИДА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2010 |
|
RU2444525C2 |
| Способ получения трипептидов | 1980 |
|
SU1085505A3 |
| Способ получения пептидов или их солей | 1977 |
|
SU664560A3 |
| 1-АРИЛПИРРОЛО[1,2-A]ПИРАЗИН-3-КАРБОКСАМИДЫ С НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2572076C2 |
| СРЕДСТВА, УСИЛИВАЮЩИЕ СЕКРЕЦИЮ ГОРМОНА РОСТА | 2001 |
|
RU2270198C2 |
Изобретение относится к новому ряду биологически активных соединений - дипептидам общей формулы: R1-C(O)-L-Leu-L-Trp-R2, где R1 выбирают из С6Н5-СН2- или C6H5-(CH2)2-; R2 выбирают из ОН, ОСН3, NH2 или NHCH3. Соединения являются лигандами 18 кДа митохондриального транслокаторкого протеина (TSPO) и обладают нейропсихотропными свойствами, в частности анксиолитической активностью. 5 з.п. ф-лы, 6 ил., 7 табл., 7 пр.
1. Соединения, обладающие анксиолитической активностью, общей формулы R1C(O)-L- Leu -L- Trp -R2, где
R1 могут быть C6H5-CH2- или C6H5-(CH2)2-,
R2 могут быть -ОН или -ОСН3 или -NH2 или -NHCH3.
2. Соединение по п. 1, отличающееся тем, что
R1=С6Н5-(СН2)2-, R2=-NH2.
3. Соединение по п. 1, отличающееся тем, что
R1=С6Н5-СН2-, R2=-NH2.
4. Соединение по п. 1, отличающееся тем, что
R1=C6H5-(СН2)2-, R2=-ОСН3.
5. Соединение по п. 1, отличающееся тем, что
R1=С6Н5-(СН2)2-, R2=-ОН,
6. Соединение по п. 1, отличающееся тем, что
R1=С6Н5-(СН2)2-, R2=-NHCH3.
| RU 2015154806 A, 26.06.2017 | |||
| ЗАМЕЩЕННЫЕ ДИПЕПТИДЫ С НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2573823C2 |
| CN 110655554 A, 07.01.2020 | |||
| US 5656604 A1, 12.08.1997. | |||
Авторы
Даты
2021-10-18—Публикация
2020-04-14—Подача