Изобретение относится к этанольным аддуктам соединений с формулой 1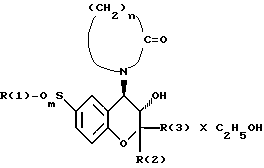
где R(1) фенил, который может быть замещен на 1-2 метильные группы и/или хлором,
R(2) и R(3) могут быть одинаковыми или различными и являются H, метилом или метилом, а также
n число 3 и 4,
m число 1 и 2, способу их получения и применению их в качестве средств ингаляции при заболеваниях.
Изобретение касается исключительно оптически активных соединений, в которых радикал лактама и гидрокси-группа имеют 4R или 3S-конфигурацию. В случае асимметричного замещения С-2 атома в системе хромана изобретение касается как S так и R-структурированных соединений.
Под аддуктами этанола следует понимать стабильные сольваты соединений формулы 1 с этанолом, в смысле, что этанол является твердым компонентом кристаллической решетки, определяющим характер соответствующего соединения в твердой форме.
Наиболее предпочтительным из соединений формулы 1 можно считать этанольный аддукт (3S, 4R)-3-гидрокси-2,2-диметил-4-(2-оксо-1-пирролидинил-6-фенилсульфонилхроман).
Основные соединения формулы 1а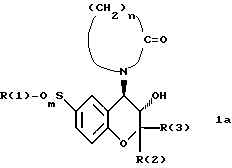
уже известны из европейской патентной заявки [2] а их применение для лечения различных форм астмы описано в европейской патентной заявке ЕР 351 720. Однако там речь идет не об этанольных аддуктах и не о не содержащих сольваты соединениях 1, а также не об их гидратах. Предлагаемое там применение соединений 1а, в частности для лечения астматических явлений, когда препараты принимаются, главным образом, путем ингаляций, касается превращения растворов веществ в аэрозоли, например распыления водных растворов. Однако такое применение ограничивается определенной степенью растворимости соединений 1а в воде. Значительно эффективнее была бы ингаляция порошкообразных веществ, либо прямая, либо в виде суспензий, в фторхлоруглеводородах в качестве газа носителя, что обеспечило бы более высокую или более быстрое дозирование. Чтобы обеспечить хорошее прохождение вдыхаемых порошкообразных веществ к легким, в этих случаях следовало бы проводить процесс микронизации. При этом оказалось, что вещества, соответствующие Европейской патентной заявке [3] вследствие их слипания в процессе ингаляции или вообще не способны к микронизированию, или не полностью микронизируются.
Неожиданно удалось получить до сих пор неизвестные этанольные аддукты соединений 1а. Они оказались стабильными, хорошо микронизировались и не изменяли размера своих частиц при суспендировании во фторхлоруглеводородах или других веществах-носителях, в противоположность веществам, известным из [3] Таким образом можно сказать, что представляемые в изобретении этанольные аддукты обладают ценными физическими свойствами, которые целесообразно использовать при их применении в качестве порошкообразных средств для ингаляций.
Аналогичные по структуре соединения и их сольвенты, предпочтительно их гидраты, а также применение их для лечения астмы описаны, например, в европейской патентной заявке [1] однако особенностей сольвента или даже этанольного аддукта для получения порошкообразного средства для ингаляции, а также его получения не приводится.
Представляемые согласно изобретению этанольные аддукты получают или при контакте не содержащих сольвата соединений с формулой 1а или любого другого сольвата соединений 1а, например, гидрата, с этанолом с последующей перекристаллизацией из этанола.
Синтез исходных материалов, необходимых для такой реакции взаимодействия, описан либо в европейской патентной заявке [4] либо их получение проводится по аналогии с примером 1.
Как уже упоминалось, этанольные аддукты особенно удобно применять в качестве средств ингаляции при заболеваниях, связанных с закупоркой дыхательных путей, таких как астма. Ежедневная доза при этом составляет в зависимости от тяжести заболевания 0,1 мкг/кг веса тела, причем наиболее предпочтительная доза от 1 до 10 мкг/кг. Для применения в качестве средства для ингаляций предпочтителен микронизированный порошок с размером частиц в пределах 10 мкм, оптимально от 3 до 8 мкм. Такой порошок вдыхается либо как таковой, либо с добавками вспомогательных веществ, например лактозы, всасывается вместе с вдыхаемым воздухом, причем для этой цели может быть использован соответствующий прибор. Он может применяться в совокупности с веществом-носителем, например в аэрозольных дозаторах с добавлением поверхностно-активных или других вспомогательных веществ.
Пример 1. Этанольный аддукт (3S,4R)-3-гидрокси-2,2-диметил-4-(2-оксо-1-пирролидинил) -6-фенилсульфонилхромана.
Полугидрат (3S, 4R)-3-гидрокси-2,2-диметил-4-(2-оксо-1-пирролидинил) -6-фенилсульфонилхромана растворяют в кипящем этаноле и медленно охлаждают до комнатной температуры. Продукт высушивают в течение 8 часов при температуре 80oC. Т. пл. 118-120oC, ИК/К Br см-1/1639, 1480, 1302, 1152, 732, 608, 577.
Аналитически рассчитано для C21H23NO5• 1C2H5OH:
C, 61,7; H 6,5; N, 3,1;
Найдено: С, 61,5; H, 6,3; N, 3,2.
Получение исходного материала полугидрата (3S, 4R)-3-гидрокси-2,2-диметил -4-(2-оксо-1-пирролидинил)-6-фенилсульфонилхромана.
13,2 г (0603 моля) (2S, 4R)-4-(4-хлорбутириламино)-3-гидрокси-2,2 -диметил-6-фенилсульфонилхромана растворяют в 100 мл тетрагидрофурана и разбавляют 4 г мелко размолотого твердого NaOH. Реакционную смесь перемешивают в течение часа при комнатной температуре и при добавлении 25 мл H2O сгущают под вакуумом. Остаток обрабатывают ледяной водой до начала кристаллизации. После перекристаллизации из чистого метанола и в последующем из смеси метанола с водой (1:2) получают полугидратный аддукт.
Выход 10,0 г
Т. пл. 121-123oC.
1H-ЯМР (270 Мгерц, CD Cl3): 1,25 (S, CH3), 2,00-2,18 (m, C (4')H2(2,47-2,70 (m, C (3') H2), 2,95 3,05 (m, C (5') H2), 3,18-3,30 (ps-dd, C (5')H2), 3,13 (d, J 5,6, O-H), 3,71 (dd, J=10 герц, С (3) H2), 5,31 (d, J 10 герц, С (4)H2), 6,91 (d, J 8,4 герц, С(6)H2), 7,45-7,60, 7,73, 7,9 (m, 7H, Ar-H), [α]
Аналитически рассчитано для C21H23NO5 •0,5H2O:
C 61,4; H 5,9; N 3,4
Найдено: C 61,4; H 5,7; N 3,4.
Получение других предварительных стадий.
(3S, 4R)-4-(4-хлорбутириламино)-3-гидрокси-2,2-диметил-6 -фенилсульфонидхроман 15,8 г (0,33 моля) (3S, 4R)-4-(4-хлорбутириламино)-3-гидрокси-2,2-диметил-6-фенилсульфонидхроман (+)-манделата добавляют к хорошо перемешанной смеси из 3,26 г NaOH в 80 мл H2 и 80 мл CH2Cl2. После охлаждения на 5oC добавляют 6,84 г (0,0485 моля) 4-хлорбутирилхлорида и перемешивают смесь еще в течение 30 минут при 5-10oC. После добавления 100 мл CH2Cl2 (чтобы ввести в раствор уже выпавший продукт) органические фазы отделяют и дважды промывают сначала 2N NaOH, а затем последовательно водой. После испарения растворителя остаток обрабатывают горячим диизопропиловым эфиром.
Выход: 13,6 г, т. пл. 178-180oC.
[α]
Аналитически рассчитано для C21H24ClNO5S
C 57,6; H 5,5; N 3,2;
Найдено: C 57,4; H 5,5; N 3,2.
(3S, 4R)-4-амило-3-гидрокси-2,2-диметил-6-фенилсульфонилхроман (+)-манделат и свободные основания.
198 г (0,59 молей) рацемического 4-амино-3-гидрокси-2,2-диметил-6-фенилсульфонилхромана и 90,28 г (0,59 молей) (+)-миндальной кислоты растворяют в 4,5 л горячего (60oC) абсолютного этанола. Затем проводят охлаждение до комнатной температуры в течение 2 часов. В случае если самопроизвольная кристаллизация не наступала, впрыскивают раствор 0,3 г оптически чистого конечного продукта. После этого выдерживают раствор в течение 48 часов при комнатной температуре и получающиеся при этом кристаллы отсасывают. Полученный материал с [α]
Выход: 81 г.
Т. пл. 203-204oC.
[α]
Аналитически рассчитано для C25H27NO7S:
C 61,8; H 5,6; N 2,9;
Найдено: С 62,1; H 5,7; N 3,0.
Соответствующие свободные основания получены тем, что манделат суспендировался в указанную смесь из 2-нормального NaOH и CH2Cl2. Т. пл. [α]
4-амино-3-гидрокси-2,2-диметил-6-фенилсульфонилхроман.
50 г (0,158) молей (4-амино-3-гидрокси-2,2-диметил-6-фенилсульфонилхромана, растворенного в 280 мл этанола, встряхивали в автоклаве при 70oC и давлении NH2 7 бар в течение 18 часов. После испарения растворителя остаток перекристаллизовывают из изопропанола. Выход: 39,9 г, т. пл. 166-167oC.
3,4-эпокси-2,2-диметил-6-фенилсульфонилхроман.
К 100 мл абсолютного диметилсульфоксида добавляют 1,8 г (0,06 молей) NaOH в виде 80%-ой суспензии в масле, а также по каплям 20 г 3,4-эпокси-2,2-диметил-6-фенилсульфонилхромана, растворенного в 80 мл диметилсульфоксиде при температуре 25-28oC. После 2-часового перемешивания при комнатной температуре смесь сливают при перемешивании в ледяную воду, а образующийся остаток отсасывают. При растворении сырого продукта в этиловом эфире уксусной кислоты и обработки активированным углем добивались дальнейшей очистки. После испарения растворителя остаток обрабатывают диизопропиловым эфиром до начала кристаллизации. Выход: 14,5 г, т. пл. 103-105oC.
3-бром-4-эпокси-2,2-диметил-6-фенилсульфонилхроман.
К 200 г 4-нитродифенилсульфона (0,76 молей) и 140 мл (1,45 молей) 2-метил-3-бутин-3-ола в 1,4 л диметилсульфоксида добавляли 100г твердых образований NaOH. Смесь перемешивают при комнатной температуре в течение 5 часов, причем добавив еще 50 мл 2-метил-3-бутин-3-ола после 2 часового перемешивания. Затем смесь сливают при перемешивании в 1,5 л диизопропилового эфира и 1 л H2O. Органическую фазу отделяют и трижды промывают водой. После испарения растворителя оставалось масло красноватого цвета. Методом хроматографии на кизельгеле можно получить небольшую пробу чистого вещества: 2-метил-3-(4-фенилсульфонил) фенокси-3-бутина с т. пл. 58-60oC.
Аналитически рассчитано для:
C17H16O3S
C 68,0; H 5,4;
Найдено: С 67,5; H 5,8.
Основное количество этого продукта без дальнейшей очистки растворяют в 800 мл 1,2-дихлорбензола и кипятят в течение 2 часов с обратным холодильником. После отгонки растворителя под вакуумом при 100oC получают темное масло, которое путем хроматографии на кизельгеле удалось очистить до 2,2-диметил-6-фенилсульфонилхромана с т. пл. 95-96oC.
Аналитически рассчитано для:
C17H16O3S
C 68,0; H 5,4;
Найдено: C 68,3; H 5,3.
Сырой продукт, полученный из этого соединения, растворяют в диметилсульфоксиде и 10 мл воды и при 15oC разбавляют 100,2 г N-бромсукцинимида, разделенного на небольшие порции. Смесь перемешивают в общей сложности в течение 5 часов, после чего выливают в ледяную воду. После экстракции с применением метилтретбутилового эфира получают сырой 3-бром-4-гидрокси-2,2-диметил-6-фенилсульфонилхроман, который выделяют в чистом виде при перемешивании в диизопропиловом эфире. Выход через 3 стадии 105,3 г, т. пл. 122-124oC.
Фармакологические данные:
а) микронизированные
890 г (3 S, 4R)-3-гидрокси-2,2-диметил-4-/2-оксо-1-пирролидинил/ -6-фенилсульфонилхроманэтанольного аддукта микронизуют в мельнице с использованием воздушной струи. Размер частиц после микронизации составляет 10 мкм для 50% частиц. При использовании (3S, 4R)-3-гидрокси-2,2-диметил- 4-/2-оксо-1-пирролидинил/-6-фенилсульфонилхромана или (3S, 4R)-гидрокси- 2,2-диметил-4-/2-оксо-1-пирролидинил/-6-фенилсульфонилхроман-полугидрата при данных условиях можно обойтись без перемалывания, поскольку продукты могут слипаться при введении в мельницу.
б) стабильность во фторуглеродах:
полученный в соответствии с п.а) микронизированный материал (3S, 4R)-3- гидрокси-2,2-диметил-4-/2-оксо-1-пирролидинил/-6-фенилсульфонилхроман- этанольного аддукта не изменяет размера своих частиц при суспендировании в фторуглеводороды в течение 8 дней.
в) бронхорасширяющее действие для наркотизированных морских свинок.
Микронизированный в соответствии с п. а) материал (3S, 4R)-3-гидрокси- 2,2-диметил-4-/2-оксо-1-пирролидинил/-6-фенилсульфонилхроман-этанольный аддукт суспендируют во фторуглеводороде и подают в дозировочную аэрозольную емкость. Концентрацию выбирают таким образом, что при одном нажатии кнопки баллончика выходит 0,1 мг или 1,0 мг вещества вместе с 0,5 мл фторхлоруглеводородов. При введении такого количества вещества морским свинкам, находящимся под наркозом под действием пентобарбитала (введение проводилось при использовании системы для нагнетания воздуха по методу Концетт-Расслера), отмечалось устойчивое сокращение бронхоспазмов, вызванных внутривенным давлением гистамина, которое составило через 30 минут n=2 или через 40 минут n= 3. При этом следует отметить, что вначале имело место полное торможение. Подробное описание метода дано в Европейской патентной заявке [3]
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА | 1993 |
|
RU2126378C1 |
| БЕНЗОПИРАНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2160735C2 |
| ПРОИЗВОДНЫЕ ХИНОЛОН- И НАФТИРИДОНКАРБОНОВОЙ КИСЛОТЫ В ВИДЕ СМЕСИ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫХ ИЗОМЕРОВ, ИХ ГИДРАТЫ И СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2105770C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПЕПТИДОВ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2047621C1 |
| 2-2-ДИАЛКИЛ- ИЛИ ТРАНС-2,2-ДИАЛКИЛ-3,4-ДИГИДРО-3-ГИДРОКСИ-6-(ПИРИДИН-4-ИЛ)-2Н-1-БЕНЗОПИРАН | 1992 |
|
RU2104277C1 |
| ПРОИЗВОДНЫЕ КАРБАМИНОВОЙ КИСЛОТЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2103271C1 |
| СПОСОБ ТОРМОЖЕНИЯ РЕТРОВИРУСНЫХ ПРОТЕАЗ | 1991 |
|
RU2028155C1 |
| Способ получения производных аминокислот или их физиологически совместимых солей | 1987 |
|
SU1836335A3 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА NK-3 | 2010 |
|
RU2561271C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ФОРМИЛБЕНЗИЛФОСФОНОВОЙ КИСЛОТЫ | 1990 |
|
RU2039063C1 |
Изобретение касается этанольных аддуктов соединений формулы 1, приведенной в описании, их получения, их применения в качестве средства для ингаляций при заболеваниях, в частности при астме. 4 с. п. ф-лы.
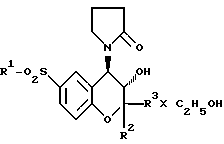
где R1 фенил;
R2 и R3 одинаковые или различные, метил или этил.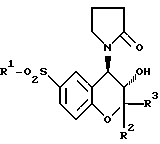
где R1, R2 и R3 имеют указанные значения,
или его с сольват подвергают контактированию с этанолом с последующей кристаллизацией и очисткой целевого продукта.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ЕР, патент, 176689, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ЕР, патент, 277612, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ЕР, патент, 351720, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ЕР, патент, 277611, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-01-20—Публикация
1992-12-14—Подача