Изобретение относится к синтезу новых химических соединений, в частности азопроизводных на основе 2,4,6-триаминотолуола, которые могут быть использованы в качестве красителей для натуральных и синтетических субстратов.
Известны аналоги моно- и дисазопроизводных на основе 2,4-диаминотолуола, например:
Basic Orange 1 (CI 11320)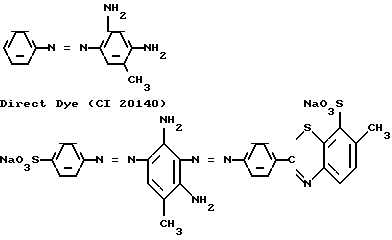
Известны аналоги моно- и дисазопроизводных на основе 1,3-фенилендиамина, например: Acid Dye (CI 20070)
Известен способ получения аналогов реакцией азосочетания замещенных азопроизводных на основе 1,3-фенилендиамина с ароматическими диазосоединениями /2/.
Наиболее близким по существу к предложенному способу является способ получения моно- и дисазопроизводных на основе 2,4-диаминотолуола, включающий стадию восстановления 2,4-динитротолуола до соответствующего амина с последующим азосочетанием с диазотированным анилином /3/.
В известных способах в качестве исходного сырья для получения азокрасителей используют динитропроизводные бензола, толуола. В связи с наличием запаса сырья 2,4,6-тринитротолуола (тротила) было целесообразно найти его применение.
Задача, которую решает изобретение, состоит в синтезе новых азокрасителей, получаемых путем химической утилизации тротила и обладающих свойствами, пригодными для окрашивания широкого круга субстратов.
Сущность изобретения согласно п.1 формулы изобретения заключается в том, что предложены моно- и дисазопроизводные на основе 2,4,6-ттриаминотолуола общей формулы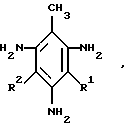
где R1 H, R2 арилазо- или R1 R2 арилазогруппа, где арилфенильный, нафтильный остатки, не замещенные или замещенные в ароматическом ядре группами: C1-C4-алкил, O - алкил, галоген, нитро-, сульфоарилазогруппа, в качестве азокрасителей.
Сущность изобретения заключается также в том, что предложен способ получения моно- и дисазопроизводных 2,4,6-триаминотолуола, включающий восстановление 2,4,6-тринитротолуола в 2,4,6-тринитроаминотолуола с последующим его азосочетанием с ароматическими диазосоединениями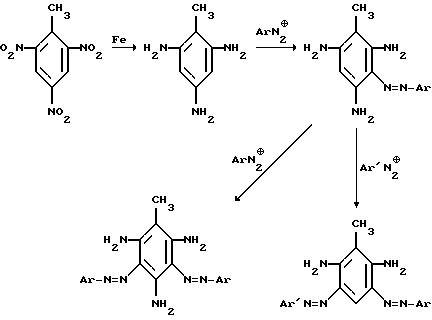
Моно- и дисазопроизводные на основе 2,4,6-триаминотолуола указанного строения синтезированы впервые. Наличие трех функциональных аминогрупп предполагает увеличение сродства красителей к ряду субстратов, например полиамиду. Присутствие двух о-аминоазогруппировок позволяет упрочнять выкраски путем металлизации (образование комплекса красителя с Me переходной группы).
Использование тротила в качестве исходного соединения для получения красителей неизвестно. Новое исходное соединение позволяет синтезировать три ряда красителей: моноазо-, симметричные и несимметричные дисазокрасители. Предложенный способ позволяет использовать для производства красителей тротил, получаемый при расснаряжении боеприпасов.
Неоднозначность взаимодействия 2,4,6-триаминотолуола с ароматическим диазосоединением заключается в том, что исходный триамин легко окисляется, а катионы диазония обладают выраженными окисляющими свойствами.
Показано, что образование азосоединения является основным процессом, и выход целевых соединений составляет не ниже 75%
Пример 1. 3-(Фенилазо)-2,4,6-триаминотолуол.
4,6 мл Анилина растворяют в 3,5 мл концентрированной серной кислоты с добавкой 25 мл воды. Раствор охлаждают до 2 5oC и приливают по каплям раствор 3,5 г нитрита натрия в 10 мл воды. Полученный диазораствор приливают при перемешивании при 2 5oC к раствору 4,13 г сульфата триаминотолуола в 100 мл воды и выдерживают 4 ч. Выпавший краситель отфильтровывают и промывают на фильтре водой до бесцветных промывных вод. Получают 5,7 г красителя с выходом 63% от теоретического. C13H15N5 М.м. 241,3. Вычислено, C 64,71; H 6,26; N 29,02. Найдено, C 64,83; H 5,52; N 28,78.
Пример 2. 3-(4-Сульфофенилазо)-2,4,6-триаминотолуол.
4,6 г Сульфанилата натрия растворяют в 25 мл воды, охлаждают льдом до 0oC и приливают 10 мл концентрированной соляной кислоты при перемешивании. В осадок выпадает белый кристаллический осадок свободной сульфанированной кислоты. К образовавшейся суспензии постепенно в течение 5-7 мин 7 мл 30%-ного раствора нитрита натрия. Суспензию диазосоединения перемешивают 15 мин, приливают ее к раствору 7,1 г сульфата триаминотолуола в 100 мл воды, охлажденному до 5-7oC, в течение 10-15 мин. Реакционную смесь перемешивают 5 ч и затем отфильтровывают краситель. Его промывают 50 мл холодной воды и сушит при 60oC. Выход 4,5 г (60% по сульфанилату натрия). Ca13H15N5O3S M.м 324,4. Вычислено, C 48,59; H 4,71; N 21,79. Найдено, C 47,81; H 4,36; N 21,08.
Пример 3. 3,5-Бис(фенилазо)-2,4,6-триаминотолуол.
4,6г (0,05 М) Анилина, 25 мл воды, 25 г льда помещают в стакан для диазотирования, добавляют при перемешивании 3,5 мл концентрированной серной кислоты. Прибавляют при 0oC раствор 3,5 г нитрида натрия в 10 мл воды в течение 15 мин, 5,3 г сернокислой соли триаминотолуола растворяют в 100 мл воды, отфильтровывают, охлаждают до 5oC. Диазораствор медленно приливают к раствору сернокислой соли триаминотолуола при перемешивании. Через 2 ч отфильтрованный осадок тщательно промывают водой до опускания в промывных водах следов диазосоединения (проба на вытяг с Аш-кислотой). Сушат при 50-60oC. Выход красителя 5,7 г (63% по анилину) с Tпл 219-223oC. C19H19N7 M.м. 345,4. Вычислено, C 66,07; H 5,54; N 28,38. Найдено, C 66,42; H 4,97; N 28,11.
Пример 4. 3,5-Бис-(4-метилфенилазо)-2,4,6-триаминотолуол.
2,14 г п-Толуидина растворяют в 10 мл 30%-ной соляной кислоты, 10 г льда, охлаждают до 5oC и медленно прибавляют раствор 1,4 г нитрида натрия в 10 мл воды. Перемешивают раствор 10 мин, 2,6 г сернокислой соли триаминотолуола растворяют в 50 мл воды, отфильтровывают, охлаждают до 5oC. К раствору медленно приливают раствор диазосоединения. Контролируют pH среды по индикаторной бумаге (pH 2). Перемешивают 2 ч. Отфильтровывают краситель, тщательно промывают водой до отсутствия следов диазосоединения (погиба на вытяг с Аш-кислотой). Получают 3,1 г (82% по п-толуидину) продукта с Tпл 214oC. C21H23N7 Вычислено, C 67,55; H 6,21; N 25,18. Найдено, C 67,42; H 6,01; N 25,02.
Пример 5. 3,5-Бис-(2-метоксифенилазо)-2,4,6-триаминотолуол.
Смесь 2,46 г (0,02 М) о-анизидина, 5 мл концентрированной соляной кислоты, 30 г льда, 20 мл воды, перемешивают, охлаждают до 0oC. Медленно прибавляют раствор 1,38 г нитрита натрия в 5 мл воды. Реакционную массу перемешивают 20 мин и приливают к предварительно отфильтрованному раствору 2,6 г сернокислой соли триаминотолуола в 25 мл воды. Через 15 мин добавляют ацетат натрия до pH 6. Реакционную массу перемешивают 1 ч, краситель отфильтровывают, промывают водой, сушат при 60oC. Выход продукта 2,95 (75% по о-анизидину) с Tпл 191oC. C21H23N7O2 M.м. 405,4. Вычислено, C 62,22; H 5,72; N 27,64. Найдено, C 61,87; H 5,34; N 27,13.
Пример 6. 3,5-Бис-(4-метоксифенилазо)-2,4,6-триаминотолуол.
К 3,7 г (0,02 М) акзотнокислого п-анизидина добавляют 10 мл воды, 10 мл концентрированной соляной кислоты, охлаждают льдом до 0oC. К раствору при 0oC при перемешивании прикапывают раствор 1,38 г нитрита натрия в 10 мл воды. Перемешивают 20 мин. Полученный раствор прибавляют к предварительно отформованному раствору 2,64 г сернокислой соли триаминотолуола в 25 мл воды. Раствор подщелачивают содой до pH 4-5. Реакционную массу перемешивают 1 ч. Краситель отфильтровывают, промывают водой, сушат. Выход продукта 3,2 г (80% по п-анизидину) с Tпл 234-235oC. C21H23N7O2 M.м. 405,4. Вычислено, C 62,22; H 5,72; N 27,64. Найдено, C 62,01; H 5,62; N 27,50.
Пример 7. 3,5-Бис-(п-хлорфенилазо)-2,4,6-триаминотолуол.
2,54 г (0,02 М) п-Хлоранилина растворяют в 10,5 мл 30% соляной кислоты, добавляют 30 г льда и при 0oC и перемешивании добавляют в течение 15 мин раствор 1,4 г нитрита натрия в 10 мл воды. Перемешивают 20 мин. Диазораствор медленно приливают к отфильтрованному раствору 2,64 г сернокислой соли триаминотолуола в 50 мл воды. Перемешивают реакционную массу 1 ч. Затем прибавляют ацетат натрия до pH 6. Образовавшийся осадок красителя отфильтровывают, промывают водой, сушат при 60oC. Выход красителя 2,9 г (72% по п-хлоранилину), Tпл 220oC с разложением. C19H17N7Cl2 M.м 413,3. Вычислено, C 55,22; H 4,14; N 23,72. Найдено, C 55,21; H 4,14; N 23,69.
Пример 8. 3,5-Бис-(нитрофенилазо)-2,4,6-триаминотолуол.
В круглодонной колбе с обратным холодильником нагревают смесь 6,8 г (0,049 М) п-нитроанилина и 30 мл соляной кислоты (1:1) при 90-100oC в течение 20-30 мин до полного растворения амина. Затем добавляют 70 мл холодной воды и раствор охлаждают на водяной бане до 0oC. В один прием вливают 17 мл 30% раствора нитрита натрия (0,05 М). Через 1 ч полученный диазораствор приливают в течение 20 мин к раствору 7,1 г сернокислой соли триаминотолуола в 50 мл воды, охлажденному до 5oC. Реакционную массу перемешивают 4 ч и отфильтровывают краситель, промывают его на фильтре 50 мл воды (3х16 мл воды) до отсутствия в промывных водах диазосоединений (проба на вытяг с Аш-кислотой). Сушат при 60oC. Выход 9,1 г (85,5% по п-нитроанилину), Tпл 300oC с разложением. C19H17N9O4 M.м. 435,4. Вычислено, C 52,41; H 3,94; N 28,95. Найдено, C 44,28; H 3,68; N 18,20.
Пример 9. 3,5-Бис-(4-сульфофенилазо)-2,4,6-триаминотолуол.
2,9 г Сульфанилата натрия растворяют в 50 мл воды, охлаждают льдом до 0oC и приливают 3 мл 50% серной кислоты. При перемешивании и охлаждении до 0oC добавляют в течение 10 мин 14 мл 30% раствора нитрита натрия. Полученную суспензию диазосоединения перемешивают 15 мин и приливают к раствору 7,1 г сернокислой соли триаминотолуола в 50 мл воды, охлажденному до 5-7oC. Время прибавления 15-20 мин. Реакционную массу перемешивают 5 ч, отфильтровывают краситель, промывают 50 мл холодной воды (3х17 мл). Сушат при 60oC. Выход 8,6 г (78,6% по сульфаниловой кислоте). C19H19N7O6S2 M.м. 505,5. Вычислено, C 45,14; H 3,79; N 19,40. Найдено, C 44,28; H 3,68; N 18,20.
Пример 10. 3,5-Бис-(4-сульфонафтилазо-1)-2,4,6-триаминотолуол.
Смесь 4,46 г (0,02 М) нафтионовой кислоты, 6 мл соляной кислоты, 50 мл воды нагревают при перемешивании до 30oC. При этой температуре прибавляют раствор 1,44 г нитрита натрия в 5 мл воды в течение 15 мин. Образовавшуюся суспензию перемешивают 1 ч. К предварительно отфильтрованному раствору 3,01 г сернокислой соли триаминотолуола в 50 мл воды добавляют при 10oC суспензию соли диазония. Реакционную массу перемешивают 2 ч, краситель отфильтровывают, отжимают, сушат при 50oC. Выход 4,3 г (60% коричневого продукта). C27H23N7O6S2 M. м. 605,6. Вычислено, C 53,53; H 3,8; N 16,18. Найдено, C 51,96; H 3,04; N 15,20.
Пример 11. 3,5-Бис-(нафтилазо-1)-2,4,6-триаминотолуол.
В стакан емкостью 0,25 л загружают 7,1 г (0,05 М) α- -нафтиламина и 50 мл 15% раствора соляной кислоты. Смесь, размешивая, нагревают до 80oC и приливают к ней 100 мл горячей воды. Раствор охлаждают до комнатной температуры, вносят 150 г льда и, размешивая, прибавляют 3 мл концентрированной соляной кислоты. В суспензию соли амина вливают раствор 3,5 г (0,05 М) нитрита натрия в 10 мл воды. Через 20 мин полученный диазораствор приливают в течение 20 мин к раствору 7,1 сернокислой соли триаминотолуола в 100 мл воды. Реакционную массу перемешивают 4 ч и отфильтровывают краситель, промывают его на фильтре 50 мл воды до отсутствия в промывных водах диазосоединения (проба с Аш-кислотой). Сушат при 60oC. Выход 9 г (80,9% по α- -нафтиламину). C27H21N6 M.м. 443,52. Вычислено, C 73,11; H 4,77; N 22,11. Найдено, C 72,98; H 5,02; N 21,90.
Пример 12. 3,5-Бис-[(4-сульфофенилазо)фенилазо-1] 2,4,6-триаминотолуол.
4 г (0,014 М) 4-Аминоазобензол-4-сульфокислоты суспендируют в 40 мл воды и нагревают до 30-32oC, добавляют 4 мл концентрированной соляной кислоты. При перемешивании добавляют 4 мл 40%-ного нитрида натрия. Температура диазотирования не должна превышать 35oC. Перемешивают 2 ч, затем разрушают избыток азотистой кислоты раствором мочевины. Полученную суспензию диазосоединения охлаждают до 0oC и медленно прибавляют раствор 2 г (0,007 М) сернокислой соли триаминотолуола в 100 мл воды. Реакционную массу с выпавшим коричневым осадком оставляют на ночь. Осадок отфильтровывают, промывают водой до отсутствия в промывных водах триаминотолуола (проба на вытяг с п-нитрофенилдиазонием). Сушат при 70oC. Выход 8,5 г (80% по азоамину) черного с бронзовым отливом продукта. C31H27N11O6S2 М.м. 713,7. Вычислено, C 52,17; H 3,78; N 21,58. Найдено, C 51,11; H 2,98; N 20,96.
Пример 13. 3,5-Бис-(4-бутилфенилазо)-2,4,6-триаминололуол.
Данный краситель получают по методике, описанной в примере 1, используя вместо анилина 0,05 М п-норм-бутиланилина. Выход составляет 6,84 г красителя (60% от теоретического). C27H35N7 М.м. 454,6. Вычислено, C 71,33; H 7,76; N 21,56. Найдено, C 71,21; H 7,34; N 21,87.
Пример 14. 3-(4-Нитрофенилазо)-5-(4-сульфенилазо)- 2,4,6-триаминотолуол.
Растворяют 10,4 г сульфанилата натрия в 55 мл воды, охлаждают до 0oC и приливают 20 мл конц. соляной кислоты. К образовавшейся суспензии при перемешивании и охлаждении (0 5oC) добавляют постепенно 15,8 мл 30% раствора нитрита натрия. Реакционную массу выдерживают 10 15 мин и приливают ее к раствору 16,2 г сульфата триаминотолуола в 150 мл воды в течение 20 мин. Дают выдержку 4 часа и добавляют при 10 15oC раствор п-нитрофенилдиазония, полученный диазотированием 6,8 г п-нитроанилина по методике, описанной в примере 8. После двух часов выдержки отфильтровывают краситель. Выход 18 г (80% от теоретического). C19H18N8O5S М. м. 470,46. Вычислено, C 48,51; H 3,85; N 20,84. Найдено, C 49,01; H 4,02; N 20,41.
Красители, содержащие сульфогруппы в арильном ядре азогруппы, пригодны для крашения шерсти как кислотные красители или для крашения хлопка как прямые красители. Устойчивость окраски данными красителями не уступает устойчивости окраски известными аналогичными красителями.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАЗОЛА И ЕГО СОЛЕЙ | 1997 |
|
RU2143427C1 |
| СОСТАВ ЦВЕТОПЛАМЕННОЙ БЕНГАЛЬСКОЙ СВЕЧИ | 1995 |
|
RU2087456C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ФЕНИЛ-4-АМИНОМАСЛЯНОЙ КИСЛОТЫ ИЛИ ХЛОРГИДРАТА 3-ФЕНИЛ-4-АМИНОМАСЛЯНОЙ КИСЛОТЫ | 2000 |
|
RU2166497C1 |
| СПОСОБ УТИЛИЗАЦИИ ПИРОКСИЛИНОВЫХ ПОРОХОВ В ПОЛИМЕРНУЮ ОСНОВУ ДЛЯ НИТРОЦЕЛЛЮЛОЗНЫХ ЛАКОКРАСОЧНЫХ МАТЕРИАЛОВ | 1999 |
|
RU2161633C1 |
| СРЕДСТВО ЗАЩИТЫ ЧЕРНЫХ МЕТАЛЛОВ ОТ КОРРОЗИИ | 1995 |
|
RU2102421C1 |
| СПОСОБ РАССНАРЯЖЕНИЯ БОЕПРИПАСОВ | 1992 |
|
RU2045744C1 |
| АБРАЗИВНО-ПОЛИУРЕТАНОВАЯ КОМПОЗИЦИЯ ДЛЯ ПОРИСТОГО ПОЛИРОВАЛЬНО-ШЛИФОВАЛЬНОГО ИНСТРУМЕНТА | 1994 |
|
RU2069143C1 |
| СПОСОБ ПРЕДПОСЕВНОГО ПРОТРАВЛИВАНИЯ СЕМЯН | 1999 |
|
RU2158071C1 |
| Полиазокрасители триазинового ряда для поливинилхлоридных и каучуковых материалов, целлюлозных, протеиновых и полиамидных волокон | 1974 |
|
SU657048A1 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВНЫХ НЕСИММЕТРИЧНЫХ АЗОКРАСИТЕЛЕЙ ДЛЯ ПРОТЕИНОВЫХ ВОЛОКОН И КОЖИ | 1970 |
|
SU286112A1 |
Назначение: азопроизводные на основе 2,4,6-триаминотолуола в качестве азокрасителей для натуральных и синтетических субстратов. Сущность изобретения: предложены новые моно- и дисазопроизводные на основе 2,4,6-триаминотолуола формулы, указанной в формуле изобретения, где R1=H, R2= арилазо- или R1=R2= арилазо-, где арил - фенильный, нафтильный остатки, не замещенные или замещенные в ароматическом ядре группами C1-C4-алкил, O-алкил, галоген, нитро-, сульфо-, арилазогруппа, в качестве азокрасителей. Способ их получения заключается в том, что 2,4,6-тринитротолуол подвергают восстановлению с последующим сочетанием полученного при этом 2,4,6-триаминотолуола с диазосоединением формулы: R-ArN≡N , где R означает H, C1-C4-алкил, O-алкил, галоген, нитро-, сульфо-, арилазогруппу. 2 с.п. ф-лы.
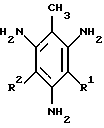
где R1 H;
R2 арилазо
или R1 R2 арилазо-, где арил фенильный, нафтильный остатки, не замещенные или замещенные в ароматическом ядре группами: С1-С4 алкил, О-алкил, галоген, нитро-, сульфо-, арилазогруппа,
в качестве азокрасителей.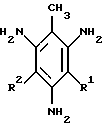
где R1 H;
R2 арилазо-
или R1 R2 арилазо-, где арил фенильный, нафтильный остатки, не замещенные или замещенные в ароматическом ядре группами: С1- С4-алкил, О-алкил, галоген, нитро-, сульфо-, арилазогруппа,
отличающийся тем, что 2,4,6-тринитротолуол подвергают восстановлению с последующим сочетанием полученного при этом 2,4,6-триаминотолуола с диазосоединением формулы
R-ArN ≡ N+,
где R Н, С1-С4-алкил, О-алкил, галоген, нитро-, сульфо-, арилазогруппу.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J | |||
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| DE, патент, 27714, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Ворожцов Н.Н | |||
| Двухступенное или многоступенное гидравлическое инжекционное устройство для сжатия воздуха и других газов, с применением насосов для постоянного поддержания циркуляции в нем жидкости | 1925 |
|
SU1955A1 |
Авторы
Даты
1998-01-20—Публикация
1994-09-30—Подача