Изобретение касается полипептида, найденного в яде паука Agelenopsis aperta, и полипептида, имеющего в основном ту же самую аминокислотную последовательность и ту же самую активность. Эти полипептиды и их фармацевтически приемлемые соли блокируют кальциевые каналы в клетках, в том числе в нейронных и мышечных клетках, многих организмов, включая беспозвоночных и позвоночных животных. Изобретение касается также применения этих полипептидов и их солей в блокировании кальциевых каналов в клетках, таких как клетки в нервной и мышечной системе организма, per se, и в лечении опосредованных кальциевыми каналами заболеваний и состояний у млекопитающих. Кроме того, данное изобретение касается композиций, содержащих эти полипептиды - их соли.
Соединения, являющиеся антагонистами кальция, имеют разнообразное применение. Антагонисты кальция могут иметь клиническое применение в лечении таких состояний, как ангина, гипертензия, кардиомиопатия, наджелудочковая экстрасистолия, эзофагеальная ахалазия, преждевременные роды, болезнь Рейно /симметричная гангрена/ и др. См. W.G. Nayler, Calcium Antagonists, Academic Press, Harcourt Brace Jovanovich Publishers, New Jork, N V 1888, на результаты которого здесь ссылаются. Кроме того, такие соединения применимы в исследовании физиологии клеток, таких как нейронные и мышечные клетки.
Другие полипептиды, выделенные из Agelenopsis aperta, описаны в U.S. Patent N 5122596.
Изобретение касается полипептида, обнаруженного в яде паука Angelenopsis aperta. Полипептид изобретения и фракция, в которой он присутствует, имеют следующие свойства.
Пептид J2 Agelenopsis имеет следующую аминокислотную последовательность, SEQ ID N 1.

Этот полипептид блокирует кальциевые каналы в клетках. Поэтому полипептид применим в блокировании кальциевых каналов в клетках, per se. Он применим также в борьбе с беспозвоночными вредителями и в лечении заболеваний и состоянии в млекопитающих, медиированных (опосредованных) функций кальциевых каналов в клетках.
В сфере действия данного изобретения находятся также полипептиды, которые имеют в основном ту же самую аминокислотную последовательность и в основном ту же самую блокирующую кальциевые каналы активность, что и описанный полипептид.
Данное изобретение касается также фармацевтических композиций, содержащих описанные полипептиды, и способов применения этих полипептидов.
Яд получен из паука Angelenopsis Aperta способом электростимуляции в соответствии со стандартными способами, хорошо известными специалистам данной области. Предпочтительно применять способ, который предотвращает загрязнение яда абдоминальной отрыгиваемой массой или гемолимфой. Такие способы хорошо известны специалистам. Цельный яд, полученный таким образом, хранили в замороженном состоянии приблизительно при -78oC до последующей очистки, описанной ниже. Очистку компонентов из цельного яда выполняли жидкостной хроматографией высокого разрешения с обращенной фазой (HPLC)/ на нескольких препаративных и полупрепаративных колонках, таких как C-4 и C-18 Vydac® колонках (Rainin Instrument Co. I n c., Mack Road, Woburn Massachusetts 01801). Детектирование пика проводили в монохроматическом свете при 220-230 нм. Дальнейший анализ этих фракций можно было проводить, например, с данными полихроматического УФ, полученными при помощи Waters 990 diode array detector (Millipore Corporation, Waters Chromtography Division, 34 Maple Street, Milford, Massachusetts 01757). Фракции из колонок собирали известными способами, например, при помощи коллектора фракций ISCO/"Foxy" и ISCO 2159 peak detector (ISCO, 4700 Superior, Lincoln, Nebraska 68504). Фракции собирали в сосуды подходящего размера, такие как стерильные полиэтиленовые лабораторные флаконы. Концентрирование фракций выполняли лиофизиацией из элюента с последующей лиофилизацией из воды. Чистоту полученных в результате фракций компонентов цельного яда можно было затем определить хроматографическим анализом с применением аналитической колонки с градиентной системой элюции, которая более точна, чем система, применяемая в окончательной очистке этих фракций.
Полипептид изобретения может быть секвенирован известными способами. Основная стратегия определения первичной структуры предусматривает, например, следующие стадии.
1) Восстановление и N-пиридилэтилирование связанных дисульфидными связями цистеиновых остатков для усиления субстратной чувствительности к ферментной атаке.
2) Контролируемое расщепление пептида при помощи одно- или многоступенчатого переваривания.
3) Выделение и очистка пептидных фрагментов с применением жидкостной хроматографии высокого разрешения (HPLC) с обращенной фазой.
4) Характеристика пептидных фрагментов путем N-концевого секвенирования и применения масс-спектрометрии с распылением ионов.
S-пиридилэтилирование цистеиновых остатков исследуемых полипептидов можно проводить, например, в растворе с последующим секвенированием аминокислот этих полипептидов. Одна из таких процедур S-пиридилэтилирования может быть выполнена, как описано ниже.
Приблизительно 1-10 мкг полипептида растворяли или разбавляли до 50 мкл буфера, приготовленного смешиванием 1 ч. 1 М Трис-HCI, pH 8,5 , содержащего 4 мМ ЭДТА, и 3 ч. 8 М гуанидина HCI. 2,5 мкл 10%-ного водного 2-меркаптоэтанола добавляли и смесь инкубировали при комнатной температуре в темноте под аргоном в течение 2 ч. После инкубации добавляли 2 мкл 4-винилпиридина ( свежего реагента, хранящегося под аргоном при -20oC) и смесь инкубировали еще в течение 2 ч при комнатной температуре в темноте под аргоном. Затем смесь обессоливали предпочтительно при помощи хроматографии на короткой колонке с обращенной фазой. Извлеченный алкилированный полипептид секвенировали затем известными способами.
Отдавая должное описанному здесь способу получения пептида, присутствующего во фракции J2 яда из Agelenopsis aperta, следует сказать, что в настоящее время можно получать этот пептид способами иными, чем выделение/очистка из цельного яда. Полипептиды данного изобретения могут быть получены при помощи способов рекомбинантной ДНК с применением клонирования кодирующей последовательности для этих полипептидов или их частей. Например, гибридизационные зонды, которые используют известную теперь информацию об аминокислотной последовательности описанного полипептида, могут быть применены в соответствии со способами, хорошо известными специалистам данной области, для клонирования кодирующей последовательности для всего полипептида. Сочетание способов рекомбинантных ДНК и синтез белка in vitro также может быть использовано для получения полипептидов данного изобретения. Такие способы синтеза белка in vitro включают (но не ограничены этим) применение твердофазного пептидного синтезатора ABI 430A (Applied Biosystems Inc., 850 Lincoln Center Drive, Foster City, California 94404) с применением стандартной Merrifield химии (химикалиев) или иных твердофазных химикалиев, известных специалистам.
Хорошо известно, что в полипептидах могут быть произведены замены определенных аминокислот, которые не влияют или почти не влияют на функцию этих полипептидов. Эти замены могут варьировать от полипептида к полипептиду. Определение допустимых замещений выполняют в соответствии со способами, хорошо известными специалистам. Таким образом, все полипептиды, имеющие в основном ту же самую аминокислотную последовательность и в основном ту же самую блокирующую кальциевые каналы активность, находятся в сфере действия данного изобретения.
Полипептиды данного изобретения блокируют кальциевые каналы, присутствующие во многих клетках, таких как клетки нервной и мышечной системы беспозвоночных и позвоночных.
Способность этих полипептидов блокировать кальциевые каналы демонстрируется при помощи следующей процедуры. Мозжечковые гранулярные клетки готовили из мозжечка 8-дневных крыс (Wilkin et al., Brain Res, 115, 181-199, 1976). Квадраты (1 см2) Aclar (Proplastics Inc., 5033 Industrial Ave., Wall, NJ 07719) покрывали поли-L-лизином и помещали в 12-луночные планшеты, которые содержали 1 мл минимальной среды Игла. Клетки мозжечка диссоциировали и пробы, содержащие 6,25•106 клеток, добавляли к каждой лунке, содержащей квадраты из Aclar. Цитозин-β-D-арабинофуранозид (конечная концентрация 10 мкМ) добавляли через 24 ч после засева. Эти клетки, присоединенные к квадратам из Aclar, использовали для анализа fura-2 на 6-ой, 7-ой и 8-ой дни культивирования. Их переносили на 12-луночные планшеты, содержащие 1 мл 2 мкМ fura 2 /AM/ Molecular Probes Inc., Eugene, OR 97402/ в HEPES - буфере, содержащем 0,01% бычьего сывороточного альбумина, 0,01% декстрозу, pH 7,4 без Mg. Клетки инкубировали в течение 40 мин при 37oC; furа2/AM-содержащий буфер удаляли и заменяли 1 мл того же буфера без Fura2/AM. В кварцевую кювету добавляли 2,0 мл предварительно нагретого (до 37oC) буфера. Клетки на Aclar помещали в эту кювету и кювету вставляли в термостатируемый (37oC) держатель, снабженный магнитной мешалкой, и флуоресценцию измеряли флуоресцентным спектрофотометром (Biomedical Instrument Group, University of Pennsylvania). Сигналу флуоресценции давали стабилизироваться в течение приблизительно 2 мин. Затем 5-20 мкл исходного раствора испытуемого соединения в забуференном фосфатом солевом растворе (PBS, pH 7,4) при подходящей концентрации добавляли в кювету. Калибровку флуоресцентных сигналов и коррекцию на потерю furа2/AM проводили при помощи установленных способов (Nemeth et al., J. Biol. Crem. 262, 5188, 1987) при завершении каждого теста. Величину максимальной флуоресценции (Fmax) определяли путем добавления иономицина (35 мкМ), а величину минимальной флуоресценции (Fmin) определяли последующим добавлением ЭГТА (12 мМ) для хелатирования кальция. При помощи описанной процедуры показано, что блокирование кальциевых каналов происходит, если при добавлении испытуемого полипептида наблюдается снижение флуоресценции. Полипептид данного изобретения обнаруживает низкие величины IC50, ниже 200 нм, в отношении блокирования кальциевых каналов при применении этого теста. Для сравнения два известных коммерческих антагониста кальциевых каналов, Nifedipine и Verapamil имеют величины IC50 33 нм и 4800 нм соответственно.
Полипептиды изобретения применимы в качестве блокаторов кальциевых каналов в клетках, per se. Как таковые эти полипептиды применимы также в борьбе с паразитами - беспозвоночными и в лечении заболеваний и состояний, опосредованных функцией кальциевых каналов в клетках млекопитающих, таких как ангина, гипертензия, кардиомиопатии, наджелудочковая экстрасистолия, эзофагеальная ахалазия, преждевременные роды и болезнь Рейно. Кроме того, эти полипептиды применимы в исследовании физиологии клеток, в том числе (но не только) клеток нервной и мышечной системы.
Также в сфере действия изобретения находятся фармацевтически приемлемые соли полипептидов данного изобретения. Такие соли получают известными в этой области способами. Например, основные соли этих полипептидов можно получить в соответствии с общепринятыми способами.
При введении полипептида данного изобретения в млекопитающее он может быть введен один или в комбинации с фармацевтически приемлемыми носителями или разбавителями в виде фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Полипептиды можно вводить перорально или парентерально, причем парентеральный путь введения является предпочтительным для полипептидов. Парентеральное введение включает внутривенное, внутримышечное, внутрибрюшинное, подкожное введение и топическое нанесение.
Для перорального применения полипептида данного изобретения соединение можно вводить, например, в виде таблеток или капсул или в виде водных растворов или суспензий. В случае таблеток для перорального применения обычно добавляют носители, которые обычно используют, в том числе лактозу и кукурузный крахмал, и смазывающие агенты, такие как стеаринат магния. Для перорального введения в виде капсул применимыми разбавителями являются лактоза и высушенный кукурузный крахмал. При применении для перорального введения водных суспензий активный ингредиент комбинируют с эмульгирующим и суспендирующим агентами. Если нужно, можно добавить подслащивающие агенты и/или ароматизаторы.
Для внутримышечного, внутрибрюшиного, подкожного и внутривенного применения обычно готовят стерильные растворы активного ингредиента и pH растворов должен быть доведен до определенного pH и поддерживаться буфером. Для внутривенного применения следует контролировать общую концентрацию растворенных веществ, чтобы препарат был изотоническим.
При применении полипептида или его соли для человека дневную дозу обычно определяет врач. Кроме того, доза будет варьировать в зависимости от возраста, веса и ответной реакции индивидуума, а также от тяжести симптомов больного и силы действия вводимого соединения.
При применении полипептида или его соли данного изобретения в борьбе с беспозвоночными - вредителями полипептид вводят в беспозвоночное непосредственно или в среду данного беспозвоночного. Например, соединение изобретения может быть распрыскано в виде раствора на это беспозвоночное. Количество соединения, необходимого для контроля беспозвоночного вредителя будет варьировать в соответствии с его видом и с условиями окружающей среды и должно определяться лицом, применяющим это соединение.
При применении полипептида или его соли по изобретению в физиологическом исследовании клеток полипептид вводят в клетки в соответствии с хорошо известными специалистам способами. Например, полипептид можно вводить в клетки в подходящем физиологическом буфере. Подходящей концентрацией полипептида для применения в таких исследованиях является концентрация 200 мкМ. Однако концентрация полипептида в таких исследованиях может быть более или менее 200 мкМ. Количество вводимого полипептида должно определяться лицом, квалифицированным в этой области, в соответствии с хорошо известными способами.
Пример 1. A. Неочищенный яд Agelenopsis aperta (≈ 40 мкл) наносили на колонку HPLC с обращенной фазой ( Vydac® C-18, 300 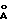 , 22х250 мм), действующую с применением двухфазной программы линейного градиента от 95% A и 5% B до 80% A и 20% B в течение 30 мин, затем до 30% A и 70% B в течение 25 мин (A = 0,1% трифторуксусная кислота и B = CH3CN) с детектированием при 220 нм и скоростью истечения 15 мл/мин. Желаемую фракцию собирали 38,3-38,7 мин. Объединенные подобные фракции из отдельных вариантов хроматографирования концентрировали лиофилизацией.
, 22х250 мм), действующую с применением двухфазной программы линейного градиента от 95% A и 5% B до 80% A и 20% B в течение 30 мин, затем до 30% A и 70% B в течение 25 мин (A = 0,1% трифторуксусная кислота и B = CH3CN) с детектированием при 220 нм и скоростью истечения 15 мл/мин. Желаемую фракцию собирали 38,3-38,7 мин. Объединенные подобные фракции из отдельных вариантов хроматографирования концентрировали лиофилизацией.
B. Материал из фракционирования стадии A, полученный из 100 мкл неочищенного яда, наносили на колонку HPLC с обращенной фазой Nydac® C-18, 300 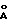 , 22х250 мм, действующую с применением программы линейного градиента от 77% A и 23% B до 70% A и 30% B в течение 25 мин (A = 0,1% трифторуксусная кислота и B = CH3C) с детектированием при 220 нм и скорости истечения 12 мл/мин. Желаемую фракцию собирали 17,3-17,7 мин. Объединенные подобные фракции из отдельных вариантов хроматографирования концентрировали лиофилизацией.
, 22х250 мм, действующую с применением программы линейного градиента от 77% A и 23% B до 70% A и 30% B в течение 25 мин (A = 0,1% трифторуксусная кислота и B = CH3C) с детектированием при 220 нм и скорости истечения 12 мл/мин. Желаемую фракцию собирали 17,3-17,7 мин. Объединенные подобные фракции из отдельных вариантов хроматографирования концентрировали лиофилизацией.
Структура пептида J2 была определена и проверена следующими способами. PTC - аминокислотный анализ проводили на 1-10 наномолях в трех повторностях при помощи системы Waters Pico-Tag. N-концевое секвенирование проводили в секвенаторе (ABI) как на нативном, так и на восстановленном пиридилэтилированном пептиде. Первичную структуру полипептида определяли при помощи автоматизированного pulse-liquid секвенаторе (Applied Biosystems, model 473A). Данные масс-спектрометрического анализа получали из времени десорбции BIO-ION плазмы flight-масс-спектрометра.
Пиридилэтилированное производное пептида J2, пригодное для N-концевого секвенирования получали следующим образом. Пептид J2 /50 мг/ растворяли в 10 мкл буфера (1:3 отношение 1 М триса, pH 8,4, 4 мкМ ЭДТА-двухосновного и 8 М гуанидингидрохлорида) и обрабатывали 2 мкл 0,454 M (10% об/об.) раствора - 2-меркаптоэтанола в буфере и хранили в течение 3 ч в темноте при комнатной температуре. Затем реакционную смесь обрабатывали 2 мкл 0,456 М раствора 4-винилпиридина в буфере и хранили при комнатной температуре в темноте в течение 18 ч. Реакционную смесь разбавляли 90 мкл воды и 40 мкл ацетонитрила и наносили на колонку HPLC (Baker WPC-18, 4,6х250 мм), действующую с применением двухфазной программы линейного градиента 80% A и 20% B в течение 5 мин, затем 80% - 50% A и 29% - 50% B в течение 30 мин (A = трифторуксусная кислота , B = CH3CN) с детектированием при 220 нм и скорости истечения 1,0 мл/мин. Желаемую фракцию собирали при 20,8-21,3 мин и концентрировали лиофилизацией.
Данные, рассмотренные вместе, подтверждают показанную структуру пептида J2.
SEQ ID N 1 : 48 остатков, 10 цистеинов, 5 дисульфидных связей.
Рассчитанная масса = 5474,4
Наблюдаемая масса = 5474.
Оцененная pI = 7,98
Последовательность
/I/ Основная информация
/i/ Заявитель
/A/ Название: Pfizer Inc.
/B/ Улица: 235 East 42 nd Street
/C/ Город: New Jork
/D/ Штат: New Jork
/E/ Страна U.S.A.
/F/ Почтовый код: (ZIP) : 10017
/G/ Телефон: (203) 441-4905
/H/ Телефакс: (203) 441-5221
/A/ Название: NPS Pharmaceuticals, Inc.
/B/ Улица: 420 Chipeta Way
/C/ Город: Salt Lake City
/D/ Штат: Utah
/E/ Страна: U.S.A.
/F/ Почтовый код:(ZIP) : 84108
/G/ Телефон: (801) 583-4939
/H/ Телефакс: (801) 583-4961
/II/ Название изобретения: Полипептид из Agelenopsis aperta, блокирующий кальциевые каналы
/III/ Число последовательностей: 1
/IV/ Форма, считываемая компьютером:
/A/ Тип носителя: Floppy disk
/B/ Компьютер: IBM PC-совместимый
/C/ Операционная система: PC-DOS/MS-DOS
/D/ Программное обеспечение: Patent In Release N 1,0 Versio N 1,25 (EPO)
/VI/ Данные предыдущей заявки:
/A/ Номер заявки: US 07/919538
/B/ Дата представления: 27 июля 1992
/2/ Информация для SEQ ID N 1:
/I/ Характеристика последовательности:
/A/ Длина: 48 аминокислот
/B/ Тип: аминокислота
/C/ Количество цепей: одна
/D/ Топология: линейная
/II/ Тип молекулы: белок
/VI/ Исходный источник:
/A/ Организм: Agelenopsis aperta
/F/ Тип ткани: яд р
р
Cущность: полипептид, выделенный из яда паука Angelenopsis Aperta, блокирует кальциевые каналы в клетках многих организмов и применим для блокирования кальциевых каналов в самих клетках, для лечения заболеваний, обусловленных состоянием кальциевых каналов и для борьбы с беспозвоночными-вредителями.
Полипептид формулы
H2N Glu Ala Cys Ala Gly Ala Tyr Lys Ser Cys - Asp Lys Val Lys Cys Cys His Asp Arg Arg Cys Arg Cys Asn Ile Ala Met Asp Asn Cys Val Cys Lys Leu Phe Tyr Cys Glu Leu Phe Gly Thr Cys Asp Arg Leu Lys Pro OH
или его фармацевтически приемлемые соли.
Авторы
Даты
1998-02-10—Публикация
1993-06-10—Подача