Область изобретения
Изобретение относится к получению, разработке, композиции и применению соединений, способных модулировать одну или несколько активностей рецептора неорганического иона.
Предпосылки изобретения
Определенные клетки в теле реагируют не только на химические сигналы, но также на ионы, такие как внеклеточные ионы кальция (Ca2+). Изменения концентрации внеклеточного Са2+ (обозначаемой здесь как "[Ca2+]") изменяют функциональные ответные реакции этих клеток. Одной из таких специализированных клеток является клетка паращитовидной железы, секретирующая паратиреоидный гормон (паратгормон) (РТН). РТН является главным эндокринным фактором, регулирующим гомеостаз Са2+ в крови и внеклеточных жидкостях.
РТН путем действия на костные клетки и клетки почек, увеличивает уровень Ca2+ в крови. Это увеличение [Са2+] действует затем как отрицательный сигнал обратной связи, подавляющий секрецию РТН. Реципрокное взаимоотношение между [Са2+] и секрецией РТН образует основной механизм поддержания гомеостаза Са2+ в теле.
Внеклеточный Са2+ действует непосредственно на клетки паращитовидной железы, регулируя секрецию РТН. Было подтверждено существование белка на поверхности клетки паращитовидной железы, который обнаруживает изменения в [Са2+] . Brown et al., 366 Nature 574, 1993. В клетках паращитовидной железы этот белок действует как рецептор внеклеточного Са2+ ("кальциевый рецептор"), обнаруживает изменения в [Ca2+] и инициирует функциональный клеточный ответ, секрецию РТН.
Внеклеточный Ca2+ может оказывать действие на различные клеточные функции, что описано в обзоре Nemeth et al., 11 Cell Calcium 319, 1990. Роль внеклеточного Са2+ в парафолликулярных клетках (С-клетках) и в клетках паращитовидной железы обсуждается в Nemeth, 11 Cell Calcium 323, 1990. Было показано, что эти клетки экспрессируют подобный рецептор Са2+. Brown et al., 366 Nature 574, 1993; Mithal et al., 9 Suppl. 1 J. Bone and Mineral Res. s282. 1994; Rogers et al., 9 Suppl. 1 J. Bone and Mineral Res. s409. 1994; Garrett et al., 9 Suppl. 1 J. Bone and Mineral Res. s409. 1994. Влияние внеклеточного Са2+ на остеокласты обсуждается Zaidi, 10 Bioscience Reports 493. 1990. Кроме того, кератиноциты, юкстагломерулярные клетки, трофобласты, панкреатические бета-клетки и жировые клетки (липоциты) все реагируют на увеличения в уровнях внеклеточного кальция, что, по-видимому, отражает активацию рецепторов кальция этих клеток.
Способность различных соединений имитировать внеклеточный Са2+ in vitro обсуждается Nemeth et.al., (спермина и спермидина) в "Calcium-Binding Proteins in Health and Disease", 1987, Academic Press, Inc., pp. 33-35; Brown et al. , (например, неомицина) 128 Endocrinology 3047, 1991; Chen et al., (диатезема и его аналога ТА-3090) 5 J. Bone and Mineral Res. 581, 1990; и Zaidi et al. , (верапамила) 167 Biochem. Biophvs. Res. Commun. 807, 1990. Nemeth et al., PCT/US93/01642, International Publication Number WO 94/18959 и Nemeth et al. , PCT/US92/07175, International Publication Number WO 93/04373, описывают различные соединения, которые могут модулировать действие неорганического иона на клетку, имеющую рецептор неорганического иона.
Ссылки, представленные в "предпосылках изобретения" не являются прототипом данного изобретения.
Сущность изобретения
Данное изобретение описывает соединения, способные модулировать одну или несколько активностей рецептора неорганического иона, и способы лечения заболеваний и расстройств путем модулирования активности рецептора неорганического иона. Предпочтительные соединения могут имитировать или блокировать действие внеклеточного кальция на рецептор кальция на поверхности клетки.
Заболевания или расстройства, которые можно лечить модулированием активности рецептора неорганического иона, включают в себя одно или несколько заболеваний или расстройств следующих типов: (1) характеризующиеся аномальным гомеостазом неорганического иона, предпочтительно, гомеостазом кальция; (2) характеризующиеся аномальным количеством внеклеточного или внутриклеточного мессенджера, на продуцирование которого может влиять активность рецептора неорганического иона, предпочтительно, активность кальциевого рецептора; (3) характеризующиеся аномальным действием (например, действием, отличающимся по типу или по силе) внутриклеточного или внеклеточного мессенджера, который может быть сам ослаблен активностью рецептора неорганического иона, предпочтительно, активностью кальциевого рецептора; и (4) другие заболевания или расстройства, в которых модуляция активности рецептора неорганического иона, предпочтительно, активности кальциевого рецептора, будет оказывать благотворное действие, например, в заболеваниях или расстройствах, при которых образование внутриклеточного или внеклеточного мессенджера, стимулируемое рецепторной активностью, компенсирует аномальное количество отличного мессенджера. Примерами внеклеточных мессенджеров, на секрецию и/или действие которых может влиять модулирование активности рецептора неорганического тона, являются неорганические ионы, гормоны, нейротрансмиттеры, факторы роста и хемокины. Примеры внутриклеточных мессенджеров включают цАМФ, цГМФ, IР3 (инозинфосфат) и диацилглицерин.
Таким образом, соединение данного изобретения предпочтительно модулирует активность рецептора кальция и применимо в лечении заболеваний или расстройств, на которые можно подействовать модуляцией одной или нескольких активностей рецептора кальция. Белки рецептора кальция позволяют некоторым специализированным клеткам отвечать на изменения в концентрации внеклеточного Са2+. Например, внеклеточный Са2+ ингибирует секрецию паратиреоидного гормона из клеток паращитовидной железы, ингибирует резорбцию костной ткани остеокластами и стимулирует секрецию кальцитонина из С-клеток.
В предпочтительном варианте изобретения соединение используют для лечения заболевания или расстройства, характеризующегося аномальным костным и минеральным гомеостазом, более предпочтительно, гомеостазом кальция. Внеклеточный Са2+ находится под жестким гомеостатическим контролем и контролирует многочисленные процессы, такие как свертывание крови, нервная и мышечная возбудимость и правильное костеобразование. Аномальный гомеостаз кальция характеризуется одной или несколькими из следующих активностей: (1) аномальное увеличение или уменьшение кальция в сыворотке; (2) аномальное увеличение или уменьшение кальция в выделившейся моче; (3) аномальное увеличение или уменьшение в уровнях кальция в костях, например, согласно оценке посредством измерений минеральной плотности костей; (4) аномальное поглощение кальция из пищи; (5) аномальное увеличение или уменьшение образования и/или высвобождения мессенджеров, которые влияют на уровень кальция в сыворотке, таких как паратиреоидный гормон и кальцитонин; и (6) аномальное изменение ответа, вызываемого мессенджерами, влияющими на уровни кальция в сыворотке. Такое аномальное увеличение или уменьшение этих различных аспектов гомеостаза кальция связано с увеличением или уменьшением, имеющим место в общей популяции, и обычно связано с заболеванием или расстройством.
Заболевания и расстройства, характеризующиеся аномальным гомеостазом кальция, могут быть обусловлены различными клеточными дефектами, такими как нарушенная активность кальциевого рецептора, нарушенное число рецепторов кальция или нарушенный внутриклеточный белок, на который действует кальциевый рецептор. Например, в клетках паращитовидной железы кальциевый рецептор связан с G1-белком, который, в свою очередь, ингибирует образование циклического АМФ. Нарушения в G1-белке могут влиять на его способность ингибировать образование циклического АМФ.
Таким образом, первый аспект данного изобретения касается соединения, модулирующего рецептор неорганического иона, имеющего формулу: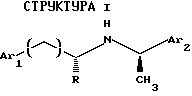
где Ar1 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых, независимо, выбран из группы, состоящей их низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, CH2OH, CONH2, CN, ацетокси, N(СН3)2, фенила, фенокси, бензила, бензилокси, α,α-диметилбензила, NO2, CHO, СН3СН(ОН), ацетила, этилендиокси;
Аr2 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых, независимо, выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2ОН, CONH2, CN и ацетокси;
q равно 0, 1, 2 или 3; и
R обозначает Н или низший алкил;
и его фармацевтически приемлемых солей и комплексов.
Соединения данного изобретения имеют предпочтительную стереохимию. СН3, показанный в Структуре I, находится в хиральном центре и обеспечивает α-(R)-метильную структуру. Когда R представляет СН3; R, показанный в Структуре I, также находится в хиральном центре, что обеспечивает (R)-метильную структуру. Таким образом, когда R представляет СН3, соединения Структуры I имеют (R,R)-стереохимию.
Активности рецептора неорганического иона представляют собой те процессы, которые являются результатом активации рецептора неорганического иона. Такие процессы включают в себя образование молекул, которые действуют как внутриклеточные или внеклеточные мессенджеры.
Соединениями, модулирующими рецептор неорганического иона, могут быть иономиметики, ионолитики, кальцимеметики и кальцилитики. Иономиметиками являются соединения, которые связываются с рецептором неорганического иона и имитируют (т. е. индуцируют или потенциируют) эффекты неорганического иона при рецепторе неорганического иона. Предпочтительно, такое соединение действует на одну или несколько активностей кальциевого рецептора. Кальцимиметиками являются иономиметики, которые действуют на одну или несколько активностей кальциевого рецептора и связываются с кальциевым рецептором.
Ионолитиками являются соединения, которые связываются с рецептором неорганического иона и блокируют (т.е. ингибируют или уменьшают) одну или несколько активностей, вызываемых неорганическим ионом при рецепторе неорганического иона. Предпочтительно, это соединение действует на одну или несколько активностей кальциевого рецептора. Кальцилитиками являются ионолитики, которые блокируют одну или несколько активностей кальциевого рецептора, индуцируемых внеклеточным кальцием, и связываются с кальциевым рецептором.
Иономиметики и ионолитики могут связываться при том же сайте рецептора, при котором связывается нативный лиганд неорганического иона, или они могут связываться при другом сайте (например, аллостерическом сайте). Например, NPS R-467, связывающийся с кальциевым рецептором, приводит к активности кальциевого рецептора и, следовательно, NPS R-467 классифицируется как кальцимиметик. Однако NPS R-467 связывается с кальциевым рецептором при отличающемся сайте (т.е. аллостерическом сайте) по сравнению с сайтом связывания внеклеточного кальция.
Степень эффективности соединения может быть определена расчетом ЕС50 или IC50 для такого соединения. EC50 представляет собой концентрацию соединения, вызывающую половину максимального имитирующего действия. IC50 представляет собой концентрацию соединения, вызывающую половину максимального блокирующего действия. ЕС50 и IC50 для соединений при кальциевом рецепторе можно определить анализом одной или нескольких активностей внеклеточного кальция при кальциевом рецепторе. Примеры таких тестов для измерения EC50 и IC50 описаны Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959 и Nemeth et.al., PCT/US92/07175. International Publication Number WO 93/04373, (обе эти публикации включены сюда в качестве ссылок) и ниже. Такие тесты включают в себя тесты экспрессии ооцитов и измерение увеличения концентрации ионов внутриклеточного кальция ([Са2+]i), вызываемого активностью кальциевого рецептора. Предпочтительно, в таких тестах измеряют высвобождение или ингибирование определенного гормона, связанное с активностью кальциевого рецептора.
Соединение, модулирующее рецептор неорганического иона, предпочтительно избирательно нацелено на активность рецептора неорганического иона в конкретной клетке. Например, избирательное нацеливание на активность кальциевого рецептора достигается соединением, оказывающим большее воздействие на активность кальциевого рецептора в одном типе клетки, чем в другом типе клетки, при данной концентрации соединения. Предпочтительно, существует 10-ти или более кратное различие в действии, как измерено in vivo или in vitro. Более предпочтительно этот дифференциальный эффект измеряют in vivo и концентрацию соединения измеряют как концентрацию в плазме и измеряемым действием является образование внеклеточных мессенджеров, таких как кальцитонин плазмы, паратиреоидный гормон или кальций плазмы. Например, в предпочтительном варианте, соединение избирательно нацелено на секрецию РТН по сравнению с секрецией кальцитонина.
Предпочтительно такое соединение является либо кальцимиметиком, либо кальцилитиком, имеющим EC50 или IС50 в отношении кальциевого рецептора менее или равные 5 мкМ или даже, более предпочтительно, менее или равные 1 мкМ, 100 нМ, 10 нМ или 1 нМ, измеренные в тестах, описанных ниже. Более предпочтительно, в таком тесте измеряют внутриклеточный Ca2+ в клетках НЕК 293, трансформированных нуклеиновой кислотой, экспрессирующей человеческий кальциевый рецептор паращитовидной железы, и нагруженных fura-2. Более низкие величины ЕС50 и IC50 являются предпочтительными, так как они позволяют использовать более низкие концентрации соединений in vivo и in vitro. Обнаружение соединений с низкими EC50 и IC50 позволяет конструировать и синтезировать дополнительные соединения, имеющие сходную или улучшенную потенцию, эффективность и/или избирательность.
Другой аспект данного изобретения касается соединения, модулирующего рецептор неорганического иона, имеющего формулу: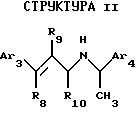
где Аr3 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых, независимо, выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкоси, ОН, СН2ОН, CONH2, CN, ацетокси, бензила, бензилокси, α,α-диметилбензила, NO2, СНО, СН3СН(ОН), N(СН3), ацетила, этилендиокси.
Аr4 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых, независимо, выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN и ацетокси;
R8 обозначает водород или фенил;
R9 обозначает водород или метил; и
R10 обозначает водород, метил или фенил;
или его фармацевтически приемлемых солей и комплексов.
Другой аспект данного изобретения касается соединения, модулирующего рецептор неорганического иона, имеющего формулу: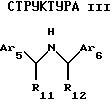
где Аr5 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых независимо выбран из группы. состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN, ацетокси, бензила, бензилокси, α,α-диметилбензила, NO2, СНО, СН3СН(ОН), ацетила, этилендиокси, -СН=СН-фенила;
Аr6 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из ацетила, низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN, карбометокси, ОСН2С(O)С2Н5 и ацетокси;
R11 обозначает водород или метил; и
R12 обозначает водород или метил.
Другой аспект данного изобретения касается фармацевтической композиции, включающей соединение, модулирующее рецептор неорганического иона, описанное здесь, и физиологически приемлемый носитель. "Фармацевтической композицией" называют композицию в форме, пригодной для введения млекопитающему, предпочтительно человеку. Предпочтительно, фармацевтическая композиция содержит достаточное количество соединения, модулирующего кальциевый рецептор, в подходящей фармацевтической форме для проявления терапевтического действия на человека.
Условия, в соответствии с которыми выбирают формы, пригодные для введения, известны в данной области и включают в себя токсическое действие, растворимость, способ введения и сохранение активности. Например, фармацевтические композиции, инъецируемые в кровоток, должны быть растворимыми.
Фармацевтические композиции могут быть также приготовлены с использованием фармацевтически приемлемых солей соединений (например, кислотно-аддитивных солей) и их комплексов. Использование таких солей может облегчать фармакологическое применение соединения вследствие изменения его физических свойств без изменения проявляемого им физиологического действия.
Другой аспект данного изобретения касается способа лечения больного путем модулирования активности рецептора неорганического иона при помощи описанных здесь соединений, модулирующих рецептор неорганического иона. Способ предусматривает введение больному фармацевтической композиции, содержащей терапевтически эффективное количество соединения, модулирующего рецептор неорганического иона. В предпочтительном варианте заболевание или расстройство лечат путем модулирования активности кальциевого рецептора введением больному терапевтически эффективного количества соединения, модулирующего кальциевый рецептор.
Соединения, модулирующие рецептор неорганического иона, и содержащие эти соединения композиции можно использовать для лечения больных. "Больным" называют млекопитающее, у которого модулирование рецептора неорганического иона оказывает благотворное действие. Больные, нуждающиеся в лечении, включающем в себя модулирование рецепторов неорганических ионов, могут быть идентифицированы при помощи стандартных способов, известных специалистам-медикам.
Предпочтительно, больным является человек, имеющий заболевание или расстройство, характеризующееся одним или несколькими из следующих признаков: (1) аномальный гомеостаз неорганического иона, более предпочтительно, аномальный гомеостаз кальция; (2) аномальный уровень мессенджера, на образование или секрецию которого влияет активность рецептора неорганического иона, более предпочтительно, влияет активность кальциевого рецептора; и (3) аномальные уровень или активность мессенджера, на функцию которого влияет активность рецептора неорганического иона, более предпочтительно, влияет активность кальциевого рецептора.
Заболевания, характеризующиеся аномальным гомеостазом кальция включают гиперпаратиреоз, остеопороз и другие костные и связанные с минерализацией расстройства и т.п. (описанные, например, в стандартных медицинских учебниках, таких как "Harrison's Principles of Internal Medicine"). Такие заболевания лечат при помощи соединений, модулирующих кальциевый рецептор, которые имитируют или блокируют одно или несколько действий внеклеточного Са2+ на кальциевый рецептор и тем самым прямо или косвенно влияют на уровни белков или других соединений в теле больного.
Под "терапевтически эффективным количеством" подразумевают количество соединения, которое, до некоторой степени, ослабляет один или несколько симптомов заболевания или расстройства у больного; или возвращает к норме, частично или полностью, один или несколько физиологических или биохимических параметров, связанных с этим заболеванием или расстройством или вызывающих это заболевание или расстройство.
В предпочтительном варианте, больной имеет заболевание или расстройство, характеризующееся аномальным уровнем одного или нескольких регулируемых кальциевым рецептором компонентов и данное соединение активно в отношении кальциевого рецептора клетки, выбранной из группы, состоящей из: клетки паращитовидной железы, костного остеокласта, юкстагломерулярной почечной клетки, почечной клетки проксимального канальца, почечной клетки дистального канальца, клетки центральной нервной системы, клетки периферической нервной системы, клетки толстой восходящей части петли Генле и/или собирающего протока, кератиноцита в эпидермисе, парафолликулярной клетки в щитовидной железе (С-клетки), клетки кишечника, тромбоцита, клетки гладких мышц сосудов, клетки предсердной артерии, секретирующей гастрин клетки, секретирующей глюкагон клетки, почечной мезанглиальной клетки, бета-клетки, жировой клетки/липоцита, иммунной клетки, клетки желудочно-кишечного тракта, кожной клетки, клетки надпочечника, гипофизарной клетки, клетки гипоталамуса и клетки субфорникального органа.
Более предпочтительно, клетки выбраны из группы, состоящей из: клетки щитовидной железы, клетки центральной нервной системы, клетки периферической нервной системы, клетки толстой восходящей части петли Генле и/или собирающего протока в почках, парафолликулярной клетки в щитовидной железе (С-клетки), клетки кишечника, клетки желудочно-кишечного тракта, гипофизарной клетки, клетки гипоталамуса и клетки субфорникального органа.
В предпочтительном варианте соединение является кальцимиметиком, действующим на кальциевый рецептор клетки щитовидной железы, и уменьшает уровень паратиреоидного гормона в сыворотке больного. Более предпочтительно, этот уровень снижается до степени, достаточной для уменьшения количества Са2+ в плазме. Наиболее предпочтительно, уровень паратиреоидного гормона снижается до уровня у нормального (здорового) индивидуума.
В другом предпочтительном варианте соединение является кальцилитиком, действующим на кальциевый рецептор клетки паращитовидной железы, и увеличивает уровень паратиреоидного гормона в сыворотке больного. Более предпочтительно, этот уровень увеличивается до степени, достаточной для увеличения минеральной плотности костей больного.
Больные, требующие такого лечения, могут быть идентифицированы стандартными медицинскими способами, такими как анализ крови или мочи. Например, путем обнаружения недостатка белка, на образование или секрецию которого влияют изменения в концентрациях неорганических ионов, или путем обнаружения аномальных уровней неорганических ионов или гормонов, влияющих на гомеостаз неорганических ионов.
В данной заявке используют многочисленные примеры. Эти примеры не предназначены для какого-либо ограничения объема данного изобретения.
Другие особенности и преимущества данного изобретения будут очевидными из следующих далее чертежей, подробного описания данного изобретения, примеров и формулы изобретения.
Краткое описание чертежей
Фиг. la-1r показывают химическую структуру различных соединений.
Фиг. 2-131 представляют физические данные для характерных соединений настоящего изобретения.
Описание предпочтительных вариантов изобретения
Данное изобретение касается соединений, способных модулировать одну или несколько активностей рецептора неорганического иона, предпочтительно, это соединение может имитировать или блокировать действие внеклеточного иона на клетке, имеющей рецептор неорганического иона, более предпочтительно, внеклеточный ион является Са2+ и это действие имеет место на клетке, имеющей кальциевый рецептор. Публикации, касающиеся активности кальция, рецептора кальция и/или соединений, модулирующих кальциевый рецептор, включают в себя следующие публикации: Brown et.al., Nature 366: 574, 1993; Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959; Nemeth et.al., PCT/US92/07175, International Publication Number WO 93/04373; Shoback and Chen, J. Bone Mineral Res. 9: 293 (1994); и Racke et.al., FEBS Lett. 333: 132, (1993). Эти публикации не являются прототипом заявленного изобретения.
I. Кальциевые рецепторы
Рецепторы кальция присутствуют на различных типах клеток и имеют различные активности в различных типах клеток. Фармакологическое действие следующих клеток, в ответ на кальций, согласуются с присутствием рецептора кальция: клетки паращитовидной железы, костного остеокласта, юкстагломерулярной почечной клетки, клетки проксимального почечного канальца, клетки дистального почечного канальца, клетки центральной нервной системы, клетки периферической нервной системы, клетки толстой восходящей части петли Генле и/или собирающего протока, кератиноцита в эпидермисе, парафолликулярной клетки щитовидной железы (С-клетки), кишечной клетки, тромбоцита, клетки гладких мышц сосудов, предсердной клетки, секретирующей гастрин клетки, секретирующей глюкагон клетки, почечной мезанглиальной клетки, клетки молочной железы, бета-клетки, жировой клетки/липоцита, иммунной клетки, клетки желудочно-кишечного тракта, кожной клетки, клетки надпочечника, гипофизарной клетки, клетки гипоталамуса и клетки субфорникального органа. Кроме того, присутствие кальциевых рецепторов на клетке паращитовидной железы, клетке центральной нервной системы, клетке периферической нервной системы, клетке толстой восходящей части петли Генле и/или собирающего протока в почках, парафолликулярной клетке в щитовидной железе (С-клетке), кишечной клетке, клетке желудочно-кишечного тракта, гипофизарной клетке, клетке гипоталамуса и клетке субфорникального органа было подтверждено физическими данными.
Кальциевые рецепторы на этих различных типах клеток могут быть различными. Возможно также, что клетка может иметь более одного типа кальциевых рецепторов. Сравнение активностей кальциевого рецептора и его аминокислотных последовательностей из различных клеток показывает, что существуют различные типы кальциевых рецепторов. Например, рецепторы кальция могут реагировать на множество двух- и трехвалентных катионов. Кальциевый рецептор паращитовидной железы реагирует на кальций и на Gd3+, тогда как остеокласты реагируют на двухвалентные катионы, такие как кальций, но не реагируют на Gd3+. Таким образом, кальциевый рецептор паращитовидной железы фармакологически отличается от кальциевого рецептора на остеокласте.
С другой стороны, последовательности нуклеиновых кислот, кодирующих кальциевые рецепторы, присутствующие в клетках паращитовидной железы и в С-клетках, указывают на то, что эти рецепторы имеют очень похожую аминокислотную структуру. Тем не менее, кальцимиметические соединения имеют различную фармакологию и регулируют различные активности в клетках паращитовидной железы и С-клетках. Таким образом, фармакологические свойства кальциевых рецепторов могут значительно изменяться в зависимости от типа клетки или органа, в которых они экспрессируются, даже если кальциевые рецепторы могут иметь похожие или даже идентичные структуры.
Кальциевые рецепторы, в общем, имеют низкое сродство к внеклеточному Ca2+ (видимая Кd обычно более приблизительно 0,5 мМ). Кальциевые рецепторы могут включать механизм свободного или связанного эффектора, описанный Cooper, Bloom and Roth, "The Biochemical Basis ofNeuropharmacology", Ch. 4, и, таким образом, отличаются от внутриклеточных рецепторов кальция, например, кальмодулина и тропонинов.
Кальциевые рецепторы отвечают на изменения уровней внеклеточного кальция. Точные изменения зависят от конкретного рецептора и клеточной линии, содержащей этот рецептор. Например, действие кальция in vitro на кальциевый рецептор в клетке паращитовидной железы включает следующее:
1. Увеличение внутреннего кальция. Это увеличение вызвано притоком наружного кальция и/или мобилизацией внутреннего кальция. Характеристики увеличения внутреннего кальция включают в себя следующее:
(a) быстрое (время до максимума <5 секунд) и временное увеличение в [Са2+] i, которое устойчиво к ингибированию 1 мкМ La3+ или 1 мкМ Gd3+ и снимается предварительной обработкой (далее называемой предобработкой) иономицином (в отсутствие внеклеточного Са2+);
(b) увеличение не ингибируется дигидропиридинами;
(c) временное увеличение устраняется предобработкой в течение 10 минут 10 мМ фторидом натрия;
(d) временное увеличение уменьшается предобработкой активатором протеинкиназы С (РКС), таким как миристат-ацетат форбола (РМА) мезереин или (-)-индолактам V. Общий эффект активатора протеинкиназы С состоит в смещении кривой доза-ответ кальция вправо без влияния на максимум ответной реакции; и
(e) предобработка токсином коклюша (100 нг/мл в течение >4 часов) не влияет на это увеличение.
2. Быстрое увеличение (<30 секунд) образования инозит-1,4,5-трифосфата или диацилглицерина. Предобработка токсином коклюша (100 нг/мл в течение >4 часов) не влияет на это увеличение.
3. Ингибирование стимулируемого допамином и изопротеренолом образования циклического АМФ. Этот эффект блокируется предобработкой токсином коклюша (100 нг/мл в течение >4 часов).
4. Ингибирование секреции паратиреоидного гормона (РТН). Предобработка токсином коклюша (100 нг/мл в течение >4 часов) не влияет на Ингибирование секреции РТН.
При помощи способов, известных в данной области, можно легко определить действие кальция на другие кальциевые рецепторы в различных клетках. Такие действия кальция могут быть сходными в отношении увеличения внутреннего кальция, наблюдаемого в клетках паращитовидной железы. Однако можно ожидать, что действие кальция будет отличаться в других аспектах, таких как индуцирование или ингибирование высвобождения гормона, иного, чем паратиреоидный гормон.
II. Соединения, модулирующие рецептор неорганического иона
Соединения, модулирующие рецептор неорганического иона, модулируют одну или несколько активностей рецептора неорганического иона. Предпочтительными модулирующими кальциевый рецептор соединениями являются кальцимиметики и кальцилитики. Модулирующие рецептор неорганического иона соединения могут быть идентифицироны скринингом соединений, которые смоделированы по соединению, имеющему, как показано, конкретную активность (т.е. соединению-примеру).
Предпочтительным способом измерения активности кальциевого рецептора является измерение изменений в [Са2+]i. Изменения в [Ca2+]i можно измерять при помощи различных способов, таких как использование клеток НЕК 293, трансдуцированных нуклеиновой кислотой, экспрессирующей кальциевый рецептор паращитовидной железы человека, и нагруженных fura-2; и измерение увеличения в токе Cl- в ооците Xenopus, инъецированном нуклеиновой кислотой, кодирующей кальциевый рецептор. (См. Nemeth et. al., PCT/US93/01642, International Publication Number WO 94/18959). Например, поли(А)+ мРНК может быть получена из клеток, экспрессирующих кальциевый рецептор, таких как клетка паращитовидной железы, костный остеокласт, юкстагломерулярная почечная клетка, клетка проксимального почечного канальца, клетка дистального почечного канальца, клетка толстой восходящей части петли Генле и/или собирающего протока почек, кератиноцит в эпидермисе, парафолликулярная клетка в щитовидной железе (С-клетка), кишечная клетка, клетка центральной нервной системы, клетка периферической нервной системы, тромбоцит, клетка гладких мышц сосудов, предсердная клетка, секретирующая гастрин клетка, секретирующая глюкагон клетка, почечная мезанглиальная клетка, клетка молочной железы, бета-клетка, жировая клетка/липоцит, иммунная клетка и клетка желудочно-кишечного тракта. Предпочтительно, нуклеиновая кислота выделена из клетки паращитовидной железы, С-клетки или остеокласта. Более предпочтительно, эта нуклеиновая кислота кодирует кальциевый рецептор и присутствует на плазмиде или векторе.
В предпочтительных вариантах соединение, модулирующее кальциевый рецептор, является кальцимиметиком, который ингибирует резорбцию костей in vivo остеокластом; ингибирует резорбцию костей in vitro остеокластом; стимулирует секрецию кальцитонина in vitro или in vivo из С-клетки; ингибирует секрецию паратиреоидного гормона из клетки паращитовидной железы in vitro и уменьшает секрецию РТН in vivo; повышает уровни кальцитонина in vivo; или блокирует остеокластную костную резорбцию in vitro и ингибирует костную резорбцию in vivo.
В другом предпочтительном варианте соединение, модулирующее кальциевый рецептор, является кальцилитиком, который индуцирует секрецию паратиреоидного гормона из клеток паращитовидной железы in vitro и повышает уровень паратиреоидного гормона in vivo.
Предпочтительно, это соединение избирательно нацелено на активность рецептора неорганического иона, более предпочтительно, активность кальциевого рецептора, в конкретной клетке. Термин "избирательно" означает, что это соединение оказывает большее действие на активность рецептора неорганического иона в одном типе клеток, чем в другом типе клеток, для данной концентрации соединения. Предпочтительно, эти эффекты различаются в 10 раз и более. Предпочтительно, эта концентрация относится к концентрации в плазме крови и измеряемым действием является образование внеклеточных мессенджеров, таких как кальцитонин плазмы, паратиреоидный гормон или кальций плазмы. Например, в предпочтительном варианте соединение избирательно действует на секрецию РТН по сравнению с секрецией кальцитонина.
В другом предпочтительном варианте такое соединение имеет величины ЕС50 и IC50 больше 5 мкМ или равные 5 мкМ в случае одной или нескольких, но не всех клеток, выбранных из группы, состоящей из клеток паращитовидной железы, остеокластов, юкстагломерулярных клеток почек, клеток проксимальных почечных канальцев, клеток дистальных почечных канальцев, клеток центральной нервной системы, клеток периферической нервной системы, клеток толстой восходящей части петли Генле и/или собирающего протока, кератиноцитов в эпидермисе, парафолликулярных клеток в щитовидной железе (С-клеток), кишечных клеток, тромбоцитов, клеток гладких мышц сосудов, предсердных клеток, секретирующих гастрин клеток, секретирующих глюкагон клеток, почечных мезанглиальных клеток, клеток молочной железы, бета-клеток, жировых клеток/липоцитов, иммунных клеток, клеток желудочно-кишечного тракта, кожных клеток, клеток надпочечников, гипофизарных клеток, клеток гипоталамуса и клеток субфорникального органа. Более предпочтительно, эти клетки выбирают из группы, состоящей из клетки паращитовидной железы, клетки центральной нервной системы, периферической нервной системы, клетки толстой восходящей части петли Генле и/или собирающего протока в почке, парафолликулярной клетки в щитовидной железе (С-клетки), кишечной клетки, клетки желудочно-кишечного тракта, гипофизарной клетки, клетки гипоталамуса и клетки субфорникального органа. Присутствие кальциевого рецептора в этой группе клеток было подтверждено физическими данными, такими как гибридизация in situ и окрашивание антител.
Предпочтительно, соединение, модулирующее рецептор неорганического иона имитирует или блокирует действия внеклеточного иона на клетку, имеющую рецептор неорганического иона, так что такие соединения дают терапевтический эффект. Соединения, модулирующие рецептор неорганического иона, могут оказывать одинаковые или различные действия на клетки, имеющие различные типы морфологии рецептора неорганического иона (например, на клетки, имеющие нормальные рецепторы неорганического иона, нормальное количество рецептора неорганического иона, аномальный рецептор неорганического иона и аномальное количество рецепторов неорганического иона).
Соединения, модулирующие кальциевый рецептор, предпочтительно имитируют или блокируют все действия внеклеточного иона в клетке, имеющей кальциевый рецептор. Однако кальцимиметики не должны обладать всеми биологическими активностями внеклеточного Са2+. Подобным образом, кальцилитики не должны блокировать все активности, вызываемые внеклеточным кальцием. Кроме того, различные кальцимиметики и различные кальцилитики не должны связываться с тем же самым сайтом на кальциевом рецепторе, с которым связывается внеклеточный Ca2+, для проявления их действий.
Неорганические модулирующие соединения не должны влиять на активность рецептора неорганического иона в той же самой степени или точно таким же образом, что и природный лиганд. Например, кальцимиметик может влиять на активность кальциевого рецептора в различной степени и с различной продолжительностью действия путем связывания с другим сайтом связывания или вследствие отличающегося сродства, по сравнению с кальцием, действующим на кальциевый рецептор.
А. Кальцимиметики
1. Соединения Структуры I
Соединения Структуры I, способные модулировать активность кальциевого рецептора, имеют следующую формулу: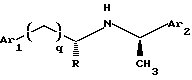
где Ar1 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тио-алкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2ОН, CONH2, CN, ацетокси, N(СН3)2, фенила, фенокси, бензила, бензилокси, α, α-диметилбензила, NO2, CHO, СН3СН(ОН), ацетила, этилендиокси, предпочтительно каждый заместитель независимо выбран из группы, состоящей из СН3, СН3О, СН3СН2О, метилендиокси, Br, Cl, F, I, СF3, CHF2, CH2F, СF3О, СF3СН2О, СН3S, ОН, СН2ОН, CONH2, CN, NO2, СН3СН2, пропила, изопропила, бутила, изобутила, трет-бутила и ацетокси. Более предпочтительно. An обозначает нафтил или фенил, имеющий от 1 до 5 заместителей, каждый из которых независимо выбран из группы, состоящей из изопропила, СН3О, СН3S, СF3О, I, Cl, F, СF3 и СН3, более предпочтительно, СF3О, I, Cl, F и СF3;
Аr2 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоал-кила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN и ацетокси, предпочтительно каждый заместитель независимо выбран из группы, состоящей из СН3, СН3О, СН3СН2O, метилендиокси, Br, Cl, F, I, СF3, CHF2, CH2F, СF3О, СF3СН2O, СН3S, ОН, СН2OН, CONH2, CN, NO2, СН3СН2, пропила, изопропила, бутила, изобутила, трет-бутила и ацетокси. Более предпочтительно, Аr2 обозначает нафтил или фенил, имеющий от 1 до 5 заместителей, каждый из которых независимо выбран из группы, состоящей из изопропила, СН3О, СН3S, СF3О, I, Cl, F, СF3 и СН3.
q равно 0, 1, 2 или 3; и
R обозначает Н или СН3;
и их фармацевтически приемлемые соли и комплексы.
"Низший алкил" относится к насыщенному углеводороду, имеющему 1-4 атома углерода, предпочтительно 1-3 атома углерода, который может иметь прямую цепь или разветвленную.
"Низший алкокси" относится к "O-низшему алкилу", где "О" представляет собой кислород, соединенный с низшим алкилом.
"Низший тиоалкил" относится к "S-низшему алкилу", где "S" обозначает серу, соединенную с низшим алкилом.
"Низший галогеналкил" относится к низшему алкилу, замещенному по меньшей мере одним галогеном. Предпочтительно, только концевой углерод низшего галогеналкила замещен галогеном и присутствуют 1-3 атома галогена. Более предпочтительно, низший галогеналкил содержит 1 атом углерода. Среди заместителей-галогенов предпочтительны Сl или F.
"Низший галогеналкокси" относится к "O-низшему галогеналкилу", где "О" обозначает кислород, соединенный с низшим галогеналкилом.
a. Ar1 и Ar2 являются оба необязательно замещенными фенилами
В предпочтительном варианте оба Ar1 и Ar2 являются необязательно замещенными фенилами и соединение имеет следующую формулу: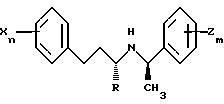
где R обозначает водород или метил,
m и n, каждый независимо, равен 0, 1, 2, 3, 4 или 5;
каждый X, независимо, выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2ОН, CONH2, CN, ацетокси, N(CH3)2, фенила, фенокси, бензила, бензилокси, α,α-диметилбензила, NO2, CHO, СН3СН(ОН), ацетила, этилендиокси. Предпочтительно каждый X, независимо, выбран из группы, состоящей из СН3, СН3О, СН3СН2O, метилендиокси, Br, Cl, F, I, СF3, CHF2, CH2F, СF3О, СF3СН2O, СН3S, ОН, СН2OН, CONH2, CN, NO2, СН3СН2, пропила, изопропила, бутила, изобутила, трет-бутила и ацетокси. Более предпочтительно, каждый X, независимо, выбран из группы, состоящей из изопропила, СН3О, СН3S, СF3О, I, Cl, F, СF3 и СН3, более предпочтительно, из СF3О, I, Cl, F и СF3;
каждый Z, независимо, выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN и ацетокси. Предпочтительно, каждый Z независимо выбран из группы, состоящей из СН3, СН3О, СН3СН2O, метилендиокси, Br, Cl, F, I, СF3, CHF2, CH2F, СF3О, СF3СН2O, СН3S, ОН, СН2OН, CONH2, CN, СН3СН2, пропила, изопропила, бутила, изобутила, трет-бутила и ацетокси. Более предпочтительно, каждый Z независимо выбран из группы, состоящей из изопропила, СН3О, СН3S, СF3О, СF3, I, Cl, F и СН3.
В более предпочтительном варианте по меньшей мере один из заместителей Z находится в мета-положении. Более предпочтительно, это соединение имеет следующую формулу: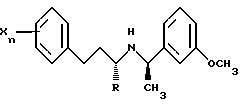
где R обозначает водород или метил;
m равно 0, 1, 2, 3, 4 или 5, предпочтительно 1 или 2;
и каждый X независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN, ацетокси, N(СН3)2, фенила, фенокси, бензила, бензилокси, α,α-диметилбензила, NO2, СНО, СН3СН(ОН), ацетила, этилендиокси, предпочтительно каждый заместитель независимо выбран из группы, состоящей из СН3, СН3О, СН3СН2O, метилендиокси, Br, Cl, F, I, СF3, CHF2, CH2F, СF3О, СF3СН2O, СН3S, ОН, СН2OН, CONH2, CN, NO2, СН3СН2, пропила, изопропила, бутила, изобутила, трет-бутила и ацетокси, более предпочтительно, изопропила, СН3О, СН3S, СF3О, СF3, I, Cl, F и СН3.
Более предпочтительно, соединение имеет формулу: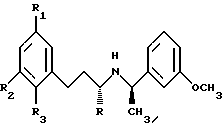
где R обозначает водород или метил;
R1 обозначает галоген или водород, предпочтительно R1 обозначает F или водород;
R2 обозначает водород, галоген, низший алкил, низший галогеналкил или низший галогеналкокси, предпочтительно, R2 обозначает водород, СF3, СН3, ОСF3 или F, и
R3 обозначает водород, галоген или алкокси, предпочтительно, R3 обозначает Cl, F, водород или метокси, более предпочтительно, метокси.
В других более предпочтительных комбинациях по меньшей мере два из радикалов R1, R2 и R3 представляют галоген, предпочтительно F, и R представляет водород или СН3; R обозначает водород или СН3, R2 обозначает низший галогеналкил или низший галогеналкокси, предпочтительно, ОСF3 или СF3, и R1 и R2 обозначают водород; и R обозначает СН3, R3 обозначает галоген, предпочтительно, Cl, R1 обозначает галоген или водород, предпочтительно F или водород, и R2 обозначает водород, низший алкил, низший галогеналкил или низший галогеналкокси, предпочтительно, водород, СF3, СН3, ОСF3 или F.
b. Ar2 обозначает нафтил и q равно 0.
В другом предпочтительном варианте Аr2 обозначает нафтил, q равно 0 и соединение имеет формулу: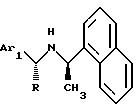
где Ar1 обозначает нафтил или фенил, необязательно замещенные 0-5 заместителями, каждый из которых, независимо, выбран из группы, состоящей из низшего алкила, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN, ацетокси, N(СН3)2, фенила, фенокси, бензила, бензилокси, α,α-диметилбензила, NO2, CHO, СН3СН(ОН), ацетила, этилендиокси, предпочтительно, каждый заместитель независимо выбран из группы, состоящей из СН3, СН3О, СН3СН2O, метилендиокси, Br, Cl, F, I, СF3, CHF2, CH2F, СF3О, СF3СН2O, СН3S, ОН, СН2OН, CONH2, CN, NO2, СН3СН2, пропила, изопропила, бутила, изобутила, трет-бутила и ацетокси. Более предпочтительно. Ar1 обозначает нафтил или фенил, имеющий от 1 до 5 заместителей, каждый из которых независимо выбран из группы, состоящей из изопропила, СН3О, СН3S, СF3, СF3О, I, Cl, F и СН3.
Более предпочтительно, Ar1 обозначает необязательно замещенный фенил, тогда это соединение имеет формулу: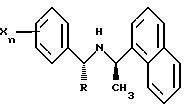
где Хn обозначает необязательные заместители для необязательно замещенного фенила, описанные выше (с предпочтительными заместителями и числом заместителей, описанными выше).
Еще более предпочтительно, это соединение имеет формулу: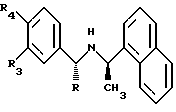
где R обозначает СН3 или водород;
R4 обозначает низший алкил, галоген или алкокси, предпочтительно, изопропил, хлор или метокси; и
R5 обозначает водород, низший алкил или галоген, предпочтительно, метил, СН3, Вr или Cl.
с. Аr2 обозначает нафтил и q равно 2
В другом предпочтительном варианте Ar1 обозначает замещенный фенил, Ar2 обозначает нафтил, q равно 2 и соединение имеет формулу: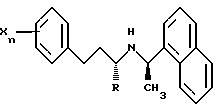
где R обозначает водород или СН3;
n равен 0, 1, 2, 3, 4 или 5, предпочтительно, 1 или 2; и
каждый X, независимо, выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN, ацетокси, N(СН3)2, фенила, фенокси, бензила, бензилокси, α,α-диметилбензила, NO2, СНО, СН3СН(ОН), ацетила, этилендиокси, предпочтительно, каждый заместитель независимо выбран из группы, состоящей из СН3, СН3О, СН3СН2О, метилендиокси, Br, Cl, F, I, СF3, CHF2, CH2F, СF3О, СF3СН2O, СН3S, ОН, СН2ОН, CONH2, CN, NO2, СН3СН2, пропила, изопропила, бутила, изобутила, трет-бутила и ацетокси, более предпочтительно, изопропила, СН3О, СН3S, СF3О, СF3, I, Cl, F и СН3.
Более предпочтительно, соединение имеет формулу: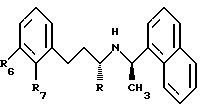
где R6 обозначает водород, низший галогеналкил или низший галогеналкокси, предпочтительно, водород, ОСF3 или ОF3; и
R7 обозначает галоген или водород, предпочтительно, хлор или водород.
В других вариантах R, R6 и R7 имеют указанные выше значения (с предпочтительными заместителями, описанными выше), при условии, что, когда оба R и R6 обозначают водород, R7 не является Cl; и R обозначает СН3 и R6 и R7 имеют указанные выше значения (с предпочтительными заместителями, описанными выше).
2. Соединения Структуры II
Соединения структуры II имеют формулу: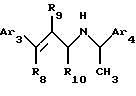
где Аr3 обозначает нафтил или фенил, необязательно замещенный от 0 до 5 заместителями, каждый из которых независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2ОН, СОNН2, CN, ацетокси, бензила, бензилокси, α,α-диметилбензила, NO2, CHO, СН3СН(ОН), N(CH3)2, ацетила, этилен-диокси, предпочтительно, N(CHs)2, низшего алкокси или низшего алкила;
Аr4 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2OН, CONH2, CN и ацетокси, предпочтительно низшего алкокси, более предпочтительно, метокси;
R8 обозначает водород или фенил, предпочтительно, водород;
R9 обозначает водород или метил; и
R10 обозначает водород, метил или фенил, более предпочтительно, когда R10 обозначает метил, хиральный углерод, к которому он присоединен, является (R)-стереоизомером.
Предпочтительно, α-метил в Структуре II является (R)-α-метилом.
3. Соединения Структуры III
Соединения структуры III имеют формулу: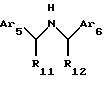
где Аr5 обозначает нафтил или фенил, необязательно замещенный 0-5 заместителями, каждый из которых независимо выбран из группы. состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2ОH, CONH2, CN, ацетокси, бензила, бензилокси, α,α-диметилбензила, NO2, СНО, СН3СН(ОН), ацетила, этилендиокси, -СН=СН-фенила, предпочтительно, низшего алкила, фенокси, -СН=СН-фенила, диметилбензила, метокси, метилена или этилена;
Аr6 обозначает нафтил или фенил, необязательно замещенные 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из ацетила, низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2ОН, CONH2, CN, карбометокси, OCH2C(O)C2H5 и ацетокси, предпочтительно, метокси, низшего алкила, фенила, галогена, СF3, CN, карбометокси или ОСН2С(O)С2Н5;
R11 обозначает водород или метил, предпочтительно, когда R11 обозначает метил, углерод, к которому он присоединен, является (R)-стереоизомером; и
R12 обозначает водород или метил, предпочтительно, когда R12 обозначает метил, углерод, к которому он присоединен, является (R)-стереоизомером.
4. Кальцимиметическая активность
Способность соединений имитировать активность Ca2+ при кальциевых рецепторах можно определить при помощи способов, известных в этой области и описанных Nemeth et. al., PCT/US93/01642, International Publication Number W094/18959. Например, кальцимиметики обладают одной или несколькими и предпочтительно всеми из следующих активностей при тестировании на клетках паращитовидной железы in vitro:
1. Соединение вызывает быстрое (время до максимума <5 секунд) и временное увеличение концентрации внутриклеточного кальция, которое устойчиво к ингибированию 1 мкМ La3+ или 1 мкМ Gd2+. Это увеличение [Ca2+]i сохраняется в отстутствие внеклеточного Са2+, но исчезает в результате предобработки иономицином (в отсутствие внеклеточного Ca2+);
2. Соединение потенциирует увеличения в [Са2+]i, индуцируемые субмаксимальными концентрациями внеклеточного Са2+;
3. Увеличение [Са2+]i, индуцируемое внеклеточным Са2+, не ингибируется дигидропиридинами;
4. Временное увеличение [Са2+]i, вызываемое соединением, снимается предобработкой в течение 10 минут 10 мМ фторидом натрия.
5. Временное увеличение [Са2+] i, вызываемое соединением, уменьшается предобработкой активатором протеинкиназы С (РКС), таким как миристат-ацетат форбола (РМА), мезереин или (-)-индолактам V. Общий эффект активатора протеинкиназы С заключается в смещении кривой доза-ответ соединения вправо без влияния на максимальный ответ;
6. Соединение вызывает быстрое (< 30 секунд) увеличение в образовании инозит-1,4,5-трифосфата и/или диацилглицерина;
7. Соединение ингибирует стимулируемое допамином или изопротеренолом образование циклического АМФ;
8. Соединение ингибирует секрецию РТН.
9. Предобработка токсином коклюша (100 нг/мл в течение >4 часов) блокирует ингибирующее действие соединения на образование циклического АМФ, но не влияет на увеличения [Са2+]i, инозит-1,4,5-трифосфата или диацилглицерина и на уменьшение секреции РТН;
10. Соединение индуцирует увеличения в токе Cl- в ооцитах Xenopus, инъецированных пoли(A)+ - oбoгaщeннoй мРНК из клеток паращитовидной железы быка или человека, но не влияет на ооциты Xenopus, инъецированные водой или мРНК печени; и
11. Подобным образом, с использованием клонированного кальциевого рецептора из клеток паращитовидной железы соединение будет индуцировать ответную реакцию в ооцитах Xenopus, инъецированных специфической кДНК или мРНК, кодирующей этот рецептор.
Различные активности кальция можно измерить при помощи доступных способов. (См. Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959). Параллельные определения соединений, имитирующих активность Са2+, на другой, реагирующей на кальций клетке, предпочтительно при кальциевом рецепторе, являются очевидными из примеров, представленных здесь, и Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959.
Предпочтительно, соединение, как измерено при помощи биотестов, описанных здесь, или согласно Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959, имеет одну или несколько из следующих активностей, более предпочтительно все следующие активности: вызывает временное увеличение внутреннего кальция, имеющее продолжительность менее 30 секунд (предпочтительно мобилизацией внутреннего кальция); вызывает быстрое увеличение [Са2+]i, имеющее место в пределах 30 секунд; вызывает устойчивое увеличение (более, чем 30-секундное) [Ca2+]i, (предпочтительно индуцированном притока наружного кальция); вызывает увеличение уровней инозит-1,4,5-трифосфата или диацилглицерина, предпочтительно в течение менее 60 секунд; и ингибирует стимулируемое допамином или изопротеренолом образование циклического АТФ.
Временное увеличение в [Са2+]i предпочтительно снимается предобработкой клетки в течение 10 минут 10 мМ фторидом натрия или это временное увеличение уменьшается короткой предобработкой (не более 10 минут) клетки активатором протеинкиназы С, предпочтительно, миристатом-ацетатом форбола (РМА), мезереином или (-)-индолактамом V.
С. Кальцилитики
Способность соединения блокировать активность внеклеточного кальция при кальциевом рецепторе можно определить при помощи стандартных способов, основываясь на настоящем описании. (См. также Nemeth et al., PCN/US93/01642, International Publication Number WO 94/18959). Например, соединения, которые блокируют действие внеклеточного кальция при использовании в отношении клеток паращитовидной железы, имеют одну или несколько и предпочтительно все из следующих характеристик при тестировании на клетках паращитовидной железы in vitro:
1. Соединение блокирует, частично или полностью, способность увеличенных концентраций внеклеточного Са2+ к:
(a) увеличению [Са2+]i,
(b) мобилизации внутриклеточного Са2+,
(c) увеличению образования инозит-1,4,5-трифосфата,
(d) уменьшению стимулируемого допамином или изопротеренолом образования циклического АМФ, и
(e) ингибированию секреции РТН;
2. Соединение блокирует увеличения в токе Cl- в ооцитах Xenopus, инъецированных пoли(A)+ - мPHK из бычьих или человеческих клеток паращитовидной железы, вызываемые внеклеточным Са2+ или кальцимиметическими соединениями, но не в ооцитах Xenopus, инъецированных водой или мРНК печени;
3. Подобным образом, при использовании клонированного кальциевого рецептора из клеток паращитовидной железы, соединение будет блокировать ответную реакцию в ооцитах Xenopus, инъецированных специфическими кДНК, мРНК или кРНК, кодирующими кальциевый рецептор, вызываемую внеклеточным Са2+ или кальцимиметическим соединением.
Параллельные определения соединений, блокирующих активность Са2+, в реагирующих на кальций клетках, предпочтительно при кальциевом рецепторе, очевидны из представленных здесь примеров и Nemeth et al., PCT/US93/01642, International Publication Number WO 94/18959.
III. ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ ИЛИ РАССТРОЙСТВ
Заболевания или расстройства, которые можно лечить модулированием активности рецептора кальция, известны в данной области. Например, заболевания или расстройства, которые можно лечить модулированием активности рецептора кальция, могут быть идентифицированы на основе функциональных ответных реакций клеток, регулируемых активностью рецептора кальция. Функциональные ответы клеток, регулируемые кальциевым рецептором, известны в этой области, в том числе, секреция РТН клетками паращитовидной железы, секреция кальцитонина С-клетками и резорбция (рассасывание) костей остеокластами.
Такие функциональные ответы связаны с различными заболеваниями или расстройствами. Например, гиперпаратиреоз приводит к повышенным уровням РТН в плазме. Уменьшение уровней РТН в плазме является эффективным способом лечения гиперпаратиреоза. Подобным образом, увеличение уровней кальцитонина в плазме связано с ингибированием резорбции костей. Ингибирование резорбции костей является эффективным лечением остеопороза. Таким образом, модулирование активности кальциевого рецептора может быть использовано для лечения таких заболеваний, как гиперпаратиреоз и остеопороз.
Соединения, модулирующие активность рецептора неорганического иона, предпочтительно, активность кальциевого рецептора, можно использовать для получения положительного действия в отношении больных, страдающих от различных заболеваний или расстройств. Например, остеопороз является расстройством, связанным с возрастом, характеризующимся потерей массы костной ткани и повышенным риском перелома костей. Описываемые соединения можно использовать для блокирования остеокластного рассасывания костей, либо непосредственно (например, остеокластным иономиметическим соединением), либо опосредованно путем увеличения уровней эндогенного кальцитонина (например, С-клеточным кальцимиметиком). Альтернативно, кальцилитик, активный в отношении рецептора кальция клетки паращитовидной железы, увеличивает количество циркулирующего гормона, стимулируя костеобразование. Все три способа приводят к благотворным эффектам у больных, страдающих от остеопороза.
Кроме того, известно, что периодическое введение низких доз РТН приводит к анаболическому действию на массу костной ткани и соответствующему исправлению костей. Таким образом, соединения и схемы дозирования, вызывающие периодические увеличения количества паратиреоидного гормона (например, периодическое дозирование ионолитиком клетки паращитовидной железы), могут увеличивать массу костной ткани у больных, страдающих от остеопороза.
Другие заболевания или расстройства могут быть идентифицированы обнаружением дополнительных клеточных функциональных ответов, связанных с заболеванием или расстройством, регулируемым активностью кальциевого рецептора. Заболевания или расстройство, которые можно лечить модулированием рецепторов других неорганических ионов, могут быть обнаружены аналогичным образом.
Соединения, модулирующие рецептор неорганического иона, данного изобретения могут оказывать действие на рецептор неорганического иона, вызывая один или несколько клеточных эффектов, дающих в конечном счете терапевтический эффект. Соединения, модулирующие кальциевый рецептор, данного изобретения могут оказывать действие на кальциевый рецептор, вызывая один или несколько клеточных эффектов, дающих в конечном счете терапевтический эффект. Различные заболевания можно лечить согласно данному изобретению путем нацеленного действия на клетки, имеющие кальциевый рецептор.
Например, первичный гиперпаратиреоз (НРТ) характеризуется гиперкальциемией и аномальными повышенными уровнями циркулирующего РТН. Нарушение, связанное с основным типом гиперпаратиреоза (НРТ), состоит в уменьшенной чувствительности клеток паращитовидной железы к негативной регуляции по типу обратной связи внеклеточным Са2+. Таким образом, в ткани от больных с первичным НРТ "установочная точка" для внеклеточного Са2+ сдвинута вправо, так что необходимы более высокие, по сравнению с нормальными, концентрации внеклеточного Са2+ для подавления секреции РТН. Кроме того, в случае первичного НРТ даже высокие концентрации внеклеточного Са2+ часто лишь частично подавляют секрецию РТН. В случае вторичного (уремического) НРТ подобное увеличение установочной точки для внеклеточного Са2+ наблюдается даже при нормальной степени подавления кальцием секреции РТН. Изменения секреции РТН параллельны изменениям [Са2+] i: установочная точка для индуцированных внеклеточным Са2+ увеличении [Са2+]i сдвигается вправо и величина таких увеличении уменьшается.
Больные, страдающие от вторичного НРТ, могут также иметь остеодистрофию. По-видимому, кальцимиметики применимы для лечения как аномальной секреции РТН, так и остеодистрофии у таких больных.
Соединения, которые имитируют действие внеклеточного Са2+, являются ценными при долговременном лечении как первичного, так и вторичного НРТ. Такие соединения обеспечивают дополнительный стимул, необходимый для подавления секреции РТН, которое не может быть достигнуто без этого при гиперкальциемическом состоянии, и тем самым помогают ослабить это гиперкальциемическое состояние. Соединения с более высокой эффективностью, чем эффективность внеклеточного Са2+, могут преодолеть наблюдаемый неподавляемый компонент секреции РТН, который вызывает особенное беспокойство в основной форме первичного НРТ, вызываемого аденомой паращитовидной железы. Альтернативно или дополнительно, такие соединения могут подавлять синтез РТН, поскольку было показано, что продолжительная гиперкальциемия снижает уровни мРНК пре-проРТН в аденоматозной паращитовидной ткани быка и человека. Продолжительная гиперкальциемия подавляет также пролиферацию клеток паращитовидной железы in vitro, так что кальцимиметики могут быть также эффективными в ограничении гиперплазии клеток паращитовидной железы, характерной для вторичного НРТ.
Клетки, отличающиеся от клеток паращитовидной железы, могут отвечать непосредственно на физиологические изменения концентрации внеклеточного Ca2+. Например, секреция кальцитонина парафол-ликулярными клетками щитовидной железы (С-клетками) регулируется изменениями концентрации внеклеточного Са2+.
Выделенные остеокласты отвечают на увеличения концентрации внеклеточного Ca2+ соответствующим увеличением [Ca2+]i, которые возникают частично вследствие мобилизации внутриклеточного Ca2+. Увеличения [Ca2+]i в остеокластах связаны с ингибированием резорбции кости. Высвобождение щелочной фосфатазы из костеобразующих остеобластов непосредственно стимулируется кальцием.
Секреция ренина из юкстагломерулярных клеток почек, подобно секреции РТН, подавляется увеличенными концентрациями внеклеточного Ca2+. Внеклеточный Ca2+ вызывает мобилизацию внутриклеточного Ca2+ в этих клетках. Другие клетки почек реагируют на кальций следующим образом: повышенный Ca2+ ингибирует образование 1,25(ОН)2-витамина D клетками проксимальных канальцев, стимулирует образование кальций-связывающего белка в клетках дистальных канальцев и ингибирует реабсорбцию Са2+ и Mg2+ в канальцах и действие вазопрессина на толстую восходящую часть петли Генле (MTAL), уменьшает действие вазопрессина в клетках кортикального собирающего протока и действует на клетки гладких мышц кровеносных сосудов почечного клубочка.
Кальций также ускоряет дифференциацию кишечных бокаловидных клеток, клеток молочной железы и кожных клеток; ингибирует секрецию предсердного натриуретического пептида из предсердий; уменьшает накопление цАМФ в тромбоцитах; изменяет секрецию гастрина и глюкагона; действует на клетки гладких мышц сосудов, модифицируя клеточную секрецию вазоактивных факторов; и влияет на клетки центральной нервной системы и периферической нервной системы.
Таким образом, существует достаточно оснований для предположения, что Са2+, в дополнение к его повсеместной роли в качестве внутриклеточного сигнала, функционирует также в качестве внеклеточного сигнала для регуляции ответных реакций определенных специализированных клеток. Соединения данного изобретения могут быть использованы для лечения заболеваний и расстройств, связанных с нарушенными ответами на Са2+ в этих клетках.
Характерные заболевания и расстройства, которые могут вылечены или предотвращены на основе воздействия на клетки, включают такие заболевания центральной нервной системы, как припадки, мозговой удар, травма головы, повреждение спинного мозга, индуцированное гипоксией повреждение нервных клеток, например, при остановке сердца или при неонатальном дистрессе, эпилепсия, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Хантингтона и болезнь Паркинсона, деменция, ригидность мышц, депрессия, тревога, состояние паники, навязчиво-компульсивное расстройство, посттравматический стресс, шизофрения, нейролептический злокачественный синдром и болезнь Туретта; заболевания, заключающиеся в избыточной реабсорбции воды почками, такие как синдром несоответствующей секреции ADH (SIADH), цирроз, застойная сердечная недостаточность и нефроз; гипертензию; предотвращение и/или уменьшение почечной токсичности от катионных антибиотиков (например, аминогликозидных антибиотиков); расстройства перистальтики кишечника, такие как диарея и слизистый колит; язвенные заболевания желудочно-кишечного тракта (GI); заболевания GI с избыточным поглощением кальция, такие как саркоидоз; и аутоиммунные заболевания и отторжение трансплантируемого органа.
Хотя соединения, модулирующие кальциевый рецептор, данного изобретения обычно будут использоваться для лечения людей, их можно также применять для лечения подобных или идентичных заболеваний у других видов теплокровных животных, таких как приматы, сельскохозяйственные животные, такие как свинья, крупный рогатый скот и домашняя птица; а также спортивных и домашних животных, таких как лошади, собаки и кошки.
IV. Введение соединений
Различные соединения, описанные в данном изобретении, можно применять для лечения различных заболеваний или расстройств путем модулирования активности рецептора неорганического иона, предпочтительно, активности кальциевого рецептора. Соединения данного изобретения могут быть приготовлены для различных способов введения, в том числе для системного и местного или локализованного введения. Способы и готовые формы в общем виде описаны в Remington's Pharmaceutical Sciences. Mack Publishing Co., Easton, PA. Введение иономиметиков и ионолитиков обсуждается Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959.
Подходящие лекарственные формы, частично, зависят от применения или пути введения, например, перорального, трансдермального или посредством инъекции. Такие лекарственные формы должны позволить соединению достичь клетки-мишени, присутствует ли клетка-мишень в многоклеточном хозяине или в культуре. Например, фармакологические соединения или композиции, инъецируемые в кровоток, должны быть растворимыми. В данной области известны и другие факторы, которые должны быть приняты во внимание, такие как токсичность и приготовление лекарственной формы, которая замедляет проявление соединением или композицией их действия.
Соединения могут быть также приготовлены в виде их фармацевтически приемлемых солей (например, кислотно-аддитивных солей) и комплексов. Фармацевтически приемлемые соли являются нетоксичными солями при той концентрации, при которой их вводят. Приготовление таких солей может облегчить фармакологическое использование путем изменения физических свойств соединения без влияния на проявление его физиологического действия. Полезными изменениями физических свойств являются понижение точки плавления для облегчения введения через слизистую оболочку и увеличение растворимости для облегчения введения высоких концентраций лекарственного средства.
К фармацевтически приемлемым солям относятся кислотно-аддитивные соли, такие как сульфат, гидрохлорид, малеат, фосфат, сульфамат, ацетат, цитрат, лактат, тартрат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хиннат. (См., например, PCT/US92/03736, включенный сюда в качестве ссылки). Фармацевтически приемлемые соли могут быть получены из таких кислот, как соляная кислота, малеиновая кислота, серная кислота, фосфорная кислота, сульфамовая кислота, уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфокислота, циклогексилсульфамовая кислота и хинная кислота.
Фармацевтически приемлемые соли могут быть получены стандартными способами. Например, соединения в виде формы свободного основания соединения растворяют в подходящем растворителе, таком как водный или водно-спиртовой раствор, содержащий соответствующую кислоту, и затем выделяют продукт выпариванием раствора. В другом примере соль получают взаимодействием свободного основания и кислоты в органическом растворителе.
Для облегчения введения соединения могут быть использованы носители или наполнители. Примерами носителей и наполнителей являются карбонат кальция, фосфат кальция, различные сахара, такие как лактоза, глюкоза или сахароза, или разные типы крахмала, производные целлюлозы, желатина, растительные масла, полиэтиленгликоли и физиологически совместимые растворители. Эти композиции или фармацевтическая композиция могут вводиться различными способами, в том числе, внутривенно, внутрибрюшинно, подкожно и внутримышечно, перорально, местным нанесением или через слизистую оболочку.
Для системного введения предпочтительно пероральное введение. Альтернативно, можно применять инъекцию, например, внутримышечную, внутривенную, внутрибрюшинную и подкожную. Для инъекции соединения данного изобретения готовят в жидких растворах, предпочтительно в физиологически приемлемых буферах, таких как раствор Хенка или раствор Рингера. Кроме того, эти соединения можно приготовлять в твердом виде и повторно растворять или суспендировать непосредственно перед использованием. Могут быть получены также лиофилизированные формы.
Системное введение может также осуществляться чрескожным способом (или через слизистую оболочку) или эти соединения могут вводиться перорально. Для введения через слизистую оболочку или трансдермального введения в готовой форме используют вещества, усиливающие проникновение через барьер, который они должны преодолеть (смачивающие вещества, пенетранты). Такие смачивающие вещества обычно известны в этой области и включают в себя, например, для введения через слизистую оболочку, соли желчных кислот и производные фусидовой кислоты. Кроме того, для облегчения проникновения можно использовать детергенты. Введение через слизистую оболочку может осуществляться при помощи, например, назальных спреев или при помощи суппозиториев. Для перорального введения соединения могут быть приготовлены в виде обычных лекарственных форм для перорального введения, таких как капсулы, таблетки и жидкие препараты.
Для местного введения соединения данного изобретения могут быть приготовлены в виде мазей, гелей или кремов, как это известно в данной области.
Вводимые количества различных соединений данного изобретения могут быть определены стандартными способами. Обычно терапевтически эффективное количество находится между приблизительно 1 нмоль и 3 мкмоль соединения, предпочтительно между 0,1 нмоль и 1 мкмоль, в зависимости от ЕС50 или IC50 и от возраста и веса больного и от конкретного заболевания или расстройства, имеющегося у этого больного. Обычно это количество находится между приблизительно 0,1 и 50 мг/кг, предпочтительно между 0,01 и 20 мг/кг веса тела подвергнутого лечению животного.
V. Примеры
Ниже представлены примеры, иллюстрирующие различные аспекты и варианты данного изобретения. Эти примеры не предназначены для ограничения объема заявленного изобретения.
Пример 1. Клонирование кальциевого рецептора паращитовидной железы человека из аденомы паращитовидной железы человека
В этом примере описано клонирование кальциевого рецептора паращитовидной железы человека из аденомной опухоли паращитовидной железы человека с использованием pBoPCaRl в качестве гибридизационного зонда (См. Nemeth et.al., PCT/US93/-1642, International Publication Number WO 94/18959). Этот зонд использовали для идентификации нуклеиновой кислоты, кодирующей кальциевый рецептор паращитовидной железы человека, посредством перекрестной гибридизации в условиях уменьшенной строгости.
Мессенджер-РНК получали из аденомной опухоли паращитовидной железы человека, удаленной у 39-летнего мужчины Индо-Европейской группы населения с диагнозом первичного гиперпаратиреоза. Нозерн-блоттинг этой мРНК с применением pBopCaRl в качестве гибридизационного зонда идентифицировал транскрипты кальциевого рецептора размером приблизительно 5 т.п.н. и приблизительно 4 т.п. н. Была сконструирована библиотека кДНК из мРНК. Двухцепочечные кДНК, большие, чем 3 т. п. н., отбирали по размеру на агарозном геле и лигировали в клонирующий вектор лямбда ZapII. 500000 первичных рекомбинантных фагов скринировали с кДНК-вставкой 5.2 т.п.н. pBoPCaRl в качестве гибридизационного зонда. Вставку pBoPCaRl метили при помощи произвольно праймированного синтеза с использованием [32Р]-dCTP до удельной активности 1 х 109 имп/мин/мкг.
Скрининг библиотеки выполняли при строгости гибридизации 400 мМ Na+, 50% формамид при температуре 38oС. Фильтры для снятия бляшек гибридизовали при концентрации зонда 500000 имп/мин/мл в течение 20 часов. После гибридизации фильтры промывали в 1 раз SSC при 40oС в течение 1 часа.
В первичном скрининге идентифицировали приблизительно 250 положительных клонов, идентифицированных гибридизацией с рВоР-CaRl. Семь из этих клонов были проведены через второй и третий скрининги для выделения отдельных клонов, которые гибридизовались с зондом pBoPCaRl. Эти семь клонов анализировали рестрикционным картированием и блоттингом по Саузерну. Три из этих клонов содержали инсерции (вставки) кДНК приблизительно 5 т.п.н. и, по-видимому, представляли собой полноразмерные клоны, соответствующие мРНК 5 т.п.н. Два из этих клонов содержат кДНК-вставки приблизительно 4 т.п.н. и являются, по-видимому, полноразмерными клонами, соответствующими мРНК 4 т.п.н.
Рестрикционное картирование двух вставок с разными размерами показывает, что они имеют общие области сходной последовательности на их 5'-концах, но отличаются в 3'-концевых последовательностях. Анализ последовательности ДНК показывает, что меньшая вставка может быть результатом альтернативного полиаденилирования против хода транскрипции от сайта полиаденилирования, используемого в большей вставке.
Данные кДНК-вставки для классов обоих размеров субклонировали в плазмидный вектор pBluescript SK. Линеаризация с последующей транскрипцией in vitro с использованием РНК-полимеразы Т7 дала кРНК-транскрипты. Эти кРНК-транскрипты инъецировали в ооциты Xenopus (150 нг/мкл РНК; 50 нл/ооцит) для функционального анализа. После периодов инкубации 2-4 дня ооциты анализировали на присутствие функциональных кальциевых рецепторов. Оба типа клонов обнаружили увеличение в функциональных кальциевых рецепторах, оцениваемых по стимуляции активируемых кальцием токов хлорида при добавлении соответствующих агонистов кальциевого рецептора. Известные агонисты кальциевого рецептора, в том числе, NPS R-467 и NPS R-563 (см. Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959), активировали экспрессируемый ооцитами рецептор при приблизительно тех же концентрацией, которые, как известно, являются эффективными для природного рецептора паращитовидной клетки. Таким образом, оба клона кодируют функциональный кальциевый рецептор клетки паращитовидной железы человека.
Плазмиды готовили субклонированием вставки каждого класса размера в pBluescript, получая в результате pHuPCaR 5,2 и pHuCaR 4,0. Последовательность нуклеиновой кислоты и аминокислотная последовательность этих вставок показаны в SEQ ID 1 и 2.
Некоторые различия наблюдались между последовательностями нуклеиновой кислоты двух кДНК-вставок. Анализ последовательности двух кДНК-вставок показывает существование по меньшей мере двух разновидностей последовательностей, отличающихся в 3'-нетранслируемом районе, которые могут быть результатом альтернативного полиаденилирования. Кроме того, различие в последовательности существует при 5'-конце вставок. Эти отличающиеся последовательности соответствуют нетранслируемым областям и могут возникать в результате альтернативной инициации транскрипции и/или сплайсинга.
Три дополнительных сайта вариации последовательности наблюдали в кодирующих областях клонов кДНК pHuPCaR5,2 и pHuPCaR4,0 (см. SEQ ID 1 и 2), показывающие, что эти клоны кДНК кодируют различные белки. Анализ последовательности гена CaR человека показывает, что дополнительные 30 пар оснований ДНК в клоне кДНК pHuPCaR5,2, по сравнению с pHuPCaR4,0, являются результатом альтернативного сплайсинга мРНК. Предсказано, что альтернативный сплайсинг мРНК ввводит 10 дополнительных аминокислот в полипептид CaR, кодируемый кДНК pHuCaR5,2, в сайте между аминокислотой 536 и аминокислотой 537 в полипептиде, кодируемом кДНК pHuPCaR4,0. Кроме того, pHuPCaR4,0 кодирует глутамин (Gin) в аа 925 и глицин (Gly) в положении 990, тогда как рНuРСа5,2 кодирует аргинин (Arg) в обоих равноценных положениях. Ген CaR человека кодирует Gin и Arg, соответственно, в этих положениях. Различие между кДНК pHuPCaR4,0 по сравнению с ДНК человека, по-видимому, представляет истинный полиморфизм последовательности в популяции человека, тогда как изменение одного основания в pHuPCaR5,2, возможно, отражает мутацию, которая имеет место во время ее клонирования. Обе кДНК кодируют функциональные кальциевые рецепторы, как показано способностью ооцитов Xenopus, инъецированных кДНК, полученной из этих клонов кДНК, отвечать на 10 мМ внеклеточный кальций, как показано по Сl-- проводимости. Однако возможно, что эти две изоформы рецептора отличаются функционально и/или фармакологически.
Пример 2. Отбор стабильных рекомбинантных клеток, экспрессирующих кальциевый рецептор
Были выделены клональные клеточные линии, которые стабильно экспрессируют два кальциевых рецептора (бычий и человеческий). КДНК кальциевого рецептора субклонировали в двух различных, коммерчески доступных экспрессирующих векторах: pMSG (полученном из Pharmacia) и Сер4В (полученном из Invitrogen). Первый вектор содержит селектируемый маркерный ген для ксантин-гуанин-фосфорибозилтрансферазы (gpt), позволяющий стабильно трансфицированным клеткам преодолеть блокаду пути биосинтеза пурина, налагаемую добавлением 2 мкг/мл аминоптерина и 25 мкг/мл микофеноловой кислоты. Второй вектор кодирует ген устойчивости к антибиотику гигромицину (используемому при 200 мкг/мл). КДНК HuPCaR 5,2 и HuPCaR 4,0 (SEQ ID 1 и 2, соответственно) удаляли из родительской плазмиды bluescript рестриктазами Not I и Hind III и затем либо лигировали непосредственно в расщепленную Not I+Hind III Cep4B, либо обрабатывали фрагментом Кленова ДНК-полимеразы перед лигированием по тупым концам в расщепленную Sma I pMSG.
Субклон pMSG, содержащий вставку HuPCaR 5,2, трансфицировали в клетки СНО, как обсуждалось выше. Отбор приводил к 20 устойчивым клонам, которые были охарактеризованы. Сер4В-субклон, содержащий вставку HuPCaR 5,2, трансфицировали в клетки НЕК 293, как описано выше. Отбор с гигромицином приводил к пулу стабильных клонов. Клоны, экспрессирующие изоформу рецептора HuPCaR 4,0, готовили подобным образом.
Клетки, полученные из пула клеток НЕК 293, отобранных при помощи гигромицина, трансфицировали плазмидой Cep4B, содержащей вставку HuPCaR 5,2, высевали на покрытые коллагеном квадраты Akiar, которые помещали в индивидуальные лунки 12-луночных планшетов для культуры ткани. Спустя 2-6 дней среду удаляли и клетки промывали сбалансированным солевым раствором и 1 мл буфера, содержащего 1 мкМ fura2-AM, 1 мМ СаСl2 и 0,1% БСА и 1 мМ СаCl2. Измерения флуоресценции в ответ на агонисты кальциевого рецептора проводили при 37oС в спектрофлуориметре с использованием длин волн возбуждения и эмиссии 340 нм и 510 нм, соответственно. Для калибровки сигнала определяли Fmax после добавления иономицина (40 мкМ) и видимую Fmin определяли путем добавления 0,3 М ЭДТА, 2,5 М Трис-HCl, рН 10. Сильные увеличения [Ca2+]; наблюдали в ответ на добавление следующих агонистов кальциевого рецептора: Са2+ (10 мМ), Mg2+ (20 мМ) и NPS R-467. Контрольные клетки, экспрессирующие функциональные рецепторы вещества К, не отвечали на эти кальцимиметические соединения.
Были получены дополнительные клональные изоляты клеток НЕК 293, трансфицированных последовательностью pHuPCaR4,0. Их тестировали на способность отвечать на кальцимиметики, как описано выше, за исключением того, что эти клетки тестировали, когда они находились в суспензии.
Пример 3. Использование нагруженных fura-2 клеток паращитовидной железы для измерения активности кальциевого рецептора
Этот раздел описывает способы, используемые для получения клеток паращитовидной железы телят и человека и применения клеток паращитовидной железы для измерения активности кальциевого рецептора.
Паращитовидные железы получали от свежезабитых телят (12-15-недельного возраста) на местной бойне и транспортировали в лабораторию в охлажденном льдом буфере для клеток паращитовидной железы (РСВ), содержащем (мМ): NaCl, 126; КCl, 4; MgCl2, 1; Na-HEPES, 20; рН 7,4; глюкозу, 5,6 и различные количества СаСl2, например, 1,25 мМ. Паращитовидные железы человека получали от больных, подвергшихся хирургическому удалению ткани паращитовидной железы при первичном или уремическом гиперпаратиреозе (уремическом НРТ), и обрабатывали аналогично обработке бычьей ткани.
Железы освобождали от избытка жировой и соединительной ткани и затем измельчали тонкими ножницами в виде кубиков со стороной приблизительно 2-3 мм. Диссоциированные клетки паращитовидной железы получали расщеплением коллагеназой и затем очищали центрифугированием в Percoll-буфере. Полученный препарат клеток паращитовидной железы по существу не содержал эритроцитов, адипоцитов и капиллярной ткани, что определяли при помощи фазово-контрастной микроскопии и окрашивания суданом черным В. Диссоциированные и очищенные клетки паращитовидной железы присутствовали в виде небольших кластеров, содержащих 5-20 клеток. Жизнеспособность клеток, определяемая путем вытеснения трипанового синего или бромида этидия, как правило, составляла 95%.
Хотя клетки можно было применять для экспериментальных целей в этой временной точке, физиологические ответные реакции (например, способность к подавляемости секреции РТН и уровней покоя [Са2+]i) должны определяться после культивирования этих клеток в течение ночи. Первичная культура имеет также то преимущество, что клетки могут быть помечены изотопами почти до изотопного равновесия так, как это необходимо для исследований, включающих измерения метаболизма инозитфосфата.
После очистки на градиентах Перколла клетки промывали несколько раз смесью 1: 1 Ham's F12 - модифицированная по способу Дульбекко среда Игла (GIBCO), дополненной 50 мкг/мл стрептомицина, 100 Ед/мл пенициллина, 5 мкг/мл гентамицина и ITS+. ITS+ представляет собой предварительно смешанный раствор, содержащий инсулин, трансферрин, селен и бычий сывороточный альбумин (БСА) - линоленовую кислоту (Collaborative Research, Bedford, MA). Затем эти клетки переносили в пластиковые колбы (на 75 или 150 см3; Falcon) и инкубировали в течение ночи при 37oС во влажной атмосфере с 5% СO2. Сыворотку не добавляли к этим стоящим в течение ночи культурам, так как ее присутствие позволяет клеткам прикрепляться к пластику, подвергаться пролиферации и дедифференцированию. Клетки, культивируемые в описанных выше условиях, легко удаляются из колб декантацией и обнаруживают такую же жизнеспособность, что и свежеприготовленные клетки.
Очищенные клетки паращитовидной железы ресуспендировали в 1,25 мМ CaCl2 - 2% БСА-РСВ, содержащем 1 мкМ фура-2-ацетоксиметиловый эфир, и инкубировали при 37oС в течение 20 минут. Затем клетки осаждали центрифугированием, ресуспендировали в том же самом буфере, но без эфира и инкубировали еще 15 минут при 37oС. Затем клетки промывали дважды РСВ, содержащим 0,5 мМ СаСl2 и 0,5% БСА, и хранили при комнатной температуре (около 20oС). Непосредственно перед использованием клетки разводили в 5 раз предварительно нагретым 0,5 мМ CaCl2 - РСВ для получения конечной концентрации БСА 0,1%. Концентрация клеток в кювете, применяемой для регистрации флуоресценции, была 1-2 х 106 клеток/мл.
Флуоресценцию нагруженных индикатором клеток измеряли при 37oС в спектрофлуорометре (Biomedical Instrumentation Group, University of Pennsylvania, Philadelphia, PA), снабженном термостатируемым держателем кюветы и магнитной мешалкой, используя длины волн возбуждения и эмиссии 340 и 510 нм, соответственно. Эта флуоресценция показывает уровень Са2+ в цитозоле. Сигналы флуоресценции калибровали при помощи дигитонина (50 мкг/мл, конечная концентрация), получая максимальную флуоресценцию (Fmax), и ЭГТА (10 мМ, рН 8,3, конечная концентрация), получая минимальную флуоресценцию (Fmin) и константу диссоциации на 224 нм. Выход красителя зависит от температуры и в основном имеет место в течение первых 2 минут после нагревания клеток в кювете. После этого выход красителя происходит только очень медленно. Для коррекции калибровки на выход красителя клетки помещали в кювету и перемешивали в течение 2-3 минут. Затем суспензию клеток удаляли, клетки осаждали центрифугированием и супернатант возвращали в чистую кювету. Затем супернатант обрабатывали дигитонином и ЭГТА для оценки выхода красителя, который обычно составляет 10-15% от общего Са2+-зависимого флуоресцентного сигнала. Эту величину вычитали из наблюдаемой Fmin.
Пример 4. Использование нагруженных fura-2 клеток НЕК 293/pHuPCaR4.0 для измерения активности кальциевого рецептора
Этот раздел описывает методики, применяемые для определения активности кальциевого рецептора при помощи нагруженных fura-2 клеток НЕК 293/pHUPCaR4,0. Клетки НЕК 293, трансфицированные pHUPCaR4,0, нагружали fura-2 путем инкубирования клеток в модифицированной по способу Дульбекко среде Игла, забуференной 20 мМ HEPES, содержащим приблизительно 5 мкМ fluo-3/AM, в течение 1 часа при комнатной температуре. Затем клетки промывали сбалансированным солевым раствором Хенка, забуференным 20 мМ HEPES, содержащим 1 мМ CaCl2 и 1 мМ MgCl2. Затем испытуемые соединения добавляли к этим клеткам и измеряли флуоресценцию (длины волн возбуждения и эмиссии 340 и 510 нм, соответственно).
Пример 5. Измерение способности соединений модулировать активность кальциевого рецептора
Способность различных соединений модулировать активность кальциевого рецептора определяли измерением увеличений [Са2+]i в клетках НЕК 293, трансфицированных нуклеиновой кислотой, кодирующей pHUPCaR4,0, с использованием нагруженных fura-2 клеток или с использованием клеток паращитовидной железы, нагруженных с использованием нагруженных fura-2 клеток. Результаты различных экспериментов показаны в таблицах 1.a, 1.b.1, l.b.2. 1.c. и 2. В таблицах 1. a, 1.b.l, l.b.2, и 1.c показаны действия соединений при различных концентрациях на активность рецептора кальция, определяемую, как описано в Примере 4 (т. е. с использованием клеток НЕК 293, трансфицированных нуклеиновой кислотой, кодирующей pHUPCaR4,0, которые были нагружены fura-2).
В таблице 2 объединены результаты различных экспериментов, где рассчитывали ЕС50, либо с клетками паращитовидной железы, либо с НЕК 293/pHuPCaR4,0, нагруженными fura-2. Клетки нагружали fura-2 и анализировали, как описано в Примере 2 (для клеток паращитовидной железы) или в Примере 3 (для клеток НЕК 293/pHuPCaR4,0).
Примеры 6-17. Синтез соединений
Описанные соединения можно синтезировать стандартными способами, такими как описанные Nemeth et.al., PCT/US93/01642, International Publication Number WO 94/18959. Ниже представлены примеры, описывающие характерные синтезы соединений настоящего изобретения.
Соединения 9R, 14U и 17Р получали восстановительным аминированием коммерчески доступных альдегида или кетона первичным амином в присутствии цианоборгидрида натрия или триацетоксиборгидрида натрия. Соединения 11Y, 12Н, 12К, 12М, 14S, 14Т, 16L-O, 17Е, 17G, 17J, 24Х, 24Y, 25А, 25Е-25К и 25O получали подобным образом.
Было обнаружено для синтезов трех соединений (9R, 14U и 16Р), что использование триацетоксиборгидрида натрия позволяло получить желаемые диастереоизомеры с более высокой диастереоселективностью, чем при использовании цианоборгидрида натрия. Затем обогащенные смеси очищали с получением единственного диастереоизомера при помощи ЖХВР с нормальной фазой или перекристаллизацией из органических растворителей.
Соединения 8J, 8U, 11Х, 17М и 25Y получали конденсацией первичного амина с альдегидом или кетоном в присутствии изопропоксида титана(IV). Затем полученные промежуточные имины восстанавливали in situ действием цианоборгидрида натрия, боргидрида натрия или триацетоксиборгидрида натрия. Промежуточный енамин для синтеза соединения 8U каталитически восстанавливали с применением дигидроксида палладия на углероде.
Соединения 12U, 12V и 12Z получали конденсацией амина с нитрилом, медиированной гидридом диизобутилалюминия (DIBAL-H). Полученный промежуточный имин восстанавливали in situ действием цианоборгидрида натрия или боргидрида натрия. Промежуточные алкены (соединения 12U и 12V) восстанавливали каталитическим гидрированием в EtOH с использованием палладия на углероде. Соединения в виде их соответствующего гидрохлорида получали обработкой их свободного основания НCl в эфире с получением белого твердого вещества.
Амины, используемые в этих синтезах, были приобретены от Aldrich Chemical Co., Milwaukee, WI или из Celgene Corp., Warren, NY или получены синтетически при помощи стандартных способов. Все другие реагенты были приобретены от Aldrich Chemical Co.
Пример 6. Синтез соединения 25Y
N-(3-(2-Фенил)пропил)-1(1-нафтил)этиламин
Смесь 3-фенил-1-пропиламина (135 мг, 1 ммоль), 1'-ацетонафтона (170 мг, 1 ммоль) и изопропоксида титана(IV) (355 мг, 1,3 ммоль) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь обрабатывали 1 М цианоборгидридом натрия в этаноле (1 мл) и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли эфиром и обрабатывали водой (0,1 мл). Реакционную смесь центрифугировали и эфирный слой удаляли и концентрировали до масла молочного цвета. Небольшую часть этого продукта (10 мг) очищали при помощи ЖХВР (Phenomenex, 1,0 х 25 см, 5 мкМ диоксид кремния) с применением градиента дихлорметана до 10% метанола в дихлорметане, содержащего 0,1% изопропиламин. Полученный продукт (свободное основание) представлял собой индивидуальное вещество согласно GC/EI-MS (Rt= 10,48 мин) m/z (отн. инт.) 289 (M+, 11), 274 (63), 184 (5), 162 (5), 155 (100), 141 (18). 115 (8), 91 (45), 77 (5).
Пример 7. Синтез соединения 8J
Гидрохлорид N-(3-фенилпропил)-1-(3-тиометилфенил)этиламина
3'-Аминоацетофенон (2,7 г, 20 ммоль) растворяли в 4 мл концентрированной НCl, 4 г льда и 8 мл воды. Раствор охлаждали до 0oС и нитрит натрия (1,45 г, 21 ммоль), растворенный в 3-5 мл воды, добавляли в течение более 5 минут, поддерживая температуру ниже 6oС. Тиометоксид натрия (1,75 г, 25 ммоль) растворяли в 5 мл воды и охлаждали до 0oС. К этому раствору добавляли соль диазония в течение более 10 минут, поддерживая температуру ниже 10oС. Реакцию перемешивали еще в течение часа, позволяя температуре повышаться до температуры окружающей среды. Реакционную смесь распределяли между эфиром и водой. Эфирный слой отделяли и промывали бикарбонатом натрия и хлоридом натрия и сушили над сульфатом натрия. Эфир выпаривали с получением 3'-тиометилацетофенона с выходом 74%. Этот неочищенный продукт очищали перегонкой при пониженном давлении.
3-Фенилпропиламин (0,13 г, 1 ммоль), 3'-тиометилацетофенон (0,17 г, 1 ммоль) и изопропоксид титана(IV) (0,36 г, 1,25 ммоль) перемешивали вместе и оставляли стоять в течение 4 часов. Добавляли этанол (1 мл) и цианоборгидрид натрия (0,063 г, 1 ммоль) и реакционную смесь перемешивали в течение ночи. Затем реакционную смесь обрабатывали добавлением 4 мл эфира и 200 мкл воды. Смесь перемешивали вортексом и затем центрифугировали для отделения твердых веществ. Эфирный слой отделяли от осадка и растворитель удаляли в вакууме. Масло повторно растворяли в дихлорметане и полученное соединение очищали препаративной тонкослойной хроматографией (ТХ) на силикагеле с элюцией смесью 3% метанол/дихлорметан с получением указанного в заголовке соединения в виде чистого масла: GC/EI-MS (Rt=7,64 мин) m/z (отн. инт.) 285 (М+, 18), 270 (90), 180 (17). 151 (100), 136 (32), 104 (17), 91 (54), 77 (13).
Пример 8. Синтез соединения 8U
Гидрохлорид N-3-(2-метоксифенил)-1-пропил(R)-3-метокси-α-метилбензиламина
Смесь (R)-(+)-3-метокси-α-метилбензиламина (3,02 г, 20 ммоль), 2-метоксициннамальдегида (3,24 г, 20 ммоль) и изопропоксида титана(IV) (8,53 г, 30 ммоль, 1,5 экв.) перемешивали 2 часа при комнатной температуре и обрабатывали 1 М (20 мл) цианоборгидридом натрия в этаноле. Реакционную смесь перемешивали в течение ночи (16 часов), разбавляли диэтиловым эфиром и обрабатывали водой (1,44 мл, 80 ммоль, 4 экв.). После смешивания в течение 1 часа реакционную смесь центрифугировали и эфирный слой удаляли и концентрировали до масла. Этот продукт растворяли в ледяной уксусной кислоте, встряхивали с гидроксидом палладия и гидрировали водородом при 60 psi (413685,42 Па) в течение 2 часов при комнатной температуре. Катализатор удаляли фильтрованием и полученный раствор концентрировали до густого масла. Этот продукт повторно растворяли в дихлорметане и нейтрализовали 1 н NaCl. Раствор в дихлорметане отделяли от водной фазы и концентрировали до масла. Этот продукт повторно растворяли в эфире и обрабатывали 1 М НСl в диэтиловом эфире. Полученный осадок (белое твердое вещество) собирали, промывали диэтиловым эфиром и сушили на воздухе. GC/E1-MS (Rt=9,69 мин) этого продукта (свободного основания) показала, что он представляет собой индивидуальное вещество: m/z (отн. инт. )299 (М+, 21), 284 (100), 164 (17), 150 (8), 135 (81), 121 (40), 102 (17), 91 (43), 77 (18).
Пример 9. Синтез соединения 9R
Гидрохлорид (R)-N-(1-(2-нафтил)этил)-(R)-1(1-нафтил)этиламина
Смесь (R)-(+)-1-(1-нафтил)этиламина (10,0 г, 58 ммоль), 2'-ацетонафтона (9,4 г, 56 ммоль), изопропоксида титана(IV) (20,7 г, 73,0 ммоль) и ЕtOН (абс.) (100 мл) нагревали до 60oС в течение 3 часов. Затем добавляли цианоборгидрид натрия (NaCNBH3) (3,67 г, 58,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли эфир (1 л) и Н2О (10 мл) и затем полученный осадок удаляли центрифугированием. Супернатант выпаривали в вакууме и неочищенный продукт перекристаллизовывали четыре раза из горячего гексана с получением 1,5 г чистого (98%) диастереоизомера. Свободное основание растворяли в гексане, фильтровали и затем добавляли НCl в эфире для осаждения продукта в виде белого твердого вещества (1,1 г, выход 6%), т. пл.: размягчение при 200-240oС (разл.).
Пример 10. Синтез соединения 11Х
Гидрохлорид N-(4-изопропилбензил)-(R)-1(1-нафтил)этиламина
Смесь (R)-(+)-1-(1-нафтил)этиламина (1,06 г, 6,2 ммоль), 4-изопропилбензальдегида (0,92 г, 6,2 ммоль) и изопропоксида титана(IV) (2,2 г, 7,7 ммоль) нагревали до 100oС в течение 5 минут и затем оставляли перемешиваться при комнатной температуре в течение 4 часов. Затем добавляли цианоборгидрид натрия (NaCNBH3) (0,39 г, 6,2 ммоль) с последующим добавлением EtOH (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли эфир (100 мл) и H2O (1 мл) и затем полученный осадок удаляли центрифугированием. Супернатант выпаривали в вакууме и неочищенный продукт хроматографировали на силикагеле (колонка 50 мм х 30 мм) (элюция смесью 1% МеОН/СНСl2). Затем хроматографированный продукт растворяли в гексане и добавляли НCl в эфире для осаждения продукта в виде белого твердого вещества (0,67 г, выход 35%), т.пл.: 257-259oС.
Пример 11. Синтез соединения 12U
Гидрохлорид N-3-(2-метилфенил)-1-пропил-(R)-3-метокси-α-метилбензиламина
Раствор 2-метилциннамонитрила (1,43 г, 10 ммоль) в дихлорметане (10 мл) охлаждали до 0oС и обрабатывали, добавляя по каплям (15 минут) 1 М гидрид диизобутилалюминия (10 мл, дихлорметан). Реакционую смесь перемешивали при 0oС в течение 15 минут и обрабатывали, добавляя по каплям (15 минут) 1 М раствор (R)-(+)-3-метокси-α-метилбензиламина (1,51 г, 10 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали 1 час при 0oС и выливали в раствор этанола (100 мл), содержащего цианоборгидрид натрия (1 г, 16 ммоль). Реакционную смесь перемешивали 48 часов при комнатной температуре, разбавляли эфиром и нейтрализовали 1 н NaOH. Эфирный слой удаляли и концентрировали до масла. Продукт хроматографировали на диоксиде кремния с использованием градиента дихлорметан 5% метанол в дихлорметане с получением ненасыщенного промежуточного продукта, являющегося индивидуальным веществом согласно GC/E1-MS (Rt= 10,06 мин) m/z (отн. инт.) 281 (М+, 17), 266 (59), 176 (19), 146 (65), 135 (73), 131 (100), 91 (21), 77 (13).
Ненасыщенный промежуточный продукт в этаноле гидрировали (1 атм H2) в присутствии палладия на углероде в течение 16 часов при комнатной температуре. Продукт этой реакции превращали в гидрохлоридную соль обработкой 1 М НCl в диэтиловом эфире. GC/E1-MS (Rt=9,31 мин) этого продукта (свободного основания) показала индивидуальное вещество: m/z (отн.инт.) 283 (М+, 21), 268 (100), 164 (12), 148 (8), 136 (85), 121 (12), 105 (49), 91 (23), 77 (21).
Пример 12. Синтез соединения 12V
Гидрохлорид N-3-(3-метилфенил)-1-пропил(R)-3-метокси-α-метилбензиламина
Это соединение получали согласно методике, описанной в Примере 11, но с использованием 2-метилциннамонитрила. Ненасыщенный промежуточный продукт представлял собой индивидуальное вещество согласно GC/E1-MS (Rt=10,21 мин) m/z (отн. инт.) 281 (М+, 57), 266 (86), 146 (98), 135 (88), 131 (100), 115 (43), 102 (26), 91 (43), 77 (18). Восстановление этого продукта и получение гидрохлорида по описанной в Примере 11 методике давало конечный продукт. GC/E1-MS (Rt=9,18 мин) этого продукта (свободного основания) показала наличие индивидуального вещества: m/z (отн. инт.) 283 (M+, 19), 268 (100), 164 (11), 148 (8), 135 (76), 121 (16), 105 (45), 91 (23), 77 (21).
Пример 13. Синтез соединения 12Z
Гидрохлорид N-3-(2-хлорфенил)-1-пропил-(R)-1(1-нафтил)этиламина
Это соединение получали согласно описанной в Примере 11 процедуре, но с использованием 2-хлоргидроциннамонитрила и (R)-(+)-1-(1-рафтил)этиламина в количестве 10 ммоль. Хроматография на диоксиде кремния с применением градиента дихлорметан 5% метанол в дихлорметане давала продукт в виде индивидуального соединения согласно анализу ТХ (5% метанол в дихлорметане). Гидрохлорид получали обработкой 1 М НCl в диэтиловом эфире.
Пример 14. Синтез соединения 14U
Гидрохлорид (R)-N-(1-(4-метоксифенил)этил)-(R)-1-(1-нафтил)этиламина
Смесь (R)-(+)-1-(1-нафтил)этиламина (1,1 г, 6,2 ммоль), 4'-метоксиацетофенона (0,93 г, 6,2 ммоль), изопропоксида титана(IV) (2,2 г, 7,7 ммоль) и EtOH (абс.) (1 мл) нагревали до 60oС в течение 3 часов. Затем добавляли цианоборгидрид натрия (NaCNBH3) (0,39 г, 6,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли эфир (200 мл) и Н2O (2 мл) и затем полученный осадок удаляли центрифугированием. Супернатант выпаривали в вакууме и неочищенный продукт хроматографировали на силикагеле (колонка 25 мм х 25 см) (элюция смесью 1% MeOH/CHCl2). Часть этого продукта хроматографировали при помощи ЖХВР [Selectosil, 5 мкМ силикагель; 25 см х 10,0 мм (Phenomenex, Torrance СА), 4 мл/мин; УФ-детект. 275 нм; 12% этилацетат 88% гексан (время элюции 12,0 минут)] . Затем очищенный при помощи ЖХВР диастереои-зомер растворяли в гексане и добавляли НCl в эфире для осаждения продукта в виде белого твердого вещества (20 мг), т. пл.: 209-210oС (разл.).
Пример 15. Синтез соединения 17М
Гидрохлорид N-(3-хлор-4-метоксибензил)-(R)-1(1-нафтил)этиламина
Смесь (R)-(+)-1-(1-нафтил)этиламина (6,6 г, 39 ммоль), 3'-хлор-4'-метоксибензальдегида (6,6 г, 39 ммоль), изопропоксида титана(IV) (13, 8 г, 48,8 ммоль) и EtOH (абс. ) (30 мл) нагревали до 80oС в течение 30 минут, затем оставляли перемешиваться при комнатной температуре в течение 3 часов. Затем добавляли цианоборгидрид натрия (NaCNBH3) (2,45 г, 39 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли эфир (100 мл) и Н2О (2 мл) и затем полученный осадок удаляли центрифугированием. Супернатант выпаривали в вакууме и неочищенный продукт хроматографировали на силикагеле (колонка 50 мм х 30 см) (элюция СН2Cl2). Затем хроматографированный продукт растворяли в гексане (500 мл), обесцвечивали отфильтрованным Норитом R(0,2 мкМ) и затем добавляли НCl в эфире для осаждения продукта в виде белого твердого вещества (10,2 г, выход 56%), т. пл.: 241-242oС (разл.).
Пример 16. Синтез соединения 17Р
4-Метокси-3-метилацетофенон (предшественник 17 Р)
Смесь 4'-гидрокси-3'-метилацетофенона (5,0 г, 33,3 ммоль), иодометана (5,7 г, 40,0 ммоль), К2СО3 (гранулированного, безводного) (23,0 г, 167 ммоль) и ацетона (250 мл) нагревали с обратным холодильником в течение 3 часов. Затем реакционную смесь охлаждали до комнатной температуры, фильтровали для удаления неорганических солей и выпаривали в вакууме. Неочищенный продукт растворяли в эфире (100 мл) и промывали Н2O (2 х 20 мл). Органический слой сушили (Na2SO4) и выпаривали с получением 4,5 г продукта (выход 82,4%). Полученный кетон использовали в следующей реакции без дополнительной очистки.
Гидрохлорид (R)-N-(1-(4-метокси-3-метилфенил)этил)-(R)-1-(1-нафтил)этиламина [соединение 17Р]
Смесь (R)-(+)-1-(1-нафтил)этиламина (4,24 г, 24,8 ммоль), 4'-метокси-3'-метилацетофенона (4,06 г, 24,8 ммоль), изопропоксида титанa(IV) (8,8 г, 30,9 ммоль) и EtOH (абс.) (1 мл) нагревали до 100oС в течение 2 часов. Добавляли изопропанол (45 мл) и реакционную смесь охлаждали до 10oС на бане со льдом. Затем добавляли порциями триацетоксиборгидрид натрия (NаНВ(O2ССН3)3) (10,5 г, 49,5 ммоль) в течение более 15 минут. Затем реакционную смесь нагревали до 70oС в течение 18 часов. Смесь охлаждали до комнатной температуры и выливали в эфир (400 мл). Суспензию центрифугировали, супернатант собирали и осадок промывали эфиром (400 мл). Объединенные органические промывки выпаривали в вакууме. Остаток растворяли в эфире (400 мл) и промывали 1 н NaOH (4 х 50 мл) и Н2O (2 х 50 мл). Органический слой сушили (Na2SO4), фильтровали и выпаривали в вакууме. EtOH (абс.) добавляли к влажному остатку и затем тщательльно сушили на роторном испарителе с получением масла. Затем эту смесь хроматографировали на силикагеле (колонка 50 мм х 30 см) [элюция смесью (1% МеОН: 1% IРА:СНCl3) с получением 4,8 г масла].
Желаемый диастереоизомер далее очищали при помощи ЖХВР [SUPERCOSILТМ PLC-Si, 18 мкМ силикагель; 25 см х 21,2 мм (Supeico, Inc., Bellefonte, PA), 7 мл/мин; УФ-детект. 275 нм: 20% EtOAc-80% гексан (время элюции 9,5 11,0 минут)] . Инъекции (аликвоты по 800 мкл) смеси (100 мг/мл раствор в элюенте) дали 65 мг желаемого изомера. Множественные инъекции ЖХВР дали 1,0 г очищенного продукта. Очищенный ЖХВР продукт растворяли в гексане (50 мл) и гидрохлоридную соль осаждали НCl в эфире. Соль собирали на стеклянном фильтре и промывали гексаном с получением 1,0 г белого твердого вещества, т. пл. 204-205oС.
Пример 17. Синтез соединения 17Х
3-Хлор-4-метоксибензалъдегид
Смесь 3-хлор-4-гидроксибензальдегида (25 г, 160 ммоль), иодметана (27,25 г, 192 ммоль), К2СО3 (гранулированного, безводного) (110,6 г, 800 ммоль) и ацетона (300 мл) нагревали с обратным холодильником в течение 3 часов. Затем реакционную смесь охлаждали до комнатной температуры. Добавляли диэтиловый эфир (500 мл) и смесь фильтровали через фильтровальную бумагу для удаления неорганических твердых веществ. Фильтрат выпаривали при пониженном давлении, растворяли в диэтиловом эфире (800 мл) и промывали 0,1 н NaOH (3 х 100 мл). Органический слой сушили (Na2SO4) и выпаривали в вакууме с получением 24 г (выход 92%) неочищенного продукта. Этот продукт далее очищали хроматографией на силикагеле (колонка 50 мм х 30 см) (элюция смесью гексан-EtOH, 5:1) с получением 15,02 г (выход 56%) белого твердого вещества: ТХ (гексан-ЕtOАс, 5:1) Rt=0,24; GC Rt=4,75 мин; MS (El) m/z 170 (М+), 172 (М+2).
1-Метил-(3'-хлор-4'-метоксибензиловый) спирт
Смесь 3-хлор-4-метоксибензальдегида (13 г, 76,5 ммоль), хлорида метилмагния (52 г, 153 ммоль) и ТГФ (300 мл) нагревали с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли NH4Cl (насыщенный раствор, 6 мл) и эту смесь фильтровали через фильтровальную бумагу для удаления неорганических твердых веществ. Фильтрат выпаривали при пониженном давлении и полученное твердое вещество растворяли в диэтиловом эфире (300 мл) и промывали водой (4 х 25 мл). Органический слой сушили (Na2SO4) и выпаривали в вакууме с получением 11,3 г, выход 80%, неочищенного продукта. Этот продукт очищали далее хроматографией на силикагеле (50 мм х 30 см) (элюция СН3Сl2) с получением 11,3 г, выход 63%, масла; ТХ (СН2Cl2) Rt=0,25; GC Rt=5,30 мин; MS (EI) m/z 186 (М+), 188 (М+2).
3'-Хлор-4'-метоксиацетофенон
Смеси 1-метил-(3'-4'-метоксибензилового) спирта (7,6 г, 41 ммоль), хлорхромата пиридиния (РСС) (13,16 г, 61,5 ммоль) и СН2Сl2 (300 мл) перемешивали при комнатной температуре в течение 2 часов. Добавляли диэтиловый эфир (1000 мл) и полученную смесь пропускали через хрома-тографическую колонку с силикагелем (50 мм х 30 см) (элюция диэтиловым эфиром) с получением 7,3 г, выход 97%, неочищенного твердого продукта. GC-анализ этого продукта показал 99% чистоту и его использовали в следующей реакции без дополнительной очистки. Тонкослойная хроматография (ТХ) (диэтиловый эфир) Rt=l,0; GC Rt=5,3 мин; MS (EI) m/z 184 (М+), 184 (М+2).
(R,R)-N-(1-Этил-4'-метокси-3'-хлорфенил)-1(1-нафтилэтил) амин
Смесь 3'-хлор-4'-метоксиацетофенона (5,3 г, 29 ммоль), (R)-(+)-1-(1-нафтил)этиламина (4,98 г, 29 ммоль), изопропоксида титана(IV) (10,2 г, 36 ммоль) и изопропанола (20 мл) нагревали до 100oС в течение 3 часов. Добавляли порциями триацетоксиборгидрид натрия (NаВ(O2ССН3)3 (12,29 г, 58 ммоль) в течение более 10 минут. Реакционную смесь нагревали с обратным холодильником в течение 30 минут и затем оставляли перемешиваться при комнатной температуре в течение 18 часов. Затем смесь выливали в диэтиловый эфир (500 мл), добавляли Н2O (2 мл) и суспензию центрифугировали для удаления мелкого осадка солей титана. Супернатант собирали и осадок промывали эфиром (500 мл). Объединенные органические слои сушили (Na2SO4) и выпаривали в вакууме с получением 6,81 г, 70%, неочищенного продукта.
Этот продукт далее очищали хроматографией на силикагеле (50 мм х 30 см) (элюция смесью 3% МеОН-97% СН2Сl2) с получением 2,01 г масла. Диастереоизомер далее очищали перекристаллизацией. Свободное основание (1,98 г) превращали в его гидрохлоридную соль с использованием НCl в эфире. Соль растворяли в горячем изопропаноле (65 мл) и этот раствор фильтровали через фильтровальную бумагу. Фильтрат выпаривали в вакууме и полученное твердое вещество растворяли в изопропаноле (30 мл). После стояния при комнатной температуре в течение 18 часов собирали кристаллическое твердое вещество, промывали холодным изопропанолом (20 мл) и сушили с получением 0,87 г, 40% (от свободного основания) диастереоизомерно чистой гидрохлоридной соли: т.пл. 236-237oС (разл. ); ТХ (MeOH-CH2Cl2 [99: 1] ) Rt=0,25; GC Rt=11,06 мин; FTIR (осадок КВr, см-1) 3433, 2950, 2931, 2853, 2803, 2659, 2608, 2497, 1604, 1595, 1504, 1461, 1444, 1268, 1260, 1067, 1021, 802, 781, 733; MS (EI) m/z 339 (М+, 341 (М+2).
Пример 18. Дополнительный протокол синтеза
Получение 22Z и 23А
Перемешиваемый раствор гидрида натрия (2,173 г, 60% в масле, 54,325 ммоль) в диметилформамиде (100 мл) обрабатывали по каплям триэтилфосфоноацетатом (12,47 г, 55,65 ммоль) и перемешивали 30 минут при комнатной температуре. После этого периода времени добавляли по каплям раствор м-трифторметоксибензальдегида (10,0 г, 52,6 ммоль) в диметилформамиде (50 мл) и раствор перемешивали 30 минут при комнатной температуре и 30 минут при 100oС. Реакцию гасили добавлением воды и реакционную смесь переносили в делительную воронку с использованием диэтилового эфира (500 мл). Эфирный раствор промывали насыщенным раствором хлорида аммония (4 х 500 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали с получением этил-м-трифторметоксициннамата в виде масла; m/z (отн. инт.) 260 (М+, 19), 232 (16), 215 (100), 187 (21), 101 (28).
Этиловый эфир в этаноле (100 мл) восстанавливали водородом при 60 psi (413685,42 Па) с применением каталитического количества (10 мас.%) гидроксида палладия. После восстановления (2 часа при комнатной температуре) реакционную смесь фильтровали и концентрировали с получением этил-м-трифторметоксигидроциннамата в виде масла; m/z (отн. инт.) 262 (М+, 16), 217 (7), 188 (100), 175 (28), 103 (31), 91 (18), 77 (23).
Насыщенный этиловый эфир гидролизовали в растворе этанол-10 М гидроксид натрия (1: 1) в течение 16 часов при комнатной температуре. После этого времени раствор подкисляли и продукт экстрагировали диэтиловым эфиром. Эфирный раствор сушили над безводным сульфатом магния и концентрировали с получением м-трифторметоксигидрокоричной кислоты в виде твердого вещества; m/z (отн. инт. ) 234 (М+, 46), 188 (100), 174 (65), 103 (27), 91 (12), 77 (17).
Кислоту перемешивали в избытке тионилхлорида в течение 4 часов при комнатной температуре. Избыток тионилхлорида выпаривали при пониженном давлении (100oС) с получением м-трифторметоксигидроциннамилхлорида в виде масла. Этот продукт использовали без дополнительной очистки.
Раствор м-трифторметоксициннамилхлорида (9,8 г, 39 ммоль) в тетрагидрофуране охлаждали до -78oС и обрабатывали по каплям раствором (13 мл 3 М в тетрагидрофуране) бромида метилмагния (39 ммоль). Реакционную смесь перемешивали в течение 4 часов при -78oС, 8 часов при комнатной температуре и гасили реакцию разбавленной НCl. Реакционную смесь экстрагировали диэтиловым эфиром. Эфир сушили над безводным сульфатом магния, фильтровали и концентрировали до масла. Хроматография этого продукта на диоксиде кремния с применением градиента гексан-ацетон давала 4-(3-трифторметоксифенил)-2-бутанон в виде масла; m/z (отн. инт.) 232 (М+, 68), 217 (7), 189 (59), 175 (31), 103 (28), 43 (100).
Раствор 4-(3-трифторметоксифенил)-2-бутанона (2,32 г, 10 ммоль), (R)-1-(3-метоксифенил)этиламина (1,51 г, 10 ммоль) и изопропоксида титана(IV) (3,55 г, 12,5 ммоль) перемешивали в течение 4 часов при комнатной температуре. Затем реакционную смесь обрабатывали раствором (10 мл 1 М) цианоборгидрида натрия в этаноле (10 ммоль) и перемешивали 16 часов при комнатной температуре. Реакционную смесь разбавляли диэтиловым эфиром (50 мл) и обрабатывали водой (0,72 мл, 40 ммоль). После основательного смешивания раствор центрифугировали и эфирный слой декантировали и концентрировали до маслянистого твердого вещества. Это твердое вещество суспендировали в диэтиловом эфире, фильтровали через CR PTFE Acrodisc 0,45 мкМ и концентрировали с получением прозрачного масла. Повторная препаративная тонкослойная хроматография с использованием 5% метанола в хлороформе дала два диастереоизомера, (S,R)-N-[4-(3-трифторметоксифенил)-2-бутил]-1-(3-метоксифенил)этиламин, 22Z; [m/z (отн. инт. ) 367 (М+, 3), 352 (20), 232 (4), 178 (47), 135 (100), 105 (14), 91 (10), 77 (11)] и (R,R)-N-[4-(3-трифторметоксифенил)-2-бутил]-1-(3-метоксифенил)этиламин, 23А; m/z (отн. инт.) 367 (М+, 3), 352 (19), 232 (7), 178 (43), 135 (100), 105 (19), 91 (10), 77 (11).
Получение 22Х и 22Y
Подобным образом равное молярное количество 4-(3-трифторметоксифенил)-2-бутанона, (R)-1-(1-нафтил)этиламина и 1,25 эквивалента изопропоксида титана(IV) перемешивали и промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и повторяемая тонкослойная хроматография с использованием 5% метанола в хлороформе дали (S,R)-N-[4-(3-трифторметоксифенил)-2-бутил] -1-(1-нафтил)этиламин, 22Х; m/z (отн. инт.) 387 (М+, 3), 372 (15), 198 (15), 176 (12), 155 (100), 128 (8), 115 (6), 109 (4), 103 (5), 77 (8) и (R,R)-N-[4-(3-трифторметоксифенил)-2-бутил]-1-(1-нафтил)этиламин, 22Y; m/z (отн. инт. ) 387 (М+, 2), 372 (12). 198 (16), 176 (11), 155 (100), 128 (8), 115 (6), 109 (4). 103 (5), 77 (8).
Получение 4Т
Подобным образом равное молярное количество 4-(2-хлорфенил)-2-бутанона, полученного из о-хлорбензальдегида, (R)-1(3-метоксифенил)этиламина и 1,25 эквивалента изопропоксида титана(IV) перемешивали и промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и повторяемая тонкослойная хроматография с использованием 5% метанола в хлороформе дали (R, R)-N-[2-хлорфенил)-2-бутил] -1-(3-метоксифенил)этиламин, 4Т; m/z (отн. инт. ) 317 (М+, 3), 302 (15), 178 (62), 178 (62), 135 (100), 125 (15). 105 (10), 91 (6), 77 (8).
Получение 21Y
Подобным образом равное молярное количество 4-(3-трифторметилфенил)-2-бутанона, полученного из м-трифторметилбензальдегида, (R)-1-(3-метоксифенил)этиламина и 1,25 эквивалента изопропоксида титана(IV) перемешивали и промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и повторяемая тонкослойная хроматография с использованием 5% метанола в хлороформе дали (R,R)-N-[4-(3-трифторметилфенил)-2-бутил]-1-(3-метоксифенил)-этиламин, 21Y [m/z (отн. инт.) 351 (М+, 2), 336 (18), 216 (4), 202 (3), 178 (45), 135 (100), 105 (13), 91 (9), 77 (8)] и (S,R)-N-[4-(3-трифторметилфенил)-2-бутил]-1-(3-метоксифенил)этиламин, 21X.
Получение 25С и 25D
Подобным образом равное молярное количество 4-(3-трифторметилфенил)-2-бутанона, (R)-1-(1-нафтил)этиламина и 1,25 эквивалента изопропоксида титана(IV) перемешивали и промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и повторяемая тонкослойная хроматография с использованием 5% метанола в хлороформе дали (S,R)-N-[4-(3-трифторметилфенил)-2-бутил] -1-(1-нафтил)-этиламин, 25С [m/z (отн. инт.) 371 (М+, 3), 356 (16), 198 (15), 155 (100), 129 (8), 115 (5), 109 (3), 77 (2)] и (R,R)-N-[4-(3-трифторметилфенил)-2-бутил] -1-(1-нафтил)этиламин, 25D; m/z (отн. инт.) 371 (M+, 3), 356 (16), 198 (15), 155 (100), 129 (8), 155 (5), 109 (3), 77 (2).
Получение 21D
Подобным образом равное молярное количество 4-фенил-2-бутанона (Aldrich Chemical Co. ), (R)-1-(3-метоксифенил)этиламина и 1,25 эквивалента изопропоксида титана(IV) перемешивали и промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и повторяемая тонкослойная хроматография с использованием 5% метанола в хлороформе дали (R,R)-N-(4-фенил-2-бутил)-1-(3-метоксифенил)этил-амин, 21D [m/z (отн. инт.) 283 (М+, 4), 268 (13), 178 (45), 138 (100), 105 (15), 91 (43), 77 (11)] и (S,R)-N-(4-фенил-2-бутил)-1-(3-метоксифенил)-этиламин, 21 Е.
Получение 21F
Подобным образом равное молярное количество 4-фенил-2-бутанона (Aldrich Chemical Co. ), (R)-1-(1-нафтил)этиламина и 1,25 эквивалента изопропоксида титана(IV) перемешивали и промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и повторяемая тонкослойная хроматография с использованием 5% метанола в хлороформе дали (R,R)-N-(4-фенил-2-бутил)-1-(1-нафтил)этиламин, 21F; m/z (отн. инт.) 303 (М+, 6), 288 (14), 198 (22), 155 (100), 129(8), 115 (5), 91 (19), 77 (4).
Получение 12Z
Перемешиваемый раствор 2-хлоргидроциннамонитрила (Aldrich Chemical Co., 1,66 г, 10 ммоль) в дихлорметане (100 мл) охлаждали до -78oС и обрабатывали, добавляя по каплям гидрид диизобутилалюминия (1,42 г, 10 ммоль). Реакционную смесь перемешивали 1 час при комнатной температуре, охлаждали до -78oС и обрабатывали раствором 1-(1-нафтил)этиламина (1,71 г, 10 ммоль) в дихлорметане (25 мл). Реакционную смесь переносили на баню со льдом и перемешивали 2 часа. После этого периода времени реакционную смесь выливали непосредственно в перемешиваемый раствор боргидрида натрия в этаноле (50 мл 0,2 М, 10 ммоль). Смесь перемешивали 30 минут при комнатной температуре и избыток боргидрида натрия гасили добавлением 10% НCl. Затем раствор подщелачивали добавлением 10 н. NaOH и переносили в делительную воронку, промывая диэтиловым эфиром (300 мл). Водную фазу удаляли и оставшийся органический слой промывали 1 н NaOH (3 х 100 мл). Органический слой сушили над безводным сульфатом магния и концентрировали до масла. Хроматография этого продукта через силикагель с использованием градиента хлороформ 10% метанол-хлороформ дала 2,34 г (выход 72%) (R)-N-[3-(2-хлорфенил)пропил]-1-(1-нафтил)-этиламина, 12Z, в виде прозрачного масла; m/z (отн. инт.) 323 (М+, 2), 308 (63), 288 (7), 196(5), 184(5), 155(100), 125(24), 115(8), 103 (4), 91 (3), 77 (7).
Получение 12В
Подобным образом 4-метилциннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-[3-(4-метилфенил)проп-2-енил] -1-(3-метоксифенил)-этиламин, 12В, в виде прозрачного бесцветного масла; m/z (отн. инт. ) 281 (М+, 6), 266 (5), 176 (27), 146 (75). 135 (63), 131 (100), 115 (25), 105 (21), 91 (21), 77 (21).
Получение 12С
Подобным образом 2-метилциннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-[3-(2-метилфенил)проп-2-енил] -1-(3-метоксифенил)-этиламин, 12С, в виде прозрачного бесцветного масла; m/z (отн. инт.) 281 (М+, 4), 266 (15), 176 (18), 146 (62), 135 (58), 131 (100), 115 (23), 105 (19), 91 (38), 77 (17).
Получение 12D
Подобным образом 2,4,6-триметилциннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-[3-(2,4,6-триметилфенил)проп-2-енил] -1-(3-метоксифенил)этиламин, 12D, в виде прозрачного бесцветного масла; m/z (отн. инт. ) 309 (M+, 8), 294 (25), 174 (82), 159 (100), 135 (52), 129 (29), 105 (21), 91 (17). 77 (14).
Получение 12Е
Подобным образом 4-изопропилциннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-[3-(4-изопропилфенил)проп-2-енил] -1-(3-метоксифенил)этиламин, 12Е, в виде прозрачного бесцветного масла; m/z (отн. инт.) 309 (М+, 9), 294 (7), 174 (98), 159 (22), 135 (80), 117 (100), 105 (35), 91 (37), 77 (19).
Получение 12F
Подобным образом 2,4-диметилциннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-[3-(2,4-диметилфенил)про-2-енил] -1-(3-метоксифенил)этиламин, 12F, в виде прозрачного бесцветного масла; m/z (отн. инт.) 295 (М+, 8). 294 (15), 174 (29), 160 (75). 145 (100), 135 (68), 117(21), 105 (30), 91 (26), 77 (19).
Получение 12G
Подобным образом 3-метилциннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-[3-(3-метилфенил)проп-2-енил] -1-(3-метоксифенил)-этиламин, 12G, в виде прозрачного бесцветного масла; m/z (отн. инт. ) 281 (М+, 5), 266 (9), 176 (24), 146 (71). 135 (62), 131 (100), 115 (23), 105 (19), 91 (41), 77 (18).
Получение 25Е
Подобным образом циннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-(3-фенилпроп-2-енил)-1-(3-метоксифенил)этиламин, 25Е, в виде прозрачного бесцветного масла; m/z (отн. инт. ) 267 (М+, 3), 252 (14), 176 (17), 135 (62), 117 (100), 105 (28), 91 (56), 77 (33).
Получение 25G
Подобным образом α-метилциннамонитрил обрабатывали гидридом диизобутилалюминия и промежуточный комплекс алюминий-имин обрабатывали (R)-1-(3-метоксифенил)этиламином. Промежуточный имин обрабатывали боргидридом натрия в этаноле. Обработка и хроматография дали (R)-N-(2-метил-3-фенилпроп-2-енил)-1-(3-метоксифенил)-этиламин, 25G, в виде прозрачного бесцветного масла; m/z (отн. инт. ) 281 (М+, 5), 266 (18), 190 (12), 146 (78), 135 (82), 131 (100), 115 (21), 105 (21), 91 (62). 77 (19).
Получение 6Х
Перемешиваемый раствор гидрида натрия (1,8 г, 75 ммоль) в диметилформамиде (150 мл) обрабатывали раствором диэтилцианометилфофоната (13,3 г, 75 ммоль) в диметилформамиде (50 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. После этого периода времени реакционную смесь обрабатывали 3-хлорбензальдегидом (10,54 г, 75 ммоль) в диметилформамиде (50 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. После этого времени реакционную смесь обрабатывали 3-хлорбензальдегидом (10,54 г, 75 ммоль) и перемешивали 1 час при комнатной температуре и 30 минут при 60oС. Затем реакцию гасили добавлением воды (200 мл). Реакционную смесь переносили в делительную воронку с использованием диэтилового эфира (300 мл) и полученную органическую фазу промывали водой (5 х 300 мл) и солевым раствором. Органический слой сушили над безводным карбонатом калия и концентрировали с получением 3-циннамонитрила (11,06 г) в виде твердого вещества. Твердое вещество растворяли в тетрагидрофуране (50 мл) и обрабатывали избытком диборана и перемешивали 30 минут при комнатной температуре. Реакционную смесь выливали на смесь льда с 10% НCl. Кислую водную фазу промывали диэтиловым эфиром (2 х 200 мл). Водную фазу подщелачивали добавлением 10 н NaOH и экстрагировали диэтиловым эфиром (200 мл). Эфирный экстракт сушили над безводным карбонатом калия и концентрировали с получением 3-(3-хлорфенил)пропиламина в виде масла (0,6 г, 3,54 ммоль). 3-(3-хлорфенил)пропиламин (0,60 г, 3,54 ммоль), 3'-метоксиацетофенон (0,53 г, 3,54 ммоль) и 1,25 молярных эквивалентов изопропоксида титана(IV) (1,26 г, 4,43 ммоль) перемешивали в течение 4 часов при комнатной температуре и промежуточный имин обрабатывали цианоборгидридом в этаноле (5 мл 1 М раствора, 5 ммоль). Реакцию перемешивали 16 часов при комнатной температуре, разбавляли диэтиловым эфиром (50 мл) и обрабатывали водой (0,32 мл, 17,7 ммоль). После основательного перемешивания раствор центрифугировали и эфирный слой концентрировали до белесоватого твердого вещества. Этот продукт суспендировали в диэтиловом эфире и фильтровали через CR PTFE Acrodisc 0,45 мкм. Эфирную промывку концентрировали до масла. Хроматография этого продукта (диоксид кремния, препаративная тонкослойная хроматография) с применением смеси 3% метанол-дихлорметан (содержащей 0,1% изопропиламин) дала N-[3-(3-хлорфенил)пропил] -1-(3-метоксифенил)-этиламин, 6Х; m/z (отн. инт.) 303 (М+, 3), 288 (40), 196 (3), 164 (8), 135 (100), 125 (46), 103 (26), 91 (29), 77 (29).
Получение 6V
Равное молярное количество 3-(4-хлорфенил)пропиламина (полученного подобно описанному выше способу из 4-хлорбензаль-дегида), 3'-метоксиацетофенона и 1,25 молярных эквивалентов изопропоксида титана(IV) перемешивали в течение 4 часов при комнатной температуре и промежуточный имин обрабатывали цианоборгидридом натрия в этаноле (5 мл 1 М раствора, 5 ммоль). Обработка и хроматография дали R-[3-(3-хлорфенил)пропил]-1-(3-метоксифенил)этиламин, 6V, в виде масла; m/z (отн. инт.) 303 (М+, 8), 288 (91), 196 (4), 164 (10), 135 (100), 125 (61), 103 (21) 91 (21), 77 (18).
Получение 20А
Подобным образом равное молярное количество 1-(1-метоксифенил)этиламин, 4-трет-бутилацетофенон и 1,25 молярных эквивалентов изопропоксида титана(IV) перемешивали в течение 4 часов при комнатной температуре и промежуточный имин обрабатывали цианоборгидридом натрия в этаноле (5 мл 1 М раствора, 5 ммоль). Обработка и хроматография дали (R)-N-[1-(4-трет-бутилфенил)этил]-1-(1-нафтил)этиламин, 20А, в виде масла; m/z (отн. инт.) 331 (М+, 12), 316 (29), 161 (70), 155 (100), 131 (14), 127 (13), 115 (10), 105 (6), 91 (10), 77 (7).
Получение 25Н и 25I
Подобным образом равное молярное количество (R)-1-(3-метоксифенил)этиламин, транс-4-фенил-3-бутен-2-она и 1,25 молярных эквивалентов изопропоксида титана(IV) перемешивали в течение 4 часов при комнатной температуре и промежуточный имин обрабатывали цианоборгидридом натрия в этаноле (5 мл 1 М раствора, 5 ммоль). Обработка и хроматография дали (R,R)-N-(2-метил-4-фенилбут-3-енил)-1-(3-метоксифенил)-этиламин, 25Н, в виде масла; m/z (отн. инт.) 283 (М+, 4) 268 (13), 178 (40). 135 (100), 105 (15), 91 (47), 77 (13) и (S,R)-N-(2-метил-4-фенилбут-3-енил)-1-(3-метоксифенил)этиламин, 25I, в виде масла; m/z (отн. инт.) 283 (M+, 4), 268 (13), 178 (40), 135 (100), 105 (15), 91 (47), 77 (13).
Получение 16L и 16М
Подобным образом равное молярное количество (R)-1-(3-метоксифенил)этиламина, 3-метоксиацетофенона и 1,25 молярных эквивалентов изопропоксида титана(IV) перемешивали в течение 4 часов при комнатной температуре и промежуточный имин обрабатывали цианоборгидридом натрия в этаноле (5 мл 1 М раствора, 5 ммоль). Обработка и хроматография дали (R,R)-N-[1-(4-метоксифенил)этил] -1-метоксифенил)этиламин, 16L, в виде масла; m/z (отн. инт.) 284 (М-1, 1), 270 (85), 150 (83), 135 (100), 120 (12), 105 (28), 91 (25), 77 (23) и (S,R)-N-[1-(4-метоксифенил)-этил]-1-(3-метоксифенил)этиламин, 16М, в виде масла; m/z (отн. инт.) 284 (М-1, 1), 270 (53), 150 (98), 135 (100), 120 (11), 105 (33), 91 (25), 77 (23).
Получение 5В/5С
Подобным образом 4-хлорацетофенон использовали для получения 3-метил-3-(4-хлорфенил)циннамонитрила. Нитрил каталитически восстанавливали (гидроксид палладия, уксусная кислота, 60 psi (413685,42 Па) водорода, 2 часа)) для получения 3-метил-3-(4-хлорфенил)-пропиламина. Равное молярное количество амина, 3'-метоксиацетофенона и 1,25 молярных эквивалентов изопропоксида титана(IV) перемешивали в течение 4 часов при комнатной температуре и промежуточный имин обрабатывали цианоборгидридом натрия в этаноле (5 мл 1 М раствора, 5 ммоль). Обработка и хроматография дали N-[3-метил-3-(4-хлорфенил)пропил] -1-(3-метоксифенил)этиламина, 5В/5С, в виде масла; m/z (отн. инт. ) 317 (M+, 12), 302 (74), 210 (2), 182 (4), 164 (12), 135 (100), 121 (25), 103 (40), 91 (19), 77 (28).
Получение 4Z/5A
Подобным образом 3-хлорацетофенон использовали для получения 3-метил-3-(3-хлорфенил)циннамонитрила. Нитрил каталитически восстанавливали (гидроксид палладия, уксусная кислота, 60 psi (413685,42 Па) водорода, 2 часа)) для получения 3-метил-3-(3-хлорфенил)-пропиламина. Равное молярное количество амина, 3'-метоксиацетофенона и 1,25 молярных эквивалентов изопропоксида титана(IV) перемешивали в течение 4 часов при комнатной температуре и промежуточный имин обрабатывали цианоборгидридом натрия в этаноле (5 мл 1 М раствора, 5 ммоль). Обработка и хроматография дали N-[3-метил-3-(3-хлорфенил)пропил]-1-(3-метоксифенил)этиламин, 4Z/5A, в виде масла; m/z (отн. инт. ) 283 (M+, 17), 268 (71), 164 (13), 135 (100), 121 (21), 105 (27), 91 (26), 77 (14).
Получение 4Y
Подобным образом 2-хлорацетофенон использовали для получения 3-метил-3-(2-хлорфенил)циннамонитрила. Нитрил каталитически восстанавливали (гидроксид палладия, уксусная кислота, 60 psi (413685,42 Па) водорода, 2 часа)) для получения 3-метил-3-(2-хлорфенил)-пропиламина. Равное молярное количество амина, 3'-метоксиацетофенона и 1,25 молярных эквивалентов изопропоксида титана(IV) перемешивали в течение 4 часов при комнатной температуре и промежуточный амин обрабатывали цианоборгидридом натрия в этаноле (5 мл 1 М раствора, 5 ммоль). Обработка и хроматография дали N-[3-(2-хлорфенил)пропил] -1-(3-метоксифенил)этиламин, 4Y, в виде масла; т/г (отн. инт.) 283 (М+, 17), 268 (71), 164 (13), 135 (100), 121 (21), 105 (27), 91 (26). 77 (14).
Получение 6Т
Раствор NFS R-568 (30,3 г, 100 ммоль) в дихлорметане при -78oС обрабатывали по каплям трибромидом бора (50 г, 200 ммоль). Реакционную смесь перемешивали 1 час при комнатной температуре и выливали на лед. Гидробромид экстрагировали из водной фазы хлороформом. Затем растворенные в хлороформе вещества промывали (4 х 100 мл) 50% НCl. Раствор хлороформа после промывки сушили над безводным сульфатом магния и концентрировали с получением гидрохлорида (R)-N-[3-(3-хлорфенил)пропил] -1-(3-гидроксифенил)этиламина в виде твердого вещества. Раствор гидрида натрия (0,48 г, 20 ммоль) в диметилформамиде обрабатывали гидрохлоридом (R)-N-[3-(2-хлорфенил)пропил]-1-(3-гидроксифенил)этиламина (3,25 г, 10 ммоль) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь обрабатывали иодэтаном (1,71 г, 11 ммоль) и перемешивали 16 часов при комнатной температуре. Обработка и хроматография на диоксиде кремния с использованием 3% метанола в хлороформе дали (R)-N-[3-(2-хлорфенил)-пропил]-1-(3-этоксифенил)этиламин, 6Т, в виде масла; т/г (отн. инт.) 316 (М+, 1), 302 (100), 282 (11), 196 (5), 178 (7), 149 (74), 121 (34), 103 (25), 91 (28), 77 (29).
Получение 6R
NPS R-467 использовали подобным образом для получения (R)-N-(3-фенилпропил)-1-(3-этоксифенил)этиламина, 6R, в виде масла; m/z (отн. инт.) 283 (М+, 10), 268 (74), 178 (11), 162 (8), 149 (100), 121 (30). 103 (16), 91 (86), 77 (29).
Получение 3U
Равное молярное количество 3,3-дифенилпропиламина (2,11 г, 10 ммоль), 1'-ацетофенона (1,70 г, 10 ммоль) и 1,25 эквивалента изопропоксида титана(IV) (3,55 г, 12,5 ммоль) перемешивали в течение 4 часов при комнатной температуре. Затем реакционную смесь обрабатывали 1 М раствором цианоборгидрида натрия в этаноле (12,5 мл, 12,5 ммоль) и перемешивали 16 часов при комнатной температуре. Реакционную смесь разбавляли диэтиловым эфиром (50 мл) и обрабатывали водой (0,72 мл, 40 ммоль). После основательного перемешивания эту смесь центрифугировали и эфирный слой декантировали и концентрировали до масла молочного цвета. Масло суспендировали в диэтиловом эфире и фильтровали через CR PTFE Acrodisc 0,45 мкм. Фильтрат суспензии в диэтиловом эфире концентрировали с получением N-(3,3-дифенилпропил)-1-(1-нафтил)этиламина, 3U, в виде прозрачного бесцветного масла; m/z (отн. инт.) 365 (М+, 17), 350 (19), 181 (23), 155 (100), 141 (25), 115 (11), 91 (13), 77 (6).
Получение 6F
Подобным образом равные молярные количества 1-(3-метоксифенил)этиламина (1,51 г, 10 ммоль), 2'-ацетонафтона (1,70 г, 10 ммоль) и 1,25 эквивалента изопропоксида титана(IV) (3,55 г, 12,5 ммоль) обрабатывали, как описано выше. Обработка дала N-[1-2-нафтил)этил]-1-(3-метоксифенил)этиламин, 6F, в виде прозрачного бесцветного масла; m/z (отн. инт.) 305 (М+, 1), 290 (35), 170 (49), 155 (100), 135 (55), 115 (8), 105 (10), 91 (9), 77 (10).
Получение 4G
Подобным образом равные молярные количества (R)-1-фенилэтиламина, 1'-ацетонафтона и 1,25 эквивалента изопропоксида титана(IV) перемешивали и полученный промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и хроматография дали N-[1-(1-нафтил)этил)-1-фенилэтиламин, 4G, в виде прозрачного бесцветного масла; m/z (отн. инт.) 275 (М+, 16), 260 (79), 155 (100), 127 (27), 105 (70). 77 (32).
Получение 4Н
Подобным образом равные молярные количества (R)-1-фенилэтиламина, 2'-ацетонафтона и 1,25 эквивалента изопропоксида титана(IV) перемешивали и полученный промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и хроматография дали N-[1-(2-нафтил)этил]-1-фенилэтиламин, 4Н, в виде прозрачного бесцветного масла; m/z (отн. инт.) 275 (М+, 1), 260 (61), 155 (100), 120 (36), 105 (55), 77(15).
Получение 6Е
Подобным образом равные молярные количества 1-(3-метоксифенил)этиламина, 1'-ацетонафтона и 1,25 эквивалента изопропоксида титана(IV) перемешивали и полученный промежуточный имин восстанавливали цианоборгидридом натрия в этаноле. Обработка и хроматография дали N-1-(1-нафтил)этил-1-(3-метоксифенил)этиламин, 6Е, в виде прозрачного бесцветного масла; m/z (отн. инт.) 305 (М+, 10), 290 (30), 170 (43), 155 (100), 135 (69), 115 (9), 105 (15), 91 (14), 77 (18).
Пример 19. Фармацевтическая препаративная форма
Состав фармацевтической препаративной формы, пригодной для введения кальцимиметика больному человеку, показан в Таблице 3.
Другими примерами препаративных форм и дозированных форм гидрохлорида NPS R-568 являются формы, пригодные для поддерживаемого или пролонгированного высвобождения, получаемые стандартными способами.
Правильное назначение надлежащей дозы можно также определить при помощи стандартных способов. Например, в одной серии экспериментов пероральные дозы 400 мг гидрохлорида NPS (R)-568 показали фармакологическую активность у больных субъектов. Значимые уровни O-глюкуронидного конъюгата 17Q, основного метаболита NPS (R)-568, наблюдали в плазме человека после перорального введения гидрохлорида NPS (R)-568. Таким образом, глюкуронидный конъюгат 17Q может обладать благотворным действием.
При помощи стандартных способов можно определять другие подходящие пределы доз для NPS (R)-568.
Подходящие диапазоны доз, готовые препаративные формы и дозированные формы для других описанных здесь соединений могут быть также определены специалистом в данной области на основании методик, представленных в описании данной заявки.
Другие варианты указаны в следующей далее формуле изобретения. Таким образом, хотя несколько вариантов были представлены и описаны, могут быть сделаны различные модификации без отхода от идеи и объема данного изобретения.

















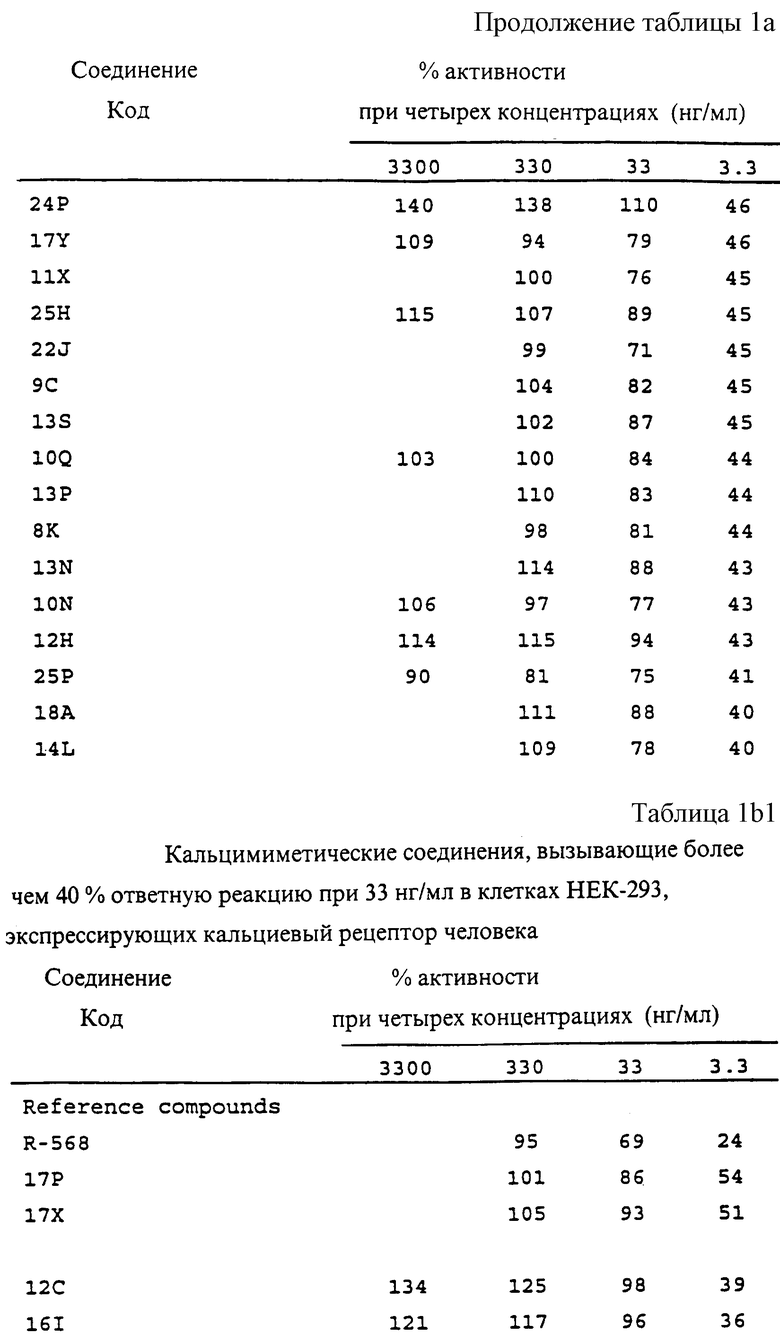
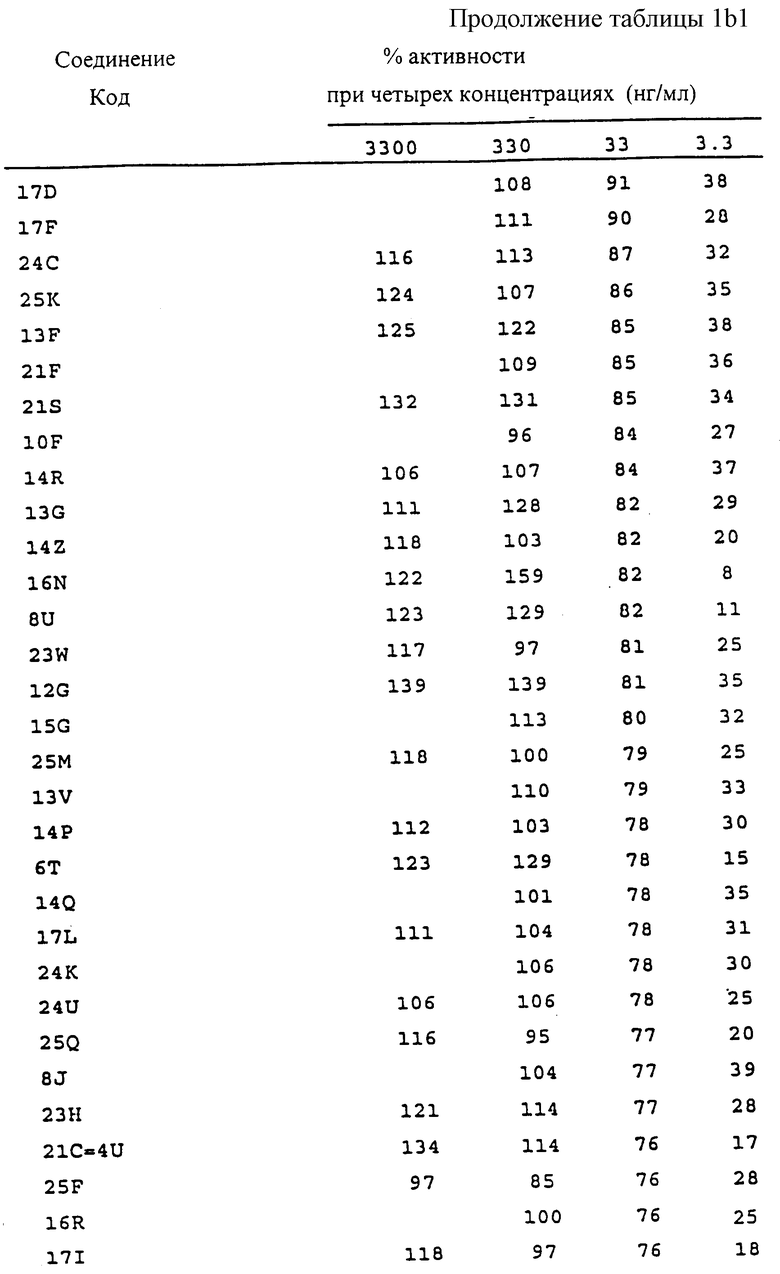
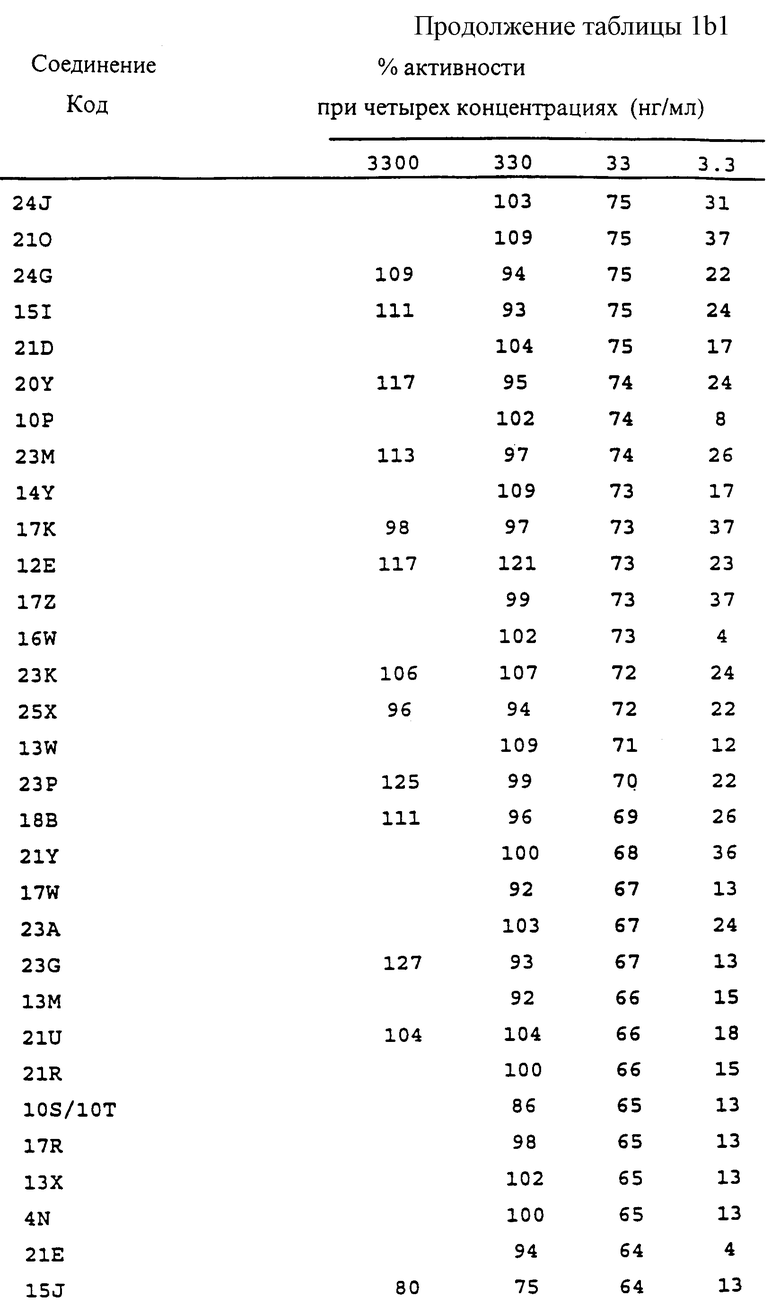
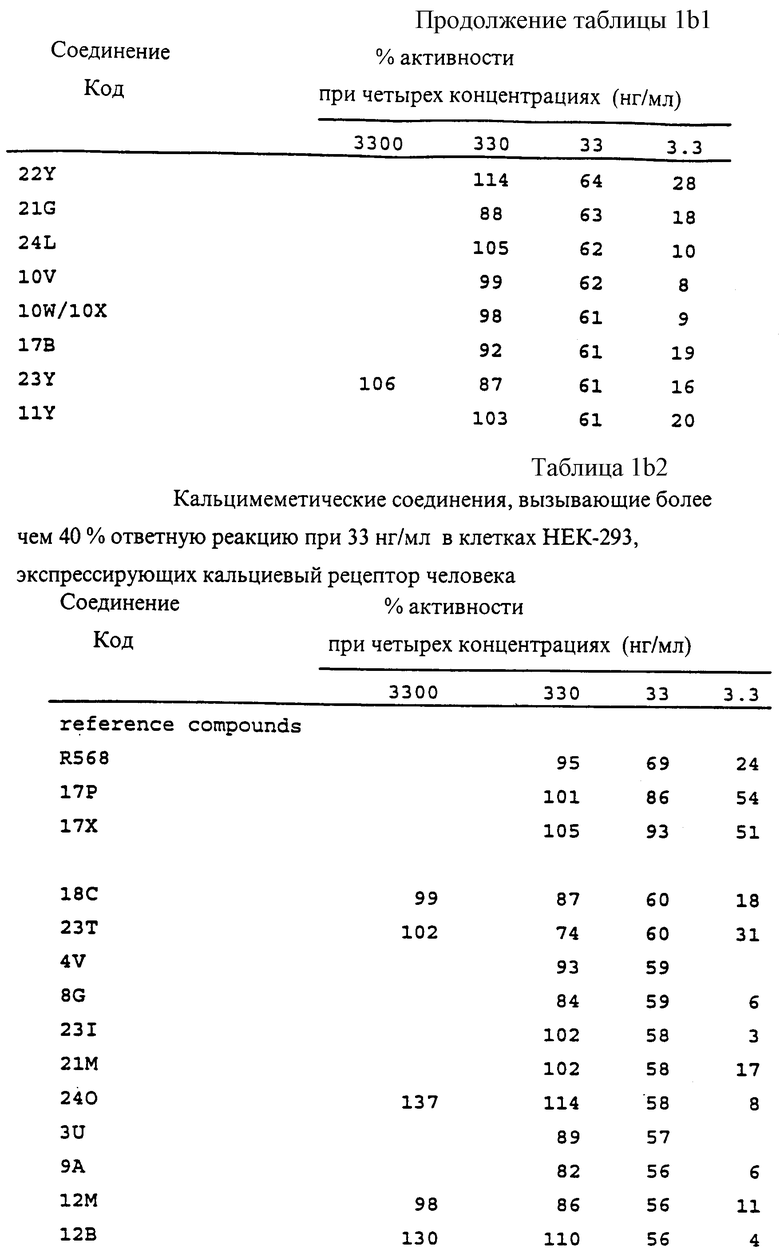
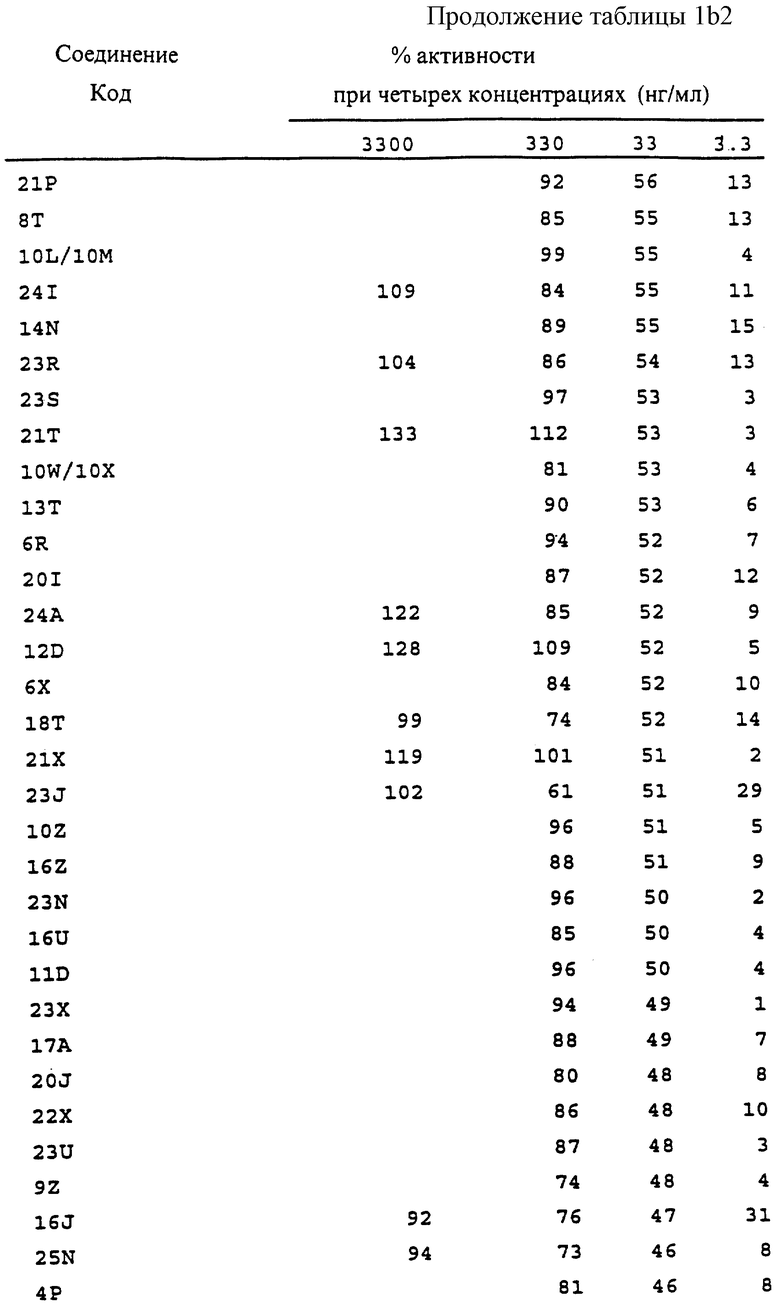
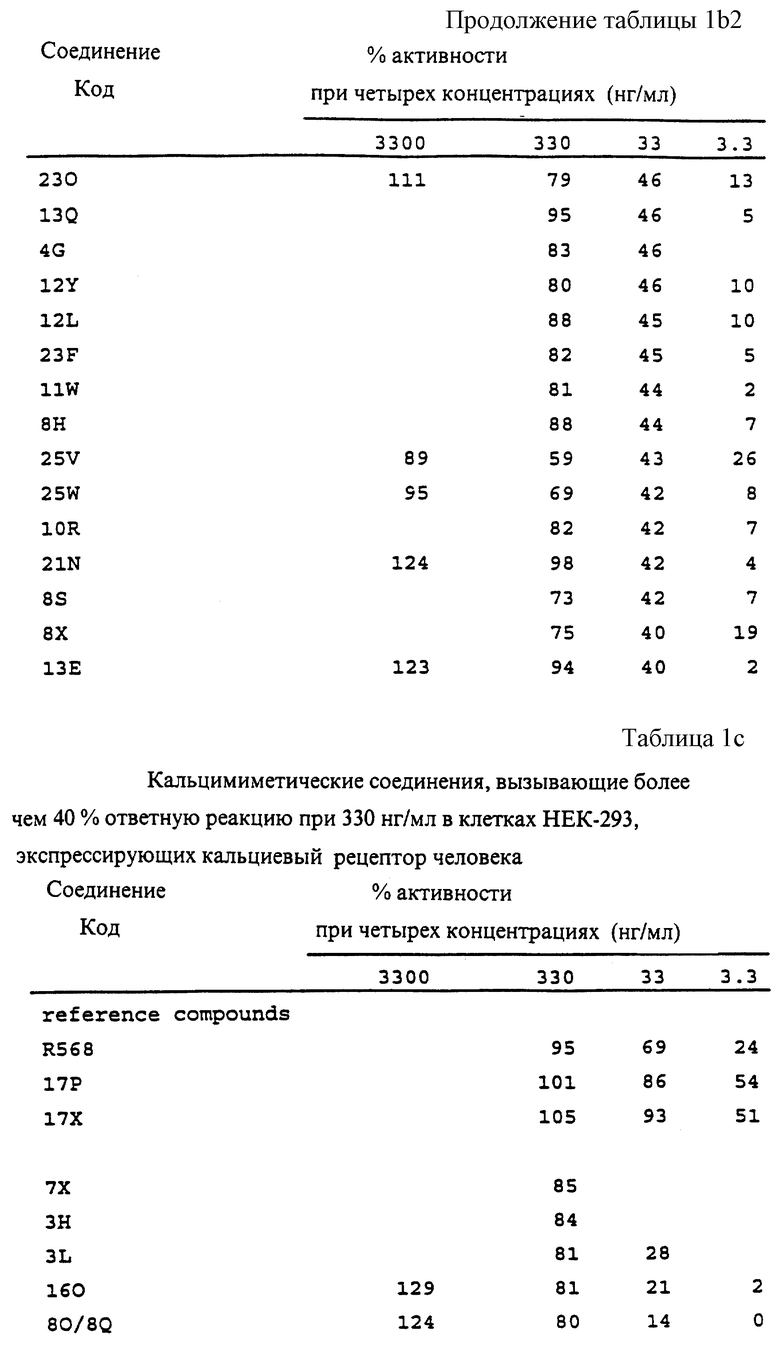
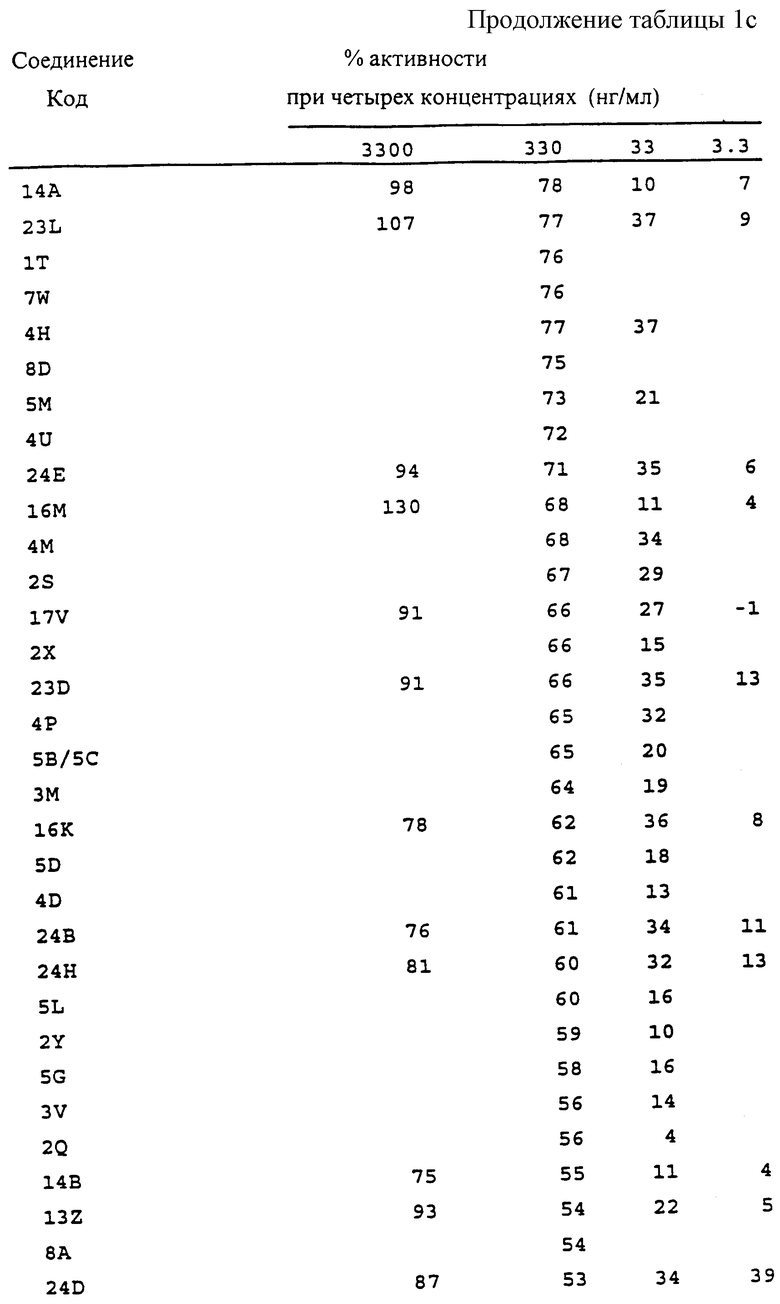

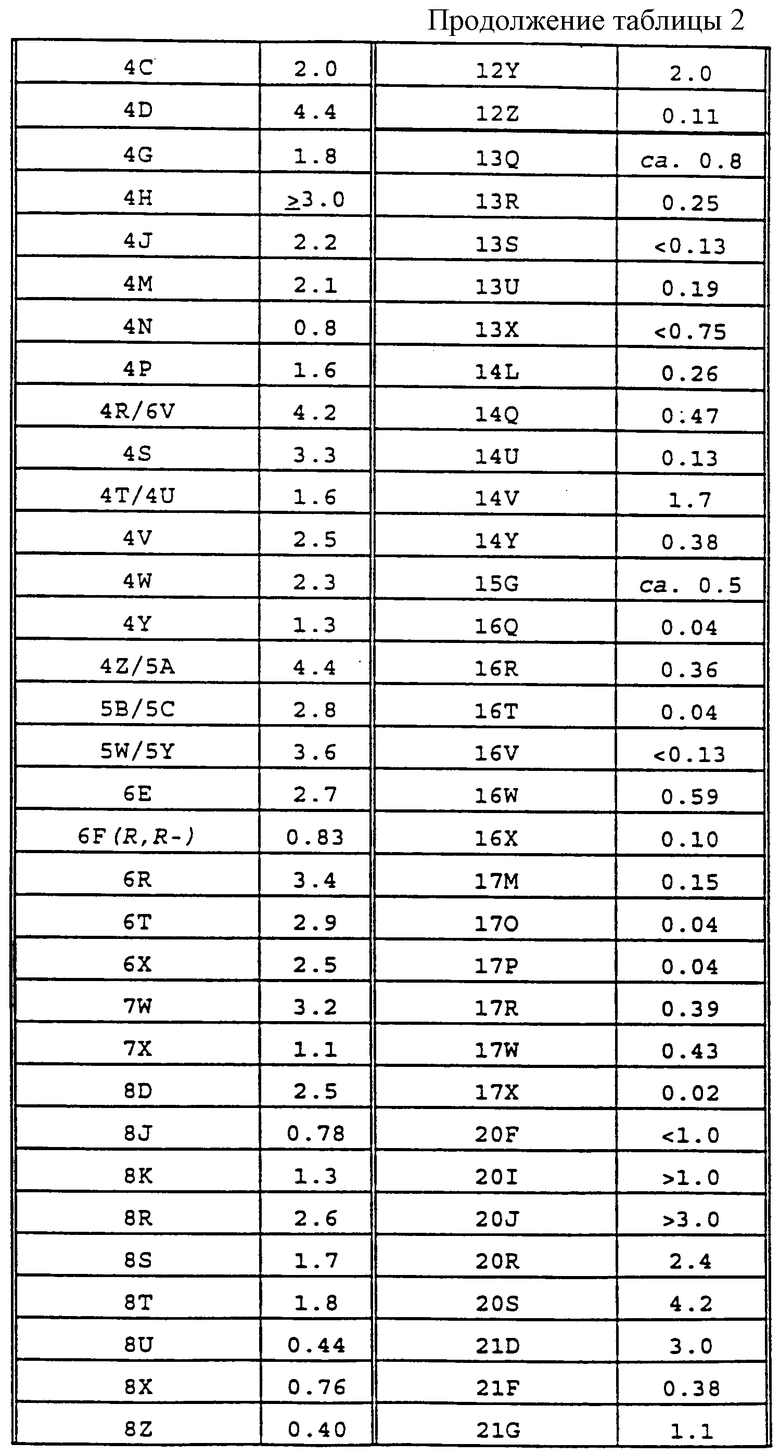
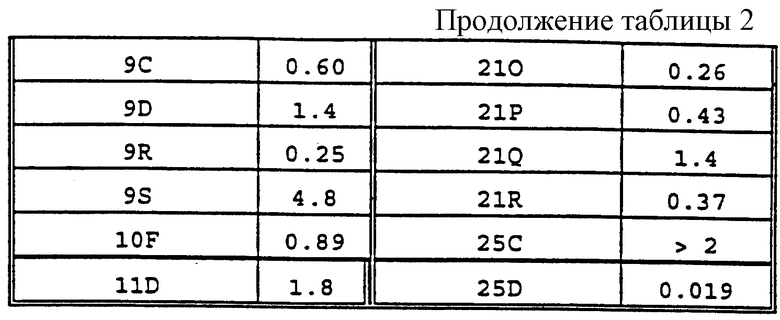
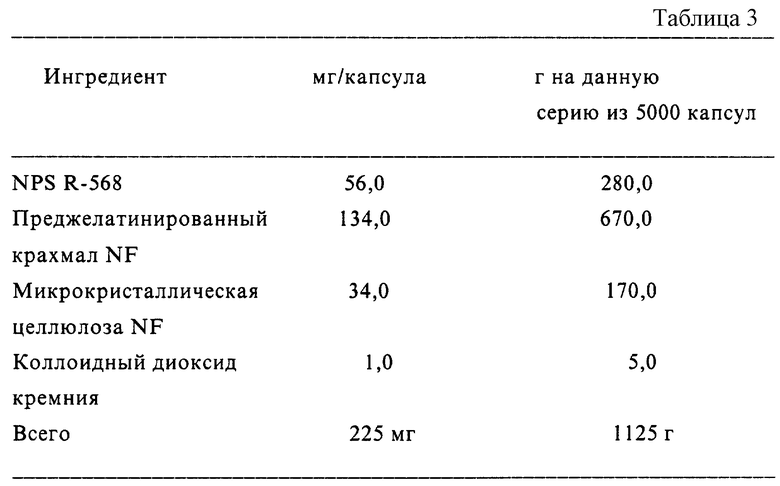
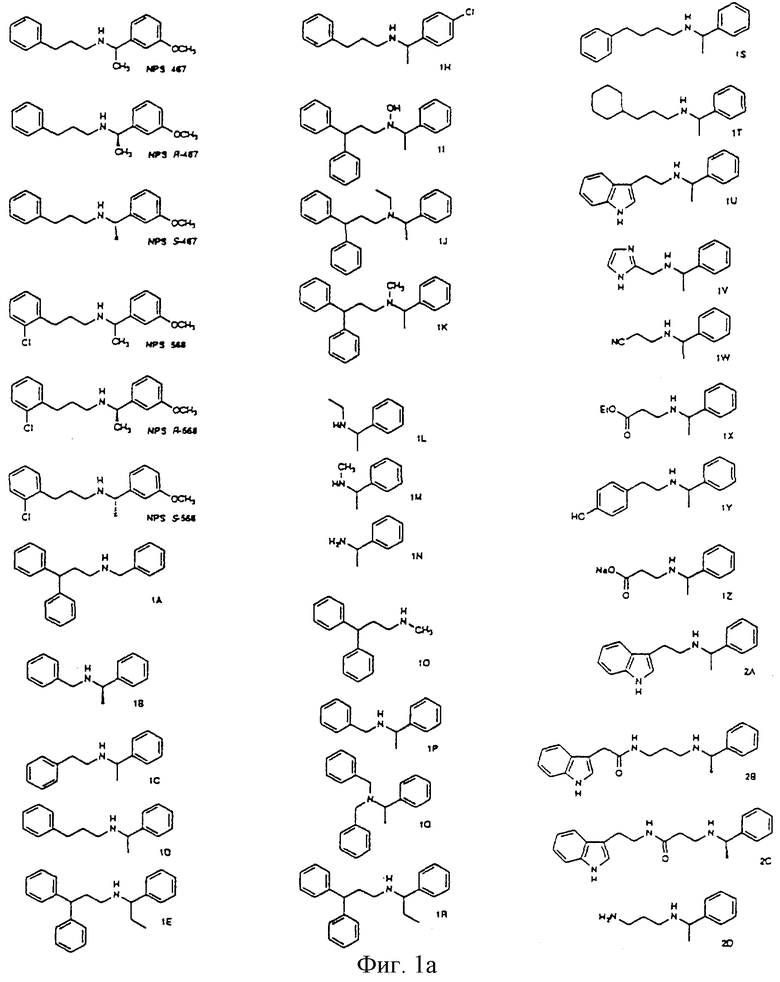
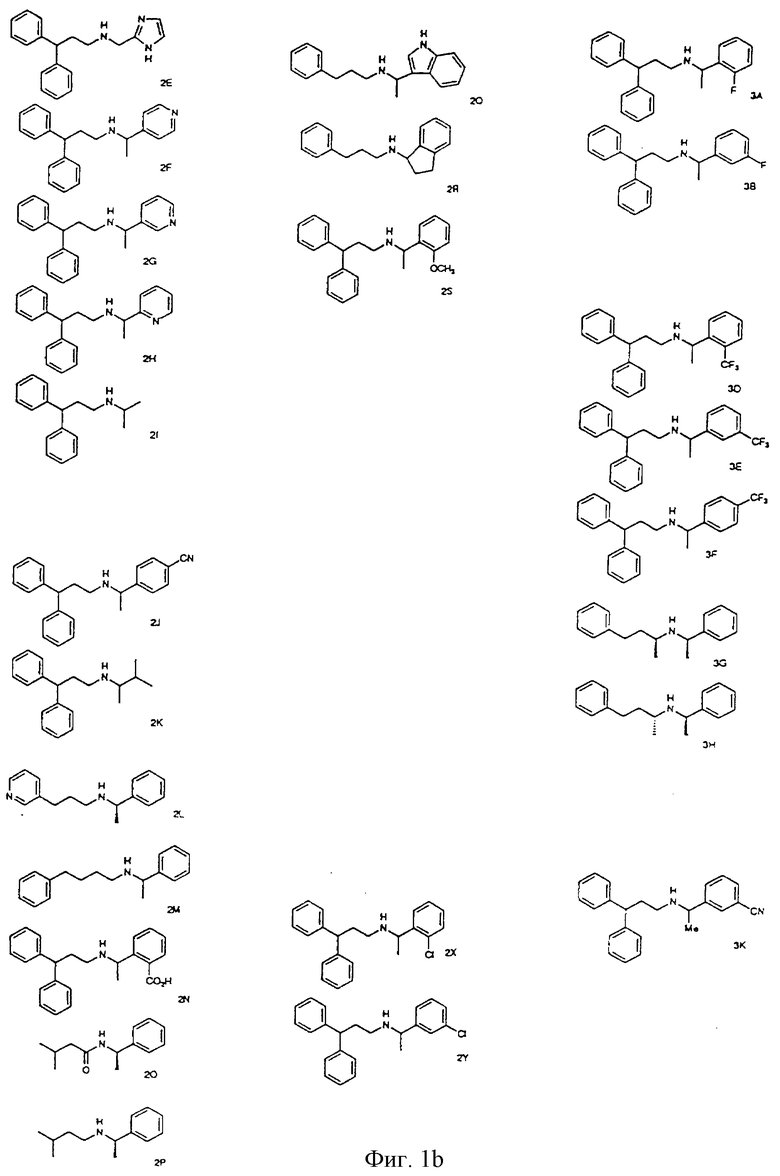
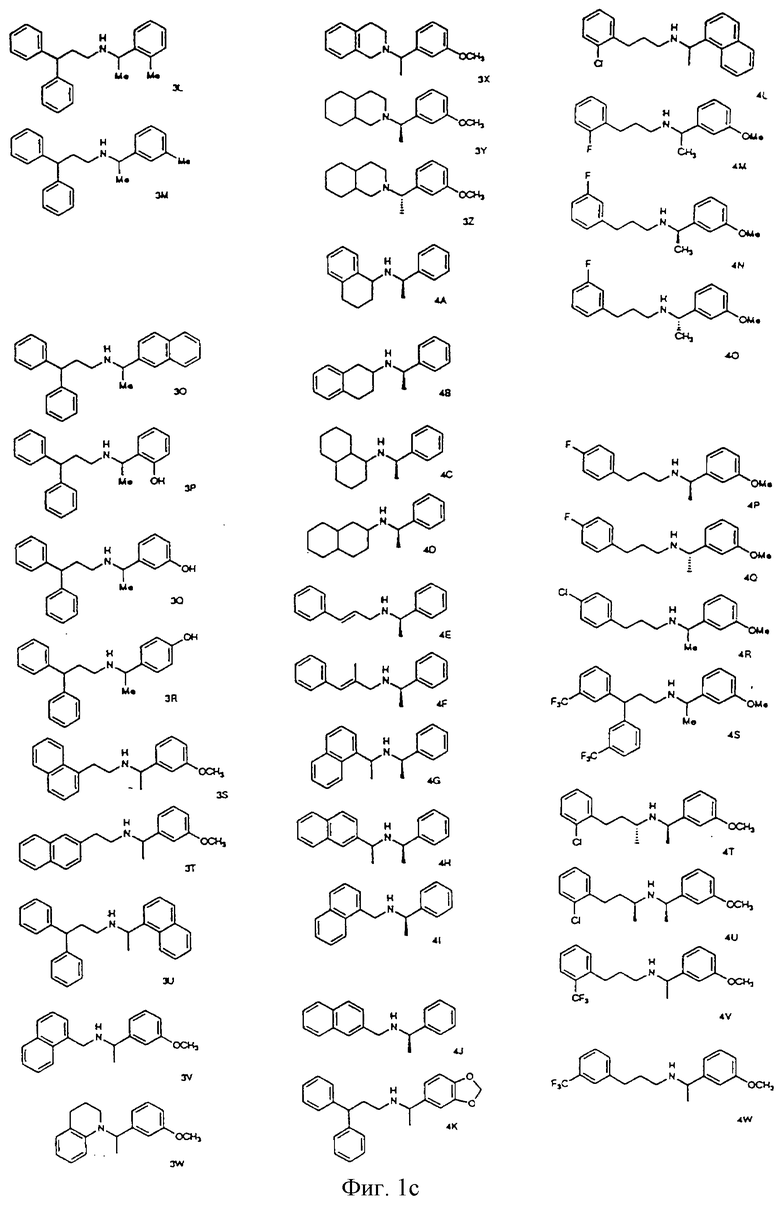
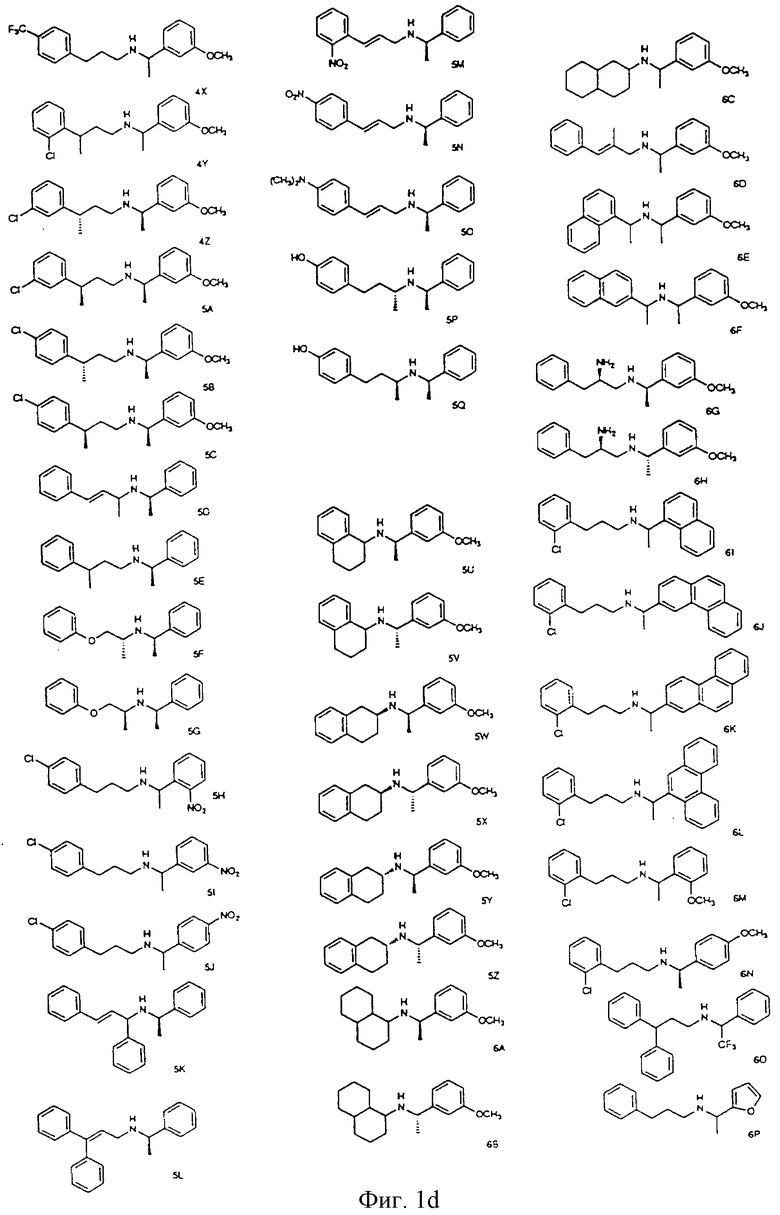
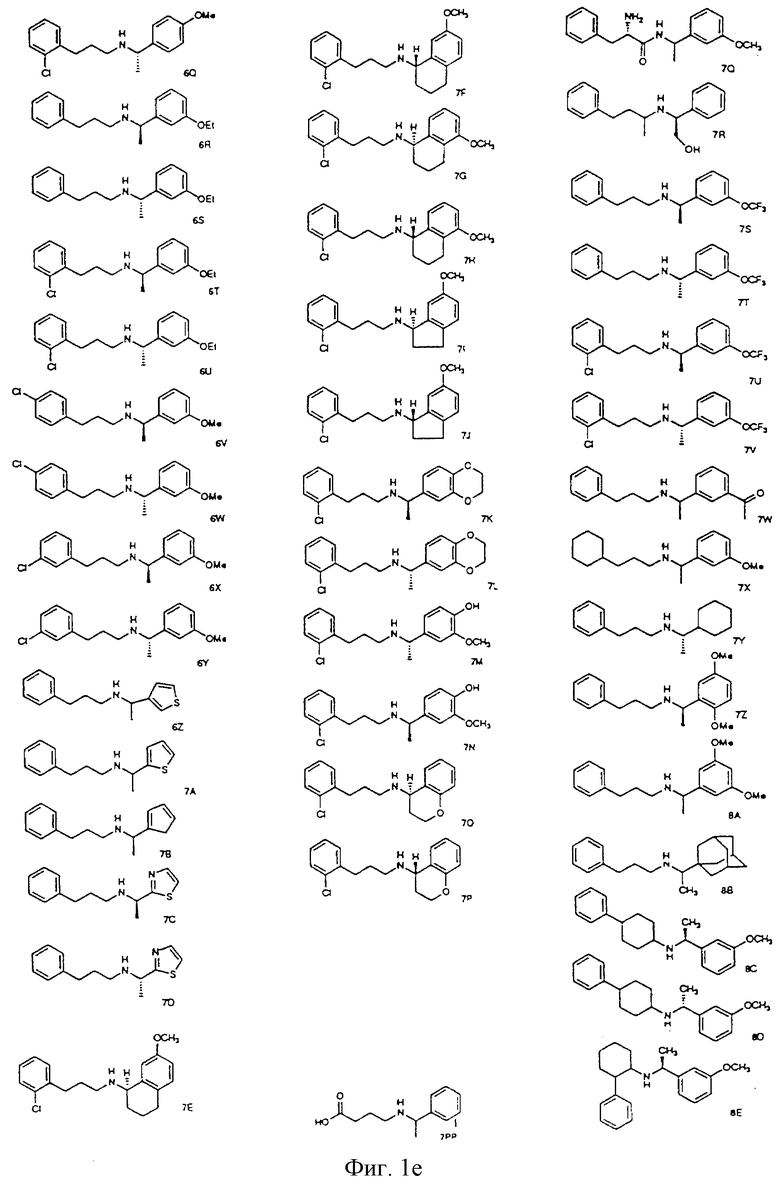
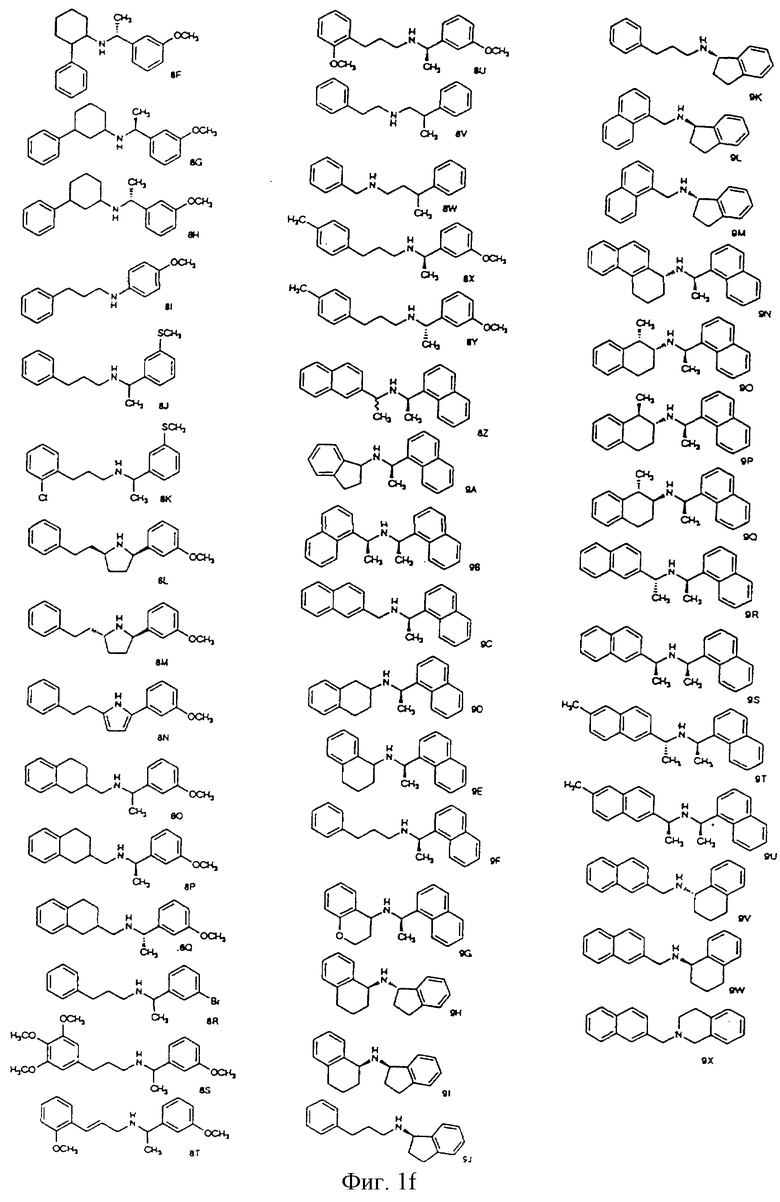
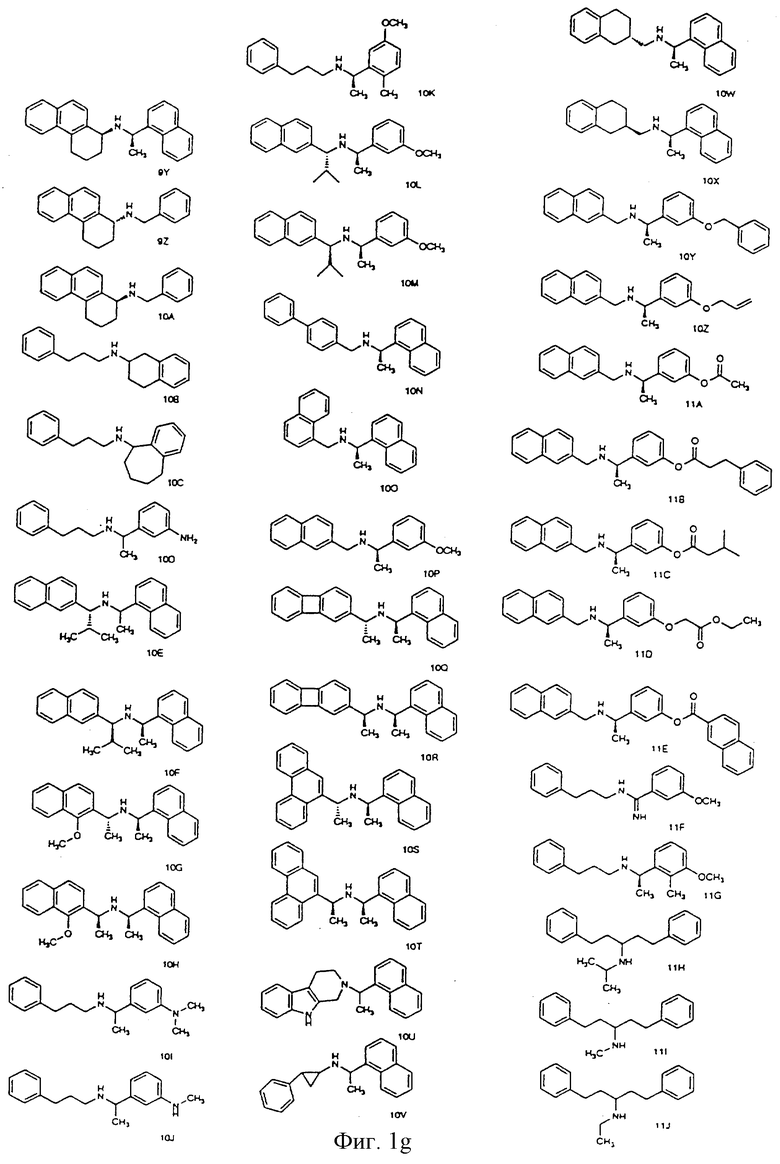
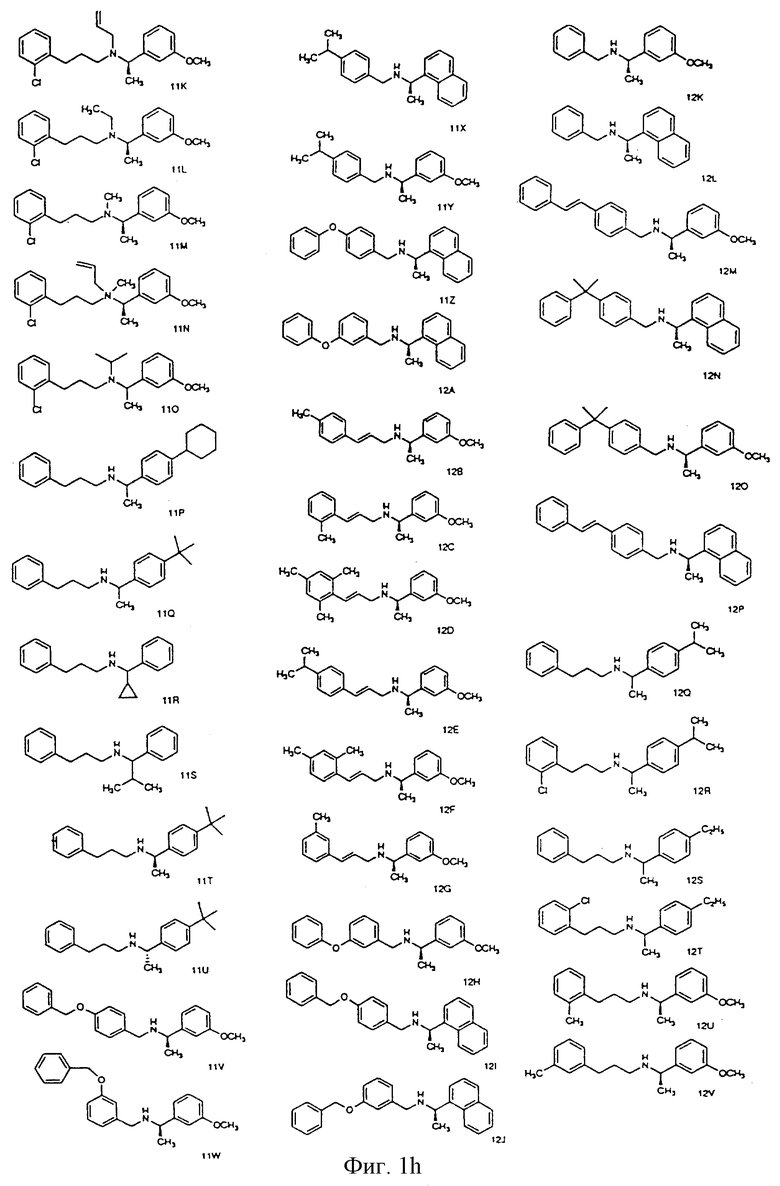
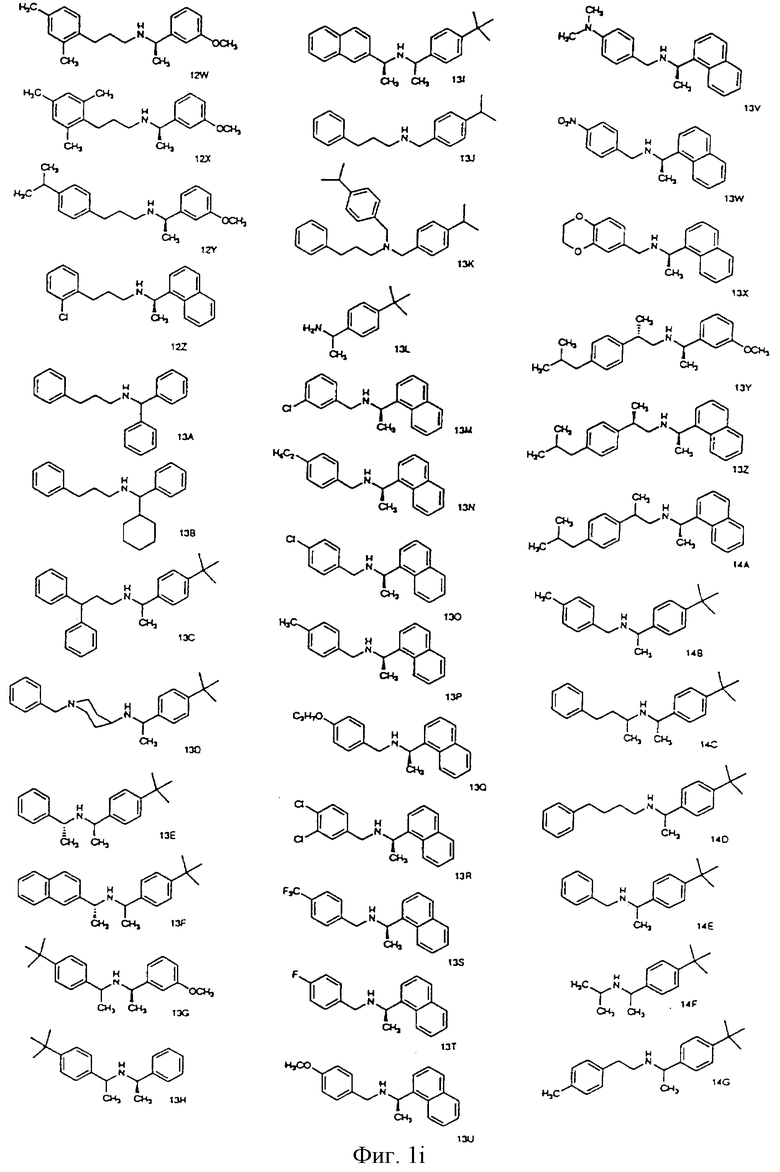
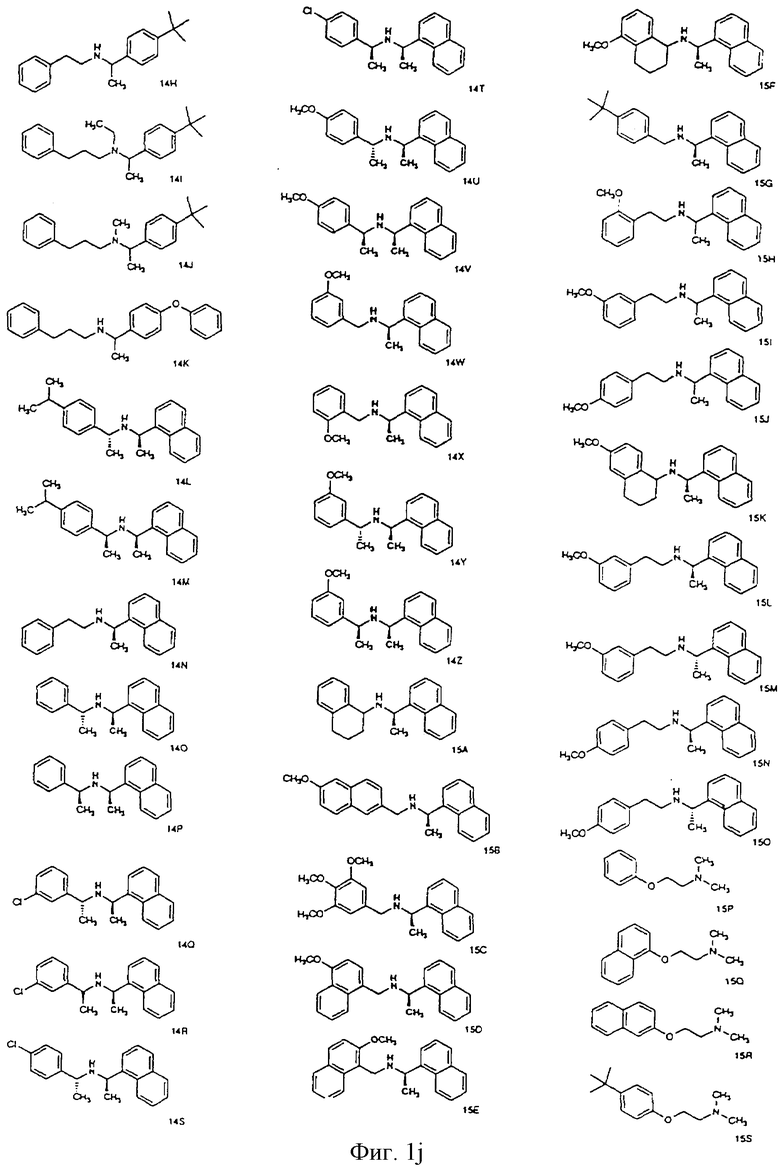
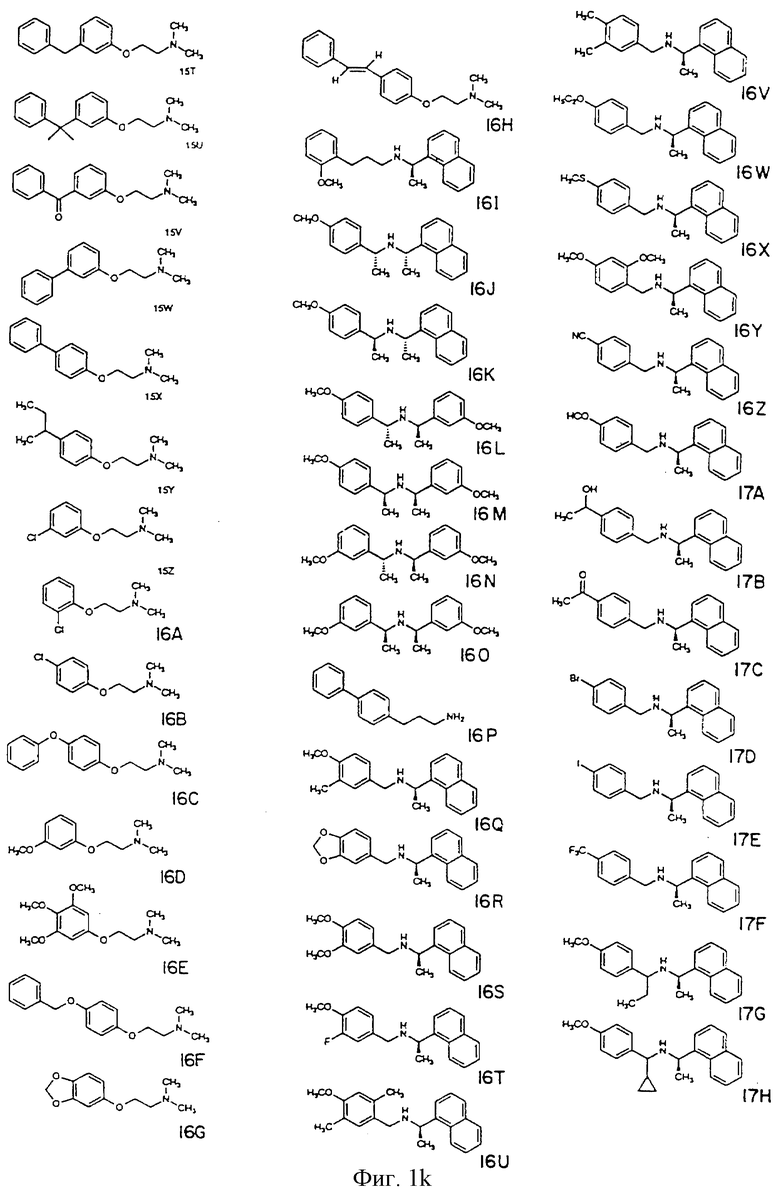
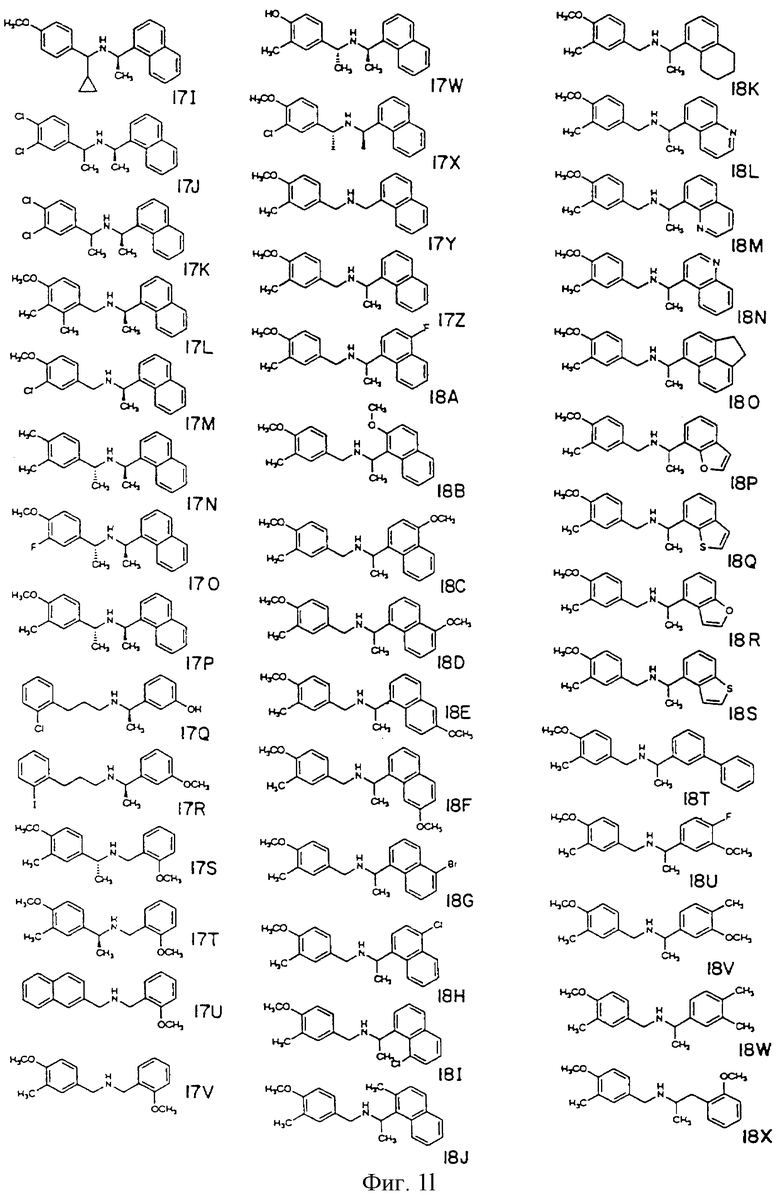
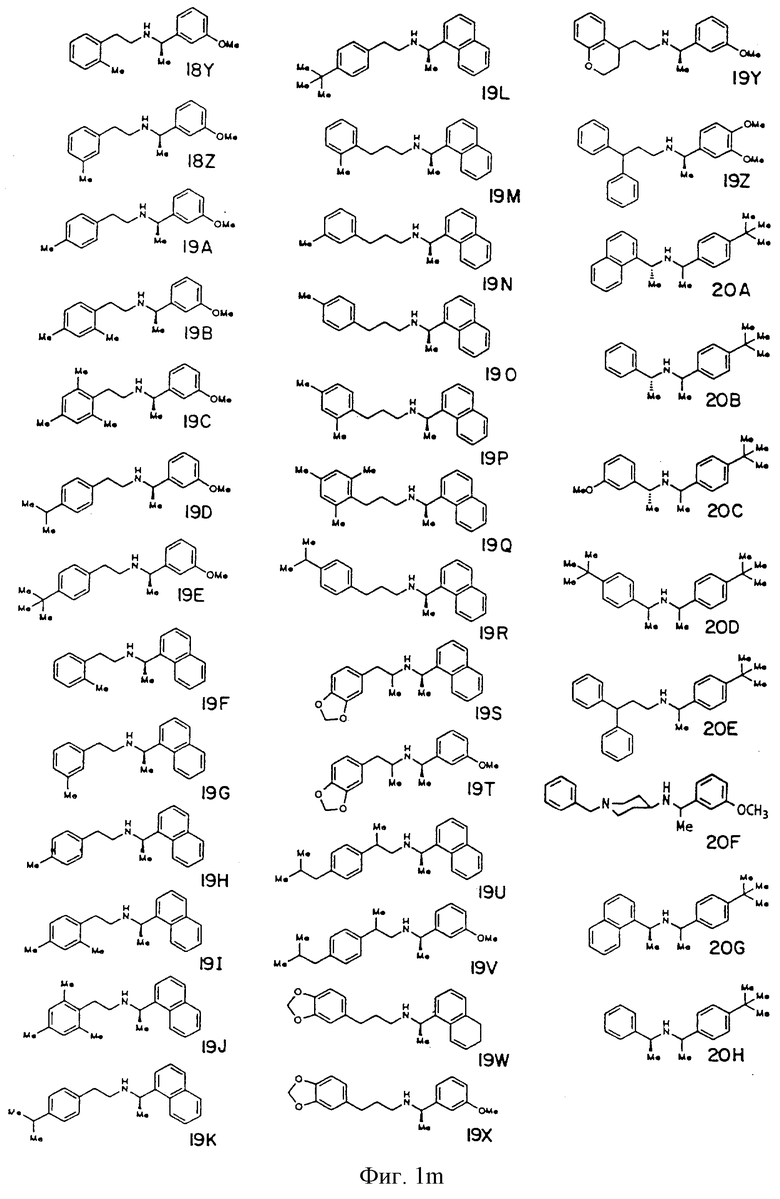
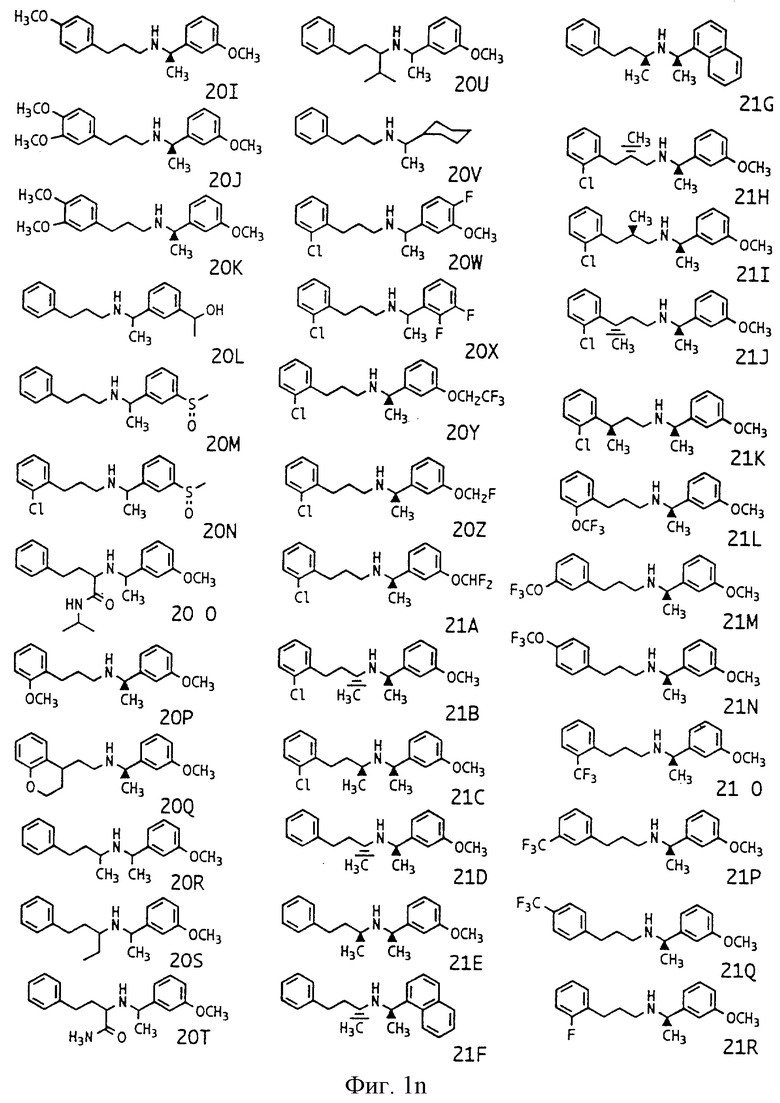
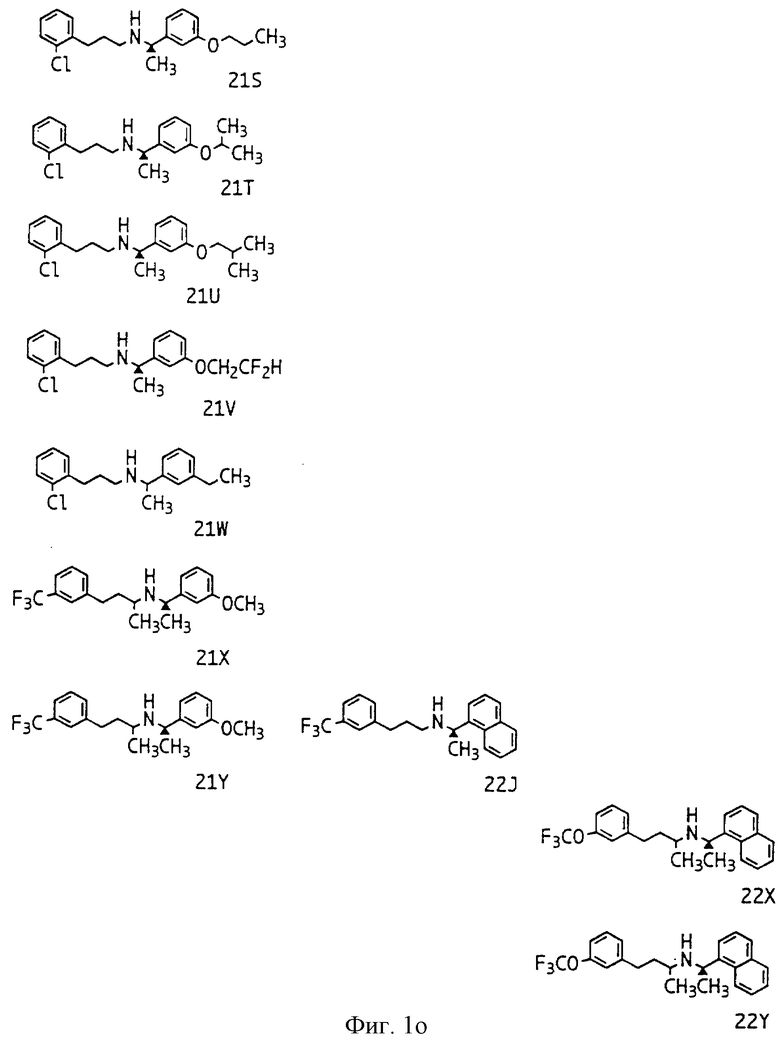
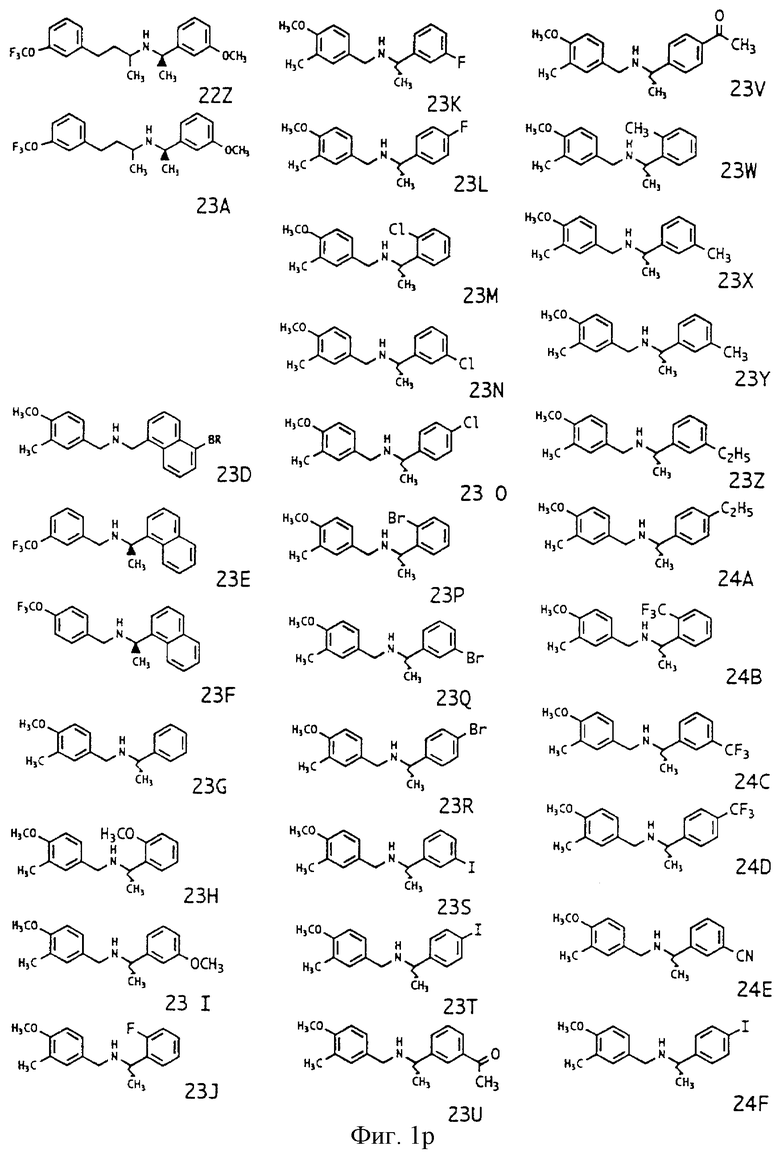
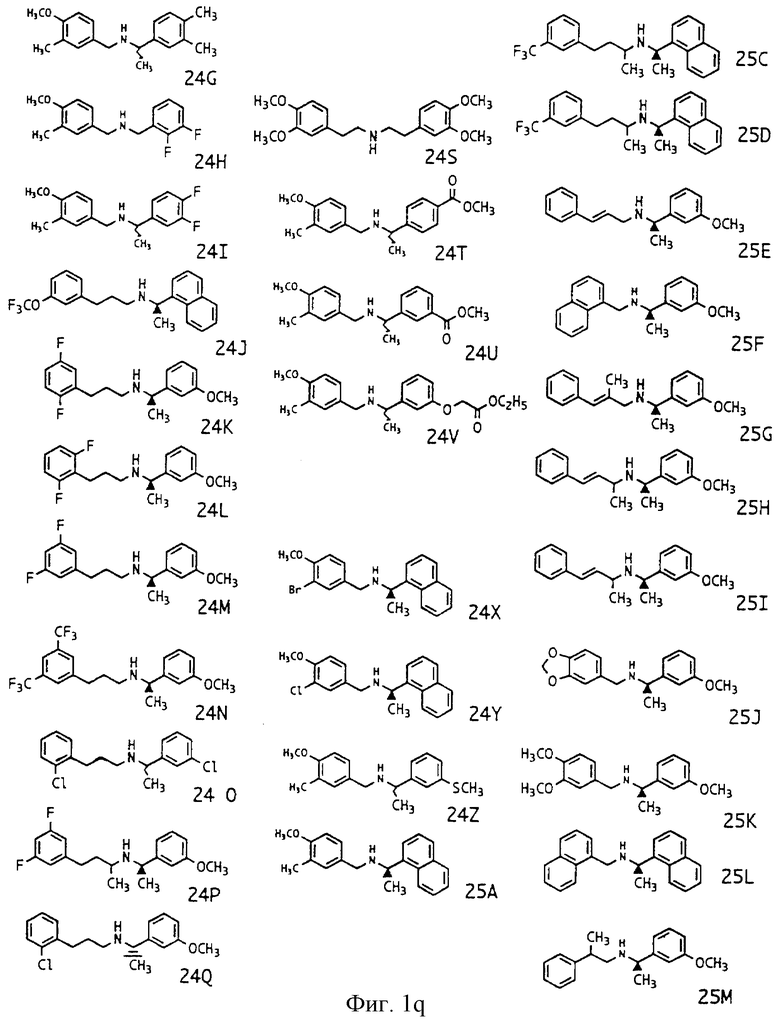
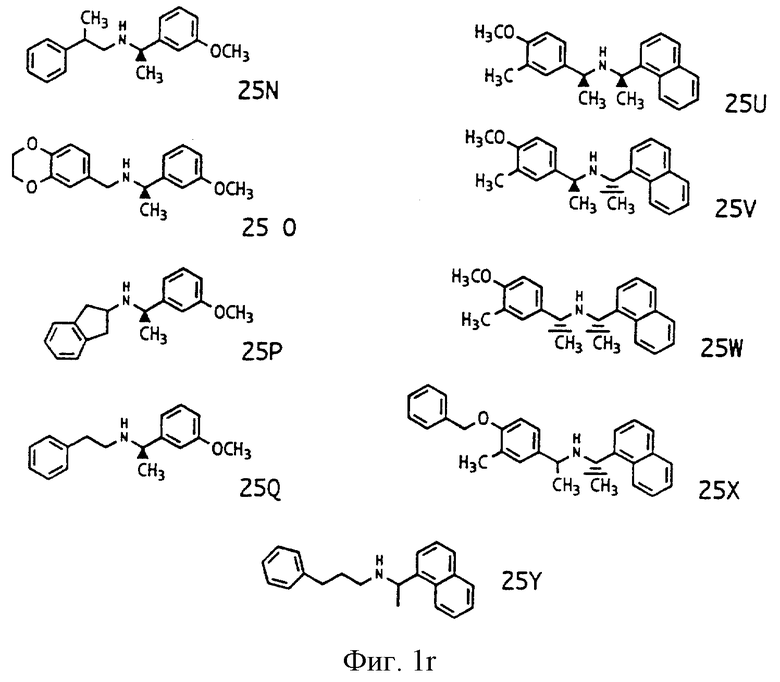
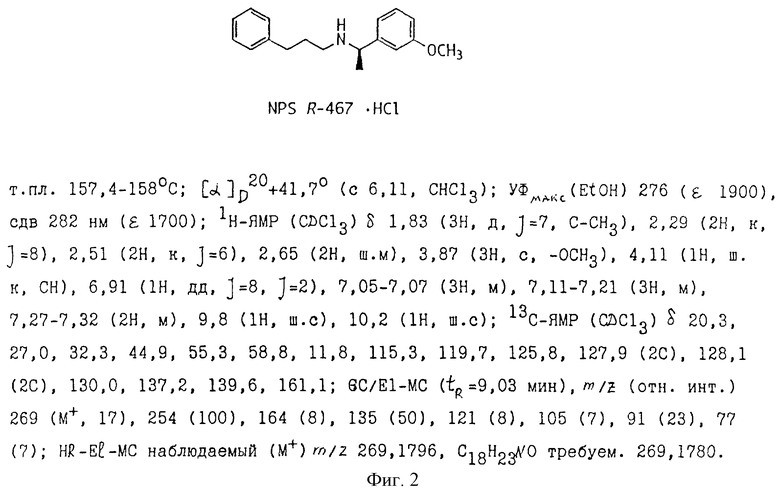
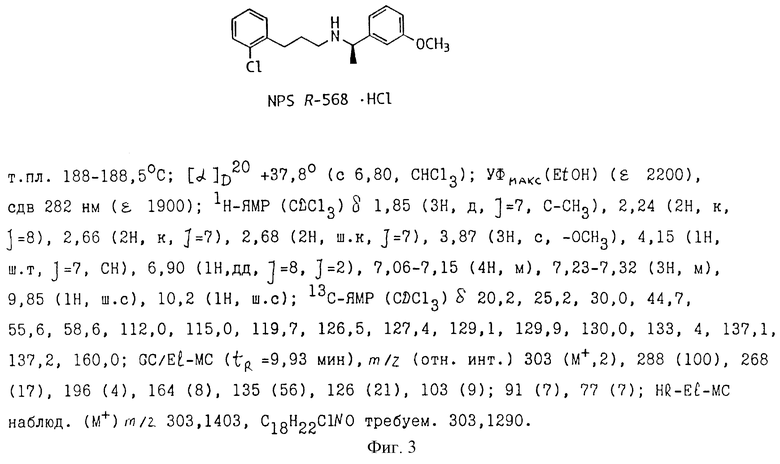
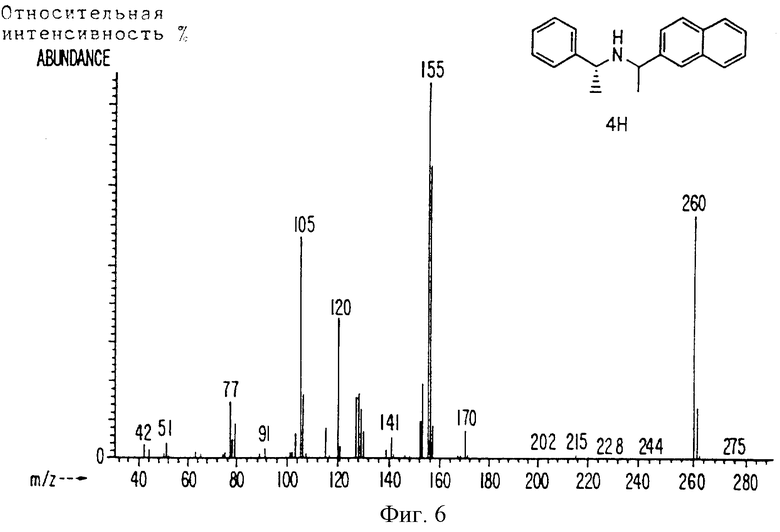
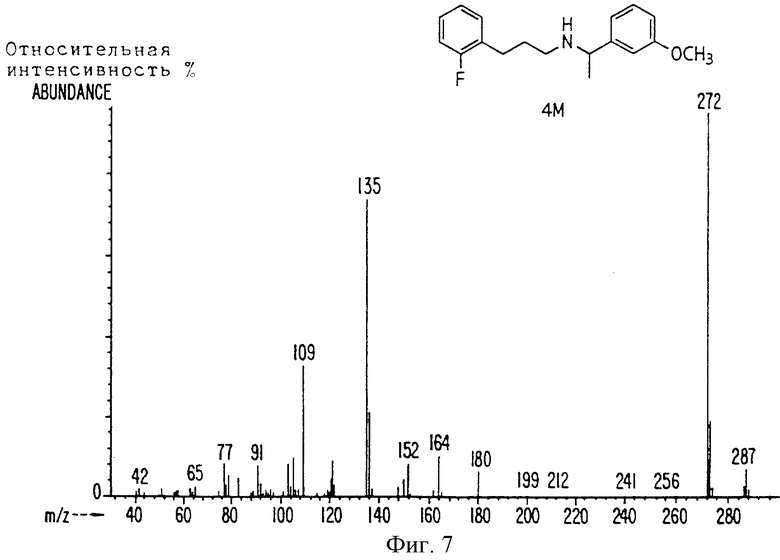
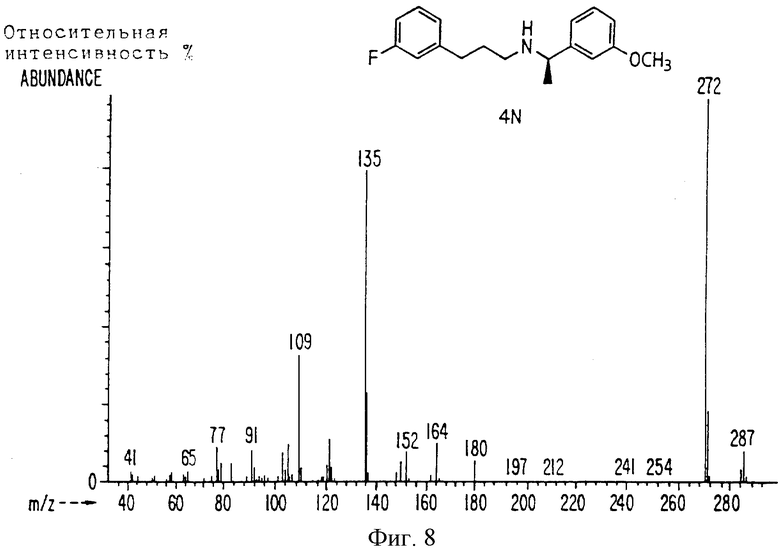
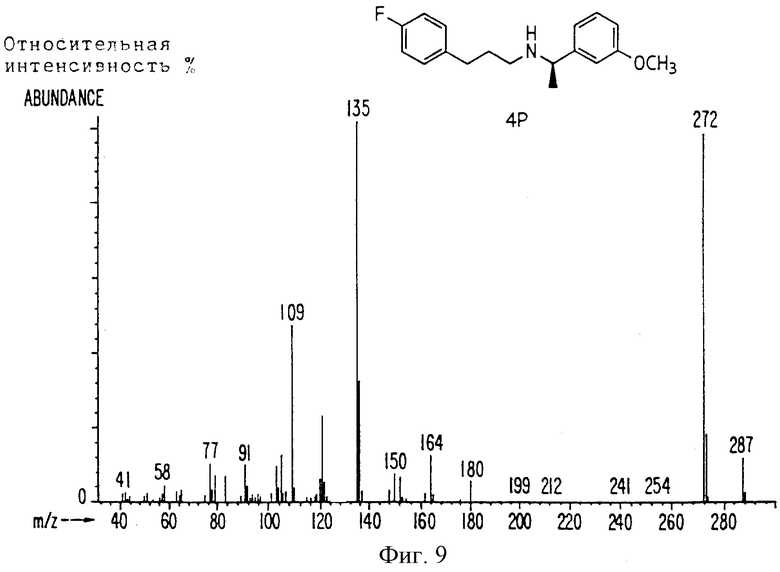
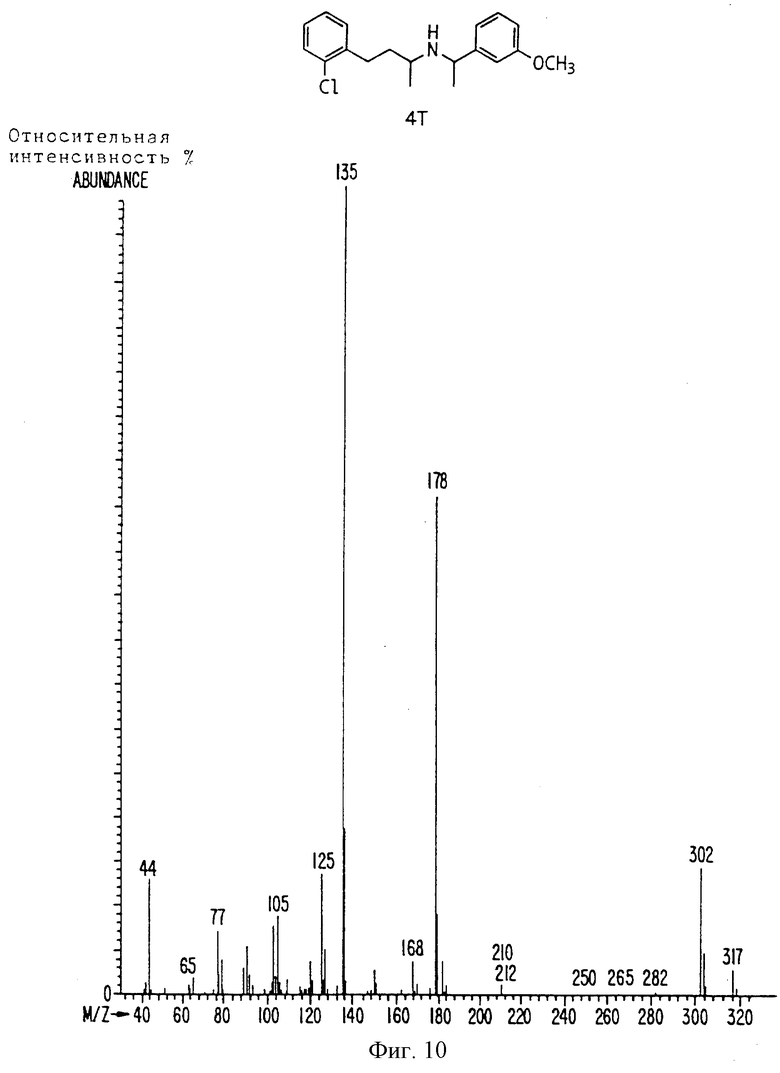
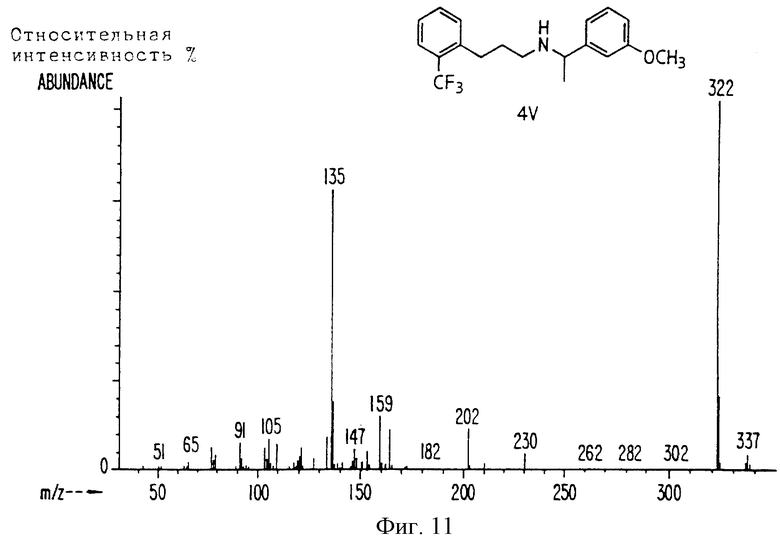
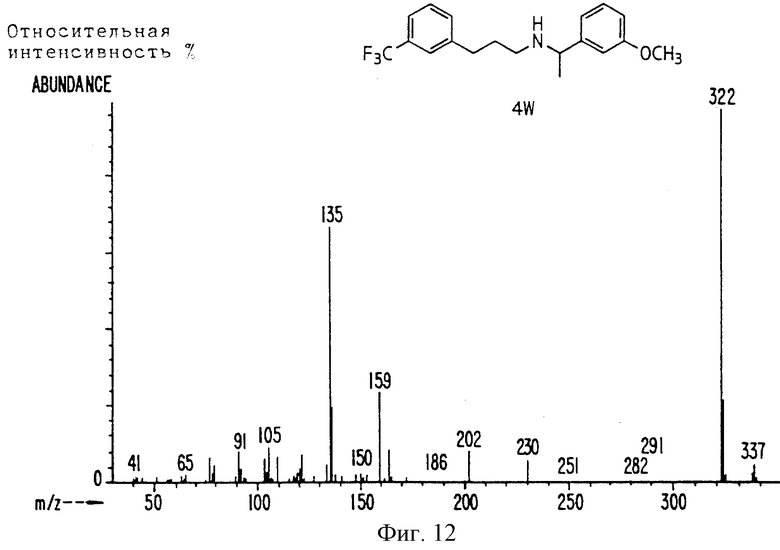
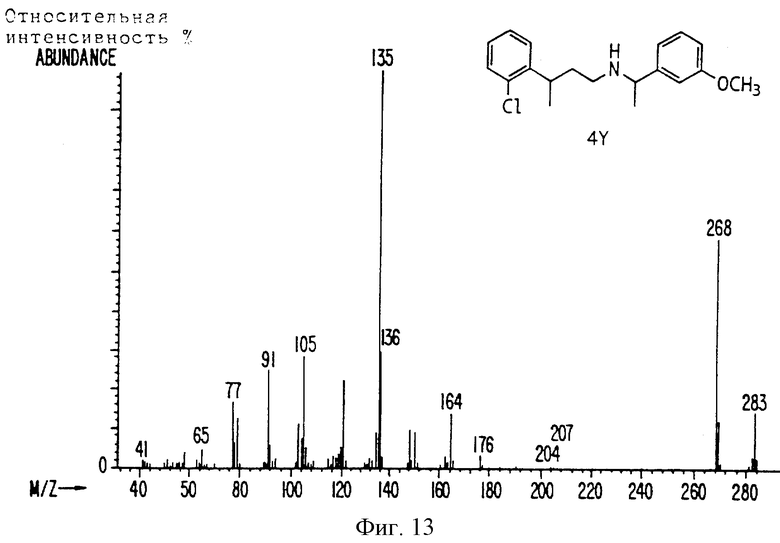
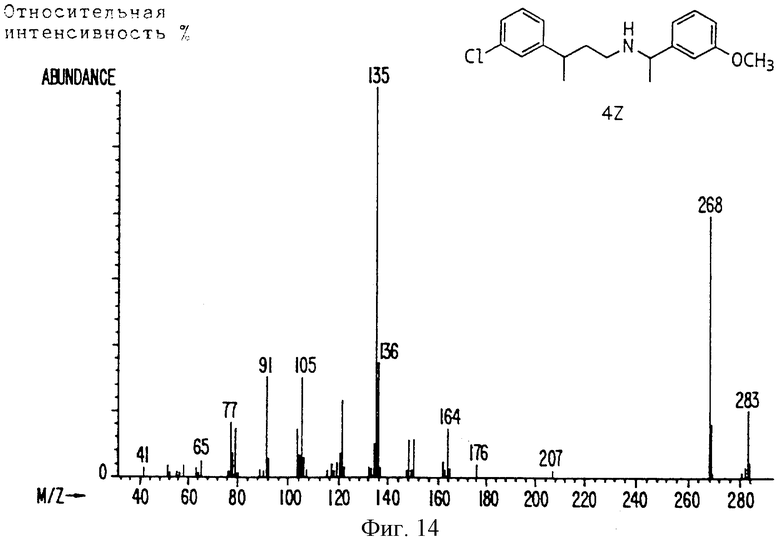
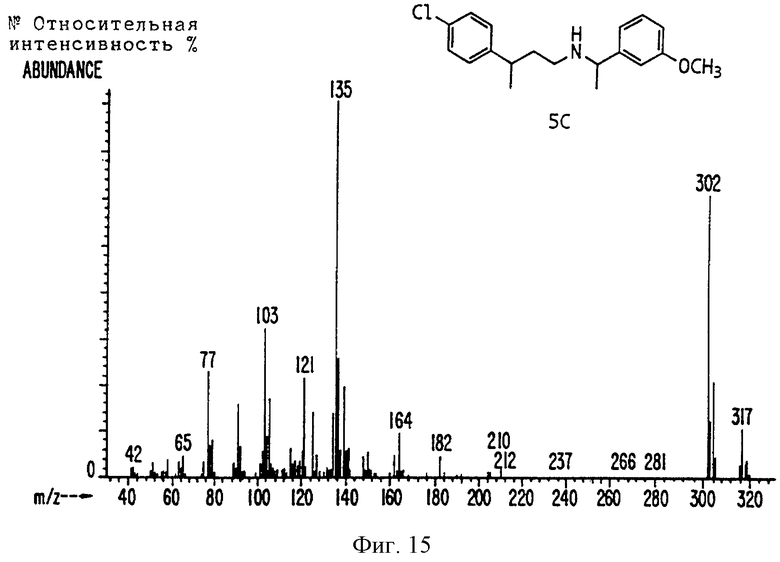
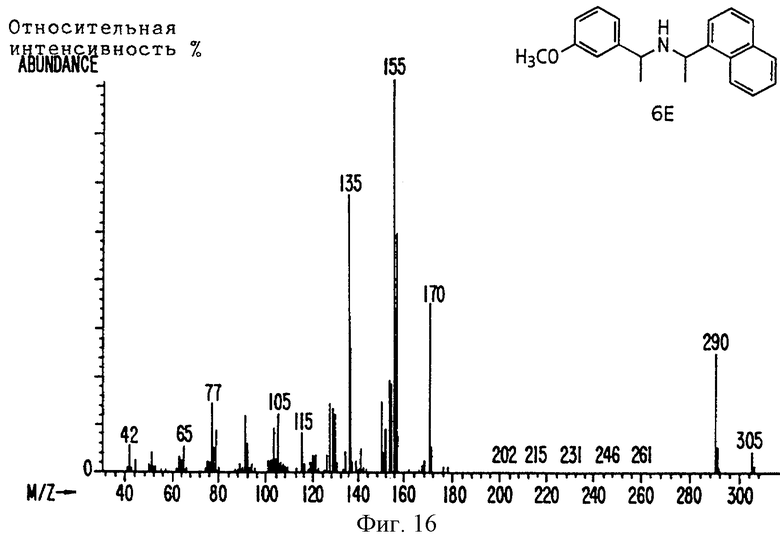
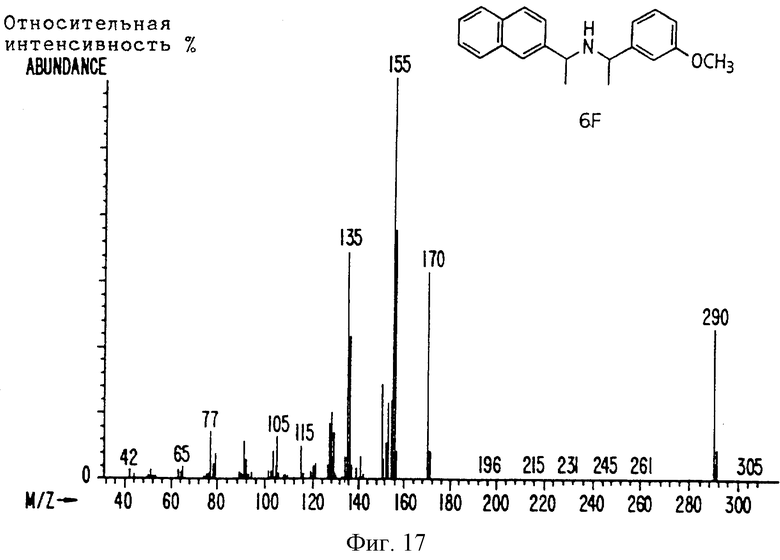
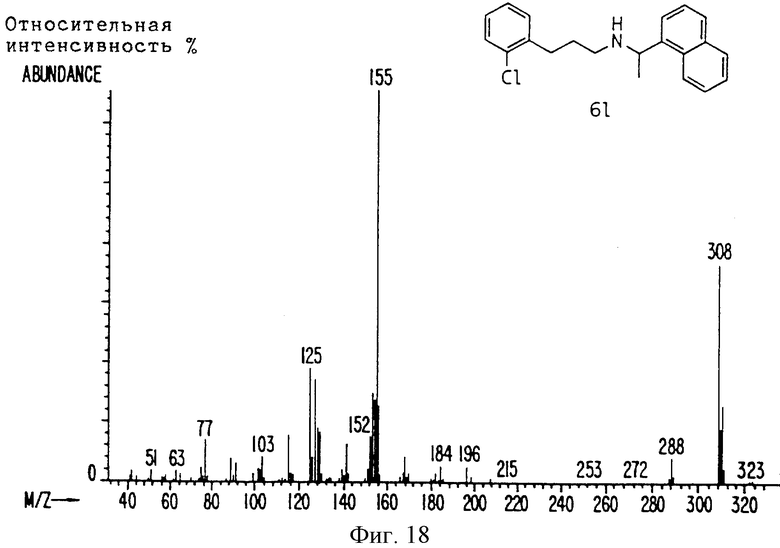
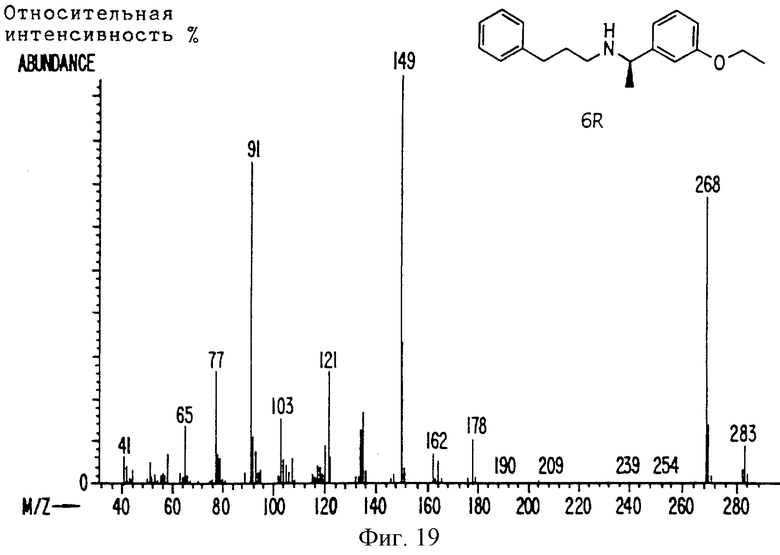
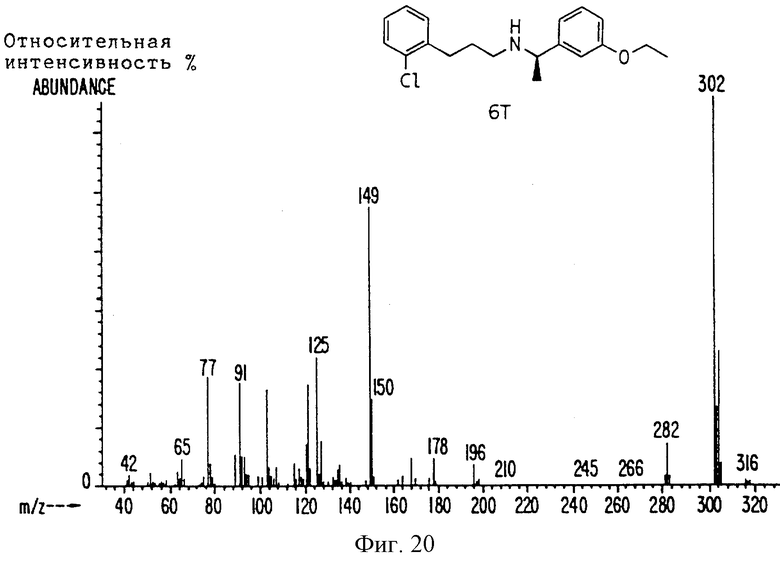
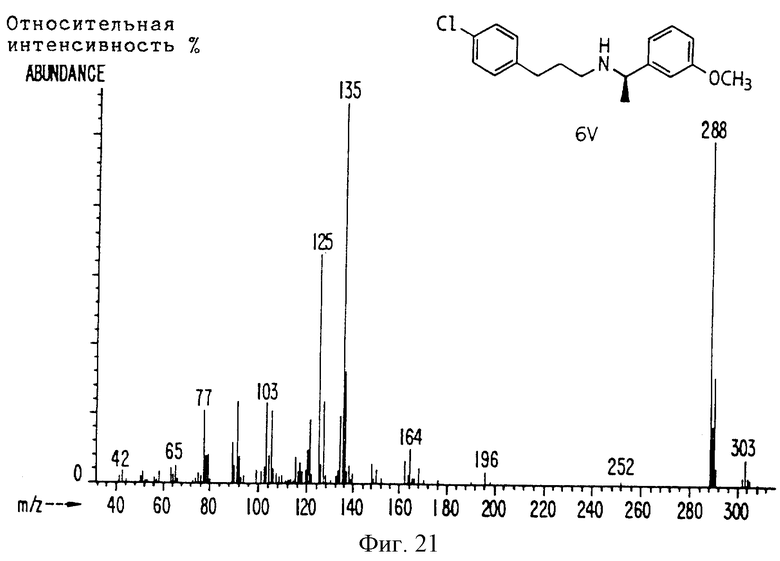
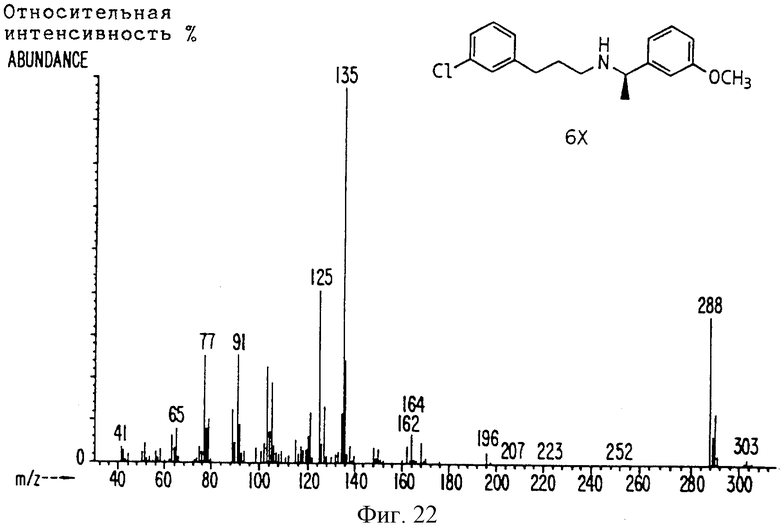
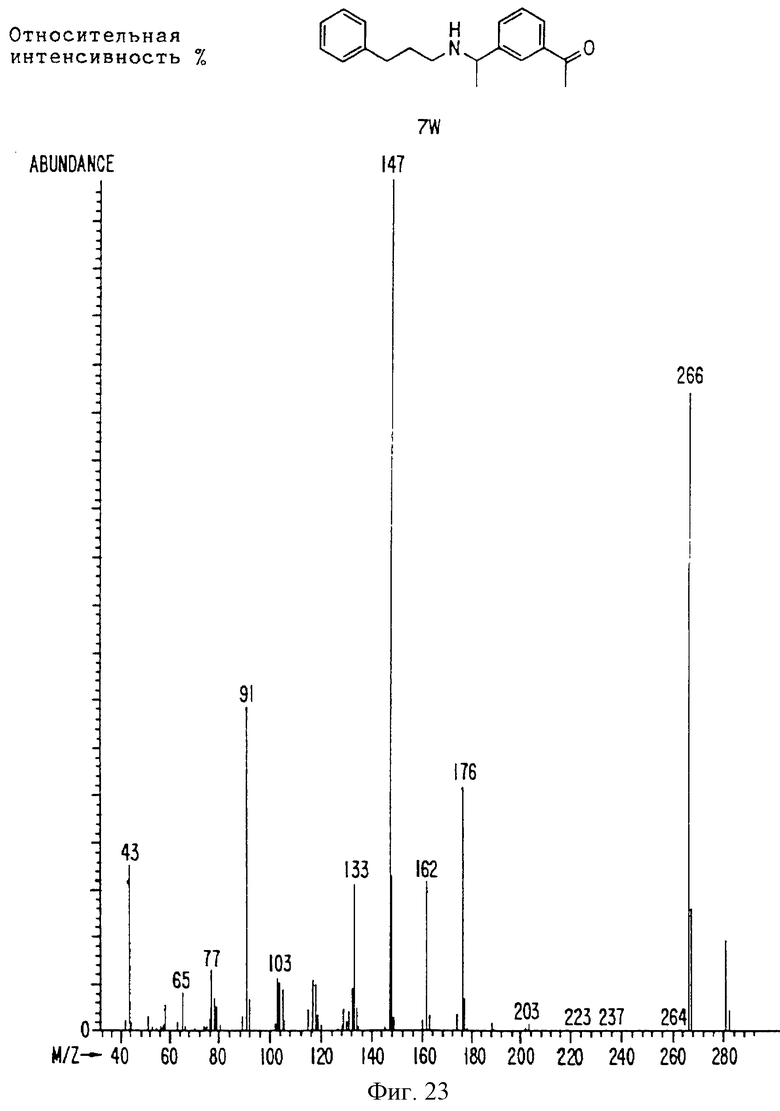
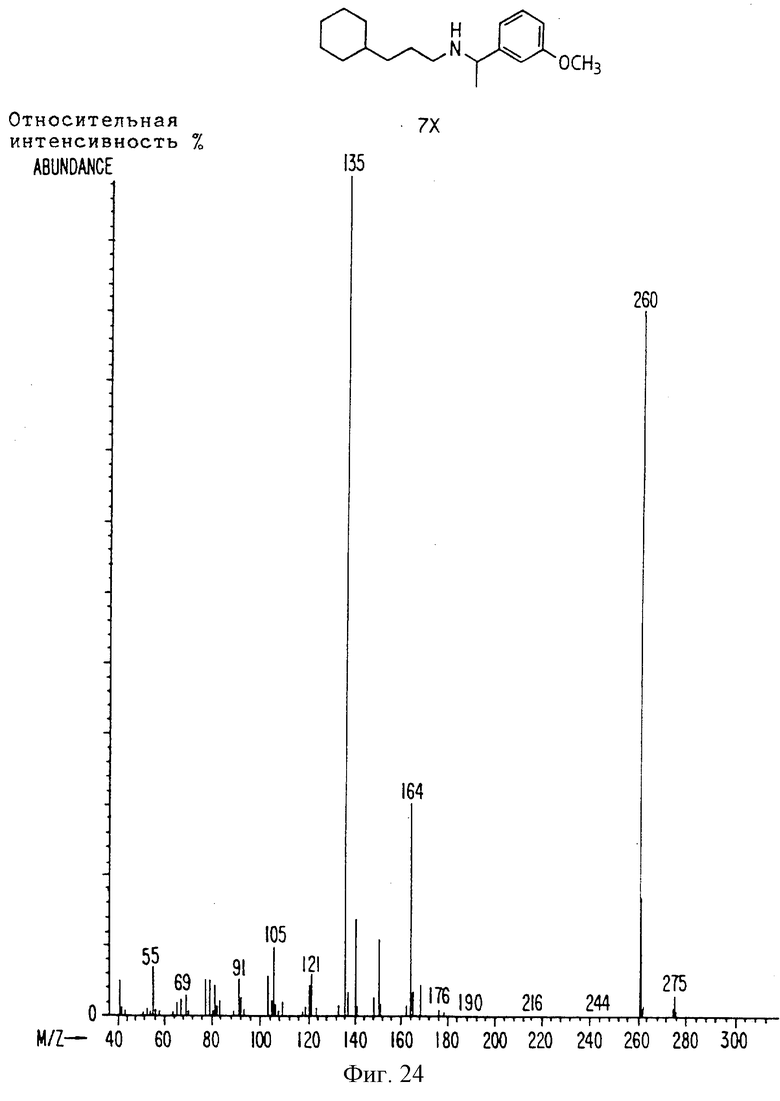
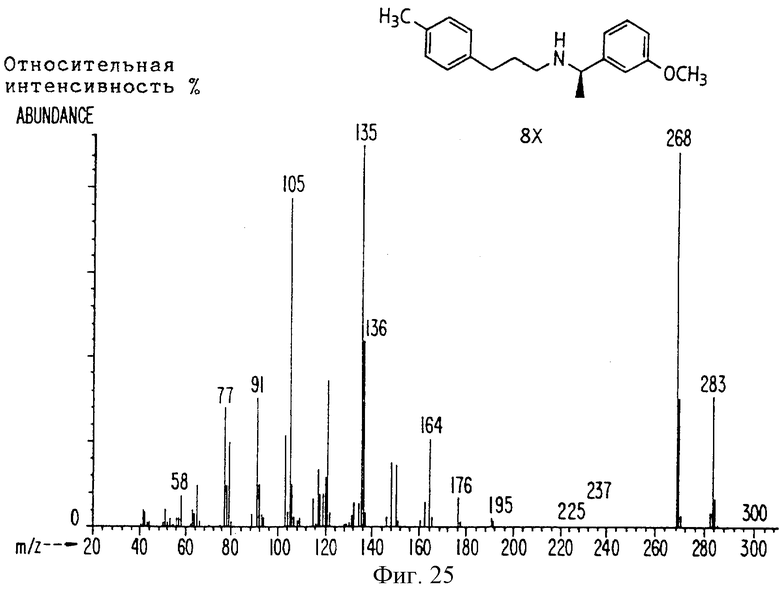
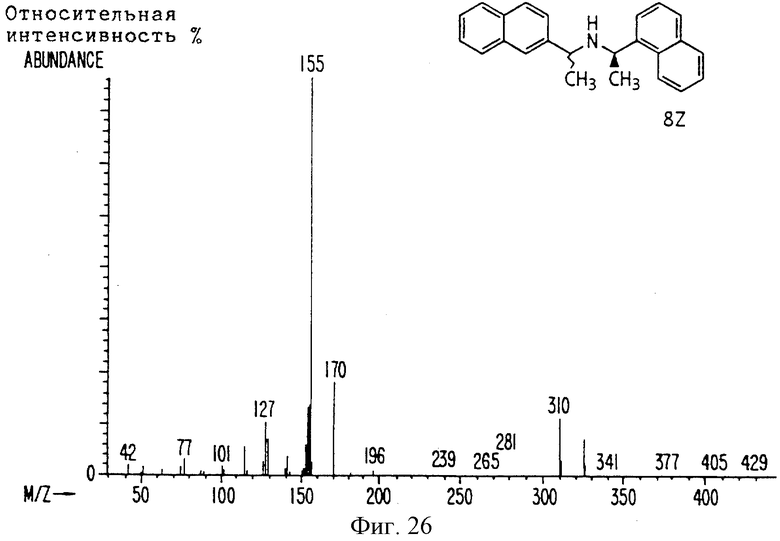
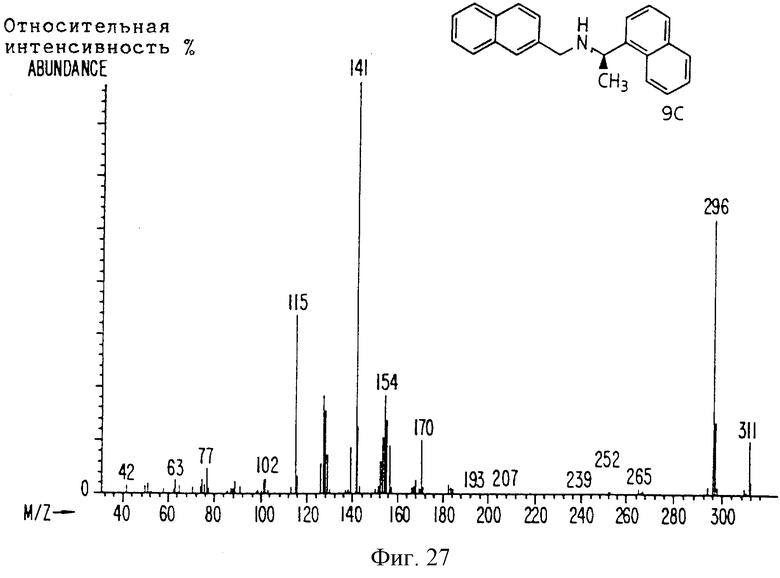
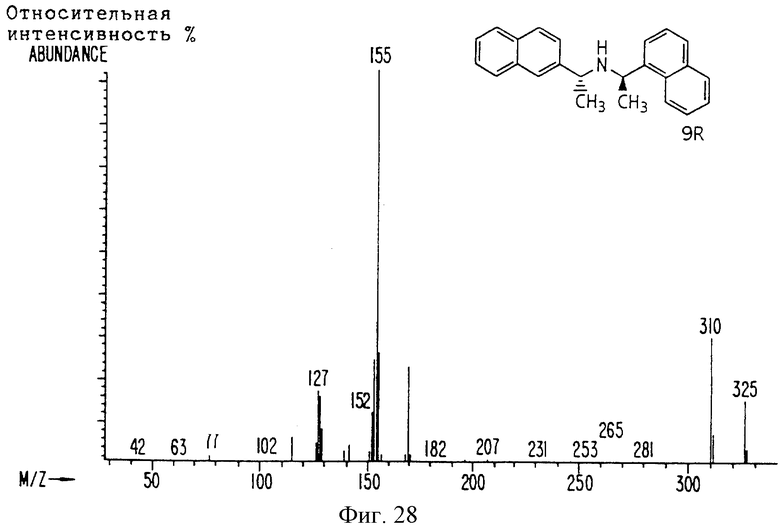
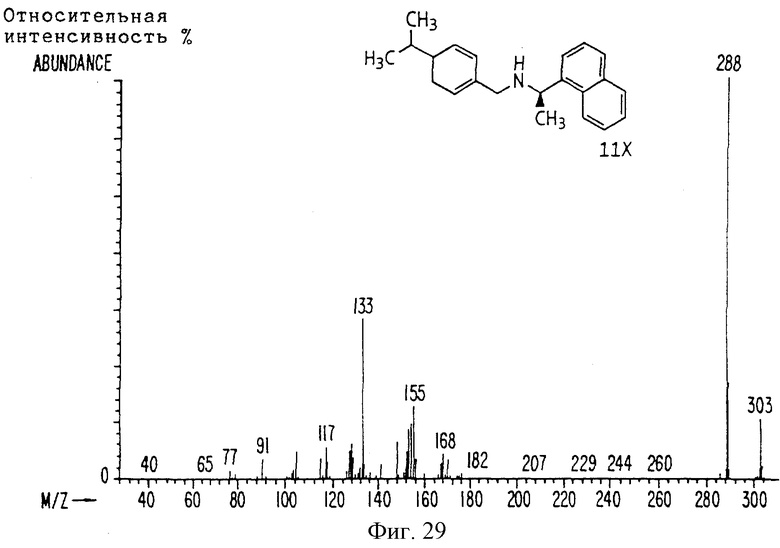
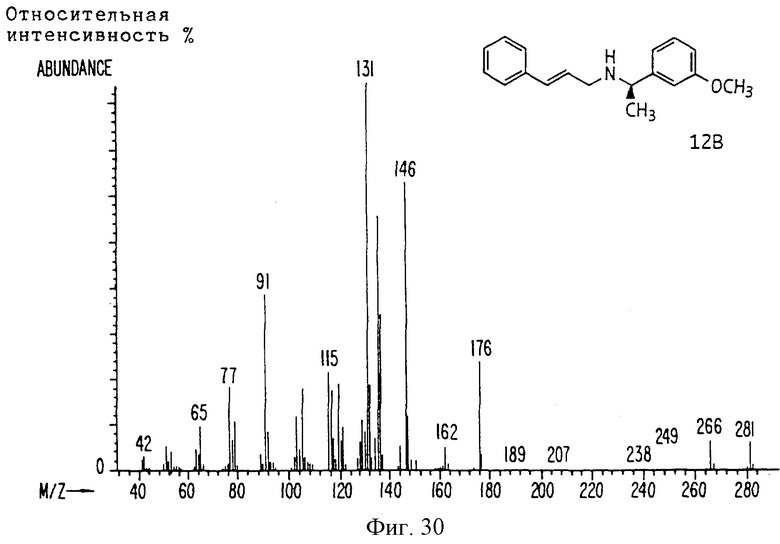
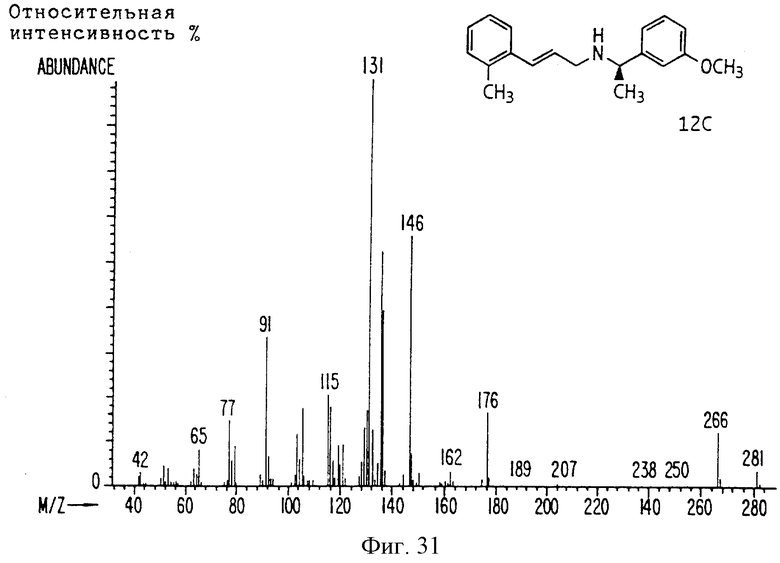
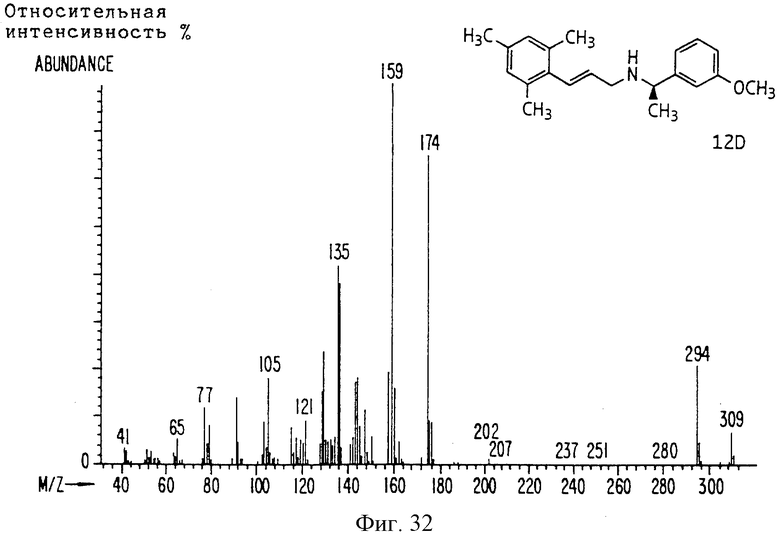
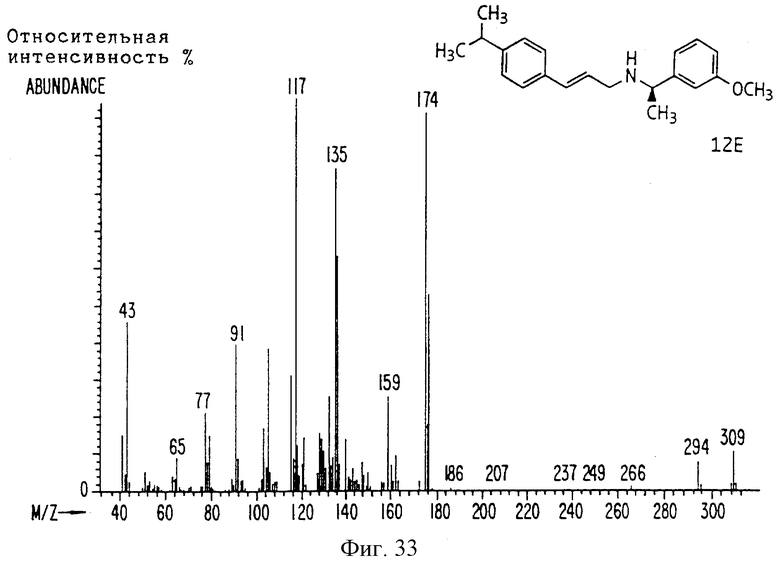
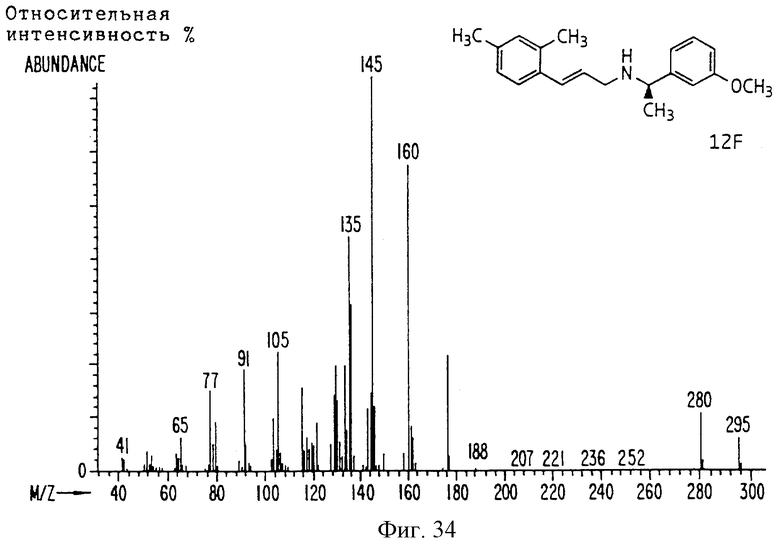
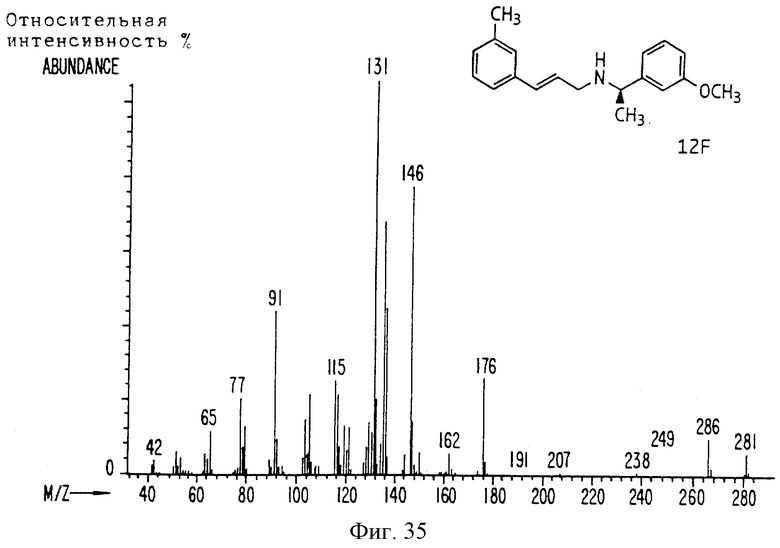
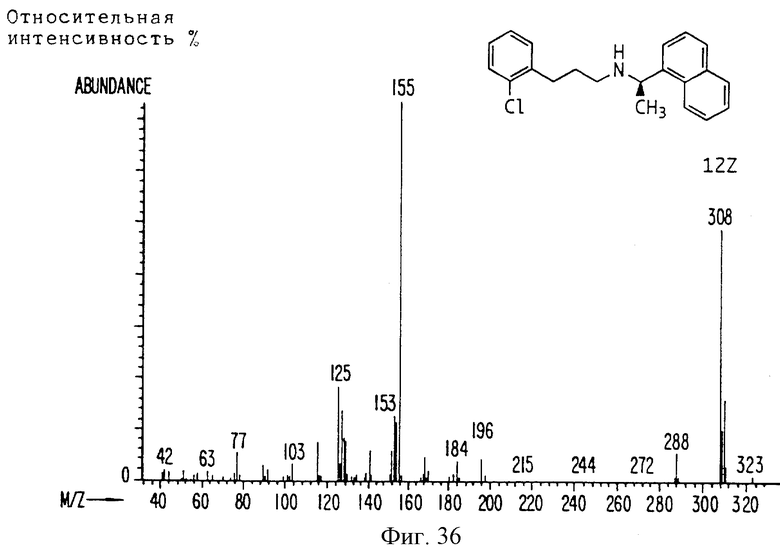
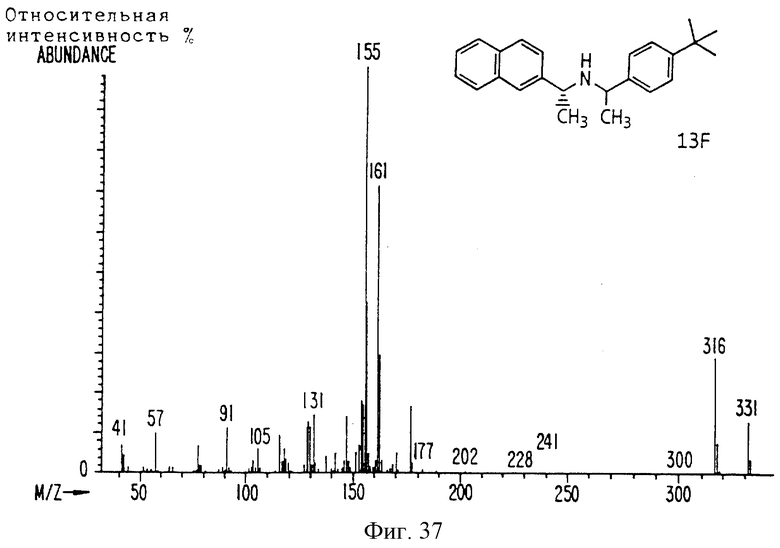
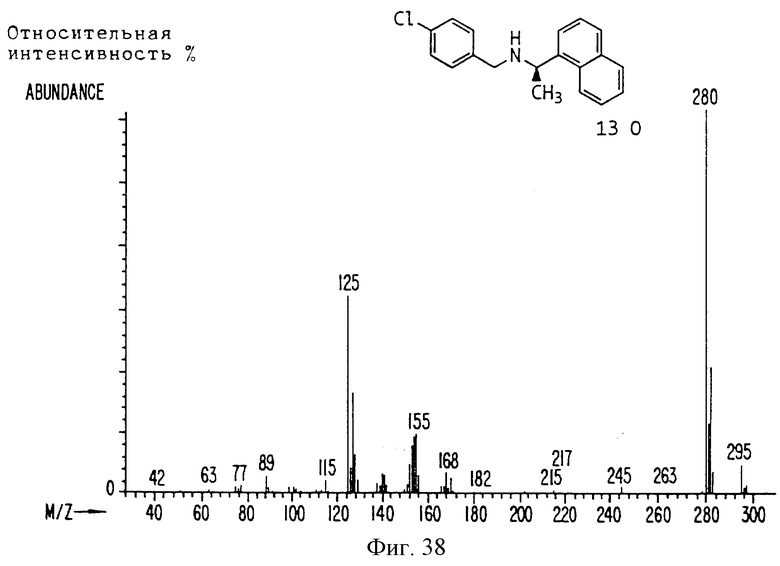
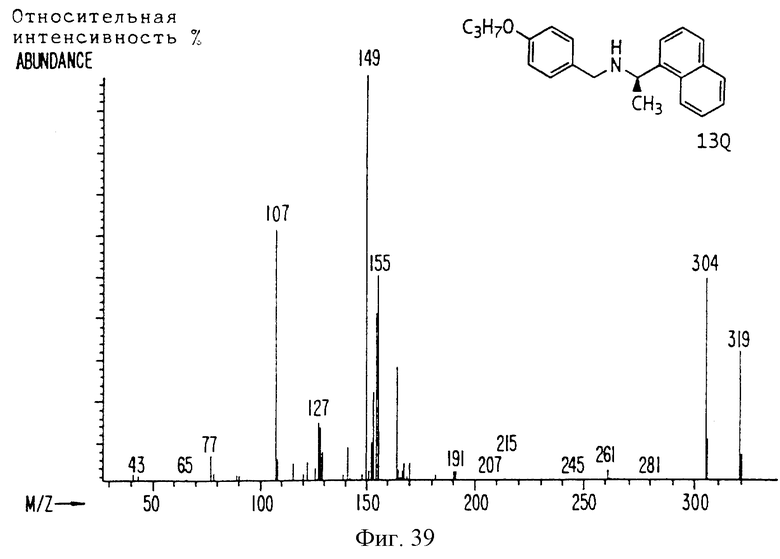
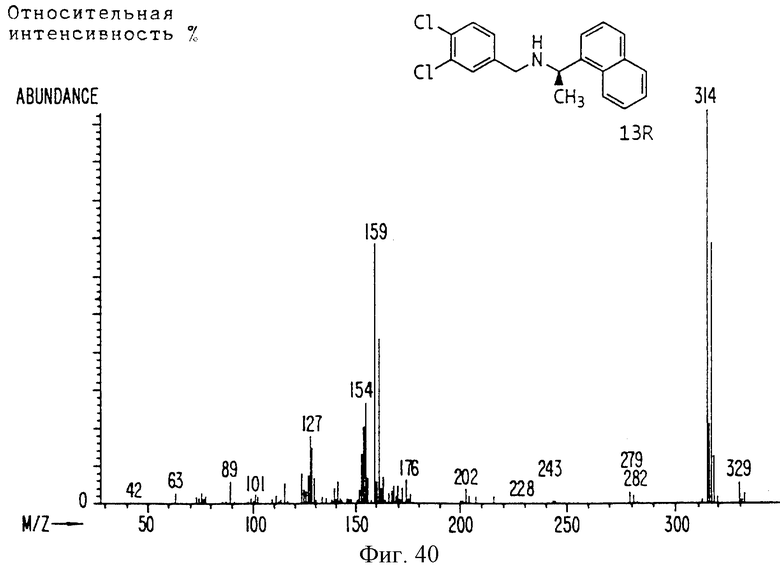
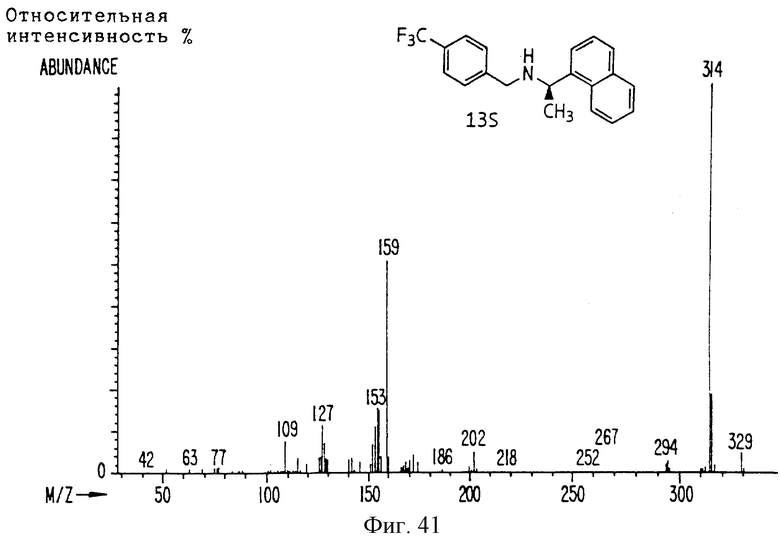
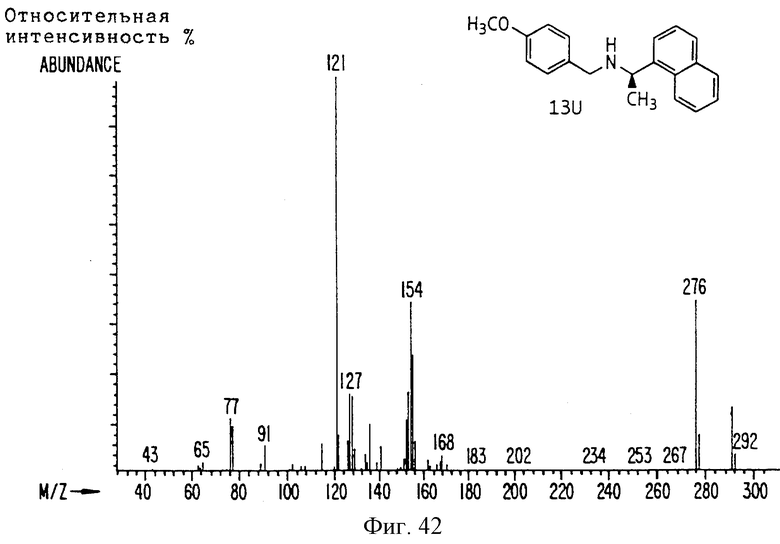
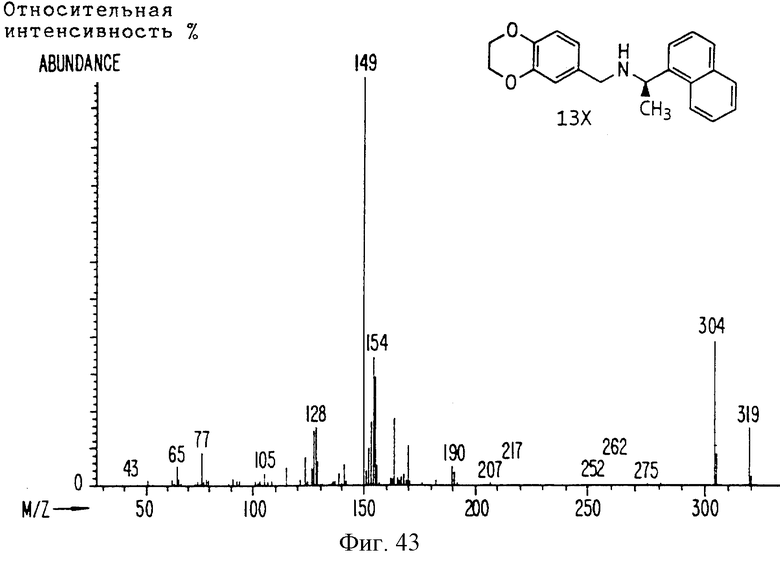
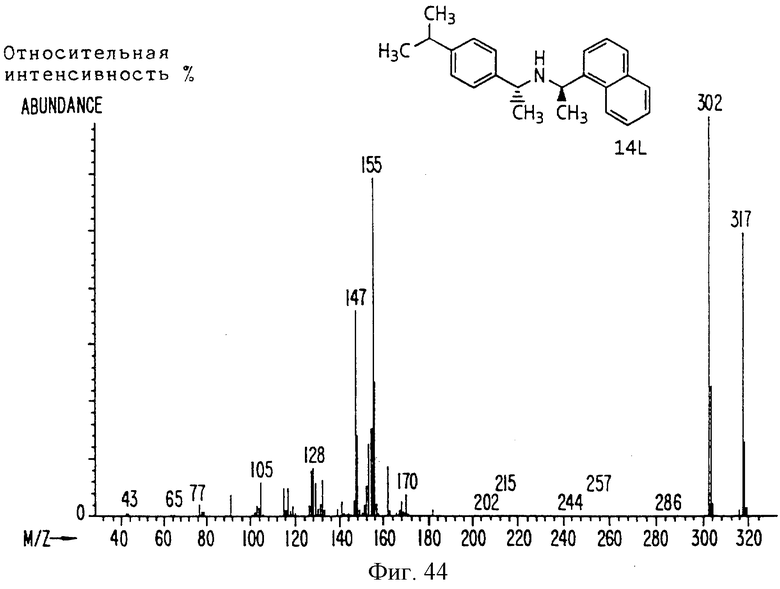
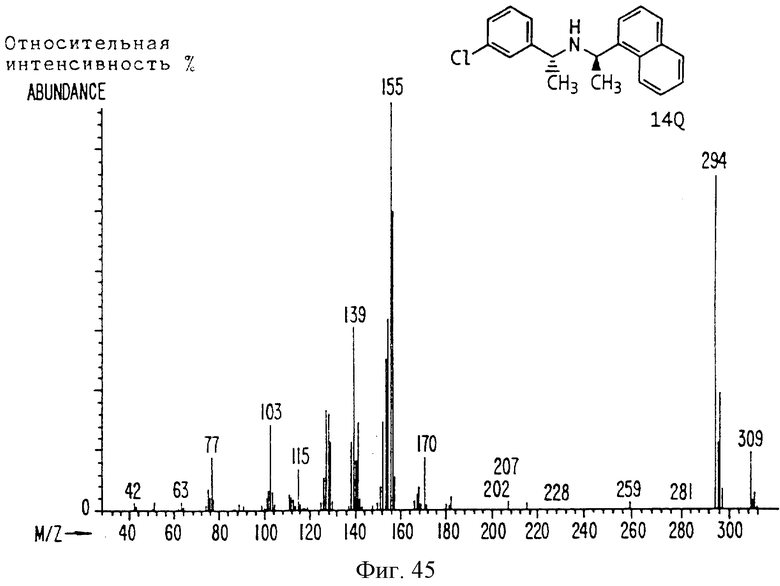
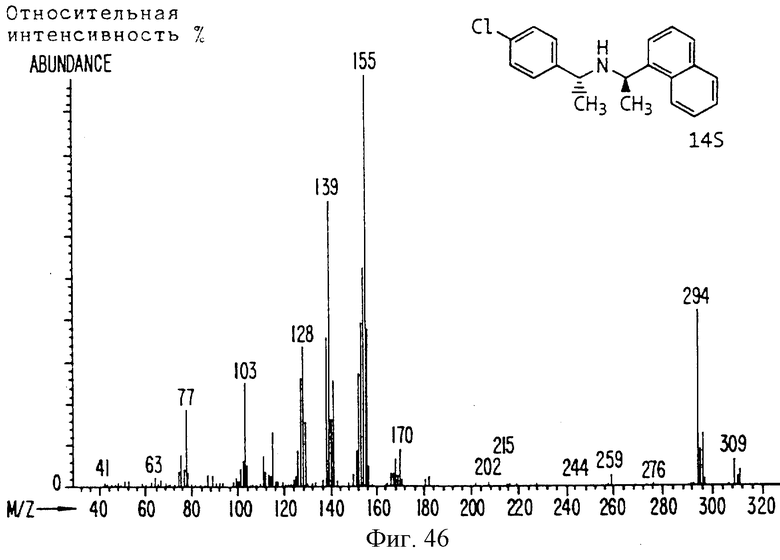
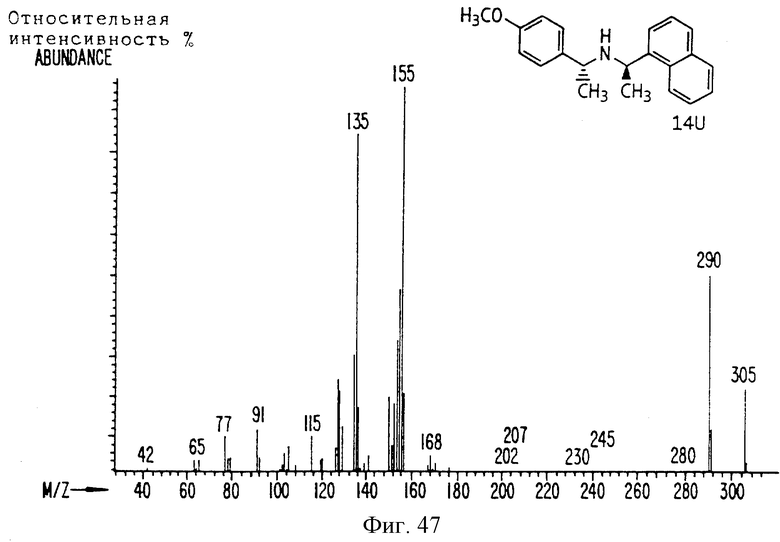
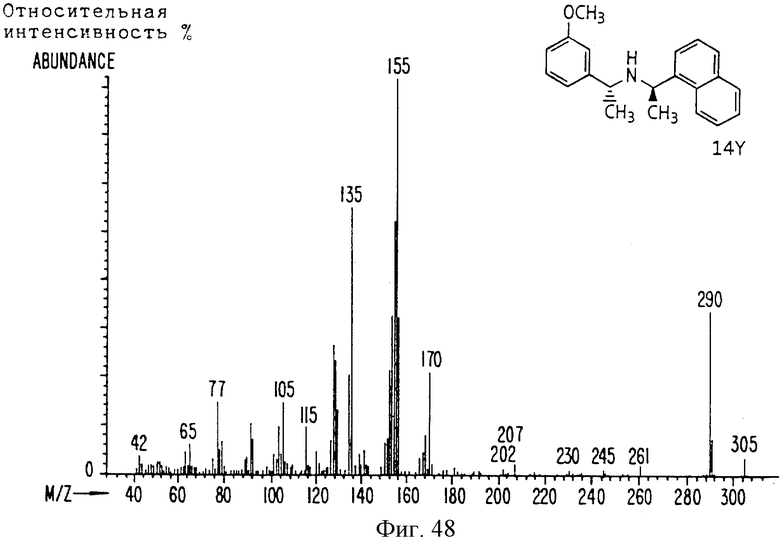
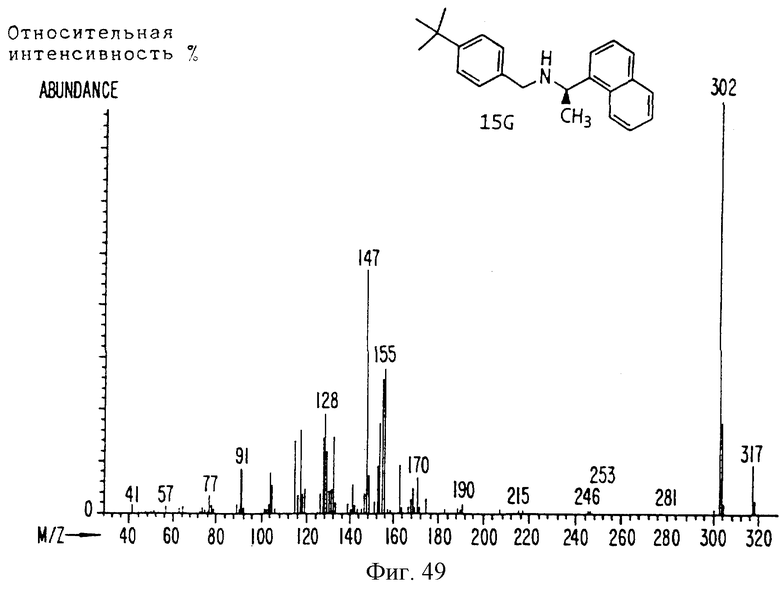
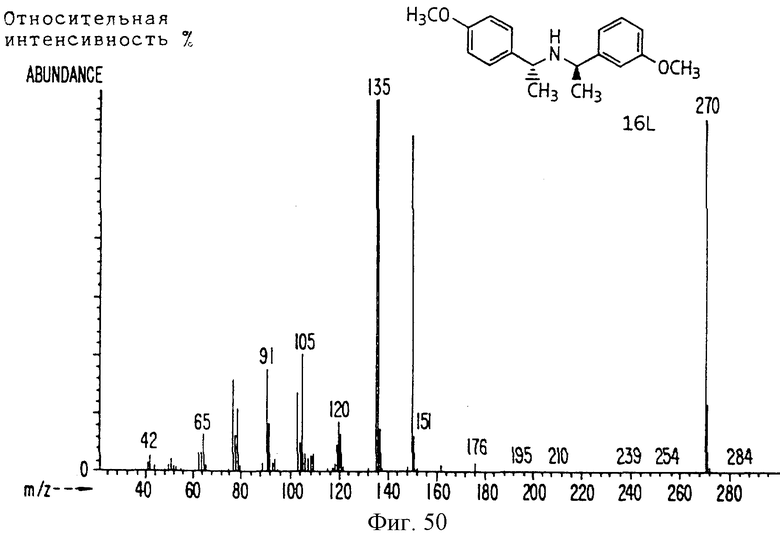
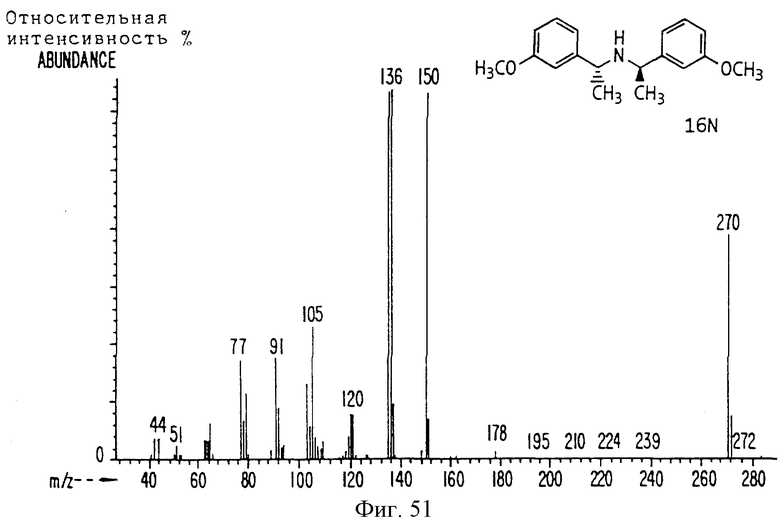
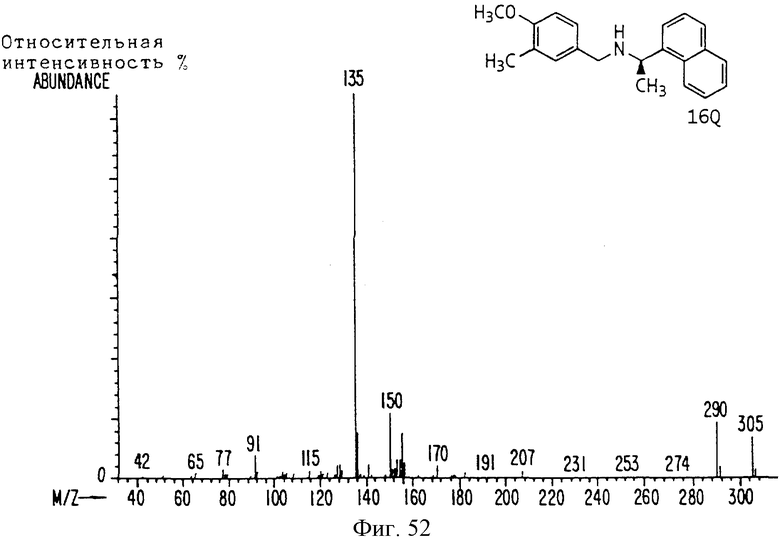
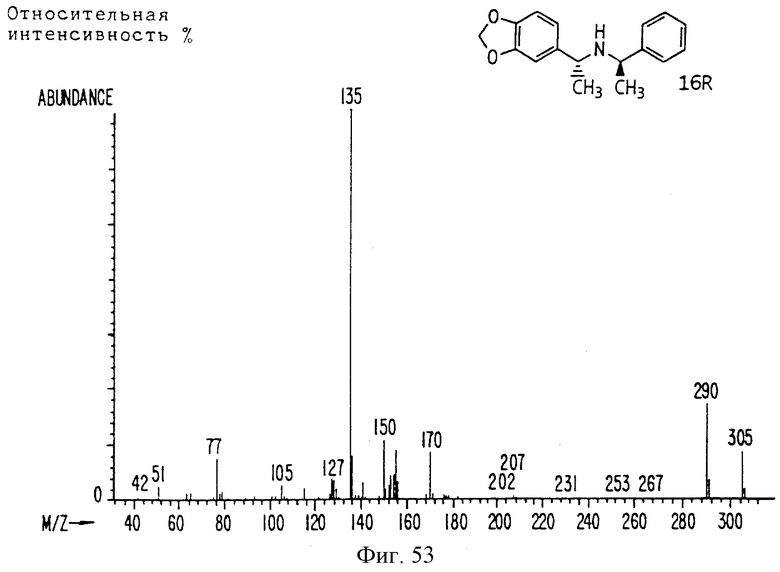
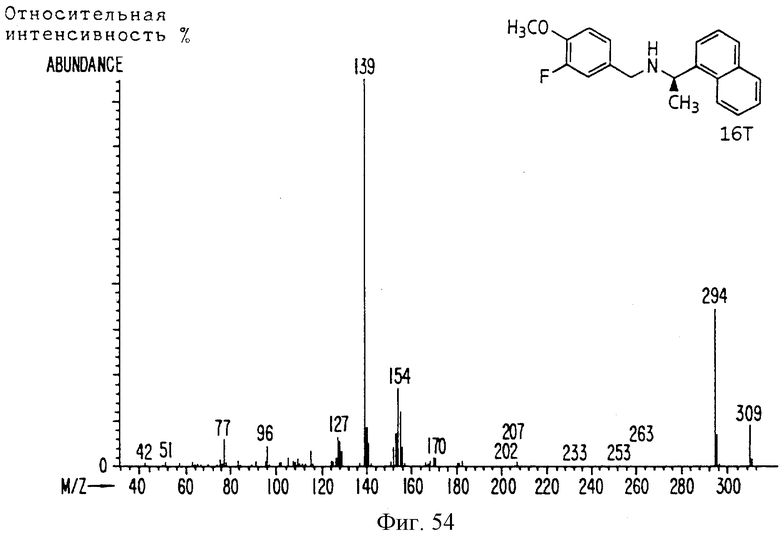
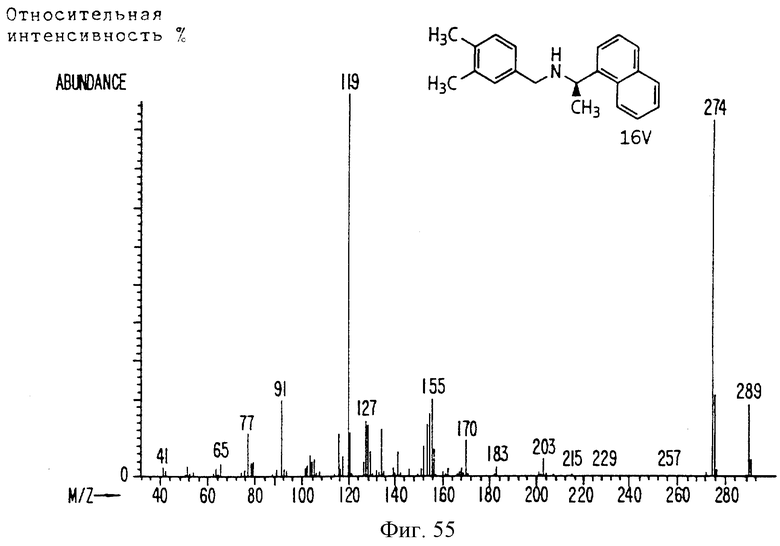
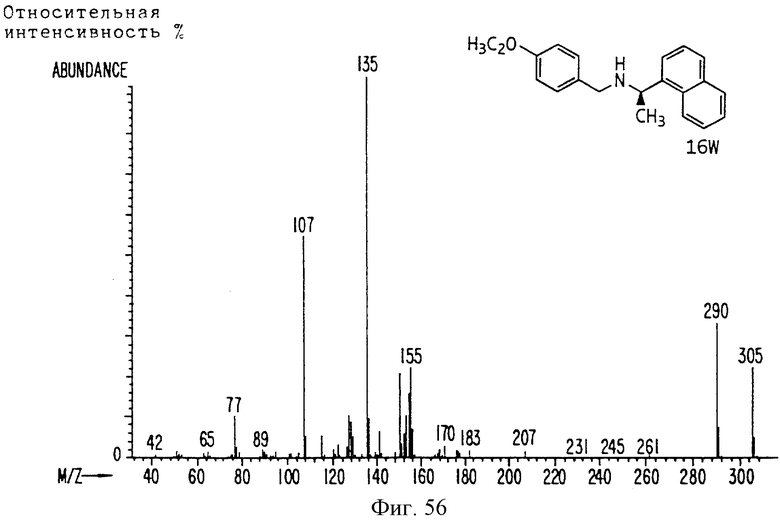
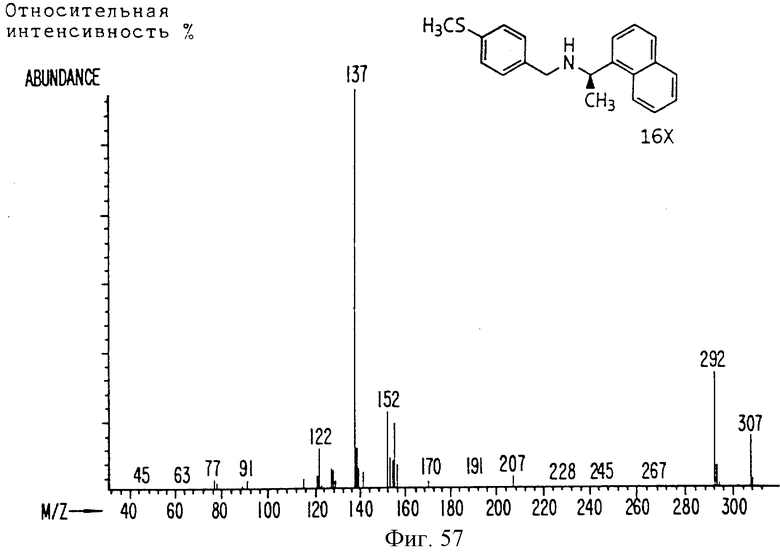
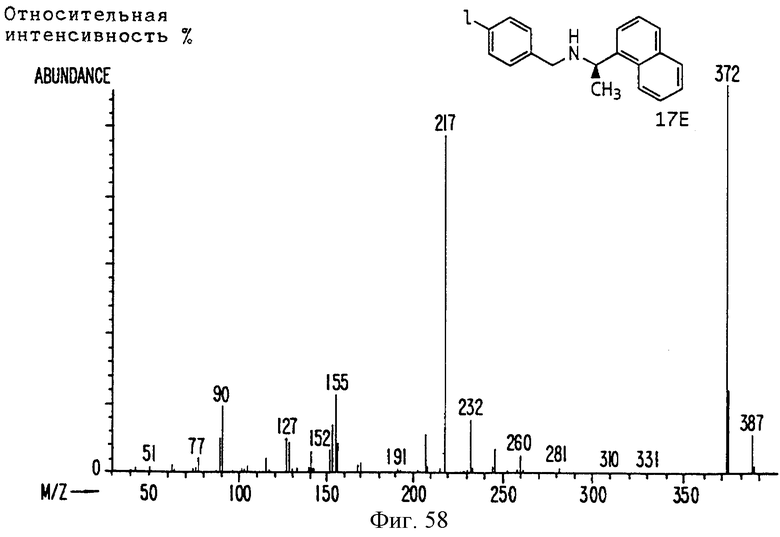
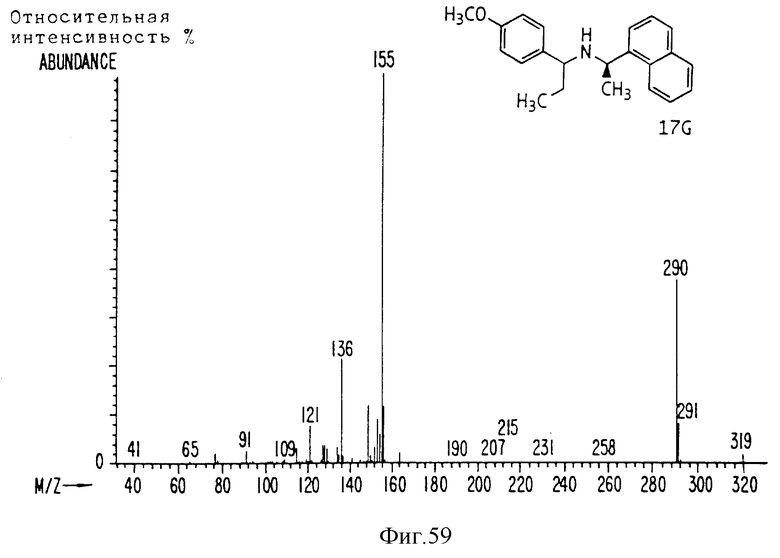
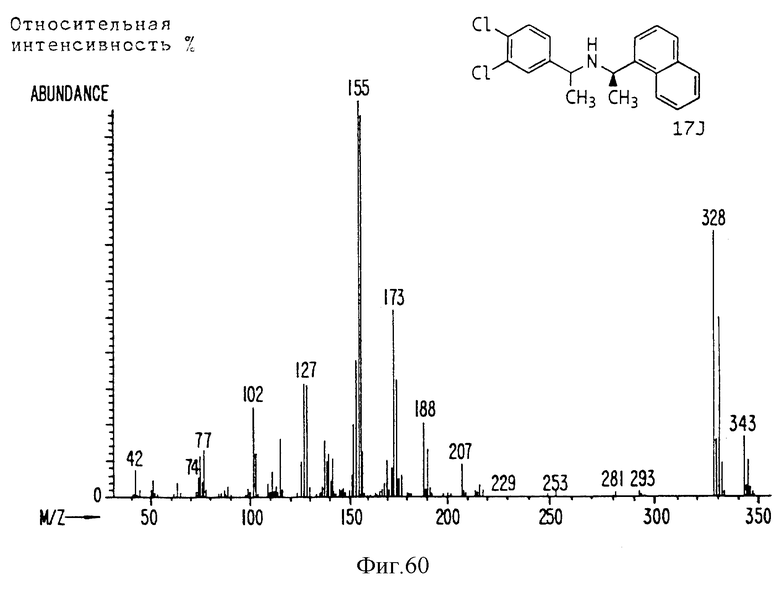
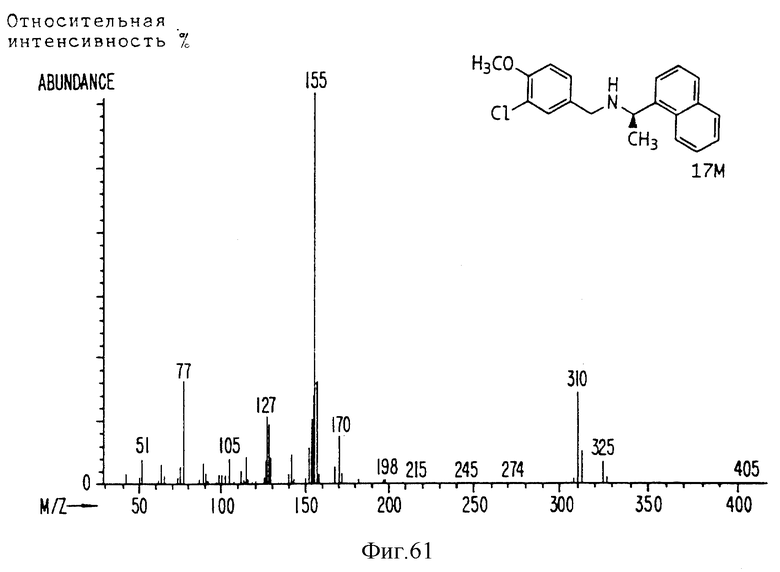
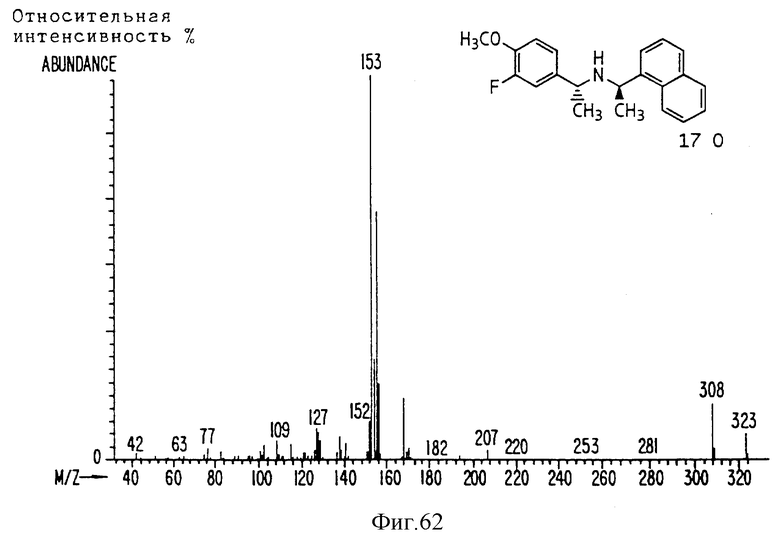
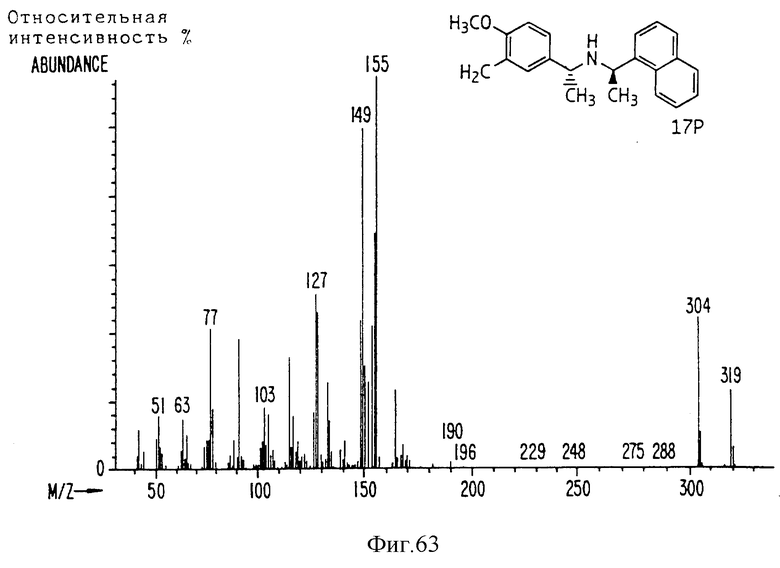
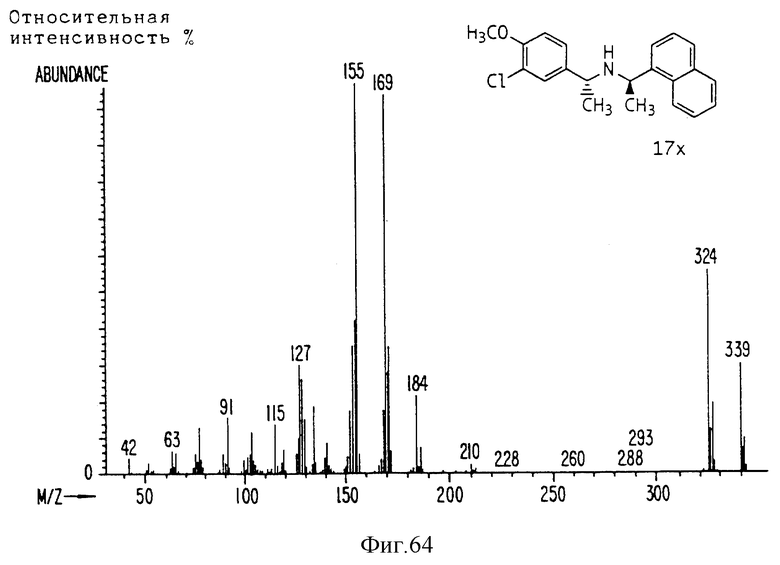
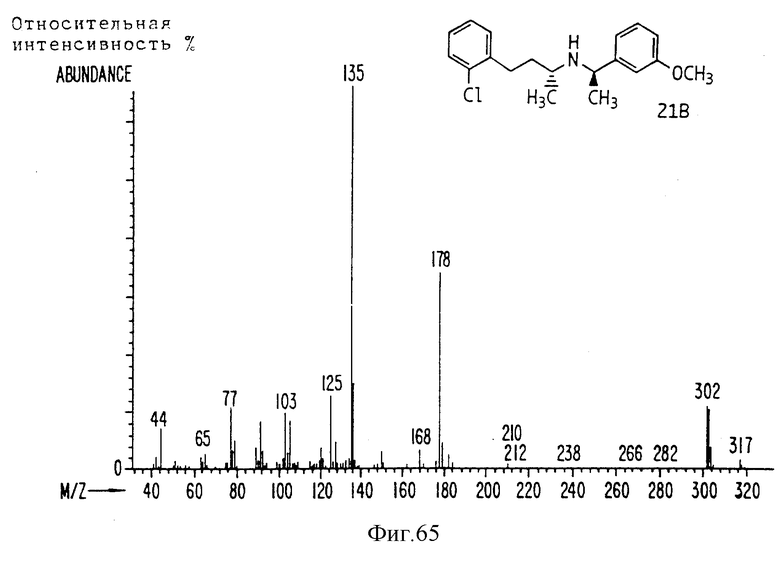
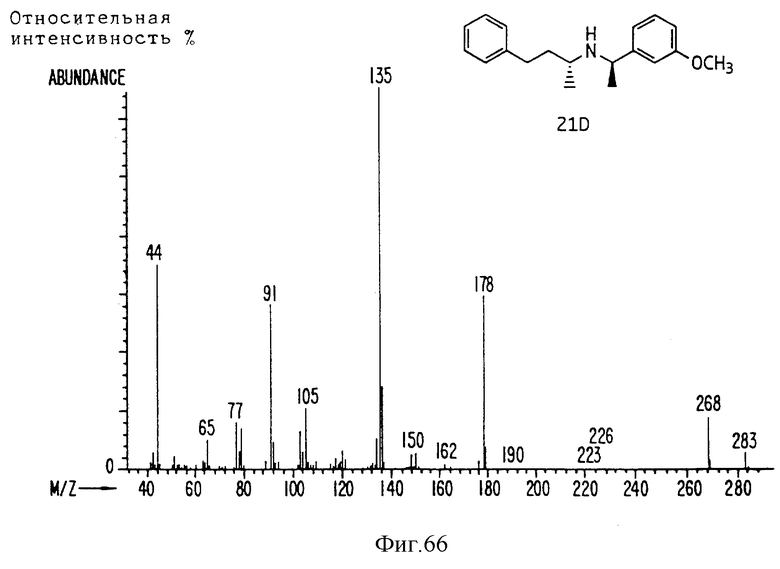
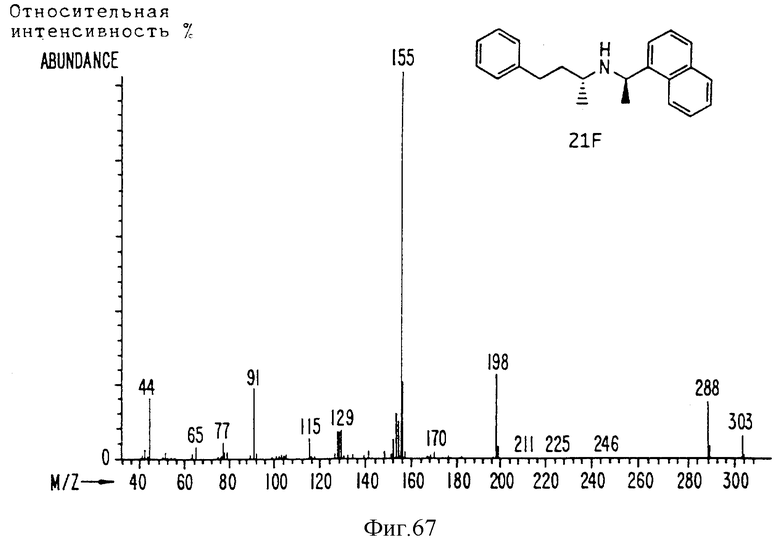
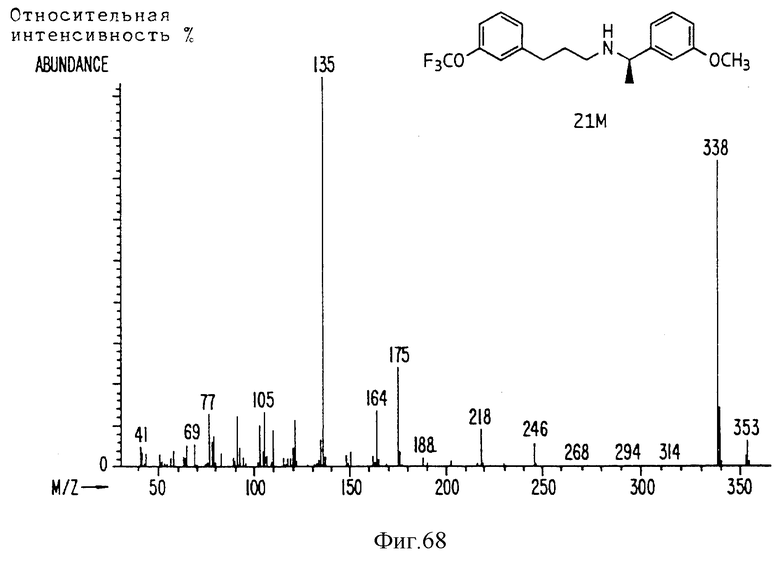
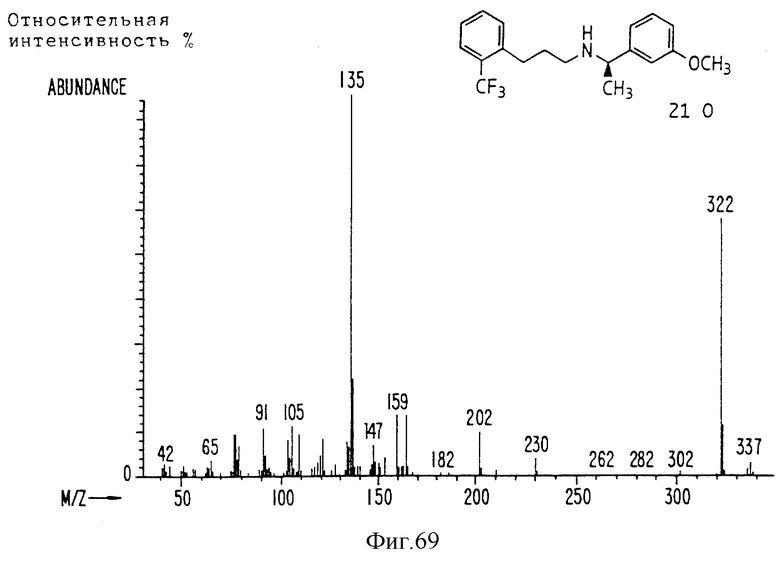
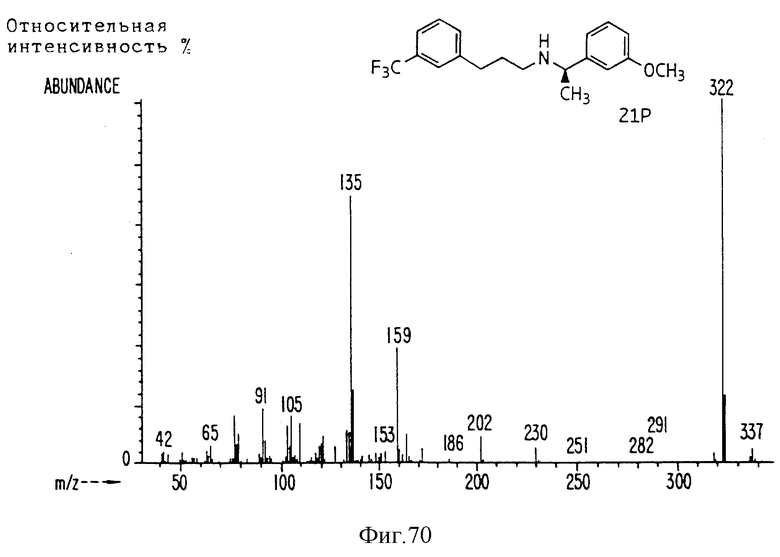
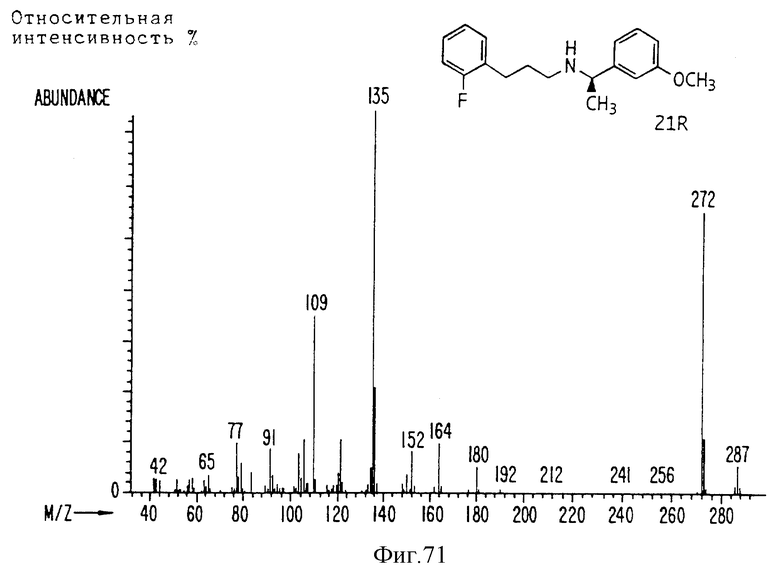
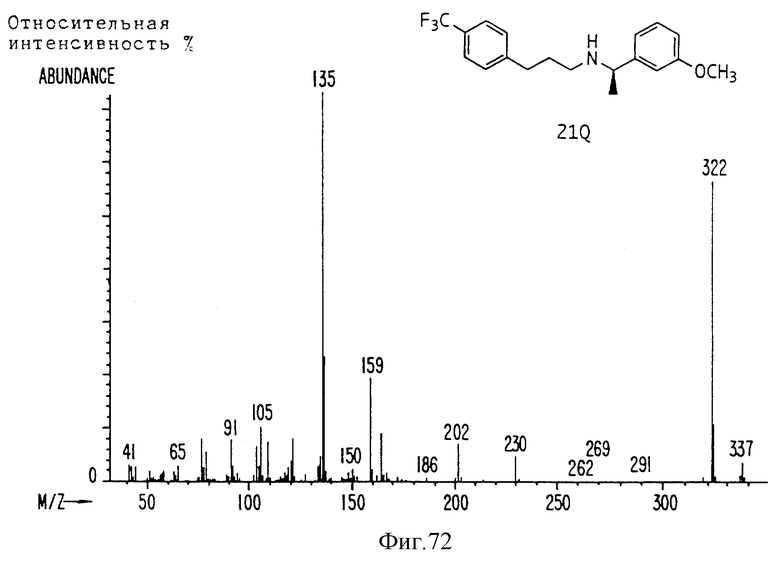
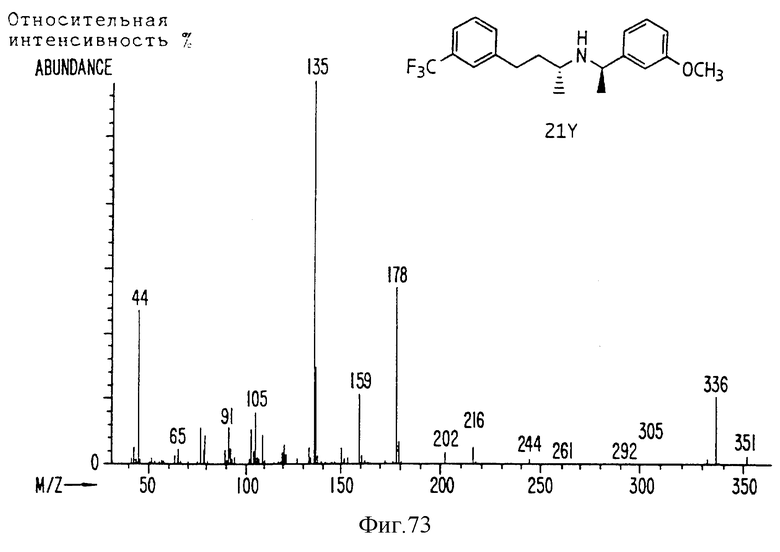
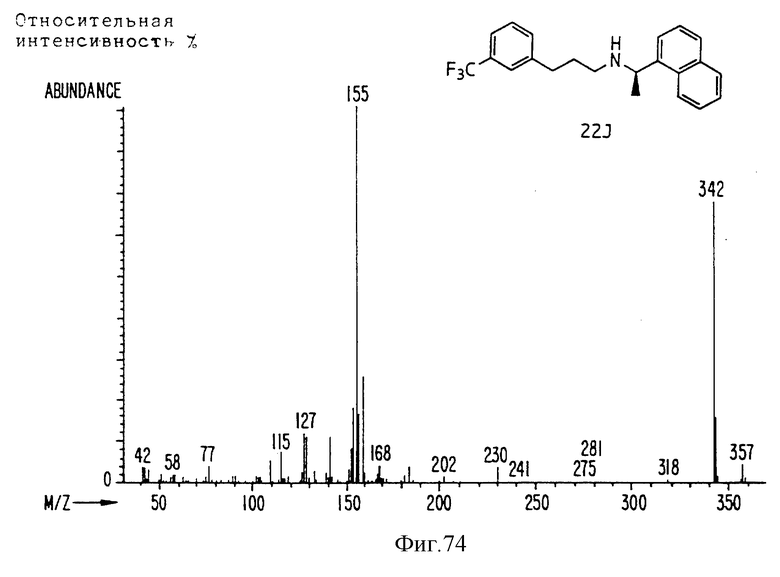
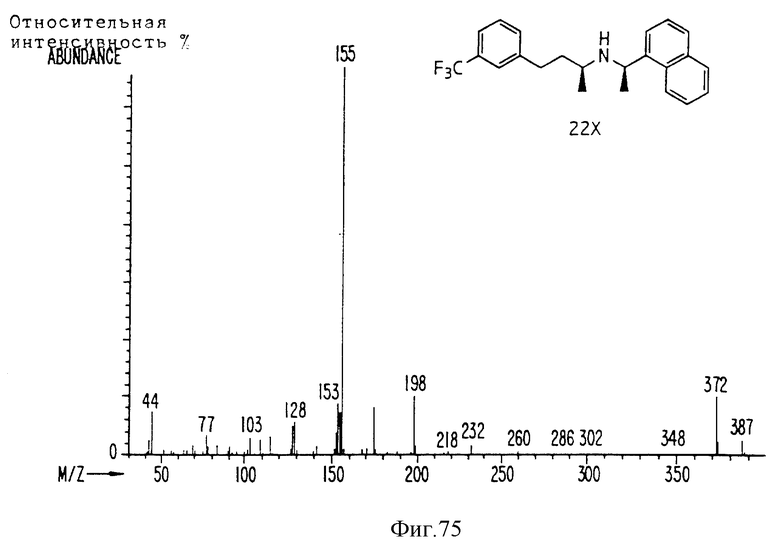
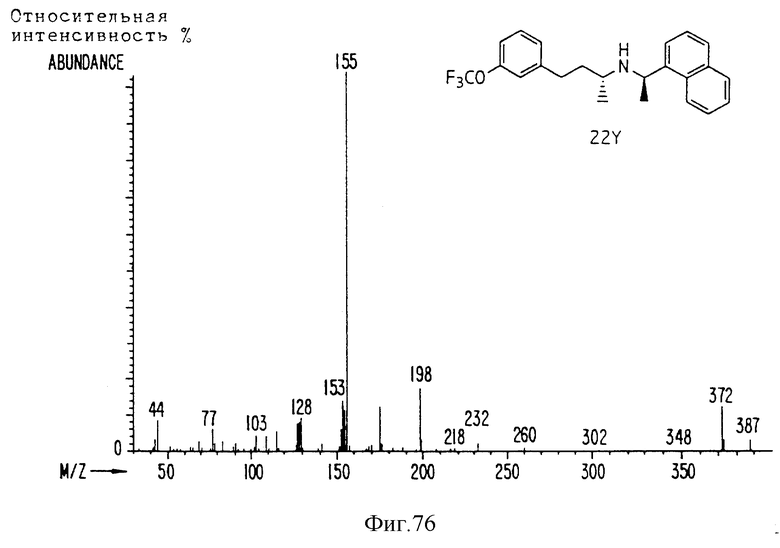
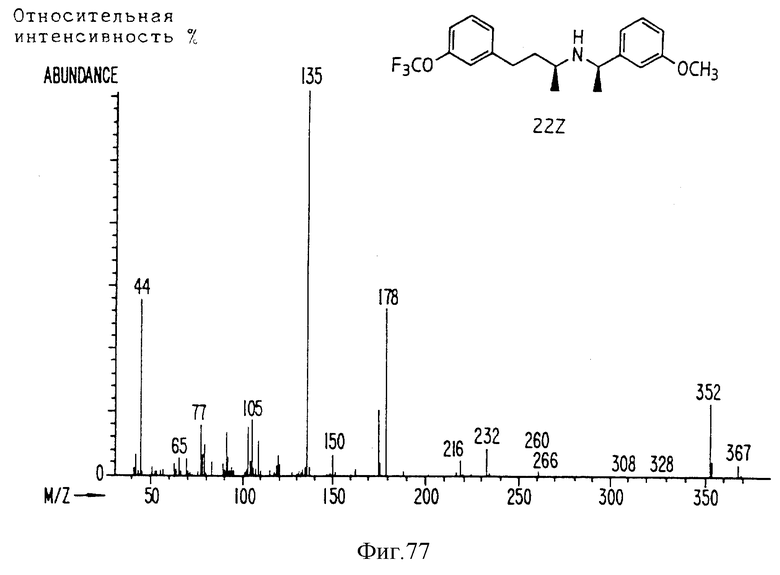
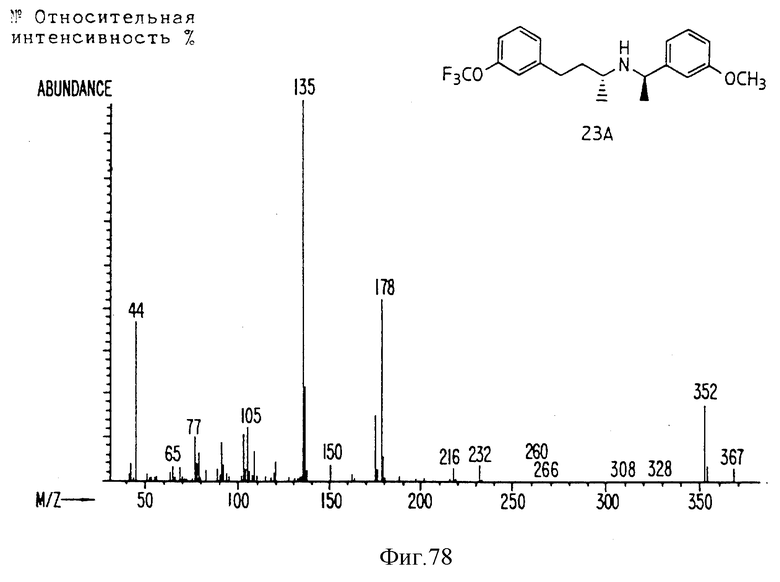
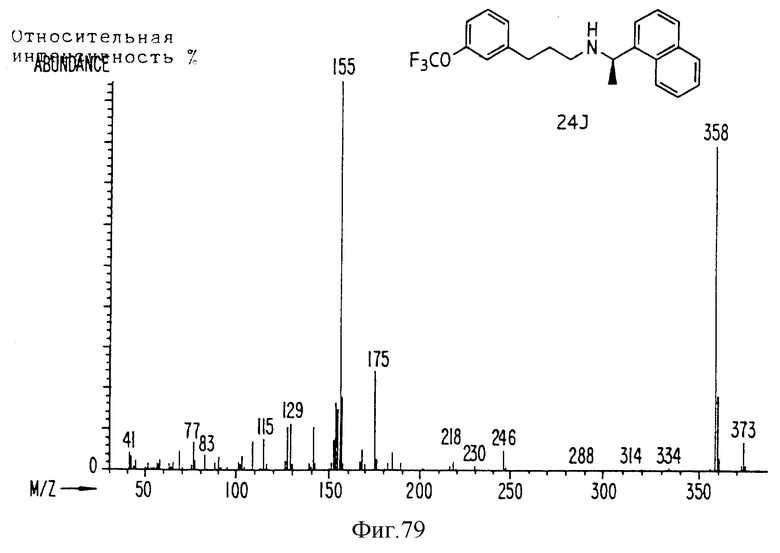
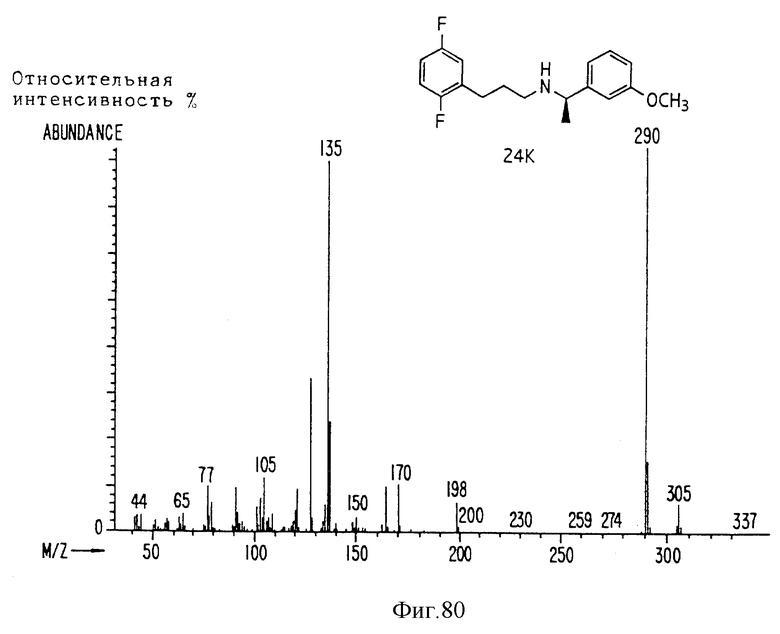
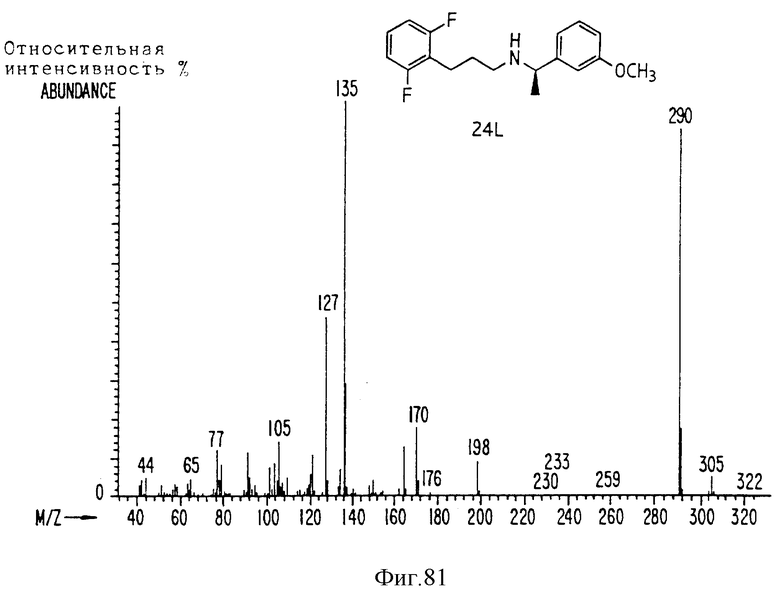

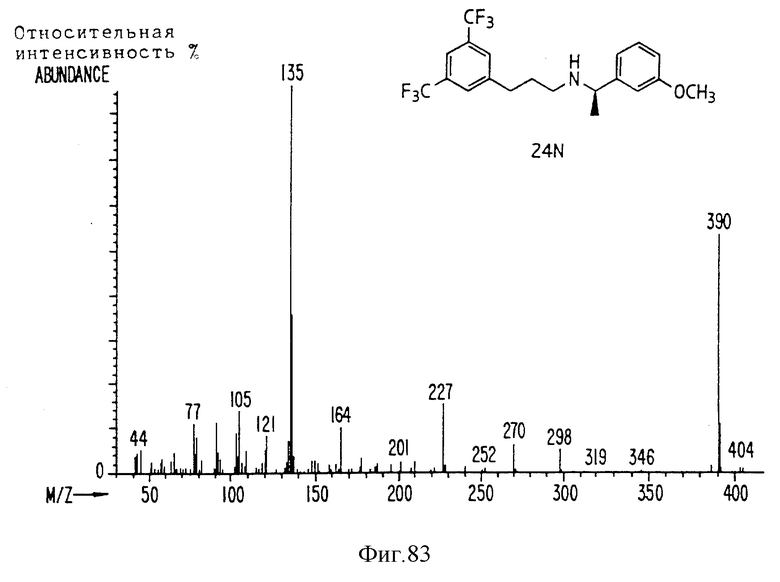
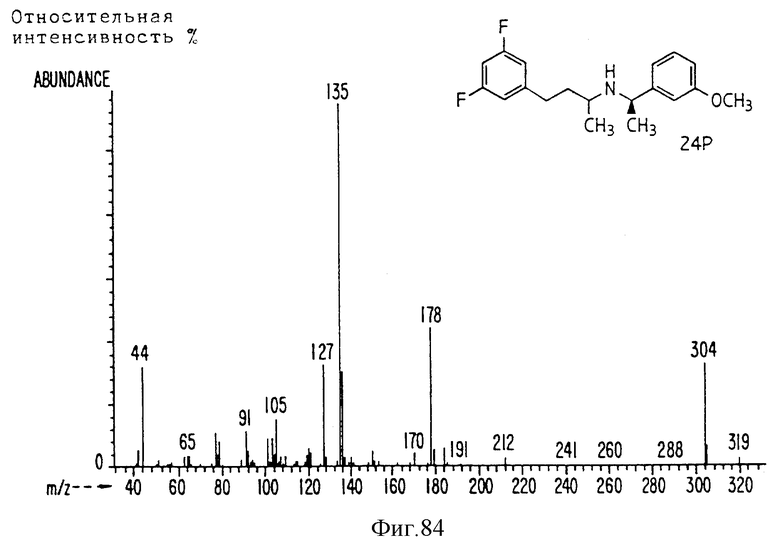
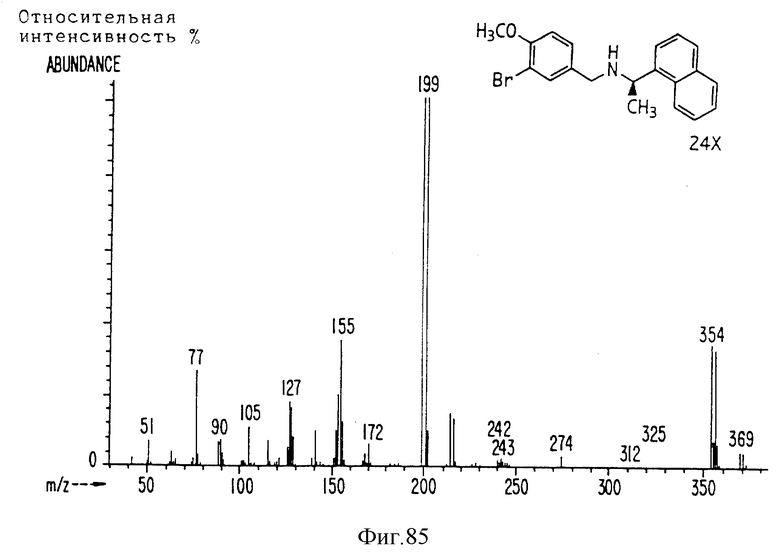
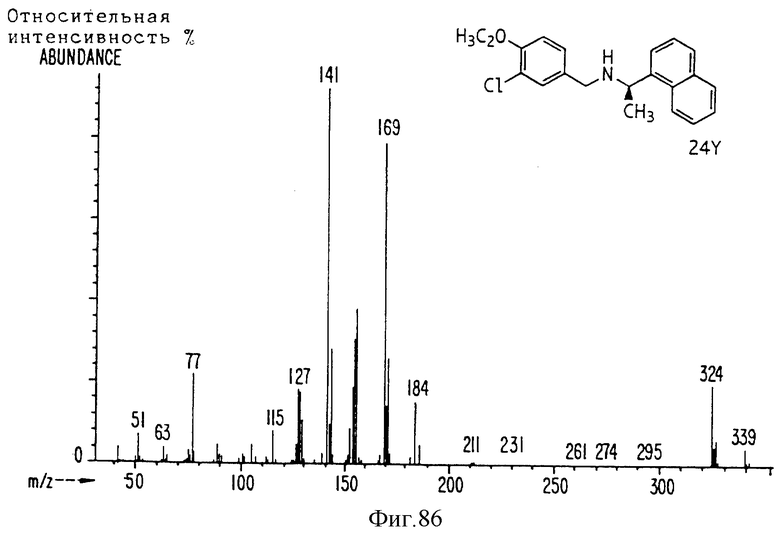
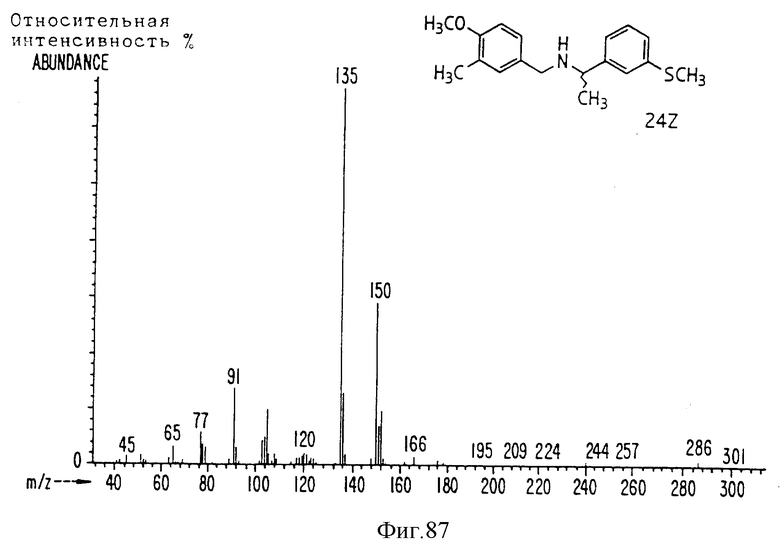
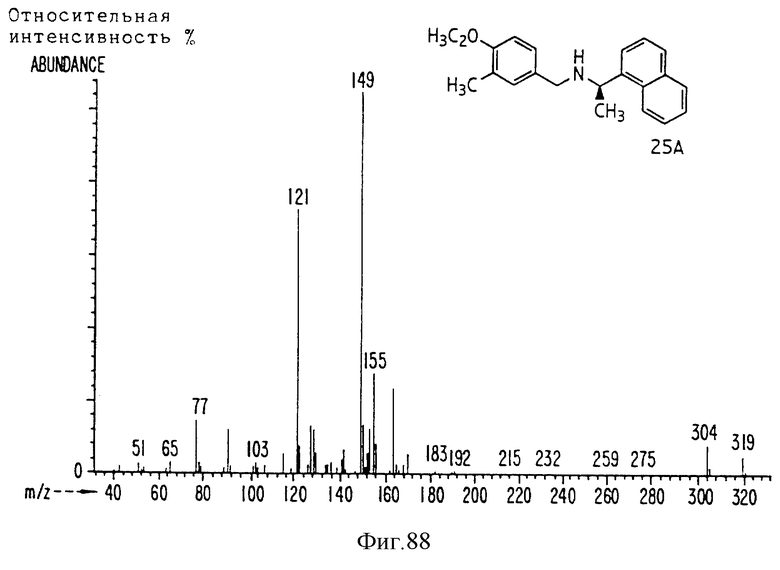
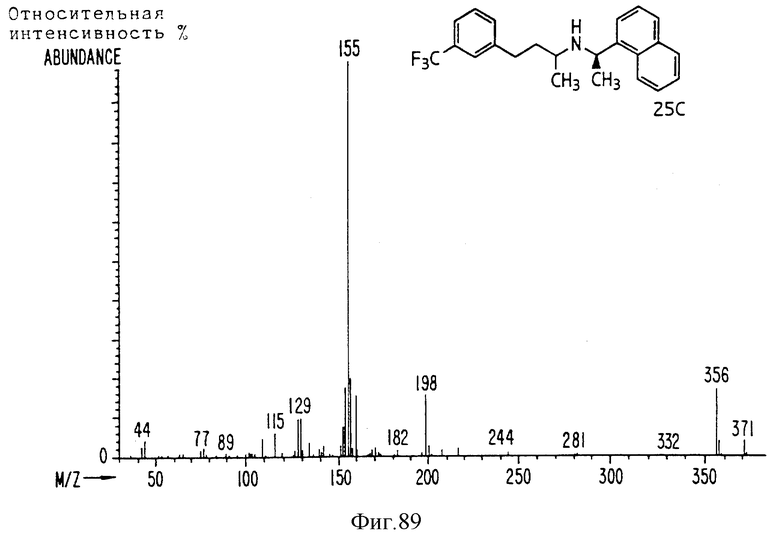
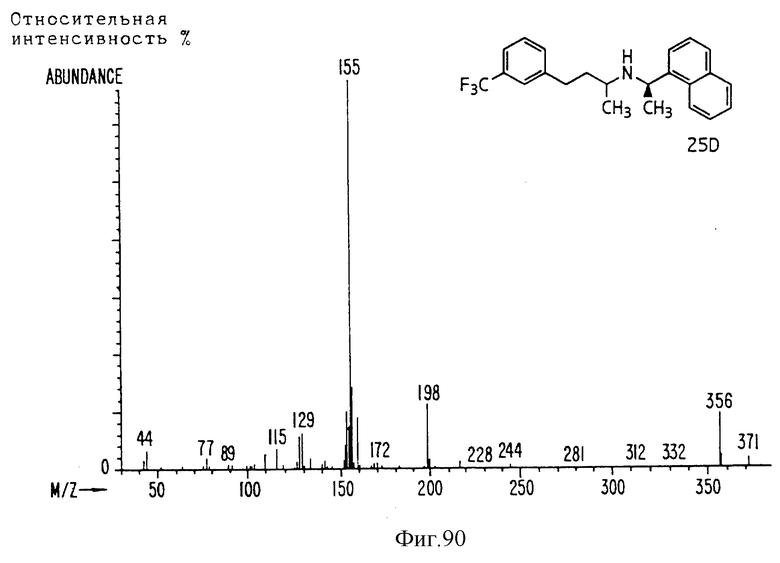
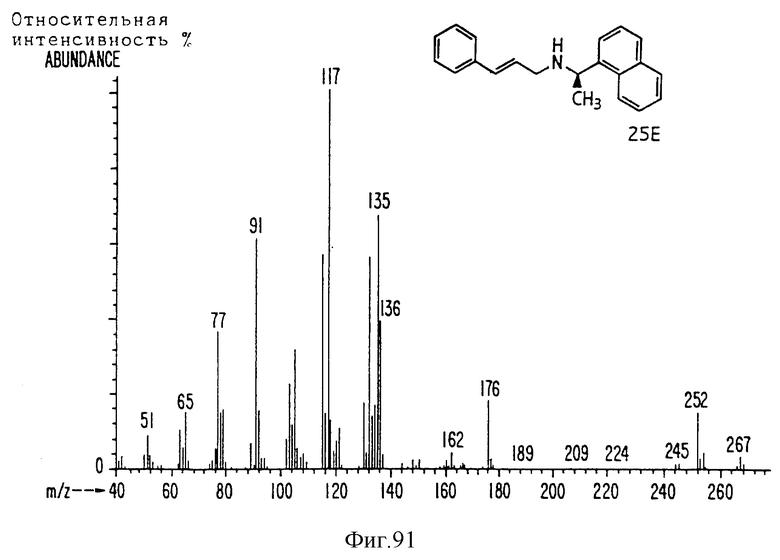
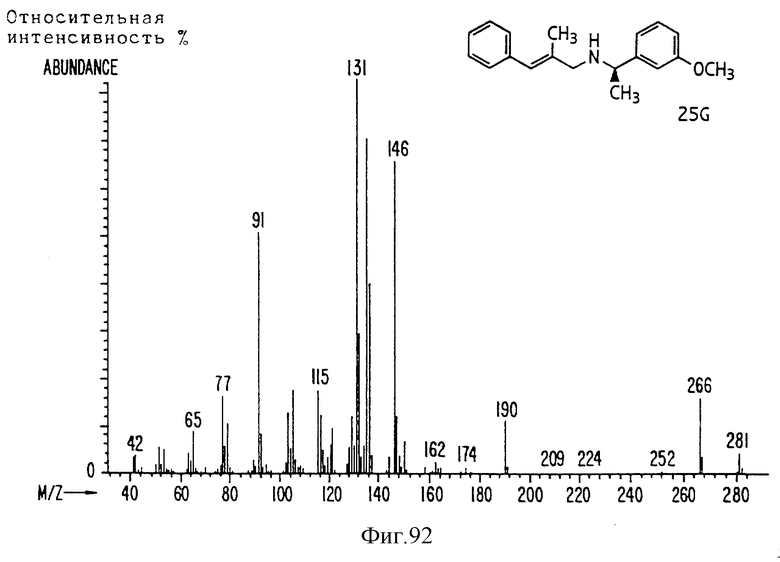
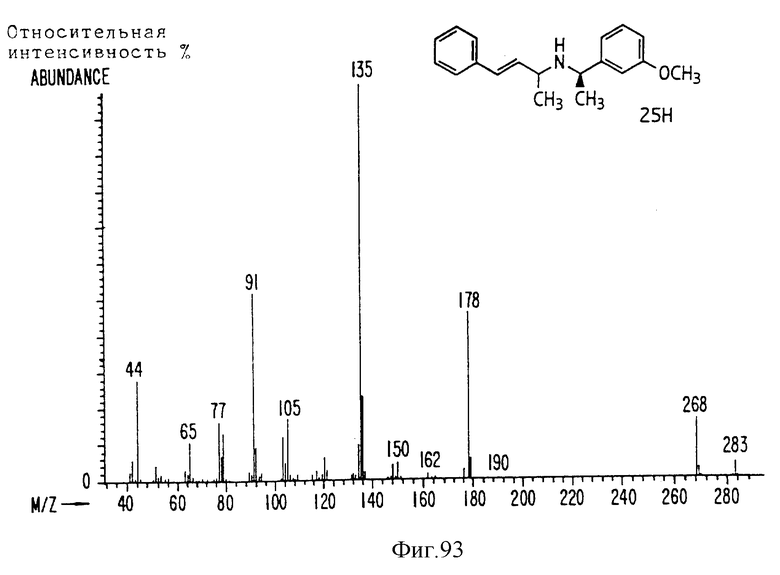
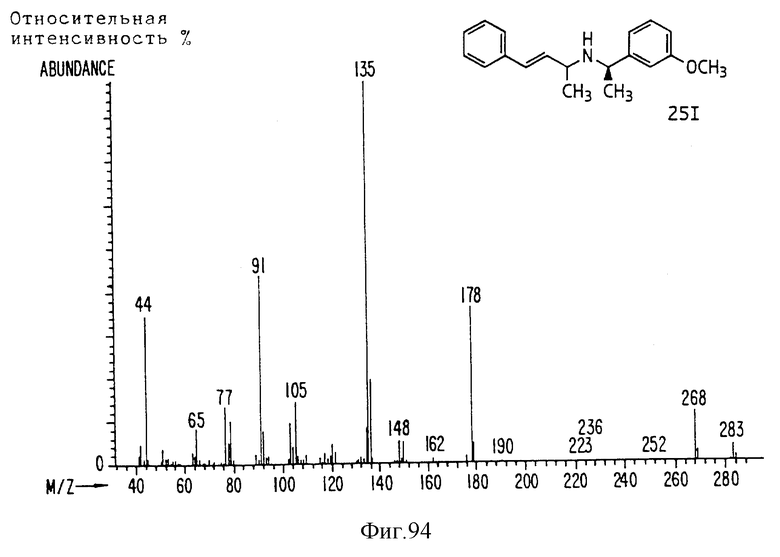
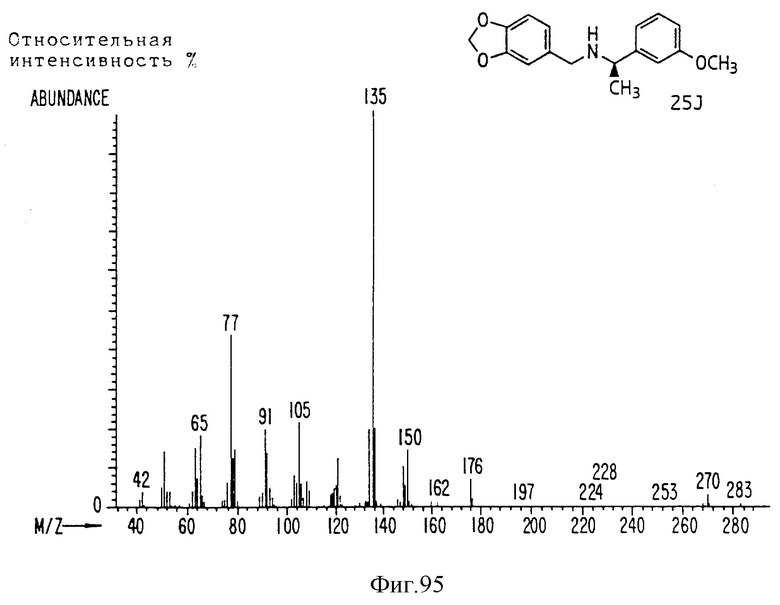
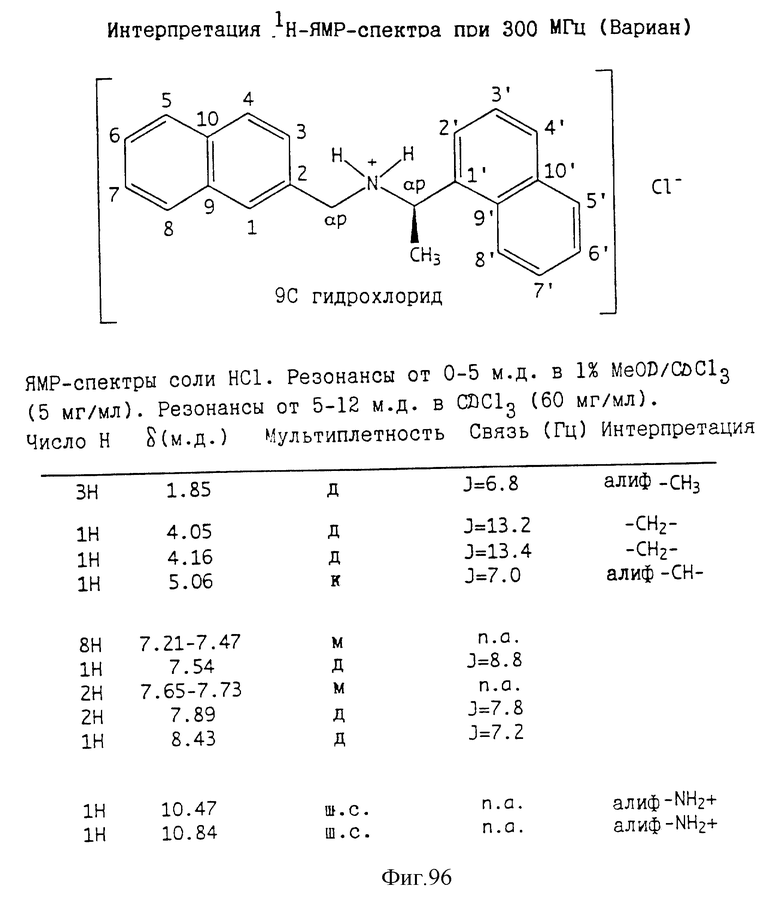
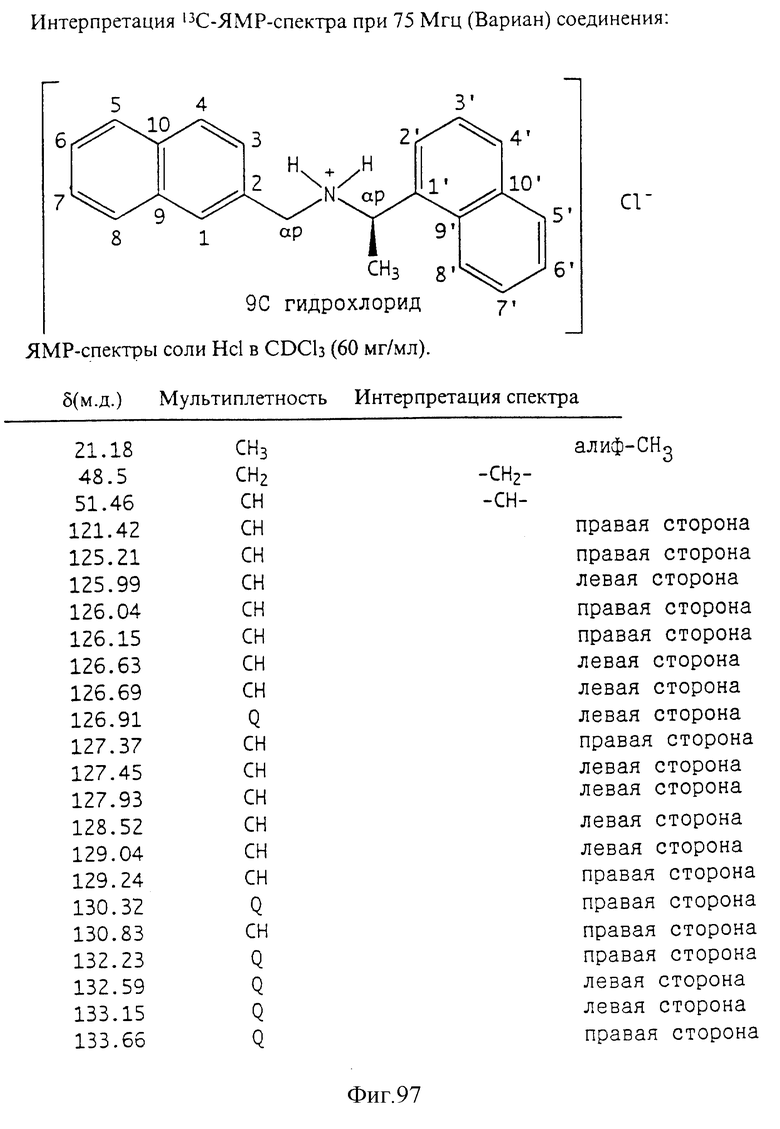
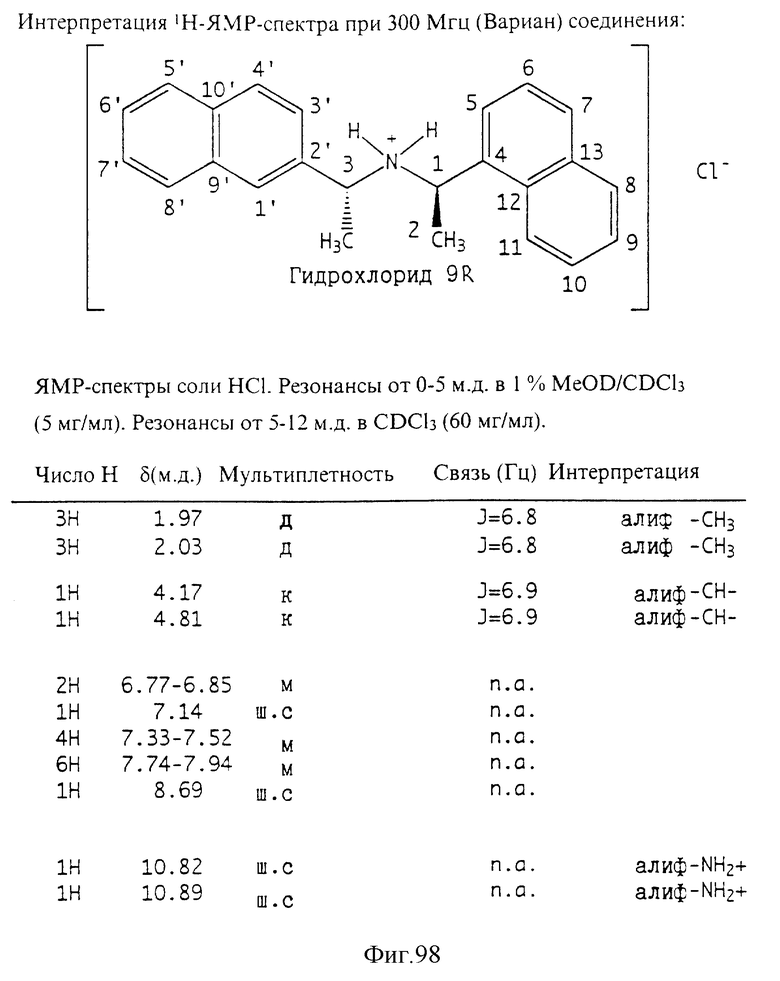
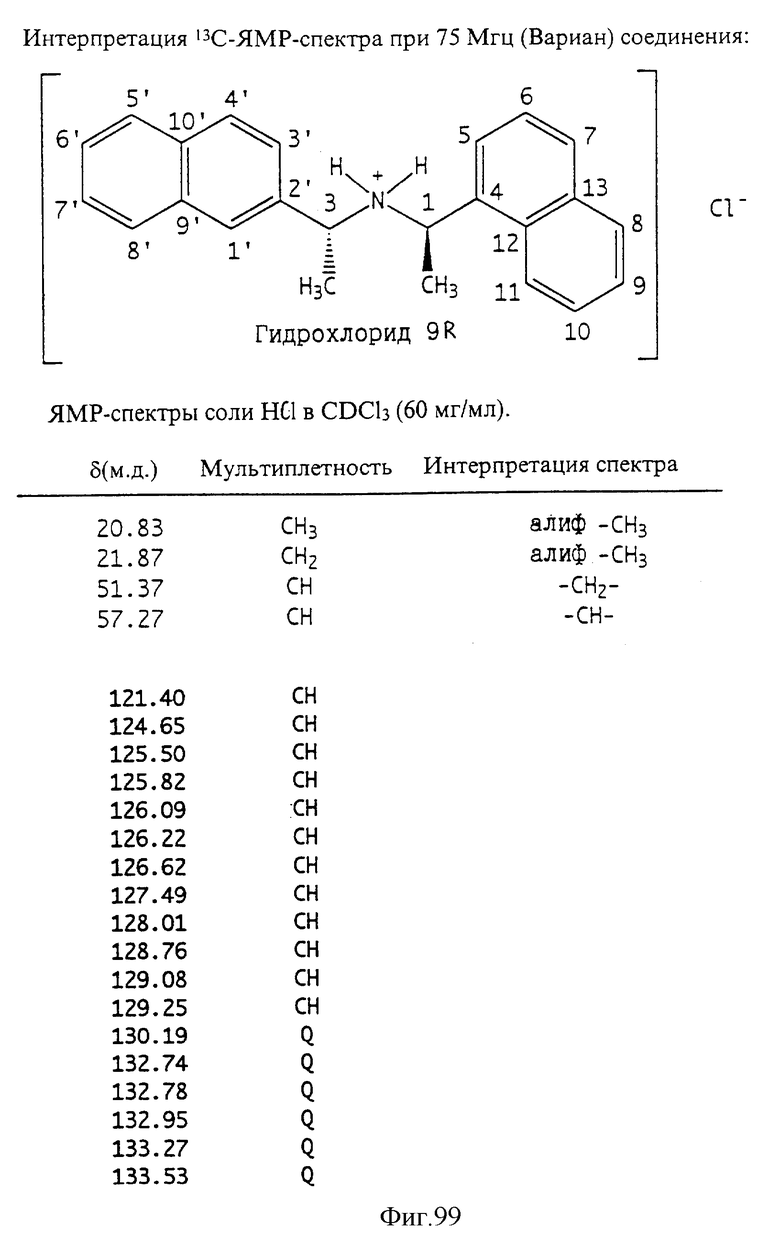
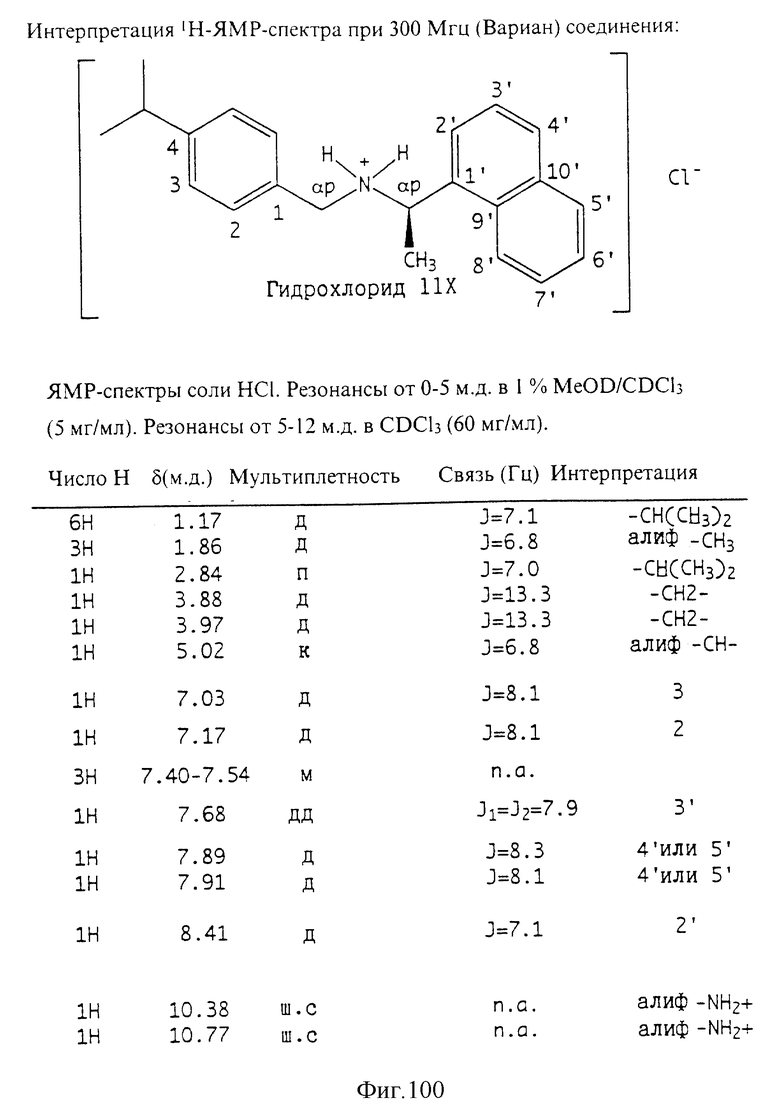
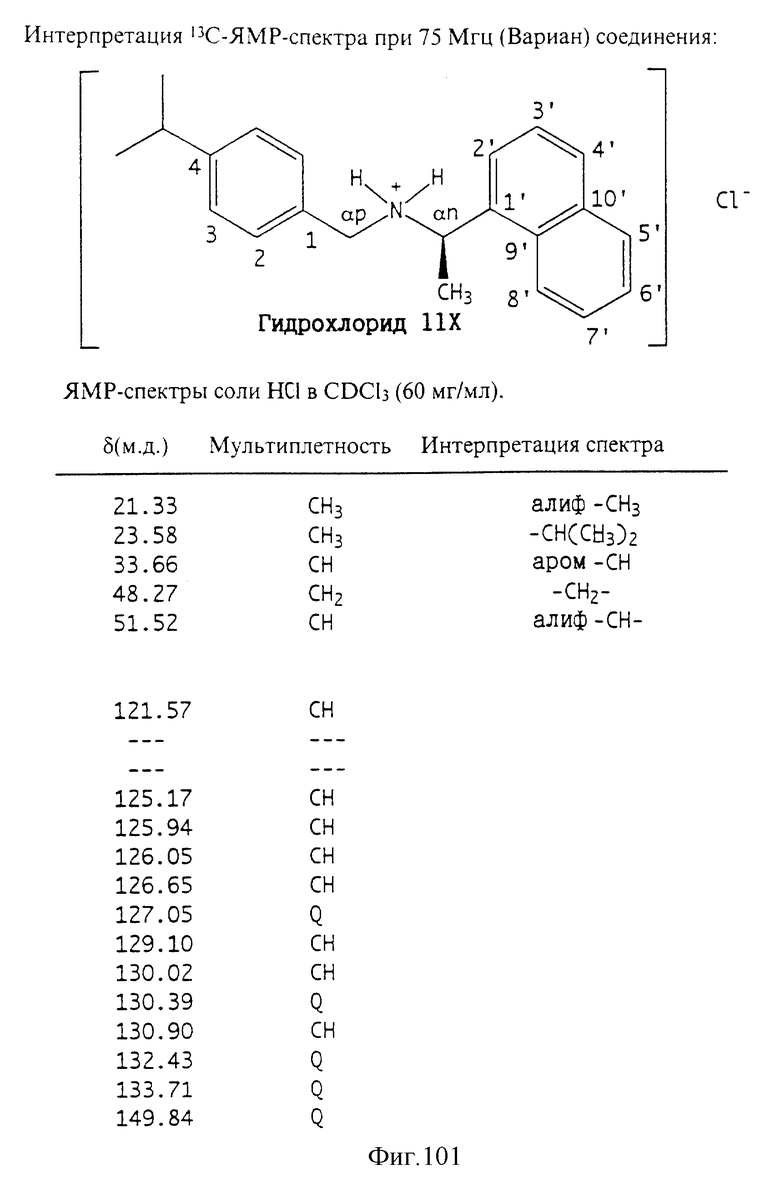
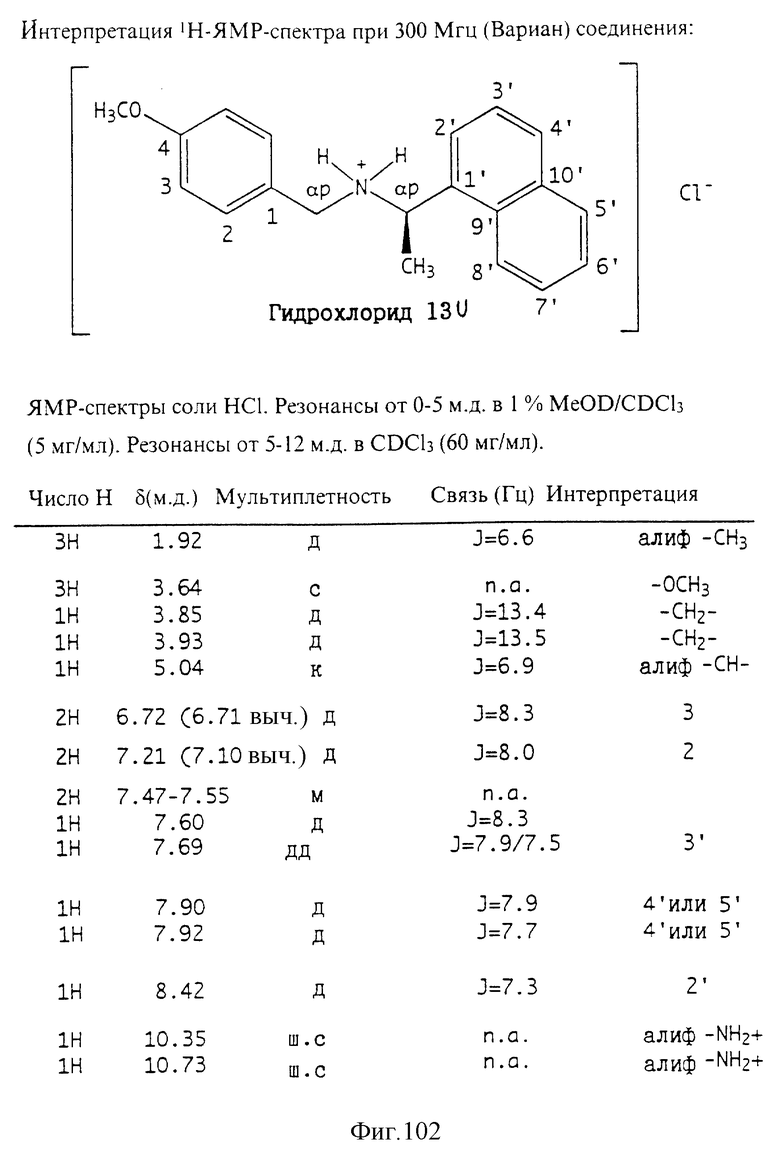
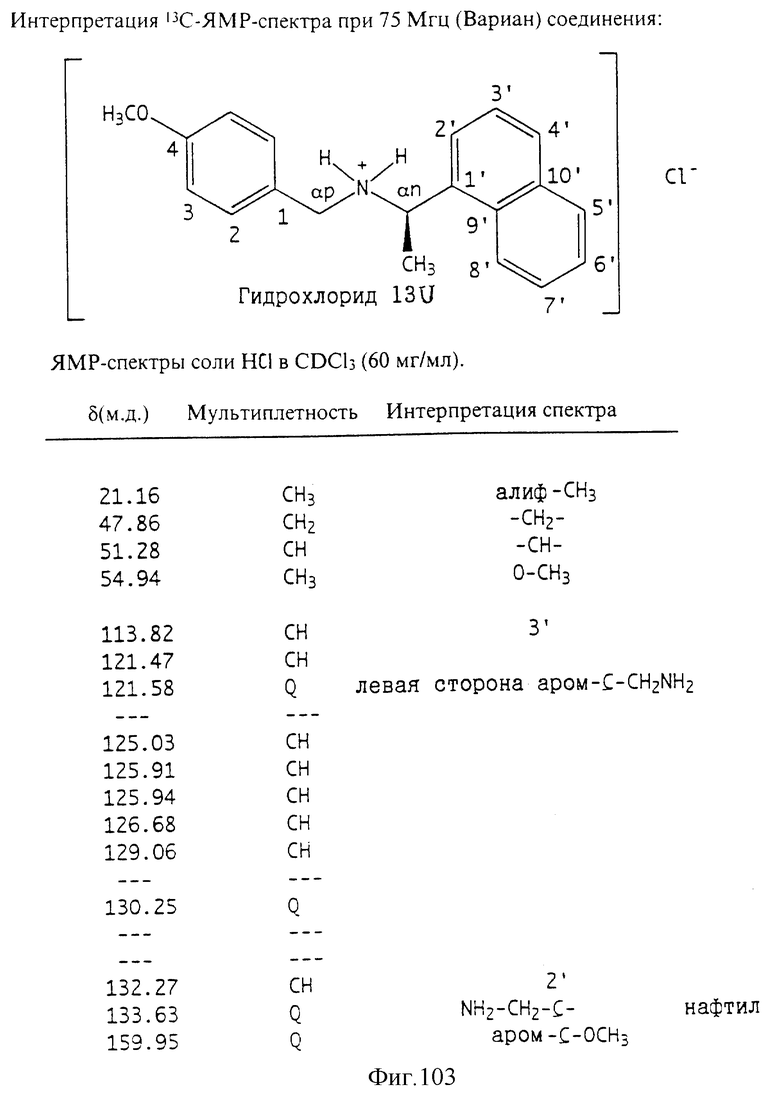
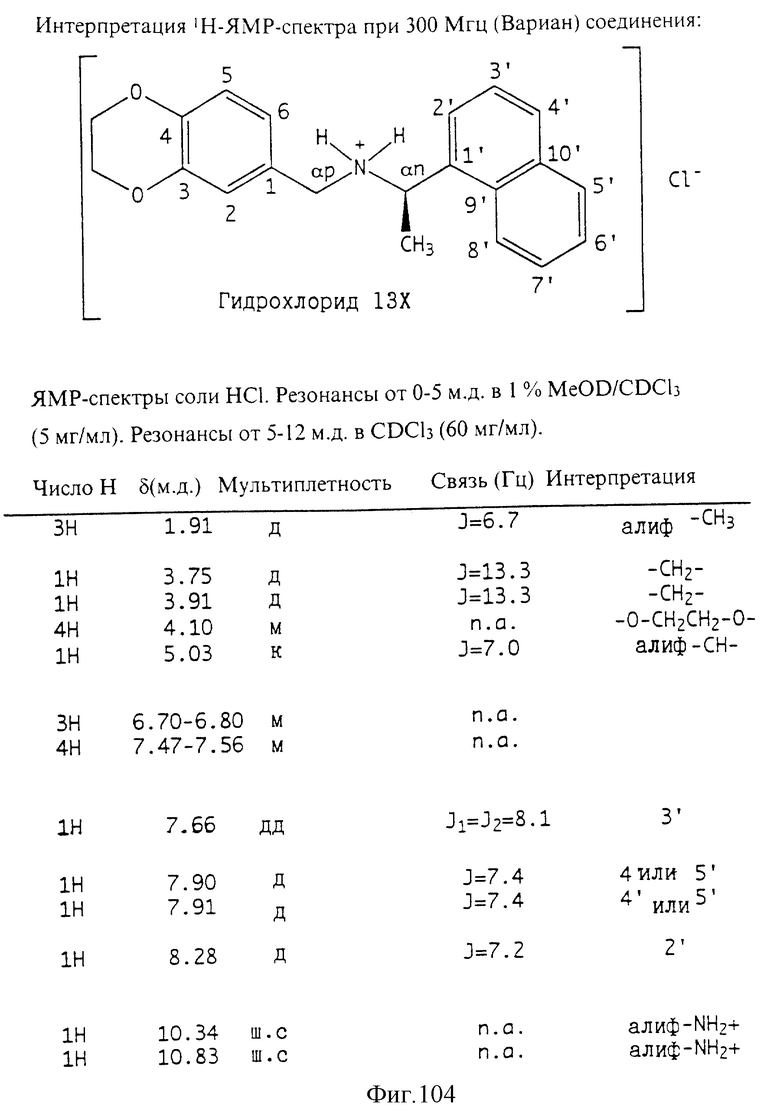
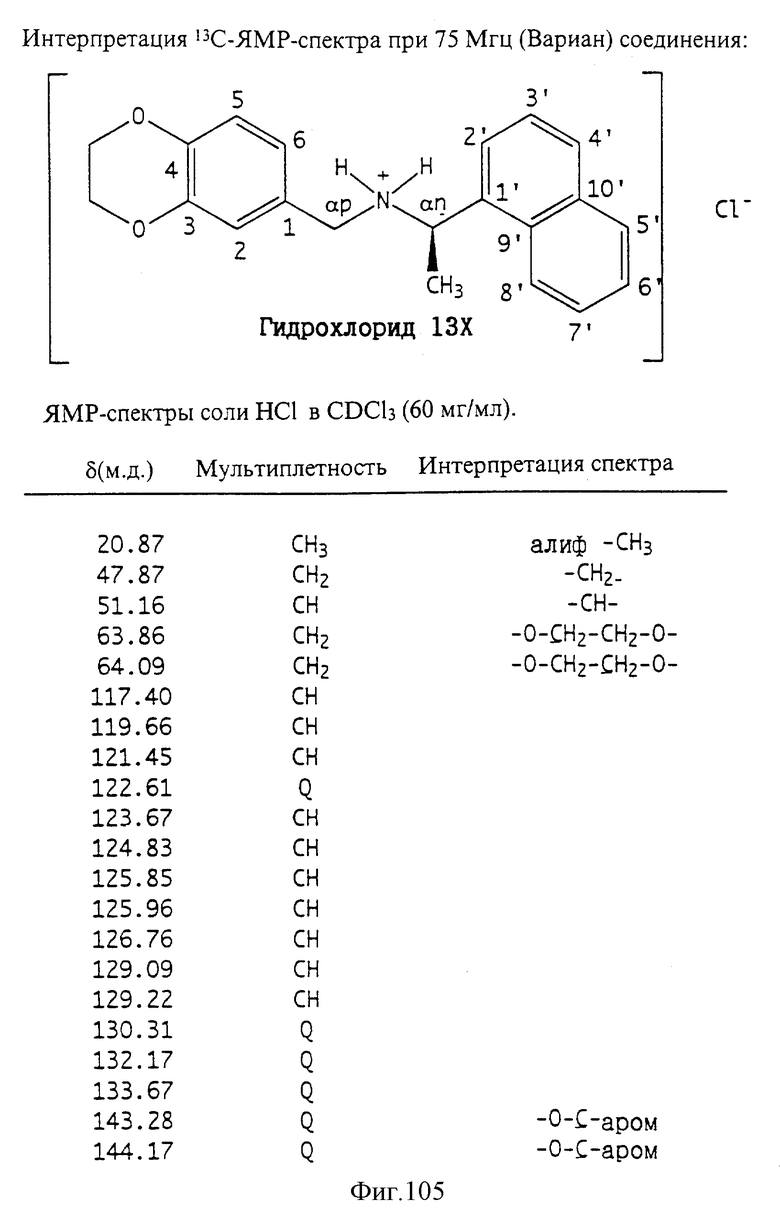
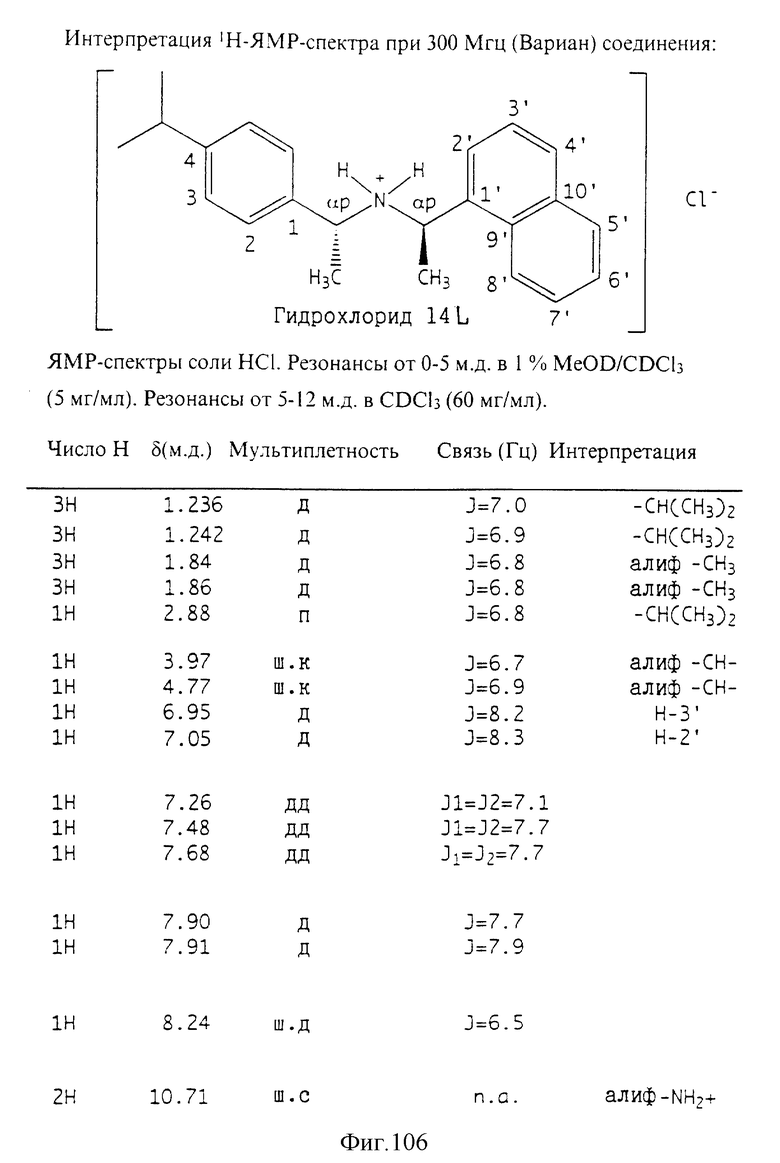
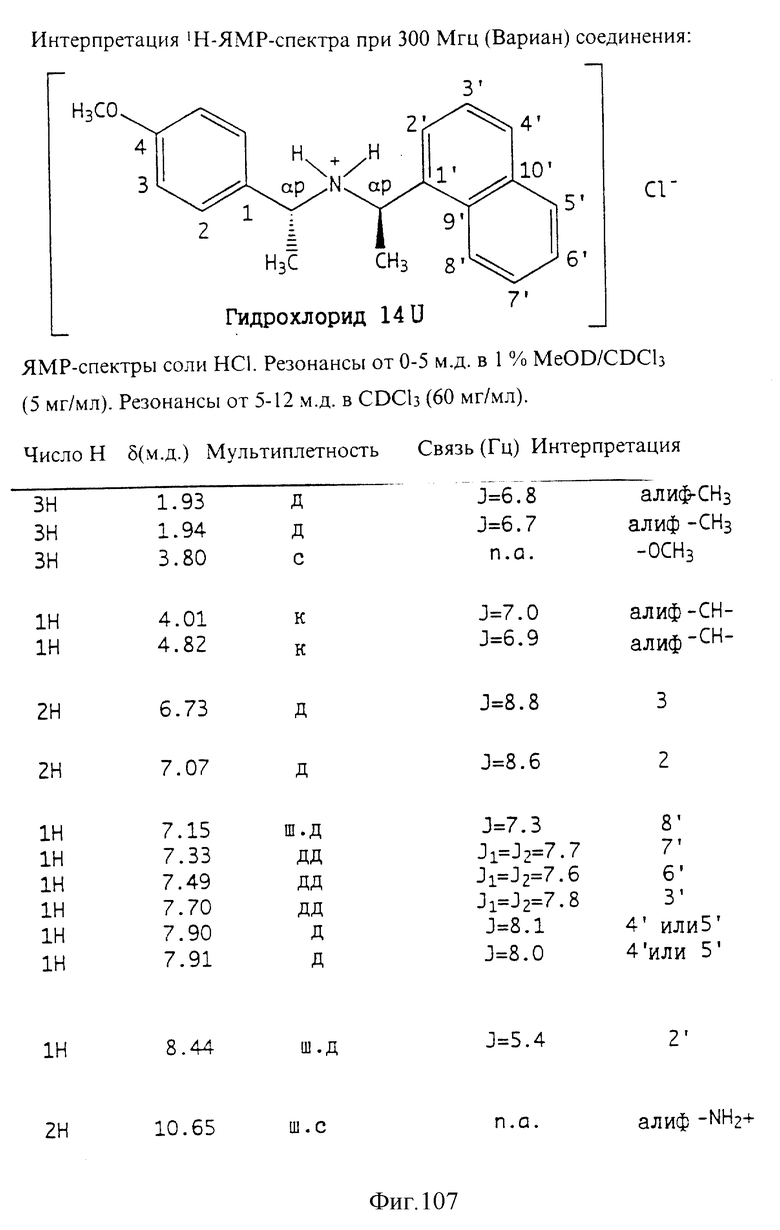
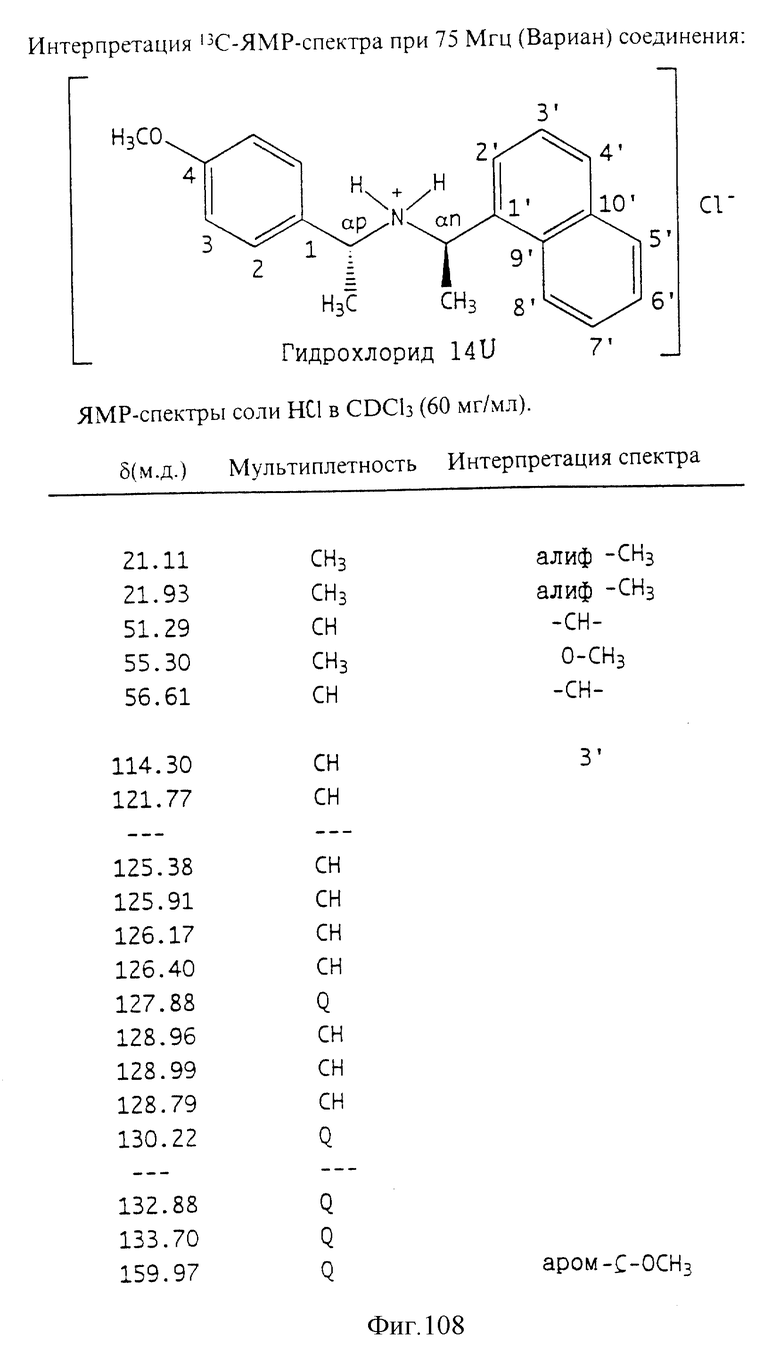
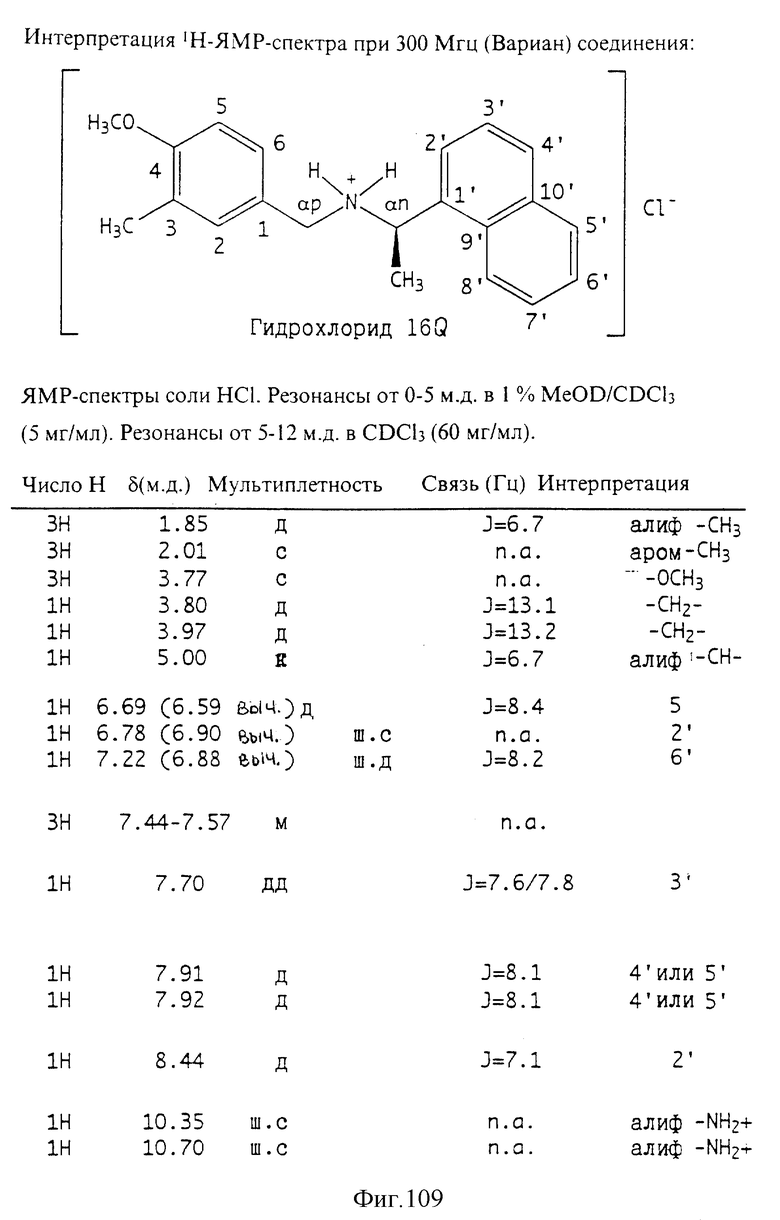
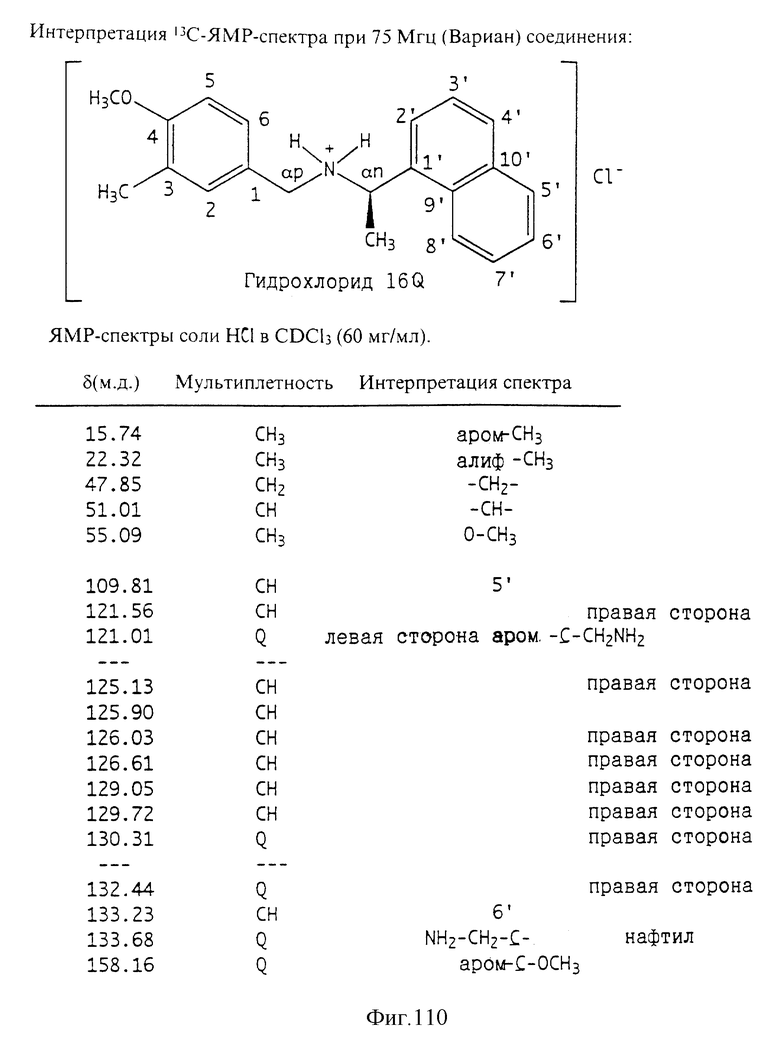
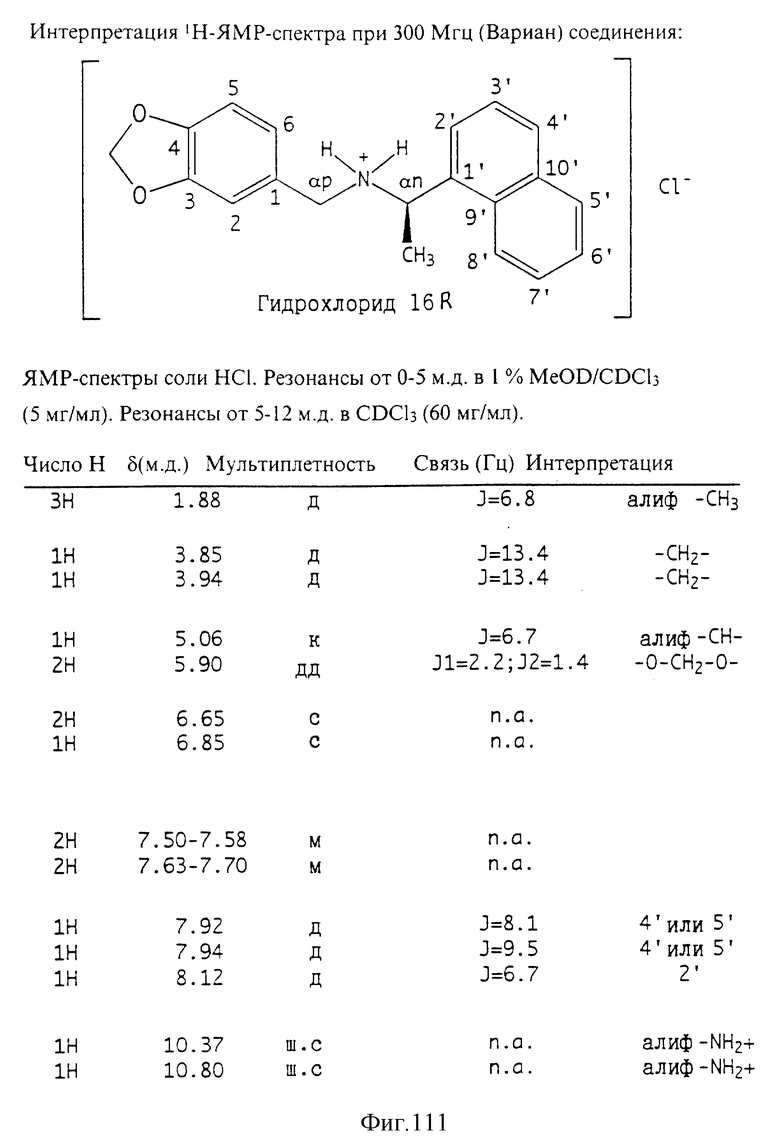
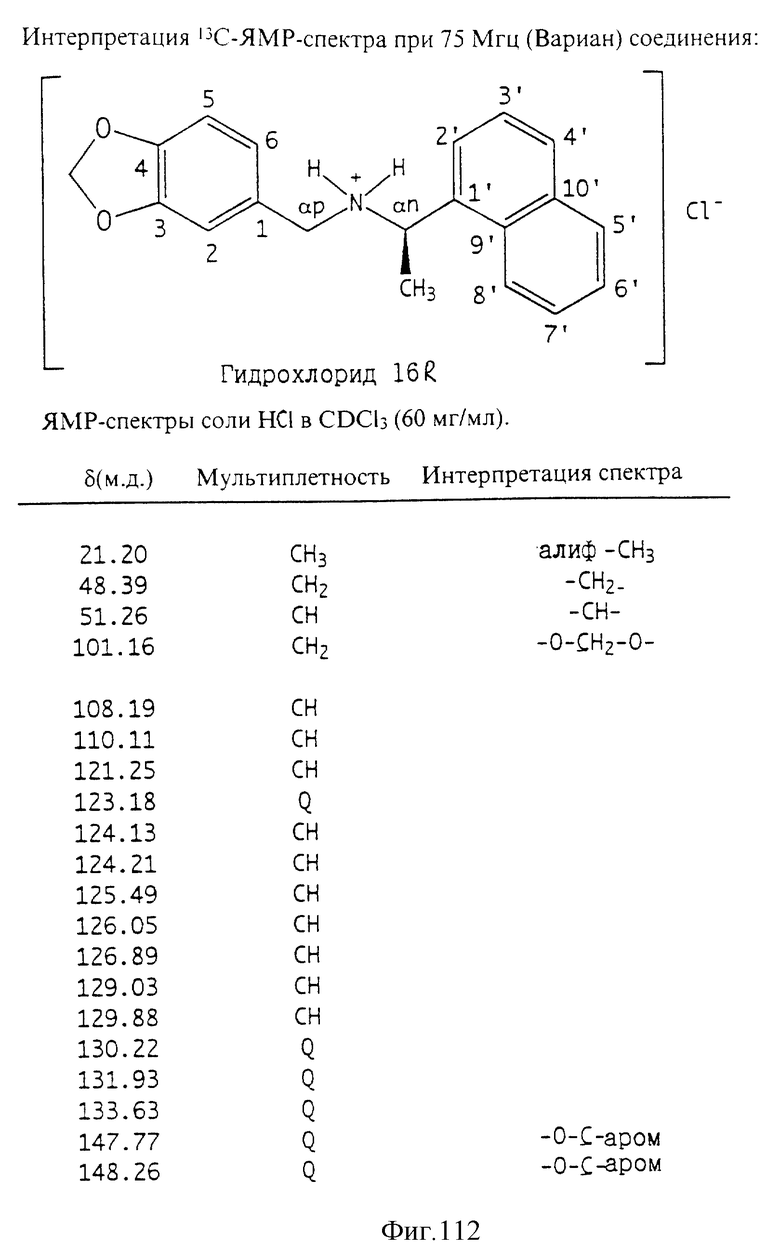
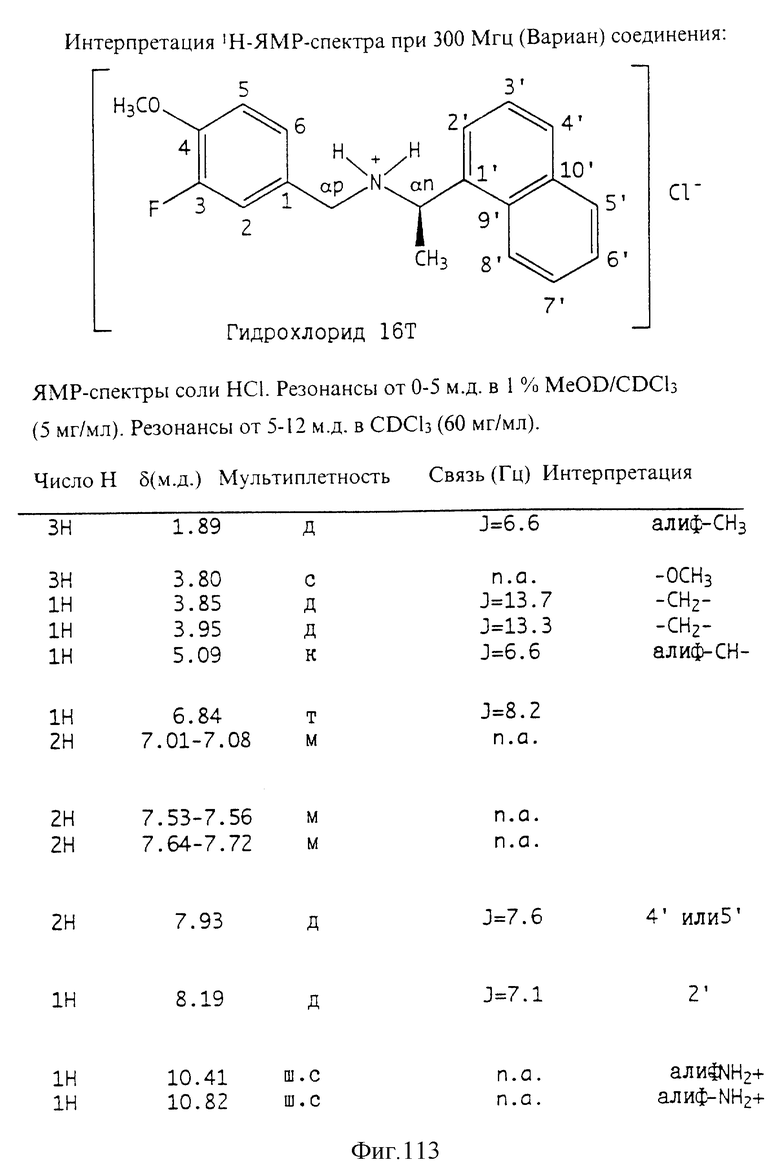

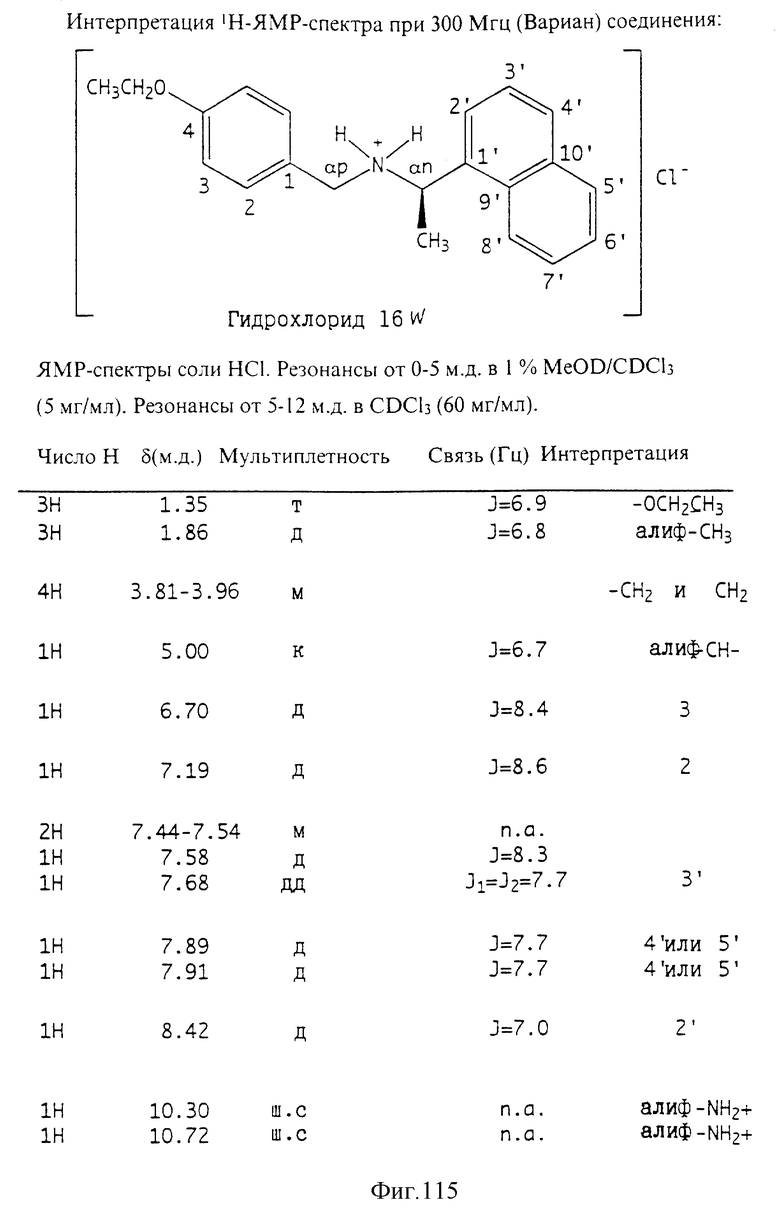
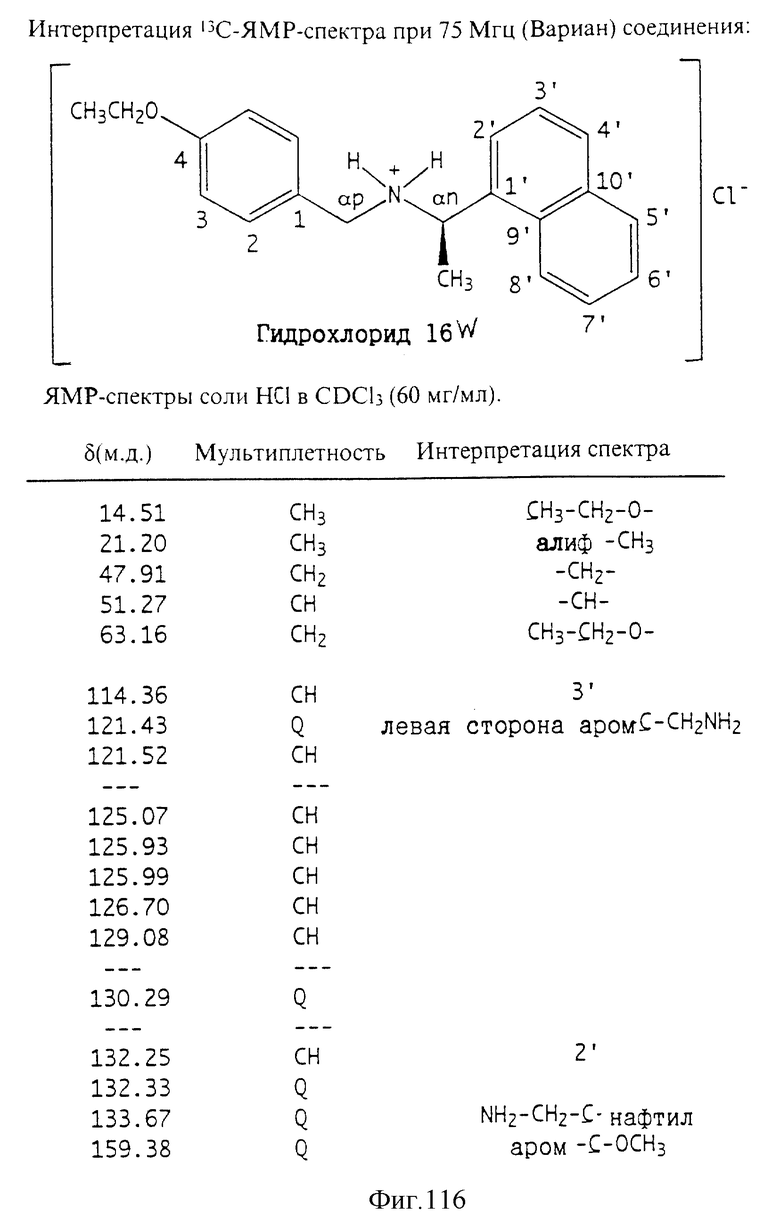
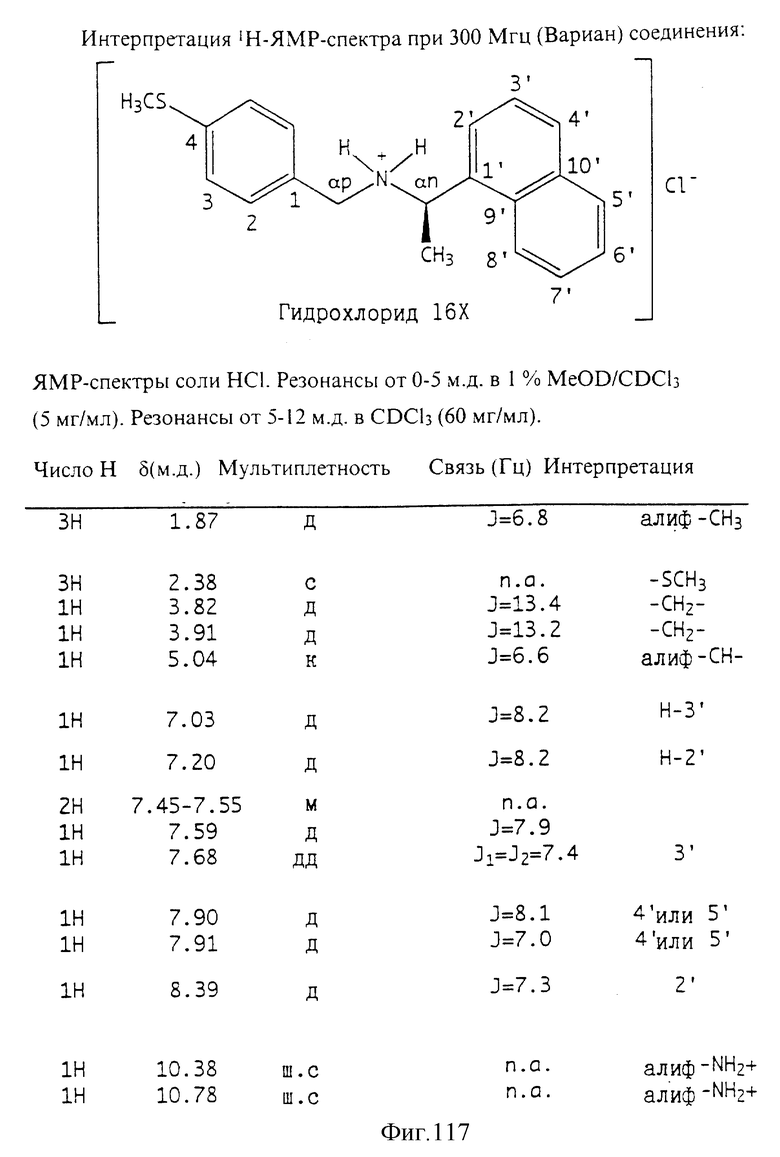
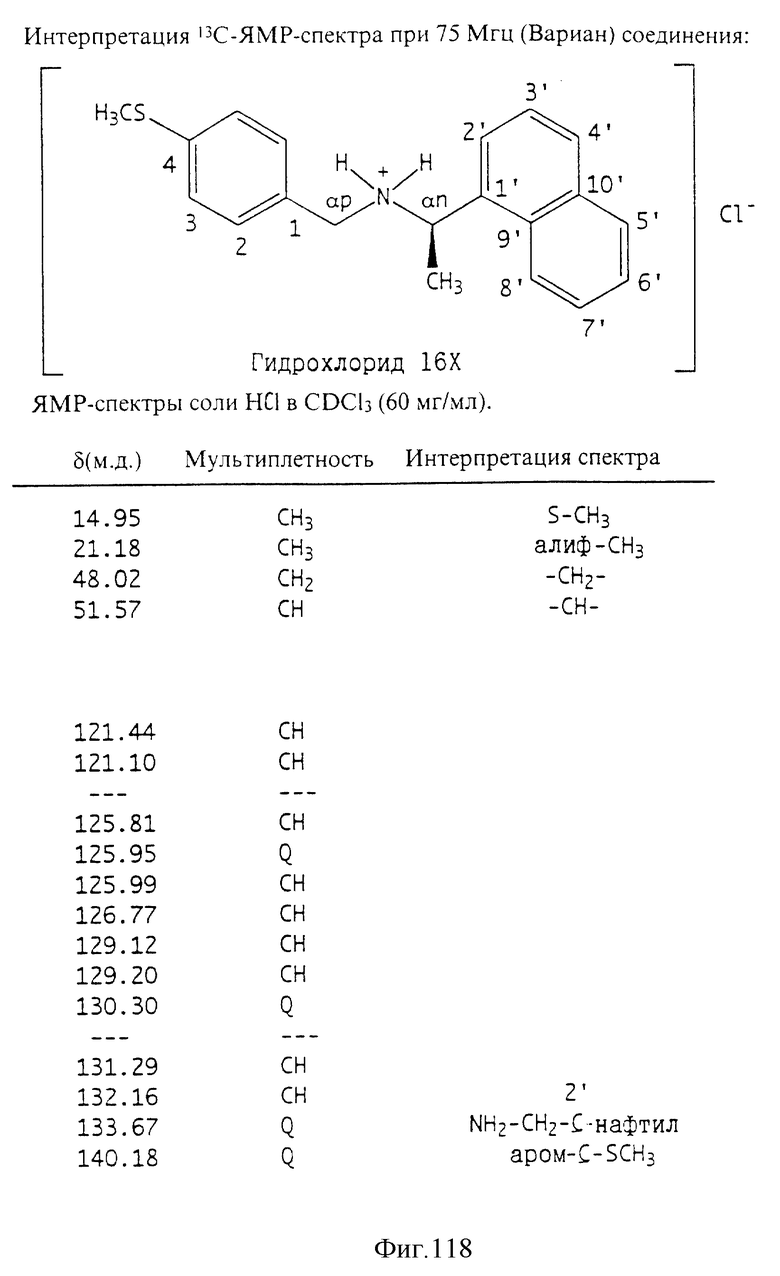
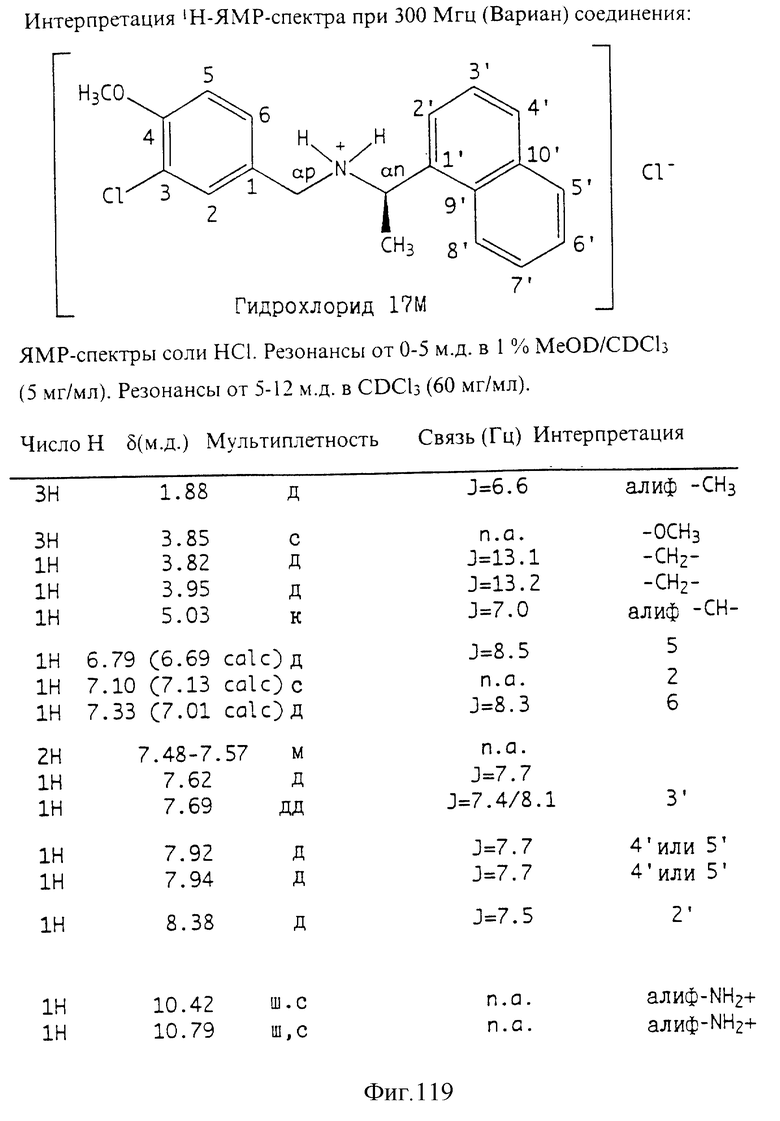
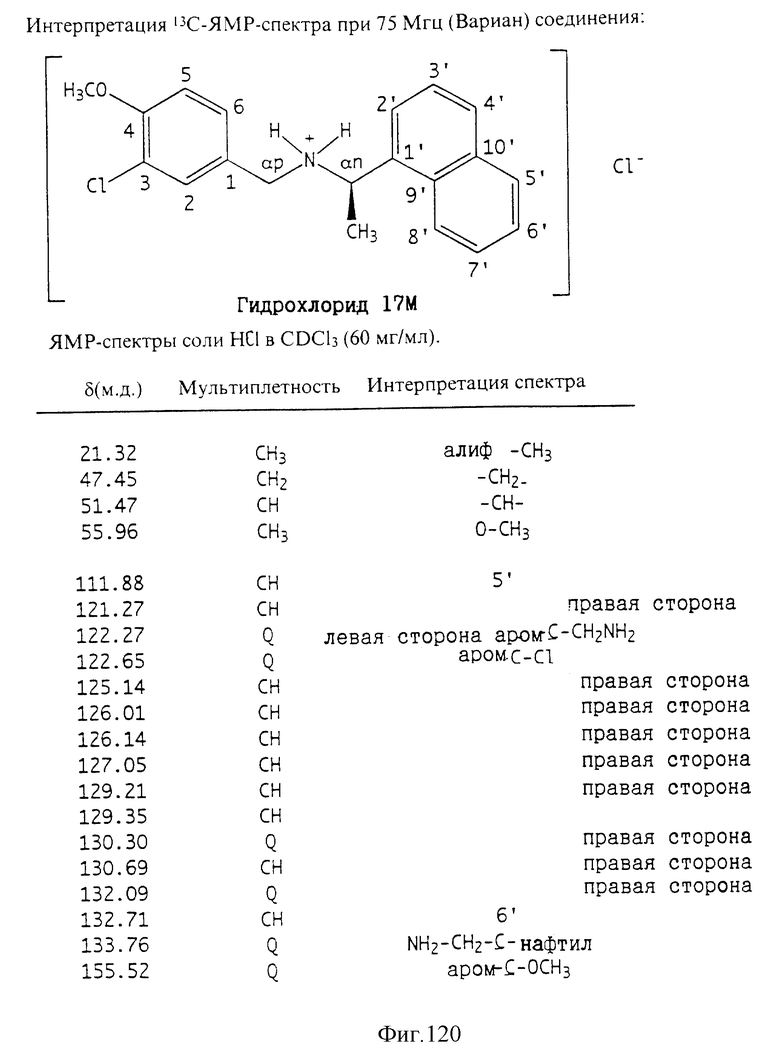
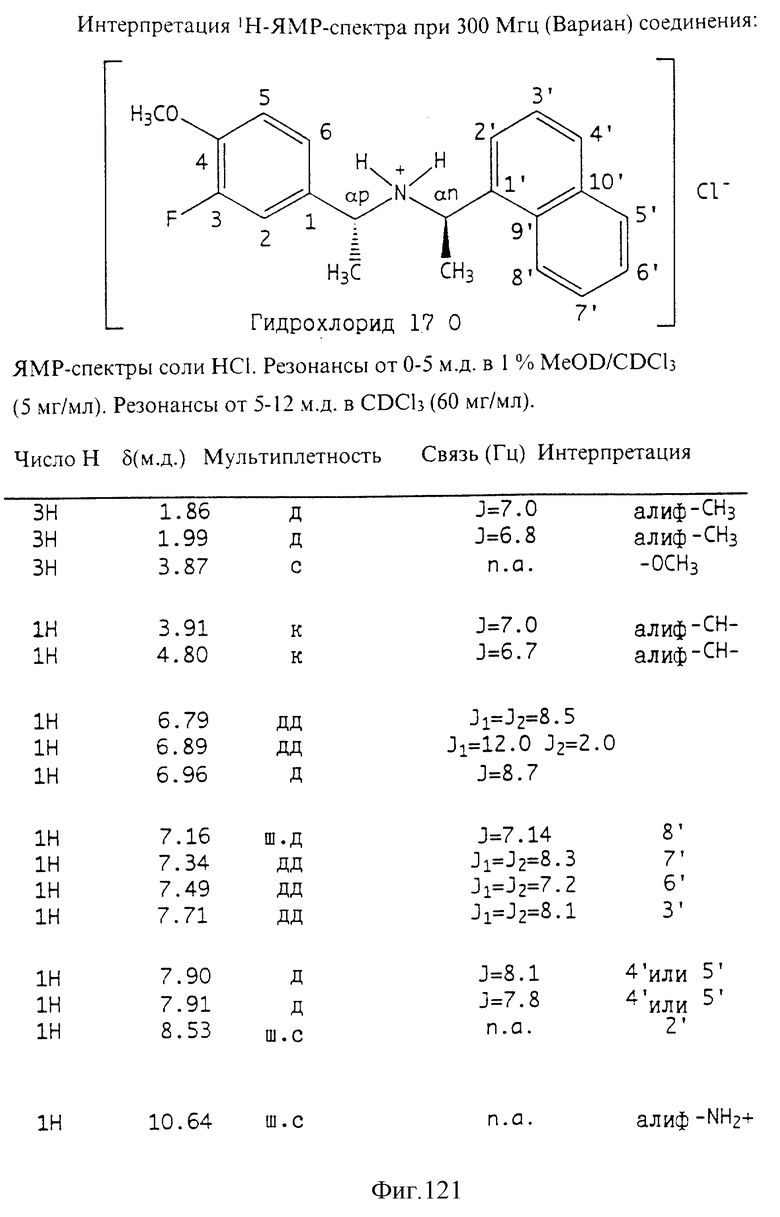
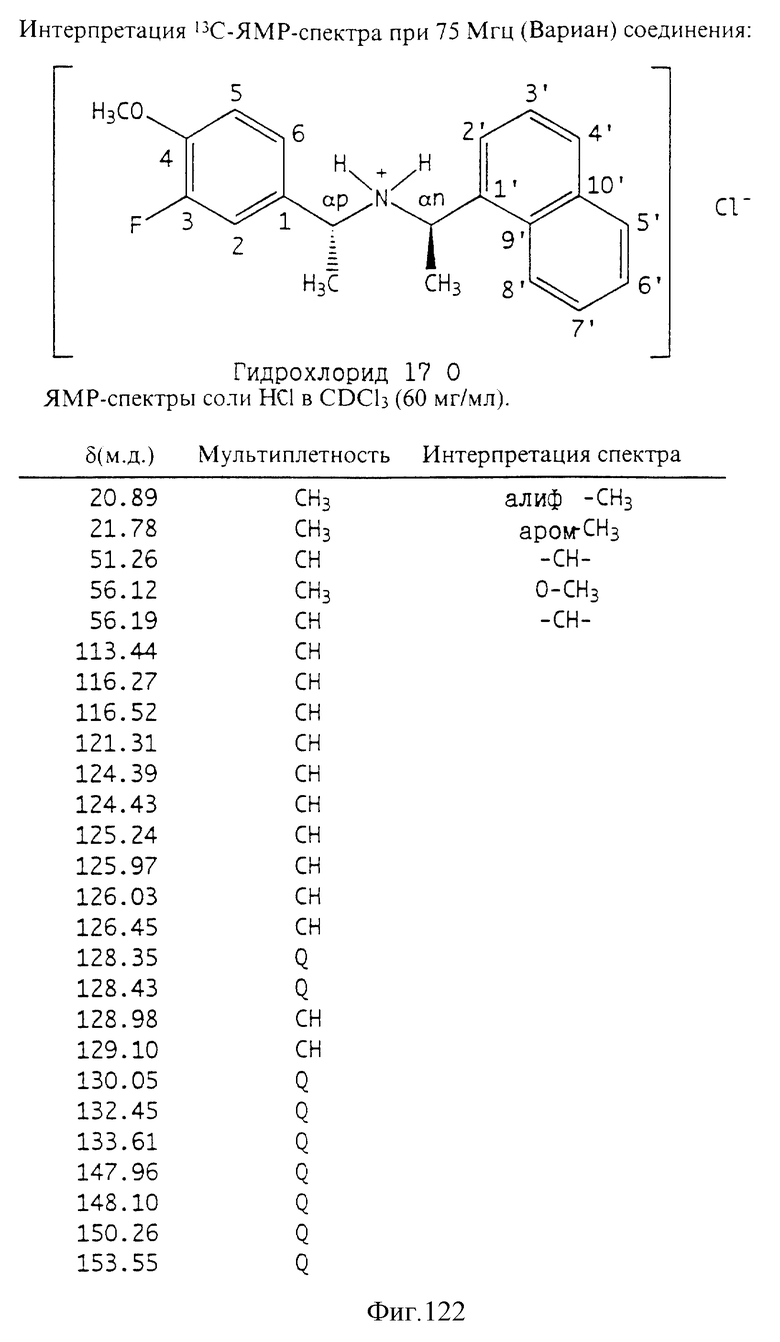
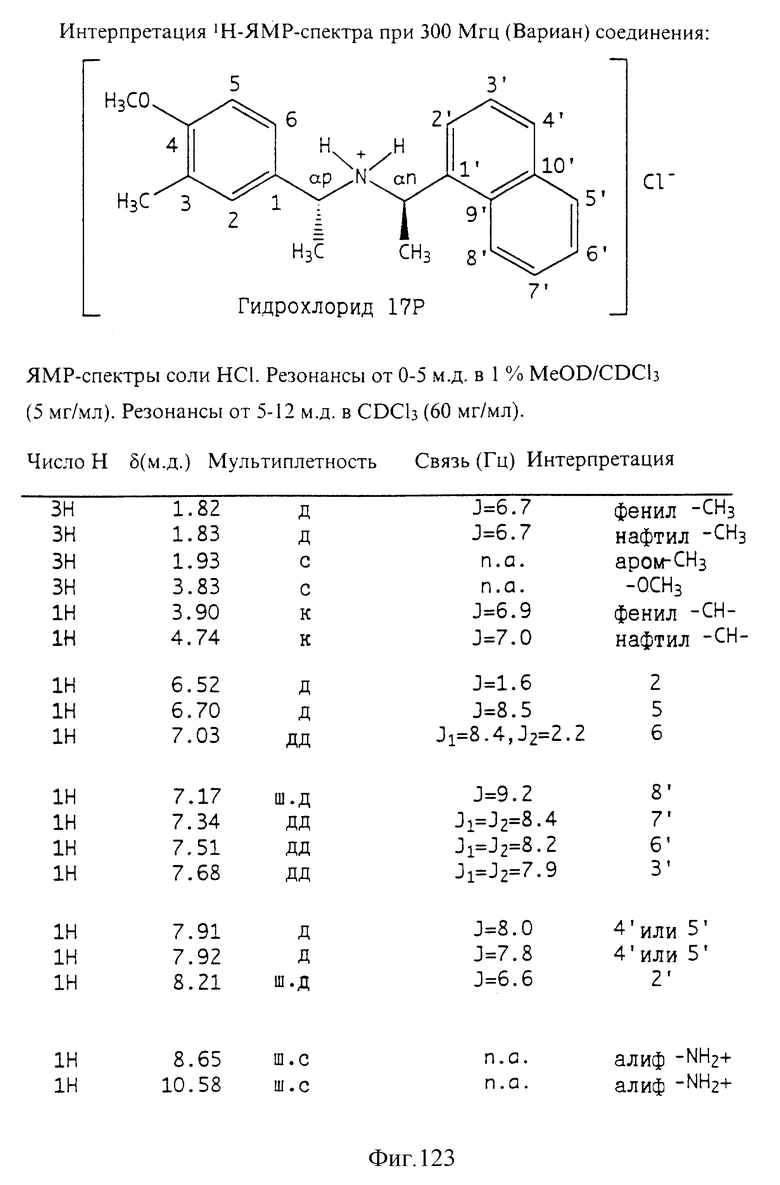
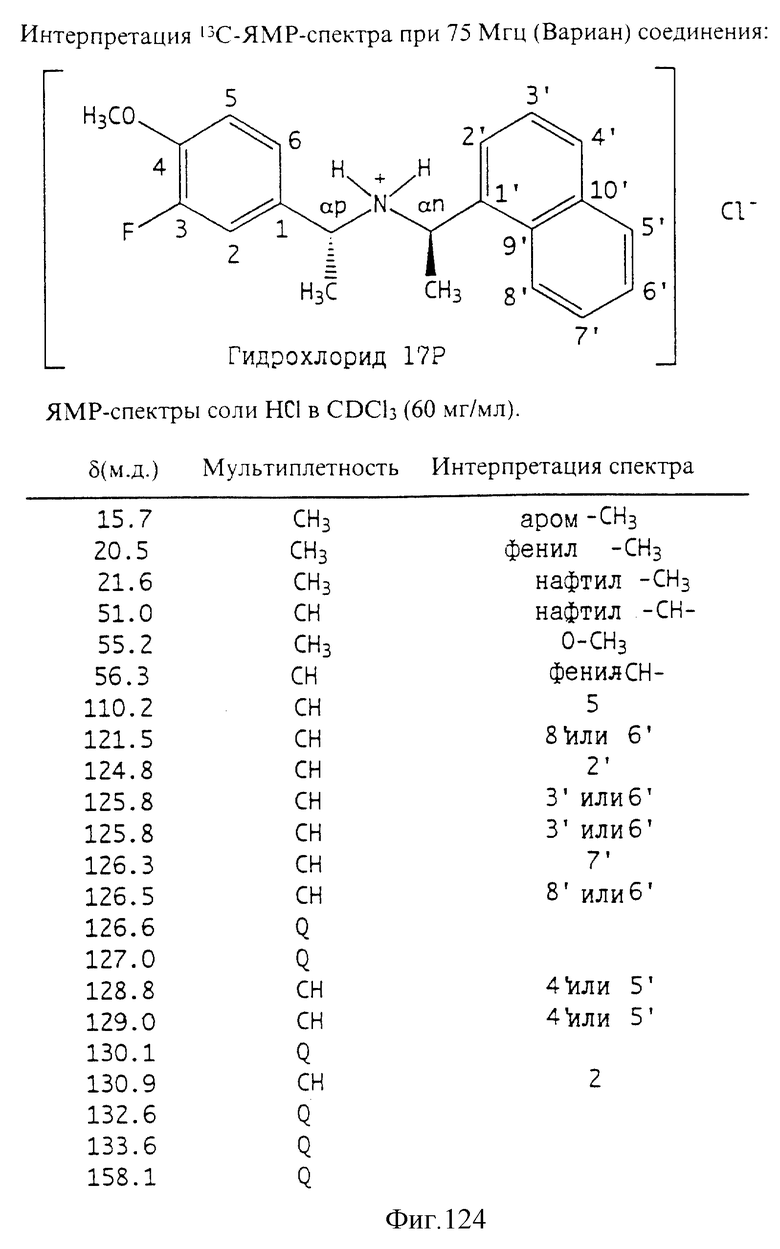
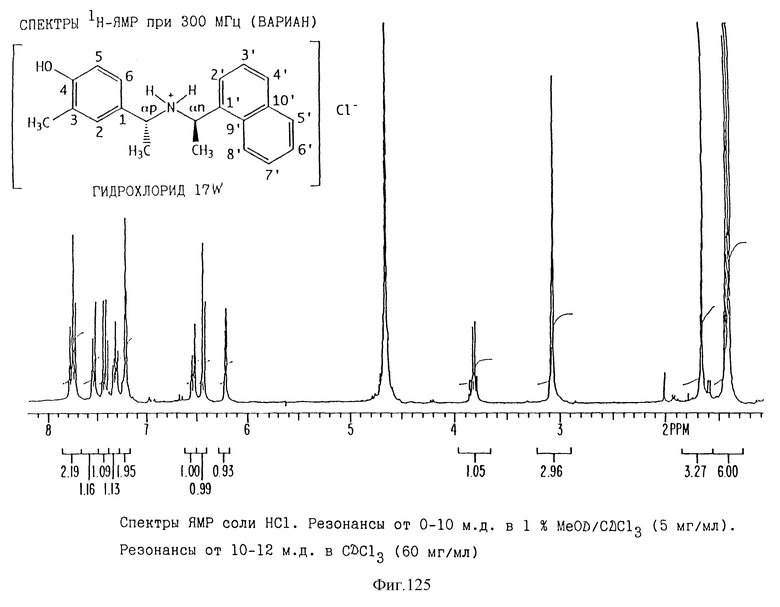
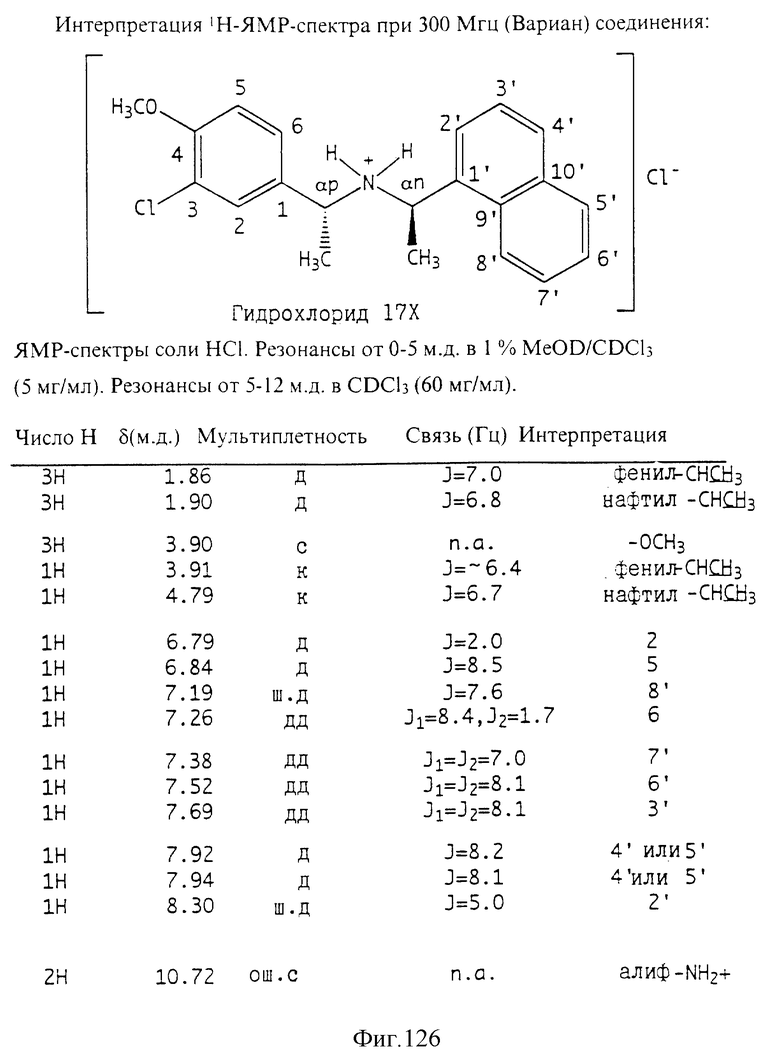
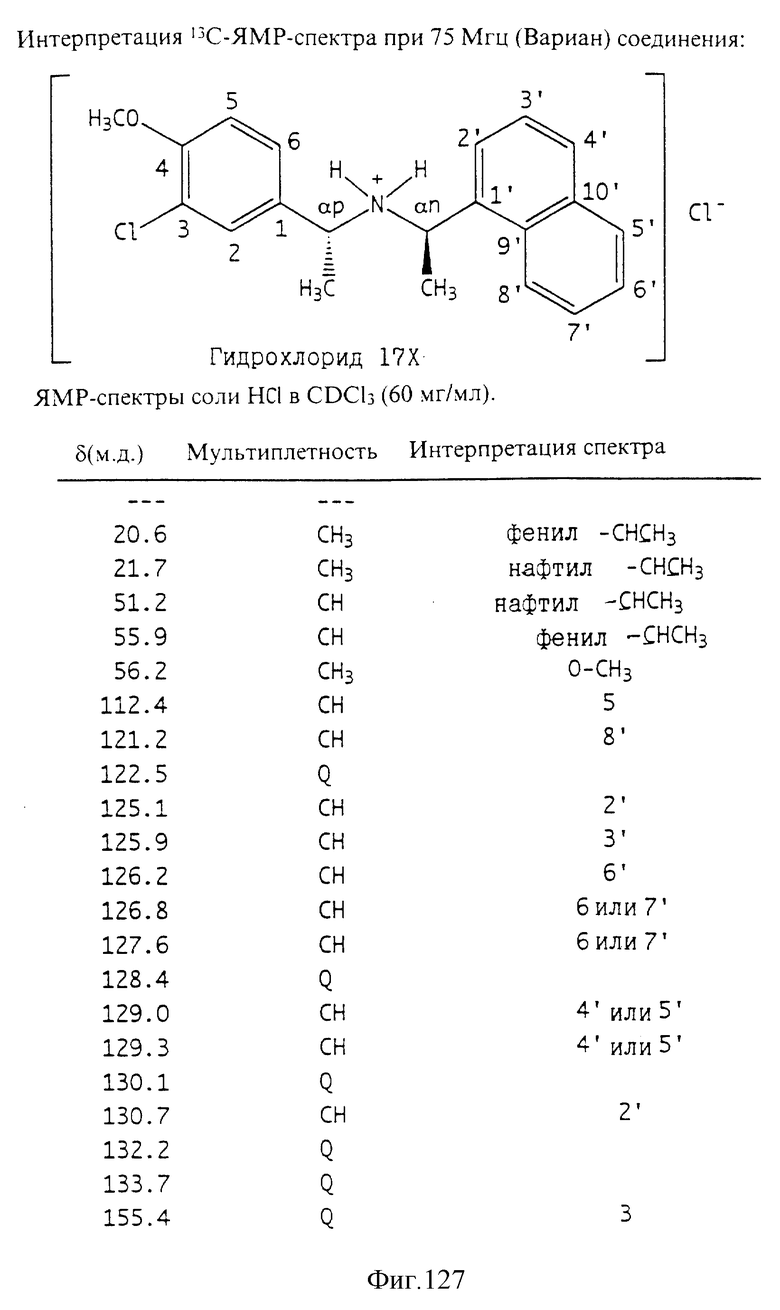
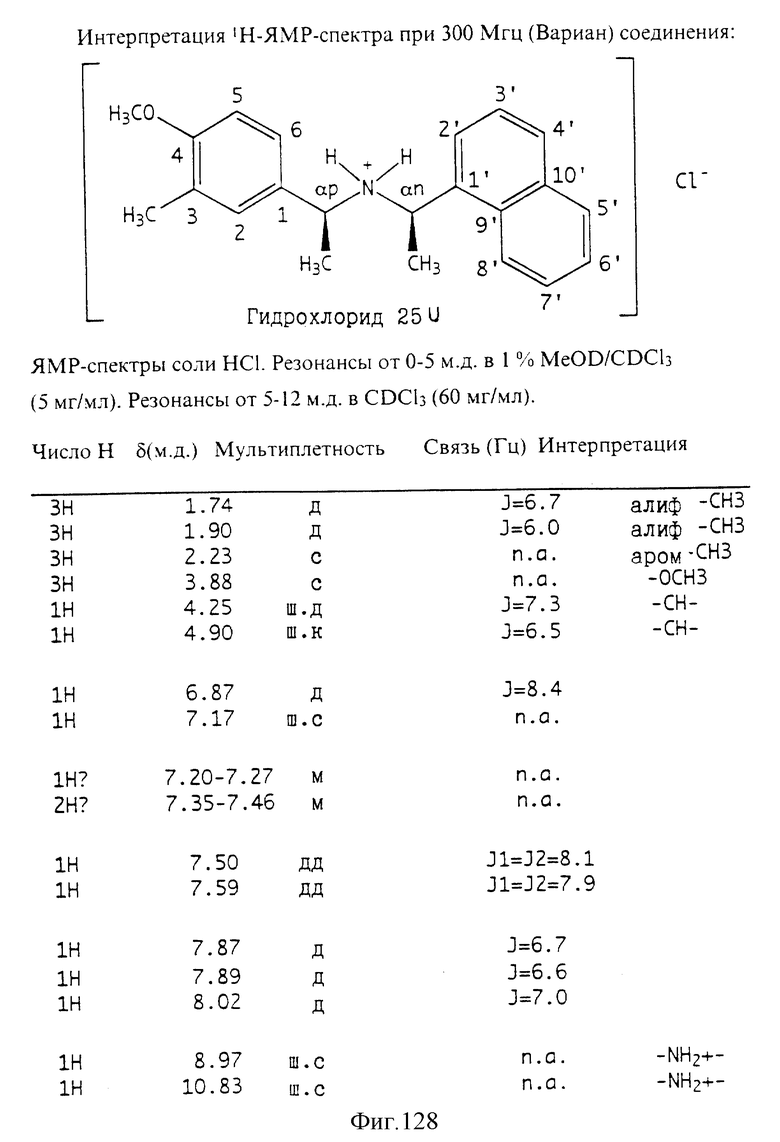
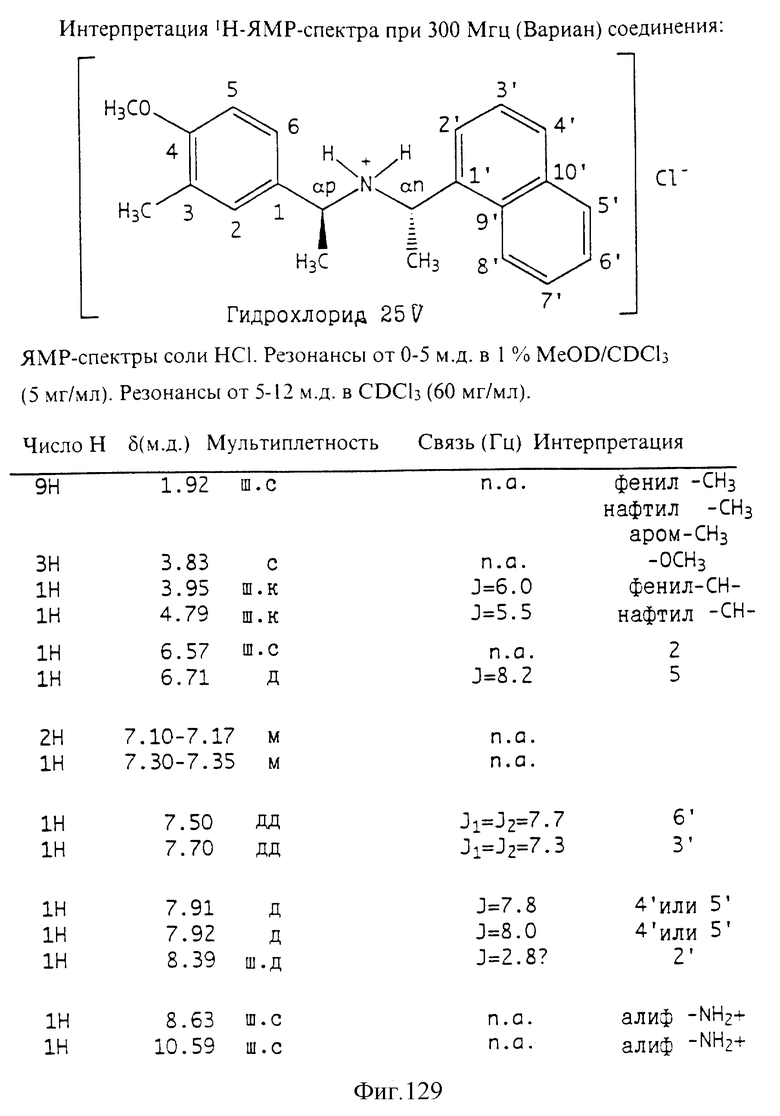
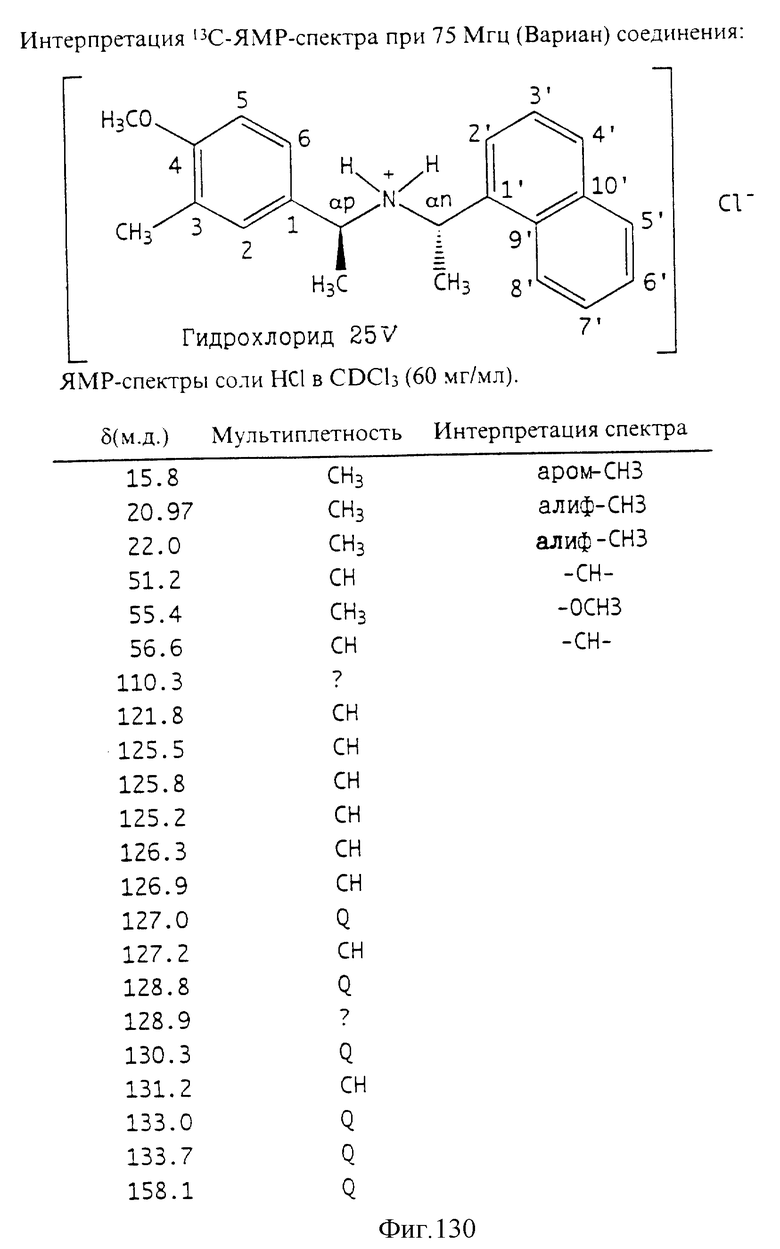
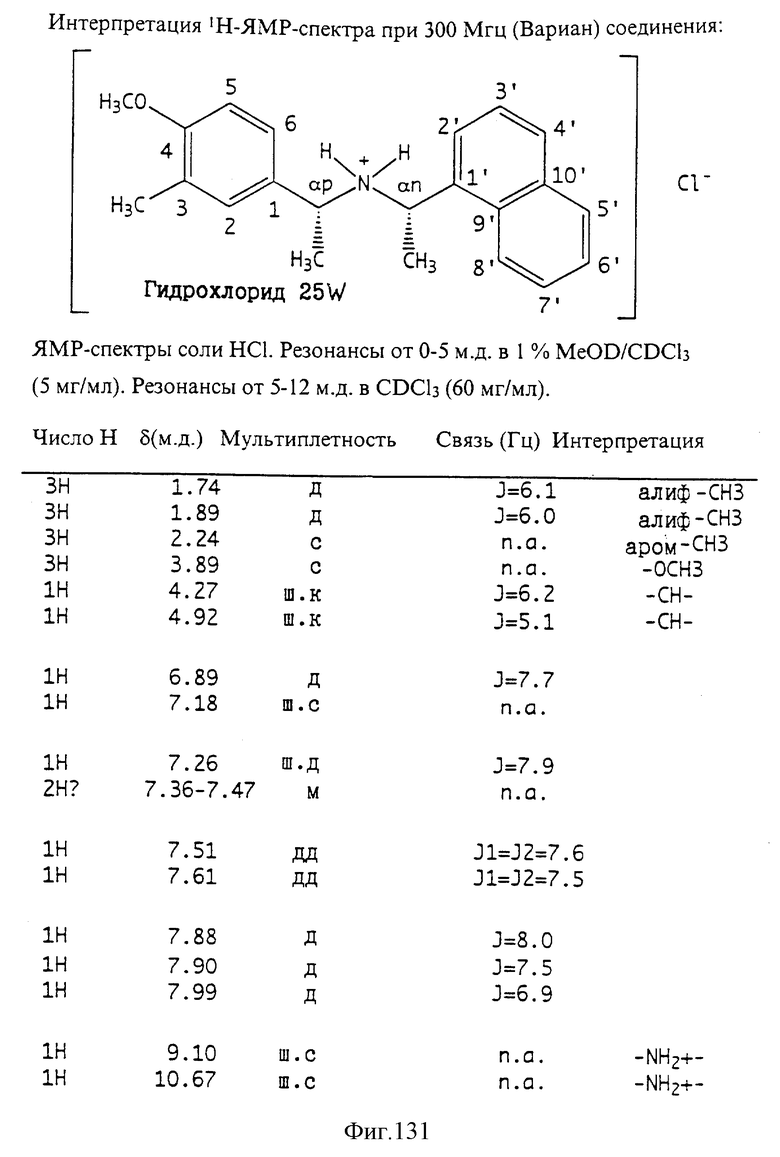
Изобретение относится к новым соединениям формулы I или II или соединениям, выбираемым из нижеуказанной группы, обладающим активностью в отношении рецептора кальция, фармацевтической композиции и способам лечения заболеваний, вызываемых аномальным и минеральным гомеостазом, гиперпаратироидизма, гиперкальцемии, злокачественной опухоли, остеопороза, гипертензии и остеодистрофии почки. В соединениях формулы I или II, Аr3, Аr4, Аr5 соответственно выбираются из возможно замещенного фенила или нафтила, Аr6 выбирается из фенила, замещенного различными заместителями, при условии, что хотя бы один заместитель является ОСН2С(O)ОС2Н5, значения других радикалов указаны в формуле изобретения. Кроме того, изобретение относится к группе соединений, выбираемых из
20Y(N-(2-хлорфенил)пропил)-1-(3-(2,2,2-трифторотокси)фенил)этиламин);
21М((R)-N-(3-(3-трифторметил)пропил)-1-(3-метоксифенил)этиламин);
21S((R)-N-(3-(2-хлорфенил)пропил)-1-(3-пропоксифенил)этиламин);
21Т-((R)-N-(3-(2-хлорфенил)пропил)-1-(3-изопропоксифенил)этиламин;
21U((R)-N-(3-(2-хлорфенил)пропил)-1-(изобутоксифенил)этиламин);
21Y((R,R)-N-(4-(3-трифторметил)фенил)-2-бутил)-1-(3-метоксифенил)этиламин):
22J((R)-N-(3-(3-трифторметил)фенил)пропил)-1-(1-нафтил)этиламин,
23А((R)-N-(4-(3-трифторметокси)фенил)-2-бутил)-1-(3-метоксифенил)этиламин);
23Е((R)-N-((3-(трифторметокси)фенил)метил)-1-(1-нафтил)этиламин;
23В(N-((3-метил-4-метоксифенил)метил)-1-(2-трифторметил) фенил)этиламин);
24J((R)-N-(3-(3-трифторметокси)фенил)пропил)-1-(1-нафтил)этиламин;
24М((R)-N-(3-(3,5-дифторфенил)пропил)-1-(3-метоксифенил)этиламин;
24V(N-((3-метил-4-метоксифенил)метил)-1-(3-(этилацетокси) фенил)этиламин);
24X((R)-N-((3-бром-4-метоксифенил)метил)-1-(1-нафтил)этиламин);
24Y((R)-N-((3-хлор-4-этоксифенил)метил)-1-(1-нафтил)этиламин;
25С((S,R)-N-(4-(3-трифторметил)фенил)-2-бутил)-1-(1-нафтил)этиламин);
25D((R,R)-N-(4-(3-трифторметил)фенил)-2-бутил)-1-(1-нафтил)этиламин; и
25Е((R)-N-(3-фенил-проп-2-ен-1-ил)-1-(3-метоксифенил)этиламин);
или их фармацевтически приемлемая соль или комплекс. 6 c. и 26 з.п. ф-лы, 6 табл., 131 ил.
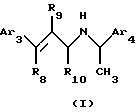
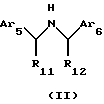
20Y (N-(2-хлорфенилпропил)-1-(3-(2,2,2-трифторэтокси)фенил)этиламин);
21М ((R)-N-(3-(3-трифторметокси)пропил)-1-(3-метоксифенил)этиламин);
21S ((R)-N-(3-(2-хлорфенил)пропил)-1-(3-пропоксифенил)этиламин);
21Т ((R)-N-(3-(2-хлорфенил)пропил)-1-(3-изопропокси-фенил)этиламин;
21U ((R)-N-(3-(2-хлорфенил)пропил)-1-(3-изобутокси-фенил)этиламин);
21Y ((R, R)-N-(4-(3-(трифторметил)фенил)-2-бутил)-1-(3-метоксифенил)этиламин);
22J ((R)-N-(3-(3-трифторметил)фенил)пропил)-1-(1-нафтил)этиламин;
23А ((R)-N-(4-(3-(трифторметокси)фенил)-2-бутил)-1-(3-метоксифенил)этиламин);
23Е ((R)-N-((3-(трифторметокси)фенил)метил)-1-(1-нафтил)этиламин);
24В (N-((3-метил-4-метоксифенил)метил)-1-(2-трифторметил)фенил)этиламин;
24J ((R)-N-(3-(3-трифторметокси)фенил)пропил)-1-(1-нафтил)этиламин);
24М ((R)-N-(3(3,5-дифторфенил)пропил)-1-(3-метоксифенил)этиламин);
24V (N-((3-метил-4-метоксифенил)метил)-1-(3-(этилацетокси)фенил)этиламин);
24Х ((R)-N-((3-бром-4-метоксифенил)метил)-1-(1-нафтил)этиламин);
24Y ((R)-N-((3-хлор-4-этоксифенил)метил)-1-(1-нафтил)этиламин);
25С ((S, R)-N-(4-(3-трифторметил)фенил)-2-бутил)-1-(1-нафтил)этиламин);
25D ((R, R)-N-(4-((3-трифторметил)фенил)-2-бутил)-1-(1-нафтил)этиламин и
25Е ((R)-N-(3-фенилпроп-2-ен-1-ил)-1-(3-метоксифенил)этиламин),
или их фармацевтически приемлемая соль.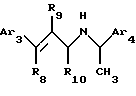
где Аr3 обозначает нафтил или фенил, необязательно замещенные 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2-ОН, -CONH2, CN, ацетокси, бензила, бензилокси, диметилбензила, NO2, СНО, СН3СН(ОН), N(СН3)2, ацетила, этилендиокси;
Аr4 обозначает нафтил или фенил, необязательно замещенные 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, СН2ОН, CONH2, CN и ацетокси, при условии, что когда Аr3, и Аr4 оба необязательно замещены фенилом, то Аr3 имеет, по крайней мере, один заместитель и Аr4 имеет, по крайней мере, один заместитель;
R8 обозначает водород или фенил;
R9 обозначает водород или метил;
R10 обозначает водород, метил или фенил,
или его фармацевтически приемлемые соли.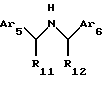
где Аr5 обозначает нафтил или фенил, необязательно замещенные 0-5 заместителями, каждый из которых независимо выбран из группы, состоящей из низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, CH2OH, CONH2, CN, ацетокси, бензила, бензилокси, α, α-диметилбензила, NO2, СНО, СН3СН(ОН), ацетила, этилендиокси, -СН= СН-фенила;
Аr6 обозначает фенил, замещенный 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из ацетила, низшего алкила, галогена, низшего алкокси, низшего тиоалкила, метилендиокси, низшего галогеналкила, низшего галогеналкокси, ОН, CH2OH, CONH2, CN, карбометокси, ОСН2С(О)C2H5, OCH2C(О)OC2H5 и ацетокси, при условии, что, по крайней мере один заместитель является OCH2C(O)ОС2Н5;
R11 обозначает водород или метил;
R12 обозначает водород или метил, при условии, что, по меньшей мере, один из R11 и R12 является метилом,
или его фармацевтически приемлемая соль.
Приоритет по пунктам:
08.12.1994 - по пп. 2 и 3;
23.10.1995 - по пп. 1 и 4-32.
| АРАЛКИЛАМИНОВЫЕ ПРОИЗВОДНЫЕ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2021256C1 |
| ГАЗОТУРБИННАЯ СИСТЕМА С ДИФФУЗИОННО-ПЛАМЕННЫМ СГОРАНИЕМ И СМЕШЕНИЕМ ТОПЛИВА ДЛЯ СНИЖЕНИЯ НЕЖЕЛАТЕЛЬНЫХ ВЫБРОСОВ | 2023 |
|
RU2841184C2 |
| DE 3405333 A, 22.08.1985 | |||
| Валковое устройство для штамповкилистового материала | 1974 |
|
SU508307A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| US 4000197 A, 28.12.1976 | |||
| УСТРОЙСТВО ДЛЯ ПРЕЦИЗИОННОЙ СОРТИРОВКИ СФЕР ПО РАЗМЕРАМ | 1984 |
|
SU1231690A1 |
| US 4129598 A, 12.12.1979 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| MAJEWSKI, MAREK ET AL | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| J | |||
| CHEM | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Курительная трубка | 1923 |
|
SU1699A1 |
| J | |||
| С | |||
| G | |||
| VAN NIEL ET AL | |||
| 'NADH models | |||
| XXI | |||
| Stereoselective reduction of chireal | |||
| imines with hantzsch ester' | |||
| TETRAHEDRON, OXFORD GB,1985, v | |||
| Механический грохот | 1922 |
|
SU41A1 |
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| Рамка для ульев | 1927 |
|
SU6005A1 |
| anines and their manufacture, intermediates, and uses 'CHEMICAL ABSTRACTS, Columbus" Ohio, US; | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Ребристый каток | 1922 |
|
SU121A1 |
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| 230462 | |||
| O | |||
| E | |||
| CLIFTON ET AL | |||
| 'Arylethanolamines | |||
| derived from Salicylamide with alpha, and | |||
| beta.-adrenoceptor blocking activity | |||
| JOURNAL OF MEDICINAL | |||
| CHEMISTRY, WASHINGTON US, 1982 | |||
| v | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Пневматический прибор для заправки нити в челнок | 1924 |
|
SU670A1 |
| WANG ET AL | |||
| 'Ruthenium-catalysed transfer hydrogenation | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| G | |||
| DAVIES ET AL | |||
| 'Asymmetric synthesis | |||
| of R-.beta.-ami no butanoic acid and | |||
| S-.beta.tyrosine' | |||
| TETRAHEDRON: ASYMMETRY, OXFORD GB, 1991 | |||
| v | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1986, т.2, с.117-120. | |||
Авторы
Даты
2002-12-27—Публикация
1995-10-23—Подача