Изобретение относится к биотехнологии, в частности к получению аналогов рекомбинантных интерферонов, обладающих антивирусной активностью и более устойчивых к трипсину и трипсиноподобным протеазам крови.
Гамма-интерферон человека ( γ -IFN) представляет собой гликопротеин с молекулярным весом около 17 000 da. В человеческом организме он продуцируется активированными T-лимфоцитами. Рекомбинантный g -интерферон, также как и его природный аналог, обладает значительным противоопухолевым, иммуномодулирующим и противовирусным действием и является весьма перспективным средством борьбы с вирусными и онкологическими заболеваниями.
Однако g -IFN весьма чувствителен к действию трипсиноподобных протеаз как in vitro, так и in vivo. Так, например, природный g -IFN человека и его рекомбинантный аналог необычно быстро деградируют в крови пациентов, причем скорость инактивации иммунного интерферона резко замедляется, если в образцы крови добавить ингибиторы трипсина [1-3] Полагают, что если повысить устойчивость иммунного интерферона человека или его аналогов к действию трипсина и трипсиноподобных протеаз, то можно уменьшить терапевтические дозы, соответственно снизить негативные побочные эффекты и пролонгировать действие соответствующих препаратов.
C-концевая область молекулы g -интерферона человека чрезвычайно насыщена сайтами для различных протеаз, в том числе для трипсиноподобных.
Известно, что иммунный интерферон человека гидролизуется трипсиноподобными протезами прежде всего по положительно заряженным кластерам аминокислотных остатков KRKR в положении 128-131 и RR, что приводит к возникновению фрагментов в 15 кД со значительно сниженной антивирусной активностью [4,5]
Известно, что при связывании g -IFN с гепарином, которое, как показано Лортат Жакоб и Гримауд, происходит по кластерам KRKR и RR, белок становится устойчивым к действию трипсина и трипсиноподобных протеаз при полном сохранении активности [6,7]
Очевидно, устранение данных сайтов протеолиза также могло бы привести к устойчивости к трипсину и трипсиноподобным протеазам. Однако попытка заменить с помощью мутагенеза кластер KRKR на SSSS оказалась неудачной, поскольку полученный мутантный белок не обладает биологической активностью [8]
Можно было предположить, что замена кластера KRKR на KGSR и удаление RR позволит снизить скорость гидролиза трипсином за счет удаления дублетов положительно заряженных аминокислотных остатков, а также убрать сайты гидролиза для клострипаина (Arg129-Lys130) и, вероятно, других трипсиноподобных протеаз.
Известен способ получения иммунного интерферона [9] в котором описаны фрагменты иммунного интерферона человека общей формулы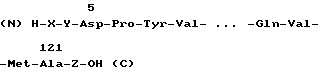
где X Met или химическая связь, Y Gln или химическая связь, Z какая либо аминокислота или цепочка из 1-4 аминокислотных остатков, начинающихся с N-конца пептида Glu-Leu-Ser-Pro (C).
Приводятся данные, демонстрирующие антивирусную активность данных фрагментов и их меньшую, чем у нативного, склонность к образованию димеров и полимеров, что авторы связывают с отсутствием Cys в молекуле фрагмента иммунного интерферона человека. Недостаток данного подхода состоит в том, что среди заявляемых аналогов иммунного интерферона человека нет устойчивых к действию трипсина и трипсиноподобных протеаз.
Известен способ [10] по которому также получают фрагменты иммунного интерферона человека в результате ограниченного протеолиза молекулы трипсином, общей формулы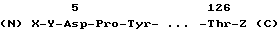
где X Met или H, а Y Gln или, если X H, то Y Gln или пироглютамат, Z фрагмент нативного иммунного интерферона человека, оканчивающийся соответственно аминокислотным остатком в 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142 и 143 положениях, а начинающийся с Thr в 126 положении.
Приводятся данные, демонстрирующие большую, чем у нативного γ -интерферона, стабильность в различных средах, что авторы также объясняют отсутствием в молекулах фрагментов Cys. Однако в таких средах, как сыворотка человека, кролика (т. е. содержащих протеазы) и питательные среды для культур клеток, заявляемые аналоги иммунного интерферона так же, как и нативный интерферон, постепенно теряют свою антивирусную активность, причем скорость инактивации значительно выше при 37oC, чем при 4oC, что очевидно связано с отсутствием у аналогов устойчивости к действию протеаза.
Недостатком данного способа также является отсутствие среди получаемых фрагментов иммунного интерферона человека, а также их аналогов, полученных заменой, делецией или вставкой одной или нескольких аминокислотных остатков, таких, которые были бы устойчивы к действию трипсина и трипсиноподобных протеаз. Более того, как только у аналогов оказывается модифицированным кластер KRKR, например у аналога 129, C-конец которогоAAKTGKA, так их антивирусная активность сразу же падает до 6-9% от активности полноразмерного g -интерферона человека.
Известны также и другие аналоги иммунного интерферона человека, отличающиеся от него делецией 7-10 [11] 6-11 [12] 9 [13-14] аминокислотных остатка на C-конце, но также не обладающие устойчивостью к действию трипсина и трипсиноподобных протеаз.
Известна рекомбинантная плазмидная ДНК pIFN g -trp2 [15, 16] кодирующая полипетид, обладающий антивирусной активностью до 20 млн. МЕ/мг, аминокислотная последовательность которого совпадает с последовательностью рекомбинантного зрелого интерферона (т.е. без Cys-TyrCys на N-конце). Высокий уровень синтеза данного полипептида в E. coli достигается за счет использования синтетического участка связывания рибосом и нуклеотидной последовательности 5= CCТCТAG между данным участком и иницирующим кодоном ATG гена-аналога гамма-интерферона.
По способу конструирования плазмида pIFN- g -trp2 является наиболее близким техническим решением к заявляемому.
Однако существенным недостатком плазмиды pIFN- g -trp2 является то, что она кодирует известный полипептид, неустойчивый к действию трипсина и трипсиноподобных протеаз.
Задачей настоящего изобретения является получение мутантного g -интерферона человека, обладающего антивирусной активностью и устойчивость к действию трипсина.
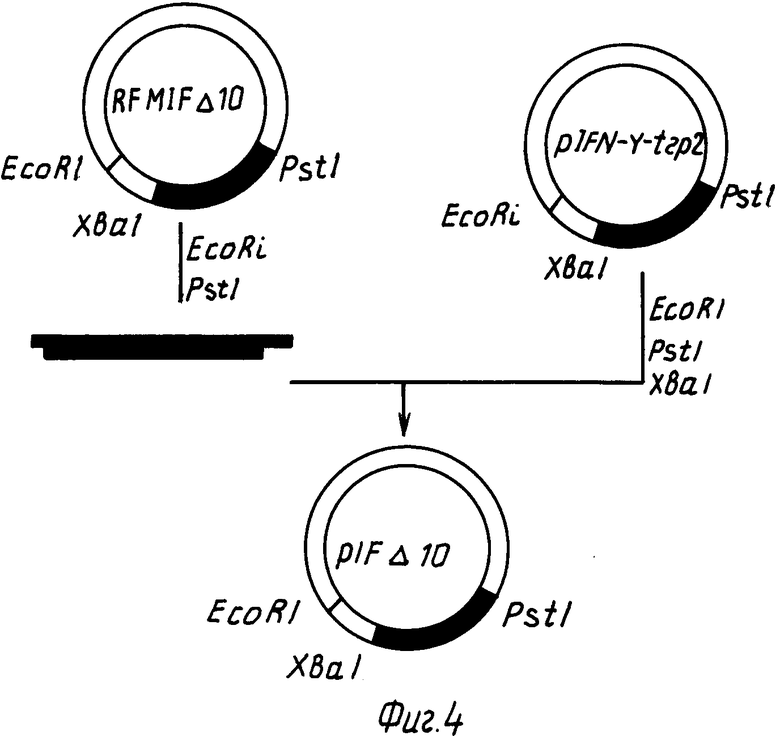
Поставленная задача решается путем конструирования мутантного гена IFN D 10, рекомбинантной плазмиды pIF D 10 и штамма-продуцента E.coli, обеспечивающего биосинтез мутантного g -интерферона человека в клетках штамма-продуцента в растворимом состоянии.
Сущность изобретения состоит в том, что олигонуклеотиднаправленным мутагенезом получают ген IFN D 10 и рекомбинацией замещают им ген природного гамма-интерферона в плазмиде pIFN g -trp2.
Мутантный ген IFN D 10 отличается от гена-прототипа тем, что он кодирует полипептид длиною всего в 131 аминокислотный остаток, из которых первые 126 остатков идентичны последовательности прототипа, а 5 последних совершенно отличны.
Плазмида pIF D 10, содержащая мутантный ген IFN D 10, состоит из следующих элементов:
большого фрагмента EcoRI-PstI плазмиды pIFN g -trp2, размером 3940 п.н.
фрагмента EcoRI-PstI, содержащего мутантный ген IFN D 10 (481 п.н.).
Плазмида pIF D 10 содержит также ген устойчивости к тетрациклину в качестве генетического маркера, имеет молекулярную массу 1,46 Mda (4421 п.н.) и обеспечивает в клетках E.coli синтез мутантного полипептида, обладающего активностью гамма-интерферона.
Синтезированный мутантный белок находится в клетке в форме растворимого белка на 90-95% и обладает антивирусной активностью (1,5-2,0)•107 МЕ/мг, что соответствует стандарту активности гамма-интерферона.
Способ конструирования мутантного гена IFN D 10 включает в себя:
выделение из плазмиды pIFN- g -trp2 фрагмента EcoRI PstI (481 п.н.) и клонирование его в ДНК фага M13mp8;
введение двух BamHI сайтов в ген гамма-интерферона с помощью олигонуклеотидов по методу Золлера Смита; наличие мутаций в гене было доказано секвенированием ДНК по методу Сэнгера, введение двух сайтов узнавания BamHI было также подтверждено рестрикционным анализом гена мутантного интерферона;
удаление С-концевого фрагмента гена интерферона гидролизом его BamHI рестриктазой с последующим лигированием гидролизованной ДНК и получением мутантного гена IFN D 10.
Мутантный ген IFN D 10 был переклонирован обратно к плазмиду pIFN- g -trp2, для чего ее фрагмент EcoRI PstI (481 п.н.) был замещен на фрагмент EcoRI-PstI, содержащий мутантный ген IFN D 10 и выделенный из репликативной формы ДНК М13IFN. Строение полученной плазмиды pIF D 10 было подтверждено анализом рестрикционными эндонуклеазами EcoRI, PstI, BamHI и определением нуклеотидной последовательности гена IFN D 10. Сайт BamHI появляется в гене IFN D 10 в результате мутагенеза.
Для получения штамма-продуцента полипептида с активностью гамма-интерферона плазмидой pIF D 10 трансформируют компетентные клетки E.coli MH-1. Полученный таким образом штамм E.coli MH-1/pIF D 10 характеризуется следующими признаками:
1. Морфологические признаки. Грамотрицательные, палочковидные клетки, неспороносные.
2. Культуральные признаки. Клетки хорошо растут на простых питательных средах. На плотной среде образуют круглые, прозрачные, блестящие колонии с ровным краем без пигмента. При росте в жидких средах (на минимальной среде с глюкозой или LB бульоне) образуют интенсивную ровную муть.
3. Физико-биохимические признаки. Клетки растут при температуре от 4oC до 40oC при оптимуме pH от 6,8 до 7,0. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. Не утилизируют многие углеводы, отрицательны по сероводороду, ацетоину, образуют индол.
4. Устойчивость к антибиотикам. Клетки проявляют устойчивость к тетрациклину (до 10 мкг/мл), обусловленную наличием плазмиды.
Штамм E.coli MH-1/pIF D 10 обеспечивает индуцибельный синтез полипептида с антивирусной активностью и уровнем экспрессии до 40% от суммарного клеточного белка бактерии.
Штамм E.coli MH-1/pIF D 10 депонирован в коллекции ВНИИГенетики под номером ВКПМ B-6663.
На фиг. 1 представлена схема получения ДНК фага M13 IFN; на фиг. 2 - схема введения мутации в ген гамма-интерферона: IFN- g мутируемый участок гена гамма-интерферона; сверху показана аминокислотная последовательность кодируемого белка, цифрами отмечена нумерация аминокислотных остатков и оснований в белке и гене соответственно; B24, B38 олигонуклеотиды-мутагены; на фиг. 3 нуклеотидная последовательность гена IFN D 10 и кодируемого им белка; подчеркнуты нуклеотиды замены в гене IFN D 10, отличающие его от прототипа [15] на фиг. 4 схема получения плазмиды pIF D 10.
Изобретение иллюстрируется следующими примерами.
Пример 1. Способ получения мутантного гена IFN D 10.
Для проведения олигонуклеотиднаправленного мутагенеза необходимо переклонировать ген IFN- g из плазмиды pIFN g -trp2 в ДНК фага M13mp8. Схема клонирования представлена на фиг. 1.
5 мкг ДНК плазмиды pIFN- g -trp2 расщепляют одновременно двумя эндонуклеазами рестрикции EcoRI и PstI (по десять единиц активности каждого фермента) в буфере, содержащем 50 mM NaCl, 10 mM MgCl2, 10 mM трис-HCl pH 8,0, 1 mM меркаптоэтанола. Гидролиз проводят при 37oC 3 ч. Полноту гидролиза анализируют с помощью электрофореза.
Реакцию останавливают добавлением 0,5 М ЭДТА pH 7,5 до конечной концентрации 10 mM. ДНК осаждают добавлением 1/10 объема ацетата натрия pH 7,0 и 2 объемов спирта. После высушивания осадок растворяют в необходимом объеме TE-буфера, содержащем 10 mM трис-HCl, pH 8,0 и 1 mM ЭДТА.
Фрагмент ДНК с геном IFN (481 п.н.) выделяют путем электрофоретического разделения реакционной смеси в 6% полиакриламидном геле с последующей электроэлюцией.
Лигирование смеси гидролизованной по EcoRI и PstI сайтам репликативной формы ДНК фага M13mp8 (80 нг) и фрагмента проводят с помощью ДНК-лигазы фага T4 (4 ед. акт.) в объеме 30 мкл буферного раствора состава: 70 mM трис-HCl pH 7,6, 5 mM MgCl2, 1 mM дитиотрейтола (ДТТ), 2 mM АТФ при 4-10oC в течение 12 ч. Реакцию останавливают добавлением раствора ЭДТА до концентрации 20 mM, ДНК осаждают этанолом из раствора 0,3 M ацетата натрия pH 7,0. Осадок растворяют после высушивания в 20 мкл стерильной воды. Контроль сшивки проводят электрофорезом в 1% агарозном геле. Полученной ДНК трансформируют компетентные клетки E.coli JM103, отбирают клоны с белой окраской на индикаторной агаризованной среде с IPTG и Ygal, выделяют из них одноцепочечную ДНК и определяют нуклеотидную последовательность клонированного фрагмента по методу Сэнгера. Полученную одноцепочечную ДНК M13 IFN используют для мутагенеза.
Для введения нуклеотидных замен в ген гамма-интерферона (фиг. 2) синтезированы олигонуклеотиды 5'-ctgactcctggatcccttccc (мутация B38) и 5'-ctgggatgcggatccacctcg (мутация B24).
Мутагенез проводят следующим способом.
После отжига с матричной ДНК M13mp8 IFN мутантного олигонуклеотида, фосфорилированного по 5'-концу, синтезируют с помощью фрагмента Кленова ДНК-полимеразы I и лигазы фага T4 гетеродуплексную двухцепочечную ДНК. После трансформации такой ДНК компетентных клеток JM103 клоны, несущие мутантный ген IFN- g выявляют методом гибридизации с радиоактивно меченным олигонуклеотидом. Мутантный олигонуклеотид, меченный [ g 32P]ATP по 5'-концу, гибридизуют с репликами примерно ста клонов на нитроцеллюлозном (НЦ) фильтре при комнатной температуре. Далее НЦ фильтр отмывают в 6•SSC (0,9 M NaCl, 0,09 M цитрата натрия) при различных температурах, получая после каждой отмывки его радиоавтограф. Поскольку олигонуклеотид-зонд полностью комплементарен лишь мутантной ДНК, то температура плавления дуплекса мутантной одноцепочечной ДНК с зондом выше, чем у немутантной ДНК с олигонуклеотидом-мутагеном. ДНК клонов, которые имели более сильный гибридизационный сигнал на радиографической пленке после отмывки фильтра при различных температурах, подвергают рестрикционному анализу и секвенированию по методу Сэнгера. Таким образом последовательно вводят в ген IFN мутации B38 и B24.
Репликативную форму ДНК фага M13IFN B38/B24 гидролизуют рестриктазой BamHI, после чего лигируют ДНК-лигазой фага T4. Полученная ДНК фага M13mp8 IFN, содержащая мутантный ген гамма-интерферона (фиг.3), далее называется MIF D 10.
Пример 2. Получение плазмиды pIF D 10.
Репликативную форму ДНК MIF D/ 10 гидролизуют по сайтам EcoR1-Pst1 (фиг. 4), рестрикционную смесь фракционируют в 6% ПААГ. Полученный фрагмент длиной 481 п.н. клонируют в плазмиду pIFN- g -trp2, обработанную рестриктазами EcoR1, Pst1, Xba1 для исключения возможности встраивания немутантного гена IFN- g обратно в плазмиду. Компонентные клетки E.coli JM103 транспортируют реакционной смесью и высевают на среду с тетрациклином. Бактериальные колонии, содержащие плазмиду с мутантным геном интерферона, выявляют гибридизацией с радиоактивными олигонуклеотидом-зондом и окончательно подтверждают структуру мутантного гена секвенированием ДНК плазмиды по методу Максама-Гилберта. Полученную плазмиду назвали pIF D 10.
Пример 3. Получение штамма-продуцента мутантного g -интерферона.
Плазмидой pIF D 10 трансформируют компетентные клетки E.coli MH-1, как описано ранее [13] и получают штамм-продуцент полипептида IFN D 10.
Пример 4. Выделение мутантного белка IFN D 10.
Высокоочищенный мутантный белок IFN D 10 получают методом ионообменной хроматографии. Для этого 1 г биомассы продуцента суспендируют в 5 мл раствора A (0,01 M трис HCl, pH 8,5) и обрабатывают ультразвуком пятью сериями по 30 с с минутными интервалами при 0oC, после чего полученную суспензию центрифугируют в течение 30 мин при 17000 об/мин, 4oC. Супернатант наносят на колонку MonoS HR 5/5, уравновешенную тем же буфером, сорбированные белки элюируют градиентом NaCl от 0 до 1 M, pH 8,5. Фракции, содержащие гамма-интерферон, выявляют с помощью гель-электрофореза в полностью денатурирующих условиях. Содержащий гамма-инерферон материал диализуют в течение ночи против 0,01 M ацетата аммония, pH 6,0. Диализованный белок наносят на колонку MonoS HR 5/5, уравновешенную 0,01 M ацетатом аммония, pH 6,0, и элюируют линейным градиентом NaCl (от 0 до 1 M) в том же буфере. Обнаружение гамма-интерферона во фракциях проводят, как описано выше. Содержащие целевой белок фракции объединяют и диализуют против 0,01 M ацетата аммония, pH 6,0, стерильно фильтруют и хранят до использования при 4oC.
Пример 5. определение антивирусной активности мутантного белка IFN D 10.
Антивирусную активность аналога IFN D 10 определяют на культуре клеток фибробластов человека L68 по ингибированию цитопатического действия вируса везикулярного стоматита (BBC) стандартным методом. К монослою клеток добавляют различные разведения препарата аналога IFN D 10 и инкубируют 24 ч при 37oC в атмосфере углекислого газа, затем добавляют к каждому монослою 100 ЛД50 BBC и инкубируют в тех же условиях еще 24 ч, после чего проводят учет. Состояние монослоя изучают с помощью инвертированного микроскопа. За единицу активности принимают то разведение аналога, которое обеспечивало сохранение 50% клеток монослоя. Для определения активности аналога в международных единицах (ME) пользовались референс-препаратом гамма-интерферона, изготовленным в НПО "Фермент" (г. Вильнюс).
Для расчета удельной антивирусной активности аналога IFN D 10 определяют также и содержание белка в высокоочищенном препарате (не менее 99%) по методу Лоури или Бредфорда.
Удельная антивирусная активность аналога IFN g 10 составляет 20 млн. ME/мг.
Пример 6. Ограниченный протеолиз трипсином D -интерферона и мутантного IFN D 10.
10 мкг очищенного белка смешивают с 0,2 мкг трипсина ("Sigma", тип XIII, активность 1000 BAEE/mg, содержание химотрипсина менее 0,1 BTEE/mg) в 0,1 M ацетате аммония pH 7,0, инкубируют при комнатной температуре требуемое время, реакцию останавливают осаждением ацетоном и наносят на 12,5% полиакриламидный гель, приготовленный по Лэммли. Удаление обоих сайтов (IFN D 10) делают молекулу устойчивой к трипсину в условиях ограниченного протеолиза.
Пример 7. Протеолиз очищенных белков лизатом клеток E.coli MH-1.
10 мкг очищенного белка смешивают с экстрактом, полученным из 0,1 о.е. культуры, инкубируют при комнатной температуре, реакцию останавливают осаждением ацетоном, реакционную смесь фракционируют по Лэммли в денатурирующих условиях. Удаление обоих сайтов (IFN g 10) делает молекулу устойчивой к действию протеаз E.coli, в частности ompF.
Пример 8. Определение внутриклеточной локализации D -интерферона и мутантного белка IFN D 10.
Клетки E.coli MH-1 с соответствующими плазмидами выращивают в течение 18 ч в 3-5 мл среды M9 с 0,2% казаминовых кислот и Tc с конечной концентрацией 10 мкг/мл до оптической плотности D550 3,0-4,0. 1 мл клеточной суспензии центрифугируют на центрифуге Eppen-dorf 3 мин при 5000 об/мин, осадок суспендируют в растворе A: 10 мM трис-HCl pH 8,0, 50 mM глюкоза, 1 мМ ЭДТА до оптической плотности D55010 o.e. Суспензию обрабатывают ультразвуком дважды по 30 с при 0oC, центрифугируют 6 мин при 10000 об/мин, осторожно разделяют супернатант и осадок. Осадок суспендируют в растворе A, в объеме равном объему супернатанта и равные аликвоты клеточных фракций используют для электрофоретического анализа. При 37oC приблизительно 90% белка IFN D 10 синтезируется в растворимой форме в отличие от прототипа, почти 100% которого находится в клетках в виде телец включения.
Литература
1. Cantell K. Schellekens H. Hitroven S. Van der Meide. De Reus A. Pharmacokinetic studies with human and rat interferons in different species. // J.Interferon Res. 1986, v. 6, p. 671-675.
2. Dobeli H. Gents R. Jucker W. Garotta G. Hartmann D.W. Hochuli E. Role of the carboxy-terminal seguence of the biological activity of human immune interferon. // J.Biotechnology. 1988, v. 7, p. 199-216.
3. Rutenfranz I. Bauer A. Kirchner H. Pharmacokinetic study of liposome-encapsulated human interferon- g after intravenous and intramuscular injection in mice.// J. IFN. Res. 1990, v.10, p. 337-341.
4. Leinikki P. Calderon J. Luguette H.M. Scheriber R.D. Redused receptor binding by a human interferon-gamma fragment lacking 11 carboxyl-terminal amino asids. //J. Immunology. 1987, v. 139, p. 3360-3366.
5. Arakawa T. Hsu Y. -R. Parker C.G. Lai P. -M. Role of polycationic C-terminal portion in the structure and activity of recombinant human interferon-gamma. // J. Biol. Chemistry. 1986, v. 261, N.18, p. 8534-8539.
6. Lortat-Jacob H. Grimaud J. -A. // FEBS Letters. 1990, v. 280, p. 152-154.
7. Lortat-Jacob H. and Grimaud J. -A. Interferon gamma C-terminal function: new working hypothesis. // Cell. Mol. Biology. 1991, v. 37, p. 253-260.
8. De la Maza L.M. Peterson E.M. Burton L.E.// Infect. Immunity. 1987, v. 56, p. 2727-2732.
9. Заявка EP N 273373, кл. C 07 K 13/00, 1988.
10. Заявка EP N 146354, кл. C 12 N 15/00, 1985.
11. Заявка EP N 306870, кл. C 07 K 13/00, 1989.
12. Заявка EP N 256424, кл. C 12 N 15/00, 1988.
13. Заявка EP N 546099, кл C 07 K 13/00, 1991.
14. Заявка WO N 92/04377, кл. C 07 K 13/00, 1992.
15. Sverdlov E.D. Tsarev S.A. Krykbaev R.A. Chernov I.P. Rostapshov V.M. //FEBS Lett. 1987, v. 212, n. 2, p. 233-236.
16. Авт. св. СССР N 1433019, кл. C 12 N 15/00, 1986, опубл. 15.09.90, Бюл. N 34.


Использование: биотехнология, генетическая инженерия. Сущность изобретения: получают ген мутантного гамма-интерферона человека IFN Δ 10 путем олигонуклеотиднаправленного мутагенеза, рекомбинацией замещают им ген природного гамма-интерферона в плазмиде pIFN- γ -trp2 и трансформируют полученной плазмидой pIF Δ 10 компетентные клетки E.coli МН-1. Полученный штамм-продуцент E. coli ВКПМ В-6663 обеспечивает индуцибельный синтез полипептида с активностью человеческого гамма-интерферона и уровнем экспрессии до 40% от суммарного клеточного белка. Мутантный гамма-интерферон устойчив к протеазам крови. 3 с.п. ф-лы, 4 ил.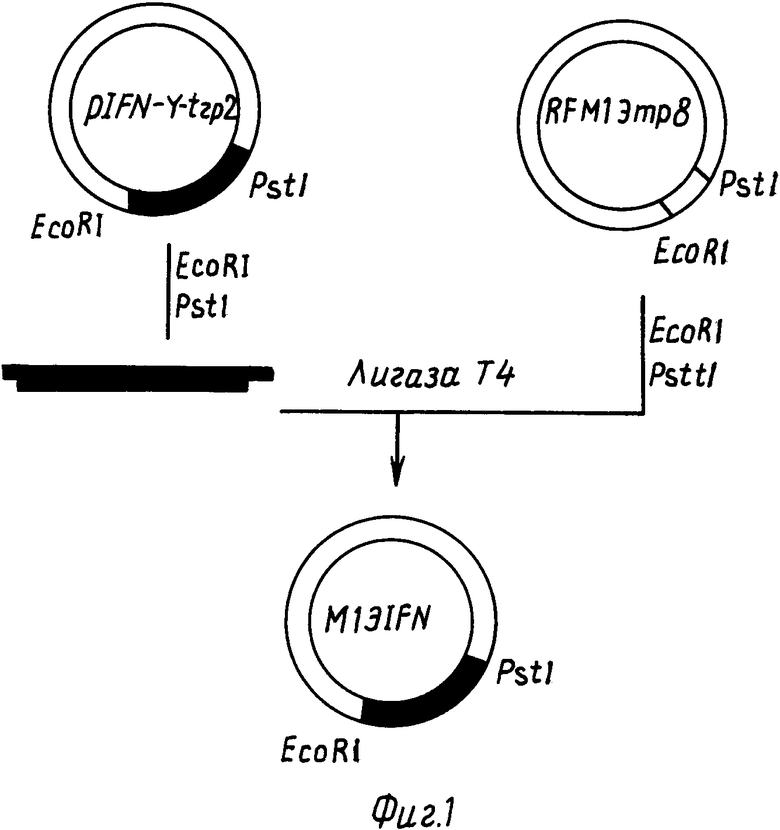
| Sverdlov E.D., Tsarev S.A., Krykbaev R.A., Chernow I.P., Rostapshov V.M | |||
| //FEBS Lett | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| SU, авторское свидетельство, 1433019, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1998-02-27—Публикация
1995-10-12—Подача