Изобретение относится к микробиологии и биотехнологии и представляет собой способ получения биомассы рекомбинантного штамма E. coli, содержащего плазмидную ДНК, кодирующую биосинтез полипептида со свойствами лимфотоксина человека. Полученная биомасса может быть использована для выделения из нее и очистки лимфотоксина с целью детального исследования его свойств и применения в медицинской практике.
В организме человека лимфотоксин (ЛТ, он же фактор некроза опухолей-бета, ФНО-бета) продуцируется главным образом активированными T-лимфоцитами. Лимфотоксин, как природный (гликозилированный), так и рекомбинантный (негликозилированный), обнаруживает широкий спектр противоопухолевой активности и существенно ингибирует рост твердых опухолей человека [1]. В ряде случаев его действие эффективнее, чем у ФНО-альфа [2]. Как и фактор некроза опухолей альфа, лимфотоксин является иммуномодулятором широкого спектра действия. Кроме того, лимфотоксин имеет противовирусное действие [3 - 5]. Все это делает перспективным применением лимфотоксина в медицине. Для глубокого исследования свойств лимфотоксина, его биологических и медицинских испытаний требуется значительное количество препарата.
Известен способ получения ЛТ из активированной лимфобластоидной линии клеток человека RPM1-1788 [6]. Недостатки способа: сложные, трудоемкие методы культивирования клеточной линии. Низкое содержание целевого продукта (около 3 мкг ЛТ на 1 л культуры).
Известны способы получения ЛТ микробиологическим синтезом с использованием рекомбинантных плазмид. Один из способов основан на использовании штамма E. coli HB 101, трансформированного плазмидой pCG 402, содержащей ген ФНО -β под контролем триптофанового промотора [7]. Согласно этому способу клетки выращивают на глюкозосолевой среде с добавлением казаминовых кислот, тиамина, триптофана и ампициллина. Для экспрессии гена ФНО -β проводят индукцию индолакриловой кислотой с заменой среды. Недостатки способа следующие: использование на стадии культивирования дефицитных добавок (тиамин и др. ), индуктора для экспрессии целевого гена, замены среды на несодержащую триптофан. При очистке ЛТ из полученной биомассы удается извлечь не более 10 - 12% целевого полипептида от суммарного клеточного белка (около 5 мг из 1 г клеток на стадии получения клеточного экстракта).
Известен способ получения биосмассы для очистки из нее ЛТ., основанный на использовании штамма E. coli M15, трансформированного плазмидой pDS78/RBS11, кодирующей целевой белок [8]. Клетки выращивают стандартным способом. Для экспрессии гена проводят индукцию лактозного оперона изопропил-1-тио -β- D-галактопиранозидом. Недостатки способа: использование штамма E. coli M-15, требующего индукции лактозного оперона и содержащего протеазы различных типов, способные инактивировать ЛТ в процессе его дальнейшей очистки, а также низкое содержание ЛТ в биомассе (на конечном этапе авторы получают 0,17 мг препарата из 1 г клеток или около 1 мг из 1 г клеток на стадии получения клеточного экстракта).
Наиболее близким (прототипом) к заявляемому способу является способ получения биомассы рекомбинантного штамма E. coli SG 200-50/pLT 21, описанный в патенте РФ N 2048521 [9]. Способ основан на использовании штамма E. coli SG 200-50, трансформированного плазмидой pLT 21, обуславливающей биосинтез ФНО-бета. Клоны клеток первичных трансформантов получают кальциевым способом [10] и затем их используют для получения биомассы, которую выращивают стандартным способом в L-бульоне в присутствии ампициллина; клетки собирают центрифугированием. К основным недостаткам способа следует отнести крайнюю нестабильность процесса получения биомассы (содержание ЛТ колеблется от 0,5% до 10% от суммарного клеточного белка) и относительно низкое содержание целевого полипептида в биомассе (от 0,26 и до 5 мг на стадии получения грубого экстракта клеток).
Технической задачей предлагаемого изобретения является стабилизация процесса биосинтеза ЛТ и повышение его процентного содержания в биомассе.
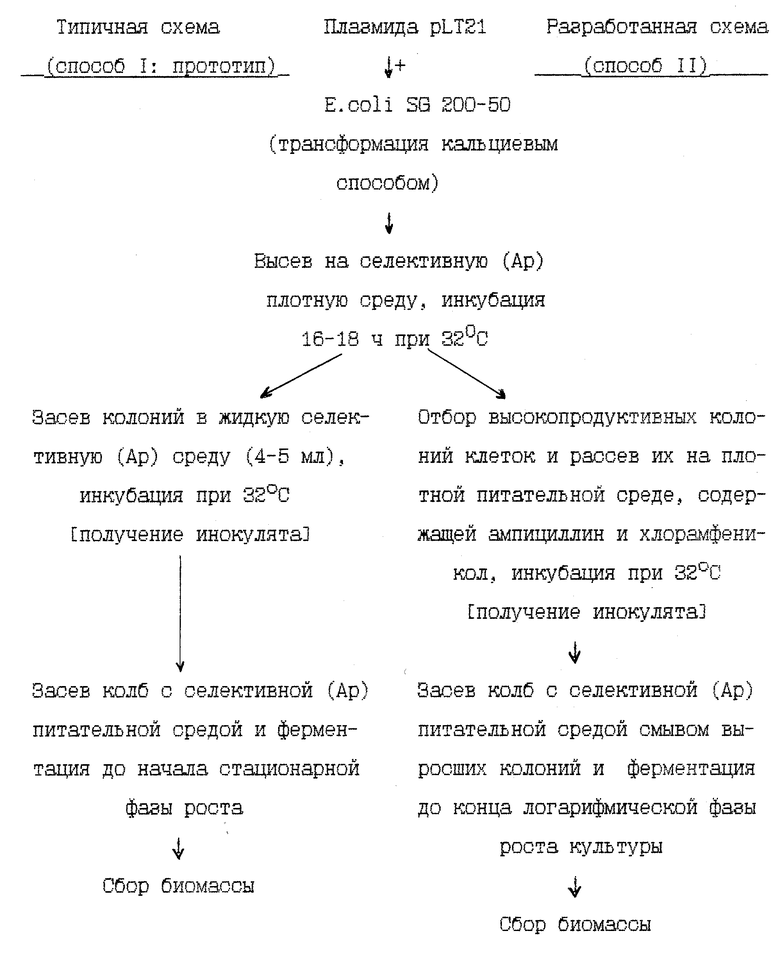
Задача решается путем использования отбора высокопродуктивных клонов клеток-трансформантов для получения инокулята биомассы, в процессе получения инокулята проводится амплификация плазмидной ДНК путем подращивания трансформированных клеток на плотной среде, содержащей хлорамфеникол, а сбор биомассы проводится в конце логарифмической фазы роста культуры (но не в стационарной, как в способе-прототипе).
Сущность предлагаемого способа получения биомассы рекомбинантного штамма E. coli, обогащенного полипептидом, со свойствами ЛТ человека представлена на следующей схеме, которая приведена в конце описания.
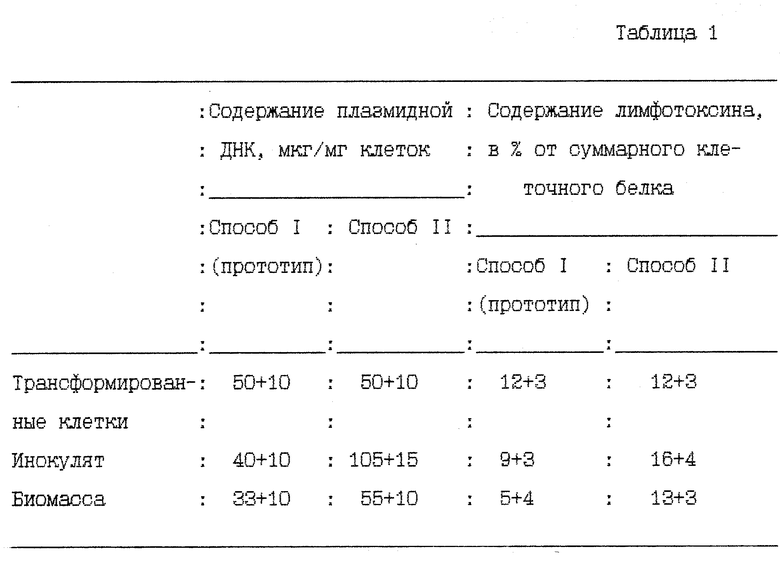
Сравнительный анализ культуры E. coli SG 200-50 на содержание плазмидной ДНК pLT 21 и целевого белка лимфотоксина в процессе культивирования представлены в табл. 1.
Из таблицы видно, что при использовании предлагаемого способа содержание целевого белка в биомассе повышается в 2 - 2,5 раза (аналогично и плазмидной ДНК в 1,5 - 2,0 раза) по сравнению со способом-прототипом.
Новыми по сравнению со способом-прототипом признаками являются:
1 - первоначальный отбор высокопродуктивных клонов клеток-трансформантов для получения инокулята;
2 - проведение амплификации плазмидной ДНК на плотных средах, содержащих хлорамфеникол в процессе получения инокулята;
3 - сбор биомассы, когда культура находится в конце логарифмической фазы роста (но не в стационарной).
Совокупность указанных признаков позволяет получать биомассу с повышенным содержанием целевого продукта (в среднем в 2,0 - 2,5 раза) и стабилизировать процесс биосинтеза ЛТ при культивировании. Специфическая активность получаемого препарата как в способе-прототипе, так и в предлагаемом одинакова и составляет не менее 3•107 ед/мг белка (по цитолитическому действию на клетки мышиных фибробластов линии L 929 в присутствии актиномицина).
Ниже следует примеры конкретного выполнения способа получения биомассы рекомбинантного штамма E. coli, обогащенной полипептидом со свойствами лимфотоксина человека.
Пример 1. Получение трансформированных клеток и отбор высокопродуктивных клонов.
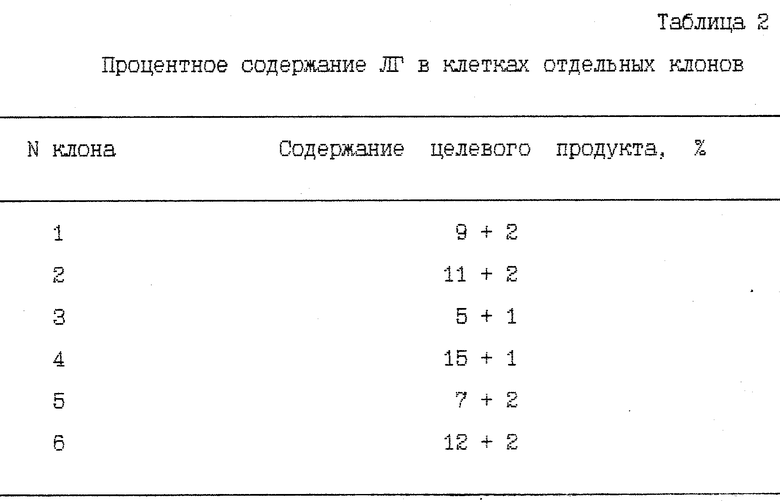
Трансформацию компетентных клеток E. coli SG 200-50 плазмидной ДНК pLT 21 проводят кальциевым способом, как описано ранее [10]. После проведения трансформации полученную суспензию клеток высевают на питательный агар, содержащий ампициллин в концентрации 50 мкг/мл и подращивают в течение 18 - 20 ч при 32oC. Выросшие отдельные клоны трансформированных клеток отбирают уколом и рассевают на свежий питательный агар, также содержащий ампициллин. Клетки из подросших клонов (18 - 20 ч при 32oC) отбирают и суспендируют в 100 мкл буфера и анализируют при помощи гель-электрофореза в 13,5%-ном полиакриламидном геле в присутствии 0,1% SDS [11]. Типичная картина по процентному содержанию ЛТ в отдельных клонах представлена в табл. 2.
Как видно из таблицы, процентное содержание целевого продукта в разных клонах значительно варьируется (от 5 до 15%).
Для дальнейшей работы клоны с наибольшим содержанием целевого продукта (в данном случае клон N 4).
Пример 2. Проведение амплификации плазмидной ДНК при выращивании клеток на плотных средах, содержащих хлорамфеникол в процессе получения инокулята.
Отобранные на предыдущей стадии высокопродуктивные клоны суспендируют в 1 - 3 мл L-бульона и вновь рассевают газоном на агаризованную среду, содержащую ампициллин (50 мкг/мл) и хлорамфеникол (150 мкг/мл); инкубируют в течение 18 - 20 ч при 32oC.
Пример 3. Ферментация.
Ферментацию проводят в качалочных колбах с объемом среды 250 мл в течение 8 - 9 ч при температуре 32oC и скорости вращения качалки 150 - 160 об/мин. Для засева используют бактериальную суспензию, полученную смывом колоний, выросших на чашках с хлорамфениколом. Инокулят вносят в количестве 2 - 3% (об/об) от засеваемого объема среды. Содержание ампициллина в среде для ферментации составляет 50 мкг/мл. По окончании ферментации культуральную жидкость быстро охлаждают до 5 - 10oC, клетки собирают центрифугированием и хранят при температуре - 20oC.
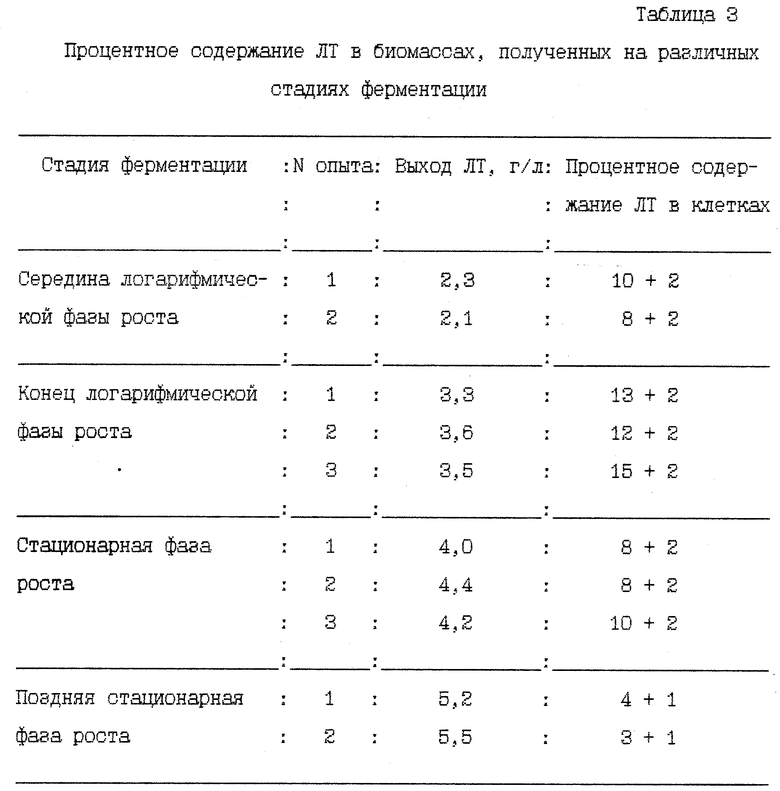
Анализ биомасс, полученных на различных стадиях ферментации, по процентному содержанию ЛТ представлен в табл. 3.
Из таблицы видно, что наибольшее содержание лимфотоксина в процессе ферментации в клетках наблюдается в конце логарифмической фазы роста культуры и резко снижается в поздней логарифмической фазе.
Таким образом, предлагаемый способ получения биомассы позволяет стабилизировать процесс биосинтеза лимфотоксина при культивировании рекомбинантного штамма E.coli SG 200-50/pLT21 и повысить содержание целевого белка в клетках (в биомассе) в среднем в 2-2,5 раза (до 5-8 мг/г клеток вместо 0,5-4,5) по сравнению со способом-прототипом. Предлагаемый способ не предусматривает использования дефицитных добавок при культивировании и индукции биосинтеза целевого белка.
ЛИТЕРАТУРА
1. Fisher Н. , Dohlsten М., Anderson W. et al.//J. lmmunol. -1990. -v. 144, N 12.-P. 4663-4669.
2. Lui S.K., Jakowatz J. G., Pollack R.B. et al.// Lymphokine Cytokine Res. - 1991. -v. 10, N 3.-p. 189-194.
3. Wong G.H.W. and Goeddel D.V. // Nature. - 1986. - v. 323, N 6091. - p. 819-822.
4. Mestan J., Digel W., Mittnacht S. et al. // Nature. -1986. - v. 323, N 6091. - p. 816-819.
5. Paul N. L. and Ruddle N.H. // Ann. Rev. Immunol. - 1988. -v. 6 - p. 407-438.
6. Agarwal В.В., Moffat В. and Harkins R.N. // J. of Biol. Chem.- 1984. - v. 259, N 1. - p. 686-691.
7. Seow H.-F., Goh C.R., Kristman L., Porter A. Biotechnology. - 1989. -v. 7, N 4.-p. 363-368.
8. Schoenfeld H.-J., Poesche D., Frey J.R. et al. // J. of Biol. Chem. - 1991, - v. 266, N 6. -p. 3863-3869.
9. Патент РФ N 2048521, кл. C 12 P 21/00, 1992 г.
10. Маниатис Т., Фрич Э., Сэмбрук Дж. // Молекулярное клонирование. - М. : Мир - 1984.
11. Laemmli U.K. // Nature - 1970, - v. 277. - p. 680-685.
Изобретение относится к микробиологии и биотехнологии. Обеспечивает получение биомассы штамма E. coli, продуцирующего рекомбинантный лимфотоксин человека с повышенным содержанием целевого продукта. Осуществляют трансформацию штамма E. coli SG 200 - 50 рекомбинантной плазмидой pLT21 с фрагментом ДНК, кодирующим лимфотоксин человека. Культивируют клетки. Отбирают первичные трансформанты на среде с ампициллином. Для амплификации плазмидной ДНК осуществляют повторный посев отобранных клонов на питательной среде, содержащей, кроме ампициллина, хлорамфеникол в концентрации 150 мкг/мл. Засевают колбы с жидкой селективной (+ ампициллин) средой смывом выросших на предыдущей стадии колоний. Сбор биомассы проводят в конце логарифмической фазы роста культуры. 3 табл.
Способ получения биомассы рекомбинатного штамма бактерий Escherichia coli, обогащенной полипептидом со свойствами лимфотоксина человека, включающий трансформацию компетентных клеток Escherichia coli SG 200 - 50 плазмидой pLT21, высев на селективную среду, содержащую ампициллин, получение инокулята, ферментацию и сбор биомассы, отличающийся тем, что для получения инокулята производится предварительный отбор высокопродуктивных клеток-трансформантов и амплификация плазмидной ДНК при подращивании клеток на селективной среде, содержащей дополнительно 150 мкг/мл хлорам феникола, а сбор биомассы проводят в конце логарифмической фазы роста культуры.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ЛИМФОТОКСИНА ЧЕЛОВЕКА | 1992 |
|
RU2048521C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Рекомбинантная плазмидная ДНК pLT21, кодирующая полипептид со свойствами лимфотоксина человека, и штамм бактерий ESCHERICHIACOL - продуцент полипептида со свойствами лимфотоксина человека | 1990 |
|
SU1709731A1 |
Авторы
Даты
1998-11-27—Публикация
1997-03-12—Подача