Изобретение относится к предлагаемым соединениям и их фармацевтически приемлемым солям и способам лечения инфекций ВИЧ и родственных вирусов и/или лечения синдрома приобретенного иммунодефицита (СПИД). Изобретение, кроме того, относится к фармацевтическим композициям, включающим предлагаемые соединения, и способам применения таких соединений как таковых или в сочетании с другими средствами для лечения и ингибирования СПИД и вирусной инфекции от ВИЧ.
Полагают, что ретровирус, названный вирусом иммунодефицита человека (ВИЧ), является агентом, вызывающим сложное заболевание, названное синдромом приобретенного иммунодефицита (СПИД), и относится к членам лентивирусного семейства ретровирусов (M.A.Gonda, F.Wong-Staal. N. R.G. Gallo. Гомологичность последовательностей и морфологическое сходство патогенных лентивирусов: ВЛТЧ III (HTL V III) и вируса Вишну. Science, 227, 173, 1985; P. Sonigo, N.Alizon и др. Нуклеотидная последовательность лентивируса Вишну, связь с вирусом СПИД. Cell, 42, 369, 1985). Вирус ВИЧ, также называемый вирусом СПИД, ранее бы известен под названиями ВЛА (LAY), ВЛТЧ-III или АРВ, а в настоящее время называется как ВИЧ-I. Другие близко родственные варианты ВИЧ-I, включающие ВИЧ-II и ВИО (вирус иммунодефицита обезъян), - их мутанты.
Сложное заболевание СПИД включает прогрессирующее разрушение иммунной системы и вырождение центральной и периферийной нервной системы. Вирус ВИЧ, видимо, преимущественно атакует Т-клетки-помощники (Т-лимфоциты и ОКТ4-несущие Т-клетки), а также другие клетки человека, например определенные клетки мозга. Т-клетки-помощники захватываются вирусом, в результате чего Т-клетки становятся продуцентами вируса. Т-клетки-помощники быстро разрушаются, их число в человеческом организме уменьшается в такой степени, что B-клетки организма, наряду с другими T-клетками, обычно стимулируемые T-клетками-помощниками, перестают нормально функционировать или продуцировать достаточно лимфокинов и антител для разрушения вируса-захватчика или других агрессивных микробов.
Хотя вирус сам по себе не обязательно является причиной смерти, тем не менее он проводит к такому тяжелому поражению иммунной системы, что человек перестает сопротивляться другими заболеваниям, таким как герпес, Pneumocistis carini, токсоплазмоз, цитомегаловирусная болезнь, саркома Каноси, лимфомы, связанные с вирусом Эпштейна-Барра среди прочих. Эти вторичные инфекции, как водится, подвергают отдельному лечению с помощью других медикаментов. На ранних этапах люди-носители ВИЧ живут вроде бы без симптомов болезни или при незначительном их проявлении, но остаются постоянно инфицированными. На более поздних этапах заболевания человек страдает от слабой депрессии иммунной системы с различными симптомами, такими как потеря веса, недомогание, лихорадка и набухание лимфатических узлов. Все эти симптомы получили название синдрома устойчивой генерализованной лимфаденопатии (УГЛ) и связанного со СПИД комплекса (ССК) и позднее переходят в СПИД.
Во всех случаях инфицированные вирусом СПИД, как полагают, остаются устойчиво инфекционными для других. Кроме того, СПИД и связанный со СПИД комплекс спустя некоторое время приводят к смерти.
Описание механизма, которым вирус инфицирует хозяина, приводится в статье (R.Yarchoan и S.Broder. Создание антиретровирусной терапии синдрома приобретенного иммунодефицита и родственных нарушений. New England Journal of Medicine, 316, 557-564, февраль 26, 1987).
Значительные усилия были направлены на борьбу с ВИЧ путем ингибирования обратной транскриптазы ВИЧ, необходимой для репликации вируса (Y.Merluzzi и др. Ингибирование репликации ВИЧ-I с помощью ненуклеозидного ингибитора обратной транскриптазы, Science, 25, 1411, 1990). К примеру, применяемого в настоящее время такое лекарственное средство, как АЗТ, является ингибитором вирусной обратной транскриптазы (патент США N 4724232). К сожалению, многие известные соединения отличаются токсичностью, отсутствием биодоступности или небольшой устойчивостью in vivo, вирусной устойчивостью или сочетанием того и другого.
Таким образом, цель изобретения заключается в создании соединений и их фармацевтическими приемлемых солей для ингибирования и/или лечения ВИЧ и СПИД.
Другая цель настоящего изобретения заключается в создании терапевтических составов, представляющих ценность для ингибирования и/или лечения инфекций ВИЧ и лечения или ингибирования синдрома приобретенного иммунодефицита.
Еще одна цель заключается в создании способов ингибирования и/или лечения инфекции ВИЧ и возникшего синдрома приобретенного иммунодефицита.
Другие цели, признаки и преимущества для специалиста станут очевидными из нижеследующих описания и формулы изобретения.
Настоящим изобретением являются соединения, применимые для ингибирования и/или лечения ВИЧ и СПИД либо в чистом виде, либо в виде фармацевтически приемлемых солей, компонентов фармацевтической композиции как в сочетании с другими противовирусными средствами, иммуномодуляторами, антибиотиками или вакцинами, так и без них. Кроме того, раскрываются способы лечения СПИД, способы ингибирования репликации ВИЧ и способы лечения или ингибирования ВИЧ у людей.
Соединения, применяемые в способах настоящего изобретения, представляют собой производные тиомочевины общей формулы I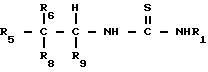
где
R1 - бензотиазол, бензимидазол, имидазол, пиразинид, пиразолил, пиридил, пиридазинил, хинолинил, нитразолил, тиазолил, тиадиазолил или триазолил, которые необязательно могут быть замещены заместителями, выбранными из следующей группы: C1 -C 4 - алкил, C1 -C 3 - алкокси, циано, гидрокси, метилтио, нитро, галоид, трифторметил;
R 5 представляет собой фенил, пиридил, пирролил, тиенил, бензотриазолил, бензоксазолил, нафтил, индолил, циклогексенил, некоторые из которых могут быть замещены вплоть до пяти положений заместителями, выбранными из следующей группы: амино, азидо, циано, нитро, гидрокси, галоген, метил, винил, этинил, трифторметил, C1 -C3 - алкокси, фенокси, фенил, метилендиокси, группа формулы -C(=0)R, где R представляет собой C1 -C3 - ацетамидометил, карбоксамидометил;
R8 и R9 независимо представляют собой водород или метил или R8 и R9 вместе с атомом углерода, к которому они присоединены, образуют циклопропил или циклобутил;
R6 представляет собой водород или метил или R6 и R8 вместе с атомом углерода, к которому они присоединены, образуют циклопропил,
или их фармацевтически приемлемые соли, при условии, что соединение формулы I не является соединением формулы
где
Rd представляет собой водород, галоген, гидрокси, алкил или алкокси,
или R1 не представляет собой группу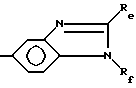
где
Re и Rf представляют низший алкил,
или их соли.
Предпочтительными производными тиомочевины общей формулы I являются следующие соединения:
N-(2-цис-фенилциклопропил)-N'-(2-тиазолил)тиомочевина,
N-(2-цис-фенилциклопропил)-N'-[2-(5-бром)пиридил]тиомочевина,
N-(2-цис-фенилциклопропил)-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(цис-2-пиридил)циклопропил]-N'-[2-(5-бром)пирилил]тиомочевина,
N-[2-(цис-2-пиридил)циклопропил]-N'-[2-(5-хлор)пирилил]тиомочевина,
N-{ 2-(цис-2-(6-фтор)пиридил] циклопропил}-N'-[2-(5-бром)пиридил] тиомочевина,
N-{ 2-(цис-2-(6-фтор)пиридил] циклопропил} -N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[цис-2-(6-метокси)пиридил]циклопропил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{ 2-(цис-2-(6-метокси)пиридил]циклопропил}-N'-[2-(5-хлор)пирилил] тиомочевина,
N-{ 2-[цис-2-(6-этокси)пиридил)циклопропил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{ 2-[цис-2-(6-этокси)пиридил] циклопропил} -[2-(5-хлор)пиридил] тиомочевина,
N-[2-(3-метоксифенил)этил]N'-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2-этоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-этоксифенил)этил]-N'-[2-(5-[хлор)пиридил]тиомочевина,
N -[2-(2,6-дифторфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(5-бром)пиразинил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[3-(6-[хлор)пирилазинил]тиомочевина,
N-[2-(2-фтор-6-метоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-фтор-6-метоксифенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2-хлорфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(2-хлорфенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(2-хлорфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-хлорфенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(1-циклогесенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[2-(4-этил)тиазолил]тиомочеивна,
N-[2-(1-циклогексенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[3-(6-хлор)пирилазинил]тиомочевина,
N-[2-(2,5-диметоксифенил)этил]-N'-[2-(5-хлор)пиразинил]тиомочевина,
N-[2-(2,5-диметоксифенил)этил]-N'-[2-(5-бром)пиразинил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-трифторметил)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-этил)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-метил)пиридил]тиомочевина,
N-{2-[2-(6-метокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-метокси)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[2-(6-этокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-этокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-фтор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[2-(3-фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(3-фтор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[2-(6-хлор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-хлор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{ 2-[2-(3-метокси-6-фтор)пиридил] этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{ 2-[2-(3-метокси-6-фтор)пиридил] этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{ 2-[2-(5-этокси-6-фтор)пиридил] этил} -N'-[2-(5-бром)пиридил]тиомочевина,
N-{ 2-[2-(5-этокси-6-фтор)пиридил] этил} -N'-[2-(5-хлор)пиридил]тиомочевина,
N-{ 2-[2-(3-этокси-6-фтор)пиридил] этил} -N'-[2-(5-бром)пиридил]тиомочевина,
N-{ 2-[2-(3-этокси-6-фтор)пиридил] этил} -N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[2-(3,6-дифтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(3,6-дифтор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2,6-дифтор-3-метоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина
или их соли.
Кроме того, изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении обратной транскриптазы вируса иммунодефицита человека, включающей активное начало и целевые добавки, причем в качестве активного начала композиция содержит эффективное количество производного тиомочевины формулы I или его фармацевтически приемлемую соль.
Как упомянуто выше, изобретение включает фармацевтически приемлемые соли соединений, определяемых приведенной формулой I. Хотя в целом и нейтральные, конкретные соединения могут обладать достаточно кислыми, достаточно основными или теми и другими функциональными группами, вследствие чего могут вступать в реакцию с любым из целого ряда неядовитых неорганических оснований и неядовитых неорганических и органических кислот с образованием фармацевтически приемлемых солей. Кислоты, обычно применяемые для образования соли с кислотой, являются неорганическими кислотами, таким как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, фосфорная кислота и другие, и органическими кислотами, такими как n-толуолсульфокислота, метансульфоновая кислота, щавелевая кислота, n- бромфенилсульфокислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примеры подобных фармацевтически приемлемых солей, таким образом, включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропионат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1, 4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. К рекомендуемым фармацевтически приемлемым солям, образованным добавлением кислот, относятся соли с минеральными кислотами, такими как хлористоводородная кислота и бромистоводородная кислота, и органическими кислотами, такими как малеиновая кислота и метансульфоновая кислота.
Соли, образованные добавлением основания, включают соли, происходящие из неорганических оснований, таких как гидроксиды, карбонаты, бикарбонаты и тому подобное, аммония, щелочного или щелочноземельного металла. Таким образом, основания, применяемые для получения солей настоящего изобретения, включают гидроксид натрия, гидроксид калия, гидроксид аммония, бикарбонат калия, гидроксид кальция, карбонат кальция и т.п.
Фармацевтически приемлемые соли изобретения обычно образуют реакцией соединения изобретения с эквимолярным или избыточным количеством кислоты или основания. Реагенты обычно смешивают в общем для них растворителе, таком как диэтиловый эфир или бензол для солей с кислотами и вода или спирты для солей с основаниями, в результате чего соли обычно осаждаются из раствора в пределах от одного часа до нескольких дней и могут быть выделены фильтрованием или иным обычным методом. Соли соединений изобретения после приема превращаются в само соединение, в силу чего являются предлекарствами. Все предлекарства вводят в количестве, достаточном для образования эффективного количества соединения, контактирующего с вирусом и взаимодействующего с ним (например, с ингибированием его репликации).
Соединения настоящего изобретения, кроме того, включают рацематы, рацемические смеси и отдельные энантиомеры или диастереомеры. Всякие асимметрические формы, отдельные и их комбинации, включены в объем настоящего изобретения. Как отмечено, оптически активные диастереомеры соединений формулы I рассматриваются как часть настоящего изобретения и такие оптически активные изомеры могут быть получены из их оптически активных предшественников по приведенным здесь методикам или разделением рецемических смесей. Разделение может быть осуществимо в присутствии разделяющего средства хроматографией, дробной кристаллизацией или сочетанием указанных методов, хорошо известных специалистам. Дополнительные подробности, касающиеся разделения, можно найти (Jaqgues и др. Энантиомеры, рацематы, их разделение. Джон Вили и сыновья, 1981).
Соединения настоящего изобретения или их предшественники получают методами, известными специалистам. Более конкретно, соединения формулы I синтезируют согласно методикам, иллюстрируемым нижеследующими схемами I, II и III и последующему пояснению к схемам.
Согласно схеме I производное изотиоцианата (1) реагирует с аминогруппой (2) в молярном отношении примерно 1:1 и инертном органическом растворителе, таком как N,N-диметилформамид с перемешиванием в течение 1-72 ч в температурном интервале 0-150 o C. Применяемые время и температура зависят от реакционности отдельных реагентов. Продукт (3) может быть выделен обычными методами.

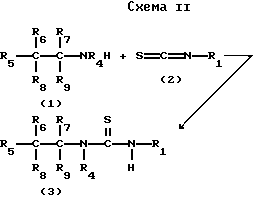
Схему II реализуют в тех же общих условиях реакции, что и схему I.

Схема III иллюстрирует способ, аналогичный способу, описанному в работе (J.Org.Chem., т.49, 4123, 1984), приводимому здесь в качестве ссылки.
Соединения, применяемые в качестве начальных исходных продуктов в синтезе соединений настоящего изобретения, хорошо известны, если не являются товарными продуктами, и легко синтезируются стандартными методами, обычно применяемыми химиками-органиками.
Другие указания на синтез соединений изобретения можно найти в работах (Organic Synthesis, 45, 69, 1965; Journal of the American Cremical Society, 79, 1236, 1957; Organic Synthesis, 20, 69, 1940; Synthesis, май 1983 г, с. 391), приводимых здесь в качестве ссылок.
Испытания вышеперечисленных соединений формулы I показали их активность в качестве ингибиторов ВИЧ. Не желая быть связанными теорией, тем не менее полагаем, что соединения действуют в качестве ингибиторов обратной транскриптазы, вследствие чего ингибируют репликацию вируса.
Ниже следует описание систем испытания, применяемых для анализа эффективности соединений по отношению к ВИЧ.
Испытания А, B, C и D(ХТТ).
Клетки МТ-4 в среде RPMI-1640. 5% ПСТ (плодной сыворотки теленка), пенициллина /стрептомицина доводят до концентрации 2 •105 клеток /мл и высевают в микропланшеты (96 ячеек/планшет) в количестве 100 мл клеточной суспензии на ячейку, что дает 2 •104 клеток на ячейку. Испытуемое соединение готовят в виде смеси концентрацией 10 мг/мл в ДМСО и хранят при -20 oC. Соединение в ДМСО разбавляют средой, содержащей 10% ДМСО, в серии с 10-кратным разбавлением и получением растворов концентрацией 1, 10 и 100 мг/мл. Дальнейшее разбавление до концентрации 400, 40, 4 и 0,4 мг/мл проводят в среде, содержащейся в микропланшетах. 50 мл растворов с концентрацией 400, 40, 4 и 0,4 мг/ мл с помощью многоканальной пипетки переносят в содержащие клетки микропланшеты (конечная концентрация 100, 10 и 1 мг/мл). Наконец, в каждую ячейку вносят 50 мл уксусной суспензии (с помощью воспроизводящей многоканальной пипетки Эппендорфа). В каждом планшете имеется по меньшей мере шесть ячеек со следующим: испытание А - вирус ВИЧ-6, испытание В - вирус ВИЧ (II), испытание C - вирус ВИО, испытание D - отсутствие вируса, отсутствие лекарства (контроль вируса) и шесть ячеек без вируса (контроль среды). Планшет помещают в пластиковый мешок и инкубируют шесть дней в атмосфере CO2. В каждую ячейку планшета вносят 50 мл ХТТ - 2,3-бис-(2-метокси-4-нитро-5-сульфонил)-5-[(фениламино)карбонил] -2H-тетразолий гидроксид(1 мг/мл в 0,01-0,02 мМ N-метилфеназоний метасульфата. После 6 ч инкубирования в атмосфере CO2 планшеты покрывают адгезивным уплотнителем планшетов и осторожно смешивают в качалке. Оптическую плотность определяют при длине волны в 450 нм и ссылочной длине волны 650 нм. Процент снижения цитотоксичности, вызываемой вирусной инфекцией, подсчитывают согласно следующему соотношению: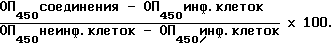
Испытания E, F, G, H: ВИЧ-1RT, ВИЧ-2RT, ВИО-RT, отсутствие вируса.
Клетки МТ-4/H9 доводят ло концентрации 2 •105 клеток/ мл в среде (RPMI-1640, 5% ПСТ, пенициллин/стрептомицин) и высевают в микропланшеты (96 ячеек/планшет) в количестве 100 мл клеточной суспензии на ячейку, что дает 2 •104 клеток/ячейку. Испытуемое соединение доводят до концентрации 10 мг/мл в ДМСО (исходный раствор, хранят при -20 oC). Растворенное в ДМСО соединение разбавляют в 25 раз в среде с получением концентрации 400 мг/мл. Дальнейшее разбавление проводят в микропланшетах до концентраций 40 и 4 мг/мл.
Многоканальный пипеткой в "содержащий клетки" микропланшет вносят 50 мл разбавлений в 400, 40 и 4 мг/мл (конечная концентрация 100, 10 и 1 мг/мл).
Наконец, в каждую ячейку вносят 50 мл вирусной суспензии (воспроизводящей многоканальной пипеткой Эппендорфа): испытание E - ВИЧ-1, испытание F-ВИЧ-2, испытание G-ВИО, испытание H-отсутствие вируса.
В каждом планшете имеется по меньшей мере четыре ячейки без лекарства, но с вирусом (контроль вируса) и две ячейки без вируса (контроль среды). Во избежание испарения планшет помещают в пластиковый мешок и инкубируют шесть дней в атмосфере CO2. Надосадочную жидкость (10 мл) из каждой ячейки многоканальной пипеткой переносят в новый микропланшет в котором в каждую ячейку добавлено 40 мл DVB (50 мМ Трис-HCl с pH 7,6, 35 мМ KCl, 4 мМ ДТТ, 1 мМ ЭДТК, 1,3% Тритона Х-100). Добавление 50 мл реакционной RT-смеси (10 мл надосадочной жидкости культуры, 40 мл DVB и 50 мл реакционной смеси, что дает конечные концентрации в 100 мМ Трис-HCl с pH 7,6, 100 мМ KCl, 4 мМ MgCl2, 4 мМ ДТТ, 275 мг/мл ВСА/мл, 5 мг (rA)n(dT)12-1/мл и 0,3 мМ 3HdTTP (удельная активность 18000 cpm\пмоль) дает конечный объем в 100 мл на ячейку. После 60 мин инкубирования полный анализируемый объем переносят с помощью клеточного сборщика на фильтровальную подушку, предварительно увлажненную 5% ТСА. Фильтр промывают 5% ТСА и один раз ополаскивают этанолом. После высушивания фильтровальной подушки (30 мин при 60 oC) каждый фильтрующий элемент (96 на подушку) выдавливают, помещают в сосуды для подсчета, добавляют 2 мл сцинтилляционной жидкости и ведут подсчет (1 мин) или же фильтровальную подушку целиком помещают в пластиковый мешок, добавляют 10 мл сцинтилляционной жидкости и счетчиком "Бекман Бетаплэйт" ведут подсчет для фильтровальной подушки. Процент уменьшения RT-активности определяют сравнением RT-активности для контроля вируса с RT-активностью, определенной для каждого разбавления соединения.
Испытание 1 [ВИЧ-RT(rAdt)].
Соединения испытывают на прямую ингибирующую активность относительно ВИЧ-RT в объеме 100 мл рекомбинантного ВИЧ-RT (разбавлен в лизирующем клетки буфере с получением 200000 cpm).
100 мМ Трис-HCl c pH 7,6, 100 mM KCl, 4 мМ MgCl2, 4 мМ ДТТ, 275 мг/мл БСА, 0,5 мг (rА)n(dT)12-18 и 0,3 мМ H3=dTTR (удельная активность 18000 cpm моль). После 60 мин инкубирования 40 мл дублей наносят в виде пятен на бумажные диски и промывают 5% ТСА. После ополаскивания бумажных дисков эталоном их сушат и ведут подсчет в сцинтилляционной жидкости.
Табл. 1-6 иллюстрируют активность соединений в вышеописанных испытаниях. Цифры показывают процент ингибирования.
К признакам изобретения, кроме того, относятся способ введения человеку, нуждающемуся в том, соединений изобретения или их фармацевтически приемлемых солей для лечения или ингибирования ВИЧ/СПИД с ингибированием репликации вируса ВИЧ/СПИД в инфицированных клетках человека и с ингибированием развития СПИД у человека, инфицированного ВИЧ/СПИД-вирусом, или созданием антител к ВИЧ/СПИД-вирусу.
Настоящее изобретение также раскрывает соединения изобретения и их соли, предназначенные для использования при лечении вышеуказанных симптомов, и применение таких соединений для приготовления фармацевтических составов для лечения указанных симптомов.
В целом, для указанного лечения приемлемая эффективная доза соединения или его фармацевтически приемлемой соли будет 0,5-250 мг на 1 кг массы тела реципиента в день. Введение может быть осуществлено любым приемлемым путем, в том числе перорально, ректально, насально, местно ( в том числе букквально и подъязычно), вагинально или парентерально (в том числе подкожно, внутримышечно, внутривенно или внутрикожно). Разумеется, предпочтительный путь введения может меняться в зависимости, например, от состояния, возраста и массы реципиента.
Вводимые компоненты могут быть использованы в виде лекарства в сочетании с другими лечебными средствами (другими противовирусными, антибактериальными соединениями, а также соединениями, применяемыми для профилактики возникающих вторичных или сопутствующих заболеваний, связанных с ВИЧ/СПИД), такими как AZT, ddI, ddC, 9-{[2-гидрокси-1-(гидроксиметил)этокси]метил}гуатин, 9-(2-гидроксиэтоксиметил)гуанин (ацикловир), 2-амино-9-(2-гидроксиэтоксиметил)пурин, сурамин, рибаварин, сурмяновольфрамат (HPA-23), интерферон, например интерферон, интерлейкин II и фосфоноформиат (фоскарнет), или в сочетании с другими иммунными модуляторами, в том числе трансплантантами костного мозга или лимфоцитов, или иными медикаментами, такими как левамизол или тимозин, способными повысить число лимфоцитов и/или их функционирование.
К примеру, изучение комбинации AZT с соединением формулы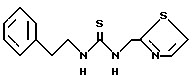
показывает синергический эффект. Комбинация исследования против ВИЧ-1 в клетках CEM по методике Prichard u Shipman (Anfiviral Researсh, 14, 181-206, 1990). Пик синергизма наблюдается при 0,5 мкг/мл соединения приведенной формулы и 0,005 мкг/мл AZT.
Хотя используемые компоненты могут быть введены по отдельности, тем не менее рекомендуется их представление в виде части фармацевтического состава. Составы настоящего изобретения включают по меньшей мере вводимый компонент, определенный выше, в смеси с одним или несколькими приемлемыми носителями и возможно другими лечебными компонентами. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими компонентами и не оказания вредного действия на реципиента.
Такие составы исключают составы, пригодные для перорального, ректального, насального, местного (в том числе букквального и подъязычного), вагинального или парентерального (в том числе подкожного, внутримышечного, внутривенного и внутрикожного) введения. Составы могут быть представлены в единичных дозированных формах, например таблетках или капсулах отложенного действия, которые могут быть приготовлены известными фармацевтическими методами.
Такие методы включают стадию смешивания подлежащих введению компонентов с носителем, состоящим из одного или нескольких дополнительных компонентов. В целом, составы получают равномерным и тщательным смешиванием активных компонентов с жидкими носителями или мелко помолотыми носителями, или с тем и другим с последующим при необходимости формованием продукта.
Составы настоящего изобретения, пригодные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, крахмальные облатки или таблетки, каждая из которых содержит заданное количество активного компонента, в виде порошка или гранул, в виде раствора или суспензии в водной жидкости или неводной жидкости или в виде жидкой эмульсии типа масла в воде или типа вода в масле, в виде болюса и т.д.
Что касается композиций для перорального введения (например, таблеток и капсул) термин "приемлемый носитель" относится к обычным наполнителям, таким как связующие средства, например сироп, камедь акации, желатин, сорбит, трагакант, поливинилпирролидин (повидон), метилцеллюлоза, этилцеллюлоза, натрийкарбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, сахароза и крахмал, наполнители и носители, например зерновой крахмал, желатин, лактоза, сахароза, микрокристаллическая целлюлоза, каолин, маннит, дикальцийфосфат, хлорид натрия и альгиновая кислота, дезинтеграторы, такие как микрокристаллическая целлюлоза, зерновой крахмал, натрийгликолят крахмала, альгиновая кислота и смазки, такие как стеарат магния и стеараты других металлов, стеариновая кислота, силиконовая жидкость, тальк, воск, масла и коллоидная окись кремния. Могут быть также использованы ароматизирующие добавки, такие как перечная мята, масло грушанки, вишневая отдушка и т.п. Может оказаться желательным добавление красителя с приданием дозировочной форме более приятного эстетического вида и с целью облегчения индентификации продукта.
Таблетки могут быть изготовлены прессованием или формованием, возможно с одним или несколькими дополнительными компонентами. Прессованные таблетки могут быть получены прессованием в подходящей машине активного компонента в свободно текучем состоянии, например, в виде порошка или гранул, возможно в смеси со связующим средством, смазкой, инертным разбавителем, консервантом, поверхностно-активным веществом или диспергирующим средством. Формованные таблетки могут быть получены формованием в подходящей машине смеси порошкообразного соединения, увлажненной инертным жидким разбавителем. На таблетки может быть нанесено покрытие или бороздки, таблетки могут быть приготовлены таким образом, чтобы обеспечить медленное или регулируемое выделение из них активного компонента.
Составы, пригодные для местного введения, включают лозенджис, включающий компоненты в ароматизирующей основе, обычно сахарозе и камеди акации или трагаканте, пастилке, включающие активный компонент в инертной основе, такой как желатин и глицерин, сахароза или камедь акации, а также составы для полоскания рта, включающие подлежащий введению компонент в приемлемом жидком носителе.
Составы, пригодные для местного внесения в кожу, могут быть представлены мазями кремами, гелями и пастами, содержащими активный, подлежащий введению компонент и фармацевтически приемлемый носитель. Пример системы для местного введения представлен трансдермальным пластырем, содержащим подлежащий введению компонент.
Составы для ректального введения могут быть представлены свечами на соответствующей основе, например масле какао или салицилате.
Составы для насального введения, в которых носитель является твердым веществом, включают грубые порошки с размером частиц, например, в интервале 20-500 мкм, вводимые путем вдыхания, например при быстрой ингаляции через носовой ход, из контейнера с порошком при его поднесении близко к носу. Приемлемые составы, в которых носитель является жидкостью, представлены, например, насальными аэрозолями или насальными каплями в виде масляного или водного раствора активного компонента.
Составы, пригодные для вагинального введения, могут быть представлены в виде пессария, тампона, крема, геля, пасты, пены или состава для опрыскивания, содержащих помимо активного компонента такие носители, которые, как известно, подходят для таких случаев.
Составы, пригодные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиокислители, буферные вещества, бактериостаты и растворимые вещества, придающие составу изотоничность с кровью предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Составы могут быть представлены единичными дозами или в виде контейнера со многими дозами, например в виде запаянных ампул и сосудиков, и могут храниться в высушенном вымораживанием (лиофилизованном) состоянии, требующем всего лишь добавления стерильного жидкого носителя, например воды, для инъекций непосредственно перед употреблением. Импровизированные растворы и суспензии для инъекций могут быть получены из стерильных порошков, гранул и таблеток ранее описанного типа.
К рекомендуемым единичным дозированным составам относятся составы, содержащие ежедневную дозу, ежедневную субдозу согласно вышеприведенному определению или их соответствующую долю активного компонента.
Противовирусные соединения формулы I могут быть использованы в качестве поверхностных дезинфекторов. Растворы, содержащие всего лишь 0,1 мас.% противовирусного соединения, могут оказаться эффективными для целей дезинфекции. Рекомендуется, чтобы такие растворы также содержали детергент или другое осветляющее средство. Растворы могут быть использованы для дезинфекции таких объектов, как стеклянное оборудование, зубные и хирургические инструменты и поверхности, например стены, полы и столы, в тех местах, где важно поддержание стерильных условий, например в больницах, местах приготовления пищи и т.п.
При осуществлении способа лечения или ингибирования ВИЧ и/или СПИД антивирусное средство может быть введено в единичной ежедневной дозе или в виде нескольких доз в день. Режим лечения может потребовать введения в течение продолжительного времени, например в течение нескольких дней, нескольких месяцев или лет. Количество, вводимое с дозой, или общее вводимое количество зависит от таких факторов, как природа и тяжесть инфекции, возраст и общее состояние здоровья пациента, толерантность и пациента, и микроорганизма или микроорганизмов, участвующих в инфекции, к антивирусному соединению.
Нижеследующие примеры представляют собой характерные фармацевтические составы, содержащие соединения, относящиеся к настоящему способу. Составы в качестве активного компонента могут включать любое соединение формулы I или его фармацевтически приемлемую соль. Примеры даются лишь с целью иллюстрации и ни в коей мере не предназначены для ограничения объема изобретения.
Состав 1.
Твердые желатиновые капсулы приготовляют, используя следующие компоненты, мг/капсула:
Предлагаемое соединение - 1250
Высушенный крахмал - 200
Стеарат магния - 10
Указанные компоненты смешивают и смесью заполняют твердые желатиновые капсулы в количестве 460 мг.
Состав 2.
Таблетированный состав получают, используя приведенные компоненты, мг/таблетка:
Соединение - 250
Микрокристаллическая целлюлоза - 400
Окись кремния, пыль - 10
Стеариновая кислота - 5
Стеарат магния - 10
Компоненты смешивают и прессуют в таблетки каждая массой 675 мг.
Состав 3.
Получают аэрозольный раствор, содержащий следующие компоненты, г:
Соединение - 0,25
Этанол - 29,75
Пропеллент 22 (хлордифторметан) - 70,00
Активное соединение смешивают с этанолом и смесь добавляют к части пропеллента 22, охлаждают до -30 oC и переносят в заполняющее устройство. Затем контейнер из нержавеющей стали заполняют необходимым количеством и разбавляют оставшейся частью пропеллента. После этого на контейнере устанавливают клапан.
Состав 4.
Таблетки, каждая из которых содержит 60 мг активного компонента, получают из следующих компонентов, мг:
Соединение - 60
Крахмал - 45
Микрокристаллическая целлюлоза - 35
Поливинилпирролидон (в виде 10%-ного раствора в воде) - 4
Натрийкарбоксиметилкрахмал - 4,5
Стеарат магния - 0,5
Тальк - 1
Активный компонент, крахмал и целлюлозу пропускают через сито N 45 меш (ст. США) и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученным порошком и затем пропускают через сито N 14 меш (ст. США). Полученные в результате гранулы сушат при 40-60 oC и просеивают через сито N 18 меш (ст. США). К гранулам добавляют натрийкарбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито N 60 меш (ст. США), и после смешивания прессуют в таблетирующей машине с получением таблеток каждая массой 150 мг.
Состав 5.
Капсулы, каждая из которых содержит 80 мг лекарства, получают из следующих компонентов, мг:
Соединение - 80
Крахмал - 59
Микрокристаллическая целлюлоза - 59
Силиконовая жидкость - 2
Активный компонент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито N 45 меш и полученной смесью в количестве 200 мг заполняют твердые желатиновые капсулы.
Состав 6.
Свечи, каждая из которых содержит 225 мг лекарства, получают из следующих компонентов, мг:
Соединение - 225
Глицериды насыщенных жирных кислот - 2
Активный компонент просеивают через сито N 60 меш (ст. США) и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с применением минимального количества необходимой теплоты. Смесь затем выливают в форму для свеч номинального объема в 2 г и оставляют охлаждаться.
Состав 7.
Состав для внутривенного введения получают из следующих компонентов:
Соединение, мг - 100
Изотонический солевой раствор, мл - 1000
Раствор указанных компонентов вводят внутривенно со скоростью 1 мл/мин млекопитающему, нуждающемуся в лечении.
Необходимо указать, что помимо указанных компонентов составы настоящего изобретения могут включать и другие агенты, обычно применяемые в этих случаях с учетом конкретного типа состава.
Нижеследующие примеры дополнительно иллюстрируют соединения изобретения и способы синтеза. Примеры ни в коей мере не ограничивают объема изобретения и их не следует рассматривать в таком аспекте.
Токсичность соединений настоящего изобретения исследовали, определяя концентрацию соединения, уменьшающую жизнеспособность клеток на 50% по сравнению с необработанными клетками (CD50) калориметрическим способом. Полученные данные представлены в табл. 7.
Данные, представленные в табл.7, показывают, что соединения настоящего изобретения нетоксичны.
Ниже приводятся примеры, иллюстрирующие способы получения предлагаемых соединений.
Пример 1. N-(2-Фенэтил-N-'[2-(1,3,4-тиадиазолил]тиомочевина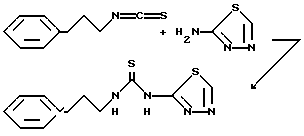
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль) и 2-амино-1,3,4-тиадиазола (2,02 г, 20 ммоль) в N, N-диметилформамиде (50 мл) нагревают до 100 oC. Спустя 68 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия и водой. Органический слой фильтруют и промыванием полученного твердого вещества (2,24 г) этилацетатом получают 1,9 г (36%) указанного в заготовке соединения, т.пл. 210-211 oC.
ИК (KBr), см-1: 3320, 2924, 2869, 2685, 1645, 1543, 1453, 1384, 1344, 1278, 762, 749, 700, 650.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 12,35 (уш.с, 1H), 8,92 (с, 1H), 8,78 (уш. с, 1H), 7,38-7,18 (м, 5H), 3,84-3,72 (м, 2H), 2,92 (т, J=6 Гц, 2H).
МС (FD), m/e: 264/(M+).
УФ (EtOH), нм: 277, 253, 205 нм.
Найдено,%: C 50,07; H 4,66; N 21,48.
C11H12N4S2
Вычислено,%: C 49,98; H 4,57, N 21, 19.
Пример 2. N-(2-Фенэтил)-N'-[4,5-диметил-(2-тиазолил)]тиомочевина.
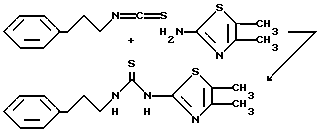
Образуют взвесь 2-амино-4,5-диметилтиазола, гидрохлорида (3,3 г, 20 ммоль) в хлористом метилене и встряхивают с насыщенным раствором бикарбоната натрия. Слои разделяют и водный слой промывают хлористым метиленом (2х). Объединенную органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. К полученному твердому веществу добавляют 2-фенэтилизотиоцианат (3,26 г, 20 ммоль, 3 мл) и N,N-диметилформамид (50 мл). Полученный раствор нагревают при 100 oC. Спустя 92,25 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия и водой (2х). Органический слой фильтруют и перекристаллизацией полученного твердого продукта (3,9 г) из этилацетата получают 3,3 г указанного соединения (57%), т. пл. 186-187 oC.
ИК (KBr), см-1: 3166, 3022, 1523, 1502, 1289, 1215, 737, 695.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,42 (уш.с, 1H), 9,83 (уш.с, 1H), 7,36-7,16 (м, 5H), 3,86-3,73 (м, 2H), 2,91 (т, J=7 Гц, 2H), 2,19 (с, 3H), 2,08 (с, 3H).
МС (FD), m/e: 291 (M+).
УФ (EtOH): 298 нм ( ε = 17987), 257 нм ( ε = 9939), 204 нм ( ε = 20802).
Найдено,%: C 57,41; H 5,85; N 14,39.
C14H17N3S2
Вычислено,%: C 57,70; H 5,80; N 14,42.
Пример 3. N-[2-(4-Метил)-1-фенэтил]-N'-(2-тиазолил)тиомочевина.
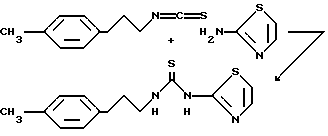
Раствор 2-(4-метилфенэтил)изотиоцианата (820 мг, 4,6 ммоль) и 2-аминотиазола (565 мг, 5,65 ммоль) в N,N-диметилформамиде (915 мл) нагревают при 100 oC. Спустя 20,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), насыщенным раствором бикарбоната натрия и рассолом. Органический слой сушат над сульфатом магния, фильтруют и концентрируют. Полученный твердый продукт (1,1 г) очищают вытеснительной хроматографией на силикагеле (1% этилацетата в хлористом метилене) и получают 570 мг (45%) указанного соединения. Образец перекристаллизован из этилацетата, т.пл. 132-133 oC.
ИК (KBr), см-1: 3168, 2990, 1560, 1513, 1166, 808, 705.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,62 (уш.с, 1H), 9,69 (уш.с, 1H), 7,36 (д, J=4 Гц, 1H), 7,2-7,06 (м, 5H), 3,83-3,73 (м, 2H), 2,87 (т, J=7 Гц, 2H), 2,3 (с, 3H).
МС (FD), m/e: 277 (M+).
УФ (EtOH): 288 нм ( ε = 18773), 257 нм ( ε = 11948), 215 нм ( ε = 14509).
Найдено,%: C 56,55; H 5,52; N 15,04.
C13H15N3S2
Вычислено,%: C 56,29; H 5,45; N 15,15.
Пример 4. N-(2-Фенэтил)-N'-(2-пиридил)тиомочевина.

Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-аминопиридина (1,9 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100 oC. Через 4 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат, органический раствор промывают водой (3х). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией белого вещества из этилацетата получают 1,86 г (36%) указанного соединения, т.пл. 153-154oC.
ИК (KBr), см-1: 3232, 1536, 1477, 1319, 775.
1H-ЯМР (300 МГц, CDCl3), δ : 11,72 (уш.с, 1H), 8,59 (уш.с, 1H), 7,97 (д, J=4,2 Гц, 1H), 7,64 (дв.т, J=1,7 и 8,2 Гц, 1H), 7,37-7,26 (м, 5H), 6,92 (дв. д, J=7,2 и 5,1 Гц, 1H), 6,74 (д, J=8,2 Гц, 1H), 4,06 (м, J=6,8 Гц, 2H), 3,04 (т, J=6,9 Гц, 2H).
МС (FD), m/e: 257 (M+).
УФ (EtOH): 293 нм ( ε = 12040), 266 нм ( ε = 12961), 247 нм ( ε = 11912), 202 нм ( ε = 12963).
Найдено,%: C 65,45; H 5,82; N 16,24.
C14H15N3S
Вычислено,%: C 65,35; H 5,87; N 16,33.
Пример 5. N-(2-Фенэтил)-N'-(4-пиридил)тиомочевина.
Раствор 2-фенилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 4-аминопиридина (1,92 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100 oC. Спустя 4,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органический раствор промывают водой (2х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Полученное масло очищают вытеснительной хроматографией на силикагеле (5% метанола в этилацетате до 10% метанола в этилацетате). Перекристаллизацией полученного продукта из этилацетата получают 1,85 г (36%) указанного соединения, т.пл. 154,5 oC.
ИК (KBr), см-1: 3142, 1579, 1518, 1328, 1276, 750.
1H-ЯМР (300 МГц, CDCl3), δ : 8,42 (дв.д, J=1 и 5 Гц, 2H), 7,94 (уш.с, 1H), 7,39-7,23 (м, 5H), 6,81 (д, J=5 Гц, 2H), 6,38 (уш.с, 1H), 3,99 (м, J=6 Гц, 2H), 3,02 (т, J=6 Гц, 2H).
МС (FD), m/e: 258 (M+1).
УФ (EtOH): 281 нм ( ε =16486), 255 нм ( ε = 21182), 208 нм ( ε = 25744).
Найдено,%: C 65,43; H 5,97; N 16,17.
C14H15N3S
Вычислено,%: C 65,34; H 5,87; N 16,33.
Пример 6. N-(2-Фенэтил)-N'-[2-(6-фтор)бензотиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-6-фторбензотиазола (3,36 г, 20 ммоль) в диметилсульфоксиде (10 мл) нагревают при 150oC. Спустя 5 ч реакционную смесь охлаждают до комнатной температуры и фильтруют. Фильтрат выливают в этилацетат, промывают водой (5х) и рассолом (2х). Органический слой концентрируют и перекристаллизацией из этилацетата получают 729,5 мг (11%) указанного соединения, т.пл. 212-213oC.
ИК (KBr), см-1: 3175, 3025, 1561, 1534, 1461, 1249, 1215.
1H-ЯМР (300 МГц, CDCl3), δ : 11,81 (уш.с, 1H), 9,83 (уш.с, 1H), 7,77 (дв. д, J= 8,7 и 2,4 Гц, 1H), 7,52 (уш.с, 1H), 7,31-7,15 (м, 6H), 3,79 (м, 2H), 2,9 (т, J=6,6 Гц, 2H).
МС (FD), m/e: 331 (M+).
УФ (EtOH), нм: 310, 289, 245, 208, 201.
Найдено,%: C 57,74; H 4,39; N 12,53.
C16H14N3S2F
Вычислено,%: C 57,98; H 4,26; N 12,68.
Пример 7. N-(2-Фенэтил)-N'-[2-(4-фенил-5-тетрадецил)тиазолил] тиомочевина.

Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-фенил-5-тетрадецилтиазола (7,45 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Спустя 24 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органический раствор промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, сушат и концентрируют. Перекристаллизацией продукта один раз из этилацетата и один раз из гексана получают 4,93 г (46%) указанного соединения, т.пл. 108,5-109oC.
ИК (KBr), см-1: 3166, 3022, 2915, 1850, 1574, 1523, 1502, 1215, 695.
1H-ЯМР (300 МГц, CDCl3), δ : 10,87 (уш.с, 1H), 9,28 (уш.с, 1H), 7,55-7,16 (м, 10H), 4-3,95 (м, 2H), 2,99 (т, J=7 Гц, 2H), 2,79 (т, J=9 Гц, 2H), 1,65-1 (м, 24H), 0,86 (т, J=6 Гц, 3H).
МС (FD), m/e: 535 (M+).
УФ (EtOH): 299 нм ( ε = 19199), 261 нм ( ε = 17809), 203 нм ( ε = 31542).
Найдено,%: C 71,93; H 8,75; N 7,92.
C32H45N3S2
Вычислено,%: C 71,73; H 8,46; N 7,84.
Пример 8. N-[2-(3,4-Диметокси)фенэтил]-N'-(2-тиазолил) тиомочевина.

Раствор 2-(3,4-диметоксифенэтил)изотиоцианата (0,52 г, 2,33 ммоль) и 2-аминотиазола (233 мг, 2,33 ммоль) в N,N-диметилформамиде (10 мл) нагревают при 100oC. Через 24 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органический раствор промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией масла из толуола получают 129 мг (17%) указанного соединения, т.пл. 139oC.
ИК (KBr), см-1: 3168, 3112, 3013, 1572, 1550, 1516, 1461, 1263, 1237, 1183.
1Н-ЯМР (300 МГц, ДMCO-d6), δ: 11,55 (уш.с,1H), 9,8-9,62 (уш.с, 1H), 7,35 (м, 1H), 7,15 (уш. с, 1H), 6,9-6,75 (м, 3H), 3,8-3,7 (м, 2H), 3,72 (c,6H), 2,84 (т, J = 6 Гц,2H).
МС (FD), m/e: 323 (M+).
УФ (EtOH): 287 нм (ε = 21687), 258 нм (ε = 11828), 228 нм (ε = 11401), 205 нм (ε = 36669).
Найдено, %: C 51,96; H 5,61; N 13,02.
C14H17N3S2
Вычислено, %: C 51,99; H 5,30; N 12,99.
Пример 9. N-(2-Фенэтил)-N'-{2-[4-(4-бромфенил)тиазолил]}тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-(4-бромфенил)тиазола (5,15 г, 200 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Через 65 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органический раствор промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3х) и рассолом. Содержащиеся в растворе твердые вещества отфильтровывают. Фильтрат сушат над сульфатом натрия, фильтруют и концентрируют, остаток добавляют к ранее отфильтрованному продукту. Перекристаллизацией объединенного продукта из этилацетата получают 12,04 г (24%) указанного соединения, т.пл. 215,5-216,5oC.
ИК (KBr), см-1: 3166, 3022, 1574, 1523, 1502, 737, 695.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 11,7 (уш.с, 1H), 9,4 (уш.с, 1H), 7,74-7,54 (м, 5H), 7,36-7,18 (м, 5H), 3,9-3,81 (м,2H), 2,96 (т, J = 6 Гц, 2H).
MC (FD), m/e: 419 (M+1).
УФ (EtOH): 287 нм (ε = 28740), 268 нм (ε = 24574), 246 нм (ε = 18009), 203 нм (ε = 35813).
Найдено,%: C 51,39; H 3,77; N 9,77.
C18H16N3S2Br
Вычислено, %: C 51,68; H 3,86; N 10,04.
Пример 10. N-[2-(4-Хлор)фенэтил]-N,-(2-тиазолил)тиомочевина.

Раствор 2-(4-хлор)фенэтилизотиоцианата (657 мг, 3,3 ммоль) и 2-аминотиазола (335 мг, 3,3 ммоль) в N, N - диметилформамиде (10 мл) нагревают при 100oC. Спустя 20,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органический раствор промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия и водой (3х). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией продукта из этилацетата (2х) получают 136 мг (14%) указанного соединения, т. пл.154-155oC.
ИК (KBr), см-1: 3090, 2991, 1561, 1515, 1490, 1176.
1H-ЯМР (300 МГц, ДMCO-d6), δ: 11,58 (уш.с, 1H), 9,78-9,6(уш.с,1H), 7,4-7,28 (м,5H), 7,12 (уш.с, 1H), 3,81-3,72 (м, 2H), 2,92(т, J = 6 Гц, 2H).
MC (FD), m/e: 297 (M+).
УФ (EtOH): 289 нм (ε = 19572), 257 нм (ε = 12071), 220 нм (ε = 15393), 202 (ε = 22079).
Найдено,%: C 48,17; H 4,02; N 13,83.
C12H12N3S2Cl
Вычислено,%: C 48,40; H 4,06; N 14,11.
Пример 11. N-(2-Фенэтил)-N'-[2-(4,5-дигидро)тиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амино-4,5-дигидротиазола (1,02 г, 10 ммоль) в диметилсульфоксиде нагревают при 100oC. Через 2,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), водой (4х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией полученного твердого вещества из этилацетата получают 1,48 г (56%) указанного соединения в виде белых кристаллов. Образец продукта вторично перекристаллизован из этилацетата, т.пл. 132-134oC.
ИК (KBr), см-1: 3161, 3027, 2945, 2862, 1630, 1574, 1552, 1221, 1033.
1Н-ЯМР (300 МГц, CDCl3), δ : 11,11 (уш. с, 1H), 8,36 (c, 1H), 7,32-7,14 (м, 5H), 4,05-3,97 (м, 2H), 3,9-3,83 (м, 2H), 3,3-3,22(м, 2H), 2,94 (т, J = 7,1 Гц, 2H).
MC (EI), m/e: 265 (M+).
УФ (EtOH): 269 нм (ε = 18349), 206 нм (ε = 18745).
Найдено,%: C 54,36; H 5,66; N 15,78.
C12H15N3S2
Вычислено, %: C 54,31; H 5,70; N 15,83.
Пример 12. N-(2-Фенэтил)-N'-[2-(4-метилтиазолил)]тиомочевина.
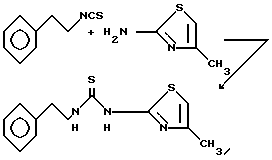
Раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл), гидрохлорида 2-амино-4-метилтиазола (1,51 г, 10 ммоль) и N,N-диизопропилэтиламина (1,29 г, 10 ммоль, 1,74 мл) в диметилсульфоксиде (10 мл) нагревают при 100oC. Через 21 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый остаток очищают вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей перекристаллизацией из этилацетата и получением 1,05 г (38%) указанного соединения очень слабо-зеленого цвета, т.пл. 190-192oC.
ИК (KBr), см-1: 3456, 3169, 3084, 3024, 1565, 1533, 1506, 1214.
1H-ЯМР (300 МГц, CDCl3), δ : 10,92 (c, 1H), 10,08 (c, 1H), 7,33-7,2 (м, 5H), 6,31 (c, IH), 4,04-3,98 (м, 2H), 3,01 (т, J = 6,9 Гц, 2H) 2,17 (c, 3H).
МС(EI), m/e: 277 (M+).
УФ (EtOH): 293 нм (ε = 18119), 258 нм (ε = 10137), 204 нм (ε = 18979).
Найдено, % : C 56,53; H 5,53; N 15,18.
C13H15N3S2
Вычислено,%: C 56,29; H 5,45; N 15,18.
Пример 13. N-(2-Фенэтил)-N'-[2-(4-этилглиоксилат)тиазолил)]тиомочевина.

Раствор 2-фенэтилизотиоцианата (626 г, 20 ммоль, 3 мл) и этил-2-амино-4-тиазоглиоксилата (4 г, 20 ммоль) в диметилсульфоксиде (20 мл) нагревают при 110oC. Спустя 68 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (5х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый продукт очищают вытеснительной хроматографией на силикагеле (10% этилацетата в дихлорметане) и после обработки обесцвечивающим углем получают 2,37 г(33%) указанного соединения в виде светло-желтого вещества. Образец продукта перекристаллизован из этилацетата, т. пл. 168-169oC.
ИК (KBr), см-1: 3174, 3029, 1724, 1685, 1558, 1530, 1215, 1133, 1054.
1H-ЯМР (300 МГц, CDCl3), δ: 10,67 (с, 1H), 8,21 (c, 1H), 7,34-7,1 (м, 5H), 4,39 (к, J=7,17 Гц, 2H), 3,96-3,85 (м, 2H), 3,09-2,93 (м, 2H), 1,4 (т, J=7,1 Гц, 3H).
MC (FD), m/e: 363 (M+).
УФ (EtOH): 284 нм ( ε =18549), 255 нм ( ε =17141), 204 нм ( ε =23447).
Найдено,%: C 53,08; H 4,80; N 11,55-
C16H17N3O3S2
Вычислено,%: C 52,97; H 4,71; N 11,56.
Пример 14. N-(2-Фенэтил)-N'-[2-(5,6-диметил)бензотиазолил)]тиомочевина.

Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-5,6-бензотиазола (3,57 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Через 24 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат с образованием осадка. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (2х) и рассолом. Органический слой фильтруют и ополаскиванием полученного твердого продукта (3 г) 20% этанола в этилацетате получают 2,91 г (43%) указанного соединения в виде бледно-желтого вещества, т.пл. 226-228oC.
ИК (KBr), см-1: 3178, 3047, 1557, 1530, 1462, 1254, 1220.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,69 (c, 1H), 10,3 (c, 1H), 7,55 (c, 1H), 7,35-7,16 (м, 6H), 3,8-3,73 (м, 2H), 2,9 (т, J=7 Гц, 2H), 2,25 (с, 3H), 2,23 (c, 3H).
MC (EI), m/e: 341 (M+).
УФ (EtOH), нм: 307, 253, 204.
Найдено,%: C 63,15; H 5,63; N 12,14
C18H19N3S2
Вычислено, %: C 63,31; H 5,61; N 12,31.
Пример 15. N-(2-Фенэтил)-N'-[2-(6-метоксибензотиазолил)]тиомочевина.
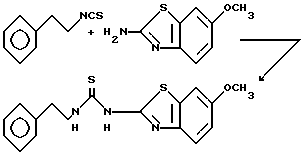
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-6-метоксибензотиазола (3,6 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Через 16 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3х) и рассолом. Фильтрованием органического слоя получают 550 мг указанного соединения. Концентрированием фильтрата и перекристаллизацией полученного твердого остатка из этилацетата получают еще 830 мг указанного соединения. Общий выход 1,38 г (20%) указанного соединения в виде рыхлого белого вещества, т. пл. 217-218oC.
ИК (KBr), см-1: 3182, 3050, 1556, 1534, 1473, 1437, 1221, 1055.
1H-ЯМР (300 МГц, CDCl3), δ : 10,99 (c, 1H), 9,29 (c, 1H), 7,46-6,99 (м, 8H), 4,12-4,06 (м, 2H), 3,86 (c, 3H), 3,08 (т, J=6,8 Гц, 2H).
MC (FD), m/e: 343 (M+).
УФ (EtOH): 312 нм ( ε =22725), 251 нм ( ε =11152), 204 нм ( ε =26183).
Найдено, %: C 59,21; H 4,97; N 12,19.
C17H17N3OS2
Вычислено, %; C 59,45; H 4,99; N 12,33.
Пример 16. 2-Амино-4-цианотиазол.

К раствору этилового эфира [2-(триэтиламино)тиазол-4-ил]-(Z)-гидроксииминоуксусной кислоты (11,46 г, 26,7 ммоль) в N,N-диметилформамиде (100 мл) добавляют этиловый эфир 1,2-дигидро-2-этокси-1-хинолинкарбоновой кислоты (6,68 г, 27 ммоль) и перемешивают 6 ч при комнатной температуре. Реакционную смесь переносят в этилацетат, промывают 1 н. соляной кислотой (2х), водой (3х) и рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Полученную белую пену (9,9 г) растворяют в дихлорметане (300 мл), обрабатывают триэтиламином (12,44 г, 107 ммоль, 17 мл) и трифторуксусной кислотой (25 мл) и перемешивают 2,5 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме, растворяют в этилацетате, промывают насыщенным раствором бикарбоната натрия и рассолом, сушат над сульфатом натрия и концентрируют. Очисткой полученного твердого продукта вытеснительной хроматографией на силикагеле (этилацетат/гексан, 1:1) получают 2,75 г (82%) указанного соединения в виде белого вещества, т.пл. 154-156oC.
ИК (KBr), см-1: 3416, 3291, 3118, 2234, 1638, 1547, 1315, 1108.
1H-ЯМР (300 МГц, CDCl3), δ: 7,23 (с, 1H), 5,19 (уш. с, 2H).
МС (FD), m/e: 125 (M+).
УФ (EtOH): 278 нм ( ε =4359), 235 нм ( ε =4047), 210 нм ( ε =16728).
Найдено, %: C 38,65; H 2,46; N 33,24.
C4H3N3S
Вычислено, %: C 38,39; H 2,42; N 33,57.
Пример 17. N-(3-Фенилпропил)-N'-(2-тиазолил)тиомочевина.
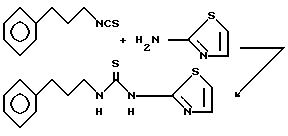
Раствор 3-фенилпропилизотиоцианата (500 мг, 2,82 ммоль) и 2-аминотиазола (300 мг, 3 ммоль) в N,N-диметилформамиде (10 мл) нагревают при 100oC. Спустя 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый остаток очищают вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) и последующей перекриcталлизацией из этилацетата получают 129 мг указанного соединения. Перекристаллизацией второй партии из смеси этилацетат/гексан (1:1) получают 110 мг указанного соединения. Общий выход этого соединения в виде снежно-белого вещества 239 мг (30%). Образец продукта вновь перекристаллизован из этилацетата, т. пл. 126,5-127,5oC.
ИК (KBr), см-1: 3166, 3022, 1574, 1523, 1502, 1215, 1166.
1H-ЯМР (300 МГц, CDCl3), δ : 10,88 (c, 1H), 10,42 (c, 1H), 7,37-7,15 (м, 6H), 6,82 (д, J= 3,6 Гц, 1H), 3,82-3,71 (м, 2H), 2,74 (т, J=7,7 Гц, 2H), 2,12-2,01 (м, 2H).
MC (FD), m/e: 277 (М+).
УФ (EtOH): 288 нм ( ε =19598), 256 нм ( ε =11329), 206 нм ( ε =19259).
Найдено, %: C 56,29; H 5,38; N 15,00.
C13H15N3S2
Вычислено, %: C 56,29; H 5,45; N 15,15.
Пример 18. N-(2-Фенэтил)-N'-[2-(6-этоксибензотиазолил)]тиомочевина.
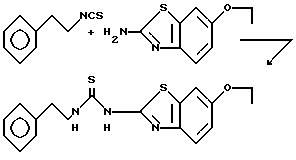
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-6-этоксибензотиазола (3,88 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Спустя 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией полученного твердого остатка из этилацетата получают 649 мг (9%) указанного соединения в виде вещества цвета загара т. пл. 204-205oC.
ИК (KBr), см-1: 3166, 3022, 1523, 1502, 1435, 1215.
1H-ЯМР (300 МГц, CDCl3), δ : 11,01 (c, 1H), 9,77 (c, 1H), 7,43-6,95 (м, 8H), 4,08-4,01 (м, 4H), 3,06 (т, J=6,6 Гц, 2H), 1,43 (т, J=6,8 Гц, 3H).
MC (FD), m/e: 357 (М+).
УФ (EtOH): 312 нм ( ε =23035), 251 нм ( ε =11355), 204 нм ( ε =26891).
Найдено, %: C 60,21; H 5,10; N 11,52.
C18H19N3OS2
Вычислено, %: C 60,48; H 5,36; N 11,75.
Пример 19. N-(2-Фенэтил)-N'-[2-(4-трет-бутилтиазолил)]тиомочевина.

Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-трет-бутилтиазола (3,13 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Через 64 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией полученного твердого остатка из этилацетата получают 2,98 г (47%) указанного соединения в виде снежно-белых кристаллов, т.пл. 173,5 - 175oC.
ИК (KBr), см-1: 3173, 2960, 1576, 1514, 1465, 1348, 1204, 1098.
1H- ЯМР (300 МГц, CDCl3), δ : 11,14 (с, 1H), 10,26 (c, 1H), 7,31-7,18 (м, 5H), 6,33 (с, 1H), 4,05-3,99 (м, 2H), 3,04 (т, J = 7,1 Гц, 2H), 1,14 (с, 9H).
МС (FD), m/e: 319 (M+).
УФ (EtOH): 292 нм ( ε = 20804), 257 нм ( ε = 10502), 203 нм ( ε = 19085).
Найдено,%: C 59,95; H 6,66; N 13,15.
C16H21N3S2
Вычислено,%: C 60,15; H 6,63; N 13,15.
Пример 20. N-(2-Фенэтил)-N'-[2-(4-трифторметилтиазолил)]тиомочевина.

Раствор 2-фенэтилизотиоцината (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-трифторметилтиазола (3,84 г, 20 ммоль) в N, N-диметилформамиде (50 мл) нагревают при 100oC. Через 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (3x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией твердого остатка из смеси этилацетата с гексаном (1:1) получают 846 мг (13%) указанного соединения в виде белого вещества, т.пл. 162-163oC.
ИК (KBr), см-1: 3166, 3033, 1562, 1516, 1469, 1242, 1126.
1H-ЯМР (300 МГц, CDCl3), δ: 10,49 (с, 1H), 10,31 (с, 1H), 7,33-7,19 (м, 6H), 4,01-3,95 (м, 2H), 3,02 (т, J = 6,9 Гц, 2H).
МС (FD), m/e: 331 (M+).
УФ (EtOH): 286 нм ( ε = 14352), 258 нм ( ε 14149), 205 нм ( ε = 24571).
Найдено,%: C 47,34; H 3,85; N 12,72.
C13H12F3N3S2
Вычислено,%: C 47,12; H 3,65; N 12,68.
Пример 21. N-(2-Фенэтил)-N', N'-диметилтиомочевина.

Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммолей, 3 мл) и 2-амино-5-хлортиазола (2,69 г, 20 ммоль) в N, N-диметилформамиде (50 мл) нагревают при 100oC. Спустя 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой и рассолом (3x). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей двукратной перекристаллизацией из этилацетата получают 606 мг (14%) указанного соединения в виде снежно-белых кристаллов, т.пл. 104,5-105,5oC.
ИК (KBr), см-1: 3284, 1536, 1452, 1347, 901.
1H-ЯМР (300 МГц, CDCl3), δ : 7,33-7,19 (м, 5H), 5,37 (уш.с, H1), 3,93-3,87 (м, 2H), 3,16 (с, 6H), 2,93 (т, J = 6,8 Гц, 2H).
МС (FD), m/e: 208 (M+).
УФ (EtOH): 242 нм ( ε = 12899), 210 нм ( ε = 21286).
Найдено,%: C 63,39; H 7,80; N 13,67.
C11H16N2S
Вычислено,%: C 63,42; H 7,74; N 13,45.
Пример 22. N-(2-Фентэтил)-N'-[2-(4-цианотиазолил)]тиомочевина.
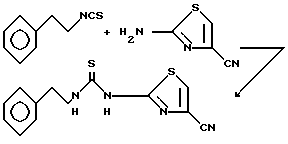
Раствор 2-фенэтилизотиоцината (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-цианотиазола (2,5 г, 20 ммоль) в N, N-диметилформамиде (50 мл) нагревают при 100oC. Спустя 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают насыщенным раствором бикарбоната натрия, водой (3x) и рассолом. Органичекий слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого продукта вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан (1:1) получают 132 мг (2%) указанного соединения в виде белого вещества, т.пл. 169-170oC.
ИК (KBr), см-1: 3166, 3022, 1574, 1523, 1502, 1215, 1166.
1H-ЯМР (300 МГц, CDCl3), δ : 10,88 (с, 1H), 10,09 (с, 1H), 7,5 (с, 1H), 7,39-7,23 (м, 5H), 4,00-3,93 (м, 2H), 3,02 (т, J = 6,9 Гц, 2H).
МС (FD), m/e: 288 (M+).
УФ (EtOH): 288 нм ( ε = 11104), 258 нм ( ε = 17433), 208 нм ( ε = 31355).
Найдено,%: C 54,04; H 4,23; N 19,73.
C13H12N4S2
Вычислено,%: C 54,14; H 4,19; N 19,43.
Пример 23. N-(2-Фенэтил)-N'-{2-[4-(4-пиридил)тиазолил]}тиомочевина.
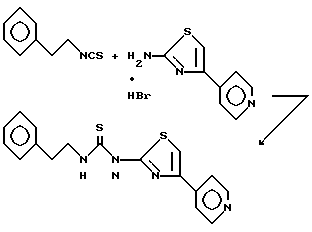
В хлористом метилене образуют взвесь 2-амино-4-(4-пиридил)тиазола гидробромида (1,2) и встряхивают с насыщенным раствором гидрокарбоната натрия. Cлои разделяют и водный слой промывают хлористым метиленом и этилацетатом. Объединенные органические слои концентрируют, к полученному твердому продукту (1 г, 5,6 ммоль) добавляют 2-фенэтилизотиоцианат (0,9 г, 5,6 ммоль, 0,83 мл) в N, N-диметилформамиде (12,5 мл) и образовавшуюся суспензию нагревают при 100oC. Спустя 20,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (4x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией полученного твердого остатка из этилацетата (3x) получают 133 мг (7%) указанного соединения, т.пл. 196oC.
ИК (KBr), см-1: 3250, 2939, 1723, 1604, 1506, 1223, 670, 664.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,72 (с, 1H), 9,21 (уш.с, 1H), 8,54 (д, J = 6 Гц, 2H), 7,82 (с, 1H), 7,63 (д, J = 6 Гц, 2H), 7,3-7,15 (м, 5H), 3,84-3,77 (м, 2H), 2,89 (т, J = 7 Гц, 2H).
МС (FD), m/e: 340 (M+).
МСВР (FAB), m/e: (M+) выч. 341,0895, набл. 341,0909.
УФ (EtOH): 294 нм ( ε = 23935), 231 нм ( ε = 16356), 203 нм ( ε = 25793).
1. Nielsen A.T. и Platt E.N. Heterocyclic Chem., 1969, т. 6 с. 896.
2. Brown, Cowden, Grigg, Kavulak Aust. J. Chem,. 1980, 33, 2291.
Пример 24. N-(2-Фенэтил)-N'-{2-[4-(4-бифенил)тиазолил]}тиомочевина.
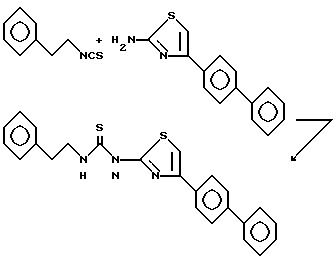
Раствор 2-фенэтилизотиоциааната (0,82 г, 5 ммоль, 0,75 мл) и 2-амино-4-(4-бифенил)тиазола (1,26 г, 5 ммоль) в N,N-диметилформамиде (12,5 мл) нагревают при 100oC. Через 19,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органический раствор промывают 1 н. соляной кислотой, смесь отфильтровывают, фильтрат разделяют и органическую фазу промывают насыщенным раствором бикарбоната натрия, водой (4x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой продукта вытеснительной хроматографией на силикагеле (от 1% этилацетата в дихлорметане до 2% этилацетата в дихлорметане) получают 372 мг (18%) указанного соединения. Вещество желтого цвета перекристаллизовано из этилацетата, т.пл. 208,5 - 209oC.
ИК (KBr), см-1: 3437, 3172, 30229, 1570, 1553, 1511, 1211, 1060, 738.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,72 (с, 1H), 9,54 (уш.с, 1H), 7,86-7,8 (м, 2H), 7,78-7,68 (м, 4H),7,58 (с, 1H), 7,52 - 7,44 (м, 2H), 7,41 - 7,35 (м, 1H), 7,34 - 7,29 (м, 4H), 7,27 - 7,2 (м, 1H), 3,92 - 3,84 (м, 2H), 2,98 (т, J = 3 Гц, 2H).
МС (FD), m/e: 415 (М+).
УФ (EtOH), нм: 293, 212.
Найдено, %: C 69,08; H 5,10; N 9,99.
C24H21N3S2.
Вычислено, %: C 69,36; H 5,09; N 10,11.
Пример 25. N-(2-Фенэтил)-N'-{2-[4-(1-<1-этоксикарбонил>-(3-трет- бутоксикарбонилметокси)имино)тиазолил]}тиомочевина.

Смесь 2-амино-4-[1-(1-этоксикарбонил)-(3-трет-бутоксикарбонилметокси)имино] тиазола (2,64 г, 8 ммоль) и 2-фенэтилизотиоцианата (1,31 г, 8 ммоль, 1,2 мл) в N,N-диметилформамиде (20 мл) нагревают при 100oC. Спустя 24 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Ополаскиванием полученного твердого остатка этилацетатом получают 801 мг (20%) указанного соединения, т. пл. 188,5oC.
ИК (KBr), см-1: 3293, 2975, 1749, 1594, 1543, 1453, 1382, 1231, 1154, 1054, 748, 698.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,85 (с, 1H), 8,46 (уш.с, 1H), 7,29 - 7,17 (м, 5H), 4,59 (с, 2H), 4,31 - 4,24 (к, J = 7,1 Гц, 2H), 3,7 - 3,64 (м, 2H), 2,82 (т, J = 7,1 Гц, 2H), 1,36 (с, 9H), 1,23 (т, J = 7,1 Гц, 3H).
МС (FD), m/e: 492 (М+).
УФ (EtOH) : 292, 257 нм ( ε = 16356), 203 нм.
Найдено,%: C 53,67; H 5,83; N 11,34.
C22H28N4O5S2
Вычислено, %: С 53,64; H 5,73; N 11,37.
Пример 26. N-(2-Фенэтил)-N'-{2-[4-(трет-бутил-5-метил)тиазолил]} тиомочевина.

Смесь 2-амино-2-трет-бутил-5-метилтиазола (1,87 г, 11 ммоль) и 2-фенэтилизотиоцианата (1,8 г, 11 ммоль) в N,N-диметилформамиде (25 мл) нагреваают при 100oC. Спустя 18,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Промывкой полученного твердого остатка эфиром получают 1,02 г (28%) указанного соединения, т.пл. 153 - 153,5oC.
ИК (KBr), см-1: 3171, 2966, 1474, 1534, 1510, 1455, 1346, 1221, 1186, 755, 704.
1H-ЯМР (300 Мгц, ДMCO-d6), δ : 11,28 (уш.с, 1H), 9,9 (уш. с, 1H), 7,28 - 7,14 (м, 5H), 3,78 - 3,34 (м, 2H), 2,84 (т, J = 7 Гц, 2H), 2,27 (c, 3H), 1,16 (c, 9H).
МС (FD), m/e: 333 (М+).
УФ (EtOH): 297 нм ( ε = 19835), 257 нм ( ε = 9954), 202 нм ( ε = 21059).
Найдено, %: C 61,42; H 6,92; N 12,55.
C17H23N3S2
Вычислено,%: C 61,22; H 6,95; N 12,60.
Пример 27. N-(2-Фенэтил)-N'-{ 5-метил-[2-(1,3,4-тиадиазолил)]}тиомочевина.
Раствор 2-амино-2-метил-1,3,4-тиадиазола (2,3 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 18 ч при 100oC.
Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией полученного твердого остатка из этилацетата получают 1,86 г (33%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3323, 3031, 1640, 1540, 1444, 1385, 781, 697, 652.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 12,4 (уш.с, 1H), 8,75 (уш.с, 1H), 7,4 - 7,2 (м, 5H), 3,85 - 3,75 (м, 2H), 2,9 (т, J = 7 Гц, 2H), 2,54 (с, 3H).
МС (FD), m/e: 278 (М+).
УФ (EtOH): 280 нм ( ε = 10188), 253 нм ( ε = 11849), 205 нм ( ε = 19724).
Пример 28. N-(2-Фенэтил)-N'-(2-пиримидинил)тиомочевина.
Раствор 2-аминопиримидина (1,9 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 40 ч при 120oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией полученного твердого остатка дважды из этилацетата получают 0,9 г (17%) указанного соединения в виде белых игл.
ИК (KBr), см-1: 3325, 1588, 1524, 1434, 1415, 1333, 1228, 1154, 797.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,25 (уш.с, 1H), 10,65 (уш.с, 1H), 8,6 (д, J = 5 Гц, 2H), 7,4 - 7,2 (м, 6H), 3,85 - 3,75 (м, 2H), 2,9 (т, J = 7 Гц, 2H).
МС (FD), m/e: 258 (М+).
УФ (EtOH) : 286 нм ( ε = 17644), 267 нм ( ε = 15834), 244 нм ( ε = 12312), 205 нм ( ε = 21839).
Найдено, %: C 60,15; H 5,48; N 21,89.
C13H14N4S
Вычислено,%: C 60,44; H 5,46; N 21,69.
Пример 29. N-(2-Фенэтил)-N'-{2-[4-(4-хлорфенил)тиазолил]}тиомочевина.
Раствор 2-фнилэтилтизотиоцианата (0,77 г, 4,75 ммоль) и 2-амино-4-(4-хлорфенил)тиазола (1 г, 4,75 ммоль) в N,N-диметилформамиде (10 мл) нагревают 20 ч при 120oC. Растворитель удаляют в вакууме и перекристаллизацией полученного твердого остатка из этилацетата получают 0,3 г (17%) указанного соединения в виде желтого твердого вещества.
ИК (KBr), см-1: 3176, 3029, 1579, 1515, 1231, 737, 698.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,7 (уш.с, 1H), 9,4 (уш.с, 1H) 7,74 - 7,54 (м, 5H), 7,36 - 7,18 (м, 5H), 3,9 - 3,8 (м, 2H), 2,96 (т, J = 6 Гц, 2H).
MC (FD), m/e: 373 (M+).
УФ (EtOH): 274 нм ( ε = 35089), 247 нм ( ε = 21894), 202 нм ( ε = 22213).
Найдено,%: C 57,55; H 4,24; N 11,26.
C18H16N3S2Cl
Вычислено, %: C 57,82; H 4,31; N 11,24.
Пример 30. N-2-(Фенэтил)-N'-[2-(6-хлор)бензотиазолил]тиомочевина.
Раствор 2-фэнэтилизотиоцианата (3,26 г, 20 ммоль) и 2-амино-2-хлорбензотиазола (3,69 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают 24 ч при 120oC. Растворитель удаляют в вакууме и перекристаллизацией полученного твердого остатка из этилацетата получают 3,68 г (53%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3165, 3021, 1574, 1522, 1501, 1289, 1215.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 12 (уш.с, 1H), 9,8 (уш.с,1H), 8,1-7,2 (м, 8H), 3,85 (м, 2H), 2,95 (т, J= 7 Гц, 2H).
МС (FD), m/e: 347 (M+).
УФ (EtOH), нм: 304, 292, 248, 220, 205.
Пример 31. N-(2-Фенэтил)-N'-{5-этил[2-(1,3,4-тиадиазолил)]}тиомочевина.
Раствор 2-амино-5-этил-1,3,4-тиадиазола (2,58 г, 20 ммоль) и 2-фенэтилтиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 8 ч при 120oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией полученного твердого остатка и этилацетата получают 2,45 г (33%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3317, 1645, 1536, 1448, 1384, 783, 693, 651.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 12,4 (уш.с, 1H), 8,75 (уш.с, 1H), 7,4-7,2 (м, 5H), 3,85-3,75 (м, 2H), 3-2,8 (м, 4H), 1,25 (т, J = 7 Гц, 3H).
MC (FD), m/e : 292(M+).
УФ (EtOH): 281 нм ( ε =13028), 253 нм ( ε = 13615), 206 нм ( ε = 23674).
Пример 32. N-(2-Фенэтил)-N'-[4-(хлорфенил)]тиомочевина.
Раствор 4-хлоранилина (2,55 г, 20 ммоль) и 2-фенилизоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 18 ч при 120oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией полученного твердого остатка из этилацетата получают 2,5 г (26%) указанного соединения в виде желтого твердого вещества.
ИК (KBr), см-1: 3166, 3021, 1523, 1501, 1289, 1079, 802, 737, 695.
1Н-ЯМР (200 МГц, ДMCO-d6), δ : 9,6 (уш.с, 1H), 7,9 (уш.с, 1H), 7,5-7,2 (м, 9H), 3,8-3,65 (м, 2H), 3-2,8 (т, J = 7 Гц, 2H).
MC (FD), m/e: 290 (М+).
УФ (EtOH): 270 нм ( ε = 14107), 247 нм ( ε = 18128), 206 нм ( ε = 27795).
Найдено,%: C 62,19; H 5,46; N 9,87.
C15Н15N2SCl
Вычислено, %: C 61,95; H 5,20; N 9,63.
Пример 33. N-(2-Фенэтил)-N'-(3-хлорфенил)тиомочевина.
Раствор 3-хлоранилина (2,55 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 20 ч при 120oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Очисткой полученного желтого масла с помощью ВЭЖХ на силикагеле получают 0,95 г (16%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3310, 1591, 1542, 1495.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 9,85 (уш.с,1H), 7,9 (уш.с, 1H), 7,65-7,2 (м, 9H), 3,8-3,65 (м,2H), 3-2,8 (т, J = 7 Гц, 2H).
MC (FD), m/e: 290 (M+).
УФ (EtOH): 250 нм ( ε = 17296), 209 нм (ε = 29630).
Найдено,%: C 61,65; H 5,44; N 9,84.
С15С15N2SCl
Вычислено, %: C 61,95; H 5,20; N 9,63.
Пример 34. N-(н-Пропил)-N'-(2-тиазолил)тиомочевина.
Раствор 2-аминотиазола (2 г, 20 ммоль) и н-пропилизотиоцианата (2 г, 20 ммоль) в N, N-диметилформамиде нагревают 20 ч при 120oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Двукратной перекристаллизацией полученного желтого масла из этилацетата получают 0,42 г (10%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3179, 1556, 1514, 1471, 680.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 11,55 (уш.с, 1H), 9,7 (уш.с, 1H), 7,4 (д, J = 5 Гц, 1H), 7,1 (д, J = 5 Гц, 1H), 3,5 (м, 2H), 1,6 (м, 2H), 0,95 (т, J = 7 Гц, 3H).
MC (FD), m/e: 201 (M+).
УФ (EtOH): 288 нм ( ε = 19469), 256 нм ( ε = 10151), 202 нм ( ε = 11550).
Найдено,%: C 42,02; H 5,61; N 20,93.
C7H11N3S2
Вычислено, %: C 41,77; H 5,51; N 20,87.
Пример 35. N-(2-Фенэтил)-N'-[2-(4,5,6,7-тетрагидробензотиазолил)]тиомочевина.
Раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль) и 2-амино-4,5,6,7-тетрагидробензотиазола (1,54 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 48 ч при 120oC. Растворитель удаляют в вакууме и перекристаллизацией полученного твердого остатка из этилацетата получают 0,32 г (11%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3165, 3021, 2923, 1601, 1529, 1501, 1261, 1225.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 11,5 (уш.с, 1H), 10 (уш.с, 1H), 7,4-7,2 (м, 5H), 3,85 (м, 2H), 2,95 (т, J = 7 Гц, 2H), 2,6-2,4 (м, 4H), 1,75 (м, 4H).
MC (FD), m/e: 317 (M+).
УФ (EtOH): 229 нм ( ε = 11400), 258 нм ( ε = 6011), 207 нм ( ε = 10579).
Пример 36. N-(2-Фенилэтил)-N'-(2-бензотиазолил)тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-аминобензотиазола (3 г, 20 ммоль) в толуоле (50 мл) нагревают до кипения. Спустя 5 ч реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат, промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 1,8 г (29%) указанного соединения, т. пл. 203-207oC.
ИК (KBr), см-1: 3181, 3045, 1697, 1557, 1523, 1451, 1440, 1244, 749.
1Н-ЯМР (300 МГц, CDCl3/ДMCO-d6), δ : 11,7 (уш.с, 1 H), 10,6 (уш.с, 1H), 7,8-7,2 (м, 9H), 3,95 (м, 2H), 3,05 (т, J = 7 Гц, 2H).
MC (FD), m/e: 313 (M+).
УФ (EtOH): 300 нм ( ε = 24241), 207 нм ( ε = 28964).
Найдено, %: C 61,03; H 4,67; N 13,19.
C16H15N3S2
Вычислено, %: C 61,31; H 4,82; N 13,41.
Пример 37. N-(2-Фенэтил)-N'-[2-(4-метил)бензотиазолил]тиомочевина.
Раствор 2-фенэтилизотиоционата (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-метилбензотиазола (3,3 г, 20 ммоль) в толуоле (50 мл) нагревают до кипения. Спустя 5 ч реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристализацией остатка из этилацетата получают 1,68 г (26%) указанного соединения, т.пл. 185-188oC.
ИК (KBr), см-1: 3170, 3024, 1571, 1525, 1219, 767, 741, 698.
1Н-ЯМР (300 МГц, CDCl3/ДMCO-d6), δ : 11,4 (уш.с, 1H), 10,9 (уш.с, 1H), 7,6-7,1 (м, 8H), 4,05 (м, 2H), 3,05 (т, J = 7 Гц, 2H), 2,37 (с, 3H).
MC (FD), m/e: 327 (M+).
УФ (EtOH): 303 нм ( ε = 27416), 204 нм ( ε = 30294).
Найдено, %: C 62,56; H 5,37; N 12,77.
C17H17N3S2
Вычислено, %: C 62,35; H 5,23; N 12,83.
Пример 38. N-(2-Фенэтил)-N'-[2-(4-метокси)бензотиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-метоксибензотиазола (3,2 г, 20 ммоль) в N,N-диметилформамиде (20 мл) нагревают 24 ч при 115oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,97 г (14%) указанного соединения, т.пл. 205-207oC.
ИК (KBr), см-1: 3165, 3021, 1574, 1522, 1215, 736, 695, 655.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 12,4 (уш.с, 1H), 9,9 (уш.с, 1H), 7,6-7 (м, 8H), 3,9 (с, 3H), 3,85 (м, 2H), 2,95 (т, J = 7 Гц, 2H).
MC (FD), m/e: 343 (M+).
УФ (EtOH): 293 нм ( ε = 20046), 248 ( ε = 15731), 210 нм ( ε = 38172).
Пример 39. N-(2-Фенэтил)-N'-[2-(4-хлор)бензотиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-4-хлорбензотиазола (3,7 г, 20 ммоль) в N,N-диметилформамиде (20 мл) нагревают 24 ч при 115oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацей остатка из этилацетата получают 2,56 г (37%) указанного соединения, т. пл. 216 - 217oC.
ИК (KBr), см-1: 3166, 2940, 1568, 1527, 766, 733, 673.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 12,2 (уш. с, 1H), 9,3 (уш. с, 1H), 7,6 - 7 (м, 8H), 3,85 (м, 2H), 2,95 (т, J = 7 Гц, 2 Н).
МС (FD), m/e: 347 M+).
УФ (EtOH): 301 нм ( ε = 20046), 248 нм ( ε = 15731), 210 нм ( ε = 38172).
Пример 40. N-(2-Фенэтил)-N'-[3-(1,2,4-триазолил)]тиомочевина.
Раствор 3-амино-1,2,4-триазола (1,7 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (20 мл) нагревают 24 ч при 115oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,99 г (20%) указанного соединения, т.пл. 160 - 162oC.
ИК (KBr), см-1: 3160, 3061, 2872, 1581, 1535, 1467, 1167, 977, 743, 681.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 13,9 уш. с, 1H), 10,85 (уш. с, 1H), 10 (уш. с, 1H), 7,4 - 7,2 (м, 6H), 3,85 (м, 2H), 2, 96 (т, J = Гц, 2H).
МС (FD), m/e: 247 (M+).
УФ (EtOH): 261 нм ( ε = 21785), 229 нм ( ε = 11918), 206 нм ( ε = 17437).
Найдено,%: C 53,69; H 5,5; N 28,07.
C11H13N5S
Вычислено,%: C 53,42; H 5,3; N 28,32.
Пример 41. N-(2-Фенэтил)-N'-(3-хинолинил)тиомочевина.
Раствор 3-аминохинолина (2,9 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (20 мл) нагревают 72 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 3,62 г (59%) указанного соединения, т. пл. 162 - 164oC.
ИК (KBr), см-1: 3143, 1537, 1493, 1350, 1283, 1239, 749, 705.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 9,9 (уш. с, 1H), 8,87 (д, J = 4 Гц, 1H), 8,35 (уш. с, 1H), 8 (д, J = 8 Гц, 1H), 7,9 (д, J = 8 Гц, 1H), 7,7 - 7,2 (м, 8H), 3,8 (м, 3H), 2,95 (т, J = 7 Гц, 2H).
МС (FD), m/e: 308 (М+).
УФ (EtOH): 331 нм ( ε = 5945), 257 нм ( ε = 27215), 247 нм ( ε = 37613).
Пример 42. N-(2-Фенэтил)-N'-[2-(4-метил)пиримидинил]тиомочевина.
Раствор 2-аминопиримидина (1,9 г, 20 ммоль) и 2-фенэтилизотиоцианата (33,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (20 мл) нагревают 24 ч при 115oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 1,21 г (22%) указанного соединения, т. пл. 174 - 176oC.
ИК (KBr), см-1: 3184, 3034, 1561, 1409, 1344, 1291, 1165, 1030, 836, 792.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,3 (уш. с, 1H), 10,45 (уш. с, 1H), 8,4 (д, J = 5Гц, 2H), 7,4 - 7,2 (м, 5H), 7 (д, J = 5 Гц, 1H), 3,85 - 3,75 (м, 2H), 2,9 (т, J = 7 Гц, 2H), 2,3 (с, 3H).
МС (FD), m/e: 272 (M+).
УФ (EtOH): 274 нм ( ε = 25263), 248 нм ( ε = 15528), 203 нм ( ε = 17107).
Найдено,%: C 61,44; H 6,11; N 20,38.
C14H16N4S
Вычислено,%: C 61,74; H 5,92; N 20,57.
Пример 43. N-(2-Фенэтил)-N'-{2-[4-(4-фторфенил)тиазолил]}тиомочевина.
Раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль), триэтиламина (1,01 г, 10 ммоль) и гидройодида 2-амино-4-(4-фторфенил)тиазола (3,2 г, 10 ммоль) в N, N-диметилформамиде (20 мл) нагревают 24 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 1,06 г (30%) указанного соединения, т.пл. 224 - 228oC.
ИК (KBr), см-1: 3178, 3030, 1553, 840, 737, 670.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,7 (уш. с, 1H), 9,5 (уш. с, 1H), 7,8 - 7,2 (м, 10H), 3,9 - 3,81 (м, 2H), 2,95 (т, J = 6 Гц, 2H).
МС (FD), m/e: 357 (M+).
УФ (EtOH): 282 нм ( ε = 15755), 264 нм ( ε = 17277, 239 нм ( ε = 13046), 209 нм ( ε = 18271).
Найдено,%: C 60,79; H 4,48; N 11,63.
C18H16N3S2F
Вычислено,%: C 60,42; H 4,48; N 11,74.
Пример 44. N-(2-Фенэтил)-N'-[2-(4-тиазолилуксусная кислота)]тиомочевина метиловый эфир.
Раствор 2-фенэтилизотиоцианата (0,82 г, 5 ммоль) и метилового эфира 2-аминотиазолуксусной кислоты (0,85 г, 5 ммоль) в N,N-диметилформамиде (20 мл) нагревают 72 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,52 г (31%) указанного соединения, т.пл. 125 - 127oC.
ИК (KBr), см-1: 3168, 3085, 1740, 1557, 1524.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,6 (уш. с, 1H), 9,4 (уш. с, 1H), 7,4 - 7,2 (м, 5H), 6,85 (с, 1H), 3,8 (м, 2H), 3,65 ( с, 2H), 3,6 (с, 3H), 2,9 (т, J = 7 Гц, 2H).
МС (FD), m/e: 335 (M+).
УФ (EtOH): 291 нм ( ε = 19133), 258 нм ( ε = 10917), 202 нм ( ε = 21433).
Найдено,%: C 53,96; H 5,16; N 12,79.
C15H17N3S2O2
Вычислено,%: C 53,71; H 5,11; N 12,53.
Пример 45. N-(2-Фенэтил)-N'-(2-тиазолил)тиомочевина.
Раствор 2-фенэтилизотиоцианата (7,5 г, 45,9 ммоль) и 2-аминотиазола (4,6 г, 45,9 ммоль) в N,N-диметилформамиде (100 мл) нагревают 12 ч при 115oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка дважды из этилацетата получают 5,7 г (47%) указанного соединения.
ИК (KBr), см-1: 3187, 3033, 2978, 1569, 1515, 1470, 1454, 1216, 1170, 1063.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,6 (уш. с, 1H), 9,7 (уш. с, 1H), 7,4 - 7,2 (м, 6H), 7,1 (д, J = 3 Гц, 1H), 3,8 (м, 2H), 2,9 (т, J = 7 Гц, 2H).
МС (FD), m/e: 263 (M+).
УФ (EtOH): 288 нм ( ε = 19656), 257 нм ( ε = 11658), 203 нм ( ε = 20054).
Найдено,%: C 54,63; H 5,02; N 15,85.
C12H13N3S2
Вычислено,%: C 54,72; H 4,97; N 15,95.
Пример 46. N-[2-(1-Циклогексенил)этил]-N'-(2-тиазолил)тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (3,3 г, 20 ммоль) и 2-аминотиазола (2 г, 20 ммоль) в N,N-диметилформамиде (20 мл) нагревают 24 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,66 г (50%) указанного соединения, т. пл. 147 - 148oC.
ИК (KBr), см-1: 3170, 3118, 2989, 1566, 1513, 1180, 706.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,6 (уш. с, 1H), 9,7 (уш. с, 1H), 7,38 (д, J = 3 Гц, 1H), 7,1 (д, J = 3 Гц, 1H), 5,45 (уш. с, 1H), 3,65 (м, 2H), 2,25 (т, J = 7 Гц, 2H), 1,9 (м, 4H), 1,5 (м, 4H).
МС (FD), m/e: 267 (M+).
УФ(EtOH): 288 нм ( ε = 19663), 256 нм ( ε = 10534), 201 нм ( ε = 14819).
Найдено,%: C 54,15; H 6,52; N 15,84.
C12H13N3S2
Вычислено,%: C 53,89; H 6,41; N 15,71.
Пример 47. N-(2-Фенэтил)-N'-[2-(4-тиазолил)уксусная кислота]тиомочевина этиловый эфир.
Раствор 2-фенэтилизотиоцианата (3,62 г, 20 ммоль) и этилового эфира 2-аминотиазолуксусной кислоты (3,72 г, 20 ммоль) в N,N-диметилформамиде (20 мл) нагревают 24 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ силикагеля получают 1,7 г (24%) указанного соединения, т. пл. 80 - 83oC.
ИК (KBr), см-1: 3184, 3109, 1730, 1580, 704.
1H-ЯРМ (300 МГц, ДMCO-d6), δ : 11,6 (уш.с, 1H), 9,4 (уш.с, 1H), 7,4-7,2 (м, 5H), 6,85 (c, 1H), 4,1 (к, J = 7 Гц, 2H), 3,8 (м, 2H), 3,65 (c, 2H), 2,9 (т, J = 7 Гц, 2H), 1,2 (т, J = 7 Гц, 3H).
MC (FD), m/e: 349 (M+).
УФ (EtOH): 291 нм ( ε = 15025), 250 нм ( ε = 10893), 203 нм ( ε = 24071).
Найдено, %: C 55,24; H 5,62; N 11,96.
C16H19N3S2O2
Вычислено, %: C 54,99; H 5,48; N 12,02.
Пример 48. N-(2-Фенэтил)-N'-[2-(4-тиазолил)уксусная кислота]тиомочевина.
Раствор этилового эфира N-(2-фенэтил)-N'-[2-(4-триазолил)уксусная кислота] тиомочевины (0,7 г, 2 ммоль) и 1 н. NaOH (2,5 мл, 2,5 ммоль) в 50 мл смеси ацетонитрил/вода (1: 1) перемешивают 24 ч при комнатной температуре. Реакционную смесь переносят в этилацетат и промывают насыщенным раствором бикарбоната натрия. Водный раствор подкисляют 1 н. HCl до pH 2 и экстрагируют этилацетатом. Органические экстракты промывают рассолом и концентрируют. Перекристаллизацией остатка из этилацетата получают 0,29 г (45%) указанного соединения, т.пл. 188-190oC.
ИК (KBr), см-1: 3200-2800 (широкая полоса), 1659, 1586, 1377, 671.
-1H-ЯРМ (300 МГц, ДMCO-d6), δ : 12 (уш.с, 1H), 9,6 (уш. с, 1H), 7,4-7,2 (м, 5H), 6,85 (c, 1H), 3,8 (м, 2H), 3,65 (c, 2H), 2,9 (т, J = 7 Гц, 2H).
MC (FD), m/e: 322 (M+).
УФ (EtOH): 291 нм ( ε = 19464), 257 нм ( ε = 10601), 202 нм ( ε = 20306).
Найдено, %: C 52,58; H 4,88; N 13,34.
C14H15N3S2O2
Вычислено, %: C 52,32; H 4,70; N 13,07.
Пример 49. N-(Бензил)-N'-(2-тиазолил)тиомочевина.
Раствор бензилизотиоцианата (1,5 г, 10 ммоль) и 2-аминотиазола (1 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 12 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и двукратной перекристаллизацией остатка из этилацетата получают 1,15 г (46%) указанного соединения, т.пл. 165-167oC.
ИК (KBr), см-1: 3171, 3038, 1560, 1509, 1451, 1183, 972, 691.
1H-ЯРМ (300 МГц, ДMCO-d6), δ : 11,7 (уш.с, 1H), 9,9 (уш.с, 1H), 7,4-7,2 (м, 6H), 7,05 (д, J = 3 Гц, 1H), 4,8 (м, 2H).
MC (FD), m/e: 249 (M+).
УФ (EtOH): 289 нм ( ε = 19103), 257 нм ( ε = 12196), 204 нм ( ε = 21328).
Найдено, %: C 53,09; H 4,50; N 16,77.
C11H11N3S2
Вычислено, %: C 52,99; H 4,47; N 16,85.
Пример 50. N-(2-Фенэтил)-N'-(2-пиразинил)тиомочевина.
Раствор 2-аминопиразина (1,9 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 17 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и двукратной перекристаллизацией остатка из этилацетата получают 0,95 г (18%) указанного соединения, т.пл. 142-143oC.
ИК (KBr), см1: 3181, 3049, 1606, 1533, 1472, 1314, 1221, 862, 725.
-1H-ЯРМ (300 МГц, ДMCO-d6), δ : 11,02 (уш.с, 1H), 10,95 (уш.с, 1H), 8,5 (с, 1H), 8,18 (д, J = 2 Гц, 1H), 8,05 (д, J = 2 Гц, 1H), 7,4-7,2 (м, 5H), 3,85-3,75 (м,2H), 2,9 (т, J = 7 Гц, 2H).
MC (FD), m/e: 258 (M+).
УФ (EtOH): 318 нм ( ε = 10579), 263 нм ( ε = 17922), 202 нм ( ε = 15887).
Найдено, %: C 60,45; H 5,63; N 22,02.
C14H14N4S
Вычислено, %: C 60,44; H 5,46; N 21,69.
Пример 51. N-(2-Фенэтил)-N'-(3-пиразолил)тиомочевина.
Раствор 2-аминопиразола (1,66 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 200 ммоль, 3 мл) в N,N,-диметилформамиде (50 мл) нагревают 18,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и двукратной перекристаллизацией остатка из этилацетата получают 2,38 г (48%) указанного соединения, т.пл. 142-144oC.
ИК (KBr), см-1: 3397, 3207, 3078, 1576, 1537, 1255, 1182, 751.
1H-ЯРМ (300 МГц, ДMCO-d6), δ : 12,4 (уш.с, 1H), 10,35 (уш.с, 1H), 9,85 (уш.с,1H), 7,6 (с,1H), 7,4-7,2 (м, 5H), 5,83(c, 1H), 3,75 (м,2H), 2,85 (т, J = 7 Гц, 2H).
MC (FD), m/e: 246 (M+).
УФ (EtOH): 264 нм ( ε = 21473), 204 нм ( ε = 17842).
Найдено, %: C 58,80; H 5,83; N 23,00.
C12H14N4S
Вычислено, %: C 58,51; H 5,73; N 22,74.
Пример 52. Получение N-(2-фенэтил)-N'-(фенил)тиомочевина.
Раствор анилина (1,86 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 18 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из смеси этиловый эфир/гексан получают 2,88 г (56%) указанного соединения, т.пл. 102-104oC.
ИК (KBr), см-1: 3375, 1592, 1542, 1483, 1250, 1000, 695.
1H-ЯРМ (300 МГц, CDCl3), δ : 7,85 (уш.с, 1H), 7,5-7 (м, 10H), 6 (уш.c, 1H), 3,9 (м,2H), 2,9 (т, J = 7 Гц, 2H).
MC (FD), m/e: 256 (M+).
УФ (EtOH): 248 нм ( ε = 15081), 206 нм ( ε = 25573).
Найдено, %: C 70,14; H 6,37; N 10,97.
C15H16N2S
Вычислено, %: C 70,28; H 6,29; N 10,93.
Пример 53. N-(Этил)-N'-(2-тиазолил)тиомочевина.
Раствор этилизотиоцианата (1,74 г, 20 ммоль) и 2-аминотиазола (2 г, 20 ммоль) в N, N-диметилформамиде нагревают 23 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и двукратной перекристаллизацией остатка из этилацетата получают 0,48 г (13%) указанного соединения, т.пл. 135-136oC.
ИК (KBr), см-1: 3165, 3021, 1574, 1501, 1435, 1366, 1215, 1179, 695.
1H-ЯРМ (300 МГц, ДMCO-d6), δ : 10,4 (уш.с, 1H), 7,4 (д, J = 3 Гц, 1H), 6,8 (д, J = 3 Гц, 1H), 3,7 (м,2H), 1,4 (т, J = 7 Гц, 3H).
MC (FD), m/e: 187 (M+).
УФ (EtOH): 287 нм ( ε = 19544), 256 нм ( ε = 10213), 202 нм ( ε = 11588).
Найдено, %: C 38,71; H 4,92; N 22,66.
C6H9N3S2
Вычислено, %: C 38,48; H 4,84; N 22,44.
Пример 54. N-(2-Фенэтил)-N'-(2-хлорфенил)тиомочевина.
Раствор 2-хлоранилина (2,55 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 17 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, водной 1 н. HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ на силикагеле получают 1,18 г (20%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3378, 3167, 1540, 1499, 1470, 1250, 1060, 758, 685.
1H-ЯРМ (300 МГц, ДMCO-d6), δ : 7,55 (уш.с, 1H), 7,5-7,2(м, 9H), 5,9 (уш. с,1H), 3,9 (м,2H), 2,9 (т, J = 7 Гц, 2H).
MC (FD), m/e: 290 (M+).
УФ (EtOH): 245 нм ( ε = 16042), 209 нм ( ε = 29276).
Найдено, %: C 61,69; H 5,28; N 9,84.
C15H15N2S
Вычислено, %: C 61,95; H 5,20; N 9,63.
Пример 55. N-(Бензил)-N'-[2-(5-хлор)тиазолил]тиомочевина.
Раствор бензилизотиоцианата (3 г, 20 ммоль) и 2-амино-5-хлортиазола (2,69 г, 20 ммоль) в N,N-диметилформамиде (25 мл) нагревают 20 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ на силикагеле получают 0,86 г (15%) указанного соединения, т.пл. 162-164oC.
ИК (KBr), см-1: 3154, 3003, 2958, 1588, 1515, 1421, 1231, 1192, 726.
1H-ЯРМ (300 МГц, ДMCO-d6), δ : 8,8 (уш.с, 1H), 7,45 (с,1H), 7,4-7,2 (м, 5H), 4,7 (м,2H).
MC (EI), m/e: 283 (M+).
УФ (EtOH): 295 нм ( ε = 6457), 259 нм ( ε = 5741), 208 нм ( ε = 11042).
Пример 56. N-(3-Фенилпропил)-N'[2-(5-хлор)тиазолил]тиомочевина.
Раствор 3-фенилпропилизотиоцианата (3,54 г, 20 ммоль) и 2-амино-5-хлортиазола (2,69 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Спустя 18 ч реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ на силикагеле получают 0,29 г (5%) указанного соединения, т.пл. 121-130oC.
ИК (KBr), см-1: 3160, 3100, 2949, 1565, 1517, 1493, 698.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 10,8 (c, 1H), 8,5 (уш. с, 1H), 7,4 (c, 1H), 7,3 (м, 5H), 3,5 (м, 2H), 2,6 (т, J=7,7 Гц, 2H), 1,8 (м, 2H).
MC (FD), m/e: 311 (M+).
УФ (EtOH): 295 нм ( ε =15069), 259 нм ( ε =12092), 205 нм ( ε =27316).
Найдено, %: C 50,17; H 4,51; N 13,42.
C13H14N3N3Cl
Вычислено, %: C 50,07; H 4,52; N 13,47.
Пример 57. N-(2-Фенэтил)-N'-(5-тетразолил)тиомочевина.
Раствор моногидрата 5-аминотетразола (2,06 г, 20 ммоль) и 2-фенилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в 50 мл N,N-диметилформамида нагревают 21 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и двукратной перекристаллизацией остатка из этилацетата получают 0,59 г (12%) указанного соединения, т.пл. 161-177oC.
ИК (KBr), см-1: 3451, 3235, 3148, 1547, 1511, 1169, 697.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 10,8 (c, 1H), 10,4 (м, 1H), 8,6 (уш. с, 1H), 7,2-7 (м, 5H), 3,8 (м, 2H), 2,8 (т, J=7 Гц, 2H).
MC (FD), m/e: 248 (M+).
УФ (EtOH): 258 нм ( ε =13630), 234 нм ( ε =15631), 204 нм ( ε =15594).
Пример 58. N-(2-Фенэтил)-N'-[2-(4-метил-5-ацетил)тиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (1,14 г, 7 ммоль) и 2-амино-4-метил-5-ацетилтиазола (1,09 г, 7 ммоль) в N,N-диметилформамиде (50 мл) нагревают 23 ч при 100oC. Реакционную смесь охлаждают до комнатной температуре, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и двукратной перекристаллизацией остатка из этилацетата получают 0,21 г (9%) указанного соединения.
ИК (KBr), см-1: 3314, 3060, 1694, 1610, 1555, 1507, 1372, 1233, 980, 667.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 12,5 (уш. с, 1H), 8,8 (уш. с, 1H), 7,4-7,2 (м, 5H), 3,8 (м, 2H), 2,9 (т, J=7 Гц, 2H), 2,4 (с, 3H), 2,3 (c, 3H).
MC (FD), m/e: 319 (M+).
УФ (EtOH): 319 нм ( ε =16944), 230 нм ( ε =13216), 201 нм ( ε =18476).
Пример 59. N-(2-Фенэтил)-N'-[2-(6-хлор)пиразинил]тиомочевина.
Раствор 2-амино-6-хлорпиразина (2,59 г, 20 ммоль) и 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) в N,N-диметилформамиде (50 мл) нагревают 35 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ на силикагеле получают 0,23 г (4%) указанного соединения, т.пл. 194-195oC.
ИК (KBr), см-1: 3171, 2932, 1575, 1517, 1465, 1359, 1270, 1169, 707.
1H-ЯМР (300 МГц, DMCO-d6), δ: 11,2 (c, 1H), 10,2 (уш. с, 1H), 8,5 (c, 1H), 8,3 (c, 1H), 7,4-7,2 (м, 5H), 3,85-3,75 (м, 2H), 2,9 (т, J=7 Гц, 2H).
МС (FD), m/e: 292 (+)
УФ (EtOH): 328 нм ( ε =12858), 265 нм ( ε =17945), 201 нм ( ε =17746).
Пример 60. N-(2-Фенбутил)-N'-(2-тиазолил)тиомочевина.
Раствор 2-фенбутилизотиоцианата (3,8 г, 20 ммоль) и 2-аминотиазола (2 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают 26 ч при 100o. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,3 г (39%) указанного соединения, т.пл. 105-107oC.
ИК (KBr), см-1: 3171, 2932, 1575, 1517, 1465, 1359, 1169, 1064, 707.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,5 (уш. с, 1H), 9,7 (уш. c, 1H), 7,4-7,1 (м, 7H), 3,6 (м, 2H), 2,6 (м, 2H), 1,6 (м, 4H).
MC (FD), m/e: 291 (M+).
УФ (EtOH): 288 нм ( ε =19013), 256 нм ( ε =10681), 203 нм ( ε =18908).
Найдено, %: C 57,6; H 6,08; N 14,56.
C14H17N3S2
Вычислено, %: C 57,7; H 5,88; N 14,42.
Пример 61. N-(2-Фенэтил)-N'-[2-(4-нитрофенил)тиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (0,74 г, 4,5 ммоль) и 2-амино-4-[(3-нитро)фенил] тиазола (1 г, 4,5 ммоль) в 50 мл N,N-диметилформамида нагревают 120 ч при 100oC. Реакционную смесь охлаждают до комнатной температуре, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ на силикагеле получают 0,07 г (4%) указанного соединения, т. пл. 192-196oC.
ИК (KBr), см-1: 3165, 3023, 1571, 1517, 1352, 1217, 1166.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,7 (уш. с, 1H), 9 (уш. с, 1H), 8,6 (c, 1H), 8,2 (м, 2H), 7,75 (c, 1H), 7,66 (т, J=6 Гц, 1H), 7,4-7,2 (м, 5H), 3,8 (м, 2H), 2,95 (т, J =6 Гц, 2H).
MC (FD), m/e: 384 (M+).
УФ (EtOH): 286 нм ( ε =21349), 264 нм ( ε =22766), 237 нм ( ε =19307), 202 нм ( ε =28514).
Найдено, %: C 56,12; N 4,24; N 14,47.
C18H16>N4S2O2
Вычислено, %: C 56,23; H 4,19; N 14,57.
Пример 62. N-(н-Пропил)-N'-[2-(5-хлортиазолил)]тиомочевина.
Раствор 2-амино-5-хлортиазола (2,69 г, 20 ммоль) и н-пропилизотиоцианата (2 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают 18 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ на силикагеле получают 0,17 г (4%) указанного соединения, т. пл. 128-133oC.
ИК (KBr), см-1: 3170, 2958, 1560, 1487, 1187, 691.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,5 (уш. с, 1H), 8,4 (уш. с, 1H), 7,4 (c, 1H), 3,4 (м, 2H), 1,6 (м, 2H), 0,95 (т, J=7 Гц, 3H).
MC (FD), m/e: 235 (M+).
УФ (EtOH): 294 нм ( ε =12928), 259 нм ( ε =10257), 204 нм ( ε =16979).
Найдено, %: C 35,85; H 4,19; N 19,78.
C7H10N3S2Cl
Вычислено, %: C 35,66; H 4,28; N 19,82.
Пример 63. N-(2-Фенэтил)-N'-{2-[4-(2',2'-дифенил-2'-циано)этил]тиазолил} тиомочевина.
Раствор 2-амино-[4-(2', 2'-дифенил-2'-циано)этил] тиазола (0,91 г, 3 ммоль) и 2-фенэтилизотиоцианата (0,49 г, 3 ммоль) в N,N-диметилформамиде (50 мл) нагревают 91 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка ВЭЖХ на силикагеле получают 0,28 г (20%) указанного соединения.
ИК (KBr), см-1: 3179, 3024, 2238, 1562, 1250, 698.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,5 (c, 1H), 10,4 (уш. с, 1H), 7,5-7,2 (м, 15H), 6,6 (c, 1H), 3,85 (c, 2H), 3,8 (м, 2H), 2,8 (т, J=7 Гц, 2H).
MC (FD), m/e: 468 (M+).
УФ (EtOH): 292 нм ( ε =12023), 259 нм ( ε =5862), 202 нм ( ε =25516).
Найдено,%: С 69,05; Н 5,33; N 11,76.
C27H24N4S2
Вычислено, %: C 69,20; H 5,16; N 11,95.
Пример 64. N-[2-(1-Циклогексенил)этил]-N'-(2-бензотиазолил)тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (3,3 г, 20 ммоль) и 2-аминобензотиазола (3 г, 20 ммоль) в 50 мл N,N-диметилформамида нагревают 17,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водой HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,57 г (40%) указанного соединения, т.пл. 185-186oC.
ИК (KBr), см-1: 3179, 3044, 2921, 2830, 1556, 1523, 1441, 1196.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,8 (уш. с, 1H), 10,2 (уш. с, 1H), 8-7,2 (м, 4H), 5,45 (с, 1H), 3,65 (м, 2H), 2,3 (т, J = 7 Гц, 2H), 1,9 (м, 4H), 1,5 (м, 4H).
МС (FD), m/e: 317 (M+).
УФ (EtOH): 287 нм ( ε = 20679), 201 нм ( ε = 25939).
Найдено,%: C 60,29; H 5,94; N 13,49.
C16H19N3S2
Вычислено,%: C 60,53; H 6,03; N 143,24.
Пример 65. N-(2-Фенэтил)-N'-[2-(4-этил)тиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцината (1,63 г, 10 ммоль) и 2-амино-2-этилтиазола (1,28 г, 10 ммоль) в N, N-диметилформамиде нагревают 23 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,84 г (29%) указанного соединения, т.пл. 145-146oC.
ИК (KBr), см-1: 3199, 3049, 2962, 1591, 1275, 655.
1H-ЯМР (300 МГц, DMCO-d6), δ : 11,5 (уш.с, 1H), 9,8 (уш.с, 1H), 7,4-7,2 (м, 5H), 6,6 (с, 1H), 3,8 (м, 2H), 2,9 (т, J = 7 Гц, 2H), 2,45 (к, J = 7 Гц, 2H), 1,1 (т, J = 7 Гц, 3H).
МС (FD), m/e: 291 (M+).
УФ (EtOH): 292 нм ( ε = 19382), 257 нм ( ε = 10362), 202 нм (ε = 20282).
Найдено,%: С 57,47; H 5,91; N 14,51.
C14H17N3S2
Вычислено,%: C 57,70; H 5,88; N 14,42.
Пример 66. 1-[(2-Бензотиазолил)тиокарбомоил]имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (8,9 г, 50 ммоль) и 2-аминобензотиазола (7,5 г, 5 ммоль) в ацетонитриле (125 мл) перемешивают 20 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 5,75 г (44%) указанного соединения.
ИК (KBr), см-1: 3199, 3049, 2962, 1628, 1461, 738.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 8,85 (с, 1H), 8,1 (уш.с, 1H), 7,9-7 (м, 6H).
МС (FD), m/e: 261 (M+).
УФ (EtON) : 366 нм ( ε = 13072), 305 нм ( ε = 11556), 213 нм ( ε = 35893).
Найдено,%: C 50,50; H 3,02; N 21,49.
C11H8N4S2
Вычислено,%: C 50,75; H 3,10; N 21,52.
Пример 67. N-[2-(2-Хлорфенил)этил]-N'-(2-бензотиазолил)тиомочевина.
Раствор 1-[(2-бензотиазолил)тиокарбамоил] имидазола (2,1 г, 8 ммоль) и 2-(2-хлорфенил)этиламина (1,25 г, 8 ммоль) в N, N-диметилформамиде (30 мл) перемешивают 1,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 1,6 г (57%) указанного соединения.
ИК (KBr), см-1 : 3181, 3050, 1587, 1527, 1231, 753.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,9 (уш.с, 1H) 10 (уш.с, 1H), 7,8-7,2 (м, 8H), 3,95 (м, 2H), 3,1 (т, J = 7 Гц, 2H).
МС (FD), m/e: 347 (M+).
УФ (EtOH) : 301 нм ( ε = 23050), 202 нм ( ε = 30924).
Пример 68. N-[2-(3-Хлорфенил)этил]-N'-(2-бензотиазолил)тиомочевина.
Раствор 1-[(2-бензотиазолил)тиокарбамоил] имидазола (1,04 г, 4 ммоль) и 2-(3-хлорфенил)этиламина (0,63 г, 4 ммоль) в N, N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 0,88 г (63%) указанного соединения.
ИК (KBr), см-1 : 3180, 2997, 1569, 1527, 1209, 755.
1H-ЯМР (300 Мгц, ДMCO-d6), δ : 11,9 (уш.с, 1H), 10,1 (уш.с, 1H), 7,8-7,2 (м, 8H), 3,9 (м, 2H), 3 (т, J = 7 Гц, 2H).
МС (FD), m/e: 347 (M+).
УФ (EtOH): 301 нм ( ε = 25367), 202 нм ( ε = 31735).
Найдено,%: С 55,05; H 4,05; N 12,03.
C16H14N3S2Cl
Вычислено,%: C 55,24; H 4,06; N 12,08.
Пример 69. N-[2-(4-Хлорфенил)этил-N'-(2-бензотиазолил)тиомочевина.
Раствор 1-[(2-бензотиазолил)тиокарбамоил] имидазола (1,04 г, 4 ммоль) и 2-(4-хлорфенил)этиламина (0,63 г, 4 ммоль) в N, N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 0,89 г (64%) указанного соединения.
ИК (KBr), см-1: 3180, 2997, 1569, 1527, 1257, 755.
1H-ЯМР (300 МГц, ДMCO-D6), δ : 12 (уш.с, 1H), 10 (уш.с, 1H), 7,9-7,2 (м, 8H), 3,85 (м, 2H), 2,95 (т, J = 7 Гц, 2H).
МС (FD), m/e: 347 (M+).
УФ (EtOH): 301 нм ( ε = 25731), 218 нм ( ε = 29376), 202 нм ( ε = 29033).
Найдено,%: C 55,27; H 4,02; N 12,10.
C16H14N3S2Cl
Вычислено,%: C 55,24; H 4,06; N 12,08.
Пример 70. N-[2-(2-Метоксифенил)этил]-N'-(2-бензотиазолил)тиомочевина.
Раствор 1-[(2-бензотиазолил)тиокарбамоил] имидазола (1,04 г, 4 ммоль) и 2-(2-метоксифенил)этиламина (0,62 г, 4 ммоль) в N, N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 0,9 г (66%) указанного соединения.
ИК (KBr), см-1: 3180, 1672, 1539, 1437, 1202, 1137, 783.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 12 (уш.с, 1H), 10 (уш.с, 1H), 7,9-7 (м, 8H), 3,85 (м, 2H), 3,75 (с, 3H), 2,9 (т, J = 7 Гц, 2H).
МС (FD), m/e: 343 (M+).
УФ (EtOH): 301 нм ( ε = 25894), 218 нм ( ε = 28357), 202 нм ( ε = 32552).
Найдено,%: C 59,70; H 5,01; N 11,99.
C17H17N3OS2
Вычислено,%: C 59,45; H 4,99; N 12,23.
Пример 71. N-[2-(3-Метоксифенил)этил]-N'-(2-бензотиазолил)тиомочевина.
Раствор 1-[(2-бензотиазолил)тиокарбамоил] имидазола (1,04 г, 4 ммоль) и 2-(3-метоксифенил)этиламина (0,62 г, 4 ммоль) в N, N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 0,77 г (56%) указанного соединения.
ИК (KBr), см-1: 3180, 1670, 1543, 1479, 1205, 1136, 718.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,9 (уш.с, 1H), 10,05 (уш.с, 1H), 7,9-6,8 (м, 8H), 3,87 (м, 2H), 3,75 (с, 3H), 2,95 (т, J = 7 Гц, 2H).
МС (FD), m/e: 343 (М+).
УФ (EtOH): 301 нм ( ε = 24893), 216 нм ( ε = 28250), 203 нм ( ε = 33504).
Найдено,%: C 59,36; H 5,02; N 12,00.
C17H17N3OS2
Вычислено,%: C 59,45; H 4,99; N 12,23.
Пример 72. N-[2-(4-Метоксифенил)этил]-N'-(2-бензотиазолил)тиомочевина.
Раствор 1-[(2-бензотиазолил)тиокарбамоил] имидазола (1,04 г, 4 ммоль) и 2-(4-метоксифенил)этиламина (0,62 г, 4 ммоль) в N, N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 0,85 г (62%) указанного соединения.
ИК (KBr), см-1: 3162, 1610, 1572, 1255, 1208, 1106, 761.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,9 (уш.с, 1H), 10,05 (уш.с, 1H), 7,9-6,8 (м, 8H), 3,85 (м, 2H), 3,75 (с, 3H), 2,9 (т, J = 7 Гц, 2H).
МС (FD), m/e: 343 (M+).
УФ (EtOH): 301 нм ( ε = 22113), 218 нм ( ε = 23878), 201 нм ( ε = 28098).
Найдено,%: C 59,33; H 5,06; N 12,04.
C17H17N3OS2
Вычислено,%: C 59,45; H 4,99; N 12,23.
Пример 73. 1-{[2-(4,5-Диметил)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (1,8 г, 10 ммоль), гидрохлорида 2-амино-4,5-диметилтиазола (1,65 г, 10 ммоль) и триэтиламина (1,01 г, 10 ммоль) в ацетонитриле (40 мл) перемешивают 7 ч при комнатной температуре. Удалением растворителя в вакууме получают в сыром виде указанное соединение в виде желтого твердого вещества, используемого на следующей стадии без очистки.
Пример 74. N-[2-(2-Хлорфенил)этил]-N'-[2-(4,5-диметил)тиазолил]тиомочевина.
Раствор 1-{[2-(4,5-диметил)тиазолил]тиокарбамоил}имидазола (10 ммоль) и 2-(2-хлорфенил)этиламина (1,55 г, 10 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,1 г (65%) указанного соединения.
ИК (KBr), см-1: 3171, 3013, 1583, 1549, 1510, 1216, 759.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,45 (уш.с, 1H), 9,75 (уш.с, 1H), 7,5-7,2 (м, 4H), 3,85 (м, 2H), 3,05 (т, J = 7 Гц, 2H), 2,2 (с, 3H), 2,05 (с, 3H).
МС (FD), m/e: 325 (M+).
УФ (EtOH): 297 нм ( ε = 9209), 257 нм ( ε = 5133), 201 нм ( ε = 14635).
Пример 75. N-[2-(3-Хлорфенил)этил]-N'-[2-(4,5-диметил)тиазолил]тиомочевина.
Раствор 1-{[2-(4,5-диметил)тиазолил]тиокарбамоил}имидазола (10 ммоль) и 2-(3-хлорфенил)этиламина (1,55 г, 10 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,2 г (67%) указанного соединения.
ИК (KBr), см-1: 3182, 3018, 1584, 1549, 1511, 1215, 788.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,45 (уш.с.1H), 9,8 (уш. с, 1Н) 7,4-7,2 (м, 4H), 3,85 (м, 2H), 2,9 (т, J = 7 Гц, 2H), 2,2 (с, 3H), 2,05 (с, 3H).
МС (FD), m/e: 325 (M+).
УФ (EtOH): 297 нм ( ε = 6543), 257 нм ( ε = 3650).
Найдено,%: C 51,73; H 4,99; N 13,16.
C14H16N3S2Cl
Вычислено,%: C 51,60; H 4,95; N 12,89.
Пример 76. N-[2-(2-Метоксифенил)этил-N'-[2-(4,5-диметил)тиазолил]тиомочевина.
Раствор 1-{[2-(4,5-диметил)тиазолил]тиокарбамоил}имидазола (10 ммоль) и 2-(3-метоксифенил)этиламина (1,51 г, 10 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 1,9 г (65%) указанного соединения, т.пл. 178-180oC.
ИК (KBr), см-1: 3175, 2998, 1598, 1495, 1213, 760, 707.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,4 (уш.с. 1H), 9,75 (уш.с, 1H), 7,25-6,8 (м, 4H), 3,8 (с, 3H), 3,78 (м, 2H), 2,87 (т, J = 7 Гц, 2H), 2,2 (с, 3H), 2,05 (с, 3H).
МС (FD), m/e: 321 (M+).
УФ (EtOH): 297 нм ( ε = 18573), 258 нм ( ε = 10587), 202 нм ( ε = 28862).
Найдено,%: C 56,29; H 6,19; N 13,27.
C15H18N3ОS2
Вычислено,%: C 56,04; H 5,96; N 13,09.
Пример 77. N-[2-(3-Метоксифенил)этил-N'-[2-(4,5-диметил)тиазолил]тиомочевина.
Раствор 1-{[2-(4,5-диметил)тиазолил]тиокарбамоил}имидазола (10 ммоль) и 2-(3-метоксифенил)этиламина (1,51 г, 10 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,2 г (69%) указанного соединения, т.пл. 146-148oC.
ИК (KBr), см-1: 3179, 3035, 1587, 1551, 1214, 701, 682.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,45 (уш.с, 1H), 9,8 (уш. с, 1H), 7,25-6,8 (м, 4H), 3,8 (с, 2H), 3,75 (м, 3H), 2,85 (т, J = 7 Гц, 2H), 2,2 (с, 3H), 2,05 (с, 3H).
МС (FD), m/e: 321 (M+).
УФ (EtOH): 297 нм ( ε = 16992), 258 нм ( ε = 9639), 202 нм ( ε = 27993).
Найдено,%: C 56,01; H 5,96; N 13,30.
C15H19N3S2
Вычислено,%: C 56,04; H 5,96; N 13,09.
Пример 78. N-[2-(4-Метоксифенил)этил-N'-[2-(4,5-диметил)тиазолил]тиомочевина.
Раствор 1-{[2-(4,5-диметил)тиазолил]тиокарбамоил}имидазола (10 ммоль) и 2-(4-метоксифенил)этиламина (1,51 г, 10 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,2 г (69%) указанного соединения, т.пл. 178-180oC.
ИК (KBr), см-1: 3174, 3024, 1590, 1552, 1214, 688.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,45 (уш.с, 1H), 9,8 (уш. с, 1H), 7,2 (д, J = 8 Гц, 2H), 6,85 (д, J = 8 Гц, 2H), 3,78 (м, 2H), 3,75 (с, 3H), 2,85 (т, J = 7 Гц, 2H), 2,2 (с, 3H), 1,05 (с, 3H).
Пример 79. N-(2-Фенэтил)-N'-[5-(3-метил)изотиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 5-амино-2-метилизотиазола (3 г, 20 ммоль) в N,N-диметилформамиде (30 мл) нагревают 24 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 5,5 г (100%) указанного соединения, т.пл. 213-216oC.
ИК (KBr), см-1: 3188, 2744, 1593, 1525, 1495, 1423, 1313, 1248, 829, 777, 752, 705, 670, 522.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 9,3 (уш.с, 1H), 7,4-7,2 (м, 5H), 6,85 (уш.с, 1H), 3,7 (м, 2H), 2,9 (т, J = 7 Гц, 2H), 2,45 (с, 3H).
МС (FD), m/e: 278 (M+).
УФ (EtOH): 286 нм ( ε = 12263), 247 нм ( ε = 14257), 206 нм ( ε = 27381).
Пример 80. 1-{[2-(6-Фтор)бензотиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (17,8 г, 100 ммоль) и 2-амино-6-фторбензотиазола (16,8 г, 100 ммоль) в ацетонитриле (700 мл) перемешивают 20 ч при комнатной температуре и затем 6 ч при 40oC. Фильтрованием образовавшегося осадка получают 19,5 г (70%) указанного соединения.
ИК (KBr), см-1: 3200, 3050, 2558, 1595, 1560, 1461, 1331, 1216, 1088, 1040, 948, 740, 648, 627.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 12 (уш.с, 1H), 8,85 (с, 1H), 8,1 (уш.с, 1H), 7,9-7 (м, 4H).
МС (FD), m/e: 279 (M+-H).
УФ (EtOH): 364 нм ( ε = 7372), 306 нм ( ε = 13593), 213 нм ( ε = 31325).
Найдено,%: C 47,72; H 2,66; N 20,09.
C11H7N4S2
Вычислено,%: C 47,47; H 2,54; N 20,13.
Пример 81. N-[2-(2-Хлорфенил)этил]-N'-[2-(6-фтор)бензотиазолил]тиомочевина.
Раствор 1-{[2-(6-фтор)бензотиазолил]тиокарбамоил}имидазола (2,1, 8 ммоль) и 2-(2-хлорфенил)этиламина (1,25 г, 8 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 1,6 г (57%) указанного соединения, т.пл. 188-189oC.
ИК (KBr), см-1: 3166, 3014, 1560, 1538, 1460, 1217, 1198, 853.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,6 (уш.с, 1H), 9,8 (уш. с, 1H), 7,9-7,2 (м, 7H), 3,9 (м, 2H), 3,1 (т, J = 7 Гц, 2H).
МС (FD), m/e: 365 (M+).
УФ (EtOH): 301 нм ( ε = 22535), 216 нм ( ε = 27344), 201 нм ( ε = 28624).
Найдено,%: C 52,79; H 3,72; N 11,76.
C16H13N3S2ClF
Вычислено,%: C 52,53; H 3,58; N 11,49.
Пример 82. N-[2-(3-Хлорфенил)этил]-N'-[2-(6- фтор)бензотиазолил]тиомочевина.
Раствор 1-{ [2-(6-фтор)бензотиазолил] тиокарбамоил} имидазола (2,1 г, 8 ммоль) и 2-(3-хлорфенил)этиламина (1,25 г, 8 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 1,6 г (57%) указанного соединения, т.пл. 193-194oC.
ИК (KBr), см-1: 3171, 3015, 1557, 1526, 1460, 1229, 1201, 866.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,9 (уш. с, 1H), 9,9 (уш. с, 1H), 7,9-7,2 (м, 7H), 3,85 (м, 2H), 3 (т, J = 7 Гц, 2H).
MC (FD), m/e: 365 (M+).
УФ (EtOH): 301 нм ( ε = 24232), 217 нм ( ε =30020), 201 нм ( ε =31875).
Найдено, %: C 52,50; H 3,67; N 11,38.
C16H13N3S2ClF
Вычислено, %: C 52,53; H 3,58; N 11,49.
Пример 83. N-[2-(4-Хлорфенил)этил]-N'-[2-(6- фтор)бензотиазолил]тиомочевина.
Раствор 1-{ [2-(6-фтор)бензотиазолил] тиокарбамоил} имидазола (2,1 г, 8 ммоль) и 2-(4-хлорфенилэтиламина) (1,25 г, 8 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 1,6 г (57%) указанного соединения, т.пл. 217-218oC.
ИК (KBr), см-1: 3168, 3033, 1559, 1532, 1491, 1462, 1230, 1143, 809.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,85 (уш.с, 1H), 9,8 (уш.с, 1H), 7,9-7,2 (м, 7H), 3,85 (м, 2H), 2,95 (т, J = 7 Гц, 2H).
MC (FD), m/e: 365 (M+).
УФ (EtOH): 301 нм ( ε = 24527), 220 нм ( ε = 31031).
Найдено, %: C 52,80; H 3,70; N 11,34.
C16H13N3S2ClF
Вычислено, %: C 52,53; H 3,58; N 11,49.
Пример 84. N-[2-(2-Метоксифенил)этил]-N'-[2-(6- фтор)бензотиазолил]тиомочевина.
Раствор 1-{ [2-(6-фтор)бензотиазолил] тиокарбамоил} имидазола (2,1 г, 8 ммоль) и 2-(2-метоксифенил)этиламина (1,25 г, 8 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 1,6 г (57%) указанного соединения, т.пл. 208-209oC.
ИК (KBr), см-1: 3168, 3034, 1561, 1536, 1462, 1242, 1198, 852.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,85 (уш.с, 1H), 9,8 (уш.с, 1H), 7,9-7 (м, 7H), 3,85 (м, 2H), 3,8 (с, 3H), 2,9 (т, J = 7 Гц, 2H).
MC (FD), m/e: 361 (M+).
УФ (EtOH): 300 нм ( ε = 24273), 218 нм ( ε =28369), 201 нм ( ε =34036).
Найдено, %: C 56,56; H 5,59; N 11,66.
C17H16N3OS2CF
Вычислено, %: C 56,49; H 4,46; N 11,63.
Пример 85. N-[2-(3-Метоксифенил)этил]-N'-[2-(6- фтор)бензотиазолил]тиомочевина.
Раствор 1-{ [2-(6-фтор)бензотиазолил] тиокарбамоил} имидазола (2,1 г, 8 ммоль) и 2-(3-метоксифенил)этиламина (1,25 г, 8 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 1,6 г (57%) указанного соединения, т.пл. 190-124oC.
ИК (KBr), см-1: 3050, 1536, 1460, 1302, 1221, 1060, 674.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,9 (уш.с, 1H), 9,9 (уш.с, 1H), 7,9-7 (м, 7H), 3,85 (м, 2H), 3,75 (с, 3H), 2,95 (т, J=7 Гц, 2H).
MC (FD), m/e: 361 (M+).
УФ (EtOH): 301 нм ( ε = 24608), 218 нм ( ε = 28535), 201 нм ( ε = 37337).
Найдено, %: C 56,21; H 4,54; N 11,40.
C17H16N3OS2CF
Вычислено, %: C 56,49; H 4,46; N 11,63.
Пример 86. N-[2-(4-Метоксифенил)этил]-N'-[2-(6- фтор)бензотиазолил]тиомочевина.
Раствор 1-{ [2-(6-фтор)бензотиазолил] тиокарбамоил} имидазола (2,1 г, 8 ммоль) и 2-(4-метоксифенил)этиламина (1,25 г, 8 ммоль) в N,N-диметилформамиде (30 мл) перемешивают 1,5 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 1,6 г (57%) указанного соединения, т.пл. 203-204oC.
ИК (KBr), см-1: 3001, 1561, 1539, 1458, 1251, 860, 818.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,85 (уш.с, 1H), 9,85 (уш.с, 1H), 7,9-6,9 (м, 7H), 3,85 (м, 2H), 3,75 (с, 3H), 2,9 (т, J = 7 Гц, 2H).
MC (FD), m/e: 361 (M+).
УФ (EtOH): 301 нм ( ε = 23562), 222 нм ( ε =28328).
Найдено, %: C 56,70; H 4,42; N 11,79.
C17H16N3OS2CF
Вычислено, %: C 56,49; H 4,46; N 11,63.
Пример 87. 1-{[2-(5-Хлор)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (25 г, 140 ммоль) в 2-амино-5-хлортиазоле (18,8 г, 140 ммоль) в ацетонитриле (300 мл) перемешивают 23 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 21,2 г (62%) указанного соединения.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 9,5 (с, 1H), 8,2 (с, 1H), 7,6 (с, 1H), 7,5 (с, 1H).
MC (FD), m/e: 361 (M+-C3H3N2).
Пример 88. N-[2-(2-Хлорфенил)этил]-N'-[2-(5-хлор)тиазолил]тиомочевина.
Раствор 1-{[2-(5-хлор)тиазолил]тиокарбамоил}имидазола (0,68 г, 2,8 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,68 г (73%) указанного соединения, т.пл. 172-174oC.
ИК (KBr), см-1: 3318, 2873, 1606, 1526, 1513, 1436, 1351, 1237, 747.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 10,7 (уш.с, 1H), 8,5 (уш.с, 1H), 7,4-7,2 (м, 4H), 3,8 (м, 2H), 2,9 (т, J=7 Гц, 2H).
MC (FD), m/e: 331 (M+).
УФ (EtOH): 295 нм ( ε = 11804), 259 нм ( ε = 10397), 202 нм ( ε = 27067).
Найдено, %: C 43,61; H 3,57; N 12,57.
C12H11N3S2Cl2
Вычислено, %: C 43,38; H 3,34; N 12,65.
Пример 89. N-[2-(3-Хлорфенил)этил]-N'-[2-(5-хлор)тиазолил]тиомочевина.
Раствор 1-{[2-(5-хлор)тиазолил]тиокарбамоил}имидазола (1,22 г, 5 ммоль) и 2-(3-хлорфенил)этиламина (0,78 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,9 г (54%) указанного соединения, т.пл. 154-155oC.
ИК (KBr), см-1: 3178, 3044, 1557, 1520, 1458, 1346, 1196, 784, 755.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,6 (уш.с, 1H), 8,4 (уш.с, 1H), 7,4 (с, 1H), 7,4-7,2 (м, 4H), 3,7 (м, 2H), 2,8 (т, J=7 Гц, 2H).
MC (FD), m/e: 331 (M+).
УФ (EtOH): 296 нм ( ε =14281), 259 нм ( ε =12090), 205 нм ( ε = 29809).
Пример 90. N-[2-(4-Хлорфенил)этил]-N'-[2-(5-хлор)тиазолил]тиомочевина.
Раствор 1-{[2-(5-хлор)тиазолил]тиокарбамоил}имидазола (1,22 г, 5 ммоль) и 2-(4-хлорфенил)этиламина (0,78 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 1,1 г (66%) указанного соединения, т.пл. 178-180oC.
ИК (KBr), см-1: 3180, 2927, 1610, 1536, 1492, 1325, 1256, 1181, 1088, 1014, 811, 747, 643, 508.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,6 (уш.с, 1H), 8,4 (уш.с, 1H), 7,4 (с, 1H), 7,32 (д, J=8 Гц, 2H), 7,22 (д, J=8 Гц, 2H), 3,7 (м, 2H), 2,8 (т, J=7 Гц, 2H).
MC (FD), m/e: 331 (M+).
УФ (EtOH): 195 нм ( ε = 13675), 259 нм ( ε = 12330), 202 нм ( ε = 27524).
Найдено, %: C 43,61; H 3,46; N 12,85.
C12H11N3S2Cl2
Вычислено, %: C 43,38; H 3,34; N 12,65.
Пример 91. N-[2-(1-Метил)-2-пирролилэтил]-N'-(2-тиазолил)тиомочевина.
Изотиоцианат 2-(2-аминометил)-1-метилпиррола синтезируют по методике (Ann, 657, 104-107, 1962).
1H-ЯМР (CDCl3), δ : 2,95 (т, 2H), 3,55 (с, 1H), 3,65 (т, 2H), 5,9-5,95 (м, 1H), 6,05 (т, 1H), 6,55 (т, 1H). Полученный изотиоцианат растворяют в ДМФА (4 мл), к раствору добавляют 200 мг (2 ммоль) 2-аминотиазола и нагревают примерно 16 ч при 100oC. Добавляют EtOAc и органическую фазу промывают насыщенным раствором NH4Cl и рассолом. После высушивания (Na2SO4) продукт очищают на колонке с силикагелем с применением в качестве элюента смеси EtOAc/гексан (1: 1). В результате получено почти чистое указанное соединение. Перекристаллизацией из смеси толуол/гексан получают 150 мг указанного соединения, т.пл. 183 - 184oC (разложение).
1H-ЯМР (ДMCO-d6), δ : 2,86 (т, 2H), 3,55 (c, 3H), 3,75 (к, 2H), 5,85 - 5,9 (м, 2H), 6,62 (с, 1H), 7,09 (д, 1H), 7,36 (д, 1H), 9,74 (широкий с, 1H), 11,65 (широкий с, 1H).
13C-ЯМР (ДMCO-d6), δ : 25,03; 33,31; 43,92; 106,24; 106,31; 112,03; 121,55; 129,33; 136,71; 161,68; 178,25.
Пример 92. N-[2-(1-Пиперазинилэтил)]-N'-(2-тиазолил)тиомочевина.
К раствору 1,29 г 1-(2-аминоэтил)пиперазина (10 ммоль) в 5 мл хлористого метилена при 0oC добавляют 1,78 г тиокарбонилдиимидазола. Реакционную смесь нагревают до комнатной температуры и перемешивают 30 мин. Хлористый метилен испаряют и к остатку добавляют 40 мл диметилформамида в смеси с 10,01 г 2-аминотиазола. Полученный продукт очищают хроматографией на колонке с силикагелем с элюированием смесями метанола с хлороформом. Кристаллизация соли с щавелевой кислотой приводит к дальнейшей очистке продукта.
1H-ЯМР (оксалат в D2O): 2,8 - 3,7 ч/млн (м), 6,75 ч/млн (д), 7,1 ч/млн (д).
Пример 93. N-[2-(2-Хлор)фенэтил]-N'-(2-тиазолил)тиомочевина.
В 20 мл хлористого метилена растворяют тиокарбонилдиимидазолил (980 мг, 5,5 ммоль) и к полученному раствору при 0oC по каплям прибавляют 2-хлорфенэтиламин (0,69 мл, 5 ммоль). После реагирования в течение 30 мин при 0oC смесь нагревают до комнатной температуры и концентрируют в вакууме до небольшого объема. К остатку добавляют 20 мл ДМФА и 2-аминотиазол (700 мг, 7 ммоль). Полученную смесь выдерживают 3 ч при 100oC. После охлаждения до комнатной температуры смесь переносят в 1 н. раствор HCl (100 мл) и экстрагируют этилацетатом (2x100 мл), затем органическую фазу промывают рассолом и сушат над сульфатом магния. Концентрированием раствора в вакууме и разделением колоночной хроматографией на силикагеле получают 440 мг (30%) продукта.
1H-ЯМР (CDCl3), δ : 7,38 - 7,17 (м, 5H, ClPh, тиазол), 6,81 (д, J = 3,7 Гц, 1H, тиазол), 4,02 (к, т, J = 7 Гц, 2H, CH2NH), 3,17 (т, J = 7,1 Гц, CH2).
13C-ЯМР (CDCl3), δ : 177,5 (C=S), 161 (тиазол), 137,5 (тиазол), 136 (ClPh), 134,1 (ClPh), 131,1 (ClPh), 129,5 (ClPh), 128 (ClPh), 126,7 (ClPh), 111,1 (тиазол), 44,8 (CH2), 32,3 (CH2). АП АФ O М ] Ч т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ % m ° = Б M М т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ М V Щ " j о 6 т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ 6 t B Д U Ь т т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т" g о ; } P Х т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ Х Ю ц + h п 2 т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ 2 x M Х \ Ъ р т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ р \ в ц ' m A В т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ В F Л K О т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ W Э d и ы 2
Пример 94. N-[2-(2-Метокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
К раствору 1,8 г (10 ммоль) 1,1'-тиокарбонилдиимидазола в CH2Cl2 при 0oC добавляют 1,46 мл (10 ммоль) 2-метоксифенэтиламина, полученный раствор перемешивают 1 ч, затем добавляют гексан и реакционную смесь фильтруют и испаряют. Остаток растворяют в ДМФА (8 мл) и к раствору добавляют 1 г (10 ммоль) 2-аминотиазола (Мерк). Затем реакционную смесь нагревают примерно 16 ч при 100oC. После этого добавляют EtOAc и разбавленный раствор HCl. Органическую фазу отделяют и последовательно промывают разбавленным раствором HCl, насыщенным раствором NH4Cl и водой (2x). После высушивания над Na2SO4 продукт очищают колоночной хроматографией на силикагеле с элюированием смесью гексан/EtOAc (2:1) и получением 0,77 г сырого продукта. Перекристаллизацией из толуола получают 0,54 г все еще загрязненного указанного соединения. Конечную очистку осуществляют на колонке с Al2O3 с элюированием CHCl3 (содержит 0,5% EtOH). В результате получено 85 мг указанного соединения, т.пл. 126 - 127,5oC.
1H-ЯМР (CDCl3), δ : 3,03 (т, 2H), 3,82 (c, 3H), 3,96 (к, 2H), 6,79 - 6,93 (м, 3H), 7,2 - 7,26 (м, 3H), 10,35 (широкий с, 1H), 10,73 (широкий с, 1H).
13C-ЯМР (CDCl3), δ : 29,59; 45,69; 55,19; 110,22; 110,97; 120,4; 126,75; 127,96; 130,78; 137,72; 157,62; 161,58; 177,34.
Пример 95. N-[2-(4-Фтор)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 94, с использованием 4-фторфенэтиламина, т.пл. 124,5 - 126oC.
Найдено, %: C 51; H 4,35; N 14,8.
Вычислено, %: C 51,22; H 4,3; N 14,93.
1H-ЯМР (CDCl3), δ: 3 (т, 3H), 4 (к, 3H), 6,86 (д, 1H), 7 - 7,3 (м, 5H).
13C-ЯМР (CDCl3), δ : 34,05; 46,82; 111,35; 115,38 (д, 2C); 130,39 (д, 2C); 134,2 (д, 1C); 137,46; 161,74 (д, 1C); 161,84; 177,52.
Пример 96. N-[2-(4-Нитро)фенэтил]-N'-(2-тиазолил)тиомочевина.
Указанное соединение получено использованием 4-нитрофенэтиламина по методике, аналогичной методике примера 93.
1H-ЯМР (CDCl3), δ : 8,17 (д, J = 8,6 Гц, 2H, O2NPh), 7,45 (д, J = 8,6 Гц, 2H, O2NPh), 7,21 (д, J = 3,7 Гц, 1H, тиазол), 6,84 (д, J = 3,7 Гц, 1H, тиазол), 4,01 (к, J = 5,7 Гц, 2H, CH2NH), 3,15 (т, J = 7,2 Гц, 2H, CH2).
13C-ЯМР (CDCl3 + CD3OD), δ : 179 (C=S), 161 (тиазол), 146,4 (O2NPh), 136,9 (тиазол), 129 (O2NPh), 123,4 (O2NPh), 111,1 (тиазол), 45,3 (CH2), 34,3 (CH2).
Пример 97. N-[2-(4-Амино)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено восстановлением продукта из примера 96 железом и соляной кислотой по методике (Vogel. Справочник практической органической химии, 4-е изд., с. 657, Лонгман, 1978).
1H-ЯМР (CDCl3), δ : 7,23 (д, J = 3,8 Гц, 1H, тиазол), 7,07 (д, J = 8,3 Гц, 2H, H2NPh), 6,79 (д, J = 3,7 Гц, 1H, тиазол), 6,65 (д, J = 8,3 Гц, 2H, N2NPh), 3,91 (к, 2H, CH2NH), 2,91 (т, J = 7,1 Гц, 2H, CH2).
13C-ЯМР (CDCl3 + CD3OD), δ : 177 (C=S), 161 (тиазол), 144 (H2NPh), 137,3 (тиазол), 129,5 (H2NPh), 128,6 (H2NPh), 115,4 (H2NPh), 110,9 (тиазол), 46,7 (CH2), 33,6 (CH2).
Пример 98. N-[2-(4-Метокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено использованием 4-метоксифенэтиламина по методике, аналогичной методике примера 93.
1H-ЯМР (CDCl3), δ : 7,22 - 7,18 (т, 3H, MeOPh и тиазол), 6,85 (д, J = 8,5 Гц, 2H, MeOPh), 6,81 (д, J = 3,7 Гц, 1H, тиазол), 3,94 (к, J = 7,1 Гц, 2H, CH2NH), 3,79 (c, 3H, MeO), 2,96 (т, J = 7,1 Гц, 2H, CH2).
13C-ЯМР (CDCl3), δ : 177,3 (C=S), 161,6 (тиазол), 158,2 (MeOPh), 137,4 (тиазол), 130,4 (MeOPh), 129,7 (MeOPh), 113,8 (MeOPh), 111 (тиазол), 55,1 (MeO), 47 (CH2), 33,8 (CH2).
Пример 99. N-[2-(4-Гидрокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено обработкой продукта из примера 98 йодтриметилсиланом в дихлорметане по методике (H. Sakurai, Synthesis, с. 740, 1979) (пример 97).
1H-ЯМР (CDCl3), δ : 7,22 (д, J = 3,6 Гц, 1H, тиазол), 7,14 (д, J = 8,4 Гц, 2H, HOPh), 6,81 - 6,77 (т, 2H, тиазол, HOP), 3,94 (к, 2H, CH2NH2), 2,94 (т, J = 7,2 Гц, 2H, CH2).
13C-ЯМР (CDCl3), δ : 177,4 (C=S), 161,4 (тиазол), 154,1 (HOPh), 137,6 (тиазол), 130,5 (HOPh), 129,9 (HOPh), 115,3 (HOPh), 110,9 (тиазол), 47,1 (CH2), 33,7 (CH2).
Пример 100. N-[2-(4-Бром)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение синтезировано использованием 4-бромфенэтиламина по методике, аналогичной методике примера 93.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,43 (д, J = 6,4 Гц, 2H, BrPh), 7,22 (д, J = 3,6 Гц, 1H, тиазол), 7,15 (д, J = 6,3 Гц, 2H, BrPh), 6,83 (д, J = 3,7 Гц, 1Н, тиазол), 3,95 (т, J = 7,1 Гц, 2H, CH2NH), 2,94 (т, J = 7 Гц, 2H, CH2).
13C-ЯМР (CDCl3 + CD3OD), δ : 177,5 (C= S), 161,5 (тиазол), 137,4 (тиазол), 131,5 (BrPh), 150,5 (BrPh), 120,3 (BrPh), 111,1 (тиазол), 46,2 (CH2), 34 (CH2).
Пример 101. N-[2-(1-Пиперидил)этил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено использованием 1-пиперидинилэтиламина по методике, аналогичной методике примера 93.
1H-ЯМР (CDCl3), δ : 7,32 (д, J = 3,7 Гц, 1H, тиазол), 6,84 (д, J = 3,7 Гц, 1H, тиазол), 3,8 (т, 2H, CH2NH), 2,62 (т, J = 6,4 Гц, 2H, CH2), 2,48 (м, 2H, пип.), 1,62 (м, 2H, пип.), 1,46 (м, 1H, пип.).
13C-ЯМР (CDCl3 + CD3OD), δ : 177,3 (C=S), 161 (тиазол), 137,3 (тиазол), 111,1 (тиазол), 56,1 (CH2), 54,1 (пип.), 42,2 (CH2), 25,6 (пип.), 24 (пип.).
Пример 102. N-(2-Морфолиноэтил)-N'-(2-тиазолили)тиомочевина.
Это соединение получено использованием морфолиноэтиламина по методике, аналогичной методике примера 91.
1Н-ЯМР (250 МГц, CDCl3), δ : 7,38 (д, 1H, CH=CH), 6,86 (д, 1H, CH=CH), 3,82 (к,2H, CH2NH), 3,86-3,71 (м, 4H, CH2-O-CH2), 2,67 [т, 2H, CH2-N (цикл)] , 2,62-2,52 (м, 4H, CH2-N-CH2).
13С-ЯМР (250 МГц, CDCl3), δ : 178, 163, 138, 112, 67, 57, 53, 42.
Т.пл. 150,5-151,5oC.
Пример 103. 1-(2-Аминотиазол)-1'-имидазолтиокарбонил.
К 50 мл ацетонитрила добавляют 8,9 г тиокарбонилдиимидазола (50 ммоль) и 5 г 2-аминотиазола (50 ммоль). Смесь нагревают до 40oC и перемешивают при этой температуре 2 ч. Смесь охлаждают до комнатной температуры, твердое вещество отфильтровывают и промывают 300 мл холодного ацетонитрила. Выход чистого продукта после высушивания составляет 9,7 г (46 ммоль).
Найдено, %: C 39,3; H 2,8; N 26,2.
Вычислено, %: C 40; H 2,87; N 26,6.
1Н-ЯМР (250 МГц, ДMCO), δ : 8,68 (с,1H, N=CH-N), 7,97 (с,1H, N-CH=CH-N), 7,76 (д,1H, S-CH=CH-N), 7,33 (д,1H, S-CH=CH-N), 7,08 (с,1H, N-CH=CH-N).
Пример 104. N-(2-Фенэтил)-N'-[2-(6-гидрокси)пиридил]тиомочевина.
Перемешиваемый раствор фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амино-6-гидроксипиридина (1,1 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 87,25 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (4х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого вещества вытеснительной хроматографией на силикагеле (от 10% этилацетата в дихлорметане до 15% этилацетата) с последующим ополаскиванием этилацетатом получают 1,15 г указанного соединения в виде снежно-белого вещества, т.пл. 196-197oC.
ИК (KBr), см-1: 2937, 1668, 1595, 1475, 1428, 1365, 1219, 1158, 1023.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 11,49 (уш.с, 1H), 10,82 (с,1H), 10,33 (с, 1H), 7,52 (т, J = 7,9 Гц, 1H), 7,25-7,14 (м, 5H), 6,53 (д, J = 7,9 Гц, 1H), 6,19 (д, J = 8 Гц, 1H), 3,8-3,73 (м, 2H), 2,92 (т, J = 7,7 Гц, 2H).
МС (FD), m/e : 273 (M+).
УФ (EtOH): 305 нм ( ε = 20692), 262 нм ( ε = 13737), 247 нм ( ε = 18743), 203 нм ( ε = 19201).
Найдено, %: С 61,73; H 5,72; N 15,57.
C14H15N3OS
Вычислено,%: C 61,52; H 5,53; N 15,37.
Пример 105. N-[2-(2-Нафтилэтил]-N'-[2-тиазолил]тиомочевина.
В 5 мл ДМФА суспендируют 2-нафталинэтиламин (256 мг, 1,5 ммоль) и продукт из примера 103 (400 мг, 1,9 ммоль). Реакционную смесь нагревают до 110oC, и в течение нескольких минут она становится прозрачной. Спустя 1 ч реакционную смесь охлаждают до комнатной температуры и добавляют 20 мл хлористого метилена. Органический раствор промывают последовательно 0,5 н. раствором HCl (70 мл), рассолом (50 мл) и водой (50 мл). Органический раствор сушат над сульфатом магния и затем сушат в вакууме. Очисткой продукта колоночной хроматографией на силикагеле (хлороформ/циклогексан, 1:1 об./об.) получено 324 мг (69%) соединения.
1Н-ЯМР (CDCl3), δ : 7,82-7,39 (м, 7H, нафт.), 6,98 (т, J = 3,6 Гц, 1H, тиазол), 6,73 (д, J = 3,1 Гц, 1H, тиазол), 4,07 (к, J= 7 Гц, 2H, CH2NH), 3,28 (т, J= 7 Гц, 2H, CH2).
13С-ЯМР (CDCl3+CD3OD), δ : 177 (C=S), 161 (тиазол), 128,5 (нафт.), 134,5 (нафт. ), 133,6 (нафт.), 131,7 (нафт.), 128,5 (нафт.), 125,2 (нафт.), 123,6 (нафт.), 110,9 (тиазол), 45,8 (CH2), 31,7 (CH).
Пример 106. N-[1-(4-Пентенил)-N'-(2-тиазолил)тиомочевина.
Смесь 4-пентенола (3,04 г, 35,3 ммоль), пиридина (2,79 г, 35,3 ммоль) и 25 мл диэтилового эфира охлаждают до -60oC. По каплям при -60oC прибавляют в течение 5 мин ангидрид трифторметансульфоновой кислоты. Реакционную смесь медленно нагревают (30 мин) до комнатной температуры и образовавшуюся соль отфильтровывают.
Фильтрат по каплям примерно при -30oC прибавляют к смеси 10 мл диэтилового эфира и 30 мл жидкого аммиака. Аммиак испаряют, а оставшийся раствор оставляют нагреваться до комнатной температуры. Эфирный раствор экстрагируют 10 мл 10 М водного гидроксида натрия. Разгонкой при атмосферном давлении получают 4-пентениламин (2,35 г, 27,6 ммоль).
По методике примера 105 конденсируют 0,85 г (10 ммоль) полученного амина с 2,1 г продукта примера 103. Кристаллизацией из смеси н-гексана с толуолом получают чистый продукт.
1Н-ЯМР (CDCl3), δ : 1,85 ч/млн (м), 2,2 ч/млн (м), 3,7 ч/млн (м), 5-5,15 ч/млн (м), 5,75-5,95 ч/млн (м), 6,85 ч/млн (д), 7,3 ч/млн (д).
13С-ЯМР (CDCl3), δ : 177, 162, 137, 116, 111, 45, 31, 28 ч/млн.
Пример 107. N-[2-(3-Трифторметил)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение синтезировано по методике, аналогичной методике примера 106, с использованием 1-трифторметил-3-этанолбензола.
1Н-ЯМР (CDCl3), δ : 3 (т, PhCH2, 2H), 4 (к, CH2N, 2H), 6,8 (д, тиазол, 1H), 7,4-7,6 (мульт., о-, м- и n-, 4H).
Пример 108. N-(цис-3-Гексенил)-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 106, с использованием 3-цис-гексенола.
1Н-ЯМР (CDCl3), δ : 7,3 (д, J = 3,9 Гц, 1H, тиазол), 6,83 (д, J = 3,8 Гц, 1H, тиазол), 5,56 и 5,4 (м, 2H, H-C=C-H), 3,75 (к, 2H, CH2NH), 2,47 (к, 2H, CH2), 2,09 (к,2H, CH2), 0,95 (т, J = 5,4 Гц, 3H, CH3).
13С-ЯМР (CDCl3), δ : 177 (C=S), 161 (тиазол), 137,5 (тиазол), 134,8 (C= C), 124,6 (C=C), 111 (тиазол), 45,4 (CH2-NH), 26,3 (CH2), 20,6 (CH2), 14,1 (CH3).
Пример 109. N-[2-(1-Нафтил)этил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 106, с использованием (1-нафтил)-2-этанола.
1Н-ЯМР (CDCl3+CD3OD), δ : 8,24-7,4 (м, 7H, нафт.), 7,16 (д, J = 3,7 Гц, 1H, тиазол), 6,8 (д, J= 3,7 Гц, 1H, тиазол), 4,1 (т, J= 7,5 Гц, 2H, CH2NH), 3,49 (т, J = 7,5 Гц, 2H, CH2).
Пример 110. N-[2-(2-Фтор)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 106, с использованием 1-фтор-2-этанолбензола.
1Н-ЯМР (CDCl3), δ : 7,28-7,03 (м, 5H, тиазол, FPh), 6,81 (д, J=3,8 Гц, 1H, тиазол), 3,99 (к, J = 7,1 Гц, 2H, CH2NH), 3,08 (т, J=7 Гц, 2H, CH2).
13С-ЯМР (CDCl3), δ : 178 (C=S), 161 (тиазол), 137,4 (тиазол), 131 (д, C-F-связь, FPh), 128 (д, С-F-связь, FPh), 124 (FPh), 115,4 (FPh), 115 (FPh), 111 (тиазол), 45,3 (CH2), 28,1 (CH2).
Пример 111. N-[2-(2-Трифторметил)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 106, с использованием 1-трифторметил-2-этанолбензола.
1Н-ЯМР (CDCl3), δ : 7,66 (д,1H, TFMPh), 7,51 (м, 2H, TFMPh), 7,34 (м, 1H, TFMPh), 7,26 (д, J = 3,6 Гц, 1H, тиазол), 6,84 (д, J= 3,8 Гц, 1H, тиазол), 3,99 (к, J= 6,3, Гц, 2H, CH2NH), 3,23 (т, J=7,6 Гц, 2H, CH2).
13С-ЯМР (CDCl3), δ : 177,7 (C=S), 161,5 (тиазол), 137,6 (тиазол), 136,9 (TFMPh), 131,8 (TFMPh), 131,6 (TFMPh), 129 (к, C-F-связь, CF3), 126,6 (TFMPh), 125,9 (д, TFMPh), 111,1 (тиазол), 46,3 (CH2), 31,4 (CH2).
Пример 112. N-(3-Пентинил)-N'-(2-тиазолил)тиомочевина.
Исходный 3-пентиниламин синтезировали из 3-пентин-1-ола.
3-Пeнтиниламин. К раствору 3-пентин-1-ола (2 г, 23,8 ммоль) и пиридина (1,92 мл, 23,8 ммоль) в диэтиловом эфире (50 мл) добавляют при -45oC ангидрид трифторметансульфоновой кислоты. Смесь перемешивают 15 мин при той же температуре и при перемешивании фильтруют в холодном состоянии в диэтиловый эфир (≈10 мл), насыщенный при -45oC NH3. Реакционную смесь перемешивают 3 ч при комнатной температуре и после испарения получают желтые кристаллы (2 г, 36%) в качестве соли 3-пентиниламина с трифторметансульфоновой кислотой.
1Н-ЯМР (250 МГц, D2O), δ : 3,12 (т, 2H, CH2- NH+ 3), 2,55 (м, 2H, CH2- C≡C ), 1,78 (т, 3H, CH3- C≡C).
13С-ЯМР (250 МГц, D2O), δ : 126, 83, 77, 41, 20, 5.
Затем по методике, аналогичной методике примера 106, получено указанное соединение, т.пл. 118, 5-119oC.
1Н-ЯМР (250 МГц, CDCl3, δ: 7,33 (д, 1H, CH=CH), 6,87 (д, 1H, CH=CH), 3,86 (к, 2H, CH2-NH), 2,56 (тр. т, 2H, CH3-C ≡ C), 1,81 (т, 3H, CH3-C ≡ C).
13С-ЯМР (250 МГц, CDCl3), δ : 178, 162, 138, 111, 45, 19, 4.
Пример 113. 3-(2-Фенэтил)-2-тиоксо-1,2,3,4-тетрагидрохиназолин.
В 200 мл ацетонитрила растворяют 2-нитробензальдегид (10 г, 66 ммоль) и 2-фенэтиламин (8,3 мл, 66 ммоль) с установлением pH 6 добавлением уксусной кислоты.
Наибольшими порциями добавляют цианборгидрид натрия. Раствор перемешивают 40 мин, разбавляют водой (400 мл) и экстрагируют эфиром.
Кислотно-основным распределением (водн. HCl, в одн. NH4OH) получают масло, которое суспендируют в воде (200 мл), после чего добавляют железную пыль (10 г, 180 ммоль). Смесь нагревают до кипения и к ней медленно прибавляют HCl (конц. водн.) и кипячение продолжают 40 мин. Раствор охлаждают и подщелачивают 40%-ной гидроокисью натрия до pH 14. Раствор перемешивают с толуолом (700 ил) и фильтруют через слой целита.
Кислотно-основным распределением (водн. HCl, водн. NH4OH) и испарением получают масло, которое растворяют в ацетонитриле (20 мл), после чего добавляют N, N-тиокарбонилдиимидазол (0,7 г, 6,6 ммоль). Раствор перемешивают 72 ч при комнатной температур, нагревают 40 мин при 75oC и испаряют. Остаток очищают вытеснительной хроматографией на силикагеле с элюированием смесью этилацетата с гексаном (1:3).
Продукт спонтанно кристаллизуется из чистых фракций с образованием длинных игл.
1H-ЯМР (CDCl3), δ : 3 (т, PhCH2, 2H), 4,1 (т, PCH2CH2N, 2H), 4,4 (с, PhCH2N, 2H), 6,7-7,5 (м, C6H5, C6H4, 9H), 8,7 (широкий с, NH, 1H).
Пример 114. N-(2-Фенэтил)-N'-[2-(3-метил)пиридил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амино-3-метилпиридина (1,08 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 16,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (4х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) получают 1,77 г (65%) указанного соединения, перекристаллизацией которого из смеси этилацетата/гексан получают 878 мг указанного соединения в виде бледно-желтых кристаллов, т.пл. 82-84oC.
ИК (KBr), см-1: 3430, 2945, 1594, 1555, 1454, 1268, 1243, 1161.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,62 (уш.с, 1H), 8,66 (с, 1H), 7,9 (д, J= 4,1 Гц, 1H), 7,59 (д, J=7,2 Гц, 1H), 7,28-7,15 (м, 5H), 6,96 (дв.д, J=7,4 и 5Гц, 1H), 3,84-3,78 (м, 2H), 2,89 (т, J=7 Гц, 2H), 2,23 (с, 3H).
МС (FD), m/e: 271 (M+).
УФ (EtOH): 293 нм (ε = 17290), 265 нм ( ε = 14634), 244 нм ( ε = 16388), 202 нм ( ε = 19784).
Найдено,%: С 66,66; Н 6,32; N 15,73. C15H17N3S
Вычислено,%: C 66,39; H6,31; N 15,48.
Пример 115. N-[2-(2-Тиенил)этил]-N'-(2-тиазолил)тиомочевина.
В 50 мл диэтилового эфира растворяют 6,4 г 2-(2-тиенил)этанола (50 ммоль) и 3,95 г пиридина (50 ммоль). Смесь охлаждают до -30oC и к ней при перемешивании по каплям прибавляют 5,7 г метансульфонилхлорида (950 ммоль). Затем реакционную смесь нагревают и выдерживают 30 мин при температуре кипения. Смесь охлаждают до комнатной температуры и фильтруют. Фильтрат переносят в автоклав вместе со 100 мл раствора аммиака в метаноле (насыщенный при 0oC). Автоклав герметизируют и нагревают 17 ч при 150oC. Растворитель удаляют испарением в вакууме и к остатку добавляют 100 мл 5 М водной гидроокиси натрия. Смесь дважды экстрагируют по 100 мл хлористого метилена с получением раствора 2-(2-тиенил)этиламина с примесью вторичного амина.
Чистый первичный амин получают дробной кристаллизацией из метанола солей с щавелевой кислотой с последующим добавлением водной гидроокиси натрия и экстрагированием хлористым метиленом.
К раствору 800 мг тиокарбонилдиимидазола (4,5 ммоль) в 5 мл хлористого метилена добавляют при 0oC 500 мг чистого 2-(2-тиенил)этиламина (3,93 ммоль). Смесь перемешивают 15 мин при 0oC и затем 1 ч при 20oC. Растворитель удаляют в вакууме и к остатку добавляют в 5 мл диметилформамида 500 мг 2-аминотиазола. Полученную смесь нагревают 17 ч при 110oC. После испарения растворителя в вакууме добавляют 100 мл этилацетата и смесь нагревают при 50oC. Теплую смесь дважды промывают 20 мл 1 М HCl и один раз 20 мл воды. Испарением растворителя до небольшого объема получают кристаллы целевого продукта. Двукратной перекристаллизацией из этилацетата получают 340 мг очень чистого продукта.
13C-ЯМР (CDCl3 + ДMCO-d6), δ : 178, 162, 141, 137, 127, 125, 124, 111, 46, 29 ч/млн.
1H-ЯМР (CDCl3 + ДMCO-d6), δ : 3,3 ч/млн (т), 3,9 ч/млн (м), 6,85 ч/млн (д), 6,9 ч/млн (м), 7,2 ч/млн (д), 7,25 ч/млн (д).
Пример 116. N-[2-(2-Фтор-6-хлор)фенэтил]-N'-(2-тиазолил) тиомочевина.
В 30 мл диэтилового эфира растворяют 2-хлор-6-фторфенилацетонитрил (2,5 г, 14,7 ммоль) и к раствору в течение 10 мин небольшими порциями прибавляют литийалюминийгидрид (1,5 г). Затем смесь кипятят 15 мин и после охлаждения до комнатной температуры медленно добавляют 1,5 мл воды, 1,5 мл водной гидроокиси натрия и 4 мл воды. Эфирный раствор, содержащий целевой 2-хлор-6-фторфенэтиламин, декантируют и растворитель удаляют в вакууме.
Соединением полученного амина с продуктом примера 103 по методике примеров 104 и 105 получают после перекристаллизации из этанола 270 мг указанного соединения.
1H-ЯМР (ДMCO-d6), δ : 3,1 ч/млн (т), 3,85 ч/млн (м), 7,1 ч/млн (д), 7,15-7,3 ч/млн (м), 7,4 ч/млн (д).
Пример 117. N-[2-(3-Метокси)фенэтил]-N'-(2-тиазолил) тиомочевина.
По методике, аналогичной методике примера 105, проводят реакцию продукта примера 103 с 3-метоксифенэтиламином с получением указанного соединения.
1H-ЯМР (ДMCO- d6), δ : 2,9 (т, Ph, CH2, 2H), 3,75 (с, OCH3, 3H), 3,9 (к, CH2N, 2H), 6,8 (м, о- и n-, 4H), 7,1 (д, тиазол, 1H), 7,2 (т, м-, 1H), 7,4 (д, тиазол, 1H).
Пример 118. N-(2-Фенэтил)-N'-[2-(5-метил)пиридил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амин-5-метилпиридина (1,08 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 125oC. Через 16,54 реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (4х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый продукт очищают вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) с получением 2,01 г (74%) указанного соединения, перекристаллизацией которого из смеси этилацетат/гексан получают 1,72 г указанного соединения в виде белых кристаллов, т.пл. 153-154oC.
ИК (KBr), см-1: 3235, 2939, 1613, 1559, 1534, 1493, 1300, 1188.
1H-ЯМР (300 Мгц, ДMCO-d6), δ : 11,56 (уш.с, 1H), 10,42 (с, 1H), 7,84 (д, J= 1,3 Гц, 1H), 7,52 (дв.д, J=8,5 и 2,1 Гц, 1H), 7,31-7,16 (м, 5H), 6,99 (д, J=8,5 Гц, 1H), 3,82-3,75 (м, 2H), 2,87 (т, J=7 Гц, 2H), 2,16 (с, 3H).
МС (FD), m/e: 271 (M+).
УФ (EtOH): 298 нм ( ε = 14080), 268 нм ( ε = 21638), 248 нм ( ε =15905).
Найдено,%: C 66,33; H 6,26; N 15,33.
C15H17N3S
Вычислено,%: C 66,39; H 6,31; N 15,48.
Пример 119. N-Метил-N-(5-фенэтил)-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 105, реакцией продукта из примера 103 с N-метилфенэтиламином.
1H-ЯМР (ДMCO-d6), δ : 2,9 (т, PhCH2, CH), 3,2 (с, NCH3, 3H), 4 (т, CH2N, 2H), 6,8 (т, тиазол, 1H), 7,2 (м, тиазол, 1H), 7,3 (м, C6P5, 5H).
Пример 120. N-(2-Инданил)-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 105, реакцией продукта из примера 103 с 2-инданиламином.
1H-ЯМР (ДMCO-d6), δ : 2,4 (к, CH2, 2H), 3,3 (к, CH2, 2H), 4,8 (к, CHN, 1H), 7 (д, тиазол, 1H), 7,1-7,3 (м, C6H4, 4H), 7,4 (д, тиазол, 1H).
Пример 121. N-[2-(2-Азидо)фенэтил]-N'-(2-тиазолил)тиомочевина.
В 15 мл воды при 0oC растворяют 2-аминофенэтиловый спирт (олжрис, 0,8 г, 5,8 ммоль), к раствору добавляют трифторуксусную кислоту (1,2 мл), затем добавляют нитрит натрия (0,41 г, 0,6 ммоль), растворенный в холодной воде (2 мл), и полученный раствор перемешивают 10 мин при 0oC.
Медленно прибавляют азид лития (0,59 г, 12 ммоль) в воде (2 мл) и раствор доводят до комнатной температуры. Раствор экстрагируют диэтиловым эфиром (3 х 50 мл), органическую фазу промывают 1 н. водн. HCl (2 х 20 мл), сушат над Na2SO4, фильтруют и испаряют.
Остаток в атмосфере азота растворяют в дихлорметане (20 мл), раствор охлаждают до -10oC и к нему добавляют этилдиизопропиламин (1,1 мл, 6,4 ммоль).
По каплям прибавляют ангидрид трифторметансульфоновой кислоты (0,87 мл, 5,17 ммоль), раствор перемешивают 20 мин при 0oC, после чего при интенсивном перемешивании добавляют раствор аммиака (г) в метаноле (50 мл, насыщенный при 0oC). Раствор перемешивают 40 мин при комнатной температуре, разбавляют водой (100 мл) и экстрагируют дихлорметаном (2 х 50 мл). Кислотно-основным распределением (NH4OH, водный, HCl, водная)) и испарением получают 2-азидофенэтиламин.
По методике, аналогичной методике примеров 104 и 105, проводят реакцию продукта из примера 103 с 2-азидофенэтиламином и получают указанное соединение.
1Н-ЯМР (ДMCO-d6), δ : 2,9 (т, PhCH2, 2H), 3,8 (к, CH2N, 2H), 7 - 7,4 (м, Ph-O, м-, n-, триазол, 6H).
Пример 122. N-[2-(3-Фтор)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 105, реакцией продукта из примера 103 с 3-фторфенэтиламином.
1Н-ЯМР (ДMCO-d6), δ : 2,9 (т, PhCH2, 2H), 3,8 (к, CH2N, 2H), 7 - 7,4 (м, Ph-O, n-, м-, тиазол, 6H).
Пример 123. N-[2-(Бензолсульфонамид-4-этил]-N'-(2-тиазолил) тиомочевина.
Это соединение получено по методике, аналогичной методике примера 105, реакцией продукта из примера 103 с 4-(2-аминоэтил)бензолсульфонамидом.
1Н-ЯМР (ДMCO-d6), δ : 3 (т), 3,8 (м), 7,1 (д), 7,35 (м), 7,45 (д), 7,8 (д).
13С-ЯМР (ДMCO-d6-CDCl3), δ : 178, 162, 143, 142, 137, 129, 126, 112, 45, 34.
Пример 124. N-[2-(3,4-Диметокси)фенэтил]-N'-(2-тиазолил) тиомочевина.
Это соединение получено по методике, аналогичной методике примера 105, реакцией продукта из примера 103 с 3,4-диметоксифенэтиламином.
1Н-ЯМР (ДMCO-d6-CDCl3), δ : 2,95 (т), 3,7 (т), 3,85 (с), 3,9 (с), 6,8 (с), 6,9 (с), 7,4 (д).
Пример 125. N-(Фенилпропан-1-ол-2-ил)-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 105, реакцией продукта из примера 103 с норэфедрином.
1Н-ЯМР (ДMCO-d6), δ : 0,95 (д), 4,25 (м), 4,95 (д), 7,1 - 7,5 (м).
Пример 126. N-[2-(2-Пиридил)этил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено реакцией продукта из примера 103 с 2-(2-аминоэтил)пиридином по методике, аналогичной методике примера 105.
1Н-ЯМР (ДMCO-d6), δ : 3,1 (т), 4 (м), 7,1 (д), 7,2 - 7,4 (м), 7,7 (м), 8,5 (д), 9,8 (с), 11,7 (с).
Пример 127. N-[2-(2,5-Диметокси)фенэтил]-N'-(2-тиазолил) тиомочевина.
Это соединение получено реакцией продукта из примера 103 с 2,6-диметоксифенэтиламином по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3), δ : 3 (т), 3,73 (с), 3,77 (с), 3,97 (м), 6,7 - 6,85 (м), 7,24 (д), 10,8 (с).
13С-ЯМР (CDCl3), δ : 177, 162, 153, 152, 138, 128, 117, 112, 111, 111, 56, 56, 46, 30.
Пример 128. N-[1-(2-Фенил)пропанил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено реакцией продукта из примера 103 с 1-амино-2-фенилпропаном по методике, аналогичной методике примера 105.
1Н-ЯМР (ДMCO-d6), δ : 1,2 (д), 3,13 (к), 3,7 (т), 7,09 (д), 7,2 - 7,5 (м). Широкие пики, δ : 8,14; 9,33; 9,75 и 10,57.
Пример 129. N-[2-(3-Индолил)этил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено реакцией продукта из примера 103 с триптамином по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3 + CD3OD), δ : 7,68 - 7,06 (м, 6H, индол, тиазол), 6,84 (д, J = 3,7 Гц, 1H, тиазол), 4,02 (т, J = 7 Гц, 2H, CH2NH), 3,26 (т, J = 6,9 Гц, 2H, CH2).
13С-ЯМР (CDCl3 + CD3OD), δ : 177 (тиазол), 161 (тиазол), 137 (тиазол), 136 (индол), 127 (индол), 123 (индол), 121 (индол), 118 (индол), 117 (индол), 111 (тиазол), 110 (индол), 109 (индол), 46 (CH2), 26 (CH2).
Пример 130. N-[2-(2-Гидроксиэтокси)этил]-N'-(2-тиазолил) тиомочевина.
Это соединение получено реакцией продукта из примера 103 с 2-(2-аминоэтокси)этанолом по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3), δ : 7,34 (д, J = 3,4 Гц, 1H, тиазол), 6,84 (д, J = 3,4 Гц, 1H, тиазол), 3,95 (т, J = 4,9 Гц, 2H, CH2NH), 3,76 (м, 4H, CH2), 3,66 (т, J = 4,3 Гц, 2H, CH2).
13С-ЯМР (CDCl3), δ : 177,4 (C=S), 161,8 (тиазол), 137,5 (тиазол), 111,2 (тиазол), 72,1, 68,4, 61,5, 44,9.
Пример 131. N-[2-(5-Нитропирид-2-ил)аминоэтил]-N'-(2-тиазолил) тиомочевина.
Это соединение получено реакцией продукта из примера 103 с 2-(2-аминэтиламино)-5-нитропиридином по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3 + CD3OD), δ : 8,95 (д, 1H, пир.), 8,12 (дв. д, 1H, пир.), 7,26 (д, J = 3,8 Гц, 1H, тиазол), 6,86 (д, J = 3,8 Гц, 1H, тиазол), 6,52 (д, 1H, пир.), 3,99 (т, 2H, CH2NH), 3,78 (т, 2H, CH2).
Пример 132. N-[2-(1-Метилпирролид-2-ил)этил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено реакцией продукта из примера 103 с 2-(2-аминоэтил)-1-метилпирролидином по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3), δ : 7,32 (д, J = 4 Гц, 1H, тиазол), 6,83 (д, J = 3,6 Гц, 1H, тиазол), 3,78 (к, 2H, CH2NH), 3,08 [м, 1H, NCH(CH2)2], 2,34 (с, 3H, N-CH3), 2,16 (м, 2H, NCH2), 2,01 (м, 2H, CH2), 1,7 (м, 4H, пир.).
13С-ЯМР (CDCl3), δ : 177 (C=S), 161 (тиазол), 137,5 (тиазол), 111,1 (тиазол), 64,1 (пир. ), 57,1 (пир.), 43,1 (CH2), 40,6 (CH2), 32,1 (пир.), 30,3 (пир.), 22,2 (пир.).
Пример 133. N-[2-(2,4-Дихлор)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено реакцией продукта из примера 103 с 2,4-дихлорфенэтиламином по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3 + CD3OD), δ : 7,4 (д, 1H, тиазол), 7,41 (с, 1H, Cl2Ph), 7,24 (м, 2H, Cl2Ph), 6,87 (д, 1H, тиазол), 3,95 (т, 2H, CH2NH), 3,14 (т, 3H, CH2).
Пример 134. N-[1,1-(2-n-Гидроксифенил)метоксикарбонилэтил] -N'-(2-тиазолил)тиомочевина.
Это соединение получено реакцией продукта из примера 103 с метиловым эфиром тирозина по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3), δ : 7,25 (д, J = 3,3 Гц, 1H, тиазол), 7,02 (д, J = 8,2 Гц, 2H, тир. ), 6,82 (д, J = 3,4 Гц, 1H, тиазол), 6,74 (д, J = 8,2 Гц, 2H, тир.), 5,29 (т, 1H, CH), 3,73 (с, 3H, CH3), 3,19 (д, 2H, CH2).
13С-ЯМР (CDCl3), δ : 177,4 (C=S), 171,5 (CO2Me), 161,2 (тиазол), 155,4 (тир. ), 136,9 (тиазол), 130 (тир. ), 126,2 (тир. ), 115 (тир.), 111,1 (тиазол), 59 (CH), 51,9 (CH3), 36,4 (CH2).
Пример 135. 1-(2-Тиазолил)-4-(n-гидроксибензил-2-тиогидантоин.
Это соединение получено в качестве побочного продукта в синтезе соединения из примера 134.
1Н-ЯМР (CDCl3 + CD3OD), δ : 7,78 (д, 1H, тиазол), 7,5 (д, 1H, тиазолил), 7,07 (д, 2H, тир.), 6,78 (д, 2H, тир.), 4,5 (т, 1H, CH), 3,15 (м, 2H, CH2).
Пример 136. N-(2-транс-Фенилциклопропил)-N'-(2-тиазолил) тиомочевина.
Это соединение получено реакцией продукта из примера 103 с транс-2-фенилциклопропиламином по методике, аналогичной методике примера 105.
1Н-ЯМР (CDCl3 + CD3OD), δ , 7,32 (д, J = 3,8 Гц, 1H, тиазол), 7,23 (м, 5H, Ph), 3,38 (м, 1H, CHNH), 2,27 (м, 1H,CH), 1,91 (м, 2H, CH2).
13C-ЯМР (CDCl3+CD3OD), δ: 179,2 (C=S), 161,7 (тиазол), 139,8 (Ph), 137,3 (тиазол), 128,2 (Ph), 126,5 (Ph), 126 (Ph), 111,2 (тиазол), 36,1 (CH), 35,1 (CH), 16,1 (CH2).
Пример 137. N-(4-Метил-3-пентенил)-N'-(2-тиазолил)тиомочевина.
Исходный 4-метил-3-пентиламин получен из 5-бром-2-метил-2-пентена.
4-Метил-3-пентениламин. К раствору 5-бром-2-метил-2-пентена (1,63 г, 10 ммоль ) в 5 мл ДМФА добавляют LiN3 (1 г, 20 ммоль) и раствор перемешивают два дня при комнатной температуре. Затем реакционную смесь переносят в смесь гексана с насыщенным раствором NH4Cl. Органическую фазу промывают насыщенным раствором NH4Cl, рассолом и водой. После высушивания растворитель удаляют и сырой азид подвергают реакции с LiAlH4 (380 мг, 10 ммоль) в эфире и при 0oC. Через 2 ч реакционную смесь нейтрализуют добавлением 380 мкл воды, 380 мкл 15%-ного раствора NaOH и 1,14 мл воды в указанном порядке. После фильтрования растворитель испаряют и разгонкой остатка в вакууме получают 0,42 г указанного амина, т.кип. 50oC/40 мм рт.ст.
1H-ЯМР (CDCl3), δ: 1,5 (широкий с, 2H), 1,6 (д, 3H), 1,7 (д,3H), 2,68 (к, 2H), 5,05-5,15 (м, 1H).
13C-ЯМР (CDCl3), δ : 17,7, 18,39, 25,66, 32,22, 42,03, 121,64, 133,5.
Это соединение получено реакцией продукта из примера 103 с 4-метил-3-пентениламином по методике, аналогичной методике примера 105, т.пл. 87,5-88,5oC.
Найдено,%: C 49,35; H 6,2; N 17,15.
Вычислено,%: C 49,76; H 6,26; N 17,41.
1H-ЯМР (CDCL3), δ : 1,65 (c,3H), 1,75 (c,3H), 2,4 (к,2H), 3,73 (м,3H), 5,1-5,25 (м, 1H), 6,83 (д,1H), 7,29 (д, 1H).
13C-ЯМР (CDCl3), δ : 17,93, 25,88, 27,31, 45,54, 111,22, 120,4, 135,1, 137,51, 161,94, 177,21.
Пример 138. N-(транс-3-Гексенил)-N'-(2-тиазолил)тиомочевина.
Исходный транс-гексениламин получен из транс-3-гексен-1-ола.
транс -3-Гексениламин. К перемешиваемому раствору транс-3-гексен-1-ола (5 г, 0,05 моль), Et3N (7,65 мл, 0,055 моль) и CH2Cl2 (70 мл) при -30oC добавляют 4,33 мл (0,055 моль) метансульфонилхлорида и раствор перемешивают 2 ч при -20oC. После добавления CH2Cl2 органическую фазу промывают насыщенным раствором NaHCO3, насыщенным раствором NH4Cl и водой, сушат (Na2SO4) и концентрируют в вакууме. В результате получают сырой мезилат, который растворяют в ДМФА (30 мл), после чего добавляют LiN3 (5 г, 100 ммоль). Реакционную смесь перемешивают примерно сутки и переносят в смесь эфира с рассолом. Эфирную фазу промывают рассолом (2х) и сушат (Na2SO4). Эфирный раствор концентрируют примерно до 100 мл и охлаждают до 0oC, после чего добавляют 1,9 г (50 ммоль) LiAlH4. Через 1 ч реакционную смесь нейтрализуют последовательным добавлением 1,9 мл воды, 1,9 мл 15%-ного раствора NaOH и 5,7 мл воды. После фильтрования, испарения растворителя и перегонки остатка в вакууме получают 2,35 г указанного амина, т.кип. 34oC/20 мм рт. ст.
1H-ЯМР (CDCl3), δ : 0,92,-1,05 (м, 3H), 1,75 (широкий с, 2H), 1,95-2,2 (м, 4H), 2,68-2,75 (м, 2H), 5,27-5,63 (м, 2H).
13C-ЯМР (CDCl3), δ: 13,8, 25,55, 36,62, 41,56, 126,1, 134,48.
Реакцией транс-3-гексениламина с продуктом из примера 103 по методике, аналогичной методике примера 105, получено указанное соединение, т.пл. 116-117oC.
Найдено,%: C 49,6; H 6,3; N 17,4.
Вычислено,%: C 49,76; H 6,26; N 17,41.
1H-ЯМР (CDCl3), δ : 0,98 (т,3H), 2-2,1 (м, 2H), 2,41 (к,2H), 3,76 (к, 2H), 5,4-5,7 (м, 2H), 6,83 (д, 1H), 7,29 (д, 1H), 10,8 (широкий с, 1H), 11,35 (широкий с, 1Н).
13C-ЯМР (CDCl3), δ : 13,72, 25,65, 45,42, 111,25, 124,97, 135,56, 137,5, 161,95, 177,14.
Пример 139. N-[2-(Цикло-2-пентен-1-ил)этил]-N'-(2-тиазолил)тиомочевина.
Исходный 2-(цикло-2-пентен-1-ил)этиламин получен из 2-циклопентен-1-ил-уксусной кислоты.
2-(Цикло-2-пентен-1-ил)этиламин. В 100 мл эфира растворяют 2-циклопентен-1-ил-уксусную кислоту (5 мл, 0,042 моль) и порциями добавляют LiAlH4 (2,4 г, 0,063 моль). По окончании прибавления реакционную смесь перемешивают 2 ч при комнатной температуре. Затем реакционную смесь нейтрализуют последовательным добавлением 2,4 г воды 2,4 г 15%-ного раствора NaOH и 7,2 мл воды. Фильтрованием и испарением получают 4,45 г сырого 2-(цикло-2-пентен-1-ил)этанола. Полученный спирт превращают в указанный амин по методике, аналогичной методике примера 138.
1H-ЯМР (CDCl3), δ : 1,4-1,8 (м,4H), 2-2,15 (м, 1H), 2,2-2,4 (м,3H), 2,6-2,8 (м, 3H), 5,6-5,8 (м, 2H).
Реакцией 2-(цикло-2-пентен-1-ил)этиламина с продуктом примера 103 по методике, аналогичной методике примера 105, получено указанное в заголовке соединение, т.пл. 139-140oC.
13 C-ЯМР (CDCl3), δ : 29,68, 31,78, 40, 40,64, 42,97, 130,29, 134,61.
Найдено,%: C 52,2; H 6,05; N 16,35.
Вычислено,%: C 52,14; H 5,97; N 16,58.
1H-ЯМР (CDCl3), δ : 1,42-1,58 (м, 1H), 1,62-1,92 (м, 2H), 2,06-2,45 (м, 3H), 2,72-2,86 (м, 1H), 3,71-3,84 (м,2H), 5,7-5,8 (м,2H), 6,85(д, 1H), 7,32 (д, 1H), 10,9(широкий с, 1H), 10,96 (широкий с, 1H).
13C-ЯМР (CDCl3), δ : 29,71; 32,01; 34,77; 43,23; 44,31; 111,15; 131,19; 134,13; 137,66; 161,99; 177,28.
Пример 140. N-[2-(транс-3-Пентенил)]-N'-(2-тиазолил)тиомочевина.
Исходный транс-3-пентен-1-ол получен восстановлением 3-пентин-1-ола литийалюминийгидридом в кипящем тетрагидрофуране, после чего по методикам примеров 106 и 112 получено указанное соединение, т.пл. 129-129,5oC.
1H-ЯМР (250 МГц, CDCL3), δ : 7,28 (д,1H, CH=CH), 6,83 (д,1H, CH=CH), 5,66-5,38( м, 2H, транс-CH=CH), 3,67 (к, 2H, CH2-NH), 2,37 (к, 2H, CH2-CH= CH), 1,72 (дв.д,3H, CH=CH-CH3).
13C-ЯМР (250 МГц, CDCl3), δ : 177, 162, 138, 129, 127, 111, 46, 32, 18.
Найдено,%: C 47,9; H 5,8; N 17,8.
C9H13N3S2
Вычислено,%: C 47,5; H 5,7; N 18,5.
Пример 141. N-[2-(цис-3-Пентенил)]-N'-(2-тиазолил)тиомочевина.
Исходный цис-3-пентен-1-ол получен восстановлением 3-пентин-1-ола водородом в ацетоне примерно при 5 psi (0,35 кг/см2) в присутствии в качестве катализатора палладия на карбонате кальция (катализатор Линдлара), после чего по методикам примеров 106 и 112 получено указанное соединение, т.пл. 76,5oC.
1H-ЯМР( 250 МГц, CDCl3), δ : 7,3 (д, 1H, CH=CH), 6,83 (д,1H, CH=CH), 5,73 -5,74 (м, 2H, цис-CH=CH), 3,76 (к, 2H, CH2-NH), 2,48 (к, 2H, CH=CH-CH2), 1,66 (д, 3H, CH=CH-CH3).
13C-ЯМР (250 МГц, CDCl3), δ : 177, 162, 138, 127, 126, 111, 45, 26.
Пример 142. N-[2-(2-Метил)фенэтил]-N'-(2-тиазолил)тиомочевина.
Исходный 1-метилфенэтанол получен восстановлением о-толилуксусной кислоты литийалюминийгидридом в кипящем тетрагидрофуране, после чего по методикам примеров 106 и 112 синтезировано указанное соединение, т.пл. 143-144oC.
Пример 143. N'-[2-(3,4,5-Триметокси)фенэтил]-N-(2-тиазолил)тиомочевина.
Исходный 2-(3,4,5-триметокси)фенэтиламин получен восстановлением 3,4,5-триметоксибензонитрила в присутствии хлорида кобальта и боргидрида натрия по общей методике (приведенной в статье: L.S., Heinzwan. J.Am. Chem. Soc,104, c. 6801, 1982).
В 70 мл метанола растворяют 3,4,5-триметоксибензонитрил (965 мг, 5 ммоль) и хлорид кобальта (2,37 г, 10 ммоль) и к раствору добавляют боргидрид натрия (1,89 г, 50 ммоль). Через 3 ч реакционную смесь фильтруют через целит и концентрируют до небольшого объема. Остаток переносят в хлороформ и экстрагируют 1 н. HCl (100 мл). Органическую фазу отбрасывают. Водный раствор подщелачивают водным аммиаком и экстрагирует хлороформом. Органическую фазу сушат над сульфатом магния и после высушивания в вакууме получают 427 мг 2-(3,4,5-триметокси)фенэтиламина.
1H-ЯМР (CDCl3), δ : 6,58 (с,2H, ТМРh), 3,85 (м, 8H, 2x MeO, CH2), 3,82 (c, 3H, OMe), 3,8(м, 2H, CH2).
Затем по методике примера 105 получено указанное соединение.
1H-ЯМР (CDCl3), δ : 7,26 (д, 1H, тиазол), 6,85 (д, 1H, тиазол), 6,64 (с, 2H, TMPh), 4,84 (д, J=5,7 Гц, 2H, CH2NH), 3,86 (м, 11H, CH2, MeO).
13C-ЯМР (CDCl3), δ : 177 (C=S), 161 (тиазол), 153 (TMPh), 138 (TMPh), 137 (тиазол), 132 (TMPh), 111 (тиазол), 104,8 (TMPh), 61 (MeO), 56,1 (MeO), 53 (CH2), 50 (CH2).
Пример 144. N-[2-(2,4-Дифтор)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 143, с использованием 2,4-дифторфенилацетонитрила.
1H-ЯМР (CDCl3), δ : 7,26 (м, 1H, ДФРh), 7,2 (д, 1H, тиазол), 6,8 (д, 1H, тиазол), 6,75 (м, 2H, ДФРh), 3,85 (к, 2H, CH2NH), 3,04 (т, 2H, CH2).
Пример 145. N-[2-(2,6-Дифтор)фенэтил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике, аналогичной методике примера 143, с использованием 2,6-дифторфенилацетонитрила.
1H-ЯМР (CDCl3), δ : 7,23 (д, J=3,8 Гц, 1H, тиазол), 7,26-7,12 (м, 1H, ДФРh), 6,86 (м, 2H, ДФРh), 6,81 (д, J = 3,6 Гц, 1H, тиазол), 3,96 (к, 2H, CH2NH), 3,11 (т, J=7 Гц, CH2).
13C-ЯМР (CDCl3), δ : 177 (C=S), 164 и 159 (дв.д, C-F-связь, ДФPh), 162 (тиазол), 137 (тиазол), 128 (м, C-F-связь, ДФРh), 111 (тиазол), 110,8 (д, C-F-связь, ДФРh), 44,5 (CH2), 21,6 (CH2).
Пример 146. N-[2-(3,4-Метилендиокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
Указанное соединение синтезировано по методике примера 143 с использованием 3,4-метилендиоксифенилацетонитрила.
1H-ЯМР (CDCl3), δ : 7,24 (д, 1H, тиазол), 6,8 (м, 3H, Ph, тиазол), 6,74 (с, 1H, Ph), 5,93 (с, 2H, OCH2O), 3,94 (к, 2H, CH2NH), 2,93 (т, 2H, CH2).
13C-ЯМР (CDCl3), δ : 177,3 (C=S), 161,6 (тиазол), 148 (Ph), 146 (Ph), 137,4 (тиазол), 132,1 (Ph), 111,1 (тиазол), 109,2 (Ph), 108,2 (Ph), 100,7 (OCH2O), 47 (CH2), 34,4 (CH2).
Пример 147. N-[2-(4-Трифторметил)фенэтил]-N'-(2-тиазолил)тиомочевина.
Данное соединение получено по методике примера 143 с использованием 4-трифторметилфенилацетонитрила.
1H-ЯМР (CDCl3+CD3OD), δ : 7,57 (д, J=8,3 Гц, 2H, ТМФPh), 7,4 (д, J=8,3 Гц, 2H, ТМФPh), 7,19 (д, J=3,7 Гц, 1H, тиазол), 6,83 (д, J=3,7 Гц, 1H, тиазол), 3,95 (т, J=7,2 Гц, 2H, CH2NH), 3,08 (т, 2H, CH2).
Пример 148. (RS)-N-[2-Метил-2-(2,6-дифтор)фенэтил] -N'-(2- тиазолил)тиомочевина.
В течение 2 ч ведут реакцию между 2,6-дифторбензилцианидом (1,24 мл, 10 ммоль) и гидридом натрия (360 мг, 12 ммоль) в ТГФ (5 мл), после чего к реакционной смеси добавляют йодметан. Через 30 мин реакционную смесь обрабатывают и продукт выделяют колоночной хроматографией на силикагеле. Получено 985 мг (59%) продукта.
1H-ЯМР (CDCl3), δ : (смесь двух стереоизомеров) 7,28 (м, 1H, ДФРh), 6,98 (м, 2H, ДФРh), 4,26 (м, 1H, CH), 1,69 и 1,66 (2 x с, 3H, CH3).
Использованием по методике примера 143 2-метил-2-(2,6- дифтор)фенэтиламина получено указанное в заголовке соединение.
1H-ЯМР (CDCl3), δ : (R- и S-стереосмесь) 7,12 (м, 2H, ДФРh, тиазол), 6,85 (т, 2H, ДФРh), 6,77, 6,76, 6,75, 6,74 (2д, J=3,6 Гц, 1H, тиазол), 4,11 (м, 1H, CH), 4,05-3,65 (м, 2H, CH2), 1,45, 1,42 (2с, 3H, CH3).
Пример 149. N-[2-(2-Бром)фенэтил]-N'-(2-тиазолил)тиомочевина.
Указанное соединение получено по методике примера 143 с использованием 2-бромфенилацетонитрила.
1H-ЯМР (ДMCO-d6), δ : 2,9 (т, PhCH2, 2H), 3,05 (т, PhCH2, 2H), 3,8 (к, CH2N, 2H), 7,1 (д, тиазол, 1H), 7,15-7,6 (м, o-, м-, n-, тиазол, 5H).
Пример 150. N-[2-(1-Фенил-1-циклопропан)этил]-N'-(2-тиазолил)тиомочевина.
Это соединение получено по методике примера 116 с использованием 1-фенил-1-циклопропанкарбонитрила.
1H-ЯМР (CDCl3), δ : 1 (д), 3,8 (д), 6,9 (д), 7,2-7,4 (м), 7,9, 9,5 (NH).
Пример 151. N-[2-(2,6-Диметокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
Исходный 2,6-диметоксифенэтиламин получен на основе 2,6-диметоксибензальдегида. Реакцией с нитрометаном по методике (приведенной в изд. Yogel. Справочник практической органической химии, с. 176, Лонгман, 1978, 4-е изд. ), получают 2,6-диметокси- β - нитростирол. Полученное соединение (1,1 г, 5,3 ммоль) растворяют в смеси диэтилового эфира с тетрагидрофураном (2:1, 200 мл) и к раствору небольшими порциями добавляют литийалюминийгидрид (0,5 г, 13 ммоль). Смесь кипятят 120 мин и затем обрабатывают 0,6 мл воды, 0,6 мл 15%-ного водного NaOH и 1,8 мл воды. Смесь фильтруют, очищают кислотно-основным распределением (NH4OH водный, разбавленная HCl водная) и испаряют. Полученный в качестве сырого продукта 2,6-диметоксифенэтиламин достаточно чист, чтобы быть использованным непосредственно на следующей стадии, на которой его реакцией с продуктом из примера 103 по методике примера 105 получают указанное соединение.
1H-ЯМР (ДMCO-d6), δ : 2,9 (т, PhCH2, 2H), 3,7 (к, CH2N, 2H), 3,8 (с, OCH3, 6H), 6,7 (д, o-, 2H), 7,1 (д, тиазол, 1H), 7,2 (т, n-, 1H), 7,3 (д, тиазол, 1H).
Пример 152. N-[2-(3,5-Диметокси)фенэтил]-N'-(тиазолил)тиомочевина.
Это соединение получено по методике примера 151 реакцией продукта из примера 103 с 3,5-диметоксифенэтиамином, полученным из 3,5-диметоксибензальдегида.
1H-ЯМР (ДMCO-d6), δ : 2,8 (т, PhCH2, 2H), 3,65 (с, OCH3, 6H), 3,7 (к, CH2N, 2H), 6,3 (т, n-, 1H), 6,4 (т, o-, 2H), 7,1 (д, тиазол, 1H), 7,3 (д, тиазол, 1H).
Пример 153. N-[2-(3,5-Дихлор)фенэтил]-N'-(2-тиазолил)тиомочевина.
Данное соединение синтезировано по методике примера 151 реакцией продукта из примера 103 с 3,5-дихлорфенэтиламином, полученным из 3,5-дихлорбензальдегида.
1H-ЯМР (ДMCO-d6), δ : 2,9 (т, PhCH2, 2H), 3,8 (к, CH2N, 2H), 7,1 (д, тиазол, 1H), 7,3 (м, o- и n-, 3H), 7,4 (д, тиазол, 1H).
Пример 154. N-[2-(2,5-Дихлор-6-гидрокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2,5-дихлор-6-гидроксифенэтиламином, полученным из 2,5-дихлор-6-гидроксибензальдегида.
1H-ЯМР (CDCl3), δ : 3 (т, PhCH2, 2H), 3,9 (к, CH2N, 2H), 6,9 (д, o-, 1H), 7,1 (д, тиазол, 1H), 7,2 (д, n-, 1H), 7,3 (д, тиазол, 1H).
Пример 155. N-[2,3,6-Трихлор)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2,3,6-трихлорфенэтиламином, полученным из 2,3,6-трихлорбензальдегида.
1H-ЯМР (ДMCO-d6), δ : 3,3 (т, PhCH2, 2H), 3,4 (к, CH2N, 2H), 7,1 (д, тиазол, 1H), 7,4 (д, тиазол, 1H), 7,5-7,5 (м, м- и n-, 2H).
Пример 156. N-[2-(2,3,4-Трифтор)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию 2,3,4-трифторфенэтиламина, полученного из 2,3,4-трифторбензальдегида, с продуктом из примера 103.
1H-ЯМР (CDCl3), δ : 3 (т, PhCH2, 2H), 4 (к, CH2N, 2H), 6,8 (д, тиазол, 1H), 6,85-7,6 (м, м- и o-, 2H), 7,2 (д, тиазол, 1H).
Пример 157. N-[2-(2,3,4-Трихлор)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2,3,5-трихлорфенэтиламином, полученным из 2,3,5-трихлорбензальдегида.
1H-ЯМР (ДMCO-d6), δ : 3,05 (т, PhCH2, 2H), 3,9 (к, CH2N, 2H), 7,1 (д, тиазол, 1H), 7,4 (д, тиазол, 1H), 7,5 (д, o-, 1H), 7,7 (д, n-, 1H).
Пример 158. N-[2-(2,4-Диметокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2,4-диметоксифенэтиламином, полученным из 2,4-диметоксибензальдегида.
1H-ЯМР (CDCl3+CD3OD), δ : 7,23 (д, J=3,6 Гц, 1H, тиазол), 7,1 (д, J=7,8 Гц, 1H, DMPh), 6,81 (д, J=3,6 Гц, 1H, тиазол), 6,44 (с, 1H, DMPh), 6,42 (д, 1H, ДMPh), 3,87 (т, 2H, CH2N), 3,8 (с, 3H, OMe), 3,79 (с, 3H, OMe), 2,94 (т, 2H, CH2).
13C-ЯМР (CDCl3 + CD3OD), δ : 177, 3 (C=S), 161,6 (тиазол), 159,7 (ДMPh), 158,4 (ДMPh), 137,5 (тиазол), 130,9 (ДMPh), 119,1 (ДMPh), 110,9 (тиазол), 103,8 (ДMPh), 99,3 (ДMPh), 55,3 (OMe), 55,1 (OMe), 45,5 (CH2), 28,7 (CH2).
Пример 159. N-[2-(2,3-Диметокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2,3-диметоксифенэтиламином, полученным из 2,3-диметоксибензальдегида.
1H-ЯМР (CDCl3), δ : 7,23 (д, J = 3,7 Гц, 1H, тиазол), 7,02-6,83 (м, 3H, ДMPh), 6,79 (д, J = 3,6 Гц, 1H, тиазол), 3,99 (к, J = 8,9 Гц, 2H, CH2N), 3,87 (с, 3H, OMe), 3,86 (с, 3H, OMe), 3,05 (т, 2H, CH2).
13C-ЯМР (CDCl3), δ : 177,3 (C=S), 161,6 (тиазол), 152,6 (ДMPh), 147,3 (ДMPh), 137,3 (тиазол), 132 (ДMPh), 123,7 (ДMPh), 122,2 (ДMPh), 110,9 (тиазол), 110,8 (ДMPh), 60,6 (OMe), 55,5 (OMe), 45,8 (CH2), 28,9 (CH2).
Пример 160. N-[2-(2,3,5,6-Тетрафтор)фенэтил]-N'-(2-тиазолил)мочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2, 3,5,6-тетрафторфенэтиламином, полученным из 2,3, 5,6-тетрафторбензальдегида.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,24 (д, J = 3 Гц, 1H, тиазол), 6,98 (м, C-F-связь, 1H, ТФPh), 6,83 (д, J = 3 Гц, 1H, тиазол), 3,99 (т, J = 6,8 Гц, 2H, CH2N), 3,18 (т, J = 6,9 Гц, 2H, CH2).
13C-ЯМР (CDCl3), δ : 178,2 (C=S), 161,5 (тиазол), 147,6 (м, ТФPh), 143,6 (м, ТФPh), 137,3 (тиазол), 117,6 (т, ТФPh), 111,1 (тиазол), 104,3 (т, ТФPh), 53,3 (CH2), 43,7 (CH2).
Пример 161. N-[2-(2-Метокси-5-бром)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2-метокси-5-бромфенэтиламином, полученным из 2-метокси-5-бромбензальдегида.
1H-ЯМР (CDCl3), δ : 7,34 (м, 3H, МБPh и тиазол), 6,81 (д, J = 3,6 Гц, 1H, тиазол), 6,72 (д, J = 8,4 Гц, 1H, МБPh), 3,95 (к, 2H, CH2N), 3,79 (с, 3H, OMe), 2,98 (т, J = 6,8 Гц, 2H, CH2).
Пример 162. N-[2-(2-Этокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2-этоксифенэтиламином, полученным из 2-этоксибензальдегида.
1H-ЯМР (250 МГц, CDCl3), δ : 7,37-7,16 (м, 2H, аром.). 7,22 (д, 1H, δ), 6,91-6,78 (м, 2H, аром. ), 6,78 (д, 1H, δ), 4,07-3,93 (2хк, 2х2H, CH2-NH, CH2-O), 3,04 (т, 2H, Ph-CH2), 1,42 (т,3H, OCH2CH3).
13C-ЯМР (250 МГц, CDCl3), ≡ : 178, 162, 157, 138, 131, 128, 127, 120, 111, 111, 63, 46, 30, 15.
Полученное соединение имеет т.пл. 140oC.
Найдено,%: C 54,4; H 5,6; N 13,3.
C14H17N3OS2
Вычислено,%: C 54,6; H 5,5; N 13,7.
Пример 163. N-[2-(2,3-Дихлор)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 151 проводят реакцию продукта из примера 103 с 2,3-дихлорфенэтиламином, полученным из 2,3-дихлорбензальдегида.
1Н-ЯМР (250 МГц, ДMCO-d6), ≡ : 7,55 (д, 1H, CHδCH), 7,42-7,32 (м, 3H, аром.), 7,12 (д, 1H, C δ CH, 3,86 (к, 2H, CH2NH), 3,12 (т, 2H, Ph-CH2).
13C-ЯМР (250 МГц, ДMCO-d6), ε : 178, 162, 138, 130, 129, 128, 112, 44, 33.
Пример 164. N-[2-(4-Хлорфенил)этил]-N'-[2-С4,5-диметил)тиазолил]тиомочевина.
Раствор 1-{ [2-(4,5-диметил)тиазолил]тиокарбонил}имидазола (10 ммоль) и 2-(4-хлорфенил)этиламина (1,55 г, 10 ммоль) в N, N-диметилформамиде (30 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 2,44 г (75%) указанного соединения.
ИК (KBr), см-1: 3170, 3024, 1550, 1260, 1212, 708.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,45 (ш.с, 1H), 9,8 (ш.с, 1H), 7,35 (д, J = 8 Гц, 2H), 7,3 (д, J = 8 Гц, 2H), 3,8 (м, 2H), 2,85 (т, J = 7 Гц, 2H), 2,2 (с, 3H), 2,05 (с, 3H).
МС (FD), m/e: 326 (M+).
УФ (EtOH): 297 нм ( ε = 17467), 257 нм ( ε = 10021), 219 нм ( δ = 16075), 201 нм ( ε = 22380).
Найдено,%: C 51,7; H 5,07; N 13,08.
C14H16N3S2Cl
Вычислено,%: C 51,6; H 4,95; N 12,89.
Пример 165. 1-[(2-Нафто[1,2]тиазолил)тиокарбамоил]имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (1,8 г, 20 ммоль) и 2-аминонафто[1,2]тиазола (2 г, 20 ммоль) в ацетонитриле (150 мл) перемешивают 24 ч при 65oC. Фильтрованием образовавшегося осадка получают 1,69 г (46%) указанного соединения.
ИК (KBr), см-1 : 3148, 2670, 1465, 736.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 9,2 (с, 1H), 8,85 (c,1H), 8,65 (д, J = 8 Гц, 1H), 8,2 (ш.с, 1H), 8-7,3 (м, 5H).
МС (FD), m/e: 309 (M+-H).
УФ (EtOH) : 383 нм ( ε = 8297), 244 нм ( δ = 15160), 226 нм ( ε = 17126).
Найдено,%: C 58,13; H 3,21; N 18,03.
C15H10N4S2
Вычислено,%: C 58,04; H 3,25; N 18,05.
Пример 166. N-(2-Фениэтил)-N'-(2-нафто[1,2]тиазолил)тиомочевина.
Раствор 1-[(2-нафто[1,2] тиазолил)тиокарбомоил[имидазола (1,69 г, 5 ммоль) и 2-фенилэтиламина (0,62 г, 5,2 ммоль) в N, N-диметилформамиде (20 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка и этилацетата получают 1,5 г (82%) указанного соединения.
ИК (KBr), см-1 : 3171, 3027, 1581, 1521, 1213, 695.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,7 (ш.с, 1H), 9,9 (ш.с, 1H), 8,25 (д, J = 8 Гц, 1H), 8 (д, J = 8 Гц, 2H), 7,8 (д, J = 8 Гц, 1H), 7,6-7,2 (м, 7H), 3,95 (м, 2H), 3,05 (т, J = 7 Гц, 2H).
МС (FD), m/e: 363 (M+).
УФ (EtOH) : 340 нм ( ε = 23922), 325 нм ( ε = 19262), 313 нм ( ε = 20808), 245 нм (δ = 39665), 209 нм (ε = 36141).
Найдено,%: C 65,86; H 4,84; N 11,48.
C20H17N3S2
Вычислено,%: C 66,09; H 4,71; N 11,56.
Пример 167. 1-{[2-(4-Метил)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (13,37 г, 75 ммоль) и 2-амино-4-метилтиазола (8,55 г, 75 ммоль) в ацетонитриле (150 мл) перемешивают 24 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 14,22 г (85%) указанного соединения.
ИК (KBr), см-1 : 3179, 2558, 1455, 1217, 737.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 8,55 (с, 1H), 7,9 (с, 1H), 7,05 (с, 1H), 6,9 (с, 1H), 2,3 (с, 3H).
МС (FD), m/e: 224 (M+-H).
УФ (EtOH): 359 нм ( ε = 10749), 291 нм (δ = 8720), 202 нм ( ε = 20498).
Найдено,%: C 42,90; H 3,54; N 24,89.
C8H8N4S2
Вычислено,%: C 42,84; H 3,59; N 24,98.
Пример 168. N-[2-(1-Циклогексенил)этил]-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1-{[2-(4-метил)тиазолил]тиокарбамоил}имидазола (2,24 г, 10 ммоль) и 2-(1-циклогексенил)этиламина (1,25 г, 10 ммоль) в N, N-диметилформамиде (25 мл) перемешивают 4 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией из этилацетата получают 2,4 г (86%) указанного соединения.
ИК (KBr), см-1 : 3177, 2918, 1565, 1505, 1202, 717.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (ш.с, 1H), 9,85 (ш.с, 1H), 6,65 (c, 1H), 5,45 (с, 1H), 3,65 (м, 2H), 2,25 (м, 5H), 1,9 (м, 4H), 1,55 (м, 4H).
МС (FD), m/e: 281 (M+).
УФ (EtOH): 291 нм ( ε = 19178), 257 нм ( δ = 9837), 201 нм ( ε = 16247).
Найдено, %: C 55,40; H 6,82; N 14,77.
C13H19N3S2
Вычислено, %: C 55,48; H 6,80; N 14,93.
Пример 169. N-[2-(2-Хлорфенил)этил]-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1-{[2-(4-метил)тиазолил]тиокарбомоил}имидазола (2,24 г, 10 ммоль) и 2-(2-хлорфенил)этиламина (1,56 г, 10 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 1,5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 2,4 г (77%) указанного соединения.
ИК (KBr), см-1: 3163, 3012, 1584, 1214, 754, 706.
1H-ЯМР (300 МГц, ДMCO-d6) ε : 11,6 (ш.с, 1H), 9,8 (ш.с, 1H), 7,5-7,2 (м, 4H), 6,65 (с, 1H), 3,85 (м, 2H), 3,05 (т, J = 7 Гц, 2H), 2,2 (с, 3H).
МС (FD), m/e: 311 (M+).
УФ (EtOH): 292 нм ( ε = 18641), 257 нм ( δ = 10471), 202 нм ( ε = 24729).
Найдено, %: C 49,99; H 4,56; N 13,45.
C13H14N3S2Cl
Вычислено, %: C 50,07; H 4,52; N 13,47.
Пример 170. N-[2-(3-Хлорфенил)этил]-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1-{ [2-(4-метил)тиазолил] тиокарбамоил} имидазола (2,24 г, 10 ммоль) и 2-(3-хлорфенил)этиламина (1,56 г, 10 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 1,5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 2,67 г (86%) указанного соединения.
ИК (KBr), см-1: 3171, 3016, 1581, 1214, 761, 713.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с,1H), 9,85 (ш.с, 1H), 7,4-7,2 (м, 4H), 6,65 (с, 1H), 3,85 (м, 2H), 2,95 (т, J = 7 Гц, 2H), 2,2 (с, 3H).
МС (FD), m/e: 311 (M+).
УФ (EtOH): 293 нм ( ε = 18976), 257 нм ( δ = 10523), 202 нм (ε = 27048).
Найдено, %: C 49,94; H 4,48; N 13,37.
C13H14N3S2Cl
Вычислено, %: C 50,07; H 4,52; N 13,47.
Пример 171. N-[2-(2-Хлорфенил)этил]-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1-{ [2-(4-метил)тиазолил] тиокарбамоил} имидазола (2,24 г, 10 ммоль) и 2-(4-хлорфенил)этиламина (1,56 г, 10 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 1,5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 2,52 г (81%) указанного соединения.
ИК (KBr), см-1: 3170, 3022, 1562, 1215, 744, 709.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с,1H), 9,85 (ш.с, 1H), 7,38 (д, J = 8 Гц, 2H), 7,3 (д, J = 8 Гц, 2H), 6,65 (с, 1H), 3,8 (м, 2H), 2,9 (т, J = 7 Гц, 2H), 2,18 (с, 3H).
МС (FD), m/e: 311 (M+).
УФ (EtOH): 292 нм ( ε = 16470), 257 нм ( δ = 9506), 219 нм ( ε = 20563).
Найдено,%: C 49,94; H 4,55; N 13,58.
C13H14N3S2Cl
Вычислено,%: C 50,07; H 4,52; N 13,47.
Пример 172. N-[2-(2-Метоксифенил)этил-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1-{[2-(4-метил)тиазолил]тиокарбамоил}имидазола (2,25 г, 10 ммоль) и 2-(2-метоксифенил)этиламина (1,51 г, 10 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 2,2 г (73%) указанного соединения.
ИК (KBr), см-1: 3173, 3024, 1568, 1246, 1206, 750, 694.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (ш.с,1H), 9,85 (ш.с, 1H), 7,2-6,8 (м, 4H), 6,65 (с, 1H), 3,75 (м, 5H), 2,9 (т, J = 7 Гц, 2H), 2,18 (с, 3H).
МС (FD), m/e: 307 (M+).
УФ (EtOH): 291 нм ( ε = 18637), 259 нм ( δ = 10786), 202 нм ( ε = 15565).
Найдено,%: C 54,68; H 5,50; N 13,46.
C14H17N3ОS2
Вычислено,%: C 54,70; H 5,57; N 13,67.
Пример 173. N-[2-(3-Метоксифенил)этил]-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1-{[2-(4-метил)тиазолил]тиокарбамоил}имидазола (2,24 г, 10 ммоль) и 2-(3-метоксифенил)этиламина (1,51 г, 10 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 3,5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 2,73 г (89%) указанного соединения.
ИК (KBr), см-1: 3170, 3029, 1586, 1213, 749, 691.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (ш.с,1H), 9,9 (ш.с, 1H), 7,2-6,8 (м, 4H), 6,65 (с, 1H), 3,8 (м, 2H), 3,72 (с, 3H), 2,85 (т, J = 7 Гц, 2H), 2,18 (с, 3H).
МС (FD), m/e: 307 (M+).
УФ (EtOH): 292 нм ( ε = 16935), 258 нм ( δ = 9604), 202 нм (ε = 27197).
Найдено,%: C 54,97; H 5,58; N 13,60.
C14H17N3ОS2
Вычислено,%: C 54,70; H 5,57; N 13,67.
Пример 174. N-[2-(2-Метоксифенил)этил]-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1-{[2-(4-метил)тиазолил]тиокарбамоил}имидазола (2,24 г, 10 ммоль) и 2-(4-метоксифенил)этиламина (1,51 г, 10 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 3 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 2,35 г (76%) указанного соединения.
ИК (KBr), см-1: 3171, 3009, 1565, 1511, 1218, 720, 514.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (ш.с,1H), 9,9 (ш.с, 1H), 7,2 (д, J = 8 Гц, 2H), 6,9 (д, J = 8 Гц, 2H), 6,65 (с, 1H), 3,8 (м, 2H), 3,75 (с, 3H), 2,85 (т, J = 7 Гц, 2H), 2,18 (с, 3H).
МС (FD), m/e: 307 (M+).
УФ (EtOH): 292 нм ( ε = 18700), 258 нм ( ε = 11165), 223 нм ( δ = 14043), 201 нм ( ε = 25520).
Найдено,%: C 54,62; H 5,55; N 13,69.
C14H17N3S2
Вычислено,%: C 54,70; H 5,57; N 13,67.
Пример 175. N-[2-(4-Метилфенил)этил] -N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 2-(4-метилфенил)этилизотиоцианата (1 г, 5,64 ммоль) и 2-амино-4-метилтиазола (0,44 г, 5,64 ммоль) в N,N-диметилформамиде (20 мл) нагревают 24 ч при 90oC. Растворитель удаляют в вакууме и перекристаллизацией полученного твердого остатка получают 0,67 г (41%) указанного соединения в виде белого твердого вещества.
ИК (KBr), см-1: 3170, 3020, 1562, 1507, 1203, 986.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (ш.с,1H), 9,9 (ш.с, 1H), 7,18 (д, J = 8 Гц, 2H), 7,18 (д, J = 8 Гц, 1H), 6,65 (с, 1H), 3,8 (м, 2H), 2,85 (т, J = 7 Гц, 2H), 2,26 (с, 3H), 2,18 (с, 3H).
МС (FD), m/e: 291 (M+).
УФ (EtOH): 292 нм ( ε = 18863), 257 нм ( δ = 10886), 202 нм ( ε = 21164).
Найдено,%: C 57,83; H 5,90; N 14,36.
C14H17N3S2
Вычислено,%: C 57,70; H 5,88; N 14,42.
Пример 176. N-[2-(2-Метоксифенил)этил]-N'-[2-(5-хлор)тиазолил]тиомочевина.
Раствор 1-{[2-(5-хлор)тиазолил]тиокарбамоил}имидазола (1,22 г, 5 ммоль) и 2-(2-метоксифенил)этиламина (0,77 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,86 г (53%) указанного соединения.
ИК (KBr), см-1: 3313, 2835, 1608, 1527, 1514, 1441, 1352, 1244, 1040.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (ш.с,1H), 8,4 (ш.с, 1H), 7,4 (с, 1H), 7,2 - 6,8 (м, 4H), 3,74 (с, 3H), 3,68 (м, 2H), 2,8 (т, J = 7 Гц, 2H).
МС (FD), m/e: 327 (M+).
УФ (EtOH): 295 нм ( ε = 14366), 261 нм ( δ = 12558), 203 нм ( ε = 31267).
Пример 177. N-[2-(3-Метоксифенил)этил]-N'-[2-(5-хлор) тиазолил]тиомочевина.
Раствор 1-{[2-(5-хлор)тиазолил]тиокарбамоил}имидазола (1,22 г, 5 ммоль) и 2-(3-меткосифенил)этиламина (0,77 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией остатка из этилацетата получают 0,86 г (53%) указанного соединения, т.пл. 106 - 107oC.
ИК (KBr), см-1: 3334, 2826, 1611, 1517, 1332, 1259, 1156, 1051, 777.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,4 (ш.с, 1H), 7,4 (с, 1H), 7,18 (м, 1H), 6,77 (м, 3H), 3,7 (м, 5H), 2,8 (т, J = 7 Гц, 2H).
МС (FD), m/e: 327 (M+).
УФ (EtOH): 295 нм ( ε = 13695), 260 нм ( δ = 11987), 203 нм ( ε = 32295).
Найдено, %: C 47,75; H 4,41; N 12,65.
C13H14N3OS2Cl
Вычислено, %: C 47,63; H 4,30; N 12,81.
Пример 178. N-[2-(4-Метоксифенил)этил] -N'-[2-(5-хлор) тиазолил]тиомочевина.
Раствор 1-{[2-(5-хлор)тиазолил]тиазолил]тиокарбамоил}имидазола (1,22 г, 5 ммоль) и 2-(4-метоксифенил)этиламина (0,77 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 1,2 г (74%) указанного соединения, т.пл. 156 - 158oC.
ИК (KBr), см-1: 3315, 2934, 1601, 1511, 1320, 1243, 1180, 1034, 745.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,4 (ш.с, 1H), 7,4 (с, 1H), 7,1 (д, J = 8 Гц, 2H), 6,8 (д, J = 8 Гц, 2H), 3,67 (с, 3H), 3,63 (м, 2H), 2,7 (т, J = 7 Гц), 2H).
МС (FD), m/e: 327 (M+).
УФ (EtOH): 295 нм ( ε = 13569), 260 нм ( ε 12490), 223 нм ( δ = 18432), 202 нм ( ε = 28264).
Найдено, %: C 47,59; H 4,34; N 12,53.
C13H14N3OS2Cl
Вычислено, %: C 47,63; H 4,30; N 12,81.
Пример 179. N-[2-(1-Цкилогексенил)этил]-N'-[2-(5-хлор) тиазолил]тиомочевина.
Раствор 1-{[2-(5-хлор)тиазолил]тиокарбамоил}имидазола (1,22 г, 5 ммоль) и 2-(1-циклогексенил)этиламина (0,645 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из хлористого метилена получают 0,83 г (55%) указанного соединения, т.пл. 145 - 147oC.
ИК (KBr), см-1: 3167, 2929, 1564, 1488, 1230, 1183, 1199, 1030, 685.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,4 (ш.с, 1H), 7,4 (с, 1H), 5,4 (с, 1H), 3,5 (м, 2H), 2,15 (т, J = 7 Гц, 2H), 1,9 (м, 4H), 1,5 (м, 4H).
МС (FD), m/e: 301 (M+).
УФ (EtOH): 295 нм ( ε = 14231), 259 нм ( δ = 11275), 204 нм ( δ = 20953).
Найдено, %: C 47,90; H 5,47; N 14,21.
C12H16N3S2Cl
Вычислено, %: C 47,75; H 5,34; 13,92.
Пример 180. 5-Бензил-3-фенил-2-тиогидантоин.
Раствор DL-фенилаланина (1,65 г, 10 ммоль) метил-N-фенилдитиокарбамата (1,85 г, 10 ммоль) и триэтиламина (1,4 мл, 10 ммоль) в этаноле (30 мл) кипятят 5 ч. Затем смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате, промывают 1 н. водной HCl и водой. Органический слой концентрируют и перекристаллизацией остатка из этанола получают 2,48 г (88%) указанного соединения, т.пл. 187 - 189oC.
МС (FD), m/e: 282 (M+).
Пример 181. 1-{[2-(5-Бром)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилимидазола (9,9 г, 50 ммоль) и 2-амино-5-бромтиазола (8,95 г, 50 ммоль) в ацетонитриле (200 мл) перемешивают 24 ч при 50oC. Фильтрованием образовавшегося осадка получают 5,38 г (37%) указанного соединения.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 9,3 (с, 1H), 8,25 (с, 1H), 7,63 (с, 1H), 7,43 (с, 1H).
МС (FD), m/e: 288, 290 (M+).
Пример 182. N-[2-(2-Хлорфенил)этил]-N'-[2-(5-бром)тиазолил] тиомочевина.
Раствор 1-{[2-(5-бром)тиазолил]тиокарбамоил}имидазола (0,72 г, 2,5 ммоль) и 2-(2-хлорфенил)этиламина (0,4 г, 2,5 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,06 г (5%) указанного соединения.
ИК (KBr), см-1: 3318, 2926, 1562, 1512, 1257, 1177, 1052, 749, 687.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,4 (ш.с, 1H), 7,4 - 7 (м, 5H), 3,8 (м, 2H), 2,9 (т, J = 7 Гц, 2H).
МС (FD), m/e: 375, 377 (M+).
УФ (EtOH): 291 нм ( ε = 15522), 258 нм ( δ = 11594), 202 нм ( ε = 29572).
Пример 183. N-[2-(3-Хлорфенил)этил]-N'-[2-(5-бром)тиазолил] тиомочевина.
Раствор 1-{ [2-(5-бром)тиазолил] тиокарбамоил} имидазола (0,72 г, 2,5 ммоль) и 2-(3-хлорфенил)этиламина (0,4 г, 2,5 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,36 г (38%) указанного соединения, т.пл. 141 - 145oC.
ИК (KBr), см-1: 3168, 3019, 1568, 1514, 1331, 1251, 1189, 787, 686.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,4 (ш.с, 1H), 7,44 (с, 1H), 7,4 - 7,2 (м, 4H), 3,7 (м, 2H), 2,8 (т, J = 7 Гц, 2H).
МС (FD) m/e: 377, 379 (M+).
УФ (EtOH): 296 нм ( ε = 10140), 259 нм ( δ = 8392), 201 нм ( ε = 23984).
Пример 184. N-[2-(4-Хлорфенил)этил]-N'-[2-(5-бром)тиазолил] тиомочевина.
Раствор 1-{ [2-(5-бром)тиазолил] тиокарбамоил} имидазола (0,72 г, 2,5 ммоль) и 2-(4-хлорфенил)этиламина (0,4 г, 2,5 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,32 г (34%) указанного соединения, т.пл. 147 - 150oC.
ИК (KBr), см-1: 3170, 3020, 1608, 1507, 1348, 1180, 745, 642.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,4 (ш.с, 1H), 7,44 (с, 1H), 7,3 (д, J = 8 Гц, 2H), 7,2 (д, J = 8 Гц, 2H), 3,7 (м, 2H), 2,8 (т, J = 7 Гц, 2H).
МС (FD), m/e: 377, 379 (M+).
УФ (EtOH): 296 нм ( ε = 14604), 259 нм ( δ = 12656), 201 нм ( ε = 18845).
Пример 185. N-[2-(2-Метоксифенил)этил] -N'-[2-(5-бром) тиазолил]тиомочевина.
Раствор 1-{[2-(5-бром)тиазолил]тиокарбамоил}имидазола (0,72 г, 2,5 ммоль) и 2-(2-метоксифенил)этиламина (0,41 г, 2,5 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,38 г (41%) указанного соединения.
ИК (KBr), см-1: 3164, 2960, 1563, 1513, 1241, 1182, 1030, 757, 682.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,4 (ш.с, 1H), 7,43 (c, 1H), 7,4-7 (м, 4H), 3,73 (c, 3H), 3,7 (м, 2H), 2,9 (т, J=7 Гц, 2H).
MC (FD), m/e: 371, 373 (M+).
УФ (EtOH): 291 нм ( ε =16746), 261 нм ( δ = 13112), 202 нм ( ε = 31492).
Пример 186. N-[2-(3-Метоксифенил)этил]-N'-[2-(5-бром)тиазолил]тиомочевина.
Раствор 1-{[2-(5-бром)тиазолил]тиокарбамоил}имидазола (0,72 г, 2,5 ммоль) и 2-(3-метоксифенил)этиламина (0,41 г, 2,5 ммоль) в N,N-диметилформамида (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,53 г (57%) указанного соединения.
ИК (KBr), см-1: 3174, 1558, 1510, 1339, 1238, 1175, 1041, 785, 688.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш. с, 1H), 8,4 (ш. с, 1H), 7,44 (c, 1H), 7,3-6,8 (м, 4H), 3,7 (c, 3H), 3,7 (м, 2H), 2,9 (т, J=7 Гц, 2H).
MC (FD), m/e: 371, 373 (M+).
УФ (EtOH): 294 нм ( ε = 15068), 260 нм ( δ = 12248), 202 нм ( δ = 35594).
Пример 187. N-[2-(4-Метоксифенил)этил]-N'-[2-(5-бром)тиазолил]тиомочевина.
Раствор 1-{[2-(5-бром)тиазолил]тиокарбамоил}имидазола (0,72 г, 2,5 ммоль) и 2-(4-бромфенил)этиламина (0,41 г, 2,5 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,42 г (45%) указанного соединения.
ИК (KBr), см-1: 3170, 1558, 2512, 1343, 1246, 1163, 1082, 824.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш. с, 1H), 8,4 (ш, с. 1H), 7,44 (c, 1H), 7,1 (д, J=8 Гц, 2H), 6,8 (д, J=8 Гц, 2H), 3,67 (c, 3H), 3,63 (м, 2H), 2,9 (т, J=7 Гц, 2H).
MC (FD), m/е: 371, 373 (M+).
Пример 188. N-[2-(1-Циклогексенил)этил]-N'-[2-(5-бром)тиазолил]тиомочевина.
Раствор 1-{[2-(5-бром)тиазолил]тиокарбамоил]имидазола (0,72 г, 2,5 ммоль) и 2-(1-циклогексенил)этиламина (0,32 г, 2,5 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из хлористого метилена получают 0,157 г (18%) указанного соединения.
ИК (KBr), см-1: 3170, 2928, 1559, 1510, 1478, 1344, 1228, 1182, 1096, 834.
1H-ЯМР (300 МГц, DMCO-d6), ε : 11,6 (ш. с, 1H), 8,3 (ш. с, 1H), 7,4 (с, 1H), 5,4 (с, 1H), 3,5 (м, 2H), 2,15 (т, J=7 Гц, 2H), 1,9 (м, 4H), 1,5 (м, 4H).
МС (FD), m/e: 345, 347 (M+).
УФ (EtOH): 295 нм ( ε = 15533), 259 нм (δ = 11792), 201 нм ( ε = 21261).
Найдено, %: C 41,87; H 4,91; N 12,21.
C12H16N3S2Br
Вычислено, %: C 41,62; H 4,66; N 12,13.
Пример 189. N-[2-(1-Циклогексенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина.
Перемешиваемый раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-2-бромпиридина (1,73 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 17 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (2х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка перекристаллизацией из этилацетата получают 1,08 г (32%) указанного соединения в виде снежно-белого вещества, т.пл. 166-167oC.
ИК (KBr), см-1: 3159, 2927, 1595, 1561, 1531, 1475, 1310, 1228, 1092.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,09 (ш. с, 1H), 10,64 (с, 1H), 8,2 (д, J= 2,4 Гц, 1H), 7,93 (дв.д, J=8,9 и 2,4 Гц, 1H), 7,09 (д, J=9 Гц, 1H), 5,47 (с, 1H), 3,62-3,58 (м, 2H), 2,19 (т, J=6,7 Гц, 2H), 2-1,9 (м, 4H), 1,55-1,44 (м, 4H).
MC (FD), m/e: 339 (M+), 341 (M+2).
УФ (EtOH): 305 нм ( δ = 14037), 274 нм ( ε = 25281).
Найдено, %: C 49,22; H 5,28; N 12,32.
C14H18BrN3S
Вычислено, %: C 49,42; H 5,33; N 12,35.
Пример 190. N-(2-Фенэтил)-N'-[2-(4-метил)пиридил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль) и 2-амино-4-метилпиридина (1,08 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 16,75 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка перекристаллизацией из смеси этилацет/гексан получают 1,69 г (62%) указанного соединения в виде белых кристаллов, т. пл. 151-153oC.
ИК (KBr), см-1: 3225, 1616, 1534, 1486, 1313, 1192, 1037.
1H-ЯМР (300 МГц, ДМСО-d6, ε : 11,72 (ш. с, 1H), 10,42 (c, 1H), 7,87 (д, J= 5,3 Гц, 1H), 7,31-7,15 (м, 5H), 6,88 (с, 1H), 6,8 (д, J=5,2 Гц, 1H), 3,81-3,76 (м, 2H), 2,88 (т, J=7 Гц, 2H), 2,2 (с, 2H).
MC (FD), m/e: 271 (M+).
УФ (EtOH): 290 нм ( ε = 15080), 266 нм ( ε = 15528), 247 нм ( δ = 13132), 202 нм ( ε = 21819).
Найдено, %: C 66,09; H 6,34; N 15,71.
C15H17N3S
Вычислено, %: C 66,38; H 6,31; N 15,48.
Пример 191. N-(2-Фенэтил)-N'-[2-(4,6-диметил)пиридил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль) и 2-амино-4,6-диметилпиридина (1,22 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Спустя 16 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка перекристаллизацией из смеси этилацетата с гексаном получают 1,81 г (63%) указанного соединения в виде снежно-белых кристаллов, т. пл. 165-167oC.
ИК (KBr), см-1: 3219, 1618, 1543, 1342, 1215.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,83 (ш. с, 1H), 10,35 (с, 1H), 7,25-7,16 (м, 5H), 6,69 (с, 1H), 6,63 (с, 1H), 3,88-3,82 (м, 2H), 2,89 (т, J=6,8 Гц, 2H), 2,14 (с, 3H), 2,09 (с, 3H).
MC (FD), m/e: 285 (M+).
УФ (EtOH): 294 нм ( ε = 17405), 266 нм ( ε = 15904), 247 нм ( δ = 14348), 203 нм ( ε = 23896).
Найдено, %: C 67,11; H 6,63; N 14,71.
C16H19N3S
Вычислено, %: C 67,33; H 6,71; N 14,72.
Пример 192. N-(2-Фенэтил)-N'-[2-(3-гидрокси)пиридил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль) и 2-амино-2-гидроксипиридина (1,1 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 65,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый остаток очищают вытеснительной хроматографией на силикагеле (от 5% этилацетата в дихлорметане до 10% этилацетата) с получением 1,51 г (55%) указанного соединения, перекристаллизацией которого из этилацетата получают 1,05 г указанного соединения в виде снежно-белых кристаллов, т.пл. 168-169oC.
ИК (KBr), см-1: 3377, 1613, 1561, 1534, 1347, 1288, 1152.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,43 (ш.с, 1H), 10,94 (с, 1H), 8,32 (с. 1H), 7,54-7,52 (м, 1H), 7,28-7,14 (м,6H), 6,9-6,86 (м,1H), 3,84-3,77 (м, 2H), 2,9 (т, J = 7 Гц, 3H).
MC (FD), m/e: 273 (M+).
УФ (EtOH): 309 нм ( ε = 17349), 261 нм ( ε = 11851), 245 нм ( δ = 17252), 204 нм ( ε = 23596).
Пример 193. N-[2-(2-Метоксифенил)этил]-N'-[2-(5 -бром)пиридил]тиомочевина.
Перемешиваемый раствор N-(тиоимидазоил)-2-(2- метоксифенил)этиламина (2,61 г, 10 ммоль) и 2-амино-5-бромпиридина (1,73 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают при 90oC. Спустя 65 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), водой (2х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией полученного твердого остатка из этилацетата получают 1,78 г (49%) указанного соединения в виде снежно-белых кристаллов, т.пл. 147-148oC.
ИК (KBr), см-1: 3224, 1596, 1530, 1492, 1459, 1229, 1191, 1038.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,1 (ш.с, 1H), 10,63 (с, 1H), 8,11 (д, J = 2,3 Гц, 1H), 7,9 (дв.д, J = 8,9 и 2,6 Гц, 1H), 7,21-7,16 (м,2H), 7,06 (д, J = 8,9 Гц, 1H), 6,94-6,83 (м, 2H), 3,78-3,73 (м,2H), 3,72 (с, 3H), 2,86 (т, J = 6,8 Гц, 2H).
MC (FD), m/e: 365 (M+), 367 (M+2).
УФ (EtOH): 305 нм ( ε = 13279), 274 нм ( δ = 26971), 202 нм ( ε = 28527).
Найдено, %: C 48,97; H 4,36; N 11,66.
C15H16BrN3OS
Вычислено, %: C 49,19; H 4,40; N 11,47.
Пример 194. N-[2-(2-Хлорфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина.
Перемешиваемый раствор N-(тиоимидазолил)-2-(2-хлорфенил)этиламина (2,65 г, 10 ммоль) и 2-амино-5-бромпиридина (1,73 г, 10 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90oC. Через 64,74 ч. реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (4х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка перекристаллизацией из смеси этилацетат/гексан получают 1,52 г (41%) указанного соединения в виде кристаллов цвета загара, т.пл, 160-161oC.
ИК (KBr), см-1: 3220, 1594, 1562, 1534, 1474, 1338, 1222, 1165, 1088.
-1H-ЯМР (300 МГц, ДМСО-d6, ε : 11,16 (ш.с, 1H), 16,69 (c, 1H), 8,15 (д, J = 2,2 Гц, 1H), 7,93 (дв. д, J = 8,9 и 2,4 Гц, 1H), 7,41-7,38 (м,2H), 7,28-7,23 (м, 2H), 7,08 (д, J =8,9 Гц, 1H), 3,86-3,8 (м,2H), 3,04 (т, J = 6,9 Гц, 2H).
MC (FD), m/e: 371 (M+2).
УФ (EtOH): 306 нм ( ε = 14321), 275 нм ( ε = 24813), 257 нм ( δ = 16728), 201 нм ( ε = 27700).
Найдено, %: C 45,13; H 3,60; N 11,17.
C14H13BrClN3S
Вычислено, %: C 45,36; H 3,53; N 11,33.
Пример 195. N-(2-Фенэтил)-N'-[2-(н-пропил)тиазолил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,38 г, 8,44 ммоль, 1,26 мл) и 2-амино-4-н-пропилтиазола (1,2 г, 8,44 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 17 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), водой (2х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка из смеси этилацетат/гексан получают 1,39 г (54%) указанного соединения в виде желтых кристаллов, т.пл. 135-137oC.
ИК (KBr), см-1: 3175, 3027, 1562, 1529, 1507, 1216.
1H-ЯРМ (300 МГц, ДMCO-d6), ε : 11,5 (ш.с, 1H), 9,93 (ш.с, 1H), 7,29-7,15 (м, 5H), 6,6 (с, 1H), 3,79-3,73 (м, 2H), 2,85 (т, J = 6,9 Гц, 2H), 2,4 (т, J = 7,4 Гц, 2H), 1,53-1,41 (м,2H), 0,82 (т, J = 7,3 Гц, 3H).
MC (FD), m/e: 305 (M+).
УФ (EtOH): 292 нм ( ε = 19216), 257 нм ( δ = 10283), 202 нм ( ε = 20314).
Найдено, %: C 59,17; H 6,08; N 13,55.
C15H19N3S2
Вычислено, %: C 58,98; H 6,27; N 13,76.
Пример 196. N-(2-Фенэтил)-N'-[2-(3,5-дихлор)пиридил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амино-3,5-дихлорпиридина (3,26 г, 20 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 125oC. Спустя 16,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (5х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (20% гексана в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан получают 581 мг (18%) указанного соединения в виде белых кристаллов, т.пл. 102-104oC.
ИК (KBr), см-1: 3409, 3040, 1560, 1508, 1429, 1147, 1057.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,66 (с, 1H), 8,71 (с, 1H), 8,27 (д, J = 2,2 Гц, 1H), 8,12 (д, J = 2,2 Гц, 1H), 7,32 - 7,19 (м, 5H), 3,82-3,76 (м, 2H), 2,9 (т, J = 7,1 Гц, 2H).
MC (FD), m/e: 325 (M+), 327 (M+2).
УФ (EtOH): 311 нм ( ε = 8820), 276 нм ( ε = 16571), 257 нм ( δ = 13676), 203 нм ( ε = 19245).
Найдено, %: C 51,32; H 4,12; N 12,69.
C14H13Cl2N3S
Вычислено, %: C 51,54; H 4,02; N 12,88.
Пример 197. N-(2-Фенэтил)-N'-[2-(4-н-бутил)тиазолил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амино-4-н-бутилтиазола (1,56 г, 10 ммоль) в N-пирролидиноне (20 мл) нагревают при 100oC. Через 16,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), водой (2х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка из смеси этилацетат/гексан получают 1,63 г (51%) указанного соединения в виде желтых кристаллов, т.пл. 100-102oC.
ИК (KBr), см-1: 3027, 1560, 1529, 1262, 1212.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,52 (ш.с, 1H), 9,89 (ш.с, 1H), 7,29-7,15 (м, 5H), 6,59 (с, 1H), 3,79-3,73 (м, 3H), 2,86 (т, J = 6,9 Гц, 2H), 2,45-2,4 (м, 2H), 1,5-1,4 (м,2H), 1,29-1,19 (м, 2H), 0,84 (т, J = 7,3 Гц, 3H).
MC (FD), m/e: 319 (M+).
УФ (EtOH): 292 нм ( ε = 19193), 258 нм ( δ = 10262), 203 нм ( δ = 20024).
Найдено, %: C 59,86; H 6,62; N 12,99.
C16H21N3S2
Вычислено, %: C 60,15; H 6,62; N 13,15.
Пример 198. N-[2-(1-Циклогексенил)этил] -N'-[2-(4-н- пропил)тиазолил] тиомочевина.
Перемешиваемый раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино- 4-н-пропилтиазола (1,42 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 40,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка перекристаллизацией из смеси этилацетат/гексан получают 1,26 г (41%) указанного соединения в виде желтых кристаллов, т.пл. 152-153oC.
ИК (KBr), см-1: 3175, 2930, 1561, 1529, 1507, 1203.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,49 (ш.с, 1H), 9,9 (ш.с, 1H), 6,63 (с, 1H), 5,42 (с, 1H), 3,6-3,54 (м, 2H), 2,49-2,45 (м, 2H), 2,16 (т, J=6,5 Гц, 2H), 1,95-1,88 (м, 4H), 1,6-1,43 (м, 6H), 0,84 (т, J=7,3 Гц, 3H).
MC (FD), m/e: 309 (M+).
УФ (EtOH), нм: 292, 257, 201.
Найдено, %: C 58,29; H 7,58; N 13,37.
C12H23N3S2
Вычислено,%: C 58,21; H 7,49; N 13,58.
Пример 199. N-[2-(1-Циклогексенил)этил]-N'-[2-(4-н- бутил)тиазолил]тиомочевина.
Перемешиваемый раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-4-н-бутилтиазола (1,56 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 18 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка перекристаллизацией из смеси этилацетата с гексаном получают 1,02 г (32%) указанного соединения в виде желтых кристаллов, т.пл. 92-94oC.
ИК (KBr), см-1: 3174, 2927, 1583, 1532, 1507, 1466, 1203.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,73 (ш.с, 1H), 10,14 (ш.с, 1H), 6,86 (с, 1H), 5,65 (с, 1H), 3,83-3,78 (м, 2H), 2,75-2,7 (м, 2H), 2,42-2,38 (м, 2H), 2,18-2,1 (м, 4H), 1,81-1,65 (м, 6H), 1,55-1,43 (м, 2H), 1,08 (т, J=7,3 Гц, 3H).
MC (FD), m/e: 323 (M+).
УФ (EtOH): 292 нм ( ε = 19266), 257 нм ( δ = 9555), 201 нм ( ε = 15788).
Найдено, %: C 59,56; H 7,93; N 10,00.
C16H25N3S2
Вычислено,%: C 59,40; H 7,79; N 12,99.
Пример 200. N-[2-(1-Циклогексенил)этил] -N'-[2-(4- изопропилтиазолил] тиомочевина.
Перемешиваемый раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-4-изопропилтиазола (1,42 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 15,75 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка перекристаллизацией из смеси этилацетат/гексан получают 1,01 г (33%) указанного соединения в виде бледно-желтых кристаллов, т.пл. 110-112oC.
ИК (KBr), см-1: 3164, 2936, 1562, 1525, 1463, 1321, 1214.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,5 (ш.с, 1H), 9,84 (ш.с, 1H), 6,61 (с, 1H), 5,41 (с, 1H), 3,61-3,55 (м, 2H), 2,82-2,76 (м, 1H), 2,17 (т, J=6,4 Гц, 2H), 1,94-1,88 (м, 4H), 1,56-1,41 (м, 4H), 1,14 (т, J=6,8 Гц, 6H).
MC (FD), m/e: 309 (M+).
УФ (EtOH): 291 нм ( ε = 20249), 256 нм ( δ = 9969), 201 нм ( ε = 15880).
Найдено, %: C 58,50; H 7,63; N 13,38.
C15H23N3S2
Вычислено,%: C 58,21; H 7,49; N 13,58.
Пример 201. N-[2-(Фенэтил)-N'-[2-(4-изопропил)тиазолил]тиомочевина.
Перемешиваемый раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амино-4-изопропилтиазола (1,42 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 17 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 10 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка перекристаллизацией из смеси этилацетат/гексан получают 1,42 г (46%) указанного соединения в виде желтых кристаллов, т.пл. 155-156oC.
ИК (KBr), см-1: 3172, 2962, 1581, 1525, 1467, 1350, 1290, 1210.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,52 (ш.с, 1H), 9,89 (ш.с, 1H), 7,29-7,14 (м, 5H), 6,58 (с, 1H), 3,8-3,74 (м, 2H), 2,87 (т, J=6,9 Гц, 2H), 2,76-2,71 (м, 1H), 1,07 (д, J=6,8 Гц, 6H).
MC (FD), m/e: 305 (M+).
УФ (EtOH): 292 нм ( ε = 19882), 257 нм ( δ = 10580), 203 нм ( ε = 20047).
Найдено, %: C 58,95; H 6,39; N 13,72.
C15H19N3S2
Вычислено,%: C 58,98; H 6,27; N 13,76.
Пример 202. N-[2-(Фенэтил)-N'-[2-(4-глиоксиловая кислота)тиазолил]тиомочевина.
Раствор N-(2-фенэтил)-N'-{ 2-[(4-этилглиоксилат)тиазолил] } тиомочевины (1,3 г, 3,58 ммоль) в этаноле (30 мл) обрабатывают 1 н. гидроокисью натрия и нагревают до кипения. Через 1 ч реакционную смесь охлаждают до комнатной температуры, разбавляют водой и промывают этилацетатом (2x). Водный слой подкисляют соляной кислотой до pH 1 и экстрагируют дихлорметаном (2x). Органические слои объединяют, промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. После полученного твердого остатка ополаскиванием этилацетатом получают 390 мг (32%) указанного соединения в виде светло-коричневого вещества, т.пл. > 170oC (разл.)
ИК (KBr), см-1: 3024, 1705, 1669, 1565, 1323, 1146.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 12,2 (ш.с, 1H), 9,07 (с, 1H), 8,01 (с, 1H), 7,28-7,14 (м, 5H), 3,71-3,64 (м, 2H), 2,84 (т, J=7,3 Гц, 2H).
MC (FD), m/e: 336 (M+1).
MCBP (FAB), m/e: выч. 336,0477, обнар. 336,0474.
УФ (EtOH): 284 нм ( δ =17301), 203 нм ( δ =18110).
Пример 203. N-(2-Фенэтил)-N'-[2-(4-метоксибензо)тиазолил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль) и 2-амино-4-метокси бензотиазола (3,6 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Через 64 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (2x) и рассолом. Непосредственно из органического слоя получают 3,87 г (56%) указанного соединения в виде белого вещества, т.пл. 209-211oC.
ИК (KBr), см-1: 3171, 2938, 1570, 1527, 1331, 1191, 1044.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,88 (с, 1H), 9,86 (с, 1H), 7,49-6,93 (м, 6H), 3,86 (с, 3H), 3,77-3,7 (м, 2H), 2,89 (т, J=7,1 Гц, 2H).
MC (FD), m/e: 343 (M+).
MCBP (FAB), m/e: выч. 344,0891, обнар. 344,0884.
УФ (EtOH), нм: 290, 248, 210.
Пример 204. N-(2-Фенэтил)-N'-{2-(5-трифторметил)-1,3,4- тиадиазолил]}тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,26 г, 20 ммоль, 3 мл) и 2-амино-5-трифторметил-1,3,4-тиадиазола (3,38 г, 20 ммоль) в N,N-диметилформамиде (50 мл) нагревают при 100oC. Через 40 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (3х) и рассолом (2х). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикегеле (5% этилацетата в дихлорметане) с последующей перекристаллизацией из этилацетата получают 171 мг (3%) указанного соединения в виде белого вещества, т.пл. 212-213oC.
ИК (KBr), см-1: 3336, 2788, 1629, 1534, 1494, 1398, 1327, 1148, 1038.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 12,6 (ш. с, 1H), 8,51 (с, 1H), 7,3-7,15 (т, 5H), 3,73-3,66 (м, 2H), 2,85 (м, J = 7,3 Гц, 2H).
MC (FD), m/e: 332 (M+).
УФ (EtOH): 322 нм ( ε = 5240), 261 нм ( δ = 11025), 204 нм ( δ = 28776).
Пример 205. N-(2-фенэтил)-N'-[2-(4-карбоновая кислота)тиазолил]тиомочевина.
Раствор N-(2-Фенэтил)-N'-[2-(4-циано)тиазолил]тиомочевины (250 мг, 0,867 ммоль) в ледяной уксусной кислоте (10 мл) и 5 н. соляной кислоте (10 мл) нагревают до кипения. Через 16 ч реакционную смесь охлаждают до комнатной температуры, разбавляют ацетонитрилом и концентрируют досуха (2х). Полученный твердый остаток очищают вытеснительной хроматографией на силикагеле (2% уксусной кислоты в этилацетате) с последующей перекристаллизацией из смеси метанол/этилацетат и получением 13 мг указанного соединения. Концентрированием маточного раствора и ополаскиванием остатка этилацетатом получают дополнительно 34 мг указанного соединения, общий выход которого составил 47 мг (18%), белое вещество, т.пл. > 230oC.
ИК (KBr), см-1: 3276, 1603, 1531, 1394, 1268.
1Н-ЯМР (300 МГц, ДMCO-d6), δ : 7,26-7,14 (м, 6H), 3,71-3,65 (м, 2H), 2,87 (т, J = 7,2 Гц, 2Н).
MC (FD), m/e: 307 (M+).
MCBP (FAB), m/e: (M+1), выч. 309,0527, обнар. 309,0528
УФ (EtOH), нм: 288, 260, 206.
Пример 206. N-[2-(1-Циклогексенил)этил]-N'-[2-(6-фторбензотиазолил)]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианат (1,66 г, 9,93 ммоль) и 2-амино-6-фторбензотиазола (1,67 г, 9,93 ммоль) в диметилсульфоксиде (10 мл) нагревают до 125oC. Через 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей перекристаллизацией из этилацетата получают 1,04 г (31%) указанного соединения в виде желтых кристаллов, т.пл. 200-201oC.
ИК (KBr), см-1: 3451, 3177, 3044, 2924, 2832, 1560, 1255, 1462, 1215, 1198.
1Н-ЯМР (300 МГц, CDCl3), ε : 10,83 (с, 1H), 10,33 (ш.с, 1H), 7,61-7,56 (м, 1H), 7,41-7,37 (м, 1Н), 7,17-7,1 (м, 1H), 5,65 (с, 1H), 3,87-3,81 (м, 2H), 2,38 (т, J = 6,5 Гц, 2H), 2,03-2 (м, 4H), 1,67-1,52 (м, 4H).
MC (FD), m/e: 335 (M+).
УФ (EtOH), нм: 301, 218, 201.
Найдено,%: C 57,58; H 5,44; N 12,42.
C16H18FN3S2
Вычислено,%: C 57,29; H 5,41; N 12,53.
Пример 207. N-(2-Фенэтил)-N'-[-2-(5-хлортиазолил)]тиомочевина.
В дихлорметане образуют взвесь гидрохлорида 2-амино-5-хлортиазола, которую встряхивают с небольшим избытком раствора гидроокиси натрия. Слои разделяют и водный слой промывают дихлорметаном. Объединенные органические слои сушат над сульфатом натрия, фильтруют и концентрируют. К полученному твердому продукту добавляют 2-фенэтилизотиоцианат (1,63 г, 10 ммоль, 1,5 мл) и N-метилпирролидинон (20 мл) и образовавшийся раствор нагревают при 100oC. Через 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, водой (4х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан получают 187 мг указанного соединения в виде светло-коричневых кристаллов, т.пл. 163-164oC.
ИК (KBr), см-1: 3312, 3028, 2925, 1607, 1527, 1513, 1438, 1377, 1348, 1314, 1026.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш.с, 1H), 8,41 (с,1H), 7,39 (с,1H), 7,3-7,15 (м,5H), 3,7-3,63 (м,2H), 2,82 (т, J= 7,2 Гц, 2H).
MC (FD), m/e: 297 (M+), 299 (M+2).
УФ (EtOH): 296 нм ( ε = 14487), 260 нм ( δ = 12442), 206 нм ( ε = 27427).
Найдено,%: C 48,4; H 4,16; N 13,85.
C12H12ClN3S2
Вычислено,%: C 48,4; H 4,06; N 14,11.
Пример 208. N-[2-(1-Циклогексенил)этил]-N'-[2-(4-тирифторметил)тиазолил] тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-4-трифторметилтиазола (1,68 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 125oC. Через 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), водой (3х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан (1: 1) получают 139 мг (4%) указанного соединения в виде снежно-белого вещества, т.пл 153-154oC.
ИК (KBr), см-1: 3168, 2932, 1562, 1513, 1472, 1438, 1219, 1175, 1081.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,95 (с,1H), 8,21 (с,1H), 7,71 (с,1H), 5,41 (с, 1H), 3,55-3,49 (м, 2H), 2,14 (т, J= 6,7 Гц, 2H), 1,33-1,83 (м, 4H), 1,56-1,41 (м,4H).
MC (FD), m/e: 335 (M+).
MCBP (FAB), m/e: (M+1), выч. 336,0816, обнар. 336,0842.
УФ (EtOH): 285 нм ( ε = 15215), 258 нм ( δ = 12868), 203 нм ( ε = 20271).
Пример 209. N-[2-(2-Хлорфенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина.
Раствор 2-(2-хлорфенил)этиламина (1,56 г, 10 ммоль, 1,41 мл) и N-(тиоимидазолил)-2-амино-4-трифторметилтиазола (3 г, 10,8 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-100oC. Через 2 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), водой (2х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан (1:1) получают 870 мг (24%) указанного соединения в виде белых кристаллов, т.пл. 187-188oC.
ИК (KBr), см-1: 3169, 3018, 1569, 1512, 1245, 1220, 1154, 1133, 1080.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,92 (с,1H), 8,32 (с,1H), 7,71 (с,1H), 7,41-7,22 (м, 4H), 3,76-3,69 (м, 2H), 2,97 (т, J= 7,1 Гц, 2H).
MC (FD), m/e: 365 (M+).
УФ (EtOH): 285 нм ( ε = 13785), 257 нм ( δ = 14164), 202 нм ( ε = 30204).
Найдено,%: C 42,82; H 3,14; N 11,68.
C13H11F3ClN3S2
Вычислено,%: C 42,68; H 3,03; N 11,49.
Пример 210. N-[2-(4-Хлорфенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина.
Раствор 2-(4-хлорфенил)этиламина (1,56 г, 10 ммоль, 1,4 мл) и N-(тиоимидазоил)-2-амино-4-трифторметилтиазола (3 г, 10,8 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-100oC. Через 2 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2х), водой (2х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан (1: 1) получают 570 мг (16%) указанного соединения в виде белых кристаллов, т.пл. 196-197oC.
ИК (KBr), см-1: 3167, 3021, 1562, 1516, 1469, 1445, 1184, 1173, 1126, 1083.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,91 (с,1H), 8,27 (с,1H), 7,71 (с,1H), 7,32 (д, J=8,4 Гц, 2H), 7,23 (д, J=8,4 Гц, 2H), 3,72-3,65 (м, 2H), 2,83 (т, J= 7 Гц, 2H).
MC (FD), m/e: 365 (M+).
УФ (EtOH): 286 нм ( ε = 11309), 257 нм ( δ = 11445), 202 нм ( ε = 21815).
Найдено,%: C 42,87; H 3,05; N 11,46.
C13H11F3ClN3S2
Вычислено,%: C 42,68; H 3,03; N 11,49.
Пример 211. N-[2-(3-Хлорфенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина.
Раствор 2-(3-хлорфенил)этиламина (1,56 г, 10 ммоль, 1,4 мл) и N-(тиоимидазоил)-2-амино-4-трифторметилтиазола (3 г, 10,8 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-100oC. Через 2 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (1% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан получают 407 мг (11%) указанного соединения в виде белых кристаллов, т.пл. 159-160oC.
ИК (KBr), см-1: 3176, 3017, 1567, 1517, 1224, 1133, 1080.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,93 (с, 1H), 8,28 (с, 1H), 7,72 (с, 1H), 7,33-7,17 (м, 4H), 3,73-3,67 (м, 2H), 2,85 (т, J=7 Гц, 2H).
MC (FD), m/e: 365 (M+), 367 (M+2).
УФ (EtOH): 285 нм ( ε = 14175), 257 нм ( δ = 14293), 202 нм ( ε = 31514).
Найдено, %: C 42,72; H 3,09; N 11,79.
C13H11F3ClN3S2
Вычислено, %: C 42,68; H 3,03; N 11,49.
Пример 212. N-[2-(2-Метоксифенил)этил]-N'-[2-(4-трифторметил)тиазолил] тиомочевина.
Раствор 2-(2-метоксифенил)этиламина (1,51 г, 10 ммоль, 1,4 мл) и N-(тиоимидазоил)-2-амино-4-трифторметилтиазола (3 г, 10,8 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-100oC. Через 2 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой полученного твердого остатка вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан (1:1) получают 872 мг (24%) указанного соединения в виде белых кристаллов, т.пл. 184-184,5oC.
ИК (KBr), см-1: 3168, 2973, 1571, 1514, 1244, 1221, 1168, 1127, 1077.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,87 (с, 1H), 8,24 (с, 1H), 7,71 (с, 1H), 7,18-7,1 (м, 2H), 6,94-6,82 (м, 2H), 3,74 (с, 3H), 3,68-3,61 (м, 2H), 2,8 (т, J=7 Гц, 2H).
MC (FD), m/e: 361 (M+).
УФ (EtOH): 280 нм ( ε = 16781), 259 нм ( δ = 15202), 203 нм ( ε = 32863).
Найдено, %: C 46,52; H 3,94; N 11,52.
C14H14F3N3OS2
Вычислено, %: C 46,53; H 3,90; N 11,63.
Пример 213. N-[2-(3-Метоксифенил)этил]-N'-[2-(4- трифторметил)тиазолил] тиомочевина.
Раствор 2-(3-метоксифенил)этиламина (1,51 г, 10 ммоль, 1,45 мл) и N-(тиоимидазоил)-2-амино-4-трифторметилтиазола (3 г, 10,8 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-100oC. Через 2 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой твердого остатка вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан (1: 1) получают 1,32 г (36%) указанного соединения в виде белого вещества, т.пл. 139-140oC.
ИК (KBr), см-1: 3215, 3018, 1598, 1582, 1544, 1490, 1299, 1242, 1180, 1081.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,93 (с, 1H), 8,26 (с, 1H), 7,71 (с, 1H), 7,18(т, J= 8 Гц, 1H), 6,79-6,74 (м, 3H), 3,73-3,66 (м, 2H), 3,69 (с, 3H), 2,8 (т, J=7 Гц, 2H).
MC (FD), m/e: 361 (M+).
УФ (EtOH): 281 нм ( ε = 15384), 258 нм ( δ = 14389), 202 нм ( ε = 35020).
Найдено, %: C 46,76; H 3,91; N 11,52.
C14H14F3N3OS2
Вычислено, %: C 46,53; H 3,90; N 11,63.
Пример 214. N-[2-(4-Метоксифенил)этил]-N'-[2-(4- трифторметил)тиазолил] тиомочевина.
Раствор 2-(4-метоксифенил)этиламина (1,51 г, 10 ммоль, 1,46 мл) и N-(имидазоил)-2-амино-4-трифторметилтиазола (3 г, 10,8 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-100oC. Через 2 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) с последующей перекристаллизацией из смеси этилацетат/гексан (1:1) получают 879 мг (25%) указанного соединения в виде белых кристаллов, т.пл. 169-170oC.
ИК (KBr), см-1: 3173, 3025, 1565, 1515, 1240, 1181, 1127, 1083.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,9 (с, 1H), 8,26 (с, 1H), 7,71 (с, 1H), 7,12 (д, J=8,5 Гц, 2H), 6,83 (д, J=8,5 Гц, 2H), 3,67 (с, 3H), 3,67-3,61 (м, 2H), 2,76 (т, J=7,1 Гц, 2H).
MC (FD), m/e: 361 (M+).
УФ (EtOH): 284 нм ( ε = 15865), 258 нм ( δ = 14872), 224 нм ( ε = 16821).
Найдено, %: C 46,70; H 3,89; N 11,50.
C14H14F3N3OS2
Вычислено, %: C 46,53; H 3,90; N 11,63.
Пример 215. N-[2-(1-Циклогексенил)этил] -N'-[2-(4,5- диметил)тиазолил] тиомочевина.
В дихлорметане образуют взвесь гидрохлорида 2-амино-4,5-диметилтиазола (1,65 г, 10 ммоль) и встряхивают со смесью гидроокиси натрия и насыщенного раствора бикарбоната натрия. Органическую фазу промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. К полученному твердому остатку добавляют 2-(1-циклогексенил)этилизотиоцианат (1,67 г, 10 ммоль) и N-(метилпирролидинон (20 мл) и полученный раствор нагревают при 105oC. Через 20 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой твердого остатка перекристаллизацией из смеси этилацетат/гексан (2: 1) получают 1,57 г (53%) указанного соединения в виде светло-желтых кристаллов, т.пл. 162-164oC.
ИК (KBr), см-1: 3170, 2917, 1583, 1554, 1514, 1433, 1325, 1255, 1215.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,35 (с, 1H), 9,83 (ш.с, 1H), 5,43 (с, 1H), 3,58-3,52 (м, 2H), 2,17-2,11 (м, 5H), 2,07 (с, 3H), 1,94-1,89 (м, 4H), 1,57-1,44 (м, 4H).
MC (FD), m/e: 295 (M+).
УФ (EtOH): 297 нм ( ε = 18557), 256 нм ( δ = 9443), 201 нм ( ε = 16880).
Найдено, %: C 57,10; H 7,28; N 14,36.
C14H21N3S2
Вычислено, %: C 56,91; H 7,16; N 14,22.
Пример 216. N-[2-(3-Этокси-4-метоксифенил)этил]-N'-(2- тиазолил)тиомочевина.
Раствор 2-(3-этокси-4-метоксифенил)этиламина (1 г, 5,12 ммоль) и N-(тиоимидазоил)-2-аминотиазола (1,08 г, 5,12 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-100oC. Через 16 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой твердого остатка из смеси дихлорметан/этилацетат получают 471 мг (27%) указанного соединения в виде снежно-белого вещества, т.пл. 150-152oC.
ИК (KBr), см-1: 3176, 3112, 3040, 1575, 1514, 1469, 1261, 1235, 1140, 1042.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,51 (с, 1H), 9,73 (ш.с, 1H), 7,28 (д, J= 3,8 Гц, 1H), 7,07 (с, 1H), 6,9-6,78 (м, 2H), 6,72 (д, J=8,2 Гц, 1H), 4-3,88 (м, 2H), 3,8-3,67 (м, 5H), 2,76 (т, J=6,9 Гц, 2H), 1,25 (т, J=6,9 Гц, 3H).
MC (FD), m/e: 337 (M+).
УФ (EtOH): 287 нм ( ε = 21828), 259 нм ( δ = 11770), 205 нм ( δ = 35881).
Найдено, %: C 53,10; H 5,64; N 12,22.
C15H19N3O2S2
Вычислено, %: C 53,39; H 5,67; N 12,45.
Пример 217. N-[2-(3-Метокси-4-изопропоксифенил)этил] -N'-(2- тиазолил)тиомочевина.
Раствор 2-(3-метокси-4-изопропоксифенил)этиламина (1 г, 4,78 ммоль) и N-(тиоимидазоил)-2-аминотиазола (1 г, 4,78 ммоль) в N,N-диметилформамиде (20 мл) нагревают при 90-95oC. Через 24 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой твердого остатка из этилацетатата получают 891 мг (53%) указанного соединения в виде желтоватых игл. Вторичной перекристаллизацией продукта из этилацетата получен образец с т.пл. 140-141oC.
ИК (KBr), см-1: 3165, 2971, 1560, 1516, 1466, 1266, 1182, 1144.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,53 (с, 1H), 9,71 (ш.с, 1H), 7,28 (д, J=3,6 Гц, 1H), 7,06 (с, 1H), 6,84-6,81 (м, 5H), 6,71-6,68 (м, 1H), 4,45-4,37 (м, 1H), 3,74-3,66 (м, 5H), 2,77 (т, J=7 Гц, 2H), 1,17 (д, J=6 Гц, 6H).
МС (FD), m/e: 351 (M+).
УФ (EtOH), нм: 286, 258, 204.
Найдено, %: C 54,79; H 6,11; N 12,21.
C16H21N3O2S2
Вычислено, %: C 54,68; H 6,02, N 11,96.
Пример 218. N-[2-(3,4-Дихлорфенил)этил]-N'-(2-тиазолил)тиомочевина.
В дихлорметане образуют взвесь гидрохлорида 2-(3,4-дихлорфенил)этиламина (1 г, 4,41 ммоль), которую встряхивают с небольшим избытком раствора гидроокиси натрия. Слои разделяют и органический слой сушат над сульфатом натрия, фильтруют и концентрируют. К полученному маслу добавляют N-(тиоимидазоил)-2-аминотиазол (928 мг, 4,41 ммоль) и N,N-диметилформамид (20 мл) и образовавшийся раствор нагревают при 90-100oC. Через 18 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) получают 1 г (68%) продукта в виде белого твердого вещества, перекристаллизацией которого из этилацетата получают 700 мг указанного соединения в виде белых кристаллов, т.пл. 159,5-160oC.
ИК (KBr), см-1: 3175, 1577, 1515, 1472, 1328, 1190, 1029.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (с, 1H), 9,63 (ш.с, 1H), 7,54-7,48 (м, 2H), 7,3-7,21 (м, 2H), 7,06 (с, 1H), 3,77-3,7 (м, 2H), 2,87 (т, J=6,9 Гц, 2H).
МС (FD), m/e: 331 (M+).
УФ (EtOH): 289 нм ( ε = 19623), 265 нм ( δ = 11818), 204 нм ( ε = 36059).
Найдено, %: C 43,14; H 3,36; N 12,63.
C12H11Cl2N3S2
Вычислено, %: C 43,38; H 3,34, N 12,65.
Пример 219. N-[2-(2-Метил-3-трифторметилфенил)этил] -N'-(2- тиазолил)тиомочевина.
В дихлорметане образуют взвесь гидрохлорида 2-(2-метил-3-трифторметилфенил)этиламина (1 г, 4,17 ммоль) и встряхивают с небольшим избытком раствора гидроокиси натрия. Слои разделяют и органический слой сушат над сульфатом магния, фильтруют и концентрируют. К полученному маслу добавляют N-(тиоимидазоил)-2-аминотиазол (877 мг, 4,17 ммоль) и N,N-диметилформамид (20 мл) и раствор нагревают при 90-100oC. Через 65 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка вытеснительной хроматографией на силикагеле (2% этилацетата в дихлорметане) с последующей перекристаллизацией из этилацетата (первая партия) или смеси этилацетат/гексан (1: 1) (вторая партия) получают 581 мг (40%) указанного соединения в виде белого вещества, т.пл. 158-159oC.
ИК (KBr), см-1: 3178, 3130, 2994, 1566, 1514, 1473, 1321, 1161, 1120.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (с, 1H), 9,76 (ш.с, 1H), 7,52-7,47 (м, 2H), 7,33-7,28 (м, 2H), 7,07 (с, 1H), 3,75-3,68 (м, 2H), 2,98 (т, J=7,4 Гц, 2H), 2,4 (с, 3H).
МС (FD), m/e: 345 (M+).
УФ (EtOH): 289 нм ( ε = 19176), 258 нм ( δ = 111507), 203 нм ( ε = 21953).
Найдено, %: C 48,89; H 4,06; N 12,44.
C14H14F3N3S2
Вычислено, %: C 48,68; H 4,08, N 12,16.
Пример 220. N-{ 2-[3-(3,3,3-Трифтор)пропилфенил] этил} -N'-(2- тиазолил)тиомочевина.
В дихлорметане образуют взвесь тозилата 2-[3-(3,3,3-трифтор)пропилфенил] этиламина (1 г, 2,57 ммоль), которую встряхивают с небольшим избытком раствора гидроокиси натрия. Слои разделяют и водный слой экстрагируют дихлорметаном. Объединенную органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. К полученному маслу добавляют N-(тиоимидазоил)-2-аминотиазол (540 мг, 2,57 ммоль) и N,N-диметилформамид (20 мл) и раствор нагревают при 90-95oC. Через 1 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка из смеси 40% этилацетата в гексане получают 508 мг (55%) указанного соединения в виде снежно-белых кристаллов, т.пл. 138-139oC.
ИК (CHCl3), см-1: 3192, 3058, 2979, 1567, 1514, 1259, 1139.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,53 (с, 1H), 9,73 (ш.с, 1H), 7,29-7,06 (м, 6H), 3,75-3,69 (м, 2H), 2,83 (т, J=7 Гц, 2H), 2,77-2,71 (м, 2H), 2,57-2,45 (м, 2H).
МС (FD), m/e: 359 (M+).
УФ (EtOH): 288 нм ( ε = 19255), 257 нм ( δ = 11152), 203 нм ( ε = 21782).
Найдено, %: C 50,36; H 4,45; N 11,46.
C15H16F3N3S2
Вычислено, %: C 50,13; H 4,49; N 11,69.
Пример 221. N-[2-(1-Циклогексенил)этил]-N'-(2-пиридил)тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-аминопиридина (941 мг, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 16,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (4x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка перекристаллизацией из этилацетата получают 1,31 г (50%) указанного соединения в виде белых кристаллов, т.пл. 153-155oC.
ИК (KBr), см-1: 3219, 2921, 1605, 1569, 1537, 1481, 1319, 1235, 1181, 1092.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (с, 1H), 10,47 (с, 1H), 8,09 (д, J= 3,9 Гц, 1H), 7,74-7,68 (м, 1H), 7,09 (д, J=8,3 Гц, 1H), 7-6,96 (м, 1H), 5,47 (с, 1H), 3,65-3,59 (м, 2H), 2,19 (т, J=6,6 Гц, 2H), 1,94-1,9 (м, 4H), 1,55-1,43 (м, 4H).
МС (FD), m/e: 261 (M+).
УФ (EtOH): 292 нм ( ε = 15926), 265 нм ( δ = 17724), 247 нм ( ε = 15198).
Найдено, %: C 64,12; H 7,33; N 15,89.
C14H19N3S
Вычислено, %: C 64,33; H 7,33; N 16,08.
Пример 222. N-(2-Фенэтил)-N'-[2-(5-бром)пиридил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (1,63 г, 10 ммоль, 1,5 мл) и 2-амино-5-бромпиридина (1,73 г, 10 ммоль) в N-метилпирролидиноне (20 мл) нагревают при 100oC. Через 22 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой (2x), водой (2x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка перекристаллизацией из смеси этилацетата с гексаном получают 1,2 г (36%) указанного соединения в виде белых кристаллов, т.пл. 160-162oC.
ИК (KBr), см-1: 3028, 1595, 1559, 1531, 1475, 1311, 1228, 1092.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,16 (с, 1H), 10,65 (с, 1H), 8,11 (д, J= 2,1 Гц, 1H), 7,93-7,9 (м, 1H), 7,29-7,18 (м, 5H), 7,05 (д, J=8,8 Гц, 1H), 3,82-3,77 (м, 2H), 2,88 (т, J=7 Гц, 2H).
МС (FD), m/e: 335 (M+), 337 (M+2).
УФ (EtOH): 305 нм ( ε = 14171), 275 нм ( δ = 24881), 201 нм ( δ = 21601).
Найдено, %: C 49,93; H 4,19; N 12,52.
C14H14BrN3
Вычислено, %: C 50,01; H 4,20; N 12,50.
Пример 223. N-[2-(1-Циклогексенил)этил]-N'-[2-(5- циано)пиридил]тиомочевина.
Перемешиваемый раствор 2-(1-циклогексенил)этилизотиоцианата (1,36 г, 8,14 ммоль) и 2-амино-5-цианопиридина (0,97 г, 8,14 ммоль) в N-метилпирролидиноне (20 мл) нагревают до 100oC. Через 5 дней реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (4x) и рассолом. Органический слой сушат над Na2SO4, фильтруют и концентрируют. Очисткой твердого остатка вытеснительной хроматографией на силикагеле (2% EtOAc в CH2Cl2) с последующей перекристаллизацией из смеси EtOAc/гексан получают 78 мг (3%) указанного соединения в виде снежно-белого вещества, т.пл. 195-197oC.
ИК (KBr), см-1: 2927, 2224, 1605, 1570, 1533, 1487, 1369, 1228, 1165.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,17 (ш. с, 1H), 10,96 (с, 1H), 8,57 (д, J=1,8 Гц, 1H), 8,12 (дв. д, J=8,8 и 2,1 Гц, 1H), 7,2 (д, J=8,8 Гц, 1H), 5,47 (с, 1H), 3,66-3,59 (м, 2H), 2,2 (т, J=6,6 Гц, 2H), 1,94-1,89 (м, 4H), 1,54-1,43 (м, 4H).
МС (FD), m/e: 286 (M+).
УФ (EtOH), нм: 308, 202.
Найдено, %: C 62,70; H 6,42; N 19,42.
C15H18N4S
Вычислено, %: C 62,91; H 6,34; N 19,56.
Пример 224. N-(2-Фенэтил)-N'-{2-[4-(4-бифенил)тиазолил]}тиомочевина.
Раствор 2-фенэтилизотиоцианата (0,82 г, 5 ммоль, 0,75 мл) и 2-амино-4-(4-бифенил)тиазола (1,26 г, 5 ммоль) в N,N-диметилформамиде (12,5 мл) нагревают при 100oC. Через 19,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой. Смесь фильтруют, фильтрат разделяют и органическую фазу промывают насыщенным раствором бикарбоната натрия, водой (4x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой продукта вытеснительной хроматографией на силикагеле (от 1% этилацетата в дихлорметане до 2% этилацетата в дихлорметане) получают 372 мг (18%) указанного соединения. Полученное желтое вещество перекристаллизовано из этилацетата, т.пл. 208,5-209oC.
ИК (KBr), см-1: 3437, 3172, 3029, 1570, 1553, 1511, 1211, 1060, 738.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,72 (с, 1H), 9,54 (ш. с, 1H), 7,86-7,8 (м, 2H), 7,78-7,68 (м, 4H), 7,58 (с, 1H), 7,52-7,44 (м, 2H), 7,41-7,35 (м, 1H), 7,34-7,29 (м, 4H), 7,27-7,2 (м, 1H), 3,92-3,84 (м, 2H), 2,98 (т, J=3 Гц, 2H).
МС (FD), m/e: 415 (M+).
УФ (EtOH), нм: 293, 212.
Найдено, %: C 69,08; H 5,10; N 9,99.
C24H21N3S2
Вычислено, %: C 69,36; H 5,09, N 10,11.
Пример 225. N-(2-Фенэтил)-N'-{2-[4-пиридил)тиазолил]}тиомочевина.
В хлористом метилене образуют взвесь гидробромида 2-амино-4-(4-пиридил)тиазола и встряхивают с насыщенным раствором бикарбоната натрия. Слои разделяют и водный слой промывают хлористым метиленом и этилацетатом. Объединенные органические слои концентрируют. К твердому остатку (1 г, 5,6 ммоль) добавляют 2-фенэтилизотиоцианат (0,91 г, 5,6 ммоль, 0,83 мл) в N,N-диметилформамиде (12,5 мл) и образовавшуюся суспензию нагревают при 100oC. Через 20,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают фазу промывают водой (4x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией полученного твердого остатка из этилацетата (3x) получают 133 мг (7%) указанного соединения, т.пл. 196,5oC.
ИК (KBr), см-1: 3250, 2939, 1723, 1604, 1506, 1223, 670. 664.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,72 (с, 1H), 9,21 (ш. с, 1H), 8,54 (д, J=6 Гц, 2H), 7,82 (с, 1H), 7,63 (д, J=6 Гц, 2H), 7,3-7,15 (м, 5H), 3,84-3,77 (м, 2H), 2,89 (т, J=7 Гц, 2H).
МС (FD), m/e: 340 (M+).
МСВР (FAB), m/e: (M+) выч. 341,0895; обнар. 341,0909.
УФ (EtOH): 294 нм ( ε = 23935), 231 нм ( δ = 16356), 203 нм ( ε = 25793).
Пример 226. N-(2-Фенэтил)-N'-(2-{ 4-[1-(1-этоксикарбонил)-(3-трет- бутоксикарбонилметокси)имино]тиазолил}тиомочевина.
2-Амино-4-[1-(1-этоксикарбонил)-(3-трет- бутоксикарбонилметокси)имино] тиазол (2,64 г, 8 ммоль) и 2-фенэтилизотиоцианат (1,31 г, 8 ммоль, 1,2 мл) в N, N-диметилформамиде (20 мл) нагревают при 100oC. Через 24 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Ополаскиванием твердого остатка этилацетатом получают 801 мг (20%) указанного соединения, т.пл. 188,5oC.
ИК (KBr), см-1: 3293, 2975, 1749, 1594, 1543, 1453, 1382, 1231, 1154, 1054, 748, 698.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,85 (с, 1H), 8,46 (ш. с, 1H), 7,29-7,17 (м, 5H), 4,59 (с, 2H), 4,31-5,24 (к, J=7,1 Гц, 2H), 3,7-3,64 (м, 2H), 2,82 (т, J=7,1 Гц, 2H), 1,36 (с, 9H), 1,23 (т, J=7,1 Гц, 3H).
МС (FD), m/e: 492 (M+).
УФ (EtOH): 292, 257 нм ( ε = 16356), 203 нм.
Найдено, %: C 53,67; H 5,83; N 11,34.
C22H28N4O5S2
Вычислено, %: C 53,64; H 5,73, N 11,37.
Пример 227. N-(2-Фенэтил)-N'-2-(4-трет-бутил-5- метилтиазолил)тиомочевина.
2-Амино-4-трет-бутил-5-метилтиазол (1,87 г, 11 ммоль) и 2-фенэтилизотиоцианат (1,8 г, 11 ммоль, 1,64 мл) в N,N-диметилформамиде (25 мл) нагревают при 100oC. Через 18,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Ополаскиванием твердого остатка эфиром получают 1,02 г (28%) указанного соединения, т.пл. 153-153,5oC.
ИК (KBr), см-1: 3171, 2966, 1474, 1534, 1510, 1455, 1346, 1221, 1186, 755, 704.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,28 (ш. с, 1H), 9,9 (ш. с, 1H), 7,28-7,14 (м, 5H), 3,78-3,34 (м, 2H), 2,84 (т, J=7 Гц, 2H), 2,27 (с, 3H), 1,16 (с, 9H).
МС (FD), m/e: 333 (M+).
УФ (EtOH): 297 нм ( ε = 19835), 257 нм ( δ = 9954), 202 нм ( δ = 21059).
Найдено, %: C 61,42; H 6,92; N 12,55.
C17H23N3S2
Вычислено,%: C 61,22; H 6,95; N 12,60.
Пример 228. N-(2-Фенэтил)-N'-2-[4-(4-бромфенил-5- этилтиазолил]тиомочевина.
2-Амино-4-(4-бромфенил)-5-этилтиазол (848 мг, 3 ммоль) и 2-фенэтилизотиоцианат (490 мг, 3 ммоль, 0,45 мл) в N,N-диметилформамиде (7,5 мл) нагревают при 100oC. Через 22,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают 1 н. соляной кислотой, насыщенным раствором бикарбоната натрия, водой (3x) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией твердого остатка из этилацетата и толуола получают 146 мг (11%) указанного соединения, т.пл. 169-170oC.
ИК (KBr), см-1: 3169, 3025, 2969, 2930, 1581, 1558, 1520, 1234, 1168, 1009.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,54 (с, 1H), 9,4 (ш. с, 1H), 7,57 (д, J=8,3 Гц, 2H), 7,36 (д, J=8,3 Гц, 2H), 7,21-7,14 (м, 5H), 3,75-3,73 (м, 2H), 2,87-2,82 (м, 2H), 2,8 (к, J=7,8 Гц, 2H) 1,17 (т, J=7,8 Гц, 2H).
МС (FD), m/e: 445 (M+), 447 (М+2).
УФ (EtOH), нм: 291, 263, 237, 203.
Найдено, %: C 53,71; H 4,61; N 9,39.
C20H20BrN3S2
Вычислено,%: C 53,81; H 4,52; N 9,41.
Пример 229. N-(2-Фенэтил)-N'-пиридино[2,3-о]тиазолил)тиомочевина.
Раствор 2-фенэтилизотиоцианата (1,33 г, 8,13 ммоль, 1,21 мл) и 2-аминопиридино[2,3-о] тиазола (1,23 г, 8,13 ммоль) в N,N-диметилфомамиде (15 мл) нагревают при 105oC. Через 46,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органический раствор промывают водой (6х) и рассолом. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой остатка вытеснительной хроматографией на силикагеле (от 5% этилацетата в дихлорметане до 10% этилацетата в дихлорметане) получают 330 мг (13%) указанного соединения в виде белого порошка, перекристаллизованного из этилацетата, т. пл. 202-202,5oC.
ИК (KBr), см-1: 3445, 3171, 3025, 1565, 1551, 1510, 1382, 1201, 1150.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,91 (ш.с, 1H), 9,76 (ш.с, 1H), 8,37 (м, 1H), 7,88 (м, 1H), 7,43 (дв.д, J = 3 и 6 Гц, 1H), 7,33-7,2 (м, 5H), 3,82-3,79 (м, 2H), 2,89 (т, J = 7,0 Гц, 2H).
МС (FAB), m/e: 315 (M+1).
УФ (EtOH): 312 нм (δ = 22468), 211 нм ( ε = 19194).
Найдено,%: C 57,2; H 4,49; N 17,66.
C15H14N4S2
Вычислено,%: C 57,3; H 4,49; N 17,82.
Пример 230. N-(2-Фенэтил)-N'-[2-(3-этил)пиридил]тиомочевина.
A. 2-трет-Бутоксикарбониламино-3-этилпиридин.
В 80 мл тетрагидрофурана растворяют 2-трет-бутоксикарбониламинопиридин (10 г, 51,5 ммоль) и охлаждают до -78oC. В течение 1 ч по каплям прибавляют н-бутиллитий (80 мл 1,49 М раствора в гексане, 120 ммоль). После перемешивания еще в течение 15 мин при -78oC и затем 2,5 ч при -10oC раствор вновь охлаждают до -78oC и в течение 15 мин шприцем по каплям прибавляют йодэтан (77,2 ммоль, 6,18 мл). Раствор оставляют нагреваться до комнатной температуры. Реакционную смесь нейтрализуют насыщенным раствором хлорида аммония (100 мл) и экстрагируют этилацетатом (3х). Органические вытяжки объединяют, сушат над сульфатом магния и концентрируют. Очисткой остатка вытеснительной хроматографией на силикагеле (25% этилацетата в гексане) получают 4,9 г (43%) указанного соединения в виде светло-коричневого вещества, т. пл. 101-102 oC.
ИК (KBr), см-1: 3174, 2968, 1725, 1594, 1519, 1442, 1278, 1249, 1156.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 8,98 (с, 1H), 8,17 (м, 1H), 7,61 (м, 1H), 7,15 (м, 1H), 2,52 (к, J = 7,5 Гц, 2H), 1,39 (с, 9H), 1,08 (т, J = 7,5 Гц, 3H).
МС (FD), m/e: 222 (M+).
УФ (EtOH): 270 нм ( δ = 4398), 223 нм ( ε = 6745).
Найдено,%: C 64,91; H 8,34; N 12,42.
C12H18N2O2
Вычислено,%: C 64,84; H 8,16; N 12,60.
B. Получение 3-этил-2-аминопиридина.
В 90 мл смеси 3 н. HCl с уксусной кислотой растворяют 2-трет-бутоксикарбониламино-3-этилпиридин (4,9 г, 19,8 ммоль) и перемешивают 2 ч. Раствор нейтрализуют 2 н. NaOH до pH 7 и затем экстрагируют этилацетатом (2 х 400 мл). Органическую фазу сушат над сульфатом магния и после концентрирования получают 2,3 г (95%) желтоватого твердого продукта, используемого в последующей реакции без дополнительной очистки.
C. N-(2-Фенэтил)-N'-[2-(3-этил)пиридил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (3,61 г, 18,8 ммоль, 3,3 мл) и 2-амино-3-этилпридина (2,3 г, 18,8 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 3 ч при 90-95oC. Раствор охлаждают до комнатной температуры, переносят в этилацетат (150 мл) и промывают 0,1 н. соляной кислотой (2х), водой (3х) и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Очисткой твердого остатка вытеснительной хроматографией на силикагеле (1,5% этилацетата в дихлорметане) с последующей перекристаллизацией (30% этилацетата в гексане) получают 1,1 г (21%) указанного соединения в виде белого вещества, т. пл. 57-58oC.
ИК (KBr), см-1: 3433, 2932, 1561, 1516, 1452, 1433, 1328, 1237, 760.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,58 (ш.с, 1H), 8,66 (ш.с, 1H), 7,92-7,9 (м, 1H), 7,6-7,58 (м, 1H), 7,3-7,15 (м, 5H), 7,02-6,98 (м, 1H), 3,83-3,77 (м, 2H), 2,89 (т, J = 6 Гц, 2H), 2,64 (к, J = 7,5 Гц, 2H), 1,09 (т, J = 7,5 Гц, 3H).
МС (FD), m/e: 285 (M+).
УФ (EtOH): 293 нм ( ε = 16632), 265 нм ( ε = 14930), 244 нм ( δ = 16594), 202 нм ( ε = 21127).
Найдено,%: C 67,17; H 6,88; N 14,51.
C16H19N3S
Вычислено,%: C 67,33; H 6,71; N 14,72.
Пример 231. N-(2-Фенэтил)-N-[2-(3-бром)пиридил]тиомочевина.
A. 2-трет-Бутоксикарбониламино-3-бромпиридин.
В 80 мл тетрагидрофурана растворяют 2-трет-бутоксикарбониламинопиридин (10 г, 51,5 ммоль), охлаждают до -78oC и в течение 1 ч по каплям прибавляют н-бутиллитий (120 ммоль, 80 мл 1,49 М раствора в гексане). После перемешивания в течение еще 15 мин при -78oC и 2,5 ч при -10oC раствор вновь охлаждают до -78oC и к нему в течение 15 мин шприцем по каплям прибавляют 1,2-дибромэтан (77,2 ммоль, 6,65 мл). Раствор оставляют нагреваться до комнатной температуры. Реакционную смесь нейтрализуют 100 мл насыщенного раствора хлорида аммония и экстрагируют этилацетатом (3х). Органические слои объединяют, сушат над сульфатом магния, фильтруют и концентрируют. Очисткой твердого остатка вытеснительной хроматографией на силикагеле (25% этилацетата в гексане) получают 4,5 г (32%) указанного соединения в виде светло-коричневого вещества, т. пл. 120-121oC.
ИК (KBr), см-1: 3191, 2980, 1729, 1521, 1442, 1365, 1272, 1166, 1032.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 9,28 (с, 1H), 8,34 (м, 1H), 8,05 (м, 1H), 7,15 (м, 1H), 1,39 (с, 9H).
МС (FD), m/e: 272 (M+), 274 (M+2).
УФ (EtOH): 280 нм ( ε = 4047), 230 нм ( δ = 9067), 204 нм ( δ = 16385).
B. Получение 3-бром-2-аминопиридина.
В 70 мл смеси 3 н. HCl с уксусной кислотой растворяют 3-бром-2-трет-бутоксикарбониламинопиридин (3,8 г, 13,9 ммоль) и перемешивают 2 ч. Раствор нейтрализуют 2 н. NaOH до pH 7 и затем экстрагируют этилацетатом (3 х 300 мл). Органическую фазу сушат над сульфатом магния и после концентрирования получают коричневое масло. Масло примерно сутки выдерживают в вакууме и получают 2,4 г (100%) кристаллического продукта, используемого на последующей стадии без дополнительной очистки, т. пл. 57-59oC.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 7,9 (м, 1H), 7,65 (м, 1H), 6,4 (м, 1H), 6,2-6,1 (с, 2H).
C. N-(2-Фенэтил)-N'-[2-(3-бром)пиридил]тиомочевина.
Раствор 2-фенэтилизотиоцианата (1,89 г, 11,6 ммоль, 1,73 мл) и 2-амино-3-бромпиридина (2 г, 11,6 ммоль) в N,N-диметилформамиде перемешивают 3 ч при 90-95oC. Раствор охлаждают до комнатной температуры, переносят в этилацетат и промывают 0,1 н. соляной кислотой (2х), водой (3х) и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают вытеснительной хроматографией, на силикагеле (30% этилацетата в гексане) и получают 0,5 г (13%) указанного соединения в виде белого вещества, т. пл. 95-96oC.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,2 (м, 1H), 8,45 (с, 1H), 8,13-8,06 (м, 2H), 7,29-7,18 (м, 5H), 7,04-7 (м, 1H), 3,86-3,8 (м, 2H), 2,91 (т, J = 6 Гц, 2H).
МС (FD), m/e: 335 (M+), 337 (M+2).
УФ (EtOH): 298 нм ( ε = 13404), 272 нм ( ε = 16029), 250 нм ( δ = 17186), 203 нм ( ε = 22974).
Найдено,%: C 49,77; H 4,21; N 12,37.
C14H14N4S2Br
Вычислено,%: C 50,01; H 4,20; N 12,50.
Пример 232. N-(4-Бромфенэтил)-N'-[2-(4-этил)тиазолил]тиомочевина.
В дихлорметане с водой образуют взвесь гидрохлорида 4-бромфенэтиламина (1 г, 4,22 ммоль), к полученной взвеси добавляют водную гидроокись натрия (0,17 г, 4,22 ммоль) и перемешивают. Органическую часть отделяют, промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый продукт добавляют к N-(тиоимидазоил)-2-амино-4-этилтиазолу (1 г, 4,22 ммоль) в 20 мл N,N-диметилформамида и перемешивают 3 ч при 90-95oC. Раствор охлаждают до комнатной температуры, добавляют 150 мл этилацетата и промывают 0,1 н. соляной кислотой (2х), водой (3х) и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией остатка (50% этилацетата в гексане) получают 0,7 г (45%) указанного соединения в виде желтого вещества, т. пл. 156-157oC.
ИК (KBr), см-1: 2963, 1560, 1527, 1259, 1212, 1011, 802, 743.
1H-ЯМР (300 МГц, CDCl3), ε : 10,94 (ш.с, 1H), 9,77 (ш.с, 1H), 7,41 (д, J = 8,3 Гц, 2H), 7,24 (д, J = 8,2 Гц, 2H), 6,33 (с, 1H), 4,03-3,97 (м, 2H), 2,97 (т, J = 6,8 Гц, 2H), 2,49 (к, J = 7,5 Гц, 2H), 1,13 (т, J = 7,5 Гц, 3H).
МС (FD), m/e: 369 (M+), 371 (M+2).
УФ (EtOH): 292 нм ( δ = 10803), 257 нм ( ε = 6300).
Найдено,%: C 45,53; H 4,42; N 11,49.
C14H16N3SBr
Вычислено,%: C 45,41; H 4,35; N 11,35.
Пример 233. N-(3-Феноксифенэтил)-N'-[2-(4-этил)тиазолил] тиомочевина.
В дихлорметане с водой образуют взвесь гидрохлорида 3-феноксифенэтиламина (1 г, 4 ммоль), к взвеси добавляют водную гидроокись натрия (0,16 г, 4 ммоль) и перемешивают. Органическую часть отделяют, промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. К полученному твердому остатку добавляют N-(тиоимидазоил)-2-амино-4-этилтиазол (1 г, 4,22 ммоль) и N,N-диметилформамид (20 мл) и перемешивают 3 ч при 90-95oC. Раствор охлаждают до комнатной температуры, добавляют к 150 мл этилацетата и промывают 0,1 н. соляной кислотой (2х), водой (3х) и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Масло примерно на сутки помещают под вакуум и после перекристаллизации (50% этилацетата в гексане) получают 0,6 г (42%) указанного соединения в виде белого вещества, т. пл. 124oC.
ИК (KBr), см-1: 3177, 2966, 1563, 1534, 1509, 1491, 1446, 1349, 1287, 1218, 1158, 773.
1H-ЯМР (300 МГц, CДCl3), ε : 10,99 (ш.с, 1H), 9,87 (ш.с, 1H), 7,31-7,23 (м, 3H), 7,09-6,84 (м, 6H), 6,32 (с, 1H), 4,03-3,97 (м, 2H), 2,99 (т, J = 6,8 Гц, 2H), 2,53 (к, J = 7,5 Гц, 2H), 1,14 (т, J = 7,5 Гц, 3H).
МС (FD), m/e: 383 (M+).
УФ (EtOH): 293 нм ( ε = 19262), 258 нм ( δ = 11356), 205 нм ( ε = 37212).
Найдено,%: C 62,69; H 5,61; N 11,06.
C20H21N3OS2
Вычислено,%: C 62,63; H 5,52; N 10,96.
Пример 234. В дихлорметане с водой образуют взвесь тозилата 2-нитрофенэтиламина (0,97 г, 3 ммоль), к взвеси добавляют водную гидроокись натрия (0,12 г, 3 ммоль) и перемешивают. Органическую часть отделяют, промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый остаток добавляют к N-(тиоимидазоил)-2-амино-4-этилтиазолу (ВК8-6ТТ-074) (0,71 г, 3 ммоль) в 20 мл N,N-диметилформамида и перемешивают 3 ч при 90-95oC. Раствор оставляют охлаждаться до комнатной температуры, затем добавляют к 150 мл этилацетата и промывают 0,1 н. соляной кислотой (2х), водой (3х) и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией (50% этилацетата в гексане) твердого остатка получают 0,5 г (54%) указанного соединения в виде белого вещества, т. пл. 132-133oC.
ИК (KBr), см-1: 3171, 2966, 1586, 1531, 1509, 1341, 1215.
1H-ЯМР (300 МГц, CDCl3), ε : 11,06 (ш.с, 1H), 9,76 (ш.с, 1H), 7,88 (д, J = 8,1 Гц, 1H), 7,56-7,35 (м, 3H), 6,35 (с, 1H), 4,13-4,02 (м, 2H), 3,33 (т, J = 7,0 Гц, 2H), 2,56 (к, J = 7,4 Гц, 2H), 1,16 (т, J = 7,4 Гц, 3H).
МС (FD), m/e: 336 (M+).
УФ (EtOH): 292 нм ( ε = 20546), 258 нм ( δ = 14748), 203 нм ( ε = 24932).
Найдено,%: C 49,95; H 4,86; N 16,59.
C14H16N4O2S2
Вычислено,%: C 49,98; H 4,79; N 16,65.
Пример 235. N-[6-(2-Фенилбензоксазолил)этил] -N'-(2-этилтиазолил) тиомочевина.
В дихлорметане с водой образуют взвесь гидрохлорида 2-[6-(2-фенилбензоксазолил)] этиламина, добавляют водную гидроокись натрия (0,13 г, 3,2 ммоль) и перемешивают. Органическую часть отделяют, промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток добавляют к N-(тиоимидазоил)-2-амино-4-этилтиазолу (0,71 г, 3 ммоль) в N,N-диметилформамиде (20 мл) и перемешивают 3 ч при 90-95oC. Раствор охлаждают до комнатной температуры, добавляют к 150 мл этилацетата и промывают 0,1 н. соляной кислотой (2х), водой (3х) и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией (50% этилацетата в гексане) твердого остатка получают 0,64 г (49%) указанного соединения в виде белого вещества, т. пл. 183oC.
ИК (KBr), см-1: 3178, 3035, 1578, 1533, 1506, 1253, 1214, 701.
1H-ЯМР (300 МГц, CDCl3), ε : 10,96 (ш. с, 1H), 9,7 (ш. с, 1H), 8,25-8,21 (м, 2H), 7,69 (д, J = 8,1 Гц, 1H), 7,53-7,48 (м, 4H), 7,29 (м, 1H), 6,28 (с, 1H), 4,13-4,06 (м, 2H), 3,17 (т, J = 6,6 Гц, 2H), 2,39 (к, J = 7,5 Гц, 2H), 1 (т, J = 7,5 Гц, 3H).
МС (FD), m/e: 408 (M+).
УФ (EtOH): 294 нм ( δ = 12603), 201 нм ( ε = 14517).
Найдено,%: C 61,99; H 5,18; N 13,85.
C21H20N4OS2
Вычислено,%: C 61,74; H 4,93; N 13,71.
Пример 236. N-(2-Феноксифенэтил)-N'-[2-(этил)тиазолил)]тиомочевина.
В дихлорметане с водой образуют взвесь гидрохлорида 2-феноксифенэтиламина (0,97 г, 3,9 ммоль), добавляют водную гидроокись натрия (0,13 г, 3,9 ммоль) и перемешивают. Органическую часть отделяют, промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Полученный твердый продукт добавляют к N-(тиоимидазоил)-2-амино-4-этилтиазолу (0,929 г, 3,9 ммоль) в N,N-диметилформамиде (20 мл) и перемешивают 3 ч при 90-95oC. Раствор охлаждают до комнатной температуры, добавляют к 150 мл этилацетата и промывают 0,1 н. соляной кислотой (2х), водой (3х) и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Перекристаллизацией твердого остатка из 50% этилацетата в гексане получают 0,73 г (49%) указанного соединения в виде белого вещества, т. пл. 168oC.
ИК (KBr), см-1: 3168, 3013, 1581, 1532, 1487, 1237, 1209, 753.
1H-ЯМР (300 МГц, CDCl3), ε : 10,93 (ш.с, 1H), 9,67 (ш.с, 1H), 7,35-7,24 (м, 3H), 7,21-7,16 (м, 1H), 7,08-7,02 (м, 2H), 6,94-6,86 (м, 3H), 6,31 (с, 1H), 4,05-4 (м, 2H), 3,05 (т, J = 6,9 Гц, 2H), 2,5 (к, J = 7,35 Гц, 2H), 1,12 (т, J = 7,5 Гц, 3H).
МС (FD), m/e: 383 (M+).
УФ (EtOH): 292 нм ( ε = 19052), 258 нм ( δ = 11450), 204 нм ( ε = 38534).
Найдено,%: C 62,91; H 5,67; N 11,22.
C20H21N3OS2
Вычислено,%: C 62,63; H 5,52; N 10,96.
Пример 237. N-{[(4-Метил-2-тиазолил)амино]тиоксометил}-DL- фенилаланин, метиловый эфир.
Раствор 1-{[2-(4-метил)тиазолил]тиокарбамоил}имидазола (0,45 г, 5 ммоль) и гидрохлорида метилового эфира DL-фенилаланина (0,43 г, 2 ммоль) в N,N-диметилформамиде (50 мл) нагревают 12 ч при 110oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этилового эфира с гексаном получают 118 мг (18%) указанного соединения, т. пл. 131-132oC.
ИК (KBr), см-1: 3179, 3027, 1578, 1579, 1533, 1224.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,8 (ш. с, 1H), 10,2 (ш. с, 1H), 7,2-7,38 (м, 5H), 6,63 (с, 1H), 5,1 (к, 1H), 3,63 (с, 3H), 3,03-3,22 (м, 2H), 2,12 (с, 3Н).
МС (FD), m/e: 335 (M+).
УФ (EtOH): 294 нм ( ε = 18428), 257 нм ( δ = 9852), 202 нм ( ε = 21796).
Найдено,%: C 53,47; H 5,11; N 12,75.
C15H17N3O2S2
Вычислено,%: C 53,71; H 5,11; N 12,53.
Пример 238. (±)-3-(4-Метил-2-тиазолил)-5-фенилметил-2-тиоксо-4- имидазолидинон.
Раствор метилового эфира N-{[(4-метил-2-тиазолил)амино]тиоксометил}-DL-фенилаланина (0,94 г, 2,8 ммоль) и гидрата п-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (80 мл) кипятят 24 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют. Перекристаллизацией полученного продукта из смеси этилацетат/гексан получают 216,1 мг (25%) указанного соединения, т. пл. 169-171oC.
ИК (KBr), см-1: 3153, 1776, 1539, 1280, 1195, 744, 303.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,85 (с, 1H), 7,4 (д, 1H), 7,3 (м, 3H), 7,11 (м, 2H), 4,83 (т, 1H), 3,5 (д, 2H), 2,35 (с, 3H).
МС (FD), m/e: 303 (M+).
УФ (EtOH): 265 нм ( δ = 16902), 203 нм ( ε = 17971).
Найдено,%: C 55,63; H 4,45; N 13,91.
C14H13N3OS2
Вычислено, %: C 55,42; H 4,32; N 13,85. Ад/ АС р _ в & n т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ A В U Ы g з т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ з ъ 1 Z б c и 8 т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ 8 q > O Ф т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ [ Ю с d л z т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ z J Р \ д щ . т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ . r Ц T Ь с ( c л т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ л ( o н 9 А B т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ B В 9 ~ E М т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ Z " j Ы у
Пример 239. N-[(2-Тиазолиламино)тиоксометил]-DL-фенилаланин, метиловый эфир.
Раствор 1-[(2-тиазолил)тиокарбамоил] имидазола (4,21 г, 20 ммоль) и гидрохлорида метилового эфира DL -фенилаланина (4,31 г, 20 ммоль) в N,N-диметилформамиде (150 мл) нагревают 3 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси эфир/гексан получают 3,26 г (51%) указанного соединения.
ИК (KBr), см-1: 3184, 3029, 1735, 1569, 1510, 1223, 1189.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,9 (с, 1H), 7,4 (д, 1H), 7,2-7,38 (м, 5H), 7,17 (д, 1H), 5,3 (к, 1H), 3,63 (с, 3H), 3,02-3,22 (м, 2H).
МС (FD), m/e: 321 (M+).
УФ (EtOH): 291 нм ( ε = 18235), 255 нм ( δ = 10773), 202 нм ( ε = 20575).
Найдено,%: C 52,24; H 4,61; N 13,18.
C14H15N3O2S2
Вычислено,%: C 52,31; H 4,70; N 13,07.
Пример 240. DL-5-(Фенилметил)-3-(2-тиазолил-2-тиоксо-4- тиазолидинон.
Раствор метилового эфира N-[(2-тиазолиламино)тиоксометил]-DL-фенилаланина (0,47 г, 2,23 ммоль) и гидрата п-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (50 мл) кипятят 12 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией полученного продукта из смеси эфир/гексан получают 0,243 г (58%) указанного соединения, т. пл. 164-165oC.
ИК (KBr), см-1: 3099, 2985, 2873, 1775, 1532, 1440, 1398, 1329, 1251, 1208, 737.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,9 (с, 1H), 7,83 (д, 1H), 7,8 (д, 1H), 7,5 (м, 3H), 7,2 (м, 2H), 4,9 (т, 1H), 3,17 (д, 2H).
МС (FD), m/e: 289 (M+).
УФ (EtOH): 264 нм ( δ = 16108), 202 нм ( ε = 17275).
Найдено,%: C 54,22; H 3,96; N 14,30.
C13H11N3OS2
Вычислено,%: C 53,96; H 3,83; N 14,52.
Пример 241. N-[(2-Бензотиазолиламино)тиоксометил]-DL- фенилаланин, метиловый эфир.
Раствор 1-[(2-бензотиазолил)тиокарбамоил] имидазола (1,3 г, 5 ммоль) и гидрохлорида метилового эфира DL-фенилаланина (1,08 г, 5 ммоль) в N,N-диметилформамиде (50 мл) нагревают 3 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси эфир/гексан получают 1,31 г (70%) указанного соединения, т. пл. 168-169oC.
ИК (KBr), см-1: 3168, 3030, 1732, 1548, 1525, 1206, 1193.
1H-ЯМР (300 МГц, ДMCO-d6), ε :10,3 (ш.с, 1H), 7,88 (д, 1H), 7,62 (д, 1H), 7,32 (т, 1H), 7,2-7,29 (м, 6H), 5,18 (к, 1H), 3,7 (с, 3H), 3,22 (м, 2H).
МС (FD), m/e: 371 (M+).
УФ (EtOH): 303 нм ( ε = 25329), 247 нм ( δ = 12095), 203 нм ( ε = 28990).
Найдено,%: C 58,19; H 4,70; N 11,30.
C13H11N3OS2
Вычислено,%: C 58,20; H 4,61; N 11,31.
Пример 242. DL-3-(Бензотиазолил)-5-фенилметил-2-тиоксо-4- тиазолидинон.
Раствор N-[(2-бензотиазолиламино)тиоксометил]-DL-фенилаланин, метилового эфира (1 г, 2,69 ммоль) и гидрата n-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (80 мл) кипятят 36 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией полученного продукта из смеси этилацетата с гексаном получают 74,9 мг (8%) указанного соединения, т. пл. 187-189oC.
ИК (KBr), см-1: 3250, 1766, 1522, 1489.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11 (с, 1H), 8,18 (д, 1H), 8,02 (д, 1H), 7,08-8 (м, 2H), 7,37 (м, 3H), 7,23 (д, 2H), 4,97 (т, 1H), 3,18 (д, 2H).
МС (FD), m/e: 339 (M+).
УФ (EtOH): 300 нм ( ε = 7355), 265 нм ( ε = 19454), 217 нм ( δ = 26558), 203 нм ( δ = 31150).
Найдено,%: C 60,33; H 4,14; N 12,25.
C17H13N3OS2
Вычислено,%: C 60,16; H 3,86; N 12,38.
Пример 243. N-{[(6-Фтор-2-бензотиазолил)амино]тиоксометил}-DL- фенилаланин, метиловый эфир.
Раствор 1-{ [2-(6-фтор)бензотиазолил] тиокарбамоил} имидазола (1,4 г, 5 ммоль) и гидрохлорида метилового эфира DL - фенилаланина (1,08 г, 5 ммоль) в N, N-диметилформамиде (175 мл) нагревают 3 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией из смеси эфир/этилацетат получают 900 мг (46%) указанного соединения.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,03 (ш.с, 1H), 7,82 (к, 1H), 7,6 (м, 1H), 7,2-7,32 (м, 6H), 5,1 (к, 1H), 3,63 (с, 3H), 3,2 (т, 2H).
МС (FD), m/e: 389 (M+).
Пример 244. DL-3-(6-Фтор-2-бензотиазолил)-5-(фенилметил)-2- тиоксо-4-имидазолидинон.
Раствор метилового эфира N-{[(6-фтор-2-бензотиазолил)амино] тиоксометил} -DL-фенилаланина (0,9 г, 2,31 ммоль) и гидрата n-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (80 мл) кипятят 48 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией полученного продукта из смеси эфир/гексан получают 251 мг (31%) указанного соединения, т.пл. 223-224oC.
ИК (KBr), см-1: 3173, 1767, 1538, 1453, 1388, 1267.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,02 (с, 1H), 8-8,12 (м, 2H), 7,4-7,5 (м, 1H), 7,2-7,39 (м, 5H), 4,97 (т, 1H), 3,2 (д, 2H).
МС (FD), m/e: 357 (M+).
УФ (EtOH): 265 нм ( ε = 15680), 223 нм ( δ = 19505), 201 нм ( ε = 23665).
Найдено,%: C 56,89; H 3,43; N 11,60.
C17H12FN3OS2
Вычислено,%: C 57,13; H 3,38; N 11,76.
Пример 245. N-{[(4,5-Диметил-2-тиазолил)амино]тиоксометил}-DL- фенилаланин, метиловый эфир.
Раствор 1-{ [2-(4,5-диметил)тиазолил]тиокарбамоил}имидазола (1,8 г, 7,5 ммоль) и гидрохлорида метилового эфира DL-фенилаланина (1,6 г, 7,5 ммоль) в N, N-диметилформамиде (50 мл) нагревают 4 ч при 90oC. Реакционную массу охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси эфир/гексан получают 1,91 г (72%) указанного соединения.
ИК (KBr), см-1: 3178, 3079, 1756, 1552, 1505, 1219.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,65 (с, 3H), 7,2-7,38 (м, 5H), 5,1 (к, 1H), 3,65 (с, 3H), 3,05-3,21 (м, 2H), 2,2 (с, 3H), 2,08 (т, 3H).
МС (FD), m/e: 349 (M+).
УФ (EtOH): 300 нм ( ε = 17248), 257 нм ( δ = 9202), 203 нм ( ε = 22444).
Найдено,%: C 55,16; H 5,57; N 12,01.
C16H19N3O2S2
Вычислено,%: C 54,99; H 5,48; N 12,02.
Пример 246. DL-(4,5-Диметил-2-тиазолил)-5-(фенилметил)-2- тиоксо-4-имидазолидинон.
Раствор N-{[(4,5-диметил-2-тиазолил)амино]тиоксометил}-DL- фенилаланина (1 г, 2,86 ммоль) и гидрата n-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (50 мл) кипятят 48 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют по пониженном давлении. Перекристаллизацией полученного продукта из смеси эфир/гексан получают 0,545 г (60%) указанного соединения, т. пл. 205-207oC.
ИК (KBr), см-1: 3161, 1783, 1527, 1287, 1164.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,8 (с, 1H), 7,3 (м, 3H), 7,2 (м, 2H), 4,83 (т, 1H), 3,1 (д, 2H), 2,32 (с, 3H), 2,21 (с, 3H).
МС (FD), m/e: 317 (M+).
УФ (EtOH): 266 нм ( δ = 16921), 201 нм ( ε = 17995).
Найдено,%: C 56,53; H 4,94; N 13,49.
C15H15N3OS2
Вычислено,%: C 56,76; H 4,76; N 13,24.
Пример 247. N-{[(4-Циано-2-тиазолил)амино]тиоксометил}-DL- фенилаланин, метиловый эфир.
Раствор 1-{[2-(4-циано)тиазолил]тиокарбамоил}имидазола (1,76 г, 7,5 ммоль) и гидрохлорида метилового эфира DL-фенилаланина (1,62 г, 7,5 ммоль) в N, N-диметилформамиде (50 мл) нагревают 5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этилового эфира с гексаном получают 1,42 г (55%) указанного соединения.
ИК (KBr), см-1: 3011, 2220, 1742, 1672, 1586, 1455, 1372.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 7,12-7,38 (м, 5H), 7,4 (с, 1H), 5,05 (к, 1H), 3,63 (с, 3H), 3,03-3,22 (м, 2H).
МС (FD), m/e: 346 (M+).
УФ (EtOH): 287 нм ( ε = 7404), 257 нм ( δ = 12260), 206 нм ( ε = 30014).
Пример 248. DL-3-(4-Циано-2-тиазолил)-5-(фенилметил)-2-тиоксо-4- имидазолидинон.
Раствор метилового эфира N-{[4-циано-2-тиазолил)амино]тиоксометил}-DL-фенилаланина (1,42 г, 4,10 ммоль) и гидрата п-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (80 мл) кипятят 24 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией полученного продукта из смеси этиловый эфир/гексан получают 170,1 мг (10%) указанного соединения, т. пл. 214-216oC.
ИК (KBr), см-1: 3294, 3092, 2246, 1781, 1505, 1381, 1325, 1244.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,08 (с, 1H), 8,9 (с, 1H), 7,22-7,8 (м, 3H), 7,2-7,22 (м, 2H), 4,83 (т, 1H), 3,17 (д, 1H).
МС (FD), m/e: 314 (M+).
УФ (EtOH): 259 нм ( δ = 15097), 205 нм ( ε = 26419).
Найдено,%: C 53,75; H 3,43; N 17,62.
C14H10N4OS2
Вычислено,%: C 53,49; H 3,21; N 17,82.
Пример 249. N-{ [(4-Трифторметил-2-тиазолил)амино]тиоксометил}- DL-фенилаланин, метиловый эфир.
Раствор 1-{ [2-(4-трифторметил)тиазолил] тиокарбамоил}имидазола (1,6 г, 5,8 ммоль) и гидрохлорида метилового эфира DL-фенилаланина (1,24 г, 5,8 ммоль) в N,N-диметилформамиде (50 мл) нагревают 5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией из смеси этиловый эфир/гексан получают 2,22 г (99%) указанного соединения.
ИК (KBr), см-1: 3000, 1744, 1672, 1554, 1523, 1226.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 8,64 (д, 1H), 7,82 (с, 1H), 7,21-7,38 (м, 3H), 7,19-7,21 (д, 2H), 5,05 (к, 1H), 3,63 (с, 3H), 3,02-3,22 (м, 2H).
МС (FD), m/e: 389 (M+).
УФ (EtOH): 287 нм ( ε = 11327), 256 нм ( δ = 11674), 203 нм ( ε = 24532).
Найдено,%: C 46,55; H 3,57; N 11,06.
C15H14F3N3O2S2
Вычислено,%: C 46,27; H 3,62; N 10,79.
Пример 250. DL3-(4-Трифторметил-2-тиазолил)-5-(фенилметил)-2- тиоксо-4-имидазолидинон.
Раствор N-{ [(4-трифторметил-2-тиазолил)амино] тиоксометил}- DL-фенилаланин, метилового эфира (2,09 г, 5,38 ммоль) и гидрата п-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (80 мл) кипятят 48 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией полученного продукта из смеси этиловый эфир/гексан получают 1,01 г (53%) указанного соединения, т. пл. 187-189oC.
ИК (KBr), см-1: 3431, 3008, 1782, 1495, 1369, 1328, 1242, 1178, 1149, 1085.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,02 (с, 1H), 8,59 (с, 1H), 7,22-7,8 (м, 3H), 7,2-7,22 (м, 2H), 4,83 (т, 1H), 3,17 (д, 2H).
МС (FD), m/e: 357 (M+).
УФ (EtOH): 263 нм ( δ = 13898), 202 нм ( ε = 19355).
Найдено,%: C 47,33; H 2,86; N 11,67.
C14H10F3N3OS2
Вычислено,%: C 47,05; H 2,82; N 11,76.
Пример 251. N-[2-(1-Циклогексенил)этил]-N'-[2-(6-бром)пиридинил]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцината (1,67 г, 10 ммоль) и 2-амино-6-бромпиридина (1,73 г, 10 ммоль) в N,N-диметилформамиде (100 мл) нагревают 96 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают 1 н. HCl. Органический слой концентрируют и очисткой остатка ВЭЖХ (элюирование смесью гексан/EtOAc) получают 70,1 мг (2,1%) указанного соединения, т. пл. 174-175oC.
ИК (CHCl3), см-1: 2936, 1592, 1512, 1448, 1203.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,79 (с, 1H), 10,65 (м, 1H), 7,7 (т, 1H), 7,28 (д, 1H), 7,19 (д, 1H), 5,6 (с, 1H), 3,7 (к, 2H), 2,23 (т, 2H), 1,95 (с, 4H), 1,62-1,42 (м, 4H).
МС (FD), m/e: 341 (M+).
УФ (EtOH): 303 нм ( ε = 19786, 269 нм ( ε = 18279), 252 нм ( δ = 18006), 201 нм ( δ = 17992).
Найдено,%: C 49,69; H 5,36; N 12,09.
C14H18BrN3S
Вычислено,%: C 49,42; H 5,33; N 12,35.
Пример 252. N-[2-(1-Циклогексенил)этил] -N'-[(4-изопропил) пиридинил] тиомочевина.
Раствор 2-(1-циклогексенил)этилизоцианата (0,36 г, 2,2 ммоль) и 2-амино-4-изопропилпиридина (0,36 г, 2,2 ммоль) в N,N-диметилформамиде (20 мл) нагревают 96 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат и промывают 1 н. водной HCl. Органический слой концентрируют и очисткой остатка ВЭЖХ (элюирование смесью гексан/EtOAc) получают 169 мг (5,6%) указанного соединения, т. пл. 105-106oC.
ИК (KBr), см-1: 3215, 2931, 1614, 1556, 1534, 1487, 1199.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,65 (т, 1H), 10,4 (с, 1H), 8,3 (д, 1H), 7,2 (с, 1H), 6,93 (д, 1H), 5,52 (с, 1H), 3,63 (к, 2H), 2,8 (м, 1H), 2,22 (т, 2H), 1,95 (м, 4H), 1,62-1,42 (м, 4H), 1,18 (д, 6H).
Пример 253. N-[2-(1-Циклогексенил)этил]-N'-[2-(6-метилтио) бензотиазолил]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-аминобензотиазола (1,96 г, 10 ммоль) в N,N-диметилформамиде (20 мл) нагревают 96 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, образовавшийся осадок собирают и промыванием этилацетатом, получают 1,22 г (54%) указанного соединения, т. пл. 186-187oC.
ИК (KBr), см-1: 3171, 3036, 2918, 1548, 1522, 1251, 1214.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,82 (ш. с, 1H), 10,2 (ш. с, 1H), 7,88 (с, 1H), 7,6-7,5 (м, 1H), 7,4-7,3 (к, 1H), 5,55 (с, 1H), 3,67 (к, 1H), 2,4 (с, 3H), 2,25 (т, 2H), 1,95 (с, 4H), 1,62-1,42 (м, 4H).
МС (FD), m/e: 363 (M+).
УФ (EtOH): 318 нм ( ε = 14538), 256 нм ( ε = 6742), 224 нм ( δ = 13749), 201 нм ( ε = 11940).
Найдено,%: C 56,40; H 5,94; N 11,76.
C17H21N3S3
Вычислено,%: C 56,16; H 5,82; N 11,56.
Пример 254. N-[2-(1-Циклогексенил)этил]-N'-{2-[4-(4-бром)фенил]}тиазолилтиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-4-(4-бромфенил)тиазола (2,55 г, 10 ммоль) в N,N-диметилформамиде (20 мл) нагревают 72 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этилацетат/гексан получают 455 мг (11%) указанного соединения, т. пл. 219-220oC.
ИК (KBr), см-1: 3171, 2927, 1566, 1516, 1301, 1211, 1110, 1071.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,7 (с, 1H), 9,3 (ш.с, 1H), 7,8 (д, 2H), 7,6 (м, 3H), 5,43 (с, 1H), 3,67 (к, 2H), 2,25 (т, 2H), 1,95 (с, 4H), 1,62-1,42 (м, 4H).
МС (FD), m/e: 421 (M+).
УФ (EtOH): 285 нм ( ε = 27781), 245 нм ( δ = 17426), 202 нм ( ε = 31192).
Найдено,%: C 51,08; H 4,47; N 9,91.
C18H20BrN3S2
Вычислено,%: C 51,18; H 4,77; N 9,95.
Пример 255. N-[2-(1-Циклогексенил)этил] -N'-{ 2-[4-(2- гексадецилокси)фенил]тиазолил}тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцината (840 мг, 5 ммоль) и 2-амино-4-[(2-гексадецилокси)фенил] тиазола (2,1 г, 5 ммоль) в N,N-диметилформамиде (20 мл) нагревают 72 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией из смеси этилацетат/гексан получают 900 мг (31%) указанного соединения, т. пл. 98-99oC.
ИК (KBr), см-1: 2919, 1567, 1473, 1222, 1062, 681.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,62 (с, 1H), 9,62 (ш.с, 1H), 7,95 (д, 1H), 7,56 (с, 1H), 7,3 (т, 1H), 7,12 (д, 1H), 7 (т, 1H), 5,43 (с, 1H), 4,1 (т, 2H), 3,65 (к, 2H), 2,25 (т, 2H), 1,95 (ш.с, 2H), 1,83 (т, 3H), 1,94-1,73 (м, 4H), 1,4-1,38 (м, 2H), 1,23 (с, 28H).
МС (FD), m/e: 583 (M+).
УФ (EtOH): 299 нм ( ε = 21244), 263 нм ( δ = 21549), 202 нм ( ε = 30773).
Найдено,%: C 69,70; H 8,99; N 7,28.
C34H53N3OS2
Вычислено,%: C 69,93; H 9,15; N 7,19.
Пример 256. N-[(2-Тиазолил)амино]тиоксометил-DL-2-фторфенилаланин, метиловый эфир.
Раствор 1-[(2-тиазолил)тиокарбамоил] имидазола (3,15 г, 15 ммоль) и гидрохлорида метилового эфира DL-2-фторфенилаланина (3,51 г, 15 ммоль) в N, N-диметилформамиде (100 мл) нагревают 8 ч при 80oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этиловый эфир/гексан получают 1,89 г (37%) указанного соединения.
ИК (KBr), см-1: 3187, 3122, 3090, 3037, 2950, 1739, 1566, 1495, 1209, 1182.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,81 (ш.с, 1H), 7,39 (д, 1H), 7,26 (м, 2H), 7,18 (м, 3H), 5,16 (к, 1H), 3,64 (с, 3H), 3,28 (м, 2H).
МС (FD), m/e: 339 (M+).
УФ (EtOH): 290 нм ( ε = 18548), 256 нм ( δ = 10899), 203 нм ( ε = 19927).
Найдено,%: C 49,45; H 4,07; N 12,40.
C14H14FN3O2S2
Вычислено,%: C 49,67; H 3,87; N 12,42.
Пример 257. DL-3-[2-(Тиазолил)-5]-(2-фтор)фенилметил]-2-тиоксо-4-имидазолидинон.
Раствор метилового эфира N-[(2-тиазолил)амино]тиоксометил-DL-2- фторфенилаланина (1 г, 2,95 ммоль) и гидрата п-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (100 мл) кипятят 48 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией полученного продукта из смеси этилацетат/гексан получают 305 мг (23%) указанного соединения.
ИК (KBr), см-1: 3104, 2870, 1781, 1531, 1438, 1330, 1255, 1204.
1H-ЯМР (300 МГЦ, ДMCO-d6), ε : 10,95 (ш.с, 1H), 7,85 (д, 1H), 7,78 (д, 1H), 7,3 (м, 2H), 7,18 (м, 2H), 4,83 (т, 1H), 3,18 (д, 2H).
МС (FD), m/e: 307 (M+).
УФ (EtOH): 397 нм ( ε = 586), 263 нм ( δ = 16615), 201 нм ( ε = 15980).
Найдено,%: C 50,84; H 3,33; N 13,38.
C13H10N2FOS2
Вычислено,%: C 50,80; H 3,28; N 13,67.
Пример 258. N-[(2-Тиазолил)амино]тиоксометил-DL-3,5-бис(трифторметил)фенилаланин, метиловый эфир.
Раствор 1-[2-тиазолил)тиокарбамоил] имидазола (0,46 г, 2,19 ммоль) и гидрохлорида метилового эфира DL-3,5-дитрифторметилфенилаланина (0,77 г, 2,19 ммоль) в N,N-диметилформамиде (75 мл) нагревают 7 ч при 80oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этиловый эфир/гексан получают 203 мг (20%) указанного соединения.
ИК (KBr), см-1: 3179, 3022, 1745, 1568, 1379, 1291, 1212.
1H-ЯМР (300 МГЦ, ДMCO-d6), ε : 11,82 (ш. с, 1H), 7,98 (с, 3H), 7,1 (м, 1H), 5,12 (м, 1H), 3,31 (с, 3H), 3,08 (м, 2H).
МС (FD), m/e: 457 (M+).
УФ (EtOH): 291 нм ( ε = 18895), 255 нм ( δ = 10490), 202 нм ( ε = 19571).
Найдено,%: C 41,90; H 2,74; N 9,36.
C16H13F6N3O2S2
Вычислено,%: C 42,01; H 2,86; N 9,19.
Пример 259. DL-3-(2-Тиазолил)-5-[(3,5-бис-(трифторметил) фенилметил]-2-тиоксо-4-имидазолидинон.
Раствор N-[(2-Тиазолил)амино] тиоксометил-DL-3,5-бис-трифторметилфениланин, метилового эфира (0,15 г, 0,32 ммоль) и гидрата п-толуолсульфокислоты (0,1 г, 0,53 ммоль) в толуоле (65 мл) кипятят 48 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и после концентрирования при пониженном давлении получают 39 мг (29%) указанного соединения.
ИК (KBr), см-1: 3105, 1771, 1535, 1500, 1444, 1380, 1278, 1217.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,93 (ш.с, 1H), 8,03 (с, 1H), 7,96 (с, 2H), 7,89 (д, 1H), 7,8 (д, 1H), 5,01 (т, 1H), 3,37 (д, 2H).
МС (FD), m/e: 425 (M+).
УФ (EtOH): 440 нм ( δ = 1169), 264 нм ( δ = 14109).
Найдено,%: C 42,60; H 2,33; N 9,63.
C15H9F6N3OS2
Вычислено,%: C 42,35; H 2,13; N 9,88.
Пример 260. N-[(2-Тиазолил)амино]тиоксометил-DL-2- хлорфенилаланин, метиловый эфир.
Раствор 1-[(2-тиазолил)тиокарбамоил]имидазола (1,5 г, 7,1 ммоль) и гидрохлорида метилового эфира DL-2-хлорфенилаланина (1,78 г, 7,1 ммоль) в N,N-диметилформамиде (65 мл) нагревают 7 ч при 80oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этиловый эфир/гексан получают 280 мг (12%) указанного соединения.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 7,38 (м, 3H), 7,23 (м, 2H), 7,08 (ш.с, 1H), 5,17 (к, 1H), 3,62 (с, 3H), 3,21 (м, 2H).
МС (FD), m/e: 355 (M+).
Пример 261. N-[(2-Тиазолил)амино] тиоксометил-DL-4- хлорфенилаланин, метиловый эфир.
Раствор 1-[(2-тиазолил)тиокарбамоил]имидазола (1,5 г, 7,1 ммоль) и гидрохлорида метилового эфира DL-4-хлорфенилаланина (1,78 г, 7,1 ммоль) в N,N-диметилформамиде (65 мл) нагревают 6 ч при 80oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этиловый эфир/гексан получают 840 мг (20%) указанного соединения.
ИК (KBr), см-1: 3176, 3025, 1735, 1562, 1510, 1493, 1467, 1452, 1387, 1353, 1306, 1202, 1191.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,81 (ш. с, 1H), 7,39 (м, 3H), 7,26 (д, 2H), 7,18 (ш. с, 1H), 5,09 (к, 1H), 3,64 (с, 3H), 3,18 (м, 2H).
МС (FD), m/e: 355 (M+).
УФ (EtOH): 291 нм ( ε = 18545), 255 нм ( ε = 11222), 220 нм ( δ = 16171), 201 нм ( δ = 18545).
Найдено,%: C 47,28; H 3,94; N 11,88.
C12H14ClN3O2S2
Вычислено,%: C 47,25; H 3,96; N 11,81.
Пример 262. DL-3-(2-Тиазолил)-5-[(4-хлор)фенилметил] -2-тиоксо-4- имидазолидинон.
Раствор метилового эфира N-[(2-тиазолил)амино]тиоксометил-DL-4- хлорфенилаланина (0,84 г, 2,36 ммоль) и гидрата п-толуолсульфокислоты (0,2 г, 1,05 ммоль) в толуоле (100 мл) кипятят 48 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией полученного продукта из смеси этилацетат/гексан получают 176 мг (23%) указанного соединения.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 7,83 (д, 1H), 7,78 (д, 1H), 7,38 (д, 2H), 7,22 (д, 2H), 4,85 (т, 1H), 3,11 (д, 2H).
МС (FD), m/e: 323 (M+).
Пример 263. N-[(2-Тиазолил)амино]тиоксометил-DL-4- трифторметилфенилаланин, метиловый эфир.
Раствор 1-[(2-тиазолил)тиокарбамоил] имидазола (1,03 г, 4,1 ммоль) и гидрохлорида метилового эфира DL-4-трифторметилфенилаланина (1,15 г, 4,1 ммоль) в N, N-диметилформамиде (75 мл) нагревают 6 ч при 80oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этиловый эфир/гексан получают 389 мг (24%) указанного соединения.
ИК (KBr), см-1: 3178, 3020, 1747, 1577, 1509, 1325, 1278, 1185.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,82 (ш. с, 1H), 9,82 (ш. с, 1H), 7,63 (д, 2H), 7,39 (д, 2H), 7,35 (д, 1H), 7,13 (с, 1H), 5,18 (к, 1H), 3,62 (с, 3H), 3,31 (м, 2H).
МС (FD), m/e: 389 (M+).
УФ (EtOH): 291 нм ( ε = 18127), 255 нм ( δ = 10867), 201 нм ( ε = 20712).
Найдено,%: C 46,21; H 3,69; N 11,00.
C15H14N3F3O2S2
Вычислено,%: C 46,26; H 3,62; N 10,79.
Пример 264. DL-3-(2-Тиазолил)-5-[(4-трифторметил)фенилметил] -2- тиоксо-4-имидазолидинон.
Раствор N-[(2-тиазолил)амино]тиоксометил-DL-4- трифторметилфенилаланин, метилового эфира (0,34 г, 0,87 ммоль) и гидрата п-толуолсульфокислоты (0,2 г, 0,106 ммоль) в толуоле (100 мл) кипятят 48 ч с ловушкой Дина-Старка. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат, промывают насыщенными растворами бикарбоната натрия и хлорида натрия, сушат над сульфатом магния и после концентрирования при пониженном давлении получают 145 мг (46%) указанного соединения.
ИК (KBr), см-1: 3176, 1779, 1619, 1532, 1508, 1432, 1327, 1270, 1194, 1129.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,9 (ш. с, 1H), 7,83 (д, 1H), 7,79 (д, 1H), 7,65 (д, 2H), 7,41 (д, 2H), 4,88 (т, 1H), 3,22 (д, 2H).
МС (FD), m/e: 357 (M+).
УФ (EtOH): 264 нм ( δ = 15626), 201 нм ( ε = 16341).
Найдено,%: C 47,17; H 2,82; N 11,53.
C14H10F3N3OS
Вычислено,%: C 47,05; H 2,82; N 11,76.
Пример 265. N-[(2-Тиазолил)амино]тиоксометил-DL-2,6- дифторфенилаланин, метиловый эфир.
Раствор 1-[(2-тиазолил)тиокарбамоил] имидазола (0,65 г, 3,08 ммоль) и гидрохлорида метилового эфира DL-2,6-дифторфенилаланина (0,78 г, 3,08 ммоль) в N, N-диметилформамиде (75 мл) нагревают 7 ч при 80oC. Реакционную массу охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и перекристаллизацией остатка из смеси этиловый эфир/гексан получают 413 мг (38%) указанного соединения.
ИК (KBr), см-1: 3205, 3036, 1737, 1625, 1554, 1511, 1468, 1442, 1388, 1265.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,83 (ш. с, 1H), 7,37 (к, 2H), 7,08 (м, 2H), 5,21 (к, 1H), 3,62 (с, 3H), 3,31 (м, 2H).
МС (FD), m/e: 357 (M+).
УФ (EtOH): 291 нм ( ε = 18495), 256 нм ( δ = 10699), 202 нм ( ε = 20082).
Найдено,%: C 47,08; H 3,76; N 11,93.
C14H13F2N3O2S2
Вычислено,%: C 47,05; H 3,67; N 11,76.
Пример 266. N-[2-(1-Циклогексенил)этил] -N'-(4,5,6,7- тетрагидробензотиазолил)тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-4,5,6,7-тетрагидробензотиазола (1,54 г, 10 ммоль) в N,N-диметилформамиде (100 мл) нагревают 120 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат и промывают 1 н. HCl. Органический слой концентрируют и перекристаллизацией остатка из смеси этилацетат/гексан получают 426 мг (13%) указанного соединения.
ИК (KBr), см-1: 3169, 3031, 2931, 1580, 1258, 1198.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,41 (ш.с, 1H), 10,85 (ш.с, 1H), 5,43 (с, 1H), 3,58 (м, 2H), 2,6-1,9 (м, 10H), 1,7 (м, 4H), 1,5 (м, 4H).
МС (FD),m/e: 321 (M+).
УФ (EtOH): 298 нм ( ε = 12157), 257 нм ( δ = 6569), 201 нм ( ε = 12172).
Найдено,%: C 60,06; H 6,95; N 12,82.
C16H23N3S2
Вычислено,%: C 59,97; H 7,21; N 13,07.
Пример 267. N-[2-(1-Циклогексенил)этил]-N'-[2-(5-хлор) пиразинил]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (2,3 г, 13,7 ммоль) и 2-амино-5-хлорапиразина (1,75 г, 13,7 ммоль) в N,N-диметилформамиде (40 мл) нагревают 192 ч при 100oC. Реакционную смесь охлаждают до комнатной температуре, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат и промывают 1 н. водной HCl. Органический слой концентрируют и перекристаллизацией полученного продукта из смеси этилацетат/гексан получают 64 мг (1,6%) указанного соединения.
ИК (KBr), см-1: 3192, 2931, 1588, 1515, 1457, 1320, 1251, 1153.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,01 (ш.с, 1H), 10,45 (т, 1H), 8,38 (д, 1H), 8,29 (д, 1H), 5,5 (ш.с, 1H), 3,63 (к, 2H), 2,21 (т, 2H), 1,95 (м, 4H), 1,52 (м, 4H).
МС (FD), m/e: 296 (M+).
УФ (EtOH): 330 нм ( ε = 9176), 273 нм ( δ = 21432), 201 нм ( ε = 10972).
Найдено,%: C 67,55; Н 8,48; N 13,94.
C13H17N4SCl
Вычислено,%: C 67,28; H 8,30; N 13,85.
Пример 268. N-[2-(1-Циклогексенил)этил]-N'-{2-[4-(3,4-дихлор) фенил]тиазолил}тиомочевина.
Раствор 4-(3,4-дихлорфенил)-2-тиазоламина (2,45 г, 10 ммоль) и 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) в N,N-диметилформамиде (50 мл) нагревают 120 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении, остаток переносят в этилацетат и промывают 1 н. HCl. Органический слой концентрируют и перекристаллизацией остатка из смеси этилацетат/гексан получают 933 мг (2,3%) указанного соединения.
ИК (KBr), см-1: 3169, 2927, 1573, 1558, 1523, 1460, 1393, 1295, 1214.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,72 (ш.с, 1H), 9,11 (ш.с, 1H), 8,07 (д, 1H), 7,83 (м, 1H), 7,62 (м, 2H), 5,45 (м, 1H), 3,6 (м, 2H), 2,21 (м, 2H), 1,85 (м, 4H), 1,43 (м, 4H).
МС (FD), m/e: 411 (M+).
УФ (MeOH): 287 нм ( ε = 25040), 241 нм ( δ = 16142), 205 нм ( ε = 29362).
Найдено,%: C 52,63; H 4,48; N 10,21.
C18H19N3S2Cl2
Вычислено,%: C 52,42; H 4,64; N 10,19.
Пример 269. 1-[2-(2-Метоксифенил)этил]тиокарбамоилимидазол.
Раствор 1,1'-тиокарбонилдиимидазола (1,78 г, 10 ммоль) и 2-метоксифенэтиламина (1,51 г, 10 ммоль) в ацетонитриле (25 мл) перемешивают 20 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 1,4 г (53%) указанного соединения.
ИК (KBr), см-1: 2944, 1563, 1493, 1409, 1282, 1246, 1031, 755.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 12 (ш.с, 1H), 7,65 (с, 1H), 7,25 (м, 2H), 7,05-6,9 (м, 4H), 3,8 (м, 2H), 3,8 (с, 3H), 2,95 (т, J = 7 Гц, 2H).
МС (FD), m/e: 261 (M+).
УФ (EtOH): 278 нм ( ε = 7083), 216 нм ( δ = 12683), 203 нм ( ε = 22221).
Пример 270. N-[2-(2-Метокси)этил]-N'-(2-пиридил)тиомочевина.
Раствор 1-[2-(2-метоксифенил)этил]тиокарбамоилимидазола (0,52 г, 2 ммоль) и 2-аминопиридина (0,19 г, 2 ммоль) в N,N-диметилформамиде (5 мл) перемешивают 4 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией остатка из этилацетата получают 0,25 г (44%) указанного соединения.
ИК (KBr), см-1: 3219, 3048, 1607, 1557, 1236, 1036, 756.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,65 (м, 1H), 10,55 (ш. с, 1H), 8,1 (м, 1H), 7,75 (м, 1H), 7,3-6,9 (м, 6H), 3,8 (м, 2H), 3,78 (с, 3H), 2,9 (т, J = 7 Гц, 2H).
МС (FD), m/e: 287 (M+).
УФ (EtOH): 290 нм ( ε = 10141), 267 нм ( ε = 13121), 247 нм ( δ = 10959), 202 нм ( ε = 24078).
Пример 271. N-[2-(1-Циклогексенил)этил]-N'-[2-(6-метил)пиридил] тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-6-метилпиридина (1,08 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 20 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Перекристаллизацией полученного продукта из смеси этилацетат/гексан получают 1,04 г (38%) указанного соединения.
ИК (KBr), см-1: 3230, 2920, 1608, 1572, 1540, 1457, 1378, 1317, 1235, 1164.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,7 (ш. т, 1H), 10,45 (с, 1H), 7,62 (т, 1H), 6,95 (д, 1H), 6,9 (д, 1H), 5,5 (ш. с, 1H), 3,7 (к, 2H), 2,4 (с, 3H), 2,25 (т, 2H), 1,95 (м, 4H), 1,55 (м, 4H).
МС (FD), m/e: 275 (M+).
УФ (EtOH): 296 нм ( ε = 17669), 265 нм ( δ = 16667), 247 нм ( ε = 15266).
Найдено,%: C 65,42; H 7,75; N 15,20.
C15H21N3S
Вычислено,%: C 65,42; H 7,69; N 15,26.
Пример 272. N-[2-(1-Циклогексенил)этил]-N'-[2-(5-метил)пиридил] тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-5-метилпиридина (1,08 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 20 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией полученного остатка из смеси этилацетат/гексан получают 1,06 г (39%) указанного соединения.
ИК (KBr), см-1: 3225, 2933, 1586, 1569, 1532, 1494, 1344, 1311, 1232, 827.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,55 (ш. т, 1H), 10,45 (с, 1H), 7,95 (ш. с, 1H), 7,6 (дв. д, 1H), 7,05 (д, 1H), 5,5 (ш.с, 1H), 3,7 (к, 2H), 2,3 (м, 5H), 1,95 (м, 4H), 1,55 (м, 4H).
МС (FD), m/e: 275 (M+).
УФ (EtOH): 298 нм ( ε = 13663), 268 нм ( δ = 21631), 249 нм ( ε = 14893).
Найдено,%: C 65,15; H 7,75; 15,33.
C15H21N3S
Вычислено,%: C 65,42; H 7,69; N 15,26.
Пример 273. N-[2-(1-Циклогексенил)этил]-N'-[2-(4-метил)пиридил]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-4-метилпиридина (1,08 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 16 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Очисткой продукта с помощью ВЭЖХ получают 1,67 г (61%) указанного соединения.
ИК(KBr), см-1: 3220, 2935, 1617, 1535, 1487, 1322, 1188, 866.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,65 (ш.т, 1H), 10,45 (с,1H), 8 (д, 1H), 6,95 (с,1H), 6,85 (д,1H), 5,5 (ш.с, 1H), 3,65 (к,2H), 2,3 (м, 5H), 1,95 (м, 4H), 1,55 (м,4H).
МС (FD), m/e: 275 (M+).
УФ (EtOH): 289 нм (ε = 16865), 266 нм (ε = 17870), 247 нм (δ = 14179), 202 нм (ε = 20105).
Найдено, %: C 65,16; H 7,55; N 15,30.
C15H21N3S
Вычислено, %: C 65,42; H 7,69; N 15,26.
Пример 274. N-[2-(1-Циклогексенил)этил]-N'-[2-(3-метил)пиридил]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-3-метилпиридина (1,08 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 16 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Очисткой продукта с помощью ВЭЖХ получают 1,8 г (65%) указанного соединения.
ИК (KBr), см-1: 3220, 2931, 1589, 1513, 1462, 1325, 1164.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,6 (ш. т, 1H), 8,65 (c, 1H), 8,05 (д, 1H), 7,65 (д, 1H), 7,05 (дв, д, 1H), 5,5 (ш. с, 1H), 3,65 (к, 2H), 2,3 (с, 3H), 2,25 (т, 2H), 1,95 (м, 4H), 1,55 (м,4H).
МС (FD), m/e: 275 (M+).
УФ (EtOH): 293 нм (ε = 16693), 264 нм (ε = 14464), 244 нм (δ = 14762), 201 нм (ε = 16723).
Пример 275. N-[2-(1-Циклогексенил)этил]-N'-[2-(6-этил)пиридил]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-6-этилпиридина (1,22 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 20 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Очисткой продукта с помощью ВЭЖХ получают 1,55 г (54%) указанного соединения.
ИК (KBr), см-1: 3230, 2930, 1604, 1533, 1450, 1211, 1157.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,8 (ш. т, 1H), 10,45 (с, 1H), 7,62 (т, 1H), 6,95 (д, 1H), 6,9 (д,1H), 5,45 (ш. c, 1H), 3,7 (к, 2H), 2,7 (к,2H), 2,25 (т,2H), 1,95 (м, 4H), 1,55 (м,4H), 1,2 (т,3H).
МС (FD), m/e: 289 (M+).
УФ (EtOH): 296 нм (ε = 17903), 265 нм (ε = 16556), 247 нм (δ = 14932), 201 нм (ε = 14174).
Найдено, %: C 66,4; H 8,00; N 14,75.
C16H23N3S
Вычислено, %: C 66,4; H 8,01; N 14,52.
Пример 276. N-[2-(1-Циклогексенил)этил]-N1-[2-(4-этил)пиридил]тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-4-этилпиридина (1,22 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 16 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Очисткой продукта с помощью ВЭЖХ получают 1,2 г (42%) указанного соединения.
ИК (KBr), см-1: 3215, 2931, 1615, 1535, 1407, 1334, 1198, 843.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,68 (ш.т, 1H), 10,45 (с, 1H), 8, (д, 1H), 7 (с, 1H), 6,9 (д, 1H), 5,5 (ш. с,1H), 3,65 (к, 2H), 2,6 (к, 2H), 2,25 (т,2H), 1,95 (м,4H), 1,55 (м, 4 H), 1,2 (т,3H).
МС (FD), m/e: 290 (M+-H).
УФ (EtOH): 289 нм (ε = 17378), 266 нм (ε = 18654), 247 нм (δ = 14847), 202 нм (ε = 23101).
Найдено, %: C 66,45; H 7,99; N 14,26.
C16H23N3S
Вычислено, %: C 66,40; H 8,01; N 14,52.
Пример 277. N-[2-(1-Циклогексенил)этил]-N1-[2-(5-трифторметил)пиридил] тиомочевина.
Раствор 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) и 2-амино-5-трифторметилпиридина (1,62 г, 10 ммоль) в N,N-диметилформамиде (25 мл) нагревают 72 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Очисткой продукта с помощью ВЭЖХ получают 0,33 г (10%) указанного соединения.
ИК (KBr), см-1: 3220, 2929, 1618, 1551, 1500, 1324, 1238, 1132, 1078, 828.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,4 (ш. т, 1H), 10,95 (с, 1H), 8,5 (ш. с, 1H), 8,15 (дв. д, 1H), 7,3 (д, 1H), 5,55 (ш.с, 1H), 3,7 (к, 2H), 2,3 (т, 2H), 1,95 (м, 4H), 1,55 (м, 4H).
МС (FD), m/e: 329 (M+).
УФ (EtOH): 296 нм (δ = 17058), 255 нм (ε = 14250).
Найдено, %: C 54,98; H 5,67; N 12,59.
C15H18N3F3S
Вычислено, %: C 54,70; H 5,51; N 12,76.
Пример 278. N-[(1-Циклогексенил)этил]-N'-[2-(4-метил)тиазолил]тиомочевина.
Раствор 1- {[2-(4-метил)тиазолил]тиокарбамоил}имидазола (1 г, 4,46 ммоль) и 2-циклогексенилэтиламина (0,567 г, 4,46 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 16 ч при 90oC. Реакционную массу охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией остатка из этилацетата получают 0,72 г (57%) указанного соединения.
ИК (KBr), см-1: 3220, 2922, 1565, 1505, 1227, 1168.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,5 (ш.с, 1H), 9,9 (ш.с, 1H), 6,65 (с, 1H), 3,55 (м, 2H), 2,25 (с, 3H), 1,8-0,8 (м, 13H).
МС (FD), m/e: 283 (M+).
УФ (EtOH): 291 нм (δ = 5315), 257 нм (ε = 2711).
Найдено, %: C 55,29; H 7,60; N 14,64.
C13H21N3S2
Вычислено, %: C 55,09; H 7,47; N 14,82.
Пример 279. N-[2-(2-Метоксифенил)этил]-N'-[2-(5-метил)пиридил]тиомочевина.
Раствор 1-[2-(2-метоксифенил)этил] тиокарбамоилимидазола (0,7 г, 2,68 ммоль) и 2-амино-5-метилпиридина (0,29 г, 2,68 ммоль) в N,N-диметилформамиде (5 мл) перемешивают 16 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией остатка из этилацетата получают 0,62 г (77%) указанного соединения.
ИК (KBr), см-1: 3227, 2932, 1612, 1534, 1493, 1273, 1037.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,55 (ш.т, 1H), 10,45 (с, 1H), 7,9 (ш.с, 1H), 7,6 (м, 1H), 7,2-6,9 (м, 5H), 3,8 (м, 5H), 2,9 (т, J= 7 Гц, 2H), 2,2 (с, 3H).
МС (FAB), m/e: 302 (M+-H).
УФ (EtOH): 298 нм (ε = 13316), 268 нм (ε = 23132), 249 нм (ε = 15574).
Найдено, %: C 63,71; H 6,34; N 13,79.
C16H19N3OS
Вычислено, %: C 63,76; H 6,35; N 13,94.
Пример 280. 1-[2-(2-Хлорфенил)этил]тиокарбамоилимидазол.
Раствор 1,1'-тиокарбонилдиимидазола (1,8 г, 10 ммоль) и 2-(2-хлорфенил)этиламина (1,56 г, 10 ммоль) в ацетонитриле (100 мл) перемешивают 3 ч при комнатной температуре. Раствор концентрируют примерно до 50 мл и помещают на 4 дня в холодильник. Фильтрованием образовавшихся кристаллов получают 2,37 г (89%) сырого указанного соединения, т.пл. 74-78oC.
ИК (KBr), см-1: 3134, 2924, 1564, 1529, 1474, 1448, 1411, 1353, 1287, 1215.
МС (FD), m/e: 266 (M+).
УФ (EtOH): 278 нм (ε = 5421), 247 нм (δ = 5655), 202 нм (ε = 22240).
Пример 281. N-[2-(2-Хлорфенил)этил]-N1-[2-(5-метил)пиридил] тиомочевина.
Раствор 1-[2-(2-хлорфенил)этил]тиокарбамоилимидазола (1 г, 3,76 ммоль) и 2-амино-5-метилпиридина (0,41 г, 3,76 ммоль) в N,N-диметилформамиде (10 мл) перемешивают 16 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией остатка из этилацетата получают 0,82 г (80%) указанного соединения.
ИК (KBr), см-1: 3226, 1597, 1532, 1491, 1273, 1050.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,6 (ш. с, 1H), 10,5 (с, 1H), 7,9 (ш.с, 1H), 7,6-7 (м, 6H), 3,9 (к, 2H), 3,1 (т, J= 7 Гц, 2H), 2,2 (с, 3H).
МС (FD), m/e: 305 (M+).
УФ (EtOH): 298 нм (ε = 14145), 268 нм (δ = 21034), 249 нм (ε = 23053).
Найдено, %: C 58,65; H 5,39; N 13,77.
C15H16N3ClS
Вычислено, %: С 58,91; H 5,27; N 13,74.
Пример 282. 1-{[2-(4-Этил)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (11,9 г, 60 ммоль) и 2-амино-4-этилтиазола (8 г, 60 ммоль) в ацетонитриле (250 мл) перемешивают примерно 5 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 12 г (85%) указанного соединения, т. пл. 198-200oC.
ИК(KBr), см-1: 2970, 2637, 1609, 1529, 1461, 1398, 1357, 1226, 1262.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 8,6 (с, 1H), 7,9 (с, 1H), 7 (с, 1 H), 6,9 (с, 1 H), 2,6 (к, J = 7 Гц, 2H), 1,2 (т, J = 7,0 Гц, 3H).
МС (FD), m/e : 238 (M+).
УФ (EtOH) : 361 нм ( ε = 11223), 290 нм ( δ = 8828), 203 нм ( ε = 20303).
Найдено, %: C 45,51; H 4,20; N 23,53.
C9H10N4S2
Вычислено, %: C 45,36; H 4,23; N 23,51.
Пример 283. N-[2-(2-Пиридил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина.
Раствор 1-{[2-(4-этил)тиазолил]тиокарбамоил}имидазола (1 г, 4,2 ммоль) и 2-(2-аминоэтил)пиридина (0,51 г, 4,2 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 3 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют вакууме. Перекристаллизацией остатка из этилацетата получают 0,75 г (61%) указанного соединения.
ИК (KBr), см-1: 3163, 1557, 1524, 1222, 757.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,3 (ш.с, 1H), 10 (ш.с, 1H), 8,5 (м, 1H), 7,7 (м, 1H), 7,25 (м, 2H), 6,6 (с, 1H), 3,9 (м, 2H), 3,05 (м, 2H), 2,45 (к, J = 7 Гц, 2H), 1,05 (т, J = 7 Гц, 3H).
МС (FD), m/e : 292 (M+).
УФ (EtOH) : 292 нм ( ε = 17803), 261 нм ( δ = 12919), 201 нм ( ε = 17809).
Найдено, %: C 53,64; H 5,51; N 19,02.
C13H16N4S2
Вычислено, %: C 53,40; H 5,51; N 19,16.
Пример 284. N-[2-(1-Циклогексенил)этил]-N'-[2-(4-этил)тиазолил] тиомочевина.
Раствор 1-{[2-(4-этил)тиазолил]тиокарбамоил}имидазола (0,75 г, 3,15 ммоль) и 2-(1-циклогексенил)этиламина (0,39 г, 3,15 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 4 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией остатка из этилацетата получают 0,77 г (83%) указанного соединения, т. пл. 155-156oC.
ИК (KBr), см-1 : 3172, 2914, 1560, 1507, 1202, 710.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,5 (ш.с, 1H), 9,8 (ш.с, 1H), 6,6 (с, 1H), 5,42 (с, 1H), 3,56 (к, J = 7 Гц, 2H), 2,45 (м, 2H), 2,16 (м, 2H), 1,9 (м, 4H), 1,5 (м, 4H), 1,12 (т, J = 7 Гц, 3 H).
МС (FD), m/e : 295 (M+).
УФ (EtOH) : 291 нм ( ε = 19227), 257 нм ( δ = 9628), 201 нм ( ε = 15736).
Найдено, %: C 57,20; H 7,22; N 14,16.
C14H21N3S2
Вычислено, %: C 56,91; H 7,16; N 14,22.
Пример 285. N-[2-(2-Хлорфенил)этил]-N'-[2-(4-этил)тиазолил] тиомочевина.
Раствор 1-{ [2-(4-этил)тиазолил] тиокарбамоил] имидазола} (0,75 г, 3,15 ммоль) и 2-(2-хлорфенил)этиламина (0,49 г, 3,15 ммоль) в N,N-диметилформамида (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 0,85 г (83%) указанного соединения, т.пл. 153-155oC.
ИК (KBr), см-1 : 3167, 3018, 1570, 1505, 1215, 749, 699.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,65 (ш.с, 1H), 9,85 (ш.с, 1H), 7,5-7,2 (м, 4H), 6,65 (с, 1H), 3,85 (м, 2H), 3,05 (т, J = 7 Гц, 2H), 2,55 (к, J = 7 Гц, 2H), 1,1 (т, J = 7 Гц, 3H).
УФ (EtOH) : 292 нм ( ε = 19154), 257 нм ( δ = 10451), 202 нм ( ε = 24308).
Найдено, %: C 51,75; H 4,98; N 12,79.
C14H16N3S2Cl
Вычислено, %: C 51,60; H 4,95; N 12,87.
Пример 286. N-[2-(2-Метоксифенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина.
Раствор 1-{[2-(4-этил)тиазолил]тиокарбамоил}имидазола (0,7 г, 2,94 ммоль) и 2-(2-метоксифенил)этиламина (0,44 г, 2,94 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 2 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Перекристаллизацией остатка из этилацетата получают 0,67 г (71%) указанного соединения, т. пл. 166-167,5oC.
ИК (KBr), см-1 : 3173, 3025, 1528, 1248, 1209, 755, 677.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,5 (ш.с, 1H), 9,85 (ш.с, 1H), 7,2-6,8 (м, 4H), 6,57 (с, 1H), 3,7 (м, 5H), 2,82 (т, J = 7 Гц, 2H), 2,04 (к, J = 7 Гц; 2Н), 1,06 (т, J = 7,0 Гц, 3H).
МС (FD), m/e : 321 (M+).
УФ (EtOH) : 291 нм ( ε = 12114), 259 нм ( δ = 6792), 201 нм ( ε = 18914.
Найдено, %: C 55,83; H 6,00; N 13,08.
C15H19N3OS2
Вычислено,%: C 56,04; H 5,96; N 13,07.
Пример 287. N-[2-(3-Метоксифенил)этил] -N'-[2-(4-этил)тиазолил] тиомочевина.
Раствор 1-{[2-(4-этил)тиазолил]тиокарбамоил}имидазола (0,7 г, 2,94 ммоль) и 2-(3-метоксифенил)этиламина (0,44 г, 2,94 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Кристаллизацией остатка из этилацетата получают 0,76 г (80%) указанного соединения, т. пл. 123-125oC.
ИК (KBr), см-1 : 3167, 3027, 1587, 1207, 699.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,5 (ш. с, 1H), 9,9 (ш. с, 1H), 7,2-6,8 (м, 4H), 6,58 (с, 1H), 3,75 (м, 2H), 3,67 (с, 3H), 2,84 (т, J = 7 Гц, 2H), 2,45 (к, J = 7,0 Гц, 2H), 1,05 (т, J = 7 Гц, 3H).
МС (FD), m/e : 321 (M+).
УФ (EtOH) : 292 нм ( ε = 19113), 258 нм ( δ = 10607), 202 нм (δ = 29289).
Найдено, %: C 56,08; H 5,96; N 13,16.
C15H19N3OS2
Вычислено, %: C 56,04; H 5,96; N 13,07.
Пример 288. 1-{[2-(4-Циано)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (3,2 г, 16 ммоль) и 2-амино-4-цианотиазола (2 г, 16 ммоль) в ацетонитриле перемешивают 72 ч при комнатной температуре и нагревают 24 ч при 60oC. Фильтрованием образовавшегося осадка получают 2,74 г (73%) указанного соединения.
ИК (KBr), см-1 : 3097, 2230.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,99 (ш. с, 1H), 8,76 (с, 1H), 8,67 (с, 1H), 8,07 (с, 1H), 7,92 (с, 1H).
МС (FAB), m/e : 236 (M+-H).
Пример 289. N-[2-(2-Хлорфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{[2-(4-циано)тиазолил]тиокарбамоил}имидазола (0,66 г, 2,8 ммоль) и 2-(2-хлорфенил)этиламина (0,45 г, 2,8 ммоль) в N,N-диэтилформамиде (15 мл) перемешивают 2 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,24 г (26%) указанного соединения, т. пл. 165-168oC.
ИК (KBr), см-1 : 3119, 2955, 2232, 1577, 1505, 1461, 1328, 1299, 1221, 1053, 826.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,8 (ш.с, 1H), 8,5 (ш.с, 1H), 8,1 (с, 1H), 7,2-7,4 (м, 4H), 3,74 (м, 2H), 2,98 (т, J = 7 Гц, 2H).
МС (FD), m/e : 322 (M+).
УФ (EtOH) : 287 нм ( ε = 10082), 258 нм ( δ = 15462), 205 нм ( ε = 31601).
Пример 290. N-[2-(3-Хлорфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{ [2-(4-циано)тиазолил] тиокарбамоил} имидазола (0,66 г, 2,8 ммоль) и 2-(3-хлорфенил)этиламина (0,44 г, 2,8 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из хлористого метилена получают 0,21 г (23%) указанного соединения в виде вещества цвета загара, т. пл. 180-185oC.
ИК (KBr), см-1 : 2955, 2239, 1559, 1522, 1331, 1251, 106, 1168, 823.
1H-ЯМР (300 МГц, ДMCO-d6), : 11,8 (ш.с, 1H), 8,4 (ш.с, 1H), 8,1 (с, 1H), 7,1-7,3 (м, 4H), 3,71 (м, 2H), 2,86 (т, J = 7 Гц, 2H).
МС (FD), m/e : 322 (М+), 324.
УФ (EtOH) : 287 нм ( ε = 10684), 258 нм ( ε = 16406), 207 нм ( δ = 33113).
Пример 291. N-[2-(2-Метоксифенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{[2-(4-циано)тиазолил]тиокарбамоил}имидазола (0,66 г, 2,8 ммоль) и 2-(2-метоксифенил)этиламина (0,46 г, 2,8 ммоль) в N, N -диметилформамиде (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатока хроматографией на силикагеле получают 0,21 г (23%) указанного соединения в виде желтого вещества, т.пл. 159-161oC.
ИК (KBr), см-1: 2937, 2235, 1566, 1454, 1301, 1243, 1208, 1173, 754.
1H-ЯМР (300 МГц, ДMCO - d6), ε : 11,8 (ш.с, 1H), 8,4 (ш. с, 1H), 8,1 (с, 1H), 6,8-7,2 (м, 4H), 3,73 (с, 3H), 3,66 (м, 2H), 2,81 (т, J=7 Гц, 2H).
УФ (EtOH): 279 нм ( ε = 12102), 259 нм ( ε = 16281), 203 нм ( δ = 33347).
МС (FD), m/e: 318 (M+).
Пример 292. N-[2-(3-Метоксифенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{[2-(4-циано)тиазолил]тиокарбамоил}имидазола (0,66 г, 2,8 ммоль) и 2-(3-метоксифенил)этиламина (0,44 г, 2,8 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,21 г (23%) указанного соединения в виде желтого вещества, т. пл. 151-153oC.
ИК (KBr), см-1: 3065, 2235, 1564, 1515, 1295, 1250, 1209, 1155, 1058, 874, 768, 748, 684.
1H-ЯМР (300 МГц, ДMCO - d6), ε : 11,8 (ш. с, 1H), 8,4 (ш. с, 1H), 8,1 (с, 1H), 7,18 (м, 1H), 6,77 (м, 3H), 3,68 (м, 5H), 2,8 (т, J=7,0 Гц, 2H).
МС (FD), m/e: 318 (M+).
УФ (EtOH): 280 нм ( ε = 11770), 258 нм ( ε = 16613), 204 нм ( δ = 34785).
Пример 293. N-[2-(1-Циклогексенил)этил]-N1-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{[2-(4-циано)тиазолил]тиокарбамоил}имидазола (0,82 г, 3,5 ммоль) и 2-(1-циклогексенил)этиламина (0,45 г, 3,5 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 1,5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н.водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 0,27 г (26%) указанного соединения в виде бледно-желтого вещества, т.пл. 176-178oC.
ИК (KBr), см-1: 3169, 3075, 2924, 2233, 1556, 1513, 1330, 1298, 1260, 1217, 1200, 1167, 1145, 983, 922.
1H-ЯМР (300 МГц, ДMCO - d6), ε :11,87 (ш. с, 1H), 8,4 (ш. с, 1H), 8,11 (с, 1H), 5,42 (ш.с, 1H), 3,52 (м, 2H), 2,14 (т, J=7 Гц, 2H), 1,9 (м, 4H), 1,49 (м, 4H).
МС (FD), m/e: 292 (M+).
УФ (EtOH): 288 нм (ε = 11250), 258 нм ( ε = 16113), 206 нм ( δ = 25473).
Найдено,%: C 53,1; H 5,55; N 18,96;
C13H16N4S2
Вычислено,%: C 53,4; H 5,22; N 19,16.
Пример 294. 1-{2-[4-(3-Хлорфенил)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (2,52 г, 12 ммоль) и 4-(3-хлорфенил)-2-тиазоламина (2,14 г, 12 ммоль) в ацетонитриле (35 мл) перемешивают 30 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 2,77 г (72%) указанного соединения.
МС (FAB), m/e: 321 (M+-H).
Пример 295. N-[2-(2-Хлорфенил)этил]-N'-{2-[4-(3-хлорфенил)]}тиазолилтиомочевина.
Раствор 1-{ 2-[4-(3-хлорфенил)тиазолил] тиокарбамоил}имидазола (0,92 г, 2,86 ммоль) и 2-(2-хлорфенил)этиламина (0,46 г, 2,86 ммоль) в N, N-диметилформамиде (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка на EtOAc получают 1 г (86%) указанного соединения в виде желтых игл, т. пл. 193-195oC.
ИК (KBr), см-1: 3018, 1560, 1515, 1470, 1291, 1210, 1065, 935, 785, 757, 716.
1H-ЯМР (300 МГц, ДMCO - d6), ε : 11,65 (ш. с, 1H), 9,29 (ш. с, 1H), 7,79 (с, 1H), 7,63 (м, 2H), 7,35 (м, 4H), 7,23 (м, 2H), 3,83 (м, 2H), 3,02 (т, J= 7 Гц, 2H).
МС (FD), m/e: 407 (M+), 409 (M+2).
УФ (EtOH): 295 нм ( ε = 22709), 266 нм ( ε = 20608), 202 нм ( δ = 37861).
Найдено,%: C 52,96; H 3,74; N 10,49.
C18H15N3SCl2
Вычислено,%: C 52, 94; H 3,70; N 10,29.
Пример 296. N-[2-(3-Метоксифенил)этил]-N'-{2-[4-(3-хлорфенил)]}тиазолил тиомочевина.
Раствор 1-{ 2-[4-(3-хлорфенил)тиазолил] тиокарбамоил}имидазола (0,92 г, 2,86 ммоль) и 2-(3-метоксифенил)этиламина (0,45 г, 2,86 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,85 г (74%) указанного соединения в виде белого вещества, т.пл. 183-185oC.
ИК (KBr), см-1: 3172, 3024, 1569, 1515, 1466, 1319, 1287, 1260, 1220, 1067, 996, 775, 728, 604.
1H-ЯМР (300 МГц, ДMCO - d6), ε : 11,66 (ш. с, 1H), 9,2 (ш. с, 1H), 7,81 (с, 1H), 7,63 (м, 2H), 7,35 (м, 2H), 7,16 (м, 1H), 6,73 (м, 3H), 3,77 (м, 2H), 3,64 (с, 3H), 2,86 (т, J=7 Гц, 2H).
МС (FD), m/e: 403 (M+), 405 (M+2).
УФ (EtOH): 280 нм ( ε = 23880), 202 нм ( δ = 42912).
Найдено,%: C 56,62; H 4,50; N 10,58.
C19H18N3OS2Cl2
Вычислено,%: C 56,49; H 4,49; N 10,40.
Пример 297. N-[2-(1-Циклогексенил)этил]-N'-{2-[4-(3-хлорфенил)]}тиазолилтиомочевина.
Раствор 1-{ 2-[4-(3-хлорфенил)тиазолил] тиокарбамоил}имидазола (0,92 г, 2,86 ммоль) и 2-(1-циклогексенил)этиламина (0,37 г, 2,86 ммоль) в N,N-диметилформамиде (15 мл) перемешивают 0,5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,7 г (65%) указанного соединения в виде белого вещества, т.пл. 196-197oC.
ИК (KBr), см-1: 2939, 1557, 1514, 1469, 1287, 1202, 1062, 881, 784, 719, 661.
1H-ЯМР (300 МГц, ДMCO- d6), ε : 11,66 (ш. с, 1H), 9,17 (ш. с, 1H), 7,85 (с, 1H), 7,76 (м, 1H), 7,61 (с, 1H), 7,37 (м, 2H), 5,41 (ш. с, 1H), 3,6 (м, 2H), 2,2 (т, J = 7 Гц, 2H), 1,87 (м, 4H), 1,46 (м, 4H).
МС (FD), m/e: 377 (M+), 379 (M+2).
УФ (EtOH): 285 нм ( ε = 23385), 232 нм ( ε = 18756), 202 нм ( δ = 31779).
Найдено,%: C 57,04; H 5,32; N 11,09.
C18H20N3S2Cl
Вычислено,%: C 57,20; H 5,33; N 11,12.
Пример 298. 1-{2-[4-(3-Нитрофенил)тиазолил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (0,41 г, 2,3 ммоль) и 4-(3-нитрофенил)-2-тиазоламина (0,5 г, 2,3 ммоль) в ацетонитриле (25 мл) перемешивают 72 ч при комнатной температуре и нагревают 72 ч при 60oC. Фильтрованием образовавшегося осадка получают 0,51 г (68%) указанного соединения.
МС (FAB), m/e: 332 (M+-H).
Найдено,%: C 47,35; H 2,69; N 21,03.
C13H9N5O2S2
Вычислено,%: C 47,12; H 2,73; N 21,13.
Пример 299. N-[2-(1-Циклогексенил)этил]-N'-{2-[4-(3-нитрофенил)]}тиазолилтиомочевина.
Раствор 1-{ 2-[4-(3-нитрофенил)тиазолил] тиокарбамоил}имидазола (0,5 г, 1,5 ммоль) и 2-(1-циклогексенил)этиламина (0,19 г, 1,5 ммоль) в N, N-диметилформамиде перемешивают 0,75 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,37 г (63%) указанного соединения в виде желтого вещества, т.пл. 218 - 221oC.
ИК (KBr), см-1: 3165, 3017, 2922, 1569, 1513, 1465, 1352, 1265, 1216, 1065, 877, 788, 713, 676.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,76 (с, 1H), 8,85 (ш.с, 1H), 8,61 (с, 1H), 8,25 (д, J = 8,0 Гц, 1H), 8,11 (д, J = Гц, 1H), 7,77 (с, 1H), 7,67 (м, 1H), 5,42 (ш.с, 1H), 3,58 (м, 2H), 2,2 (т, J = 7 Гц, 2H), 1,89 (м, 4H), 1,46 (м, 4H).
МC (FD), m/e: 388 (M+).
УФ (EtOH): 286 нм ( ε = 22903), 265 нм ( ε = 23582), 237 нм ( ε = 17806), 202 нм ( δ = 24107).
Найдено, %: C 55,45; H 5,14; N 14,51.
C18H20N4O2S2.
Вычислено, %: C 55,65; H 5,19; N 14,42.
Пример 300. N-[2-(4-Хлорфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{[2-(4-циано)тиазолил]тиокарбамоил}имидазола (0,71 г, 3 ммоль) и 2-(4-хлорфенил)этиламина (0,48 г, 3 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,4 г (41%) указанного соединения в виде вещества цвета загара, т.пл. 188 - 190oC.
ИК (KBr), см-1: 3396, 3110, 2226, 1586, 1518, 1490, 1353, 1248, 1087, 808, 766, 649, 517.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,8 (с, 1H), 8,43 (ш.с, 1H), 8,12 (с, 1H), 7,33 (д, J = 8 Гц, 2H), 7,24 (д, J = 8 Гц, 2H), 3,69 (м, 2H), 2,84 (т, J = 7,0 Гц, 2H).
МС (FD), m/e: 322 (M+).
УФ (EtOH): 287 нм ( ε = 10775), 257 нм ( ε = 17025), 206 нм ( δ = 31350).
Пример 301. N-[2-(4-Метоксифенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{[2-(4-циано)тиазолил]тиокарбамоил}имидазола (0,9 г, 3,8 ммоль) и 2-(4-метоксифенил)этиламина (0,59 г, 3,8 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,66 г (55%) указанного соединения в виде желтого вещества, т.пл. 185 - 190oC.
ИК (KBr), см-1: 3208, 3064, 2236, 1547, 1514, 1259, 1201, 1164, 1033, 886, 775, 748, 680.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,8 (ш.с, 1H), 8,4 (ш.с, 1H), 8,1 (с, 1H), 7,13 (д, J = 8 Гц, 2H), 6,83 (д, J = 9 Гц, 2H), 3,68 (с, 3H), 3,64 (м, 2H), 2,77 (т, J = 7 Гц, 2H).
МС (FD), m/e: 318 (M+).
УФ (EtOH): 284 нм ( ε = 12158), 258 нм ( ε = 17248), 204 нм ( δ = 30994).
Пример 302. 1-[(2-(Бензимидазолил)тиокарбамоил]имидазол.
Раствор 1,1'-тиокарбамоилдиимидазола (8,91 г, 50 ммоль) и 2-аминобензимидазола (6,66 г, 50 ммоль) в ацетонитриле (50 мл) перемешивают 19 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 8,92 г (73%) указанного соединения.
ИК (KBr), см-1: 3058, 2621, 1623, 1580, 1509, 1469, 1445, 1355, 1290, 1252, 1212, 1153, 1099, 1081, 1048, 925, 898, 746, 659.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 13,24 (ш.с, 2H), 8,52 (с, 1H), 7,87 (с, 1H), 7,57 (м, 2H), 7,33 (м, 2H), 6,96 (с, 1H).
МС (FAB), m/e: 244 (M+1).
УФ (EtOH): 351 нм ( ε = 18204), 283 нм ( ε = 13099), 227 нм ( ε = 17339), 204 нм ( δ = 31915).
Пример 303. N-[2-(2-Хлорфенил)этил]-N'-(2-бензимидазолил)тиомочевина.
Раствор 1-[(2-бензимидазолил)тиокарбамоил]имидазола (1,22 г, 5 ммоль) и 2-(2-хлорфенил)этиламина (0,81 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,67 г (40%) указанного соединения в виде белого вещества, т.пл. 166 - 169oC.
ИК (KBr), см-1: 3235, 1656, 1554, 1459, 1248, 1224, 1192, 754, 737, 629.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,95 (ш.с, 1H), 1082 (ш.с, 1H), 7,42 (м, 5H), 7,25 (м, 2H), 7,12 (м, 2H), 3,83 (м, 2H), 3,05 (т, J = 7 Гц, 2H).
МС (FD), m/e: 330 (M+).
УФ (EtOH): 301 нм ( ε = 18044), 293 нм ( ε = 18559), 266 нм ( ε = 11113), 260 нм ( ε = 10441), 239 нм ( ε = 8428), 206 нм ( δ = 27620).
Пример 304. N-[2-(3-Хлорфенил)этил]-N'-(2-бензимидазолил)тиомочевина.
Раствор 1-[(2-бензимидазолил)тиокарбамоил]имидазола (1,22 г, 5 ммоль) и 2-(3-хлорфенил)этиламина (0,79 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,24 г (14%) указанного соединения в виде белого вещества, т.пл. 171 - 177oC.
ИК (KBr), см-1: 3387, 1574, 1539, 1461, 1426, 1237, 1175, 734, 699, 477.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,8 (м, 2H), 7,28 (м, 2H), 7,06 (м, 1H), 3,83 (м, 2H), 2,94 (т, J = 7 Гц, 2H).
МС (FD), m/e: 330 (M+).
УФ (EtOH): 293 нм ( ε = 17219), 266 нм ( ε = 9969), 260 нм ( ε = 8196), 203 нм ( δ = 27483).
Пример 305. N-[2-(4-Хлорфенил)этил]-N'-(2-бензимидазолил)тиомочевина.
Раствор 1-[(2-бензимидазолил)тиокарбамоил]имидазола (1,22 г, 5 ммоль) и 2-(4-хлорфенил)этиламина (0,79 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 1,31 г (79%) указанного соединения в виде белого вещества, т.пл. 173 - 182oC.
ИК (KBr), см-1: 3168, 3031, 1668, 1562, 1494, 1470, 1327, 1221, 1174, 1090, 817, 777, 742, 657, 526, 457.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 12,18 (ш.с, 1H), 10,36 (ш.с, 1H), 7,52 (м, 2H), 7,22 - 7,38 (м, 7H), 3,76 (м, 2H), 2,89 (т, J = 7 Гц, 2H).
МС (FD), m/e: 330 (M+), 332 (M+2).
УФ (EtOH): 301 нм ( ε = 21672), 293 нм ( ε = 22296), 266 нм ( ε = 13408), 260 нм ( ε = 12591), 206 нм ( δ = 29310).
Пример 306. N-[2-(2-Метоксифенил)этил]-N'-(2-бензимидазолил)тиомочевина.
Раствор 1-[(2-бензимидазолил)тиокарбамоил]имидазола (1,22 г, 5 ммоль) и 2-(2-метоксифенил)этиламина (0,82 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,62 г (38%) указанного соединения в виде белого вещества, т.пл. 176 - 184oC.
ИК (KBr), см-1: 3035, 1644, 1539, 1495, 1463, 1331, 1246, 1203, 1025, 750, 454.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,95 (ш.с, 1H), 10,32 (ш.с, 1H), 7,52 (м, 2H), 7,2 (м, 5H), 6,88 (м, 2H), 3,75 (с, 3H), 3,7 (м, 2H), 2,88 (т, J = 7 Гц, 2H).
МС (FD), m/e: 326 (M+).
УФ (EtOH): 301 нм ( ε = 20950), 293 нм ( ε = 21508), 265 нм ( ε = 14212), 239 нм ( ε = 9552), 204 нм ( δ = 30277).
Пример 307. N-[2-(3-Метоксифенил)этил]-N'-(2-бензимидазолил)тиомочевина.
Раствор 1-[(2-бензимидазолил)тиокарбамоил]имидазола (1,22 г, 5 ммоль) и 2-(3-метоксифенил)этиламина (0,78 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 1,2 г (73%) указанного соединения в виде белого вещества, т.пл. 161 - 167oC.
ИК (KBr), см-1: 2932, 1574, 1541, 1460, 1230, 1152, 1016, 737, 694, 577, 461.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,14 (ш.с. 1H), 10,95 (ш. с, 1H), 7,3 (м, 2H), 7,16 (м, 1H), 7,06 (м, 2H), 6,87 (м, 2H), 6,75 (м, 2H), 3,83 (м, 2H), 3,8 (с, 3H), 2,89 (т, J = 7 Гц, 2H).
МС (FD), m/e: 326 (M+).
УФ (EtOH): 301 нм ( ε = 23757), 293 нм ( ε = 24495), 265 нм ( ε = 16086), 260 нм ( ε = 14682), 239 нм ( ε = 11477), 204 нм ( δ = 36963).
Пример 308. N-[2-Метоксифенил)этил]-N1-(2-бензимидазолил)тиомочевина.
Раствор 1-[(2-бензимидазолил)тиокарбамоил]имидазола (1,22 г, 5 ммоль ) и 2-(4-метоксифенил)этиламина (0,77 г, 5 ммоль) в N, N- диметилформамиде (20 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 1,1 г (67%) указанного соединения в виде белого вещества, т.пл. 166-172oC.
ИК (KBr), см-1: 3416, 3195, 3065, 1575, 1543, 1511, 1464, 1243, 1176, 1037, 747, 442.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,11 (ш.с, 1H), 10,95 (ш.с, 1H), 7,36 (м, 2H), 7,2 (д, = J= 8 Гц, 2H), 7,08 (м, 3H), 6,82 (д, J 8 Гц, 2H), 3,78 (с, 3H), 3,67 (с, 3H), 2,85 (т, J = 7 Гц, 2H).
МС (FD) m/e: 326 (M+).
УФ (EtOH): 301 нм ( ε = 24618), 293 нм ( ε = 25247), 265 нм ( ε = 16716), 260 нм ( ε = 15557), 203 нм ( δ = 35060).
Пример 309. N-[2-(1-Циклогексенил)этил] -N'-(2-бензимидазолил)тиомочевина.
Раствор 1-[(2-бензимидазолил)тиокарбамоил]имидазола (1,22 г, 5 ммоль) и 2-(1-циклогексенил)этиламина (0,64 г, 5 ммоль) в N, N-диметилформамиде (20 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,82 г (55%) указанного соединения в виде желтых игл, т.пл. 178-180oC.
ИК (KBr), см-1: 3182, 2922, 1576, 1540, 1421, 1271, 1232, 1033, 740, 450.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,08 (ш.с, 1H), 11,07 (ш.с, 1H), 11,02 (ш. с, 1H), 7,36 (м, 2H), 7,06 (м, 2H), 5,51 (c, 1H), 3,66 (м, 2H), 2,21 (т, J= 7 Гц, 2H), 1,93 (м, 4H), 1,51 (м, 4H).
МС (FD), m/e: 300 (M+).
УФ (EtOH): 301 нм ( ε = 25279), 292 нм ( ε = 26214), 265 нм ( ε = 15965), 259 нм ( ε = 14734), 239 нм ( δ = 11012), 206 нм ( δ =30007).
Найдено, %: C 64,25; H 6,99; N 18,63.
C16H20N4S
Вычислено, %: C 63,97; H 6,71; N 18,65.
Пример 310. 1-[(2-Пиридил)тиокарбамоил]имидазол.
Раствор 1,1' - тиокарбонилдиимидазола (9,9 г, 50 ммоль) и 2-аминопиридина (4,75 г, 50 ммоль) в ацетонитриле (50 мл) перемешивают 72 ч при комнатной температуре. Полученный раствор испаряют до черного масла и ополаскивают гексаном. Выдерживанием маслянистого остатка в вакууме получают 13,6 г сырого указанного соединения в виде черного твердого вещества.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 8,89 (ш.с. 1H), 8,58 (м, 1H), 8,35 (м, 1H), 7,8 (м, 2H), 7,4 (м, 1H), 7,15 (м, 1H), 6,95 (м, 1H).
МС (FAB), m/e: 204 (M+, слабый).
Пример 311. N-[2-(2-Хлорфенил)этил]-N'-(2-пиридил)тиомочевина.
Раствор 1-[(2-пиридил)тиокарбамоил]имидазола (1,02 г, 5 ммоль) и 2-(2-хлорфенил)этиламина (0,81 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 24 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остаточного масла хроматографией на силикагеле получают 0,21 г (14%) указанного соединения в виде желтого вещества, т.пл. 116-122oC.
ИК (KBr), см-1: 3235, 1606, 1592, 1558, 1437, 1477, 1439, 1332, 1259, 1234, 1212, 1185, 1150, 1088, 1057, 861.
1Н-ЯМР (300 МГц ДMCO -d6), ε: 11,63 (м, 1H), 10,53 (с, 1H), 8,03 (м, 1H), 7,68 (м, 1H), 7,41 (м, 2H), 7,3 (м, 2H), 7,07 (м, 1H), 6,96 (м, 1H), 3,84 (м, 2H), 3,04 (т, J = 7 Гц, 2H).
МС (FD), m/e: 291 (M+).
УФ (EtOH): 293 нм ( ε = 14959), 266 нм ( ε =15723), 246 нм ( δ = 15174), 201 нм ( ε = 23340).
Пример 312. 2-(2,6-Дифторфенил)этиламин.
В 75 мл тетрагидрофурана при комнатной температуре растворяют 2,6 -дифторфенилацетонитрил (15,8 г, 100 ммоль), раствор охлаждают в бане со льдом и в течение 15 мин в атмосфере азота по каплям прибавляют комплекс боран•ТГФ. По окончании прибавления борана смесь перемешивают 23 ч при комнатной температуре и в атмосфере азота. В течение 30 мин при перемешивании по каплям прибавляют насыщенный водный раствор хлорида аммония (20 мл). Реакционную смесь фильтруют через диатомовую землю, концентрируют до масла, вновь растворяют в смеси этилацетат/вода и концентрированной соляной кислотой устанавливают pH 1. Смесь фильтруют через диатомовую землю и этилацетатный слой экстрагируют 1 н. соляной кислотой (4 х 10 мл). Объединенные водные кислотные экстракты промывают этилацетатом (2 х 50 мл). К кислотным водным экстрактам добавляют твердый хлорид натрия, добавлением твердого бикарбоната натрия и 5 н. раствора гидроокиси натрия устанавливают pH 9 и смесь экстрагируют хлористым метиленом (7 х 50 мл). Объединенные экстракты хлористого метилена промывают рассолом, сушат над безводным сульфатом натрия, фильтруют и после концентрирования получают 10,6 г (68%) указанного соединения в виде почти бесцветного масла.
ИК (KBr), см-1: 2967, 2876, 1626, 1590, 1469, 1265, 1236, 1213, 1157, 1128, 1085, 1051, 1016, 956, 843.
1H- ЯМР (300 МГц CDCl3), ε : 7,13 (м, 1H) 6,83 (м, 2H), 2,89 (м, 2H), 2,8 (т, J = 7 Гц, 2H), 1,19 (с, 2H).
МС (FD), m/e: 157 (M+, слабый).
УФ (EtOH): 265 нм ( ε = 650), 260 нм ( δ = 674), 204 нм ( ε = 7922).
Титрование (66% ДМФА - H2O): pKa 9,06.
Найдено,%: C 60,88; H 5,88; N 8,63.
C8H9F2N
Вычислено, % : C 61,14; H 5,77; N 8,91.
Пример 313. N-[2-(2,6-Дифторфенил)этил]-N'- [2-(4-этил)тиазолил]тиомочевина.
Раствор 2-(2,6-дифторфенил)этиламина (0,16 г, 1 ммоль) и 1-{[2-(4-этил)тиазолил] тиокарбамоил} имидазола (0,24 г, 1 ммоль) в N,N -диметилформамиде (15 мл) перемешивают 2 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,29 г (89%) указанного соединения в виде бледно-желтого вещества, т.пл. 157-158oC.
ИК (KBr), см-1: 178, 2972, 1584, 1502, 1469, 1340, 1351, 1293, 1267, 1212, 1075, 1014, 953, 787, 726, 672.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,54 (ш. с, 1H), 9,75 (ш. с, 1H), 7,29 (м, 1H), 7,01 (м, 2H), 6,58 (с, 1H), 3,77 (м, 2H), 2,92 (т, J= 7 Гц, 2H), 2,45 (к, J = 8 Гц, 2H), 1,05 (т, J = 8 Гц, 3H).
МС (FD), m/e: 327 (M+).
УФ (EtOH): 292 нм ( ε = 18786), 257 нм ( δ = 10109), 202 нм ( ε = 19042).
Найдено, %: C 51,60; H 4,78; N 13,08.
C14H15F2N3S2
Вычислено, % : C 51,36; H 4,62; N 12,83.
Пример 314. N-[2-(2,6-Дифторфенил)этил]-N'-(2-пиридил)тиомочевина.
Раствор 2-(2,6-дифторфенил)этиламина (0,43 г, 2,7 ммоль) и 1-[(2-пирилил)тиокарбамоил] имидазола (0,55 г, 2,7 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 27 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой образовавшегося масла хроматографией на силикагеле получают 0,08 г (10%) указанного соединения в виде бледно-желтого вещества, т.пл. 157-160oC.
ИК (KBr), см-1: 3226, 1605, 1539, 1466, 1332, 1260, 1236, 1188, 1100, 874, 899, 861, 774, 725, 635, 516.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,68 (ш.с, 1H), 10,53 (ш.с, 1H), 7,99 (м, 1H), 7,7 (м, 1H), 7,28 (м, 1H), 7,04 (м, 4H), 3,82 (м, 2H), 2,97 (т, J = 7 Гц, 2H).
МС (FD), m/e: 293 (M+).
УФ (EtOH): 292 нм ( ε = 15506), 266 нм ( δ = 16020), 245 нм ( ε = 14709).
Пример 315. 1-{[2-(2,6-Дифторфенил)этил]тиокарбамоил} имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (9,5 г, 48 ммоль) и 2-(2,6-дифторфенил)этиламина (7,54 г, 48 ммоль) в ацетонитриле (100 мл) перемешивают 20 ч при комнатной температуре. Раствор концентрируют при пониженном давлении, образовавшийся осадок отфильтровывают и его ополаскиванием гексаном получают 16 г сырого указанного соединения в виде коричневого твердого вещества.
ИК (KBr), см-1: 3129, 1565, 1468, 1355, 1259, 1203, 1120, 1065, 1031, 937, 900, 827, 787, 751, 664, 621, 499.
1 H-ЯМР (300 МГц, ДMCO-d6), ε : 10,5 (ш.с. 1H), 8,29 (с, 1H), 7,71 (с, 1H), 7,35 (м, 1H), 7,04 (м, 3H), 3,85 (м, 2H), 3 (м, 2H).
МС (FAB), m/e: 268 (M+-H).
УФ (EtOH): 280 нм ( ε = 4068), 250 нм ( δ = 4341), 201 нм ( ε = 15062).
Пример 316. N-[2-(1-Циклогексенил)этил]-N'-[2-(6-хлор)пиразинил]тиомочевина.
Раствор 2-амино-6-хлорпиразина (2,59 г, 20 ммоль) и 2-(1-циклогексенил)этилизотиоцианата (3,34 г, 20 ммоль) в N, N - диметилформамиде (25 мл) перемешивают 27 ч при 95oC. Реакционную смесь охлаждают по комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 0,44 г (7%) указанного соединения в виде белых игл, т.пл. 170-171oC.
ИК (KBr), см-1: 3207, 2926, 1584, 1514, 1414, 1295, 1161, 1005, 866, 714, 459.
1Н-ЯМР (300 МГц, ДMCO-d6), ε : 11,08 (ш.с, 1H), 10,02 (ш.с, 1H), 8,49 (с, 1H), 8,29 (с, 1H), 5,48 (ш.с, 1H), 3,64 (м, 2H), 2,21 (т, J=7 Гц, 2H), 1,9 (м, 4H), 1,49 (м, 4H).
МС (FD), m/e: 296 (M+), 298 (M+2).
УФ (EtOH): 327 нм ( δ = 12429), 266 нм ( ε = 17577).
Найдено,%: C 52,89; H 5,89; N 19,11.
C13H17N4SCl
Вычислено,%: C 52,60; H 5,77; N 18,87.
Пример 317. N-[2-(2.6-Дифторфенил)этил]-N'-[2-(6-метил)пиридил]тиомочевина.
Раствор 1-{ [2-(2,6-дифиорфенил)этил] тиокарбамоил}имидазола (0,53 г, 2 ммоль) и 2-амино-6-метилпиридина (0,22 г, 2 ммоль) в N, N - диметилформамида (20 мл) перемешивают 3 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,14 г (23%) указанного соединения в виде почти бесцветных призм, т.пл. 187-189oC.
ИК (KBr), см-1: 3195, 1612, 1544, 1468, 1451, 1380, 1293, 1269, 1230, 1192, 1160, 1072, 950, 788, 722, 635, 501.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,83 (ш.с, 1H), 10,44 (ш.с, 1H), 7,56 (т, J=8 Гц, 1H), 7,26 (м, 1H), 6,98 (м, 2H), 6,87 (д, J=8 Гц, 1H), 6,79 (д, J=8 Гц, 1H), 3,87 (м, 2H), 2,94 (т, J=7 Гц, 2 H), 2,11 (с, 3H).
МС (FD), m/e: 307 (M+).
УФ (EtOH): 296 нм ( ε = 12052), 265 нм ( δ = 10578), 246 нм ( ε = 10257).
Найдено,%: C 58,35; H 4,98; N 13,39.
C15H15F2N3S
Вычислено,%: C 58,62; H 4,92; N 13,67.
Пример 318. N-[2-(1-Циклогексенил)этил]-N'-[2-(3,5-диметил)пиразинил] тиомочевина.
Раствор 2-амино-3,5-диметилпиразина (0,62 г, 5 ммоль) и 2-(1-циклогексенил)этилизотиоцианата (0,84 г, 5 ммоль) в N, N - диметилформамиде (20 мл) перемешивают 24 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой образовавшегося масла хроматографией на силикагеле получают 0,27 г (19%) указанного соединения в виде снежно-белого вещества, т.пл. 100-103oC.
ИК (KBr), см-1: 3387, 2929, 1515, 1329, 1214, 1164, 1014, 966, 907.
1H-ЯМР (300 МГц, ДMCO-d6), ε :10,57 (ш. с, 1H), 9,12 (ш. с, 1H), 7,91 (с, 1H), 5,44 (ш. с, 1H), 3,61 (м, 2H), 2,47 (с, 3H), 2,35 (c, 3H), 2,18 (т, J=7,0 Гц, 2H), 1,9 (м,4H), 1,48 (м, 4H).
МС (FD), m/e: 290 (M+).
УФ (EtOH): 320 нм ( ε = 11659), 265 нм ( δ = 16153), 201 нм ( ε = 11795).
Найдено,%: C 62,06; H 7,65; N 18,58.
C15H22N4S
Вычислено,%: C 62,03; H 7,63; N 18,29.
Пример 319. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(5-трифторметил)пиридил] тиомочевина.
Раствор 1-{ [2-(2,6-дифторфенил)этил] тиокарбамоил}имидазола (1,07 г, 4 ммоль) и 2-амино-5-трифторметилпиридина (0,65 г, 4 ммоль) в N, N - диметилформамиде (20 мл) перемешивают 25 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 0,26 г (18%) указанного соединения в виде белого вещества, т.пл. 148 - 152oC.
ИК (KBr), см-1: 3165, 3033, 1619, 1600, 1548, 1470, 1332, 1248, 1189, 1160, 1138, 1106, 1079, 964, 886, 776, 669, 603, 435.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,42 (ш. с, 1H), 10,94 (ш. с, 1 H), 8,36 (с, 1H), 8,08 (м, 1H), 7,28 (м, 2H), 7,02 (м, 2H), 3,82 (м, 2H), 2,98 (т, J= 7 Гц, 2H).
МС (FD), m/e: 361 (M+).
УФ (EtOH): 297 нм ( ε = 18455), 253 нм ( δ = 14782), 201 нм ( ε = 15765).
Найдено,%: C 49,59; H 3,28; N 11,35.
C15H12F5N3S
Вычислено.%: C 49,86; H 3,35; N 11,63.
Пример 320. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина.
Раствор 1{ [2-(2,6-дифторфенил)этил] тиокарбамоил} имидазола (1,07 г, 4 ммоль) и 2-амино-5-хлорпиридина (0,53 г, 4 ммоль) в N, N - диметилформамиде (20 мл) перемешивают 22 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtОAc получают 0,65 г (50%) указанного соединения в виде вещества цвета загара, т.пл. 172-175oC.
ИК (KBr), см-1: 3233, 1597, 1557, 1529, 1468, 1340, 1308, 1265, 1231, 1190, 1112, 1072, 950, 857, 834.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,19 (м, 1H), 10,67 (с, 1H), 8,03 (c, 1H), 7,82 (м, 1H), 7,3 (м, 1H), 7,13 (м, 1H), 7,03 (м, 2H), 3,79 (м, 2H), 2,96 (т, J=7 Гц, 2H).
МС (FD), m/e: 327 (M+), 329 (M+2).
УФ (EtOH): 304 нм ( ε = 13180), 274 нм ( ε= 23154), 253 нм ( δ = 15998), 201 нм ( ε = 19019).
Пример 321. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(5-метил)пиридил]тиомочевина.
Раствор 1-{ [2-(2,6-дифторфенил)этил] тиокарбамоил}имидазола (1,33 г, 5 ммоль) и 2-амино-5-метилпиридина (0,54 г, 5 ммоль) в N, N - диметилформамиде (20 мл) перемешивают 7 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,83 г (86%) указанного соединения в виде желтых кристаллов, т.пл. 195-196oC.
ИК (KBr), см-1: 3230, 1611, 1535, 1492, 1468, 1334, 1274, 1236, 1190, 1111, 1065, 957, 821, 777, 716, 657, 608, 513.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 11,59 (ш. с, 1H), 10,44 (ш. с, 1H), 7,83 (ш. с, 1H), 7,53 (д, J=8 Гц, 1H), 7,3 (м, 1H), 7,02 (м, 3H), 3,8 (м, 2H), 2,96 (т, J=7 Гц, 2H), 2,16 (с, 3H).
МС (FD), m/e: 307 (M+).
УФ (EtOH): 297 нм ( ε = 5129), 268 нм (δ = 7508), 247 нм ( ε = 5383).
Найдено, %: C 58,36; H 4,98; N 13,73.
C15H15F2N3S
Вычислено,%: C 58,62; H 4,92; N 13,67.
Пример 322. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(5-бром)пиразинил]тиомочевина.
Раствор 1-{ [2-(2,6-дифторфенил)этил] тиокарбамоил}имидазола (1,33 г, 5 ммоль) и 2-амино-5-бромпиразина (0,87 г, 5 ммоль) в N, N - диметилформамиде перемешивают 26 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 0,31 г (17%) указанного соединения в виде белого вещества, т.пл. 175-178oC.
ИК (KBr), см-1: 3200, 1596, 1560, 1526, 1469, 1441, 1324, 1259, 1179, 1161, 1114, 1012, 962, 899, 874, 788, 780, 667, 601.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 10,98 (ш.с, 1H), 10,51 (ш.с, 1H), 8,33 (с, 1H), 8,24 (с, 1H), 7,31 (м, 1H), 7,04 (м, 2H), 3,81 (м, 2H), 3,97 (т, J = 7 Гц, 2H).
МС (FD), m/e: 372 (M+), 374 (M+2).
УФ (EtOH): 333 нм ( ε = 10125), 275 нм ( δ = 22570), 201 нм ( ε = 16801).
Найдено, %: C 42,10; H 3,12; N 14,73.
C13H11BrF2N4S
Вычислено, %: C 41,84; H 2,97; N 15,01.
Пример 323. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(6-этил)пиридил]тиомочевина.
Раствор 1-{ [2-(2,6-дифторфенил)этил] тиокарбамоил}имидазола (1,33 г, 5 ммоль) и 2-амино-6-этилпиридина (0,61 г, 5 ммоль) в N,N-диметилформамиде перемешивают 21 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка получают 0,63 г (39%) указанного соединения в виде густо-желтых кристаллов, т.пл. 147 - 148oC.
ИК (KBr), см-1: 2972, 1609, 1541, 1468, 1344, 1292, 1265, 1225, 1155, 1073, 951, 804, 786, 727, 692, 635, 501.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,97 (м, 1H), 10,48 (ш.с, 1H), 7,59 (т, J = 8 Гц, 1H), 7,27 (м, 1H), 6,98 (м, 2H), 6,89 (д, J = 8 Гц, 1H), 6,8 (д, J = 8 Гц, 1H), 3,87 (м, 2H), 2,95 (т, J = 7 Гц, 2H), 2,44 (к, J = 8,0 Гц, 2H), 0,93 (т, J = 8 Гц, 3H).
МС (FD), m/e: 321 (M+).
УФ (EtOH): 296 нм ( ε = 17512), 266 нм ( ε = 15047), 246 нм ( δ = 14627), 201 нм ( ε = 16211).
Найдено,%: C 60,04; H 5,38; N 12,22.
C16H17F2N3S
Вычислено,%: C 59,80; H 5,33; N 13,07.
Пример 324. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(6-хлор)пиразинил]тиомочевина.
Раствор 1-{[2-(2,6-дифторфенил)этил]тиокарбамоил}имидазола (4 г, 15 ммоль) и 2-амино-6-хлорпиразина (1,96 г, 15 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 18 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 0,7 г (14%) указанного соединения в виде светло-желтого вещества, т. пл. 175 - 180oC.
ИК (KBr), см-1: 3232, 1588, 1512, 1468, 1414, 1296, 1240, 1163, 1097, 1004, 981, 869, 777, 714, 659, 459.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,07 (ш.с, 1H), 10,07 (ш.с, 1H), 8,5 (с, 1H), 8,28 (с, 1H), 7,28 (м, 1H), 7 (м, 2H), 3,85 (м, 2H), 2,95 (т, J = 7 Гц, 2H).
MС (FD) m/e: 328 (M+), 330 (M+2).
УФ (EtOH): 327 нм ( ε = 10851), 265 нм ( δ = 14817), 201 нм ( ε = 16442).
Пример 325. N-[2-(2-Пиридил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина.
Раствор 1-{ [2-(4-циано)тиазолил] тиокарбамоил} имидазола (2,35 г, 10 ммоль) и 2-(2-пиридил)этиламина (1,29 г, 10 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 2 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой остатка хроматографией на силикагеле получают 0,4 г (14%) указанного соединения в виде желтого вещества, т.пл. 160oC.
ИК (KBr), см-1: 3165, 3100, 2996, 2234, 1540, 1489, 1433, 1305, 1266, 1219, 1159, 1132, 999, 904, 817, 758, 574, 435.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,88 (ш.с, 1H), 8,67 (ш.с, 1H), 8,49 (д, J = 4 Гц, 1H), 8,11 (с, 1H), 7,69 (м, 1H), 7,23 (м, 2H), 3,87 (м, 2H), 3,01 (т, J = 7 Гц, 2H).
MС (FD), m/e: 289 (M+).
УФ (EtOAc): 288 нм ( ε = 10826), 257 нм ( δ = 19925), 205 нм ( ε = 28658).
Пример 326. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(4-метил)пиридил]тиомочевина.
Раствор 1-{ [2-(2,6-дифторфенил)этил] тиокарбамоил}имидазола (1,33 г, 5 ммоль) и 2-амино-4-метилпиридина (0,54 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 3 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,49 г (32%) указанного соединения в виде желтых игл, т. пл. 168 - 170oC.
ИК (KBr), см-1: 3233, 1616, 1536, 1465, 1335, 1262, 1181, 1104, 959, 815, 783, 719, 653, 442.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,74 (ш.с, 1H), 10,44 (ш.с, 1H), 7,85 (д, J = 5 Гц, 1H), 7,27 (м, 1H), 7,02 (м, 2H), 6,88 (с, 1H), 6,8 (д, J = 5 Гц, 1H), 3,8 (м, 2H), 2,96 (т, J = 7 Гц, 2H), 2,2 (с, 3H).
МС (FD), m/e: 307 (M+).
УФ (EtOH): 290 нм ( ε = 16210), 266 нм ( ε = 15920), 246 нм ( δ = 13211), 202 нм ( ε = 13211).
Пример 327. N-[2-(2,6-Дифторфенил)-этил]-N'-[2-(4-этил)пиридил]тиомочевина.
Раствор 1-{ [2-(2,6-дифторфенил)этил] тиокарбамоил}имидазола (1,33 г, 5 ммоль) и 2-амино-4-этилпиридина (0,61 г, 5 ммоль) в N,N-диметилформамиде перемешивают 3 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией твердого остатка из EtOAc получают 0,32 г (20%) указанного соединения в виде светло-коричневого вещества, т.пл. 140 - 142oC.
ИК (KBr), см-1: 2939, 1616, 1590, 1536, 1469, 1341, 1267, 1189, 1104, 1064, 960, 868, 826, 781, 759, 721, 668, 652.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,74 (ш.с, 1H), 10,42 (ш.с, 1H), 7,87 (д, J = 5 Гц, 1H), 7,29 (м, 1H), 6,99 (м, 2H), 6,85 (с, 1H), 6,84 (д, J = 5 Гц, 1H), 3,81 (м, 2H), 2,95 (т, J = 7 Гц, 2H), 2,49 (к, J = 8 Гц, 2H), 1,09 (т, J = 8 Гц, 3H).
МС (FD), m/e: 321 (M+).
УФ (EtOH): 290 нм ( ε = 18247), 266 нм ( ε = 18045), 246 нм ( δ = 15212), 202 нм ( ε = 27817).
Найдено,%: C 59,50; H 5,31; N 12,87.
C16H17F2N3S
Вычислено,%: C 59,79; H 5,33; N 13,07.
Пример 328. 1-{[2-(2-пиридил)этил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (9,9 г, 50 ммоль) и 2-(2-пиридил)этиламина (6,43 г, 50 ммоль) в ацетонитриле (120 мл) перемешивают 24 ч при комнатной температуре. Раствор концентрируют при пониженном давлении и полученное коричневое масло ополаскивают этиловым эфиром. Выдерживанием остаточного масла в вакууме получают 10,7 г сырого указанного соединения в виде черного твердого вещества.
ИК (KBr), см-1: 3125, 2930, 2098, 1548, 1477, 1437, 1363, 1329, 1284, 1221, 1098, 1063, 1030, 925, 828, 750, 661, 620.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,35 (ш. с, 1H), 8,48 (м, 1H), 8,33 (с, 1H), 7,76 (с, 1H), 7,72 (м, 2H), 7,25 (м, 2H), 3,95 (м, 2H), 3,1 (м, 2H).
МС (FAB), m/e: 233 (M+-H).
УФ (EtOH): 267 нм ( ε = 5516), 261 нм ( ε = 6306), 256 нм ( δ = 6220), 203 нм ( ε = 14929).
Пример 329. N-[2-(2-Пиридил)этил]-N'-[2-(5-бром)пиразинил]тиомочевина.
Раствор 1-{[2-(2-пиридил)этил]тиокарбамоил}имидазола (1,16 г, 5 ммоль) и 2-амино-5-бромпиразина (0,87 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 27 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой состава хроматографией на силикагеле и кристаллизацией из EtOAc получают 0,13 г (7%) указанного соединения в виде твердого вещества цвета загара, т.пл. 185 - 190oC.
ИК (KBr), см-1: 3186, 1588, 1558, 1517, 1479, 1439, 1356, 1325, 1289, 1268, 1220, 1185, 1156, 1100, 1083, 1013, 996, 900, 876, 800, 760, 716, 569, 511, 431.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 10,93 (ш.с, 1H), 10,74 (ш.с, 1H), 8,54 (д, J = 5 Гц, 1H), 8,31 (с, 1H), 8,28 (с, 1H), 7,69 (м, 1H), 7,28 (м, 1H), 7,21 (м, 1H), 3,96 (м, 2H), 3,05 (т, J = 7 Гц, 2H).
MС (FD), m/e: 337 (M+), 339 нм (M+2).
УФ (EtOН): 333 нм ( δ = 10984), 270 нм ( ε = 25064).
Найдено, %: C 42,41; H 3,83; N 20,54.
C12H12BrN5S
Вычислено, %: C 42,61; H 3,58; N 20,71.
Пример 330. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(5-хлор)пиразинил]тиомочевина.
Раствор 1-{ [2-(2,6-дифторфенил)этил] тиокарбамоил}имидазола (1,33 г, 5 ммоль) и 2-амино-5-хлорпиразина (0,65 г, 5 ммоль) в N, N-диметилфорамиде (20 мл) перемешивают 24 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и очисткой твердого остатка хроматографией на силикагеле и кристаллизацией из EtOAc получают 0,1 г (6%) указанного соединения в виде белого вещества, т. пл. 170-171oC.
ИК (KBr), см-1: 3199, 3070, 1593, 1563, 1529, 1468, 1443, 1418, 1327, 1263, 1184, 1166, 1128, 1016, 779.
1H-ЯМР (300 МГц, ДMCO - d6), ε :11 (ш.с, 1H), 10,53 (ш. с, 1H), 8,33 (с, 1H), 8,19 (с, 1H), 7,3 (м, 1H), 7,04 (м, 2H), 3,81 (м, 2H), 2,96 (т, J=7 Гц, 2H).
МС (FD), m/e: 328 (M+), 330 (M+2).
УФ (EtOH): 332 нм ( δ = 10097), 274 нм ( ε = 22879).
Найдено,%: C 47,54; H 3,45; N 17,19.
C13H11ClF2N4
Вычислено,%: C 47,49; H 3,37; N 17,04.
Пример 331. 1-{[2-(5-Этоксикарбонил)тиазолил]тиокарбонил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (8,9 г, 50 ммоль) и 2-амино-5-этоксикарбонилтиазола (8,9 г, 50 ммоль) в ацетонитриле (600 мл) перемешивают 20 ч при 50oC. Фильтрованием образовавшегося осадка получают 6,5 г (40%) указанного соединения, т.пл. 208-210oC.
ИК (KBr), см-1: 3205, 3176, 3146, 3115, 1708, 1557, 1470, 1352, 1298, 1244, 1225.
1H-ЯМР (300 МГц, ДМCO - d6), ε : 13,2 (ш.с, 1H), 8,1 (с, 1H), 7,9 (с, 1H), 7,6 (с, 1H), 7,1 (с, 1H), 4,2 (к, 2H), 1,3 (т, 3H).
МС (FD), m/e: отсутствие правильного пика (M+).
УФ (EtOH): 349 нм ( ε = 4746), 269 нм ( δ = 8713), 209 нм ( ε = 21033).
Найдено,%: C 42,37; H 3,55; N 19,59.
C10H10N4O2S2
Вычислено,%: C 42,54; H 3,57; N 19,84.
Пример 332. N-[2-(1-Циклогексенил)этил]-N'-[2-(5-этоксикарбонил) тиазолил]тиомочевина.
Раствор 1-{[2-(5-этоксикарбонил)тиазолил]тиокарбамоил}имидазола (1,12 г, 4 ммоль) и 2-(1-циклогексил)этиламина (0,5 г, 4 ммоль) N,N-диметилформамиде (40 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и перекристаллизацией остатка из этилацетата получают 0,79 г (56%) указанного соединения, т.пл. 197-198oC.
ИК (KBr), см-1: 3243, 3121, 3044, 2991, 2925, 1707, 1582, 1543, 1458, 1190.
1H-ЯМР (300 МГц, ДMCO- d6), ε : 12 (ш. с, 1H), 8,5 (ш. с, 1H), 7,9 (с, 1H), 5,5 (с, 1H), 4,3 (к, 2H), 3,6 (м, 2H), 2,2 (т, J = 7 Гц, 2H), 1,9 (м, 4H), 1,5 (м, 4H), 1,3 (т, J = 7 Гц, 3H).
МС (FD), m/e: 339 (M+).
УФ (EtOH): 262 нм ( δ = 17510), 205 нм ( ε = 19237).
Найдено,%: C 53,31; H 6,44; N 12,42.
C15H21N3O2S2
Вычислено,%: C 53,07; H 6,23; N 12,38.
Пример 333. N-(2-Фенэтил)-N'-[2-(5-этоксикарбонил)тиазолил]тиомочевина.
Раствор 1-{[2-(5-этоксикарбонил))тиазолил]тиокарбамоил}имидазола (1,1 г, 4 ммоль) и 2-(1-фенил)этиламина (0,6 г, 4 ммоль) в N,N-диметилформамиде (40 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, 1 н. водной HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органический слой концентрируют и кристаллизацией остатка из этилацетата получают 1,07 г (80%) указанного соединения, т пл. 174-175oC.
ИК (KBr), см-1: 3340, 3253, 3124, 3056, 1707, 1682, 1579, 1537, 1454, 1252, 1222.
1H-ЯМР (300 МГц, ДMCO - d6), ε : 12 (ш. с, 1H), 8,7 (ш.с, 1Н), 7,9 (с, 1H), 7,3 (м, 5H), 4,3 (к, 2H), 3,8 (м, 2H), 2,9 (т, J = 7 Гц, 2H), 1,3 (т, J = 7 Гц, 3H).
МС (FD), m/e: 335 (M+).
УФ (EtOH), 262 нм ( δ = 19184), 206 нм ( ε 26117).
Найдено,%: C 53,48; H 5,10; N 12,68.
C15H17N3O2S2
Вычислено,%: C 53,71; H 5,11; N 12,53.
Пример 334. N-[2-(1-Циклогексенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина.
Раствор 2-амино-5-хлорпиридина (1,28 г, 20 ммоль) и 2-(1-циклогексенил)этилизотиоцианата (1,67 г, 10 ммоль) в N, N-диметилформамида (30 мл) перемешивают 1 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры, концентрируют под вакуумом с удалением растворителя и очисткой остатка с помощью ВЭЖХ получают 0,56 г (19%) указанного соединения, т.пл. 166-167oC.
ИК (KBr), см-1: 3455, 3159, 1599, 1555, 1534, 1476.
1H-ЯМР (300 МГц, ДMCO - d6), ε : 11,1 (ш.с, 1H), 10,7 (с, 1H), 8,2 (д, 1H), 7,9 (м, 1H), 7,2 (д, 1H), 5,5 (с, 1H), 3,6 (м, 2H), 2,2 (т, J=7 Гц, 2H), 1,9 (м, 4H), 1,5 (м, 4H).
МС (FD), m/e: 295 (M+).
УФ (EtOH): 305 нм ( ε = 12139), 273 нм ( δ = 15905), 244 нм ( ε = 25052).
Найдено,%: C 56,59; H 6,00; N 14,09.
C14H18N3SCl
Вычислено,%: C 56,84; H 6,13; N 14,20.
Пример 335. N-[2-(2- Хлорфенил)этил]-N1-[2-(5-хлор)пиридил]тиомочевина.
Раствор N-[2-(2-хлорфенил)этил] -N'-тиокарбамоилимидазола (1,3 г, 5 ммоль) и 2-амино-5-хлорпиридина (0,65 г, 5 ммоль) в N,N-диметилформамиде (25 мл) перемешивают 1 ч при 100oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, рассолом. Органический слой концентрируют и ополаксиванием остатка гексаном получают 0,83 г (55%) указанного соединения, т.пл. 178-179oC.
1H-ЯМР (300 МГц, ДMCO - d6), ε : 11,2 (м, 1H), 10,7 (с, 1H), 8,1 (м, 1H), 7,5 (м, 1H) 7,4 (м, 2H), 7,2 (м, 2H), 7,1 (д, 1H), 3,8 (м, 2H), 3,1 (т, J = 7 Гц, 2H).
МС (FD), m/e: 325 (M+).
УФ (EtOH): 35 нм ( ε = 12931), 273 нм ( ε = 22583), 253 нм ( δ = 16558), 201 нм ( ε = 25277).
Найдено,%: C 51,26; H 3,99; N 12,79.
C14H13N3SCl
Вычислено,%: C 51,54; H 4,02; N 12,88.
Пример 336. N-[2-(1-Циклогексенил)этил]-N'-[3-(6-хлор)пиридазинил]тиомочевина.
Раствор 3-амино-6-хлорпиридазина (1,3 г, 10 ммоль) и 2-(1-циклогексанил)этилизотиоцианата (1,67 г, 10 ммоль) в N, N-диметилформамиде (20 мл) перемешивают 1,5 ч при 90oC. Реакционную смесь охлаждают до комнатной температуры и концентрируют под вакуумом с удалением растворителя. Остаток очищают с помощью ВЭЖХ и получают 0,22 г (7,5%) указанного соединения, т.пл. 149-153oC.
pKa (66% ДМФА): 12,8.
ИК (KBr), см-1: 3203, 3072, 2935, 1599, 1565, 1520, 1424, 1351, 1308, 1280, 1184, 1147, 1073.
1H-ЯМР (300 МГц, ДMCO-d6), δ : 11,1 (м, 1H), 10,9 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 5,5 (с, 1H), 3,7 (м, 2H), 2,2 (т, J = 7 Гц, 2H), 1,9 (м, 4H), 1,5 (м, 4H).
МС (FD), m/e: 296 (M+).
УФ (EtOH): 275 нм ( ε = 23066).
Найдено,%: C 52,85; H 5,84; N 19,15.
C13H17N4SCl
Вычислено,%: C 52,60; H 5,77; N 18,87.
Пример 337. N-[2-(2,6-Дифторфенил)этил]-N'-[3-(6-хлор)пиридазинил]тиомочевина.
Раствор N-[2-(2,6-дифторфенил)этил] -N'-тиокарбамоилимиазола (1,33 г, 5 ммоль) и 3-амино-6-хлорпиридазина (0,65 г, 5 ммоль) в N, N-диметилформамида (20 мл) перемешивают 19 ч при 80oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой и рассолом. Органический слой концентрируют и остаток очищают с помощью ВЭЖХ с получением 0,12 г (7,5%) указанного соединения, т. пл. 187-189oC.
ИК (KBr), см-1: 3199, 3055, 1626, 1593, 1555, 1522, 1469, 1425, 1348, 1313, 1263.
1H-ЯМР (300 МГц, ДМСО- d6), ε : 11,2 (м, 1H), 10,9 (с, 1H), 7,9 (д, 1H), 7,6 (д, 1H), 7,3 (м, 1H), 7,1 (м, 2H), 3,9 (м, 2H), 3 (т, J = 7 Гц, 2H).
МС (FD), m/e: 328 (M+).
pKa (66% ДМФА): 12,73.
УФ (EtOH): 277 нм ( ε = 20141), 252 нм ( δ = 12935), 201 нм ( ε = 17891).
Пример 338. N-[2-(2,6-Дифторфенил)этил]- N'-[3-(6-метокси)пиридазинил] тиомочевина.
Раствор N-[2-(2,6-дифторфенил)этил] -N'-тиокарбамоилимидазола (0,8 г, 3 ммоль) и 3-амино-6-метоксипиридазина (0,4 г, 3 ммоль) в N, N-диметилформамиде (20 мл) перемешивают 19 ч при 70oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой и рассолом. Органический слой концентрируют и осаждением остатка из диэтилового эфира получают 0,235 г (24%) указанного соединения, т.пл. 193-196oC.
ИК (KBr), см-1: 3222, 3084, 1628, 1586, 1560, 1531, 1468, 1423, 1356, 1310, 1266.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,45 (м, 1H), 10,7 (с, 1H), 7,42 (д, J = 10 Гц, 1H), 7,28 (м, 1H), 7,21 (д, J = 10 Гц, 1H), 7 (т, J = 8 Гц, 2H), 3,9 (с, 3H), 3,85 (м, 2H), 3 (т, J = 7Гц, 2H).
МС (FD), m/e : 324 (M+).
УФ (EtOH) : 269 нм ( ε = 18845), 235 нм ( δ = 10636), 201 нм ( ε = 16622).
Пример 339. N-[2-(2-Пиридил)этил]-N'-[3-(6-(хлор)пиридазинил]тиомочевина.
Раствор 1,1'-тиокарбонилдиимидазола (1,83 г, 10 ммоль) и 3-амино-6-хлорпиридазина (1,3 г, 10 ммоль) в ацетонитриле (100 мл) перемешивают 288 ч при комнатной температуре. К полученному раствору добавляют 2-(2-аминоэтил)пиридин (1,22 г, 10 ммоль) и полученную смесь перемешивают 48 ч при комнатной температуре. Растворитель удаляют в вакууме и очисткой остатка с помощью ВЭЖХ получают 0,3 г (10%) указанного соединения, т. пл. 197-199oC.
ИК (KBr), см-1 : 3172, 3045, 1583, 1562, 1511, 1478, 1428, 1345, 1313, 1280.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,3 (м, 1H), 10,9 (с, 1H), 8,6 (д, J = 5 Гц, 1 H), 7,8 (д, J = 10 Гц, 1H), 7,7 (м, 1H), 7,55 (д, J = 10 Гц, 1H), 7,3 (д, J = 8 Гц, 1H), 7,2 (м, 1H), 4 (м, 2H), 3,1 (т, J = 7 Гц, 2H).
МС (FD), m/e: 293 (M+).
рКа (66% ДМФА): 4,17; 12,32.
УФ (EtOH) : 275 нм ( ε = 21715), 270 нм ( δ = 21836), 221 нм ( ε = 9867).
Найдено, %: C 48,91; H 4,14; N 23,76.
C12H12N5SCl2
Вычислено, %: C 49,06; H 4,12; N 23,84.
Пример 340. N-[2-(2,6-Дифторфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина.
Перемешиваемый раствор N-(тиоимидазоил)-2-(2,6- дифторфенил)этиламина (2,67 г, 10 моль) и 2-амино-5-бромпиридина (1,73 г, 10 ммоль) в 1-метил-2-пирролидиноне (20 мл) нагревают при 90oC. Через 16,5 ч реакционную смесь охлаждают до комнатной температуры и переносят в этилацетат. Органическую фазу промывают водой (2x), 1 н. HCl, водой и рассолом. Органический слой сушат над Na2SO4, фильтруют и концентрируют. Полученный твердый продукт очищают перекристаллизацией из смеси EtOAc/гексан (1:1) с получением 1,6 г (43%) указанного соединения. Повторной перекристаллизацией из 70% EtOAc в гексане получают 1,16 г заглавного соединения в виде светло-коричневых кристаллов, т. пл. 174-175oC.
ИК (KBr), см-1 : 3229, 1593, 1558, 1529, 1468, 1265, 1188, 1071, 832.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,2 (с, 1H), 10,68 (c, 1H), 8,11 (с, 1H), 7,95-7,91 (м, 1H), 7,33-7,28 (м, 1H), 7,09-7,01 (м, 3H), 3,83-3,77 (м, 1H), 2,98-2,94 (м, 2H).
МС (FD), m/e : 371 (М+), 373 (М+2).
УФ (EtOH) : 306 нм ( ε = 12790), 275 нм ( ε = 22096), 257 нм ( δ = 14120), 201 нм ( ε = 17270).
Найдено, %: C 44,96; H 3,29; N 11,21.
C14H12BrF2N3S
Вычислено, %: C 45,17; H 3,25; N 11,29.
Пример 341. 2-Цианометил-3-этоксипиридин.
К раствору 2-этокси-3-гидроксиметилпиридина (3 г, 19,6 ммоль) в CH2Cl2 (20 мл) при 0oC и перемешивании по каплям прибавляют раствор тионилхлорида (3,26 г, 27,4 ммоль, 2 мл) в CH2Cl2. Баню со льдом снимают и реакционную смесь перемешивают 2 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме и вновь растворяют в MeOH (30 мл). В 10 мл воды растворяют цианид калия (3,82 г, 58,7 ммоль) и одной порцией добавляют к реакционной смеси. Смесь нагревают до кипения и перемешивают 66 ч, после чего нейтрализуют насыщенным раствором Na2CO3. Реакционную смесь разбавляют водой и экстрагируют Et2O (3x). Объединенные органические экстракты промывают рассолом, сушат над Na2SO4, фильтруют и после концентрирования получают 2,84 г (89%) указанного соединения в виде коричневатого масла. Дополнительной очисткой небольшого образца вытеснительной хроматографией (40% EtOAc в гексане) получают прозрачное бесцветное масло.
ИК (KBr), см-1 : 3020, 2988, 2936, 1579, 1450, 1397, 1282, 1122, 1041.
1H-ЯМР (300 МГц, CDCl3), ε : 8,17-8,15 (м, 1H), 7,25-7,15 (м, 2H), 4,09 (к, J = 7 Гц, 2H), 3,9 (с, 2H), 1,47 (т, J = 7,0 Гц, 3H).
МС (FD), m/e : 162 (M+).
УФ (EtOH) : 278 нм ( δ = 5241), 220 нм ( ε = 7490). Ав АТ 5 т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ 7 2 т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ q т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ & m т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ f к т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ U т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ Д т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ H т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ Ю ц т@ т@ т@ т@ т@ т@ т@ т@ т@ т@ х +
Пример 342. N-[2-(3-Этоксипиридил)этил]-N'-[2-(5-бром)пиридил]тиомочевина.
Раствор 2-цианометил-3-этоксипиридина (22,03 г, 136 ммоль) в EtOH (475 мл) и 5 н. HCl (3 мл) обрабатывают PtO2 (4,5 г) в качестве катализатора под давлением H2 в 60 psi (4,2 кг/см2). Реакционную смесь перемешивают примерно сутки при комнатной температуре и затем фильтруют. Сырую реакционную смесь концентрируют и вновь растворяют в воде и EtOAc. Водный слой подщелачивают 5 н. NaOH и экстрагируют EtOAc. Органический слой промывают рассолом, сушат над Na2SO4, фильтруют и после концентрирования получают 16,89 г желтого масла. Полученный сырой продукт растворяют в 1-метил-2-пирролидиноне (175 мл) и к раствору добавляют N-(тиоимидазоил)-2-амино-5-бромпиридин (36 г, 127 ммоль). Реакционную смесь нагревают до 100oC и перемешивают 68 ч. Сырую реакционную смесь охлаждают до комнатной температуры и переносят в EtOAc. Органический слой промывают водой (4x) и рассолом, сушат над Na2SO4, фильтруют и концентрируют. Полученный твердый остаток вновь растворяют в EtOAc и экстрагируют 1 н. HCl (3x). Кислотные экстракты перемешивают с CH2CH2, подщелачивают 5 н. NaOH и экстрагируют CH2Cl2 (2x). Экстракты в CH2CH2 объединяют, промывают рассолом, сушат над MgSO4, фильтруют и концентрируют. Сырой продукт очищают вытеснительной хроматографией (10% EtOAc в CH2Cl2) с последующим ополаскиванием смесью EtOAc/гексан (1:1) и получением 3,76 г (7%) указанного соединения в виде белых кристаллов, т. пл. 170-172oC.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,39 (с, 1H), 10,59 (с, 1H), 8,13-8,11 (м, 2H), 7,92-7,87 (м, 1H), 7,3 (д, J = 8,1 Гц, 1H), 7,22-7,18 (м, 1H), 7,05 (д, J = 8,9 Гц, 1H), 4,05-3,95 (м, 4H), 3 (т, J = 6,3 Гц, 2H), 1,29 (т, J = 6,9 Гц, 3H).
МС (FD), m/e : 380 (M+), 382 (M+2).
УФ (EtOH) : 305 нм ( δ = 16291), 276 нм (ε = 36829).
Пример 343. N-[2-(3-Этоксипиридил)этил]-N'-[2-(5-бром)пиридил]тиомочевина, гидрохлорид.
В насыщенном HCl метаноле (100 мл) при перемешивании растворяют N-[2-(3-этоксипиридил)этил] -N'-[2-(5-бром)пиридил] тиомочевину (5,17 г, 13,5 ммоль). После полного растворения начинает образовываться осадок. Раствор при перемешивании выливают в Et2O (400 мл) и образовавшееся белое вещество отфильтровывают. Промыванием сырого продукта смесью MeOH-EtOAc получают 5,47 г (97%) указанного соединения в виде белого вещества, т. пл. 203-205oC (разложение).
ИК (KBr, см-1) : 3226, 3007, 2306, 1596, 1565, 1530, 1472, 1290, 1197, 1172.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,24-11,2 (м, 1H), 10,65 (с, 1H), 8,29 (д, J = 5,3 Гц, 1H), 8,17 (д, J = 2,3 Гц, 1H), 7,96-7,88 (м, 2H), 7,73-7,68 (м, 2H), 7,08 (д, J = 8,9 Гц, 1H), 4,1-4,03 (м, 4H), 3,24 (т, J = 6 Гц, 2H), 1,27 (т, J = 6,9 Гц, 3H).
МС (FD), m/e : 380 (M+), 382 (M+2).
УФ (EtOH) : 304 нм ( δ = 13635), 276 нм ( ε = 28876).
Найдено, %: C 42,90; H 4,36; N 13,11.
C15H18BrClN4OS
Вычислено, %: C 43,13; H 4,34; N 13,41.
Пример 344. 1-[(2-Амино-5-бромпиридил)тиокарбомоил]имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (17,8 г, 0,1 моль) и 2-амино-5-бромпиридина (17,3 г, 0,1 моль) в ацетонитриле (150 мл) перемешивают при комнатной температуре 2 ч. К полученной суспензии добавляют нижеописанный продукт.
Пример 345. N-[2-(2-Пиридил)этил] -N'-[(2-амино-5-бром)пиридил) тиомочевина.
К раствору 1-[(2-амино-5-бромпиридил)тиокарбомоил] имидазола из вышеприведенного примера добавляют 2-(2-аминоэтил)пиридин (14,7 г, 0,12 моль) и перемешивают 2 ч при комнатной температуре и 12 ч при 50oC. Реакционную смесь охлаждают до комнатной температуры, фильтруют и промывают ацетонитрилом. Полученное твердое вещество растворяют в метаноле, фильтруют и через раствор при охлаждении пробулькивают газообразный хлористый водород. Растворители удаляют при пониженном давлении и перекристаллизацией остатка из смеси метанола с этиловым эфиром получают 24,8 г (76%) указанного соединения в виде белого вещества, т. пл. 215-216oC.
ИК (KBr), см-1 : 3015, 2576, 1634, множественные пики в интервале 1633-400.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,3 (с, 1H), 10,75 (с, 1H), 10,78 (с, 1H), 8,8 (д, 1H), 8,4 (т, 1H), 8,22 (с, 1H), 7,97-8 (к, 1H), 7,82-7,9 (д, 1H), 7,8 (т, 1H), 7,1 (д, 1H), 4,1 (к, 1H), 3,35 (т, 2H).
МС (FD), m/e : 338 (M+).
УФ (EtOH) : 305 нм (ε = 13565), 274 нм ( δ = 24201), 201 нм ( ε = 17628).
Найдено, %: C 42,02; H 3,86; N 15,16.
C13H14N4BrClS
Вычислено, %: C 41,78; H 3,78; N 14,99.
Пример 346. N-{ 2-[(3-Метокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина, гидрохлорид.
A. Получение 2-гидроксиметил-3-метоксипиридина.
В атмосфере азота размельчают гидроокись калия (41,66 г, 0,744 моль) и перемешивают 20 мин с ДМСО (130 мл, безводный). Затем добавляют гидрохлорид 3-гидрокси-2-гидроксиметилпиридина (Олдрич) (47 г, 0,248 моль) и перемешивают 30 мин в бане со льдом. К раствору по каплям прибавляют метилйодид (35,2 г, 0,248 моль, 15,43 мл) в ДMCO (20 мл) и перемешивают примерно сутки при комнатной температуре. Добавляют 5 н. HCl до pH 1 и раствор экстрагируют дихлорметаном (5х500 мл). Водную фазу подщелачивают 5 н. NaOH до pH 14 и экстрагируют дихлорметаном (3х500 мл). Органическую фазу (от промывки щелочью) сушат над сульфатом натрия и после концентрирования получают кристаллы цвета загара, перекристаллизацией которых (50% этилацетата в гексане) получают 10,8 г (32%) указанного соединения в виде кристаллов цвета легкого загара, т.пл. 72oC.
ИК (KBr), см-1: 3080, 1575, 1459, 1424, 1278, 1218, 1066, 809.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 8,5 (д, J=4,5 Гц, 1H), 7,3 (д, J=8,3 Гц, 1H), 7,25 (дв.д, J=8,2 и 4,6 Гц, 1H), 4,77 (т, J=5,74 Гц, 1H), 4,48 (д, J= 5,6 Гц, 2H), 3,77 (с, 3H).
МС (FD), m/e: 139 (M+).
УФ (EtOH): 278 нм ( δ = 4909), 220 нм ( ε = 6984).
Найдено, %: C 60,32; H 6,54; N 10,23.
C7H9NO2
Вычислено, %: C 60,42; H 6,52; N 10,07.
B. Получение 2-[(3-метокси)пиридил]ацетонитрила.
К охлаждаемому в бане со льдом 2-гидрокси-3-метоксипиридину (13,9 г, 0,1 моль) при перемешивании добавляют тионилхлорид (100 мл). После прекращения первоначального вспенивания тионилхлорид добавляют более быстро. После этого раствор кипятят 2 ч. После охлаждения тионилхлорид удаляют при пониженном давлении с получением коричневых кристаллов, которые растворяют в 190 мл метанола с последующим прибавлением к метанольному раствору цианида калия (19,4 г, 0,298 моль), растворенного в 80 мл воды. Полученный раствор нагревают до кипячения и кипятят примерно сутки. Раствор охлаждают, добавляют 150 мл насыщенного раствора карбоната натрия и переносят в диэтиловый эфир (500 мл). Раствор еще 3 раза экстрагируют 500 мл диэтилового эфира. Объединенные органические растворы сушат над сульфатом натрия и после концентрирования получают 12,1 г (81,7%) коричневых кристаллов, т.пл. 71oC, используемых в последующей реакции восстановления без дополнительной очистки.
ИК (KBr), см-1: 3074, 2949, 2253, 1578, 1459, 1286, 1017, 821.
1H-ЯМР (300 МГц, ДMCO-d6), ε: 8,07 (м, 1H), 7,43 (м,1H), 7,35 (м, 1H), 4 (с, 2H), 3,8 (с, 3H).
МС (FD), m/e: 148 (М+).
УФ (EtOH): 278 нм ( δ =5407), 219 нм ( ε = 7435).
Найдено, %: C 64,62; H 5,50; N 19,00.
C8H8N2O
Вычислено, %: C 64,85; H 5,44; N 18,91.
C. Получение 2-этиламин-3-метоксипиридина.
2-[3-Метокси)пиридил]ацетонитрил (2 г, 13 ммоль) в 25 мл этанола восстанавливают 24 при комнатной температуре под давлением в 60 psi (4,2 кг/см2) в присутствии в качестве катализатора оксида платины (0,5 г) и 5 н. HCl (0,2 мл). Органическую часть концентрируют и затем переносят в этилацетат с водой. Добавляют 1 н. NaOH до pH и амин экстрагируют этилацетатом (2х300 мл). Органическую фазу промывают рассолом и насыщенным раствором бикарбоната натрия и сушат над сульфатом натрия. Раствор фильтруют и после концентрирования получают 1,5 г маслянистого продукта, используемого без дополнительной очистки.
D. Получение N-{ 2-[(3-метокси)пиридил]этил}-N'-[2-(5-бром)пиридил]мочевины.
Тиокарбонилдиимидазол (5 г, 28 ммоль) переносят в ацетонитрил (50 мл, безводный) и перемешивают. К раствору добавляют 2-амино-5-бромпиридин (Олдрич) (4,85 г 27 ммоль) и 30 мл ацетонитрила и перемешивают примерно сутки с образованием осадка. Твердый продукт кремового цвета отфильтровывают и используют на следующей стадии без дополнительной очистки (6,89 г, 87%).
Твердый продукт кремового цвета (2,88 г, 10,3 ммоль) переносят в 1-метил-2-пирролидинон (Олдрич), добавляют 2-этил-3-метоксипиридин и раствор нагревают примерно сутки при 100oC. Затем раствор переносят в этилацетат и промывают водой и насыщенным раствором бикарбоната натрия (3х200 мл). Очисткой сырого продукта вытеснительной хроматографией на силикагеле (40% этилацетата в гексане) получают 100 мг (3%) иглоподобных кристаллов, т.пл. 178oC.
ИК (KBr), см-1: 3157, 3037, 1595, 1562, 1434, 1314, 1275, 1178, 1023, 825.
1H-ЯМР (300 МГц, ДMCO-d6), ε : 11,53 (с, 1H), 8,5 (c, 1H), 8,17-8,12 (м, 2H), 7,68-7,65 (дв.д, J=8,75 и 8,73 Гц, 1H), 4,24-4,18 (м, 2H), 3,8 (с, 3H), 3,2-3-17 (т, J=6,63 Гц, 2H).
МС (FD), m/e: 366 (M+), 368 (M+1), 369 (M+2).
УФ (EtOH): 305 нм ( δ = 13005), 275 нм ( δ = 28998).
Найдено, %: C 45,85; H 4,12; N 15,12.
C14H15N4OSBr
Вычислено, %: C 45,78; H 4,12; N 15,25.
E. Получение N-{2-[(3-метокси)пиридил]этил}-N'-[2-(5-бром)пиридил}тиомочевины, гидрохлорида.
В раствор метанола, насыщенного HCl, переносят N-{2-[(3-метокси)пиридил] этил} -N'-[2-(5-бром)пиридил] тиомочевину (70 мг, 0,02 ммоль). Твердое вещество сразу же переходит в раствор, после чего вновь появляется в виде белого осадка, большую часть которого дробят диэтиловым эфиром. Фильтрованием осадка получают 65 мг (84%) гидрохлорида.
Пример 347. N-[2-Фтор-6-метокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
В 200 мл ТГФ растворяют 3-фторанизол (10 мл, 88 ммоль), раствор охлаждают до -75oC и к нему медленно прибавляют н-BuLi (52 мл, 105 ммоль). Бледно-желтый раствор перемешивают 10 мин при -70oC, добавляют ДМФА (20 мл) и раствор нагревают до комнатной температуры. Добавляют 200 мл толуола, раствор промывают водой и испаряют досуха с образованием кристаллического продукта. Альдегид превращают в соответствующую указанную тиазолилмочевину по методике примера 151.
1H-ЯМР (CDCl3), δ : 2,9-3 (2H, т), 3,7-3,9 (2H, т), 6,7-6,9 (2H, к, м-), 7-7,1 (1H, д), 7,15-7,3 (1H, к), 7,4 (1H, д).
Пример 348. цис-(DL)-2-Фенилциклопропиламин.
Смесь стирола (100 мл, 873 ммоль), CuI (10 мг, 0,05 ммоль) и Pd(OAc)2 в 1,2-дихлорэтане (100 мл) нагревают до кипения. В течение 30 мин добавляют этилдиазоацетат (50 мл, 475 ммоль) в стироле (100 мл, 873 ммоль) и раствор кипятят еще 5 мин. Раствор охлаждают и фильтруют через короткую колонку с окисью алюминия с элюированием смесью этилацетат/гексан (1:9). Растворители, включая стирол, испаряют. Остаточное масло представляет собой смесь цис- и транс-изомеров (3: 7). Масло растворяют в метаноле (200 мл) и к раствору добавляют гидроокись калия (30 г, 535 ммоль) в воде (50 мл). Раствор кипятят 2 ч, охлаждают и разбавляют толуолом (100 мл) и водой (100 мл).
Водную фазу отделяют и подкисляют соляной кислотой. Раствор экстрагируют толуолом, органическую фазу сушат над сульфатом натрия, фильтруют и после испарения получают бледно-коричневый твердый продукт, который (70 г, 430 ммоль) растворяют при механическом перемешивании и в атмосфере N2 в ацетоне (400 мл). Раствор охлаждают до 5oC и в течение 20 мин добавляют этилхлорформиат (41 мл, 430 ммоль). Раствор перемешивают еще 5 мин. добавляют азид натрия (30 г, 460 ммоль) в воде (100 мл) и перемешивают 30 мин. После добавления толуола (400 мл) образуется белый плотный осадок. Раствор декантируют с отделением осадка и сушат над сульфатом натрия (50 г). Раствор испаряют до 1/4 первоначального объема, разбавляют 1,2-дихлорэтаном (400 мл) и кипятят 3 ч с выделением газообразного азота.
К раствору добавляют смесь 100 мл соляной кислоты (концентрированной водной), 100 мл воды и 200 мл диоксана. Раствор кипятят 3 ч с выделением газообразного CO2. Раствор разбавляют водой (200 мл), водную фазу отделяют, промывают 1,2-дихлорэтаном, подщелачивают аммиаком (концентрированным водным) и экстрагируют дихлорметаном (3 х 100 мл). Органическую фазу промывают водой (100 мл), сушат над сульфатом натрия, фильтруют и испаряют.
Остаточное масло (50 г) разделяют на 1000 мл силикагеля с элюированием этилацетатом, причем целевой продукт (цис-) является более быстро элюируемым компонентом. Испарением чистых цис-фракций получают 14 г масла.
1H-ЯМР (CDCl3), δ , ч/млн: 0,8-0,9 (1H, CH2, м), 1,1-1,2 (1H, CH2, м), 2-2,1 (1H, PhCH, к), 2,6-2,7 (1H, CHNH2, м), 7,1-7,4 (5H, Ph).
Пример 349. N-[цис-(DL)-2-Фенилциклопропил]-N'-(2-тиазолил)тиомочевина.
Полученный в качестве продукта в примере 348 цис-(DL)-фенилциклопропиламин по методике примера 151 превращен в указанное соединение.
1H-ЯМР (CDCl3), α , ч/млн: 1,2-1,3 (1H, CH2, м), 1,5-1,6 (1H, м), 2,4-2,5 (1H, к, PhCH), 3,6-3,7 (1H, м), 6,6-6,7 (1H, д), 6,8-6,9 (1H, д), 7,2-7,4 (5H, м).
Пример 350. N-[цис-(DL)-2-Фенилциклобутил]-N'-(2-тиазолил)тиомочевина.
По методике примера 105 проводят реакцию цис-транс-смеси 2-фенилциклобутиламина (C. Beard, A.Burger.JOC, 27, 1647, 1962) (0,15 г, 1 ммоль) с продуктом из примера 103. Раствор на ночь помещают в холодильник (-10oC), кристаллы отфильтровывают и промывают на фильтре CH3CN. Стереохимия определяют с помощью NOE-дифференцированного ЯМР, согласно которому кристаллы являются чистым цис-изомером.
1H-ЯМР (CDCl3), δ , ч/млн: 2,2-2,4 (3H, м), 2,6-2,7 (1H, м), 3,9-4 (1H, к), 5,1-5,2 (1H, к), 6,6-6,7 (1H, д, тиазол), 6,8-6,9 (1H, д, тиазол), 7,3-7,5 (5H, м, Ph).
Пример 351. N-[цис-(DL)-2-Метил-2-фенилциклопропил] -N'-(4-хлорфенил)тиомочевина.
По методике примера 348 δ - метилстирол (Олдрич) превращают в соответствующий амин в виде цис-/транс- смеси. Амин (300 мг, 2,04 ммоль) и 4-хлорфенилизотиоциланат кипятят 60 мин в CH3CN (5 мл). Раствор испаряют и конечную очистку осуществляют вытеснительной хроматографией на силикагеле и элюированием смесью этилацетат/гексан (1: 4). Собранные фракции содержат согласно NOE-дифференцированному ЯМР чистый цис-изомер.
1H-ЯМР (CDCl3, δ , ч/млн: 1,1-1,2 (2H,м, CH2), 1,4-1,5 (3H, c, CH3), 3,2-3,4 (1H, м, CHN), 6,4-6,5 (1H, ш.с, NH), 7-7,1 (2H, Ph), 7,3-7,5 (7H, с + м, Ph), 7,9-8,1 (1H, ш.с, NH).
Пример 352. N-[2-(2,6-Дифторфенил)этил]- N'-(2-пиразинил)тиомочевина.
По методике примера 93 проводят реакцию между 2,6-дифторфенэтиламином (1 г, 6,4 ммоль), 2-аминопиразином (0,61 г, 6,4 ммоль) и N, N-тиокарбонилдиимидазолом (1,13 г, 6,4 моль) с получением указанного соединения в виде кристаллов.
1H-ЯМР (CDCl3), δ , ч/мин: 3,1-3,2 (2H, т, PhCH2), 3,9-4 (2H, т, CHN), 6,8-6,9 (2H, т, Ph), 7,1-7,3 (1H, м, Ph), 7,9-8 (1H, с, пир.), 8,1-8,2 (1H, д, пир. ), 8,3-8,4 (1H, с, пир.), 9,3-9,4 (1H, ш. с, NH), 11-11,2 (1H, ш.с, NH).
Пример 353. N-[2-(2,6-Дифтор-3-карбоксамидометилфенил)этил]-N'-[2-(5-бром) пиридил]тиомочевина.
Смесь 2,6-дифторбензальдегида (10 г, 70,4 ммоль), этиленгликоля (20 мл), триэтилортоформиата (10 мл), n-толуолсульфокислоты в 1,2-дихлорэтане нагревают 2 ч при 80oC. Раствор нейтрализуют гидрокарбонатом натрия, промывают водой, сушат над сульфатом натрия, фильтруют и испаряют. Остаточное масло в атмосфере азота растворяют в тетрагидрофуране (700 мл), раствор при перемешивании охлаждают до -70oC и к нему медленно прибавляют н-BuLi (48 мл, 1,6 M). Раствор перемешивают 20 мин и к нему как можно быстрее прибавляют сухой лед (20 г, 455 ммоль), наблюдается вспенивание.
Раствор медленно доводят до комнатной температуры, добавляют воду и раствор промывают этилацетатом, подкисляют уксусной кислотой и экстрагируют этилацетатом.
Органическую фазу сушат над сульфатом натрия, фильтруют и испаряют. В 50 мл дихлорметана растворяют 1 г остаточного твердого продукта (4,35 ммоль) и N, N-диизопропиламин (2 мл) и охлаждают до 0oC.
Добавляют тионилхлорид (0,5 мл, 6,9 ммоль) и раствор медленно нагревают до комнатной температуры. Добавляют метиламин (3 мл), перемешивают 30 мин, промывают водой, сушат над сульфатом натрия, фильтруют и испаряют.
Остаток растворяют в смеси воды с диоксаном (1:2, 20 мл) и добавляют n-толуолсульфокислоту (0,5 г, 2,63 ммоль). Раствор нагревают и перемешивают 2 ч при 60oC. Раствор нейтрализуют гидрокарбонатом натрия, экстрагируют этилацетатом, сушат над сульфатом натрия, фильтруют и испаряют.
Остаток растворяют в толуоле и к раствору добавляют бензилоксикарбонилметилтрифенилфосфоран (1,5 г, 3,7 моль). Раствор перемешивают 30 мин при 50oC, после чего переносят в колонку с силикагелем. Колонку элюируют смесью этилацетат/гексан (1:2) и собранные фракции испаряют. Остаток (0,15 г) гидрируют в метаноле (50 мл) и уксусной кислоте (5 мл) в присутствии Pd/C (10%, 100 мг) и газообразного водорода в аппарате Парра (1,5 бар, 1 ч).
Раствор фильтруют через целит и испаряют. Часть остатка (50 мг, 0,26 ммоль) растворяют при 0oC в ацетоне.
Добавляют триэтиламин (50 мл, 0,36 ммоль) с последующим прибавлением этилхлорформиата (30 мл, 0,32 ммоль). Раствор перемешивает 15 мин, после чего добавляют азид натрия (30 мг, 0,46 ммоль) в воде (2 мл). Раствор перемешивают 15 мин, разбавляют этилацетатом, промывают водой, сушат над сульфатом натрия, фильтруют и испаряют.
Остаток растворяют в толуоле (20 мл) и перемешивают 1 ч при 90oC. Раствор испаряют и вновь растворяют в смеси диоксан/вода/соляная кислота концентрированная водная (1: 3: 1). Раствор перемешивают 20 мин при комнатной температуре. Раствор испаряют и полученный в остатке гидрохлорида 2-(2,6-дифтор-3-карбоксамидометилфенил)этиламин по методике примера 94 конденсируют с 1-(2-амино-5-бромпиридил)-1'-(имидазолил)тиокарбонилом.
Реакционную смесь испаряют, а остаток очищают вытеснительной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (1:1). Испарением собранных фракций получают указанное соединение.
1H-ЯМР (CDCl3), δ , ч/млн: 2,9-3 (3H, с, CH3), 3,1-3,2 (2H, т, PhCH2), 4-4,1 (2H, т, CH2N), 6,8-6,9 (1H, д), 6,9-7 (2H, т), 7,7-7,8 (2H, м), 8-8,1 (1H, с).
Пример 354. N-[2-(3-Ацетамидометил-2,6-дифторфенил)этил]-N'- [2-(5-бром)пиридил]тиомочевина.
В 200 мл тетрагидрофурана в атмосфере азота при перемешивании растворяют 2,4-дифторбензонитрил (Олдрич) (4,6 г, 33 ммоль). Раствор охлаждают до -75oC и к нему прибавляют литийдиизопропиламид (25 мл, 1,5 M раствор). Раствор перемешивают 15 мин и затем добавляют диметилформамид (10 мл). Охлаждение снимают, раствор разбавляют толуолом, промывают водой, сушат над сульфатом натрия, фильтруют и испаряют. Остаток (4,76 г, 28,5 ммоль) растворяют в 250 мл толуола и к раствору добавляют бензилоксикарбонилметилтрифенилфосфоран (14 г, 34 ммоль).
Раствор перемешивают 40 мин при 35oC (слегка экзотермическая реакция), после чего переносят в колонку с силикагелем. Колонку элюируют смесью этилацетат/гексан (1: 4) и собранные фракции испаряют. Небольшую часть остатка (0,5 г) растворяют в метаноле (50 мл) и уксусной кислоте (6 мл), добавляют 5% Pd/C и смесь гидрируют 1 ч в аппарате Парра при 1,5 бар.
Раствор фильтруют через целит и испаряют. Остаток растворяют в уксусном ангидриде и раствор перемешивают 20 мин при 50oC. Избыток реагента испаряют, а остаток растворяют в воде. Раствор при перемешивании нагревают 20 мин при 60oC. Остаток (0,29 г, 1,14 ммоль) растворяют при 0oC в ацетоне.
Добавляют триэтиламин (0,315 мл, 2,3 ммоль) с последующим прибавлением этилхлорформиата (0,16 мл, 1,7 ммоль). Раствор перемешивают 15 мин, после чего добавляют азид натрия (220 мг, 3,3 ммоль) в воде (2 мл). Раствор перемешивают 15 мин, разбавляют этилацетатом, промывают водой, сушат над сульфатом натрия, фильтруют и испаряют.
Остаток растворяют в толуоле (20 мл) и перемешивают 1 ч при 90oC. Раствор испаряют и вновь растворяют в смеси диоксан/вода/соляная кислота концентрированная водная (50:10:1). Смесь перемешивают 20 мин при комнатной температуре и затем испаряют. Полученный в остатке амингидрохлорид по методике примера 94 конденсируют с 1-(2-амино-5-бромпиридил) -1'-(имидазолил)тиокарбонилом.
Реакционную смесь испаряют, а остаток очищают вытеснительной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (1:1). Испарением собранных фракций получают в виде кристаллов указанное соединение.
1H-ЯМР (CDCl3), δ , ч/млн: 1,9-2 (3H, с, CH3CON), 3-3,1 (2H, ш, с, PhCH2CH2N), 3,9-4,1 (2H, с, ш, PhCH2CH2N), 4,3-4,4 (2H, с, PhCH2N), 6,8-6,9 (2H, м), 7,2-7,4 (1H, м), 7,7-7,8 (1H, д), 8,1-8,2 (1H, с).
Пример 355. N-(4-Метил-3-пентенил)-N'-(4-метил-2-тиазолил)тиомочевина.
Это соединение получают по методике примера 105 реакцией 4-метил-3-пентениламина с активированным производным 2-амино-4-метилтиазола, например с 1-(2-амино-4-метилтиазол)-1'-имидазолтиокарбонилом, т.пл. 164,5 - 165,5oC.
Найдено, %: C 52,00; H 6,90; N 16,70.
Вычислено, %: C 51,73; H 6,71; N 16,45.
1H-ЯМР (CDCl3), δ : 1,65 (с, 3H), 1,73 (д, 3H), 2,29 (д, 3H), 2,4 (к, 2H), 3,7 - 3,78 (м, 2H), 5,16 - 5,22 (м, 1H), 6,36 (к, 1H), 10,14 (ш.с, 1H), 10,9 (ш.с, 1H).
13C-ЯМР (CDCl3), δ : 17,16; 17,93; 25,83; 27,28; 45,69; 105,04; 120,53; 134,84; 147; 99; 160,79; 177,28.
Пример 356. N-[2-(2,6-Дифтор)фенэтил]-N'-(2-бензимидазолил)тиомочевина.
Это соединение синтезировано по методике примеров 93 и 94 реакцией 2,6-дифторфенилэтиламина и 2-аминобензимидазола с использованием 2-аминобензимидазола вместо 2-аминотиазола, т.пл. 195 - 197oC (разложение).
1H-ЯМР (ДMCO-d6), δ : 3,16 (т, 2H), 4,02 (к, 2H), 7,14 - 7,24 (м, 4H), 7,43 - 7,49 (м, 3H), 11,13 (ш.с, 1H), 11,4 (ш.с, 1H).
Пример 357. N-[2-(3-Гидрокси)фенэтил]-N'-(5-бром-2-пиридинил)тиомочевина.
Это соединение получено по методикам примеров 93 и 94 в реакции 3-гидроксифенэтиламина и 5-бром-2-аминопиридина с использованием вместо 2-аминотиазола 5-бром-2-аминопиридина, т.пл. 176,5 - 178oC (выход 35%).
1H-ЯМР (ДMCO-d6), δ : 2,95 (т, 2H), 3,9 (к, 2H), 6,73 - 6,85 (м, 3H), 7,2 - 7,27 (м, 2H), 8,08 (дв.д. 1H), 8,32 (д, 1H), 9,49 (с, 1H), 10,84 (с, H), 11,33 (т, 1H).
13C-ЯМР (ДMCO-d6), δ : 34,01; 46,3; 111,7; 113,26; 114,41; 115,7; 119,32; 129,35; 140,41; 141,29; 145,79; 152,29; 157,34; 179,07.
Пример 358. N-[2-(1-Метил)-2-пирролилэтил] -N'-(5-хлор-2-пиридинил)тиомочевина.
Это соединение с выходом 78% получено по методике примера 105 в реакции 2-(аминоэтил)-1-метилпиррола с 5-хлор-2-аминопиридином, т.пл. 169,5 - 170oC.
1H-ЯМР (ДMCO-d6), δ : 3,01 (т, 2H), 3,67 (с, 3H), 3,93 (к, 2H), 6 - 6,02 (м, 2H), 6,74 (с, 1H), 7,32 (д, 1H), 7,97 (дв.д. 1H), 8,27 (д, 1H), 10,76 (с, 1H), 11,36 (ш.с, 1H).
13C-ЯМР (ДMCO-d6), δ : 24,97; 33,19; 44,37; 106,22; 106,39; 114,02; 121,58; 123,7; 129,32; 138,7; 143,61; 152,05; 179,31.
Пример 359. N-[2-(3-Метил)фенэтил]-N'-(2-тиазолил)тиомочевина.
(3-Метилфенил)уксусную кислоту восстанавливают в кипящем тетрагидрофуране литийалюминийгидридом в 2-(3-метилфенил)этанол, который далее по методике примера 106 превращают в 2-(3-метилфенил)этиламин. Реакцией полученного амина по методике примера 105 с продуктом из примера 103 получают указанное соединение, т.пл. 145 - 146oC.
13C-ЯМР (CDCl3, 250 МГц), δ : 178, 162, 132, 137, 137, 130, 128, 127, 126, 102, 47, 35, 22.
Пример 360. N-[2-(2-Этокси)фенэтил]-N'-[2-(4-метил)тиазолил)тиомочевина.
Это соединение (т.пл. 188 - 189oC) получено по методике примера 105 реакцией 2-(2-этоксифенил)этиламина с 1-(2-амино-4-метилтиазолил)-1'-имидазолтиокарбонилом, синтезированным по методике примера 105.
1H-ЯМР (250 МГц, ДMCO), δ : 7,32 - 6,73 (м, 5H, фенил, тиазол), 4,09 (к, 2H, OCH2CH3), 3,86 (к, 2H, CH2NH), 2,97 (т, 2H, Ph-CH2), 2,25 (с, 3H, тиазол-CH3), 1,43 (т, 3H, OCH2-CH3).
13C-ЯМР (250 МГц, ДMCO), δ : 176, 162, 157, 130, 128, 127, 120, 112, 107, 106, 63, 44, 29, 17, 15.
Пример 361. N-[2-(3-Этокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
Смесь 3-гидроксибензальдегида (3 г, 24,6 ммоль), этилйодида (5,9 мл, 73,8 ммоль) и K2CO3 (3,4 г, 24,6 ммоль) в 50 мл ацетона перемешивают 6 ч при 40oC и примерно сутки при комнатной температуре. Смесь фильтруют и испаряют. Продукт очищают колоночной хроматографией на силикагеле (EtOAc/петролейный эфир, 15:100) и получают 2,91 г (79%) 3-этоксибензальдегида.
1H-ЯМР (250 МГц, CDCl3), δ : 9,97 (с, 1H, CHO), 7,45 - 7,14 (м, 4H, фенил), 4,1 (к, 2H, CH2CH3), 1,44 (т, 3H, CH2CH3).
По методике примера 151 3-этоксибензальдегид превращают в 2-(3-этоксифенил)этиламин, который по методике примера 105 вводят в реакцию с продуктом из примера 103 с образованием указанного соединения, т.п. 169 - 170oC.
1H-ЯМР (250 МГц, ДMCO), δ : 7,6 (д, 1H, тиазол), 7,3 - 6,93 (м, 4H, фенил), 4,08 (к, 2H, OCH2CH3), 3,87 (к, 2H, CH2NH), 2,96 (т, 2H, фенил-CH2), 1,42 (т, 3H, OCH2CH3).
Пример 362. N-[2-(2-Этокси-6-фтор)фенэтил]-N'-(2-тиазолил)тиомочевина.
1. Смесь 3-фторфенола (20 г, 178,4 ммоль), этилйодида (83,5 г, 535,2 ммоль) и K2CO3 (49,3 г, 356,8 ммоль) в 250 мл ацетона перемешивают примерно сутки при 50oC. Смесь фильтруют и после испарения получают 19,84 г (79%) 1-этокси-3-фторбензола.
1H-ЯМР (250 МГц, CDCl3), δ : 7,2 (к, 1H, фенил), 6,69 - 6,57 (м, 3H, фенил), 4 (к, 2H, CH2CH3), 1,4 (т, 3H, CH2CH3).
2. К раствору 1-этокси-3-фторбензола (5 г, 35,7 ммоль) в 100 мл сухого ТГФ при -65oC в атмосфере азота медленно (0,5 ч) прибавляют 1,6 M раствор Buli в гексане (24 мл, 38,4 ммоль). Раствор перемешивают 25 мин при -65oC и к нему по каплям прибавляют ДМФА (5,22 г, 71,4 ммоль). Смесь оставляют нагреваться до комнатной температуры. К смеси добавляют 300 мл ледяной воды и экстрагируют диэтиловым эфиром. Раствор диэтилового эфира промывают рассолом, сушат над Na2SO4 и испаряют. Очисткой продукта колоночной хроматографией на силикагеле (EtOAc/ петролейный эфир, 10:100) получают 3,69 г (61%) 2-этокси-6-фторбензальдегида.
1H-ЯМР (250 МГц, CDCl3), δ : 7,52 - 7,4; 6,8 - 6,64 (м, 3H, фенил), 4,18 (к, 2H, CH2CH3), 1,5 (т, 3H, CH2CH3).
13C-ЯМР (250 МГц, CDCl3), δ : 188, 165, 161. 136, 109, 108, 65, 14.
3. По методике примера 151 полученный альдегид превращают в 2-(2-этокси-6-фторфенил)этиламин, который по методике примера 105 вводят в реакцию с продуктом из примера 103 с образованием указанного соединения.
1H-ЯМР (250 МГц, ДMCO), δ : 7,32 - 6,72 (м, 5H, фенил, тиазол), 4 (к, 2H, CH2CH3), 3,78 (к, 2H, CH2-NH), 2,92 (т, фенил-CH2), 1,33 (т, 3H, CH2CH3).
Пример 363. N-[2-(3-Изопропокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
По методике примера 361 из 3-гидроксибензальдегида и изопропилйодида получают 3-изопропоксибензальдегид. Полученный альдегид по методике примера 151 превращают в 2-(3-изопропоксифенил)этиламин, который по методике примера 105 вводят в реакцию с продуктом из примера 103 с образованием указанного соединения.
1H-ЯМР (250 МГц, ДMCO), δ : 7,44 - 6,84 (м, 6H, фенил, тиазол), 4,69 - 4,64 (м, 1H, изопропокси-CH), 3,87 (к, 2H, CH2-NH), 2,96 (т, 2H, фенил-CH2), 1,36 - 1,32 (м, 6H, 2CH3).
Пример 364. N-[2-(5-Бром-2-этокси)фенэтил]-N'-(2-тиазолил)тиомочевина.
1. Смесь (5-бром-2-гидроксибензилового спирта (5 г, 24,6 ммоль), этилйодида (11,5 г, 73,8 ммоль) и K2CO3 (3,4 г, 24,6 ммоль) в 50 мл ацетона перемешивают примерно сутки при 50oC. Смесь фильтруют и испаряют. Очисткой продукта колоночной хроматографией на силикагеле (EtOAc)/петролейный эфир, 30:100) получают 5,24 г (92%) 5-бром-2-этоксибензилового спирта.
1H-ЯМР (250 МГц, CDCl3), δ : 7,42 - 7,31 (м, 2H, фенил), 6,73 (д, 1H, фенил), 4,67 (д, 2H, CH2OH), 4,07 (к, 2H, CH2CH3), 1,6 (c, 1H, OH), 1,43 (т, 3H, CH2CH3).
2. Смесь 5-бром-2-этоксибензилового спирта (2,78 г, 12 ммоль) и пиридинийдихромата (4,51 г, 12 ммоль) в 120 мл CH2Cl2 перемешивают 6 ч при комнатной температуре. Смесь фильтруют, промывают водой, 0,5 н. HCl и рассолом и сушат на Na2SO4. Очисткой продукта колоночной хроматографией на силикагеле (EtOAc/петролейный эфир, 10:100) получают 2,33 г (85%) 5-бром-2-этоксибензальдегида.
1H-ЯМР (250 МГц, CDCl3), δ : 10,4 (с, 1H, CHO), 7,91 (д, 1H, фенил), 7,6 (дв. д, 1H, фенил), 6,88 (д, 1H, фенил), 4,14 (к, 2H, CH2CH3), 1,51 (т, 3H, CH2CH3).
3. По методике примера 151 альдегид превращают в 2-(5-бром-2-этоксифенил)этиламин, реакцией которого по методике примера 105 с продуктом из примера 103 получают указанное соединение.
1H-ЯМР (250 МГц, ДMCO), δ : 7,1 - 6,62 (м, 5H, фенил, тиазол), 3,73 (к, 2H, CH2CH3), 3,52 (к, 2H, CH2NH), 2,62 (т, 2H, фенил-CH2), 1,07 (т, 3H, CH2CH3).
Пример 365. N-[2-(2,5-Диметокси)фенэтил]-N'-(2-пиридил)тиомочевина.
К раствору 1,1'-тиокарбонилдиимидазола (0,36 г, 2 ммоль) в 7 ДМФА при 0oC добавляют 2,5-диметоксифенэтиламин (0,36 г, 2 ммоль) в 7 мл ДМФА и через 5 мин добавляют при 0oC 2-аминопиридин (0,19 г, 2 ммоль) в 7 мл ДМФА.
Полученную смесь кипятят 4 ч при 150oC. После охлаждения по комнатной температуры смесь переносят в ледяную воду, экстрагируют диэтиловым эфиром, сушат над Na2SO4 и растворитель испаряют. Очисткой продукта колоночной хроматографией на силикагеле (EtOAc/петролейный эфир, 15:100) получают 0,24 г (39%) указанного соединения.
1H-ЯМР (250 МГц. CDCl3), δ : 8,41 (ш.с, 1H, 11H), 8,04 (д, 1H, пиридин), 7,61 (т, 1H, пиридин), 6,94-6,67 (м, 5H, фенил, пиридин), 4,03 (к. 2H, CH2NH), 3,78 (c, 3H, CH3O), 3,73 (с, 3H, CH3O), 3 (т, 2H фенил-CH2).
Пример 366. N-[2-(2-Этокси)фенэтил]-N'-[2-(5-бром)пиридил] тиомочевина.
По методике примера 151 из 2-этоксибензальдегида получают 2-этоксифенэтиламин.
К смеси 1,1'-тиокарбонилдиимидазола (1,32 г 7,4 ммоль) и 20 мл ацетонитрила при 0oC медленно прибавляют 2-этоксифенэтиламин (1,1 г, 6,7 ммоль) в 20 мл ацетонитрила. Смесь нагревают до комнатной температуры и испаряют. Добавляют 2-амино-5-бромпиридин (1,63 г, 9,4 ммоль) и полученную сырую реакционную смесь кипятят 6 ч при 140oC в 30 мл ДМФА. После охлаждения до комнатной температуры реакционную смесь переносят в ледяную воду, экстрагируют диэтиловым эфиром, сушат над Na2SO4 и растворитель испаряют. Продукт очищают колоночной хроматографией на силикагеле (EtOAc/петролейный эфир, 15:100).
1Н-ЯМР (250 МГц, CDCl3), δ : 8,73 (ш.с, 1H, 11H), 8 (д, 1H, пиридин), 7,68 (дв. д, 1H, пиридин), 7,26-7,16 (м, 2H, фенил), 6,96-6,82 (м, 2H, фенил), 6,68 (д, 1H, пиридин), 4,03 (к, 2H, CH2CH3), 4,03 (к, 2H, CH2NH), 3,02 (т, 2H, фенил-CH2), 1,42 (т, 3H, CH2CH3).
13С-ЯМР (250 МГц, CDCl3), δ : 179, 157, 152, 146, 141, 131, 128, 127, 120, 113, 112, 111, 63, 46, 30, 15.
Пример 367. N-[2-(2-Этокси-6-фтор)фенэтил]-N'-(2-пиридил)тиомочевина.
Исходный 2-(2-этокси-6-фторфенил)этиламин синтезирован по методике примера 362. Это соединение получено по методике реакции конденсации, приведенной в примере 366, с использованием 2-аминопиридина вместо 2-амино-5-бромпиридина.
1H-ЯМР (250 МГц, CDCl3), δ : 8 (д, 1H, пиридин), 7,58 (т, 1H, пиридин), 7,14 (к, 1H, пиридин), 6,91-6,59 (м, 4H, фенил, пиридин), 3,95 (к, 2H, CH2-NH), 3,95 (к, 2H, CH2CH3), 3,09 (т, 2H, фенил-CH2), 1,39 (т, 3H, CH2CH3).
13С-ЯМР (250 МГц, CDCl3), δ : 179, 164, 153, 145, 138, 128, 128, 117, 112, 108, 107, 107, 64, 45, 22, 15.
Пример 368. N-2-(2-Метокси)фенэтил-N'-(2-тиазолил)метиловый тиоэфир.
К раствору N-[2-(2-метокси)фенэтил]-N'-(2-тиазолил)тиомочевины (0,3 г, 1 ммоль) (см. пример 94) в 15 мл ДМФА добавляют метилйодид (0,425 г, 3 ммоль) и смесь перемешивают 6 ч при комнатной температуре. Метилйодид испаряют, смесь переносят на лед, экстрагируют хлористым метиленом, сушат над Na2SO4 и испаряют. Продукт очищают колоночной хроматографией на силикагеле (EtOAc/петролейный эфир, 10:100).
1Н-ЯМР (250 МГц, CDCl3), δ : 7,25 (д, 1H, тиазол), 7,24- 7,16 (м, 2H, фенил), 6,92-6,81 (м, 2H, фенил), 6,7 (д, 1H, тиазол), 3,79 (с, 3H, CH3O), 3,57 (к, 2H, CH2NH), 2,95 (т, 2H, фенил-CH2), 2,46 (c, 3H, SCH3).
13С-ЯМР (250 МГц, CDCl3), δ : 173, 162, 157, 137, 130, 127, 126, 120, 111, 110, 55, 43, 30, 13.
Пример 369. N-[2-(2-Этокси-6-фтор)фенэтил]-N'-[2-(5-метил)пиридил]тиомочевина.
Исходный 2-(2-этокси-6-фторфенил)этиламин получен по методике примера 362. По методике реакции конденсации, приведенной в примере 366, с использованием 2-амино-5-метилпиридина вместо 2-амино-5-бромпиридина синтезировано указанное соединение.
1H-ЯМР (250 МГц, CDCl3), δ : 8,65 (ш.с, 1H, NH), 7,83 (c, 1H, пиридин), 7,41 (д, 1H, пиридин), 7,22-7,05 (к, 1H, фенил), 6,73-6,58 (м, 3H, фенил, пиридин), 3,98 (к, 2H, CH2NH), 3,98 (к, 2H, CH2CH3), 3,07 (т, 2H, фенил-CH2), 2,25 (с, 3H, CH3), 1,4 (т, 3H, CH2CH3).
13С-ЯМР (250 МГц, CDCl3), δ : 179, 168, 152, 145, 139, 127, 127, 126, 111, 108, 108, 107, 63, 44, 22, 17, 14.
Пример 370. N-Фенэтил-N'-[2-(5-хлор)пиридил]тиомочевина.
Продукт из примера 374 (0,3 г, 1,76 ммоль) и фенэтиламин (0,22 мл, 1,76 ммоль) в 8 мл ацетонитрила перемешивают 0,5 ч при комнатной температуре. Смесь фильтруют, осадок сушат и перекристаллизовывают из ацетонитрила, т. пл. 152-153oC.
1H-ЯМР (250 МГц, ДMCO), δ : 8,2 (д, 1H, пиридин), 7,98 (дв. д, 1H, пиридин), 7,45-7,4 (м, 5H, фенил), 7,27 (д, 1H, пиридин), 3,94 (к, 2H, CH2NH), 3,04 (т, 2H, фенил-CH2).
13C-ЯМР (250 МГц, ДMCO), δ : 179, 152, 143, 139, 139, 129, 128, 126, 124, 114, 46, 34.
Пример 371. N-[цис-(DL)-2-Фенилциклопропил]-N'-(2-пиридил)тиомочевина.
Это соединение получено по методикам примеров 93 и 94 реакцией цис-(DL)-2-фенилциклопропиламина и 2-аминопиридина, который применяют вместо 2-аминотиазола.
1H-ЯМР: 1,19-1,27 (м, 1H), 1,45-1,55 (м, 1H), 2,5 (к, 1H), 3,67-3,78 (м, 1H), 6,73-6,78 (м, 2H), 7,27-7,34 (м, 5H), 7,41-7,53 (м, 2H), 10,08 (ш.с, 1H).
13С-ЯМР: 12,4; 21,9; 34,6; 111,8; 117,3; 126,5; 128,2; 129,1; 136,5; 138,2; 145,1; 153, 180,3.
Т.пл. 184,5-186oC.
Пример 372. N-(5-Хлор-2-пиридил)-N'-[цис-(DL)-2-фенилциклопропил]тиомочевина.
Это соединение (т. пл. 194-195,5oC) получено по методике примера 105 в реакции цис-(DL)-2-фенилциклопропиламина (пример 148) с активированным производным 2-амино-5-хлорпиридина, например 1-(2-амино-5-хлорпиридин)-1'-имидазолтиокарбонилом.
1H-ЯМР (CDCl3) : 1,19-1,26 (м, 1H), 1,46-1,55 (м, 1H), 2,51 (к, 1H), 3,64-3,74 (м, 1H), 6,74 (дв. д, 1H), 7,3-7,4 (м, 6H), 7,47 (дв. д, 1H), 9,2 (ш. с, 1H), 10,9 (ш. с, 1H).
13С-ЯМР (CDCl3) : 12,4; 22; 34,7; 112,7; 124,7; 126,8; 129,2; 136,5; 138,3; 143,9; 151,1; 180,2.
Пример 373. N-(5-Бром-2-пиридил)-N'-[цис-(DL)-2-фенилциклопропил]тиомочевина.
Это соединение получено по методике примеров 93 и 94 реакцией цис-(DL)-2-фенилциклопропиламина (пример 148) и 2-амино-5-бромпиридина, который использован вместо 2-аминотиазола.
1H-ЯМР (CDCl3): 1,19 - 1,26 (м, 1H), 1,47 - 1,55 (м, 1H), 2,52 (к, 1H), 3,66 - 3,75 (м, 1H), 6,66 (дв.д, 1H), 7,27 - 7,41 (м, 5H), 7,47 (д, 1H), 7,6 (дв.д, 1H), 8,98 (ш.с, 1H), 10,88 (ш.с, 1H).
13C-ЯМР (CDCl3): 12,4; 22; 34,7; 112,3; 113,1; 126,8; 128,4; 129,2; 136,5; 140,9; 146,2; 151,3; 180,2.
Найдено, %: C 51,5; H 4,00; N 12,00.
C15H14BrN3S
Вычислено, %: C 51,7; H 4,05; N 12,07.
Пример 374. 5-Хлорпиридил-2-ил-изотиоцианат.
К раствору тиокарбонилдиимидазола (14,26 г) в ацетонитриле (100 мл) при комнатной температуре и перемешивании в течение 25 мин порциями прибавляют 2-амино-5-хлорпиридин (10,28 г). Перемешивание продолжают и раствор-суспензию оставляют на несколько часов при той же температуре. Осадок отфильтровывают и промывают ацетонитрилом (3 х 25 мл). Твердый остаток растворяют в горячем ацетоне и фильтруют. Ацетоновый раствор испаряют в вакууме, остаток растворяют в горячем этилацетате и фильтруют через слой окиси кремния (размер: 3 х 7 см). Окись кремния промывают еще одной порцией горячего этилацетата. Испарением в вакууме объединенных растворов получают в качестве сырого продукта 5 г указанного соединения.
1H-ЯМР (ДMCO): 7,54 (д, J=8,7 Гц, 1H), 8,17 (дв.д, J=2,7 и 8,7 Гц, 1H), 8,63 (д, J=2,7 Гц, 1H).
13С-ЯМР (ДMCO): 121,4; 130,1; 139,4; 140,7; 143,9; 148,6.
Пример 375. N-цис-(DL)-[2-(3-Метокси)фенилциклопропил] -N'- (2-тиазолил)тиомочевина.
Исходный 3-метоксистирол получен следующим образом. К смеси 26,2 г (73,4 ммоль) метилтрифенилфосфонийбромида и 200 мл ТГФ, охлаждаемой до 0oC, в течение 30 мин добавляют 42 мл раствора литийдиизопропиламида (2 М в ТГФ, 82 ммоль). Смесь перемешивают еще 2 ч, после чего по каплям в течение 25 мин прибавляют 10 г (73,4 ммоль) 3-метоксибензальдегида. Реакционную смесь перемешивают 1 ч при комнатной температуре и затем кипятят 14 ч. После охлаждения растворитель испаряют в вакууме, остаток разбавляют 200 мл диэтилового эфира и осадок отфильтровывают. Эфирный раствор промывают водой, сушат над Na2SO4 и испаряют в вакууме. Продукт очищают колоночной хроматографией на силикагеле (диэтиловый эфир/циклогексан), выход 2,83 г (29%).
1H-ЯМР (CDCl3), δ : 7,24 (т, J=8,1 Гц, 1H, Ph), 7,21-6,98 (м, 1H, Ph), 6,95 (т, J=2,3 Гц, 1H, Ph), 6,81 (два дв. д, J=8,1 Гц, 2,3 Гц, 0,9 Гц, 1H, Ph), 6,69 (дв. д, J=17,6 и 10,8 Гц, 1H, CH), 5,74 (дв. д, J=17,6 и 0,9 Гц, 1H, CH2), 5,25 (дв. д, J=10,8 и 0,9 Гц, 1H, CH2), 3,81 (с, 3H, CH3).
13С-ЯМР (CDCl3), δ: 159,81 (C-3), 139,04 (C-1), 136,79 (C-a), 129,51 (C-5), 118,92 (C-6), 114,15 (C-4), 113,46 (C-2), 111,53 (C-O), 55,22 (O-CH3).
Указанное соединение получено по методикам примеров 348 и 349 с использованием 3-метоксистирола вместо стирола.
1Н-ЯМР (CDCl3), δ : 7,26-7,19 (т и д, 2H, o-, п-, тиазол), 6,9 - 6,69 (м, 4H, o-, м-, п-, тиазол), 3,76 (с, 3H, ОМе), 3,65 (ш. с, 1H, NH-CH-), 2,5 (к, 1H, Ph-CH-), 1,22 (м, 2H, циклопропил).
13C-ЯМР (CDCl3), δ : 178,6 (C = S), 161,3 (тиазол), 159,8 (C-ОМе), 137,8 (Ph), 137,7 (тиазол), 129,5 (Ph), 121,6 (Ph), 114,5 (Ph), 112,8 (Ph), 111 (тиазол), 55,2 (O-CH3), 44 (CH-H), 22 (CH-Ph), 12,1 (CH2).
Пример 376. N-цис-((DL)-[2-(2-Фторфенил)циклопропил]-N'-(2-тиазолил) тиомочевина.
Это соединение синтезировано по методикам, приведенным в примерах 348 и 349, с использованием 2-фторстирола вместо стирола.
1H-ЯМР (CDCl3), δ: 7,32 - 7,05 (м, 4H), 6,91 - 6,64 (м, 2H), 3,68 (ш.с, 1H, CH-NH), 2,57 (к, 1H, CH-Ph), 1,7 - 1,4 (м, 3H), 1,31 - 1,18 (м, 1H).
13С-ЯМР (CDCl3), δ : 178,8 (C = S), 162,5 и 160,5 (C - F, Ph), 161,2 (тиазол), 137,4 (тиазол), 129,9 (Ph), 128,5 и 128,4 (м - по F, Ph), 124 (n-по F, Ph), 115,4 и 115,1 (о- по F, Ph), 111,8 (тиазол), 33,8 (CH-NH), 16,4 (CH-Ph), 12,2 (CH2).
Пример 377. N-{2-[3-(6-Хлор-3-метокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина.
Исходный 3-(2-аминоэтил)-6-хлор-2-метоксипиридин получен следующим образом. К раствору 1 г (7 ммоль) 2-хлор-6-метоксипиридина в 20 мл сухого ТГФ в атмосфере азота и при охлаждении по -178oC добавляют 10,9 мл н-BuLi (1,6 M в гексане, 17,4 ммоль). Перед добавлением 4 мл окиси этилена в 6 мл эфира температуру смеси оставляют повышаться до -40oC. Смесь нагревают до комнатной температуры, добавляют 50 мл воды, водный слой отделяют и экстрагируют EtOAc (2х 100 мл). Органические экстракты объединяют, промывают один раз водой, сушат над Na2SO4 и концентрируют в вакууме. Сырой продукт очищают сухой колоночной вытеснительной хроматографией (гексан/EtOAc) с получением 0,22 г 3-(2-гидроксиэтил)-6-хлор-3-метоксипиридина в виде желтоватого масла.
К охлажденному по -50oC раствору 0,2 г (0,8 ммоль) 3-(2-гидроксиэтил)-6-хлор-2-метоксипиридина в 10 мл сухого CH2Cl2 в атмосфере азота добавляют 0,18 мл (0,8 мл) ангидрида трифторметансульфоновой кислоты. Смесь перемешивают 30 мин при этой же температуре и еще 10 мин при -78oC перед быстрым прибавлением холодного (-78oC) NH3 (ж). Смесь перемешивают 15 мин при комнатной температуре и ее последующим концентрированием в вакууме получают 1 г сырого 3-(2-аминоэтил)-6-хлор-2-метоксипиридина в виде соли с трифторметансульфоновой кислотой.
1H-ЯМР (CD3OD), δ : 7,66 (д, 1H, Py), 7,03 (д, 1H, Py), 4,04 (с, 3H, CH3-O), 3,24 (т, 2H, CH2-N), 3,03 (т, 2H, CH2-Py).
Сырой 3-(2-аминоэтил)-6-хлор-2-метоксипиридин по методике примера 103 конденсируют с N-[2-(5-бром)пиридил]-N'-[1-имидазолил]мочевиной с образованием указанного соединения.
1H-ЯМР (CD3OD), δ : 11,25 (ш.с, 1H, N-H), 10,82 (ш. с, 1H, N-H), 8,31 (с, 1H, Br-Py), 8,08 (д, 1H, Br-Py), 7,89 (д, 1H, Cl-Py), 7,21 (м, 2H, Cl- и Br-Py), 3,96 (м, 5H, CH2N и CH3O), 3,03 (т, 2H, CH2-Py).
13C-ЯМР (CD3OD), δ : 179,45 (C = S), 161,43 (Cl-C в Py), 152,41 (Br-C в Py), 145,92 (Cl-Py), 145,14 (MeO-C-Py), 141,89 (Br-Py), 141,51 (Br-Py), 120,32 (Cl-Py), 116,48 (Cl-Py), 114,6 (Br-Py), 111,95 (Br-Py), 55,1 (CH3O), 43,76 (CH2-NH), 27,89 (CH2-Ph).
Пример 378. N-{2-[3-(2-Фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина.
Исходный 3-(2-аминоэтил)-2-фторпиридин получен следующим образом. К охлажденному до -78oC раствору 2 г (20,6 ммоль) 2-фторпиридина в 25 мл сухого ТГФ в атмосфере азота добавляют 25 мл раствора BuLi (1,6 M в гексане, 41,6 ммоль). Перед добавлением 4 мл окиси этилена в 7 мл эфира смесь перемешивают 2 ч при той же температуре. Смесь нагревают до комнатной температуры и к ней добавляют 150 мл эфира и 25 мл ацетона. Осадок отфильтровывают и фильтрат в вакууме концентрируют до 1,3 его объема. Остаток промывают один раз рассолом, сушат над Na2SO4 и концентрируют в вакууме. Очисткой сырого продукта сухой колоночной вытеснительной хроматографией (гексан/EtOAc) получают 0,42 г 3-(2-гидроксиэтил)-2-фторпиридина в виде коричневого масла.
К охлажденному до -40oC раствору 0,2 г (1,42 ммоль) 3-(2-гидроксиэтил)-2-фторпиридина в 8 мл сухого CH2Cl2 в атмосфере азота добавляют 0,18 мл (0,8 ммоль) ангидрида трифторметансульфоновой кислоты. После перемешивания в течение 30 мин при -40oC добавляют 30 мл холодного (-78oC) NH3 (ж). Смесь перемешивают 30 мин при -40oC и после концентрирования в вакууме получают 1,03 г сухой соли, двукратным промыванием которой 20 мл диэтилового эфира получают 0,82 г 3-(2-аминоэтил)-2-фторпиридина в виде соли с трифтометансульфоновой кислотой.
1H-ЯМР (CD3OD), δ : 8,23 (д, 1H, Py), 7,98 (т, 1H, Py), 7,4 (м, 1H, Py), 3,3 (т, 2H, CH2-N), 3,12 (т, 2H, CH2-Py).
Сырой 3-(2-аминоэтил)-2-фторпиридин по методике примера 103 вводят в реакцию с N-[2-(5-бром)пиридил]-N'-(1-имидазолил)тиомочевиной с образованием указанного соединения.
1H-ЯМР (CD3OD), δ : 8,31 (д, 1H, Br-Py), 8,23 (м, 1H, F-Py), 8,06 (м, 2H, Br и F-Py), 7,45 (м, 1H, F-Py), 7,23 (д, 1H, Br- Py), 4 (к, 2H, CH2-N), 3,14 (м, 2H, CH2-Py).
13C-ЯМР (CD3OD), δ : 179,59 (C = S), 163,53 и 159,78 (F-C в Py), 152,39 (Br-Py), 145,87 (F-Py), 145,63 и 142,38 (F-Py), 142,28 (Br-Py), 141,54 (Br-Py), 122,31 и 122,26 (F-Py), 120,94 и 120,45 (F-Py), 114,59 (Br-Py), 111,97 (Br-Py), 44,29 (CH2-N), 27,32 (CH2-Ph).
Пример 379. N-[2-(2,6-Дифтор)фенэтил]-N'-(2-бензотиазолил)тиомочевина.
По методике примера 105 проводят реакцию между 2,6-дифторфенэтиламином и 1-(2-аминобензотиазол)-1'-имидазолтиокарбонилом, синтезированным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD): 7,64 (м, 2H, бензо), 7,38 (м, 3H, ДФРh, бензо), 7,24 (т, 2H, ДФРh), 4,04 (т, 2H, CH2), 3,15 (т, 2H, CH2).
Пример 380. N-[2-(2,6-Дифтор)фенэтил]-N'-[2-(4,5-диметил)тиазолил]тиомочевина.
По методике примера 105 проводят реакцию между 2,6-дифторфенэтиламином и 1-(2-амино-4,5-диметилтиазол)-1'-имидазолтиокарбонилом, синтезированным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3), δ : 7,21 (м, 1H, ДФРh), 7,15 (т, 2H, ДФРh), 4 (к, 2H, CH2), 3,09 (т, 2H, CH2), 2,22 (д, J = 0,5 Гц, 3H, Me), 2,08 (д, J = 0,6 Гц, Me).
Пример 381. N-[2-(2-Фтор)фенэтил]-N'-[2-(6-фтор)бензотиазолил]тиомочевина.
По методике примера 105 2-фторфенэтиламин конденсируют с 1-(2-амино-6-фторбензотиазол)-1'-имидазолтиокарбонилом, полученным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,53 - 7,06 (м, 7H, бензо, ФРh), 4,04 (т, 2H, CH2), 3,1 (т, 2H, CH2).
Пример 382. N-[2-(2,6-Дифтор)фенэтил]-N'-[2-(6-фтор)бензотиазолил]тиомочевина.
По методике примера 105 2,6-дифторфенэтиламин конденсируют с 1-(2-амино-6-фторбензотиазол)-1'-имидазолтиокарбонилом, полученным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,52 (м, 1H, бензо), 7,4 (м, 1H, бензо), 7,14 (м, 2H, ДФРh, бензо), 6,88 (м, 2H, ДФРh), 4,02 (т, 2H, CH2), 3,14 (т, 2H, CH2).
Пример 383. N-[2-(2-Фтор)фенэтил]-N'-(2-бензотиазолил)тиомочевина.
По методике примера 105 2-фторфенэтиламин конденсируют с 1-(2-аминобензотиазол)-1-имидазолтиокарбонилом, полученным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,63 (к, 2H, бензо), 7,32 (м, 4H, бензо, ФРh), 7,1 (к, 2H, ФРh), 4,06 (т, 2H, CH2), 3,11 (т, 2H, CH2).
Пример 384. N-[2-(2-Фтор)фенэтил]-N'-[2-(4-метил)тиазолил]тиомочевина.
По методике примера 105 2-фторфенэтиламин конденсируют с 1-(2-амино-4-метилтиазол)-1-имидазолтиокарбонилом, полученным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,23 (м, 2H, ФРh), 7,06 (м, 2H, ФРh), 6,34 (д, J = 1 Гц, 1H, тиазол), 3,99 (т, 2H, CH2), 3,05 (м, 2H, CH2), 2,2 (д, J = 0,9 Гц, 3H, Me).
Пример 385. N-[2-(2,5-Дифтор)фенэтил]-N'-[2-(4-метил)тиазолил]тиомочевина.
По методике примера 105 2,6-дифторфенэтиламин конденсируют с 1-(2-амино-4-метилтиазол)-1-имидазолтиокарбонилом, полученным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,19 (м, 1H, ДФРh), 6,87 (т, 2H, ДФРh), 6,35 (с, 1H, тиазол), 3,98 (т, 2H, CH2), 3,09 (т, 2H, CH2), 2,22 (с, 3H, Me).
Пример 386. N-[2,2-Диметил-2-(2-хлор-6-фтор)фенэтил] -N'- (2-тиазолил)тиомочевина.
К охлажденному до -60oC раствору 2-хлор-6-фторфенилацетонитрила (1,69 г, 10 ммоль) в сухом ТГФ (70 мл) добавляют литийдиизопропиламид (5,25 мл, 10,5 ммоль). Через 30 мин к реакционной смеси добавляют метилйодид (0,68 мл, 11 ммоль), смесь медленно нагревают до 0oC и выдерживают 1 ч при той же температуре. Затем снова охлаждают до -60oC и добавляют дополнительное количество литийдиизопропиламида (6 мл, 12 ммоль). Через 30 мин добавляют метилйодид (1,87 мл, 30 ммоль). Реакционную смесь оставляют нагреваться до комнатной температуры, выдерживают при этой температуре 2 ч после чего переносят в раствор гидрокарбоната натрия и экстрагируют хлороформом. Органическую фазу промывают водой, сушат и растворитель испаряют в вакууме. Полученный в качестве продукта 2,2-диметил-2-(2-хлор-6-фтор)ацетонитрил выделяют колоночной хроматографией на силикагеле.
1H-ЯМР (CDCl3), δ : 7,25 (м, 2H, Ph), 7,03 (м, 1H, Ph), 1,98 (с, 3H, Me), 1,96 (с, 3H, Me).
2,2-Диметил-2-(2-хлор-6-фторфенил)этиламин получен восстановлением 2,2-диметил-2-(2-фтор-6-фторфенил)ацетонитрила хлоридом кобальта и боргидридом натрия по методике (приведенной в работе: L.S.Heizman. J. Am. Chem. Soc. , 104, с. 6801, 1980). Затем полученный амин конденсируют по методике примера 105 с 1-(2-аминотиазол)-1'-имидазолтиокарбонилом. Указанное соединение выделено колоночной хроматографией на силикагеле.
1H-ЯМР (CDCl3), δ : 7,35-7,09 (м, 3H, Ph), 6,95 (д, 1H, тиазол), 6,73 (д, 1H, тиазол), 4,09 (д, 2H, CH2), 1,7 (с, 6H, Me).
Пример 387. N-[2-(5-Бром-2-метокси)фенэтил] -N'-[2-(4-метил) тиазолил] тиомочевина.
По методике примера 105 5-бром-2-метоксифенэтиламин конденсируют с 1-(2-амино-4-метилтиазол)-1'-имидазолтиокарбонилом, полученным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,31 (д, 1H, Ph), 7,29 (с, 1H, Ph), 6,72 (д, 1H, Ph), 6,34 (с, 1H, тиазол), 3,95 (т, 2H, CH2), 3,79 (с, 3H, MeO), 2,96 (т, 2H, CH2), 2,23 (с, 3H, Me).
Пример 388. N-[2-(5-Бром-2-метокси)фенэтил] -N'-[2-(4-циано) тиазолил] тиомочевина.
По методике примера 105 5-бром-2-метоксифенэтиламин конденсируют с 1-(2-амино-4-цианотиазол)-1-имидазолтиокарбонилом, полученным способом примера 103. Указанное соединение очищено колоночной хроматографией на силикагеле.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,51 (тиазол), 7,32 (д, 1H, Ph), 7,27 (с, 1H, Ph), 6,76 (д, 1H, Ph), 3,9 (т, 2H, CH2), 3,83 (с, 3H, MeO), 2,97 (т, 2H, CH2).
Пример 389. N-[2-(2,6-Дифтор(фенэтил] -N'-[2-(4-циано)тиазолил] тиомочевина.
По методике примера 105 2,6-дифторфенэтиламин конденсируют с 1-(2-амино-4-цианотиазол)-1'-имидазолтиокарбонилом, полученным по методике примера 103. Указанное соединение кристаллизовано из хлористого метилена.
1H-ЯМР (CDCl3 + CD3OD), δ : 7,51 (с, 1H, тиазол), 7,22 (м, 1H, ДФРh), 6,9 (т, 2H, ДФРh), 3,93 (т, 2H, CH2), 3,08 (с, 2H, CH2).
Пример 390. N-[2-(2,6-Дифтор)фенэтил]-N'-(2-имидазолил) тиомочевина.
Это соединение получено по методике примера 93 с использованием 2,6-дифторфенэтиламина и 2-аминоимидазола.
1H-ЯМР (ДMCO + D2O), δ : 7,28 (м, 1H, ДФРh), 7,02 (т, 2H, ДФРh), 6,78 (ш. полоса, 1H, имидазол), 6,62 (ш. полоса, 1H, имидазол), 3,79 (т, 2H, CH2), 2,97 (т, 2H, CH2).
Пример 391. N-[1-1-Амино-2-(5-имидазолил)этил]-N'-[2-(5-метил) тиазолил] тиомочевина.
1-[2-(5-Метил)аминотиазол] -1'-имидазолтиокарбонил (получен по методике примера 103 с использованием 2-амино-5-метилтиазола вместо 2-аминотиазола) (910 мг, 4,06 моль) и гистамин (450 мг, 4,05 ммоль) в диметилформамиде (10 мл) нагревают 3 ч при 50oC. Смесь концентрируют и распределяют между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органический слой сушат над MgSO4 и после концентрирования получают 463 мг (43%) указанного соединения.
1H-ЯМР (250 МГц, ДMCO-d6), δ : 2,18 (с, 3H), 2,8 (м, 2H), 6,57 (с, 1H), 6,9 (с, 1H), 7,6 (с, 1H).
Пример 392. 1-(2-Амидо-5-бромпиридил)-1-(имидазолил) тиокарбонил.
Смесь 2-амино-5-бромпиридина, 97% (25 г, 140 ммоль) и 1,1'-тиокарбонилдиимидазола, 90% (27,72 г, 140 ммоль) в 300 мл ацетонитрила перемешивают примерно сутки при комнатной температуре и затем фильтруют. Высушиванием осадка в вакууме получают 37,5 г (95%) указанного соединения в виде сырого продукта, хранимого и используемого в последующих реакциях конденсации с разнообразными фенэтиламинами.
Пример 393. 1-(5-Хлорпирид-2-ил-тиокарбамоил)имидазол.
В реакционной колбе на 500 мл при перемещении и 50oC в 400 мл ацетонитрила растворяют N, N-тиокарбонилдиимидазол (60 г, 337 ммоль) и к раствору после охлаждения до 20oC добавляют 2-амино-5-хлорпиридин (43 г, 337 ммоль).
Раствор перемешивают 35 мин и выдерживают примерно сутки при комнатной температуре. Раствор фильтруют с получением кристаллической массы, состоящей из гранул и игл. Гранулы отделяют механически и очищают псевдоожижением с помощью воздуходувки и получением указанного соединения.
1H-ЯМР (ДMCO-d6), δ : 7,1-7,2 (2H, с, имид), 7,5-7,6 (1H, д, орто-связь, пир.), 7,9-8 (1H, с, имид.), 8,1-8,2 (1H, дв. д, пир.), 8,6-8,7 (1H, д, мета-связь, пир.).
Пример 394. N-2-(2,5-Диметоксифенэтил)-N'-2- (6-фторбензотиазолил)тиомочевина.
Смесь 450 мг 2,5-диметоксифенэтиламина (2,5 ммоль) и 740 мг 1-{[2-(6-фтор)бензотиазолил]тиокарбамоил}имидазола (2,5 ммоль) (см. пример 80) в 5 мл ацетонитрила кипятят полчаса. Смесь охлаждают и кристаллы отфильтровывают. Перекристаллизацией из смеси этанола с диметилформамидом получают 640 мг чистого продукта в виде мелких игл, т. пл. 196oC.
1H-ЯМР: 3 (2H, т), 3,77 (3H, с), 3,84 (3H, с), 3,91 (2H, м), 6,91-7,03 (3H, м), 7,38 (1H, м), 7,7 (1H, м), 7,94 (1H, м), 9,9 (1H, ш.с), 12 (1H, ш. с).
Найдено,%: C 55,3; H 4,7; N 10,75.
C18H18FN3O2S2
Вычислено,%: C 55,22; H 4,63; N 10,73.
Пример 395. N-2-(2,5-Диметоксифенэтил)-N'-[2-(4-метил)тиазолил] тиомочевина.
Смесь 1000 мг (4,46 ммоль) 1-[2-(4-метилтиазолил)тиокарбамоил] имидазола (получен аналогично 1-[(2-тиазолил)тиокарбамоил]имидазолу из примера 103) и 800 мг 2,5-диметоксифенэтиламина (4,42 ммоль) в 7 мл ацетонитрила кипятят полчаса. Смесь охлаждают до 0oC, кристаллы отфильтровывают, ополаскивают ацетонитрилом и сушат. Перекристаллизацией из смеси этанол/диметилформамид получают 1,42 г чистого продукта, т. пл. 210oC.
1H-ЯМР (ДMCO-d6): 2,27 (3H, с), 2,96 (2H, т), 3,78 (3H, с), 3,83 (3H, с), 3,84 (2H, м), 6,73 (1H, с), 6,85-7,04 (3H, м).
Найдено, %: C 53,1; H 5,65; N 12,35.
C15H19N3O2S2
Вычислено, %: C 53,39; H 5,67; N 12,45.
Пример 396. N-2-(2,5-Диметоксифенэтил)-N'-(2-бензотиазолил) тиомочевина.
Смесь 556 мг 1-(2-бензотиазолил)тиокарбамоил]имидазола (2 ммоль) (пример 66) и 2,5-диметоксифенэтиламина (2 ммоль) в 5 мл ацетонитрила кипятят полчаса. Перекристаллизацией из смеси этанол/диметилформамид получают 565 мг чистого продукта.
1H-ЯМР (ДMCO-d6): 3,02 (2H, т), 3,77 (3H, с), 3,85 (3H, с), 3,93 (2H, м), 6,92-7,04 (3H, м), 7,38 (1H, м), 7,53 (1H, м), 7,7 (1H, м), 8,01 (1H, м).
Найдено, %: C 57,95; H 5,15; N 11,25.
C18H19N3O2S2
Вычислено, %: C 57,88; H 5,13; N 11,25.
Пример 397. N-2-(2,6-Дихлорфенэтил)-N'-(2-тиазолил)тиомочевина.
К смеси 5 г литийалюминийгидрида и 200 мл эфира по каплям прибавляют 9,3 г 2,6-дихлорфенилацетонитрила в 50 мл диэтилового эфира. Смесь нагревают до кипения и кипятят 2 ч. Смесь охлаждают до комнатной температуры, по каплям прибавляют 5 мл воды и затем 5 мл 25%-ной водной гидроокиси натрия. После прибавления 10 мл воды смесь фильтруют и к перемешиваемому фильтрату быстро добавляют 10 мл уксусной кислоты. Осадившийся 2,6-дифторфенэтиламмонийацетат отфильтровывают и сушат.
В 5 мл ацетонитрила смешивают 500 мг 2,6-дихлорфенэтиламмонийацетата (2 ммоль), 0,42 г 1-(2-аминотиазол)-1'-имидазолтиокарбонила (пример 103) и 0,5 г диизопропиламина и смесь кипятят 30 мин. Смесь выдерживают 17 ч при 0oC и кристаллы отфильтровывают. Перекристаллизацией из ацетонитрила получают 265 мг указанного соединения.
1H-ЯМР (ДMCO-d6): 3,3 (2H, т), 3,9 (2H, м), 7,2 (1H, д), 7,35-7,6 (4H, м).
Пример 398. N-2-(2,6-Дихлорфенил)-N'-[2-(4-метил)тиазолил]тиомочевина.
В 5 мл ацетонитрила смешивают 500 мг 2,6-дихлорфенэтиламмонийацетата (2 ммоль) (см. пример 397), 0,48 г 1-[2-4-метилтиазолил)тиокарбамоил]имидазола (получен аналогично 1-[(2-тиазолил)тиокарбамоил]имидазолу из примера 103) (2 ммоль) и 0,5 г диизопропилэтиламина и смесь кипятят 30 мин. Перекристаллизацией из ацетонитрила получают 598 мг указанного соединения.
1H-ЯМР (ДMCO-d6): 2,2 (3H, с), 3,3 (2H, т), 4 (2H, м), 6,7 (1H, с), 7,4 (1H, м), 7,5 (2H, м), 9,8 (1H, ш.с), 11,7 (1H, ш.с).
Найдено, %: C 45,45; H 3,9; N 12,55.
C13H13Cl2N3S2
Вычислено, %: C 45,09; H 3,78; N 12,13.
Пример 399. N-[2-(2,6-Дихлорфенил)этил]-N'-(2-бензотиазолил)тиомочевина.
В 5 мл ацетонитрила смешивают 500 мг 2,6-дихлорфенэтиламмонийацетата (2 ммоль) (см. пример 397), 0,55 г 1-[2-бензотиазолил)тиокабамоил]имидазола (2 ммоль) (см. пример 66) и 0,5 г диизопропилэтиламина и смесь кипятят 30 мин. Смесь охлаждают и кристаллы отфильтровывают. Перекристаллизацией из ацетонитрила получают 497 мг указанного соединения.
1H-ЯМР (ДMCO-d6): 3,3 (2H, т), 4 (2H, м), 7,3-7,7 (6H, м), 8 (1H, д), 10 (1H, широкий пик), 12,1 (широкий пик).
Найдено, %: C 50,3; H 3,45; N 11,1.
C16H13Cl2N3S2
Вычислено, %: C 50,26; H 3,43; N 10,99.
Пример 400. N-[2-(2,6-Дихлорфенил)этил]-N'-[2-(6-фторбензотиазолил)]тиомочевина.
В 5 мл ацетонитрила смешивают 500 мг 2,6-дихлорфенэтиламмонийацетата (2 ммоль) (см. пример 397), 0,59 г 1-{[2-(6-фтор)бензотиазолил]тиокарбамоил} имидазола (2 ммоль) (см.пример 80) и 0,5 г диизопропилэтиламина и смесь кипятят 30 мин. Смесь охлаждают и кристаллы отфильтровывают. Перекристаллизацией из ацетонитрила получают 548 мг указанного соединения.
1H-ЯМР (ДMCO-d6): 3,4 (2H, т) 4 (2H, м), 7,3-7,4 (2H, м), 7,5-7,7 (2H, м), 8 (1H, м), 9,8 (1H, широкий пик), 12 (1H, широкий пик).
Найдено, %: C 48,25; H 3,1; N 10,6.
C16H12Cl2FN3S2
Вычислено,%: C 48; H 3,02; N 10,5.
Пример 401. N-[2-(2,6-Дифтор-3-метоксифенил)этил]-N'-(2-тиазолил)тиомочевина.
К раствору 10 ммоль 2,4-дифторанизола в 30 мл диэтилового эфира по каплям прибавляют 6,25 мл 1,6 M раствора н-бутиллития в гексане. Температуру смеси в ходе прибавления поддерживают при -65oC. Затем добавляют 3 мл диметилформамида и смесь оставляют медленно (1 ч) нагреваться до комнатной температуры. Смесь переносят в делительную воронку, содержащую 50 мл ледяной воды. Эфирный слой отделяют, промывают 50 мл воды и сушат над Na2SO4. Растворитель испаряют, а остаток вновь растворяют в 50 мл этанола. Добавляют 2 г ацетата аммония и 3 мл нитрометана и смесь кипятят 3 ч. Растворитель испаряют, а остаток распределяют между 50 мл дихлорметана и 50 мл воды. Органический слой сушат и растворитель испаряют. Кристаллизацией из холодного этанола получают 480 мг коричневых кристаллов 1-нитро-2-(2,6-дифтор-3-метоксифенил)этена.
1H-ЯМР (CDCl3): 3,9 (3H, с), 6,9-7,1 (2H, м), 7,8 (1H, д), 8,1 (1H, д).
В 50 мл тетрагидрофурана растворяют 420 мг 1-нитро-2-(2,6-дифтор-3-метоксифенил)этена и полученный раствор при перемешивании прибавляют к раствору 2 г литийалюминийгидрида в 50 мл тетрагидрофурана. Смесь кипятят 3 ч. Полученный амин обрабатывают прибавлением по каплям 2 мл воды с последующим прибавлением 2 мл 25%-ной водной гидроокиси натрия и затем 4 мл воды.
Смесь фильтруют и фильтрат экстрагируют 1 M HCl ( 2 х 20 мл). Водный слой подщелачивают добавлением 50 мл 45%-ного раствора гидроокиси натрия, после чего экстрагируют дихлорметаном (3 х 50 мл). Полученный испарением растворителя 2-(2,6-дифтор-3-метоксифенил)этиламин достаточно чист для использования на следующей стадии.
1H-ЯМР: 1,2 (2H, ш.с), 2,6 (2H, м), 2,7 (2H, м), 3,65 (3H, с.), 6,4-6,6 (2H, м).
Смесь 172 мг 2-(2,6-дифтор-3-метоксифенил)этиламина (1 ммоль) и 210 мг 1-(2-аминотиазол)-1'-имидазолтиокарбонила (1 ммоль) в 5 мл ацетонитрила кипятят 1 ч. Раствор охлаждают и оставляют на ночь для кристаллизации. Твердые вещества отфильтровывают и перекристаллизацией из ацетонитрила получают 138 мг указанного соединения.
1H-ЯМР (ДMCO-d6): 3,1 (2H, т), 3,8-4 (5H, м), 6,9-7,2 (3H, м), 7,4 (1H, д), 9,8 (1H, широкий пик), 11,7 (1H, широкий пик).
Найдено, %: C 47,6; H 4,1; N 12,75.
C13H13F2N3OS2
Вычислено, %: C 47,4; H 3,98; N 12,76.
Пример 402. N-[2-(2-Бензотриазолил)этил]-N'-(2-тиазолил)тиомочевина.
В 700 мл диметилформамида растворяют 59,5 г (0,5 моль) бензотриазола, к раствору добавляют 160 г (1,5 моль) карбоната натрия и затем по каплям прибавляют 73,5 г (0,6 моль) этилхлорацетата. Перемешиваемую смесь медленно нагревают до 40oC и выдерживают при этой температуре 17 ч. Растворитель испаряют, а остаток экстрагируют этилацетатом. ГХ показала образование одного преобладающего и одного меньшего продукта. Образовавшийся в меньшем количестве этиловый эфир 2-(2-бензотриазолил)уксусной кислоты выделен дробной кристаллизацией из холодной смеси этанола с этилацетатом.
В 50 мл смеси диэтиловый эфир/тетрагидрофуран (1:1) растворяют 7,1 (40 ммоль) полученного эфира, после чего прибавляют 1,5 г боргидрида лития и реакционную смесь перемешивают 17 ч при комнатной температуре. Растворитель удаляют и заменяют 50 мл бутанола. Добавляют 5 мл воды и температуру медленно повышают примерно до 50oC. После 4 ч выдерживания при этой температуре растворитель удаляют, остаток распределяют между дихлорметаном и водой. Органический слой сушат и образовавшийся 2-(2-бензотриазолил)этанол выделяют кристаллизацией из холодного этанола.
В 200 мл диэтилового эфира растворяют 4,7 г 2-(2-бензотриазолил)этанола (28,8 ммоль) и к раствору добавляют 2,28 г пиридина (28,8 ммоль). Смесь охлаждают до -50oC и к ней добавляют 8,18 г трифлинового ангидрида (29 ммоль). Смесь извлекают из охлаждающей бани и оставляют нагреваться до комнатной температуры. Смесь фильтруют без доступа влаги и добавляют к охлажденному до -40oC раствору примерно 150 мл аммиака в 50 мл диэтилового эфира. Полученную смесь оставляют нагреваться до комнатной температуры и эфир удаляют. Добавляют 50 мл 2 M HCl и полученную смесь промывают хлористым метиленом. Водную фазу подщелачивают добавлением 25%-ного раствора гидроокиси натрия и экстрагируют хлористым метиленом (3 х 25 мл). Испарением растворителя получают 2,1 г 2-(2-бензотриазолил)этиламина, используемого на следующей стадии без дополнительной очистки.
В 3 мл ацетонитрила смешивают 324 мг (2 ммоль) 2-(2-бензотриазолил)этиламина и 420 мг 1-(2-аминотиазол)-1'-имидазолтиокарбонила, смесь медленно нагревают до кипения и затем охлаждают для кристаллизации продукта. Повторной кристаллизацией из ацетонитрила получают 234 мг чистой N-[2-(2-бензотриазолил)этил]-N'-(2-тиазолил)тиомочевины.
1H-ЯМР (ДMCO-d6): 4,5 (2H, м), 5,1 (2H, м), 6,75 (1H, д), 7,05 (1H, д), 7,4 (2H, м), 7,9 (2H, м).
13C-ЯМР: 47, 56, 112, 119, 127, 145, 180.
Найдено, %: C 47,3; H 3,95; N 27,2.
C12H12N6S2
Вычислено, %: C 47,35; H 3,97; N 27,61.
Пример 403. цис-/транс-N-[2-(2-Этоксифенилциклопропанил)]-N'-(2-пиридил)тиомочевина.
Раствор 28,56 г метилтрифенилфосфонийбромида (80 ммоль) в 500 мл тетрагидрофурана охлаждают до -50oC и при перемешивании по каплям прибавляют 50 мл н-бутиллития в гексане (примерно 1,6 М, 80 ммоль). Смесь медленно нагревают до комнатной температуры и выдерживают при этой температуре 2 ч. Затем смесь охлаждают до -30oC и добавляют 12 г (80 ммоль) 2-этоксибензальдегида. Смесь нагревают до комнатной температуры, большую часть растворителя удаляют, остаток смешивают с 400 мл эфира и фильтруют. Растворитель удаляют и к остатку добавляют этилацетат. Раствор пропускают через слой силикагеля. Сырой 2-этоксистирол растворяют в 50 мл дихлорметана и используют в таком виде на следующей стадии реакции.
Добавляют 0,1 г CuI и смесь нагревают до кипения. Затем в течение 1 ч по каплям прибавляют 8,8 г этилдиазоацетата в 30 мл дихлорметана. ГХ-анализ показал образование двух продуктов в примерном отношении 1:2. Два изомерных продукта отделяют от других продуктов реакции колоночной хроматографией (силикагель, смеси гексан/этилацетат). В результате получено 3,1 г цис-/транс-смеси 2-(2-этоксифенил)-1-карбоксиэтилциклопропана. Полученную смесь гидролизуют в кипящей смеси 50 мл этанола и 10 мл воды 4 г гидроокиси натрия (2 ч). Растворитель испаряют, остаток подкисляют 100 мл 2М соляной кислоты и экстрагируют дихлорметаном (2 х 50 мл). Органическую фазу высушивают и растворитель испаряют. Добавляют 50 мл толуола с последующим прибавлением 6 г тионилхлорида. Смесь нагревают 1 ч при 80oC и растворитель затем удаляют. Добавляют ацетон (100 мл), раствор охлаждают в бане со льдом, добавляют 4 г азида натрия в 20 мл воды и 100 мл толуола, после чего смесь промывают водой (3 x 50 мл). Органический слой сушат над Na2SO4, растворитель испаряют, остаток растворяют в 100 мл диоксана. Диоксановый раствор медленно нагревают до кипения и кипятят 30 мин. Добавляют 25 мл концентрированной соляной кислоты и смесь кипятят 2 ч. Растворитель удаляют, а остаток распределяют между 50 мл дихлорметана и 50 мл 2M соляной кислоты. Водный слой подщелачивают добавлением 50 мл 25%-ного раствора гидроокиси натрия и экстрагируют дихлорметаном (3 x 50 мл). Дихлорметан испаряют, а остаток очищают колоночной хроматографией (силикагель, смеси этанола с этилацетатом) с получением цис-/транс-смеси (примерно 1:1) 2-(2-этоксифенил)циклопропиламина.
В 5 мл ацетонитрила перемешивают 2 ч 0,24 г (2,6 ммоль) 2-аминопиридина и 0,46 г (2,6 ммоль) тиокарбонилдиимидазола. Затем добавляют 0,41 г (2,6 ммоль) циклопропиламинов, температуру смеси медленно повышают до 70oC и перемешивают при этой температуре 17 ч. Растворитель испаряют, а указанное соединение выделяют колоночной хроматографией (силикагель, смеси гексан/этилацетат).
1H-ЯМР : 1,15-1,25 (5H, м), 2,5 (1H, м), 3,42 (0,55H, м), 3,73 (0,45H, м), 4-4,1 (2H, к), 6,7-8,15 (8H, м).
Пример 404. N-[2-(2-Пиридил)этил]-N'-[2-(5-хлорпиридил)] тиомочевина.
В 15 мл ацетонитрила перемешивают в течение 2 ч 1,73 г (10 ммоль) 2-амино-5-хлорпиридина и 1,78 г (10 ммоль) тиокарбонилдиимидазола. Добавляют 1,47 г (12 ммоль) 2-(2-аминоэтил)пиридина и смесь перемешивают 2 ч при комнатной температуре. Затем реакционную смесь нагревают до 50oC и перемешивают 17 ч. После охлаждения смеси кристаллы отфильтровывают. Перекристаллизацией из ацетонитрила получают чистое указанное соединение.
1H-ЯМР (ДMCO-d6): 3,2 (2H, т), 4,1 (2H, м), 7,2-7,5 (3H, м), 7,8-8 (2H, м), 8,2 (2H, д), 8,7 (1H, м), 18 (1H, с), 11,5 (1H, с).
Пример 405. N-[2-(2-Пиридил)этил]-N'-[2-(5-бром)пиридил]тиомочевина.
В 15 мл ацетонитрила перемешивают 2 ч 1,28 г (10 ммоль) 2-амино-5-бромпиридина и 1,78 г (10 ммоль) тиокарбонилдиимидазола. Затем добавляют 1,47 г (12 ммоль) 2-(2-аминоэтил)пиридина и смесь перемешивают 2 ч при комнатной температуре. Реакционную смесь нагревают до 50oC и перемешивают 17 ч. После охлаждения смеси кристаллы отфильтровывают. Перекристаллизацией из ацетонитрила получают чистое указанное соединение.
1H-ЯМР (ДMCO-d6): 3,5 (2H, т), 4,2 (2H, м), 7,2 (2H, д), 7,9-8,1 (3H, м), 8,3 (1H, д), 8,6 (1H, м), 8,9 (1H, д), 10,9 (1H, с), 11,4 (1H, т).
Пример 406. N-[2-(2-Пиридил)этил]-N'-[2-(5-нитро)пиридил] тиомочевина.
В 20 мл тетрагидрофурана растворяют 1,39 г (10 ммоль) 2-амино-5-нитропиридина, к раствору добавляют 0,68 г этоксида натрия, смесь нагревают до 50oC и перемешивают 30 мин. Смесь охлаждают и большую часть жидкости декантируют с образовавшегося красного осадка. Осадок переносят в 20 мл ацетонитрила, после чего добавляют 1,78 г тиокарбонилдиимидазола в 10 мл ацетонитрила. Полученную смесь перемешивают 10 мин при комнатной температуре, добавляют 1,22 г 2-(2-аминоэтил)пиридина и смесь перемешивают 1 ч. Добавляют 1 мл уксусной кислоты и растворитель испаряют. Остаток промывают водой и неоднократной кристаллизацией из ацетонитрила получают 1,28 г указанного соединения в виде желтых кристаллов.
1H-ЯМР (ДMCO-d6): 3,1 (2H, т), 3,2 (2H, т), 7,2 (1H, м), 7,3 (3H, м), 7,7 (1H, м), 8,4 (1H, м), 8,5 (1H, м), 8,9 (1H, д).
Пример 407. N-[2-(2-Пиридил)этил]-N'-[2-(5-метил)пиридил]тиомочевина.
Смесь 1,78 г тиокарбонилдиимидазола (10 ммоль) и 1,58 г 2-амино-5-метилпиридина (10 ммоль) в 15 мл ацетонитрила перемешивают 1 ч при комнатной температуре. Добавляют 1,22 г 2-(2-аминоэтил)пиридина и смесь перемешивают 1 ч при комнатной температуре, а затем 17 ч при 50oC. Смесь охлаждают и кристаллы отфильтровывают. Перекристаллизацией из ацетонитрила получают 1,3 г чистого указанного соединения.
1H-ЯМР (ДMCO-d6): 2,2 (3H, с), 3,1 (3H, т), 4 (2H, м), 7 (1H, д), 7,2 (1H, м), 7,3 (1H, д), 7,6 (1H, м), 7,7 (1H, м), 7,8 (1H, м), 8,6 (1H, м).
13C-ЯМР:17,3; 36,3: 44; 112,1; 121,7; 123,5; 126,7; 136,6; 139,7; 144,6; 149,2; 151,8; 159; 179,2.
Пример 408. N-[2-(2-Пиридил)этил] -N'-[2-(5-бром)пиридил] тиомочевина, HCl-соль.
Примерно в 10 мл воды суспендируют 100 мг N-[2-(2- пиридил)этил]-N'-[2-(5-бром)пиридил] тиомочевины (см. пример 405), суспензию нагревают примерно до 90oC и добавлением соляной кислоты устанавливают pH около 3. Указанное соединение выделяют сушкой вымораживанием.
1H-ЯМР (ДMCO-d6) : 3,6 (2H, т), 4,2 (2H, м), 7,2 (2H, д), 7,9-8,1 (3H, м), 8,3 (1H, д), 8,6 (1H, м), 8,9 (1H, д), 10,9 (1H, с), 11,4 (1H, т).
Пример 409. N-[2-(2-Пиридил)этил] -N'-[2-(5-хлор)пиридил] тиомочевина, HCl-соль.
Примерно к 10 мл воды добавляют 100 мг N-[2-(2-пиридил)этил]- N'-[2-(5-хлор)пиридил] тиомочевины (примерно 404), суспензию нагревают примерно до 90oC и добавлением соляной кислоты устанавливают pH около 3. Указанное соединение выделяют сушкой вымораживанием.
1H-ЯМР (ДMCO-d6): 3,6 (2H, т), 4,2 (2H, м), 7,3 (1H, д), 8-8,2 (3H, м), 8,3 (1H, м), 8,6 (1H, м), 9 (1H, м), 10,9 (1H, с), 11,4 (1H, т).
Пример 410. N-[2-(2-Бензотриазолил)этил]-N'-[2-(5-бром)пиридил] тиомочевина.
Смесь 356 мг (2 ммоль) тиокарбонилдиимидазола и 346 мг (2 ммоль) 2-амино-5-бромпиридина в 2 мл ацетонитрила перемешивают 1 ч при комнатной температуре. Добавляют 324 мг (2 ммоль) 2-(2-бензотриазолил)этиламина (см. пример 402), перемешивают 10 мин и затем нагревают до кипения. Спустя 20 мин добавляют еще 5 мл ацетонитрила и 3 мл диметилформамида с образованием прозрачного раствора. Раствор охлаждают и образовавшийся осадок центрифугируют. Перекристаллизацией из смеси ацетонитрил/диметилформамид получают 310 мг чистого указанного соединения.
1H-ЯМР (ДMCO-d6): 4,44 (2H, м), 5,15 (2H, м), 7,18 (1H, д), 7,56 (2H, м), 7,9 (1H, д), 8,04 (3H, м), 10,93 (1H, с), 11,41 (1H, с).
13C-ЯМР, ч/млн: 44, 55, 114, 118, 118, 127, 142, 144, 146, 152, 180.
Пример 411. N-[2-(2,6-Дифтор-3-метоксифенил)этил]-N'-[2-(5-бром) пиридил]тиомочевина.
В 3 мл ацетонитрила смешивают 334 мг (2 ммоль) 2-(2,6-дифтор-3-метоксифенил)этиламина (см. пример 401), MB 167,2, и 566 мг (2 ммоль) 1-{2-[5-бром)пиридил] тиокарбамоил} имидазола (см. пример 392), MB 283,15. Смесь медленно нагревают до кипения, после чего охлаждают для кристаллизации. Неоднократной перекристаллизацией из ацетонитрила получают 238 мг чистого указанного соединения.
1H-ЯМР (ДMCO): 3,12 (2H, т), 3,86 (3H, с), 4 (2H, м), 6,82 (3H, м), 7,68-7,72 (1H, м), 8,12 (1H, д), 9,16 (1H, с), 11,35 (1H, с).
Пример 412. N-(3,4,5-Триметоксибензил)-N'-(2-тиазолил) тиомочевина.
Исходный 3,4,5-триметоксибензиламин получен восстановлением 3,4,5-триметоксибензонитрила хлоридом кобальта и боргидридом натрия по общей методике (приведенной в работе: L.S.Heinzman, J.Am.Chem.Soc., 104, с. 6801, 1980).
В 70 мл метанола растворяют 3,4,5-триметоксибензонитрил (965 мг, 5 ммоль) и хлорид кобальта (2,37 г, 10 ммоль) и к раствору добавляют боргидрид натрия (1,89 г, 50 ммоль). Через 3 ч реакционную смесь фильтруют через целит и концентрируют до небольшого объема. Остаток переносят в этилацетат и экстрагируют 1 н. HCl (100 мл). Органическую фазу отбрасывают. Водную фазу подщелачивают водным аммиаком и экстрагируют хлороформом. Органическую фазу сушат над сульфатом магния и после испарения получают 427 мг 3,4,5-триметоксибензиламина.
1H-ЯМР (CDCl3), δ : 6,58 (с, 2H, TMPh), 3,85 (м, 6H, 2 x MeO), 3,82 (с, 3H, MeO), 3,8 (м, 2H, CH2).
Указанное в заголовке соединение получено по методике примера 105.
1H-ЯМР (CDCl3), δ : 7,26 (д, 1H, тиазол), 6,85 (д, 1H, тиазол), 6,64 (с, 2H, TMPh), 4,84 (д, J = 5,7 Гц, 2H, CH2), 3,86 (м, 6H, MeO), 3,85 (с, 3H, MeO).
13C-ЯМР (CDCl3), ε : 177 (C=S), 161 (тиазол), 153, (TMPh), 138 (TMPh), 137 (тиазол), 132 (TMPh), 111 (тиазол), 104 (TMPh), 61 (MeO), 56 (MeO), 50 (CH2).
Пример 413. 2-Формил-3-фторпиридин.
В колбу на 1 л в токе сухого азота при -60oC загружают сухой этиловый эфир (500 мл), н-BuLi (1,6 M в гексане, 62,5 мл, 0,1 моль) и сухой 1,4-диазабицикло[2,2,2] октан (ДАБЦО) (11,56 г, 0,1 моль) и образовавшийся мутный раствор перемешивают 1 ч при -20oC. Смесь охлаждают до -75oC, по каплям прибавляют раствор 3-фторпиридина (9,81 г, 0,1 моль) в этиловом эфире и перемешивание продолжают 1,5 ч при -60oC. Температуру вновь понижают до -75oC, по каплям прибавляют раствор сухого N,N-диметилформамида (8,52 мл, 0,11 моль) в этиловом эфире (50 мл) и смесь перемешивают 2 ч при -75oC. При -10oC медленно добавляют воду (175 мл), водный слой экстрагируют этилацетатом (5х200 мл) и объединенные экстракты сушат над безводным сульфатом натрия. После удаления растворителя получают темно-коричневое масло, из которого вакуумной разгонкой и очисткой хроматографией на силикагеле получают 4,4 г (35%) указанного соединения в виде снежно-белых кристаллов, т.пл. 48-49oC.
ИК (CHCl3), см-1: 3071, 3020, 2873, 2842, 1720, 1588, 1461, 1441.
1H-ЯРМ (300 МГц, CDCl3), ε : 10,21 (с, 1H), 8,62 (м, 1H), 7,57 (м, 2H).
МС (FD), m/e: 125 (M+).
УФ (EtOH): 263 нм ( δ = 1551), 201 нм ( ε = 2188).
Пример 414. 2-Гидроксиметил-3-фторпиридин.
Раствор 2-формил-3-фторпиридина (4 г, 32 ммоль) и боргидрида натрия (309 мг, 8 ммоль) в абсолютном этаноле (40 мл) перемешивают 15 мин при 0oC и 1 ч при комнатной температуре. Реакционную смесь нейтрализуют насыщенным водным раствором хлорида аммония (5 мл) и фильтруют через диатомовую землю с удалением твердых веществ. Фильтрат испаряют и полученное белое твердое вещество растворяют в этилацетате с водой. Водный слой экстрагируют этилацетатом (5 х 30 мл) и сушат над безводным сульфатом натрия. Удалением растворителя получают 3,78 г (93%) указанного соединения в виде бледно-желтого масла.
ИК (CHCl3), см-1: 3607, 3439, 3019, 1607, 1576, 1451, 1416, 1312, 1257, 1218, 1209, 1167, 1105, 1053, 857, 803.
1H-ЯРМ (300 МГц, CDCl3), ε : 8,38 (м, 1H), 7,39 (м, 1H), 7,26 (м, 1H), 4,83 (с, 2H), 3,73 (ш.с, 1H).
МС (FD), m/e: 127 (M+).
УФ (EtOH): 263 нм (δ = 2796), 201 нм ( δ = 3651).
Найдено, %: C 56,45; H 4,97; N 10,89.
C6H6FNO
Вычислено, %: C 56,69; H 4,76; N 11,02.
Пример 415. 2-Хлорметил-3-фторпиридин, гидрохлорид.
К охлажденному до -10oC раствору 2-гидроксиметил-6-фторпиридина (3,43 г, 27 ммоль) в дихлорметане (30 мл) по каплям в течение 5 мин прибавляют неразбавленный тионилхлорид (4,4 мл, 60 ммоль) и полученный бледно-зеленый раствор перемешивают 3 ч при -10oC. Последующим испарением досуха получают 4,66 г (95%) указанного соединения в виде снежно-белых кристаллов.
ИК (CHCl3), см-1: 2984, 1732, 1551, 1470, 1452, 1333, 1286, 1273, 1237, 1219, 1208, 1193, 1094, 905, 863, 806.
1H-ЯРМ (300 МГц, CDCl3), ε : 8,69 (м, 1H), 8,06 (м, 1H), 7,89 (м, 1H), 5,09 (с, 2H).
МС (FD), m/e: 145 (M+, свободное основание), 147 (M+2, свободное основание).
Пример 416. 2-Цианометил-3-фторпиридин.
Раствор гидрохлорида 2-хлорметил-3-фторпиридина (4,85 г, 26,7 ммоль) и цианида калия (3,47 г, 53,4 ммоль) в 50 мл метана и 20 мл воды перемешивают примерно при 55oC 17 ч. Полученный черный раствор концентрируют при пониженном давлении до масла, которое растворяют в этилацетате с водой и добавлением сухого карбоната натрия устанавливают pH 11,5. Водный слой подсоливают хлоридом натрия, экстрагируют этилацетатом (7 х 40 мл), объединенные экстракты сушат над безводным сульфатом натрия. Удалением растворителя получают 3,6 г (99%) указанного соединения в виде черного твердого вещества.
ИК (CHCl3), см-1 : 3019, 3011, 2977, 1708, 1603, 1578, 1454, 1412, 1259, 1222, 1219, 1215, 1161, 1097, 1047, 804.
1H-ЯРМ (300 МГц, CDCl3), ε : 8,43 (м, 1H), 7,42 (м, 1H), 7,33 (м, 1H), 3,97 (с, 1H), 3,96 (с, 1H).
МС (FD), m/e : 136 (M+).
УФ (EtOH) : 263 нм (δ = 3719), 203 нм ( δ = 3707).
Пример 417. 2-Аминоэтил-3-фторпиридин.
К раствору 2-цианометил-3-фторпиридина в абсолютном этаноле (75 мл) и 5 н. соляной кислоте (0,3 мл) добавляют в качестве катализатора оксид платины (0,64 г) и смесь гидрируют 1 ч под давлением 60 psi (4,2 кг/см2) в аппарате для гидрирования Парра. Катализатор отфильтровывают, фильтрат концентрируют при пониженном давлении до коричневого масла, масло растворяют в воде (40 мл) и этилацетате (10 мл) и добавлением концентрированной соляной кислоты устанавливают pH 0,9. Слои разделяют, этилацетатный слой экстрагируют 1 н. HCl (1 х 10 мл), водные кислотные экстракты объединяют и промывают этилацетатом (4 х 30 мл). В водном слое устанавливают pH 10,8, экстрагируют дихлорметаном (6 х 30 мл) и объединенные экстракты сушат над безводным сульфатом натрия. Удалением растворителя получают 1,58 г (70%) указанного соединения в виде коричневого масла.
ИК (CHCl3), см-1: 2969, 2873, 1632, 1602, 1575, 1550, 1450, 1414, 1359, 1246, 1219, 1203, 1169, 1093.
1H-ЯРМ (300 МГц, CDCl3), ε : 8,31 (м, 1H), 7,29 (м, 1H), 7,13 (м, 1H), 3,03 (м, 4H), 1,8 (ш.с, 2H).
МС (FD), m/e: 140 (M+).
Титрование (66% ДМФА/H2O).
Пример 418. 1-{[2-(5-Хлор)пиридил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (4,95 г, 25 ммоль) и 2-амино-5-хлорпиридина (3,28 г, 25 ммоль) в ацетонитриле (75 мл) перемешивают 23 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 3,42 г (57%) указанного соединения.
ИК (KBr), см-1: 3218, 3090, 1599, 1572, 1551, 1529, 1471, 1455, 1390, 1375, 1340, 1310, 1228, 1183, 1109, 1053, 939, 831.
1H-ЯРМ (300 МГц, ДMCO-d6), ε : 8,58 (м, 1H), 8,25 (м, 1H), 8,05 (ш.с, 1H), 8,03 (м, 1H), 7,65 (м, 1H), 7,15 (д, J = 8 Гц, 1H), 6,8 (с, 1H).
МС (FAB), m/e: 239 (M+1).
УФ (EtOH): 305 нм ( ε = 15141), 273 нм ( ε = 14730), 226 нм ( δ = 11407), 203 нм ( ε = 16456).
Пример 419. 1-{[2-(5-Бром)пиридил]тиокарбамоил}имидазол.
Раствор 1,1'-тиокарбонилдиимидазола (4,95 г, 25 ммоль) и 2-амино-5-бромпиридина (4,46 г, 25 ммоль) в ацетонитриле (75 мл) перемешивают 23 ч при комнатной температуре. Фильтрованием образовавшегося осадка получают 5,42 г (76%) указанного соединения.
ИК (KBr), см-1: 3218, 3088, 1594, 1565, 1550, 1465, 1387, 1370, 1340, 1309, 1251, 1196, 1182, 1096, 1053, 938, 828.
1H-ЯРМ (300 МГц, ДMCO-d6), ε : 8,57 (м, 1H), 8,3 (м, 1H), 8,15 (м, 1H), 8,03 (ш.с, 1H), 7,75 (м, 1H), 7,15 (д, J= 8 Гц, 1H), 6,8 (с, 1H).
МС (FAB), m/e: 284 (M+1).
УФ (EtOH): 304 нм ( ε = 13932), 274 нм ( ε = 13051), 230 нм ( δ = 11098), 204 нм ( ε = 17821).
Пример 420. N-{2-[2-(3-Фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина.
Раствор 1-{[2-(5-бром)пиридил]тиокарбамоил}имидазола (1,42 г, 5 ммоль) и 2-аминоэтил-3-фторпиридина (0,7 г, 5 ммоль) в N,N-диметилформамиде (20 мл) перемешивают 3 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, насыщенным водным раствором бикарбоната натрия и рассолом. Органический слой сушат над безводным сульфатом натрия, концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 0,33 г (19%) указанного соединения в виде белого вещества, т.пл. 184-187oC.
ИК (KBr), см-1: 3161, 3023, 1597, 1579, 1555, 1524, 1488, 1473, 1447, 1364, 1342, 1315, 1236, 1221, 1172, 1142, 1087, 833.
1H-ЯРМ (300 МГц, ДMCO-d6), ε : 11, 38 (м, 1H), 10,64 (с, 1H), 8,41 (м, 1H), 8,14 (д, J= 2Гц, 1H), 7,91 (м, 1H), 7,63 (м, 1H), 7,33 (м, 1H), 7,06 (д, J= 9,0 Гц, 1H), 4,01 (м, 2H), 3,1 (т, J= 6Гц, 2H).
МС (FD), m/e: 355 (M+), 357 (M+2).
УФ (EtOH): 305 нм ( ε = 13169), 273 нм ( δ = 25811), 201 нм ( ε = 17493).
Пример 421. N-{2-[2-(3-фтор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина.
Раствор 1-{[2-(5-хлор)пиридил]тиокарбамоил}имидазола (2,39 г, 10 ммоль) и 2-аминоэтил-3-фторпиридина (1,4 г, 10 ммоль) в N,N диметилформамиде (25 мл) перемешивают 3 ч при 95oC. Реакционную смесь охлаждают до комнатной температуры, переносят в этилацетат и промывают водой, насыщенным водным раствором бикарбоната натрия и рассолом. Органический слой сушат над безводным сульфатом натрия, концентрируют и очисткой твердого остатка хроматографией на силикагеле получают 0,96 г (31%) указанного соединения в виде снежно-белого вещества, т.пл. 170-173oC.
ИК (KBr), см-1: 3167, 3022, 1603, 1583, 1554, 1524, 1492, 1474, 1449, 1367, 1342, 1317, 1238, 1222, 1173, 1142, 1087, 835, 803.
1H-ЯРМ (300 МГц, ДMCO-d6), ε : 11,39 (м, 1H), 10,65 (с, 1H), 8,42 (м, 1H), 8,07 (д, J = 2 Гц, 1H), 7,81 (м,1H), 7,63 (м, 1H), 7,33 (м, 1H), 7,11 (д, J = 9 Гц, 1H), 4,01 (м, 2H), 3,1 (т, J = 6 Гц, 2H).
МС (FD), m/e: 310 (M+), 312 (M+2).
УФ (EtOH): 305 нм ( α = 11338), 272 нм ( α = 23394).
Пример 422. (+) и (-) N-(цис-2-Фенилциклопропил)-S- δ -метоксифенилацетамид.
В 100 мл дихлорметана растворяют S- δ -метоксифенилуксусную кислоту (2 г, 12 ммоль) и к раствору добавляют оксалилхлорид (1,36 мл, 16 ммоль) вместе с 2 каплями N,N-диметилформамида. Раствор перемешивают в атмосфере азота и при комнатной температуре 120 мин. Растворитель и избыток реагента удаляют в роторном испарителе. Маслянистый остаток растворяют в дихлорметане (100 мл) и к раствору добавляют DL-цис-фенилциклопропиламин (см. пример 202) (2 г, 15 ммоль) в пиридине (5 мл). Раствор перемешивают 15 мин и затем добавляют диэтиловый эфир (200 мл). Остаток отфильтровывают и раствор испаряют. Остаточную кристаллическую диастереомерную смесь очищают вытеснительной хроматографией с элюированием смесью этилацетат/толуол/дихлорметан (1:2:2). Испарением фракций, содержащих более быстро элюирующийся продукт, получают продукт A. Испарением медленнее элюирующихся фракций получают продукт B.
A. 1H-ЯРМ (35 мг в 0,6 мл CDCl3, 294K): 0,99-1,06 (1H,м), 1,29-1,38 (1H, м), 2,29-2,38 (1H, к), 3 (3H, с), 3,07-3,17 (м), 4,41 (1H, с), 6,3 (1H), 7,16-7,32 (10H,м).
13C-ЯМР: 11,18; 21,83; 27,82; 57,11; 83,68; 126,34; 126,43; 128,08; 128,18; 128,26; 128,78; 136,15; 136,85; 171,75; 171,75.
Вычислено для C18H19N, %: C 76,84; H 6,8; N 4,99, т. пл. 136,7-137,1oC.
B. 1H-ЯМР (те же условия, что и для A): 1,09-1,16 (1H, к), 1,32-1,41 (1H, к), 2,24-2,38 (1H, к), 3,1-3,2 (4H, м), 4,45 (1H, с), 6,4 (1H), 6,95-6,99 (2H, м), 7,15-7,27 (7H, м).
13C-ЯМР: 10,69; 21,82; 27,85; 56,87; 83,63; 126,35; 126,87; 128; 128,13; 128,19; 128,83; 135,88; 136,54; 171,55.
Вычислено для C18H19N, %: C 76,84; H 6,8; N 4,9, т. пл. 143,6-144,7oC.
Пример 423. (-)-цис-2-Фенилциклопропиламин.
Соединение A (1,2 г) кипятят 4 ч в смеси вода/диоксан (концентрированный водный)/соляная кислота (1:1:1). Раствор разбавляют водой, промывают дихлорметаном, подщелачивают гидроокисью аммония (водное концентрирование), экстрагируют дихлорметаном, сушат над сульфатом натрия, фильтруют и после испарения получают указанное соединение в виде масла.
1H-ЯМР (CDCl3), [α]
Пример 424. (+)-цис-2-Фенилциклопропиламин.
Соединение B (1,2 г) кипятят 4 ч в смеси вода/диоксан (концентрированный водный)/соляная кислота (1:1:1). Раствор разбавляют водой, промывают дихлорметаном, подщелачивают гидроокисью аммония (концентрированной водной), экстрагируют дихлорметаном, сушат над сульфатом натрия, фильтруют и после концентрирования получают в виде масла указанное соединение.
1H-ЯМР (CDCl3), δ, ч/млн: 0,8-0,9 (1H, CH2, м), 1,1-1,2 (1H, CH2, м), 2-2,1 (1H, PhCH, к), 2,6-2,7 (1H, CHNH2, м), 7,1-7,4 (5H, Ph).
[α]
Пример 425. (-)-N-(цис-2-Фенилциклопропил)-N'-(5-хлорпирид-2-ил) тиомочевина.
(+)-N-цис-2-Фенилциклопропиламин (0,23 г, 1,7 ммоль) из примера 424 конденсируют по методике примера 372 с 1-(5-хлорпирид-2-ил-тиокарбамоил)имидазолом с образованием указанного соединения в виде кристаллов, т. пл. 189,6-191,3oC.
1H-ЯМР (CDCl3), δ, ч/млн: 1,2-1,3 (1H, м, CH2), 1,5-1,6 (1H, м, CH2), 2,5-2,6 (1H, к, PhCH), 3,7-3,8 (CHN), 6,6-6,7 (1H, д, пир.), 7,2-7,5 (7H, Ph, пир.), 8,9-9 (1H, NH), 10,8-10,9 (1H, NH).
[α]
Пример 426. (+)-N-(цис-2-Фенилциклопропил)-N'-(5-хлорпирид-2-ил) тиомочевина.
(-)-N-цис-2-Фенилциклопропиламин (0,23 г, 1,7 ммоль) из примера 423 конденсируют по методике примера 372 с 1-(5-хлорпирид-2-ил-тиокарбамоил)имидазолом с образованием указанного соединения в виде кристаллов, т. пл. 189,2-191,8oC.
1H-ЯМР (CDCl3), [α]20 , ч/млн: 1,2-1,3 (1H, м, CH2), 1,5-1,6 (1H, м, CH2), 2,5-2,6 (1H, к, PhCH), 3,7-3,8 (CHN), 6,6-6,7 (1H, д, пир.), 7,2-7,5 (7H, Ph, пир.), 8,9-9 (1H, NH), 10,8-10,9 (1H, 11H).
[α]20 = +59,3o (c = 1, CHCl3).
Пример 427. (-)-N-(цис-2-Фенилциклопропил)-N'-(5-бромпирид-2-ил) тиомочевина.
Проводят реакцию между (+)-N-цис-2-фенилциклопропиламином из примера 424 с 2-амино-5-бромпиридином по методикам примеров 93 и 94 с использованием 2-амино-5-бромпиридина вместо 2-аминотиазола и получают указанное соединение в виде кристаллов, т. пл. 192-193oC.
1H-ЯМР (CDCl3): 1,19-1,26 (м, 1H), 1,47-1,55 (м, 1H), 2,52 (к, 1H), 3,66-3,75 (м, 1H), 6,66 (дв. д, 1H), 7,27-7,41 (м, 5H), 7,47 (д, 1H), 7,6 (дв. д, 1H), 8,98 (ш.с, 1H), 10,88 (ш.с, 1H).
α = -52,8o (c = 1, CHCl3).
Пример 428. (+)-N-(цис-2-Фенилциклопропил)-N'-(5-бромпирид-2-ил) тиомочевина.
По методикам примеров 93 и 94 проводят реакцию между (-)-N-цис-2-фенилциклопропиламином из примера 423 и 2-амино-5-бромпиридином, который используют вместо 2-аминотиазола, и получают указанное соединение в виде кристаллов, т. пл. 195,5-196,5oC.
1H-ЯМР (CDCl3): 1,19-1,26 (м, 1H), 1,47-1,55 (м, 1H), 2,52 (к, 1H), 3,66-3,75 (м, 1H), 6,66 (дв. д, 1H), 7,27-7,41 (м, 5H), 7,47 (д, 1H), 7,6 (дв. д, 1H), 8,98 (ш.с, 1H), 10,88 (ш.с, 1H).
[α]20 = +50o (c = 1, CHCl3).
Пример 429. N-(2-Винилфенетил)-N'-(5-бромпирид-2-ил) тиомочевина.
Раствор 2-метоксифениламина (10 г, 66 ммоль, Janssen) нагревают в 50 мл 47%-ной HBr до 120oC в течение 12 ч. В реакционную смесь добавляют раствор NaOH и промывают простым эфиром. Доводят pH до 8 и экстрагируют простым эфиром, получая 2,1 г 2-гидроксифенетиламина. Амин растворяют в дихлорметане (50 мл) и добавляют 2,8 мл триэтиламина. К раствору добавляют 2,85 мл бензилхлорформиата при 5oC. После прохождения реакции в течение 1 ч при комнатной температуре реакционную смесь выливают в дихлорметан и солевой раствор. Органический слой сушат (сульфат натрия) и выпаривают, получая неочищенный продукт, который далее очищают на силикагелевой колонке, элюируя этилацетатом 3 и гексаном 7, получая 2,0 г Cbz-защищенного 2-гидроксифенетиламина. Полученное соединение (271 г) растворяют в дихлорметане и подвергают взаимодействию с ангидридом трифлиловой кислоты (185 мл) при -70oC в присутствии DMAP (610 мг), получая после очистки на окиси алюминия (элюент - дихлорметан) 251 мг Cbz-защищенного 2-трифлилоксифенетиламина. Это соединение подвергают взаимодействию с три-n-бутилвинилстаннатом в присутствии Pd (II) и хлорида лития по методике, описанной в J.Am.Chem.Soc., p. 5478-5486, 1987. После снятия защиты TMS-1 полученный 2-винилфенетиламин превращают в целевое соединение, используя методику, описанную в примере 345.
1H-ЯМР (250 МГц, CDCl3): 1,21 (т, 2H), 3,97 (к, 2H), 5,32 (дв. д, 1H), 6,71 (д, 1H), 7,10 (дв. д, 1H), 7,23-7,55 (м, 1H), 7,70 дв. д, 1H), 8,04 (д, 1H), 8,86 (широкий с, 1H), 11,21 (широкий с, 1H).
Пример 430. N-(3-Этинилфенетил)-N'-(5-бромпирид-2-ил) тиомочевина.
Cbz-защищенный 3-трифлилоксифенетиламин, полученный из 3-метоксифенетиламина (Janssen) по методике, описанной в примере 429, подвергают реакции с TMS-ацетиленом в присутствии Pd (II) по методике, описанной в Tetrahedron Letters, p. 6403-6406, 1993), получая Cbz-защищенный 3-этинилфенетиламин. После удаления защитной группы (NaOH) полученный 3-этинилфенетиламин превращают в целевое соединение по методике, описанной в примере 345, т. пл. 162,5-163,5oC.
1H-ЯМР (250 МГц, CDCl3): 1,98 (т, 2H), 3,09 (с, 1H), 4,00 (к, 2H), 6,77 (д, 1H), 7,26-7,42 (м, 4H), 7,67 дв. д, 1H), 8,12 (д, 1H), 9,20 (широкий с, 1H), 11,26 (широкий с, 1H).
Пример 431. N-(3-Цианофенетил)-N'-(5-бромпирид-2-ил) тиомочевина.
Cbz-защищенный 3-трифлилоксифенетиламин, полученный из 3-метоксифенетиламина (Janssen) по методике, описанной в примере 429, подвергают реакции с KCN в присутствии Ni (II) и Zn по методике (описанной в J. Chem. Soc. Perkin Trans 1, p. 1365-1366, 1986). После удаления защитной группы TMS-1 полученный 3-цианофенетиламин превращают в целевое соединение по методике, описанной в примере 345, т. пл. 173,5-174,5oC.
1H-ЯМР (250 МГц, CDCl3): 3,08 (т, 2H), 4,01 (к, 2H), 6,79 (д, 1H), 7,41-7,59 (м, 4H), 7,73 (дв. д, 1H), 8,10 (д, 1H), 9,14 (широкий с, 1H), 11,32 (широкий с, 1H).
Пример 432. N-(3-Ацетилфенетил)-N'-(5-бромпирид-2-ил) тиомочевина.
Cbz-защищенный 3-трифлилфенетиламин, полученный из 3-метоксифенетиламина (Janssenn) по методике, описанной в примере 429, подвергают взаимодействию с CO в присутствии Pd (II), с 1,3-бис-(дифенилфосфино)пропаном, триэтлиламином и метанолом по методике (описанной в J. Chem. Soc. Chem. Commun, p. 904-905). Полученный Cbz-защищенный 3-метоксикарбонилфенетиламин гидролизуют водным LiOH и превращают в хлорид кислоты реакцией с тионилхлоридом. Полученный Cbz-защищенный 3-хлорформилфенетиламин подвергают взаимодействию с диметилкупратом (I) лития по методике (описанной в J. am. Chem., p. 5106-5108). После снятия защитной группы (TMS-1) полученный 3-ацетилфенетиламин превращают в целевое соединение по методике, описанной в примере 345, т. пл. 133,0-135,0oC.
1H-ЯМР (250 МГц, CDCl3): 2,59 (с, 3H), 3,08 (т, 2H), 6,72 (д, 1H), 7,39-7,51 (м, 2H), 7,70 (дв. д, 1H), 7,82-7,87 (м, 2H), 8,02 (д, 1H), 8,02 (д, 1H), 8,90 (широкий с, 1H), 11,26 (широкий с, 1H).
Пример 433. N-(2-Фенил-1-метилэтил)-N'-(тиазол-2-ил)тиомочевина.
2-Фенил-1-метилэтанол превращают в соответствующий амин по методике, описанной в примере 106. Амин конденсируют с продуктом из примера 103 при условиях реакции, описанных в примере 105, получая целевое соединение, т. пл. 118,5oC.
1H-ЯМР (CDCl3): 1,27 (3H), 2,80 (дв. д. 1H), 3,18 (дв. д, 1H), 4,75 (м, 1H), 6,79 (д. 1H), 7,23-7,29 (м, 6H).
Найдено, %: H 5,45; C 56,02; N 15,30.
C13H15N3S2
Вычислено, %: H 5,45; C 56,29; N 15,15.1
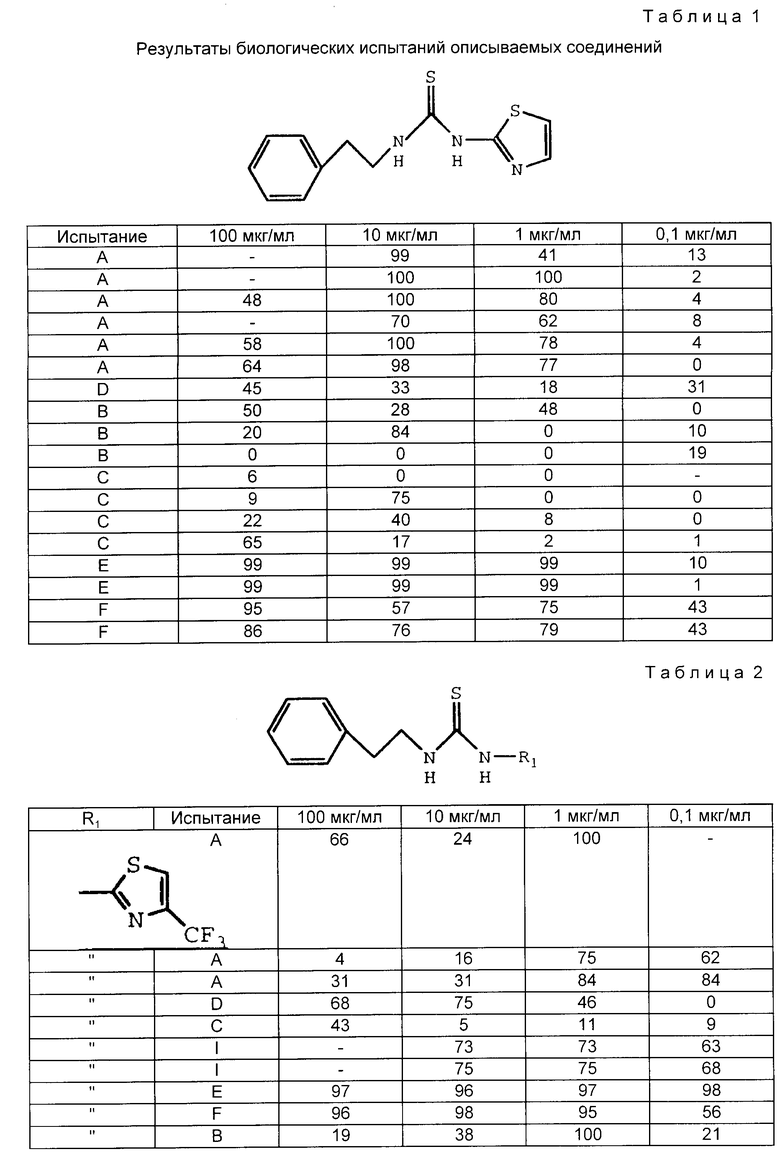
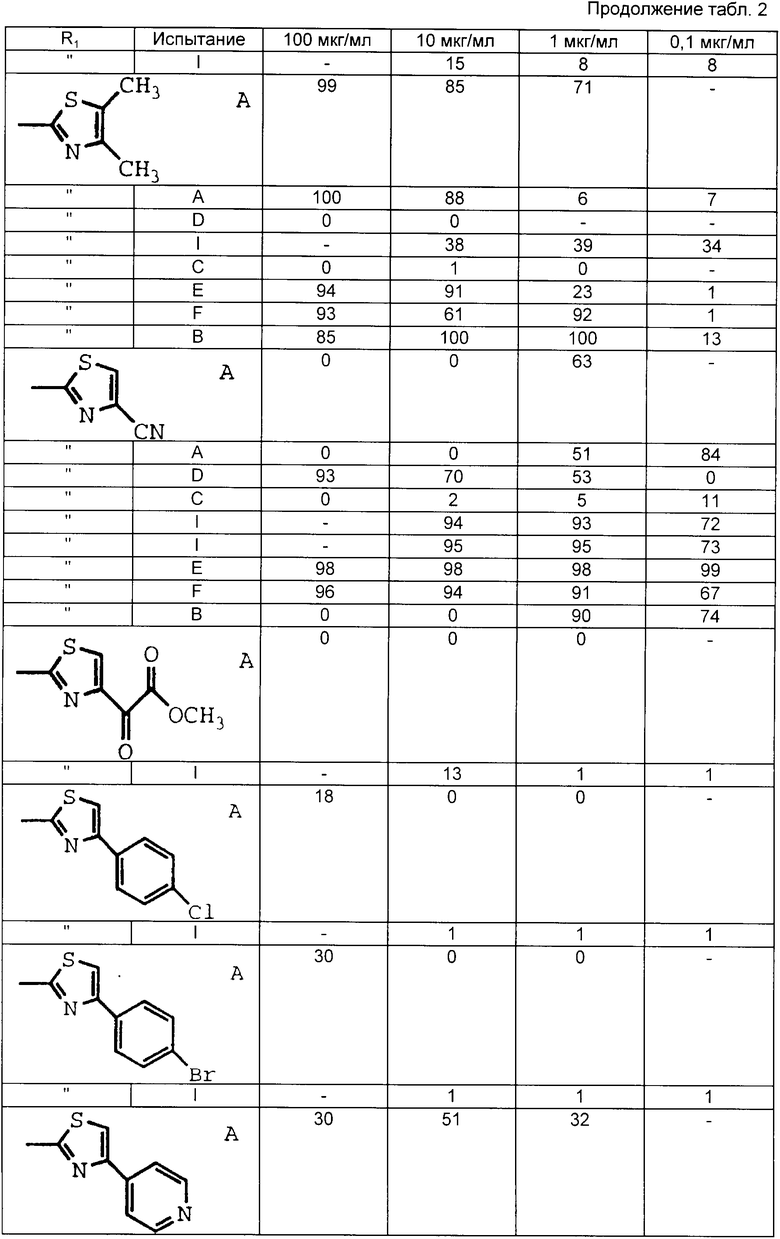
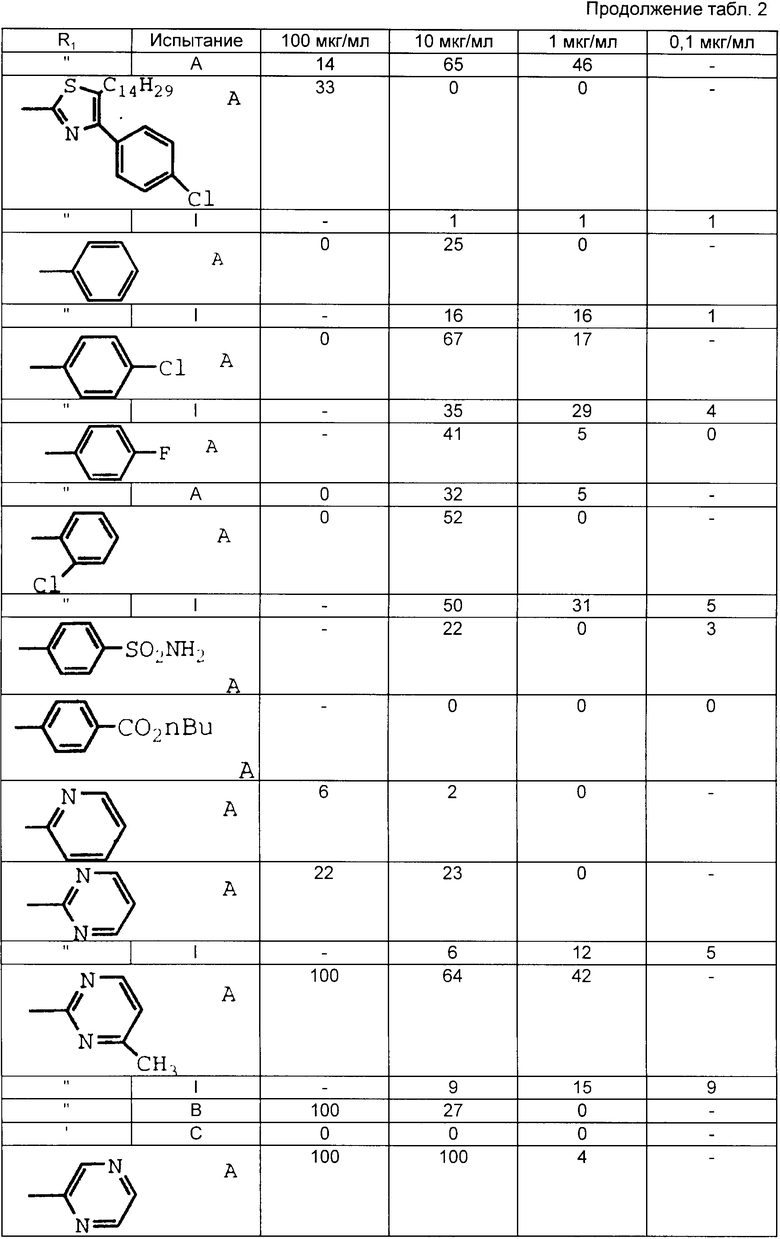


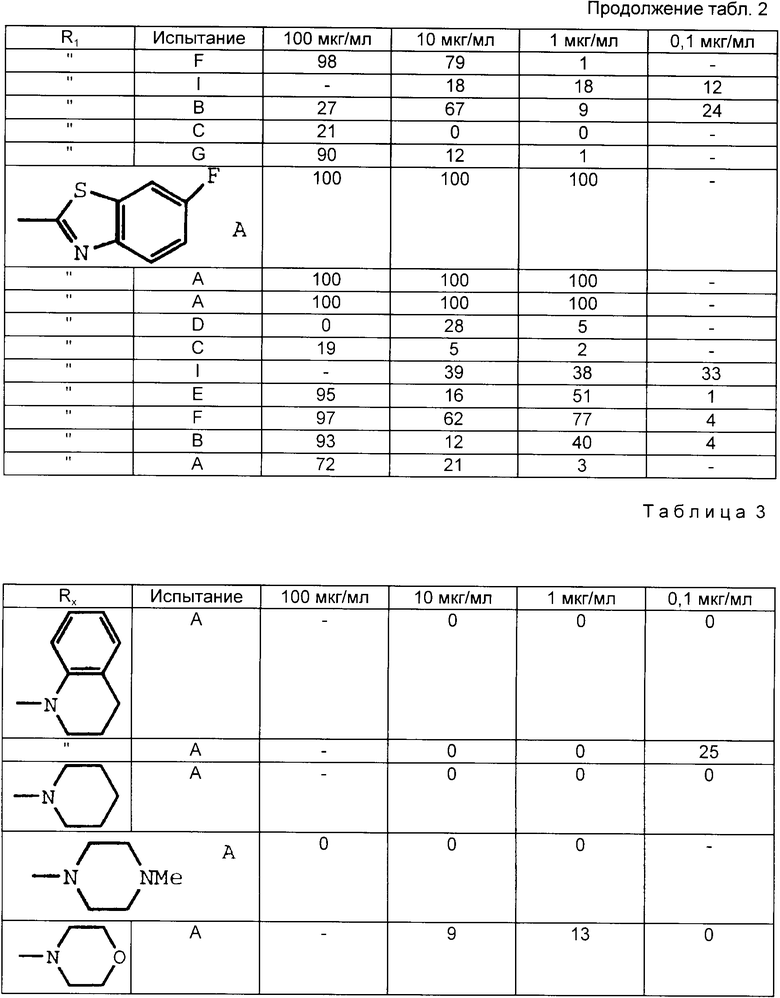



Использование: в медицине и биологии. Сущность изобретения - производные тиомочевины формулы I или их фармацевтически приемлемые соли (R5R6R8)C - CH(R9) - NH - C(=S) - NHR1, где R1 - 5-6-членные гетероциклы, содержащие азот, серу, незамещенные или замещенные алкилом C1 - C4, алкокси C1 - C3, CN, OH, CH3S, NO2, CF3, галогеном; R5 - арил, циклоалкил, гетероцикл; R6 - водород, метил; R8 и R9 - независимо водород или метил или R8 и R9 вместе с атомом углерода, к которому они присоединены, -циклопропил или циклобутил, или R6 и R8 вместе с атомом углерода, к которому они присоединены, - циклопропил; фармацевтическая композиция, обладающая ингибирующей активностью в отношении обратной транскриптазы вируса иммунодефицита человека, включающая в качестве активного начала эффективное количество производных формулы I. 7 табл., 4 с. и 16 з.п. ф-лы.
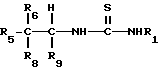
где R1 - бензотиазол, бензимидазол, имидазол, пиразинил, пиразолил, пиридил, пиридазинил, хинолинил, тетразолил, тиазолил, тиадиазолил, пиридил, пиридазинил, хинолинил, тетразолил, тиазолил, тиадиазолил или триазолил, которые необязательно могут быть замещены заместителями, выбранными из следующей группы: С1 - С4-алкил, С1 - С3-алкокси-, гидрокси-, метилтио-, нитрогруппа, галоген, трифторметил;
R5 представляет собой фенил, пиридил, пирролил, тиенил, бензотриазолил, бензоксазолил, нафтил, индолил, циклогексенил, любые из которых могут быть замещены вплоть до пяти положений заместителями, выбранными из следующей группы: амино-, азидо-, циано-, нитро-, гидроксигруппа, галоген, метил, винил, этинил, трифторметил, С1 - С3-алкокси-, фенокси-, фенил, метилендиоксигруппа, группа формулы -С(=О)R, где R представляет собой С1 - С3-алкил, ацетамидометил, карбоксамидометил;
R8 и R9 независимо представляют собой водород или метил или R8 и R9 вместе с атомами углерода, к которым они присоединены, образуют циклопропил или циклобутил;
R6 представляет собой водород или метил или R6 и R8 вместе с атомом углерода, к которому они присоединены, образуют циклопропил;
или их фармацевтически приемлемые соли при условии, что соединение формулы I не является соединением формулы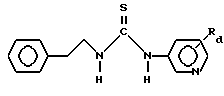
где Rd представляет собой водород, галоген, гидрокси-, алкил или алкоксигруппу, или R1 не представляет собой группу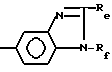
где Rе и Rf представляют низший алкил, или их соли.
R5 представляет пиридил, замещенный пиридил, фенил или замещенный фенил;
R8 и R9 вместе с атомами углерода, к которым они присоединены, образуют циклопропил.
N-(2-цис-фенилциклопропил)-N'-[2-(5-бром)пиридил]тиомочевина,
N-(2-цис-фенилциклопропил) N'-[2-(5-хлор)пиридил]тиомочевина,
N-(2-цис-пиридилциклопропил)-N'-(2-(5-бром)пиридил]тиомочевина,
N-[2-(цис-2-пиридил)циклопрорпил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[цис-2-(6-фтор)пиридил]циклопропил}-N'-[2-(5-бром)пиридил]тимочевина,
N-{2-[цис-2-(6-фтор)пиридил]циклопропил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[цис-2-(6-метокси)пиридил]циклопропил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{ 2-[цис-2-(6-метокси)пиридил)]циклопропил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[цис-2-(6-этокси)пиридил]циклопропил}-N'-[2-(5-бром)пиридил]тимочевина,
N-{ 2-[цис-2-(6-этокси)пиридил]циклопропил}-N'-[2-(5-хлор)пиридил]тиомочевина
или их соли.
R5 представляет собой циклогексенил, фенил или фенил, замещенный 1 - 4 раза метоксигруппой, этоксигруппой, бромом, метилом, фтором, хлором и их сочетаниями;
R8 и R9 независимо представляют водород или метил или их соли.
N-[2-метоксифенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-2-метоксифенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина,
N-[2-(2-метоксифенил)этил)-N'-[2-(4-этил)тиазолил]тимочевина,
N-[2-(2-метоксифенил)этил]- N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-метоксифенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2(4-циано)тиазолил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(3-метоксифенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2-этоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-этоксифенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2,6-дифторфенил)этил)-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[2-(5-бром)пиризинил]тиомочевина,
N-[2-(2,6-дифторфенил)этил]-N'-[3-(6-хлор)пиридазинил]тиомочевина,
N-[2-(2-фтор-6-метоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-фтор-6-метоксифенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2-хлорфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(2-хлорфенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(2-хлорфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-хлорфенил)этил]- N'-[2-(5-хлор)пирилил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(3-хлорфенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[2-(4-циано)тиазолил]тиомочевина,
N-[2-(1-циклогексенил) этил]-N'-[2-(4-трифторметил)тиазолил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[2-(4-этил)тиазолил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(1-циклогексенил)этил]-N'-[3-(6-хлор)пиридазинил]тиомочевина,
N-[2-(2,5-диметоксифенил)этил]-N'-[2-(5-хлор)пиразинил]тиомочевина,
N-[2-(2,5-диметоксифенил)этил] N'-[2-(5-бром)пиразинил] тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-триторметил)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-этил)пиридил]тиомочевина,
N-[2-(2-пиридил)этил]-N'-[2-(5-метил)пиридил]тиомочевина,
N-{2-[2-(6-метокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-метокси)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{-[2-(6-этокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тимочевина,
N-{2-[2-(6-этокси)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-(6-фтор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[2-(3-фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(3-фтор)пиридил]этил}-N'-[2-(5-хлор)пиридил}тиомочевина,
N-{2-[2-(6-хлор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(6-хлор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{2-[2-(3-метокси-6-фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N{2-[2-(3-метокси-6-фтор)пиридил]этил-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{ 2-[2-(5-этокси-6-фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{ 2-[2-(5-этокси-6 фтор)пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-{ 2-[2-(3-этокси-6-фтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(3-этокси-6-фтор)пиридил]этил}-N'-[2-(5-хлор)приридил]тиомочевина,
N-{2-(3,6-дифтор)пиридил]этил}-N'-[2-(5-бром)пиридил]тиомочевина,
N-{2-[2-(3,6-дифтор) пиридил]этил}-N'-[2-(5-хлор)пиридил]тиомочевина,
N-[2-(2,6-дифтор-3-метоксифенил)этил]-N'-[2-(5-бром)пиридил]тиомочевина,
или их соли.
| US, патент N 4724232, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| ЕР, заявка N 0384532, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| ЕР, заявка N 0357332, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-03-10—Публикация
1992-07-30—Подача