Изобретение относится к новым пептидам с брадикинин-антагонистическим действием, а также к способу их получения.
Брадикинин-антагонистические пептиды описываются в ВОИС 86/07263 и в европейских патентных заявках N 370453; 413277; 455133 и 472220.
Изобретение описывает новые пептиды с брадикинин-антагонистическим действием формулы I:
Z-P-A-B-C-E-F-K-(D)Q-G-M-F'y,
которой
Z - 9-флуоренилметилоксикарбонил (Fmoc), дибензилацетил, циклогексилкарбонил, N, N-дибензил-глицил, 2-(4-изобутилфенил)пропионил, 2-R-(трет-бутилсульфонилметил)-3-(1-нафтил)пропионил индол-3-ил ацетил, 6-(4-бензоил-бензоиламино)гексаноил, 1,8-нафталимидоацетил, 7-теофиллинацетил или N-бензоил;
P - прямая связь, Aoc, ε-аминогексаниол-D-Aoc, Aeq (Fmoc), 4-аминоциклогексилкарбонил или Oic;
A - (D)- или (L)- Arg, (D) или (L)- Lys или связь;
B - Arg;
C - Pro-Hyp-Gly;
E - Thia;
F - Ser;
K - прямая связь;
Q - Tic;
M - прямая связь;
G - цис-эндо, цис-экзо, транс-октагидроиндол-2-карбоновую кислоту;
F' - Arg;
y - OH.
Способ их получения, который заключается в том, что к полимерной смоле присоединяют N-терминальную защищенную аминокислоту формулы: Fmoc(Arg)Mtr OH, отщепляют N-терминальную защитную группу, проводят ступенчатое наращивание пептидной цепи и от полученного пептидилполимера отщепляют полимерную смолу и одну или несколько защитных групп, временно введенных для защиты других функций.
А также средство, обладающее брандикинин-антагонистической активностью, содержащее в качестве активного начала пептиды и фармацевтически приемлемые носители и добавки, отличающиеся тем, что в качестве активного вещества оно содержит пептиды формулы I в эффективном количестве.
Пептиды изобретения получают по общественным способам химии пептидов (Губен-Вейл. Методы органической химии, т. 15/2), предпочтительно посредством твердофазного синтеза, как, например, описано B.Merrifield, J. Qm. Chem. Soc. 85, 2149 (1963) или (R.C.Sheppard, Int.J.Peptide Protein Res, 21, 118 (1983), или известными эквивалентными способами. В качестве временных защитных для аминогруппы групп используют защитные для уретановых групп группы, как, например, трет-бутилоксикарбонил (Boc) - или флуоренилметил-оксикарбонил (Fmoc) защитная группа. Если необходимо для предотвращения побочных реакций или для синтеза специальных пептидов, функциональные группы в боковой цепи аминокислот дополнительно защищаются пригодными защитными группами (T. W.Greene. Protective Groups b Organicc Synthesis), причем в первую очередь используются Arg(Tos), Arg(Mts), Arg(Mtr), Arg(Pmc), Asp(OBzl), Asp(OBut), Cys(4-MeBzl), Cys(Acm), Cys(SBut), Glu(OBzl), Glu(OBut), His(Tos), His(Fmoc), His(Dnp), His(Trt), Lys(Gl-z), Lys(Boc), Met(O), Ser(Bzl), Ser(But), Thr(Bzl), Thr(But), Trp(Mts), Trp(CHO), Trp(Boc), Tyr(Br-Z), Tyr(Bzl) или Tyr(But).
Твердофазный синтез начинается на C-терминальном конце пептида с помощью сочетания защищенной аминокислоты с соответствующей смолой. Такого рода исходные материалы можно получать путем соединения защищенной аминокислоты с модифицированной с помощью хлорметильной, оксиметильной, бензгидриламино (BHA)-, метилбензгидриламино (MBHA)-группы полистирольной или полиакриламидной смолой через сложноэфирную, соответственно амидную связь. Используемые в качестве носителя смолы имеются в продаже. BHA и MBHA-смолы обычно применяют тогда, когда синтезированный пептид на C-конце должен содержать свободную карбамоильную группу. Если пептид должен содержать на C_терминальном конце вторичную амидную группу, то применяют хлорметил-, соответственно оксиметил-смолу и осуществляют отщепление с помощью соответствующих аминов. Если хотят получить, например, этиламид, то пептид можно отщеплять от смолы с помощью этиламина, причем отщепление защитных групп боковых цепей осуществляют затем благодаря другим пригодным реагентам. Если в пептиде должны сохраняться трет-бутильные защитные группы боковой цепи аминокислоты, то синтез осуществляют с помощью Fmoc-защитной группы для временного блокирования применяемой для удлинения цепи аминогруппы аминокислоты при применении описанной, например, R.C.Sheppard, f.Chem.Soc.,Chem.Comm. 1982, 587, методики, причем гуанидиновая функция аргинина защищается путем протонирования с помощью перхлората пиридиния и защита других, функционализированных в боковой цепи аминокислот осуществляется с помощью бензильных защитных групп, отщепляемых путем каталитического гидрирования (A.Felix и др., J.Org.Chem. 13, 4194/1978/) или благодаря натрию в жидком аммиаке (W.Roberts, J. Am. Chem. Soc. 76, 6203, (1954)).
После отщепления защитной для аминогруппы сцепленной со смолой аминокислоты с помощью пригодного реагента, такого, как, например, трифторуксусная кислота в метиленхлориде в случае Boc-защитной группы или 20%-ного раствора пиперидина в диметилформамиде в случае Fmoc-защитной группы, следующие защищенные аминокислоты сочетают друг за другом в желательной последовательности. Промежуточно образующиеся N-терминально защищенные пептидные смолы перед соединением с последующим производным аминокислоты деблокируются благодаря вышеописанным реагентам.
В качестве реагента сочетания можно применять всевозможные применяемые при синтезе пептидов реагенты активирования (Губен-Вейль. Методы органической химии, т. 15/2), в особенности, однако, карбодиимиды, например N,N'-дициклогексилкарбодиимид, N, N'-диизопропилкарбодиимид или N-этил-N'-(3-диметиламинопропил)-карбодиимид или урониевые соединения (например, TBTU, TOTU), которые, например, описаны у R.Knorr и др., b Tetrahedron Letters, т. 30, N 15, с. 1927-1930, 1989, или в европейской заявке на патент N 460446. Сочетание можно осуществлять при этом непосредственно путем добавления аминокислотного производного с активирующим реагентом и в случае необходимости с предотвращающей рацемизацию добавкой, например 1-оксибензотриазол (HOBt) (W.König, R. Geiger, Chem. Ber. 103, 708 (1970)) или 3-окси-4-оксо-3,4-дигидробензотриазин (HOObt) (W.König, R.Geiger, Chem. Ber. 103, 2054 (1970)) к смоле или, однако, предактивирование аминокислотного производного в виде симметричного ангидрида или HOBt-, соответственно HOObt сложного эфира можно осуществлять отдельно и раствор активированного соединения в пригодном растворителе добавляют к способной сочетаться пептидной смоле.
Сочетание, соответственно активирование аминокислотных производных с одним из вышеуказанных активирующих реагентов можно осуществлять в диметилформамиде, N-метилпирролидоне или метиленхлориде или в смеси из указанных растворителей. Активированное производное аминокислоты обычно используют в 1,5 - 4-кратном избытке. В случаях, в которых наступает неполное сочетание, реакцию сочетания повторяют, не осуществляя предварительно необходимого для сочетания самой ближайшей для сочетания аминокислоты деблокирования аминогруппы пептидной смолы.
Успешное протекание реакции сочетания можно проверять посредством реакции с нингидрином, как, например, описано E.Kaiser и др., Anal.Biochem. 34, 595 (1970). Синтез можно осуществлять также автоматизировано, например с помощью пептидного синтезатора модели 430A фирмы "Applied Biosystems", причем можно пользоваться либо предусмотренным изготовителем прибора программами синтеза, либо, однако, также разработанными самим потребителем. Последние используются в особенности при применении защищенных с помощью Fmoc-группы аминокислотных производных.
После синтеза пептидов вышеописанным образом пептид можно отщеплять от смолы с помощью реагентов, например жидкого фтороводорода (предпочтительно в случае полученных по Boc-методу пептидов) или трифторуксусной кислоты (предпочтительно в случае синтезированных по Fmoc-методу пептидов). Эти реагенты отщепляют не только пептид от смолы, но и также другие защитные группы боковых цепей аминокислотных производных. Таким образом получают при применении BHA- и MBHA-смол пептид в форме свободной кислоты. В случае BHA-, соответственно MBHA-смол при отщеплении с помощью фтороводорода или трифторметансульфокислоты получают пептид в виде амида кислоты. Другие способы получения пептидамидов описаны в европейских патентах A-287882 и A-322348. Здесь осуществляют отщепление петидамидов от смолы путем обработки обычно применяемыми в синтезе пептидов средней силы кислотами (например, трифторуксусная кислота), причем в качестве акцепторов катионов добавляют вещества, такие, как фенол, крезол, тиокрезол, анизол, тиоанизол, этандитиол, диметилсульфид, этиметилсульфид или подобные, обычные в твердофазном синтезе акцепторы катионов по отдельности или в виде смеси двух или более этих вспомогательных средств. Трифторуксусная кислота при этом может применяться разбавленной пригодным растворителем, например метиленхлоридом. Отщепление также можно осуществлять с помощью смеси из трифторуксусной кислоты, триметилсилилгалогенида (например, триметилсилилбромида) и фенола (например, м-крезола). Если нужно сохранить трет-бутильные, соответственно бензильные защитные группы боковых цепей пептидов, то отщепление синтезированного на особенно модифицированной смоле-носителе пептида осуществляют с помощью 1% трифторуксусной кислоты в метиленхлориде, как, например, описано у E.C.Sheppard, J. Chem. Soc., Chem. Comm., 1982, 587. Если нужно сохранить отдельные трет-бутильные, соответственно бензильные защитные группы боковых цепей, то применяют пригодную комбинацию методов синтеза и отщепления.
Для синтеза пептидов с C-терминальной карбамоильной группировкой или ω-амино-, соответственно ω-гуанидиноалкильной группировкой также применяют описанную Sheppard, модифицированную смолу-носитель. После синтеза полностью защищенной в боковой цепи пептид отщепляют от смолы и затем путем классического синтеза в растворе вводят во взаимодействие с соответствующим амином, соответственно ω-аминоалкиламином или ω-гуанидиноалкиламином, причем в случае необходимости имеющиеся другие функциональные группы известным образом можно временно защищать.
Другой способ получения пептидов с ω-аминоалкильной группировкой описан в европейском патенте A-264802.
Пептиды изобретения предпочтительно синтезируют при применении твердофазного способа согласно двум общим тактикам защитных групп.
Синтез осуществляют с помощью автоматического пептидного синтезатора модели 430A фирмы "Applied Biosystems" при применении Boc-, соответственно Fmoc-защитных групп для временного блокирования аминогруппы.
При применении Boc-защитной группы для синтеза используют запрограммированные изготовителем аппарата циклы синтеза.
Синтез пептидов со свободной на функционализированной соответствующей Boc-аминокислотой 4-(оксиметил)-фенил-ацетамидометилполистирольной смоле (R. B.Merrifield, J. Org. Chem. 43, 2845 (1978)) фирмы "Applied Biosystems". Для получения пептидамидов применяют MBHA-смолу той же фирмы. В качестве активирующих реагентов служат N, N'-дициклогексилкарбодиимид или N,N'-диизопропилкарбодиимид. Активирование осуществляется в виде симметричного ангидрида, в виде HOBt-сложного эфира или HOObt-сложного эфира в CH2Cl2, смесях CH2Cl2-ДМФ или NMP. Для сочетания используют 2-4 эквивалента активированного производного аминокислоты. Для случаев, в которых сочетание протекает неполностью, реакцию повторяют.
При применении Fmoc-защитной группы для временной защиты аминогруппы для синтеза с помощью автоматического пептидного синтезатора модели 430A фирмы "Applied Biosystems" вводят собственную программу синтеза. Синтез осуществляют на смоле на основе п-бензилоксибензилового спирта (S.Wang, J. Am. Chem. Soc. 95, 1328 (1973)) фирмы "Bachem", которая, согласно известным способам (E. Atherton и др., J.C.S.Chem. Comm., 1981, 336), этерифицирована до сложного эфира с помощью соответствующей аминокислоты. Активирование производных аминокислот в виде HOBt- или HOObt-сложных эфиров осуществляют прямо в поставляемом изготовителем прибора (аппарата) патроне с аминокислотой путем добавки раствора диизопропилкарбодиимида в ДМФ в предварительно взвешенную смесь из производного аминокислоты и HOBt или HOObt. Также могут использоваться полученные в виде вещества Fmoc-аминокислота-OObt-сложные эфиры, которые описаны в европейском патенте A-247573. Отщепление Fmoc-защитной группы осуществляют с помощью 20%-го раствора пиперидина в ДМФ в реакционном сосуде. Примененный избыток реакционноспособного производного аминокислоты составляет 1,5-2,5 эквивалента. Если сочетание неполное, то его повторяют, как и в случае Boc-метода.
Предлагаемые, согласно изобретению, пептиды индивидуально или в комбинации обладают брадикинин-антагонистическим действием, которое можно испытывать на различных моделях (см. Handbook of Exp. Pharmacol, т. 25, Springer Verlang, 1970, с. 53-55), так, например, на изолированной матке крыс, на подвздошной кишке морской свинки или на изолированной пульмональной артерии морской свинки.
Для испытания предлагаемых согласно изобретению пептидов на изолированной Arteria pulmonalis морских свинок (Dunkin Harley) весом 400-450 г умерщвляют ударом в затылок. Вскрывают грудную клетку и осторожно извлекают Arteria pulmonalis. Окружающую ткань тщательно удаляют и Arteria pulmonalis разрезают спирально под углом 45o. Полосы сосуда длиной 2,5 см и шириной 3-4 мм фиксируют во вмещающей 10 мл ванне для органа, которая заполнена раствором Рингера.
Состав раствора (в ммоль/д): NaCl = 154; KCl = 5,6; CaCl2 = 1,9; NaHCO3 = 2,4; глюкоза = 5,0.
Раствор продувают 95% O2 и 5% CO2 и нагревают при 37oC. PH-значение составляет 7,4; нагрузка (Vorlast) полос сосуда составляет 1,0 г.
Изометрические изменения сокращения охватываются с помощью Hebel-насадки и HF-Modem (измеритель пути) Hugo Sachs и регистрируются на регистрирующем самописце (BEC, Goerz Metrawatt SE 460).
После 1 ч уравновешивания начинают опыт. После того как полосы сосуда достигли своей максимальной чувствительности по отношению к 2•10-7 моль/л брадикинина - брадикинин ведет к сокращению полос сосуда, воздействуют пептидами в дозах 5•10-8 1•10-5 моль/л, смотря по обстоятельствам, в течение 10 мин и после нового введения брадикинина сравнивают снижение воздействия брадикинина по сравнению с контролем.
Для распознавания частичного агонистического эффекта пептиды применяют в дозах 1•10-5 oC1•10-3 моль/л.
Рассчитанные из кривых доза-действие значения IC50 предлагаемых согласно изобретению пептидов представлены в табл. 1.
В случае некоторых выбранных соединений при вышеописанном порядке осуществления опыта также определяют продолжительность, в течение которой полосы сосуда после замены пептидсодержащего на "чистый" буфер снова достигают своей полумаксимальной чувствительности по отношению к 2•10-7 моль/л брадикинина. Эта продолжительность обозначается как T50 и является масштабом для длительности действия. Определенные расчетным путем значения этой T50 представлены в табл. 2.
Выбранные соединения также исследуются ин виво по следующему тесту.
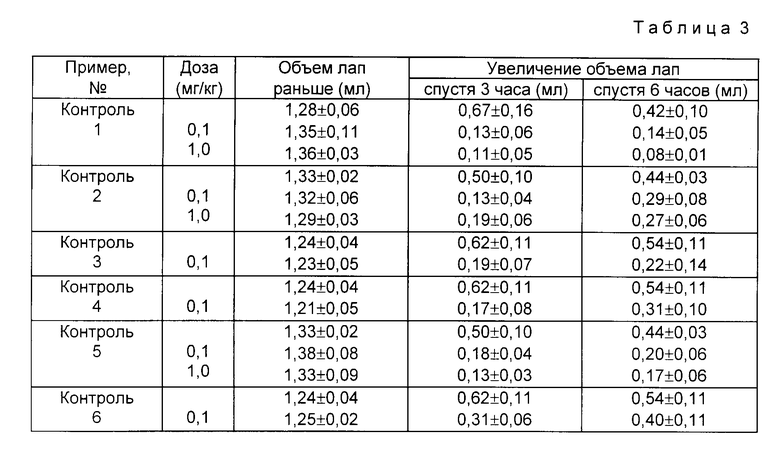
Противовоспалительное действие после системного приема: отек лап у крыс за счет каррагенана
Метод. В качестве теста на острое системное правовоспалительное действие выбирается отек лап у крыс за счет каррагенана согласно описанному Winter C. A. и др. Proc. Soc. Exp. Biol. (Нью-Йорк), 111, 544 (1962) методу. Самцы крыс Sprague-Dawley весом около 170 г в группах по 5 животных получают испытуемые вещества подкожно, растворенными в дистиллированной воде (1 мл/кг веса тела). Спустя 15 мин после измерения исходного объема лапы под наркозом с помощью эфира в левую заднюю лапу инъекцируют 0,1 мл 0,5%-ного раствора каррагенана. Спустя 3 и 6 ч измеряют объемно увеличение опухоли. Контрольные животные получают только индиферентную основу лекарственного препарата. Объемы лап указываются в мл (среднее значение и отклонение от стандартного значения). Результаты представлены в табл. 3.
Терапевтическая польза предлагаемых пептидов охватывает все патологические состояния, которым способствуют, которые возбуждаются или поддерживаются брадикинином и родственными брадикинину пептидами. Сюда относятся травмы, такие, как раны, ожоги, сыпи, эритемы, отеки, ангины, артриты, астма, аллергии, риниты, шоки, воспаления, панкреатит, низкое кровяное давление, боли, зуд и т.д. и измененная моторика спермы.
Поэтому изобретение относится также к применению пептидов формулы I в качестве лекарственного средства и фармацевтическим препаратам, которые содержат эти соединения.
Фармацевтические препараты содержат эффективное количество биологически активного вещества формулы I - индивидуально или в комбинации - вместе с неорганической или органической фармацевтически применимой основной.
Применение можно осуществлять кишечно, парентерально, например подкожно, внутримышечно или внутривенно, подъязычно, через кожу, через нос, ректально, интравагинально, орально или путем ингаляции. Доза биологически активного вещества зависит от вида теплокровного, веса тела, возраста и от рода введения.
Фармацевтические препараты изобретения получают известными способами растворения, смешения, гранулирования или дражирования.
Для оральной формы применения или для введения через слизистую оболочку активные соединения смешивают с обычными для этой цели добавками как основы, стабилизаторы или инертные разбавители, и обычными способами доводят до пригодных для приема форм, таких, как таблетки, драже, разъемные капсулы, водные, спиртовые или масляные суспензии или водные, спиртовые или масляные растворы. В качестве инертных основ можно применять, например, гуммиарабик, магнезию, карбонат магния, фосфат калия, молочный сахар, глюкозу, стеарилфумарат магния или крахмалы, в особенности кукурузный крахмал. При этом приготовление можно осуществлять также в виде сухого и влажного гранулята. В качестве масляных основ или растворителей принимают во внимание, например, растительные или животные масла, например, подсолнечное масло и рыбий жир.
Препарат для топического применения может быть в виде водного или масляного раствора, лосьона, эмульсии или желе, мази или жирной мази или, если возможно, в пульверизированной форме, причем в случае необходимости за счет добавки полимера можно улучшать прилипание.
Для формы применения в нос соединения смешивают с обычными для этой цели добавками, такими, как стабилизаторы или инертные разбавители, и обычными способами доводят до пригодных для приема форм, таких, как водные, спиртовые или масляные суспензии или водные, спиртовые или масляные растворы. В водные внутриносовые композиции можно добавлять хелатообразователи, этилендиамин-N, N,N',N'-тетрауксусную кислоту, лимонную кислоту, винную кислоту или их соли. Введение носовых растворов можно осуществлять посредством дозируемого распыления или в виде капель в нос повышающей вязкостью долей, соответственно геля или крема для носа.
Для использования в виде ингаляции можно применять аэрозоли или упаковки с газом под давлением, при применении инертных газов носителей.
Для внутривенного, подкожного, накожного или интредермального применения активные соединения или их физиологически совместимые соли в случае необходимости вместе с фармацевтически обычными вспомогательными веществами, например, для изотонирования или установления pH, а также с агентами растворения, эмульгаторами или другими вспомогательными веществами переводят в раствор, суспензию или эмульсию.
На основании короткого периода полураспада некоторых описанных лекарственных веществ в жидкостях организма бессмысленно применение инъекцируемых пролонгированных композиций. В качестве лекарственных форм можно применять, например, масляные кристаллические суспензии, микрокапсулы, Rods или имплантаты, причем последние могут быть построены из совместимых с тканью полимеров, в особенности биоразрушаемых полимеров, например, на основе сополимеров полимолочной кислоты с полигликолевой кислотой или человеческого альбумина.
Пригодной областью доз для топических и ингаляционных форм применения пригодны растворы с 0,001 - 5 мг/кг, в случае системных форм применения - 0,001 - 10 мг/кг.
Значение сокращений
Используемые для аминокислот сокращения соответствуют обычному в химии пептидов трехбуквенному коду, который описан в Europ. J. Biochem. 138, 9 (1984). Также используются следующие сокращения:
Acm - ацетамидометил
Aeg - N-2/-аминоэтил/-глицин
ε - Ahx - ε-аминогексаноил
Aoc - цис, эндо-2-азабицикло/3.3.0/-октан-3-S-карбонил
Boc - трет-бутилоксикарбонил
But - трет-бутил
Bzl - бензил
Cbz - бензилоксикарбонил
CDF - хлор-/D/-фенилаланил
Cha - циклогксилаланил
Chg - циклогексилглицил
Cl-Z - 4-хлор-бензилоксикарбонил
Dic - дигидроиндолкарбонил
ДМФ - диметилформамид
ДОМТ - 0-метил-/D/-треонил
Dnp - 2,4-динитрофенил
Fmoc - 9-флуоренилметилоксикарбонил
МДУ - 0-метил-/D/-тирозил
Me - метил
4-MebZl - 4-метилбензил
Mtr - 4-метокси-2,3,6-триметилфенил-сульфонил
Mts - мезитилен-2-сульфонил
Nal - 2-нафтилаланил
NMP - N-метилпирролидон
Npg - неопентилглицил
Oic - цис, эндо-окстагидроиндол-2-карбонил
Opr - изоксазолидин-3-ил-карбонил
Pal - пиридилаланил
Pmc - 2,2,5,7,8-ментаметилхлорман-6-сульфонил
Tbg - трет-бутилглицил
TBTU - 2-/1H-бензотриазол-1-ил/-1,1,3,3-тетраметилуронийтетрафторборат
tBu - трет-бутил
TcS - 4-метилфенилсульфонил
ТФК - трифторуксусная кислота
Thia - 2-тиенилаланил
Tic - 1,2,3,4-тетрагидроизохинолин-3-ил-карбонил
TOTU - O-//циано-/эткосикарбонил/метилиден/-амино/- 1,1,3,3-тетраметилуронийтетрафторборат
Tzt - тритил
Следующие примеры должны пояснять предпочтительные методы для твердофазного синтеза предлагаемых в изобретении пептидов, не ограничивая таким образом объема изобретения.
Используются следующие производные аминокислот:
Fmoc-Arg(Mtr)-PH, Fmoc-D-Arg(Mtr)-OH, Fmoc-D-Arg(Pmc)-OH, Boc-(D)-Arg-OH, Fmoc-Arg(Pmc)-OH, Fmoc-Hyp-OH, Fmoc-Pro-OObt, Fmoc-Gly-OOBt, Fmoc-Phe-OObt, Fmoc-Ser(tBu)-OObt, Fmoc-(D)-Tic-OH, Fmoc-Gln-OH, Fmoc-Aoc-OH, Fmoc-Thia-OH, Fmoc-Oic-OH, Fmoc-Ktu-OH, Fmoc-Lys)Boc)-OH, Fmoc- ε -Ahx-OH.
Пример 1. Fmoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-Arg-OH.
Построение проводят ступенчато с помощью пептидного синтезатора модели 430 А фирмы "Applied Biosystems" при применении Fmoc-методм на этерифицированной до сложного эфира с помощью Fmoc-Arg(Mtr)-OH смоле на основе п-бензилоксибензилового спирта фирмы "Novabiochem" (загрузка примерно 0,5 ммоль/г смолы). Используют 1 г смолы и синтез осуществляют с помощью модифицированной для Fmoc-метода синтеза программы.
В патроне синтезатора взвешивают, смотря по обстоятельствам, 1 ммоль производного аминокислоты со свободной карбоксильной группой вместе с 0,95 ммоль HOObt. Предактивацию этих аминокислот осуществляют прямо в патроне путем растворения в 4 мл ДМФ и добавки 2 мл 0,55 моль/л раствора диизопропилкарбодиимида в ДМФ.
HOObt - сложные эфиры других аминокислот растворяют в 6 мл NMP и затем так же, как предактивированные in situ аминокислоты, связывают с предварительно деблокированной с помощью 20% пиперидина в ДМФ смолой. В качестве последнего производного аминокислоты сочетают Fmoc-D-Arg(Pmc)-OH и затем удаляют защиту с помощью пиперидина. После окончания синтеза пептид при одновременном удалении защитных групп боковых цепей отщепляют от смолы с помощью трифторуксусной кислоты при применении тиоанизола и этандитиола в качестве акцепторов катионов. Полученный после удаления трифторуксусной кислоты остаток многократно настаивают с уксусным эфиром и центрифугируют. Остающийся остаток хроматографируют на ®Сефадексе LH 20 с помощью 10%-ной уксусной кислоты. Содержащие чистый пептид фракции объединяют и высушивают.
Масс-спектр (бомбардировка быстрыми атомами (ББА) : 1526,9.
Пример 2. Fmoc-Aoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-Arg-OH.
Титульное соединение получают тем, что от полученной ранее аналогично примеру 1 пептид-смолы с последовательностью Fmoc-D-Arg-(Pmc)-Arg(Mtr)-Pro-Hyp-Gly-Thia-Ser(But)-D-Tic-Oic- Arg(Mtr)-смола сначала отщепляют N-терминальную Fmoc-защитную группу с помощью пиперидина с диметилформамидом, смолу промывают ДМФ и затем сочетают с Fmoc-Aoc-Oe при применении урониевого реагента сочетания TOTU. Отщепление пептида от смолы осуществляют после этого с помощью смеси трифторуксусной кислоты с триметилсилилбромидом и м-крезолом. Очистку осуществляют аналогично описанному в примере 1 способу.
Масс-спектр (ББА): 1663,8.
Следующие примеры осуществляют аналогично примеру 2.
Пример 3. Дибензилацетил-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic- Oic-Arg-OH.
Масс-спектр (ББА): 1526,7.
Пример 4. Циклогексилкарбонил-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1414,7.
Пример 5. Fmoc-D-Аминогексаноил-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1639,6.
Пример 6. N, N-Дибензил-глицил-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1542,2.
Пример 7. Fmoc-D-Aoc-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1663,8.
Пример 8. 2-/4-Изобутилфенил/-пропионил-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1493.
Пример 9. /2-R-/трет-бутилсульфонилметил/-3-/1-нафтил/пропионил-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1621.
Пример 10. Индол-3-ил-ацетил-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1462.
Пример 11. 2-/4-Изобутилфенил/пропионил-D-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arh-Oh.
Масс-спектр (ББА): 1493.
Пример 12. 2-/4-Изобутилфенил/пропионил-6-аминогексаноил-D-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-Oh.
Масс-спектр (ББА): 1606.
Пример 13. 6-/4-Бензоил-бензоиламино/гексаноил-D-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1625,8.
Пример 14. Fmoc-Aeg-/Fmoc/-D-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1849,8.
Пример 15. Fmoc-/4-аминоциклогексилкарбонил/-D-Arg-Arg-Pro-Hyp-G1y-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1652.
Пример 16. 1,8-Нафталимидоацетил-D-Arg-Arg-Pro-Hyp-G1y-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1542,3.
Пример 17. /2-R-/трет-бутилсульфонилметил/-3-/1-нафтил/пропионил-D-Arg-Arg-Pro-Hyp-G1y-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1621,9.
Пример 18. Индол-3-ил-ацетил-D-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА) : 1462.
Пример 19. Fmoc-/4-Аминоциклогексилкарбонил/-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1496.
Пример 20. 7-Теофиллинацетил-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1369.
Пример 21. N-Бензоил-D-Arg-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1410.
Пример 22. Fmoc-Aeg/Fmoc/-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА): 1694.
Пример 23. Fmoc-DLys-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-ArgOH.
Масс-спектр (ББА): 3500.
Пример 24. Fmoc-Arg-Pro-Hyp-Gly-Thi-Cer-D-Tic-Oic-ArgOH.
Масс-спектр (ББА): 1371.
Пример 25. Fmoc-Oic-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-ArgOH.
Масс-спектр (ББА): 1523.
Пример 26. Fmoc-транс-4-аминометилциклогексил-карбонил-Arg-Pro-Hyp-Gly-Thi-Ser-D-Tic-Oic-Arg-OH.
Масс-спектр (ББА) : 1511.
Примеры получения средств для орального применения.
Пример 1. 1000 таблеток, которые содержат по 20 мг Fmoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-ArgOH, получают со следующими вспомогательными средствами, n:
Fmoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-ArgOH - 20,0
Кукурузный крахмал - 140,0
Желатин - 7,5
Микрокристаллическая целлюлоза - 2,5
Стеарат магния - 2,5
Fmoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-ArgOH и кукурузный крахмал смешивают с водным желатиновым раствором. Смесь сушат и размалывают до гранулята. Микрокристаллическую целлюлозу и стеарат магния смешивают с гранулятом. Полученный гранулят прессуют в 1000 таблеток, причем каждая таблетка содержит 20 мг брадикинин-антагониста.
Пример 2. Аналогично примеру 1 получают 1000 таблеток, содержащих по 3 мг Fmoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-ArgOH.
Пример 3. Желатиновые капсулы, содержащие по 20 мг Fma-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-ArgOH, заполняют следующей смесью, мг:
Fmoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Ser-D-Tic-Oic-ArgOH - 20
Стеарат калия - 1
Лактоза - 214
Пример 4. Аналогично примеру 3 получают желатиновые капсулы, содержащие по 3 мг Fmoc-D-Arg-Arg-Pro-Hyp-Gly-Thia-Cer-D-Tic-Oic-ArgOH.
Соединения по изобретению могут быть отнесены к практически нетоксичным.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2083586C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ | 1992 |
|
RU2081880C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПЕПТИДАМИДОВ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ СОВМЕСТИМЫХ АЦЕТАТОВ ИЛИ ГИДРОХЛОРИДОВ | 1991 |
|
RU2036200C1 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ БРАДИКИНИНА-B2 ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРОЗА | 2004 |
|
RU2329057C2 |
| АГОНИСТЫ РЕЦЕПТОРОВ НЕЙРОМЕДИНА В И СОМАТОСТАТИНА | 2000 |
|
RU2263680C2 |
| ЦИКЛОГЕКСАПЕПТИДЫ, ИХ СМЕСИ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2163242C2 |
| ПРОИЗВОДНЫЕ МЕТАСТИНА И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2430107C2 |
| ПРОИЗВОДНЫЕ МЕТАСТИНА И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2454425C2 |
| Способ получения мембраносвязанных соединений | 1986 |
|
SU1823876A3 |
| КОМПОЗИЦИИ И СПОСОБЫ СТИМУЛЯЦИИ ДВИГАТЕЛЬНОЙ ФУНКЦИИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2006 |
|
RU2566708C2 |


Использование: в медицине, как соединения, обладающие брадикинин-антагонистическим действием. Сущность изобретения: пептиды формулы I: Z-P-A-B-C-E-F-K- (D)Q-g-M-F'-y, где Z - 9-флуоренилметилоксикарбонил (Fm o c), дибензилацетил, циклогексилкарбонил, N,N-дибензил-глицил, 2-(4-изобутилфенил) пропионил 2-R-(трет-бутилсульфонилметил)-3-(1-нафтил)пропионил индол-3-ил Ацетил, 6-(4-бензоил-бензоиламино) гексаноил 1,8-нафталимидоацетил, 7-теофиллинацетил или N-бензоил; Р - прямая связь, Аос, ε- аминогексаноил, D-Аос, Aeq (Fmoc), 4-аминоциклогексилкарбонил или Oic; A -(D)- или (L)-Aeq, (D)-или (L)-Lys или связь; В - Arg; С - Pro-Hyp-Gly; Е - Thia; F - Ser; К - прямая связь; Q - Tic; М - прямая связь; С - цис-эндо, цис-экзо, транс-октагидроиндол-2 карбоновую кислоту; F' - Arg и y - ОН. Пептиды I получают твердофазным методом. Пептиды I вводят в качестве активного вещества в эффективном количестве в средство, обладающее брадикинин-антогонистической активностью. 3 с. и 1 з.п. ф-лы, 3 табл.
Z - P - A - B - C - E - F- K - (D) Q - G - M - F' - y,
в которой Z - 9-флуоренилметилоксикарбонил (Fmoc), дибензилацетил, циклогексилкарбонил, N, N-дибензил-глицил, 2-(4-изобутилфенил) пропионил, 2-R-(трет- бутилсульфонилметил)-3-(1-нафтил) пропионил индол-3-ил-ацетил, 6-(4-бенозил-бензоиламино) гексаноил, 1,8-нафталимидоацетил, 7-теофиллинацетил или N-бензоил;
P - прямая связь, Аос, ε-аминогексаноил-D-Аос, Alq (Fmoc), 4-аминоциклогексилкарбонил или Оic;
A - (D)- или (L)-Аrg, (D) - или (L)Lys или связь;
b - Arg;
C - Pro - Hyp - Gly;
E - Thia;
F - Ser;
K - прямая связь;
Q - Tic;
M - прямая связь;
G - цис-эндо, цис-экзо, транс-октагидроиндол-2-карбоновая кислота;
F' - Arg;
y - OH.
Z - P - A - B - C - E - F - K - (D) Q - G - M - F' -y,
в которой Z - 9-флуоренилметилоксикарбонил (Fmoi), дибензилацетил, циклогексилкарбонил, N, N-дибензил -глицил, 2-(4-изобутилфенил) пропионил, 2-R-(трет -бутилсульфонилметил)-3-(1-нафтил) пропионил индол-3-ил-ацетил, 6-(4-бензоил-бензоиламино) гексаноил, 1,8-нафталимидоацетил, 7-теофиллинацетил или N-бензоил;
P - прямая связь, Аос, ε-аминогексаноил, D-Аос, Aeq (Fmoc) 4-аминоциклогексилкарбонил или Oic;
A - (D)- или (L) -Arg, (D)- или (L)LyS или связь;
B - Arg,
C - Pro - Hgp - Gly;
E - Thia;
F - Ser;
K - прямая связь;
Q - Tic;
M - прямая связь;
G - цис-эндо, цис-экзо, транс-октагидроиндол-2-карбоновая кислота;
F' - Arg;
y - OH
отличающийся тем, что к полимерной смоле присоединяют N-терминальную защищенную аминокислоту формулы
Fmoc (Arg) Mtr OH,
отщепляют N-терминальную защитную группу, проводят ступенчатое наращивание пептидной цепи и от полученного пептидилполимера отщепляют полимерную смолу.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Шредер Э., Любке К | |||
| Пептиды | |||
| - М.: Мир, ч.1, 1967, с.398 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Merrifield R.B | |||
| J.Amer | |||
| Chem | |||
| Soc | |||
| Приспособление к комнатным печам для постепенного сгорания топлива | 1925 |
|
SU1963A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| EP, заявка 0334244, C 07 K 7/18, 1989 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| DE, патент 3926822, C 07 K 7/06, 1991 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| DE, патент 3938751, C 07 K 7/06, 1990 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| DE, патент, 4013270, C 07 K 7/06, 1991. | |||
Авторы
Даты
1998-04-27—Публикация
1993-04-02—Подача