Изобретение относится к диагностике и лечению таких заболеваний, как атеросклероз и тромбоз.
Большинство существующих процедур для диагностики и лечения атеросклероза и тромбоза являются инвазивными, дорогостоящими и имеют ограниченную эффективность у существенной доли пациентов.
Известны методы, в основе которых лежит принцип "усиления" бляшек при помощи красителей, который был предложен Spears, J. и др. (J. Clin. Invest. т. 71, с. 395-399, 1983). Такие красители метят поверхность бляшек флуоресцентным соединением. Abela, G. и др. (Am.J.Cardiol., 50, с. 1199-1205, 1982) предложили разрушение бляшек фотоактивацией производных гематопорфирина, осуществляемой с помощью внутрипросветного передающего излучения лазера, оптического волокна. Кроме того, было также предложено использование тетрациклиновых красителей (Murphy-Chutorian, D. и др., Am. J. Cardiol., т. 55, с. 1293-1297, 1985).
Указанные выше красители выбирают по их способности связываться с компонентами атеросклеротической бляшки. Далее краситель абсорбирует лазерный свет, концентрируя его на окрашенной поверхности. Однако имеет место некоторое окрашивание и здоровой ткани, что приводит к идентификации окружающей ткани как поврежденной.
Предложены несколько экспериментальных подходов для неинвазивного обнаружения тромбов при помощи использования радиофармацевтических агентов, но ни один не получил широкого клинического признания ввиду специфических недостатков, характерных для каждого агента.
Основные характеристики радиофармацевтических агентов для раннего обнаружения внутрисосудистых атеросклеротических изменений и тромбов состоят в следующем: высокое сродство к компонентам тромба; относительно высокая фармакокинетическая скорость очищения крови; безопасность: нетоксичность и неимуногенность; простота получения и использования.
В литературе описаны различные визуализирующие агенты этой категории. Недостатки их состоят в следующем: а) аутогенные тромбоциты, меченные 1111п: эта процедура очень трудоемкая, продолжительная по времени, а время очищения крови относительно большое, а именно 2 дня [2]; б) 1311-фибриноген: анализ основан на сродстве инъектируемого радиомеченного фибриногена относительно тромба, но он не пригоден для испытаний на быструю визуализацию из-за большого времени пребывания в крови, не пригоден для старых тромбов и не может использоваться в присутствии гепарина [3, 36]; в) фрагмент Е1 человеческого фибрина: представляется наиболее подходящим для фибриногена, но его трудно получать в достаточных количествах для широкого клинического применения [4]; г) мышиные антифибриновые моноклональные антитела: являются специфическими и имеют высокое сродство относительно тромба, но характеризуются относительно продолжительным временем очищения крови и потенциально являются иммуногенными для человеческого организма [5, 33, 34]; д) мышиные моноклональные антитела, специфические относительно активированных тромбоцитов [6, 7]: те же недостатки, что в случае г); е) меченый фибронектин [1] (прототип): фибронектин имеет сродство сразу к нескольким материалам, содержащимся в тромбе, но отличается довольно продолжительным временем очищения крови и небольшим содержанием радиоактивности в тромбе. Таким образом, в этой области техники ощущается необходимость в специфических относительно тромбов радиофармацевтических агентах для быстрой визуализации тромба.
В патенте США N 4343734 (Lian и др.) предложены специфические антитела к гамма-карбоксиглютаминовой кислоте (ГЛК), которые могут быть помечены флюоресцирующим агентом для иммунофлюоресцентного окрашивания ткани с целью установления присутствия в ней ГЛК. Специфические ГЛК-антитела связываются с ГЛК, которая содержится в развивающейся атеросклеротической бляшке, имеющей отложения кальция. Lian и др. утверждают, что ГЛК не обнаруживается в некальцинированных бляшках и что ГЛК не обнаруживается в сердечных клапанах и аорте, а также в таких циркулирующих протеинах, как протромбин, факторы свертывающей системы крови VII, IX и X, протеин C и протеин S. Кроме того, антитела, связывающие ГЛК, не обеспечивают селективного связывания с атеросклеротическими бляшками.
Фибронектин является гликопротеином, состоящим из двух идентичных субблоков, каждый из которых имеет мол. м. приблизительно 220000. Человеческими клетками в культуре и in vivo продуцируются и секретируются две основные формы фибронектина [8]. Фибронектин, ассоциированный с клеткой, слабо растворим и принимает участие в адгезии клеток, заживлении ран, дифференцировке клеток и фагоцитозе. Фибронектин плазмы, продуцируемый в основном в печени, является растворимым протеином сыворотки с биологическими свойствами, аналогичными биологическим свойствам клеточного фибронектина.
Фибронектин представляет собой многофункциональный модулятор, так как ограниченное протеолитическое расщепление продуцирует полипептиды с различными активностями. Были получены основные функциональные области молекулы фибронектина при помощи частичного протеолитического переваривания, они включают домены, связывающие гепарин, ДНК, фибрин, коллаген или желатин и клетки [8-13].
Baralle, F. E. в европейской патентной публикации N 207751, опубликованной 7 января 1989 г., описал полную кДНК-последовательность фибронектина. Он также описывает экспрессию слитых белков, содержащих часть связывающей коллаген области фибронектина, и β -галактозидазу Escherichia coli. Аналогичные слитые протеины предложены Owens и Baralle [14]. Obara и др. (1987) описана экспрессия части связывающей клетки области человеческого фибронектина, слитой с β -галоктозидазой Escherichia coli. Obara и др. также (1988) описывают экспрессию частей связывающей клетки области, слитых с β-галактозидазой после предварительного сайт-специфического мутагенеза [16]. Карбокси-конец связывающей фибрин области человеческого фибронектина экспрессировали в L-клетках мыши как протеин слияния с сигнальной последовательностью ингибитора человеческого протеина C [17].
Ни в одной из вышеупомянутых ссылок, однако, не описывается экспрессия N-терминальной части связывающей фибрин области фибронектина; кроме того, все рекомбинантные протеины, которые описаны ранее, являются слитыми протеинами.
В соответствии с изобретением предлагаются визуализирующие агенты на основе полипептидов, содержащих аминокислотную последовательность, которая по существу соответствует N-терминальной части связывающей фибрин области фибронектина. Эти полипептиды имеют приблизительные мол. м. 31, 20, 18,5 и 12 кД, определенные при помощи маркеров сравнения на SDS-гелях в восстанавливающих условиях. Они обладают следующими характеристиками, которые делают их перспективными фармацевтическими агентами: содержат аминокислотную последовательность, которая содержится в человеческом протеине и, таким образом, является неимуногенной; обладают специфичностью относительно фибрина, которая базируется на их способности к ковалентному перекрестному связыванию в катализируемой транс-глютаминазой реакции с образующимся, а также с образованным ранее тромбом (сгустком); связываются с внеклеточной матрицей, что дает возможность обнаружить атеросклеротические бляшки; обладают относительно коротким периодом очищения крови; включаются в сгустки в присутствии гепарина; продуцируются при помощи рекомбинантных приемов и могут быть, таким образом, получены в больших количествах. Указанные полипептиды для получения визуализирующих агентов метят визуализируемым маркером.
В соответствии с изобретением предлагается недорогой, точный способ визуализации содержащих фибрин материалов, т.е. тромбов и атеросклеротических бляшек как in vitro, так и in vivo. Он включает контактирование содержащего фибрин материала, подлежащего визуализации, с визуализирующим агентом, описанным выше, при таких условиях, что агент связывается с содержащим фибрин материалом, и визуализацию связанного агента, обеспечивающую одновременное обнаружение содержащего фибрин материала.
На фиг. 1-29 описана конструкция плазмид, экспрессирующих полипептиды, содержащие аминокислотную последовательность, по существу соответствующую амино-терминальной части, связывающей фибрин области (FBD) фибронектина. FBD начинается с аминокислоты под номером 1 зрелого фибронектина, которой является глютамин, и соответствует четвертой аминокислоте (Q), представленной на фиг. 2. Таким образом, N-окончанием FBD-последовательности является Q-A-Q-Q-(глютамин-аланин-глютамин-глютамин); соответствующий первый нуклеотид в кДНК-последовательности на фиг. 2 имеет, следовательно, номер 14, указанный стрелкой. Все рекомбинантные FBD-полипептиды, приведенные на фиг. и в тексте описания, нумеруются от этого первого глютамина, а все соответствующие кДНК-последовательности пронумерованы, как это показано на фиг. 2-9.
Определение полипептидов, экспрессируемых в форме 31, 20, 18,5, 12 кД, является оперативным определением, основанным на их приблизительной молекулярной массе, определяемой на SDS-полиакриламидных гелях в восстанавливающих условиях путем сравнения с маркерами с известной молекулярной массой.
На фиг. 1 приведено изображение различных областей фибронектина и конструируемых рекомбинантных полипептидов; на фиг. 2-9 - нуклеотидная последовательность кДНК человеческого фибронектина.
На фиг. 10 и 11 получают семь пар химически синтезированных олигомеров. Синтетические олигомеры кодируют первые 153 N-терминальные аминокислоты человеческого фибронектина (FN), на фиг. 10 и 11 приведена последовательность этих 7 пар синтетических олигомеров.
На фиг. 12 представлен ДНК-фрагмент, кодирующий аминокислоты с 1 по 153 N-терминальной области человеческого FN, составленный из 7 пар химически синтезированных олигомеров, представленных на фиг. 10 и 11. Синтез может быть описан следующим образом.
а) Олигомеры 3/4, 5/6, 7/8 и 9/10 (каждая пара в отдельной пробирке) подвергают отжигу, а затем фосфорированию на 5'-конце, используя фермент Т4-полинуклеотидкиназу.
б) На второй стадии пары 3/4 и 5/6 подвергают лигированию друг с другом, используя ДНК-лигазу Т4. Аналогичным образом реакционные пары 7/8 и 9/10 подвергают лигированию друг с другом. После каждого шага лигирования порцию смеси лигирования анализируют на геле, чтобы определить размер вновь образованных фрагментов и эффективность связывания.
в) На третьей стадии две вышеупомянутые смеси лигирования смешивают вместе, и в смесь добавляют пару 6, олигомеры 11/12, которые предварительно отожгли и фосфорилировали в отдельной пробирке. ДНК-фрагмент из 326 пар оснований, полученный из вышеупомянутой смеси, изолируют из агарозного геля и подвергают очистке.
Очищенный синтетический 326-фрагмент добавляли к двум дополнительным парам синтетических линкеров: пара 1, олигомеры 1/2, и пара 7, олигомеры 13/14. В паре 1 только олигомер 2 фосфорилирован в 5'-конце, а в паре 7 только олигомер 13 фосфорилирован в 5'-конце.
После лигирования ДНК-лигазой Т4 смесь без какой-либо дополнительной изоляции добавляли в ДНК вектора pBR322, переваренную эндонуклеазами EcoRI и BamHI.
Полученная плазмида, обозначенная pFN 932-18, содержала полный синтетический фрагмент EcoRI (5'-конец)-BamHI (3'-конец), кодирующий N-терминальные 153 аминокислоты человеческого FN, в векторе pBR322.
На фиг. 13 представлена экспрессия N-терминальной последовательности из 153 аминокислоты FN.
Плазмиду pFN 932-18 переваривали эндонуклеазами NdeI и BamHI. ДНК-фрагмент NdeI-BamHI, кодирующий FN (первые 153 аминокислоты + дополнительный N-терминальный метионин), изолировали и подвергали лигированию с большим фрагментом, полученным при помощи переваривания плазмиды pTУ301 эндонуклеазами NdeI и BgII. (Плазмида pTУ301 экспрессирует человеческий гормон роста (hGH) при регулировании промотором λPL и RBS CII).
Полученную плазмиду обозначали как pFN 949-2.
На фиг. 14 представлена вставка терминирующего кодона TAA в 3'-конец N-терминальной области FN (в положении, соответствующем аминокислоте 262).
Синтетический олигонуклеотид, содержащий терминирующий кодон TAA и сайт Bgl II, имеющий следующую последовательность:
лигировали с 3'-концом (сайт PvuII) EcoRI-PvuII, NF-фрагмента, выделенного из КДНК-плазмиды p931-5, переваренной ферментами EcoRI и PvuII. Лигирование осуществляли в присутствии плазмиды PBR322, переваренной ферментами EcoRI и BamHI (большой фрагмент). Полученную плазмиду обозначали как PFN935-12.
На фиг. 15 представлены рекомбинатные полипептиды областей фибронектина в сравнении с фибронектином полной длины.
Фиг. 15 показывает соотношение кДНК-клонов, кодирующих рекомбинантные полипептиды друг с другом, а также с последовательностью полной длины кДНК-фибронектина и общей схемой доменов, содержащихся внутри молекулы человеческого фибронектина.
На фиг. 16 представлена конструкция плазмиды pFN 196-2, которая экспрессирует полипептид FBD r12 кД.
Большой фрагмент BspMI-HindIII, полученный при помощи переваривания плазмиды PFN 975-25 с использованием BspMI и HindIII, подвергали лигированию с использованием ДНК-лигазы T4 с синтетической парой линкеров A (фиг. 18). Полученную плазмиду PFN 196-2 трансформировали в штамм Escherichia coli A1645, а затем переносили в штамм Escherichia coli A4255. Плазмида PFN 196-2 содержит 5'-терминальную последовательность кДНК-фибронектина от нуклеотида 14 до нуклеотида 340, т.е. она кодирует первые 109 аминокислот FBD-фибронектина, заканчивающиеся аргининовым остатком. В конечном полипептиде содержится дополнительный N-терминальный метионин. Плазмида pFN 196-2 дает хорошую экспрессию FBD-полипептида r12 кД под контролем λ -промотора и сайта связывания рибосом β -лактамазы: она сдана на хранение в ATCC под шифром хранения N 68328.
На фиг. 17 представлена конструкция плазмиды pFN 197-10, которая экспрессирует модифицированный FBD-полипептид 12 кД (12 кД').
Плазмиду pFN 975-25 обрабатывали, как это представлено на фиг. 16, за тем исключением, что использовали другую пару линкеров B (фиг. 18). Лигирование давало плазмиду pFN 197-10, которая кодирует N-терминальную последовательность FBD FN; однако модификация после нуклеотида 340 с целью получения сайта NdeI (CATATG) перед стоп-кодоном приводит к кодированию полипептида, содержащего 111 аминокислот, где первые 109 аминокислот соответствуют аминокислотам полипептида r12 кД, а два дополнительных аминокислотных остатка представлены гистидином и метионином. В конечном полипептиде также содержится дополнительный N-терминальный метиониновый остаток. Плазмиду pFN 197-10 трансформировали в штамм Escherichia coli A1645, а затем в штамм Escherichia coli A4255 и получали хорошую экспрессию модифицированного FBD-полипептида r12 кД (12 кД') под контролем λ-промотора и связывания рибосом β-лактамазы.
На фиг. 18 представлены олигонуклеотидные линкеры, используемые в конструкции плазмид.
Получали две пары химически синтезированных олигомеров (A, B) и использовали их при конструировании плазмид, как это показано на фиг. 16 и 17 соответственно.
На фиг. 19 представлено сравнение меченых FBD-полипептидов r12 кД, r20 кД и r31 кД в модели венозного тромба у крыс.
Столбцы и вертикальные консоли представляют среднее значение ± средняя стандартная ошибка (N = 5) удельной радиоактивности, ассоциированной с изолированными тромбами (T) или кровью (B) через 24 ч после применения 125I-меченых рекомбинантных полипептидов, как это указано.
На фиг. 20 представлено связывание полипептидов области связывания фибрина с фибрином сгустков.
Этот эксперимент осуществляли по существу, как это описано для двухстадийной реакции 11 (пример 6). 0,15 μМ 125I одного из полипептидов области, связывающей фибрин, как это указано выше, инкубировали при 37oC с предварительно образованными фибриновыми сгустками, полученными из 20 μл обработанной цитратом цельной крови. Связывание измеряли в присутствии 5 мМ CaCl2 и 0,02 единиц/мл транс-глютаминазы. Реакцию прекращали спустя 45 мин инкубирования центрифугированием; осадок промывали три раза с использованием фосфатно-солевого буфера (PBS), а радиоактивность измеряли в гамма-счетчике.
1. Плазматическая FBD 31 кД (p 31 кД)
2. r12 кД
3. r20 кД
4. r21 кД (Порция A)
5. r31 кД (Порция B)
6. r31 кД (Порция C)
На фиг. 21 представлены скручивание и очистка полипептида r20 кД, наблюдаемые при помощи профилей элюирования из колонки типа Superose 12 [соединенной с ЖХВД (жидкостная хроматография высокого давления)].
Порции в 200 μл полипептида r20 кД на различных стадиях процедур скручивания и очистки инъецировали в верхнюю часть колонки Superose 12 (соединенной с ЖХВЖ). Колонку уравновешивали и элюировали раствором 150 мМ NaCl (20 мМ Трис HCl, pH 7,8) с объемной скоростью потока 0,8 мл/мин. A. Осадок полипептида r20 кД солюбилизировали в 6 М гуанидин-HCl и восстанавливали 50 мм β-меркаптоэтанолом. B. Ренатурировали и окисляли воздухом полипептид r20 кД. C. Полипептиды, отделенные от очищенного r20 кД, связывали с Q-сефарозой. D. Поток через колонку из Q-сефарозы. E. Поток через колонку гепарин-сефарозы материала, отделенного от очищенного r20 кД. F. Очищали полипептид в 20 кД (время удерживания 18,16 мин), элюировали из колонки гепарин-сефарозы при помощи 0,5 М NaCl. Пик со временем удержания 18,16 мин отсутствовал в профиле A, где материал находится в восстановленной форме, а также и в профилях C и E, которые содержат неправильно образованные формы полипептиды в 20 кД.
На фиг. 22 представлены ренатурация и очистка полипептида r12 кД по данным профилей элюирования с колонки Superose 12 (соединенной с системой ЖХВД Уотерз).
Порции в 25 - 100 μл полипептида r12 кД на различных стадиях процессов ренатурации и очистки инъецировали в верхнюю часть колонки Superose 12, соединенной с системой ЖХВД Уотерз. Колонку уравновешивали и элюировали раствором 150 мМ NaCl/20 мМ Трис HCl, pH 7,8, с объемной скоростью потока 0,8 мл/мин. A. Осадок полипептида r12 кД солюбилизировали в 6 М гуанидин-HCl и восстанавливали 50 мМ β-меркаптоэтанолом. B. Полипептид r12 кД ренатурировали и окисляли воздухом. C. Полипептиды связывали с Q-сефарозой (материалы, которые отделяли от r12 кД). D. Пропускали поток через колонку Q- и гепарин-сефарозы (в этом случае колонки соединяли последовательно и поток через сефарозу автоматически загружался на колонку гепарин-сефарозы). E. Очищали полипептид r12 кД (время удерживания 18,83 мин), элюировали с колонки гепарин-сефарозы 0,5 М раствором NaCl. Пик со временем удерживания 18,83 мин отсутствовал в профиле A, где материал находится в восстановленной форме, а также и в профилях C и D, которые содержат неправильно сформированные формы полипептида r12 кД.
На фиг. 23 представлена конструкция плазмиды pFN 208-13.
Две порции плазмиды pFN 975-25 (ATCC N 67832) отдельно переваривали ферментами Xmn I и XbaI-StyI соответственно. Большие фрагменты выделяли из каждой переваренной смеси и смешивали вместе с синтетическим олигомером, приведенным на фиг. 16. Затем эту смесь кипятили в течение 2,5 мин, постепенно охлаждали 60 мин до 30oC, затем 60 мин до 40oC и, наконец, 30 мин до 0oC. ДНК, подвергнутую повторному отжигу, достраивали фрагментом Кленова и подвергали лигированию с использованием ДНК-лигазы T4. Эту ДНК трансформировали в E. coli A1645, а трансформированные клетки проверяли на наличие клонов, положительных относительно содержания олигомера. Плазмиду из положительного клона обозначали pFN 208-13 (она сдана на хранение в ATCC в хозяине E.coli A4255 под шифром хранения N 68456). Эта плазмида экспрессирует полипептид N-конца FBD размером в 18,5 кД под управлением PL-промотора λ и сайта связывания рибосом β -лактамазы.
На фиг. 24 представлен синтетический линкер, используемый в конструкции плазмиды pFN 208-13.
На этой фигуре представлен синтетический олигомер, используемый в конструкции плазмиды pFN 208-13 (фиг. 23).
На фиг. 25 представлена конструкция плазмиды pFN 201-3.
Большой фрагмент изолировали из HindIII - StyI-перевара плазмиды pFN 949-2 (ATCC, шифр хранения N 67831) и подвергали лигированию с малым фрагментом, изолированным из HindIII - StyI-перевара плазмиды pFN 196-2 (ATCC, шифр хранения N 68328). Полученная в результате плазмида, обозначенная pFN 201-3, экспрессирует полипептид FBD 12 кД под контролем PL-промотора λ и сайта связывания рибосом СII.
На фиг. 26 представлена конструкция плазмиды pFN203-2.
Большой фрагмент изолировали из смеси Ndel - HindIII-перевара плазмиды pMLK-100 (сданной на хранение в E.coli 4300 в ATCC под шифром хранения N 68605) и подвергали лигированию с малым фрагментом, изолированным из смеси Ndel - HindIII-перевара плазмиды pFN 201-3. В результате получали плазмиду, обозначенную pFN 203-2, которая экспрессирует полипептид FBD 12 кД под контролем PL-промотора λ, сайта связывания рибосом CII и содержит последовательность окончания транскрипции trp ("ter"). Названная плазмида сдана на хранение в ATCC в E.coli A4255 под шифром хранения ATCC N 68606. Плазмида pFN 203-2 известна также как pFN 203-2-3.
На фиг. 27 представлено связывание фрагментов различных полипептидов с предварительно полученными фибриновыми сгустками.
На этой фигуре представлена специфичность различных полипептидов FBD к предварительно образованному фибриновому сгустку, как это описано в примере 8. Испытывали полипептиды FBD: 31 кД, 20 кД, 18,5 кД и 12 кД. Кроме того, испытывали слитый полипептид 45 кД, состоящий из фрагмента FBD 12 кД и CBD 33 кД. В качестве контроля использовали полипептид CBD 33 кД (описанный в PCT-публикации N WO/90/07577, с. 62-64, тах же заявителей). Все испытываемые полипептиды FBD, включая слитый полипептид 45 кД, связывались с предварительно образованным сгустком в аналогичных пропорциях (25-38% связывание).
На фиг. 28 представлено введение метки в тромбы in vivo с использованием фрагментов полипептидов FBD 12 кД и 18,5 кД (примере 10). На фиг. 28 представлены данные удельной радиоактивности тромба (заштрихованные столбцы) и крови (незаштрихованные столбцы) у крыс с индуктором из нержавеющей стали спустя 24 ч после внутривенного применения IIIIп-меченных рекомбинантных протеинов FBD. Прямоугольники и вертикальные отрезки представляют средние значения и средние значения стандартного отклонения числа отсчетов в 1 мин/г влажной массы соответственно. Отношения тромб/кровь приведены на фиг. 29.
На фиг. 29 представлены отношения удельной радиоактивности "тромб/кровь" спустя 24 ч после применения IIIIп-меченных 12 кД, 18,5 кД- и 31 кД- FBD в модели, снабженной индуктором крысы, показанной на фиг. 28.
Плазмиды pFN 975-25, pFN 949-2, pFN 137-2 и pFN 196-2 сданы на хранение в соответствии с условиями и требованиями Будапештского договора в Американскую коллекцию типовых культур (ATCC) под шифрами хранения NN 67832, 67831, 67910 и 68328 соответственно. Аналогичным образом сданы на хранение другие ATCC-депозиты, на которые имеется ссылка в настоящей патентной заявке.
Основная последовательность человеческого фибронектина, как было показано, организована из трех типов гомологичных повторов (типов I, II и III). Область, связывающая фибрин (FBD), состоящая из 259 аминокислот со средней мол. м. 31 кД, составлена из пяти повторов типа I ("пальцев"), каждый из которых состоит примерно из 45 аминокислот и включает две дисульфидные связи.
Общее схематическое представление структуры областей фибронектина и рекомбинантных молекул, конструируемых в соответствии с настоящим изобретением, дано на фиг. 1.
Рекомбинантные полипептиды, входящие в состав визуализирующего агента, предлагаемого в соответствии с изобретением, по аминокислотной последовательности по существу идентичны соответствующим фрагментам области связывания.
Во всех полученных полипептидах содержится дополнительный Met на N-конце.
Полипептид r31 кД содержит пять гомологичных петель типа I или "пальцев", упомянутых выше (т.е. 10 дисульфидных связей), полипептид r20 кД и полипептид r18,5 кД, которые содержат три петли (т.е. 6 дисульфидных связей) и полипептид r12 кД имеет две петли (т.е. 4 дисульфидные связи). Присутствие этих дисульфидных связей определяет необходимость, а также трудность процедуры восстановления конформации полипептида соответствующей нативности. Правильно ренатурированные FBD-полипептиды являются биологически активными, т.е. могут связываться с фибрином.
Исходно рекомбинантные FBD-полипептиды продуцируются в виде тел включения, образующих после разрушения клеток нерастворимый осадок.
В соответствии с изобретением предлагается продуцирование рекомбинантных полипептидных фрагментов области связывания фибрина (FBD) для использования при визуализации тромбов и предотвращения их образования. Эти полипептидны могут быть также связаны с тромболитическим агентом для доставки агента к тромбу.
Рекомбинантными клетками, которые продуцируют полипептидные фрагменты FBD, могут быть любые клетки, в которые при помощи приемов рекомбинантной ДНК была введена ДНК-последовательность, кодирующая фрагмент полипептида FBD, которые способны ее экспрессировать. Это может быть клетка млекопитающего, дрожжевая клетка или бактериальная клетка.
Бактериальная клетка может принадлежать любому штамму, включая ауксотрофные, прототрофные и литические штаммы, F+- и F--штаммы; штаммы, несущие последовательность репрессора c1857 λ-профага; штаммы с удаленными репрессорами или геном deo.
Примерами используемых штаммов Escherichia coli дикого типа являются прототроф ATCC N 12435 и ауксотроф MC1061 (шифр хранения N 67361).
Примерами штаммов Escherichia coli, которые несут последовательность репрессора λ c1857, являются ауксотроф A1645, несущий плазмиду pTYR 279-8 (ATCC N 53216), A1637, несущий плазмиду pTY 104/2 (ATCC N 39384) и A2097: несущий плазмиду pSOD α 2 (ATCC N 39786), прототроф A4255, несущий плазмиду pFN 975-25 (ATCC N 67832) и независимый от биотина A4346, несущий плазмиду pHG 44 (ATCC N 53218).
Примером пригодного литического штамма Escherichia coli является A4048, который несет плазмиду pHG 44 (ATCC N 53217).
Примерами F--штаммов является Escherichia coli Sφ 930 (F-), несущий плазмиду pMF 5534, сданный на хранение под шифром ATCC N 67703, и Escherichia coli W31100 (F-), несущий плазмиду pMFS 929, сданный на хранение под шифром ATCC N 67705.
Примерами штаммов Escherichia coli с удаленным геном deo или репрессором deo являются Sφ 732, несущий плазмиду pMF 2005 (ATCC N 67362), Sφ 540, несущий плазмиду pJBF 5401 (ATCC N 67359), и Sφ 930, несущий плазмиду pEFF 920 (ATCC N 67706) (см. публикацию европейской патентной заявки N 0303972, опубликованную 22 февраля 1989 г.).
В качестве клетки-хозяина для плазмид можно также использовать и другие штаммы Escherichia coli, а также другие бактерии. К таким бактериям относятся Pseudomonas aeruginosa и Bacillus subtilis.
Плазмиды, используемые для продуцирования FBD-полипептидов, могут нести самые разнообразные промоторы, такие, как промотор для промотора deo.
Среди плазмид, которые можно использовать для продуцирования FBD-полипептидов, можно указать следующие:
a) плазмида pFN 975-25, которая экспрессирует FBD r31 кД и которая сдана на хранение в штамме A4255 Escherichia coli ATCC N 67832;
b) плазмида pFN 949-2, которая экспрессирует FBD r20 кД и которая сдана на хранение в штамме A4255 Escherichia coli ATCC N 67831;
c) плазмида pFN 196-2, которая экспрессирует FBD r12 кД и которая сдана на хранение в штамме A4255 Escherichia coli ATCC N 68328;
d) плазмида pFN 197-10, которая экспрессирует модифицированный полипептид FBD 12 кД и которая показана на фиг. 17;
e) плазмида pFN 201-3, которая экспрессирует фрагмент полипептида FBD 12 кД под контролем λPL и CIIrbs сайта связывания рибосом и которая показана на фиг. 25;
f) плазмида pFN 203-2, которая экспрессирует фрагмент полипептида FBD 12 кД под контролем λPL и CIIrbs и дополнительно содержит терминатор транскрипции, обозначаемый "ter", и которая показана на фиг. 26 (сдана на хранение в штамме A4255 Escherichia coli под шифром хранения N 68606);
h) плазмида pFN 208-13, которая экспрессирует фрагмент полипептида FBD 18,5 кД и которая показана на фиг. 23 (сдана на хранение в штамме A4255 Escherichia coli в ATCC под шифром хранения N 68456);
В соответствии с изобретением предлагается визуализирующий агент, который содержит полипептид, меченный визуализируемой меткой/маркером.
В предпочтительных вариантах осуществления изобретения используются полипептиды 20 кД, 18,5 кД и 12 кД.
Визуализируемый маркер, используемый в соответствии с изобретением, может быть выбран по обстоятельствам, однако в предпочтительном варианте таким маркером является радиоактивный изотоп, элемент, который является непрозрачным для X-лучей, или парамагнитный ион.
Среди радиоактивных изотопов предпочтительными маркерами являются индий-111, технеций-99М, иод-123, иод-125, иод-131, криптон-81М, ксенон-133, гелий-67 или их смеси. В наиболее предпочтительном варианте маркером является технеций-99М или индий-111.
Примерами парамагнитных ионов являются ионы следующих металлов: хрома (III), марганца (II), железа (III), железа (II), кобальта (II), никеля (II), меди (II), празеодима (III), неодима (III), самария (III), гадолиния (III), тербия (III), диспрозия (III), гольмия (III), эрбия (III), иттербия (III) или их смеси.
Полипептид 20 кД соответствует аминокислотной последовательности фрагмента области связывания фибрина человеческого фибронектина, охватывающей аминокислотные остатки 1-153, как это показано на фиг. 2-9, и имеет примерно 20 дополнительных аминокислот; полипептид 18,5 кД соответствует аминокислотной последовательности фрагмента области связывания фибрина человеческого фибронектина от 1 до 154 аминокислотного остатка, как это показано на фиг. 2-9; полипептид 12 кД соответствует аминокислотной последовательности фрагмента области связывания фибрина человеческого фибронектина от 1 до 109 аминокислотного остатка, как это показано на фиг. 2-9. При помощи частичного анализа аминокислотной последовательности заявитель показал, что полипептиды 12 кД и 20 кД, а также полноразмерный полипептид 31 кД содержат дополнительный N-терминальный метионин.
Однако область притязаний изобретения включает также полипептиды без дополнительного N-терминального метионина.
В соответствии с изобретением предлагается также способ визуализации содержащих фибрин материалов, а именно тромбов или атеросклеротических бляшек, который предполагает контактирование содержащего фибрин материала, подлежащего визуализации, с агентом, описанным выше, в подходящих для их связывания условиях и визуализацию связанного агента с соответствующей визуализацией содержащего фибрин материала.
Визуализация может быть осуществлена любым известным приемом, которые знакомы любому специалисту в этой области техники. Эти приемы включают (но ими не исчерпывается полный список) рентгеновский анализ, CAT-сканирование (компьютерная аксиальная томография), PET-сканирование, NMRI, флюороскопия. В предпочтительном варианте визуализацию фибринсодержащего материала при помощи вышеупомянутых приемов осуществляют с использованием гамма-камеры.
Все ссылки на позиции нуклеотидов соответствуют позициям в нуклеотидной последовательности кДНК человеческого фибронектина, приведенной на фиг. 2-9 (см. также фиг. 10 и 11 у Баралла Ф.Е., Публикация европейского патента N 207751, опубликованного 7 января 1987 г.).
Настоящая патентная заявка направлена на визуализирующие агенты, содержащие полипептиды, соответствующие N-концевой области домена связывания фибрина (FBD). Экспериментальные результаты с полипептидом 31 кД представлены с целью сравнения с более короткими фрагментами.
Пример 1. Получение кДНК-библиотеки фибронектина.
КДНК-библиотеку получали в λgtII из поля A + мРНК, изолированной из человеческой печени в соответствии с опубликованными процедурами (13, 14). КДНК-фрагменты клонировали с использованием EcoRI-линкеров и отбирали положительные относительно FBD-плазмиды, применяя следующие синтетические ДНК-зонды:
(3') GGGGGTCGGAGGGATACCGGTGACACAGTCTTAA (817-850)
(3') CGACGGGTGCTCCTTTAGACGTGTTGGTTACTTCCCCAGTAC (1310-1340)
Положительные кДНК-клоны субклонировали в сайте EcoRI в pB R322.
Пример 2. Экспрессия и очистка полипептидов области связывания фибрина (FBD).
A. Экспрессия частичного полипептида FBD в 20 кД.
Клоны кДНК, полученные, как это описано в примере 1 и изображено на фиг. 15, не включают ДНК, кодирующую аминокислоты 1 - 190 молекулы FN. Эти аминокислоты являются частью FBD. ДНК, соответствующую нуклеотидам с 14 по 472 и кодирующую аминокислоты 1-153 (фиг. 2), конструировали при помощи лигирования 7 пар химически синтезированных нуклеотидов (фиг. 10 и 11). Синтетический ДНК-фрагмент сконструировали так, что он содержал кодон инициирования ATG на 5'-конце, а также удобные сайты рестрикции для введения в различные векторы экспрессии. Чтобы иметь возможность дальнейшего манипулирования с ДНК-последовательностью, кодирующей FBD, нуклеотид номер 19, тимидин (T), заменили на аденин (A), исключая при этом сайт рестрикции DdeI и не изменяя аминокислотную последовательность (сайт изменения нуклеотида обозначается звездочкой в линкере # 1, показанном на фиг. 10). Различные стадии клонирования вышеупомянутого синтетического ДНК-фрагмента в векторе плазмиды pBR 322, переваренной ферментами EcoRI и BamHI, описаны на фиг. 11. Полученную плазмиду обозначали pFN 932-18. ДНК-фрагмент, кодирующий первые 153 N-терминальные аминокислоты фибронектина из плазмиды pFN 932-18, вставляли в pTY 301, вектор экспрессии λPL, между сайтами NdeI и BglII, заменяя ДНК-последовательность, кодирующую человеческий гормон роста (hGH) в плазмиде pTY 301 (фиг. 12).
Полученную в результате плазмиду, pFN 949-2, сдали на хранение в Американскую коллекцию типовых культур (ATCC) под шифром хранения N 67831. Плазмиду pFN 949-2 использовали для трансформации прототрофа Escherichia coli A4255. Эти трансформированные клетки Escherichia coli, как было установлено, экспрессируют частичный FBD-полипептид в количествах, составляющих примерно 5% от общего клеточного протеина. Этот полипептид имеет подвижность, соответствующую примерно 20 кД, на SDS-полиакриламидных гелях в восстанавливающих условиях. Он содержит первые 153 аминокислоты фибронектина с последующими 4 аминокислотами, кодирующими синтетический линкер, и несколькими аминокислотами, полученными в результате считывания в векторе pBR322, т.е. всего 153 аминокислоты плюс менее 20 дополнительных аминокислот и дополнительный N-терминальный метионин. На протяжении патентного описания полипептид именуется r20 кД или FBD r20 кД.
B. Экспрессия "полного" полипептида.
Для того, чтобы получить экспрессию полного FBD-полипептида, содержащего аминокислоты 1-262, конструировали следующие плазмиды.
1. Вставка терминирующего кодона TAA на 3'-конце.
Синтетический олигонуклеотид, содержащий терминирующий кодон TAA и BglII, имеющий следующую последовательность: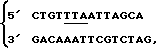
подвергали лигированию с 3'-концом фрагмента EcoRI - PvuII, выделенного из p931-5 кДНК-клона FN, и с вектором pBR322, переваренным EcoRI и MamHI, как это описано на фиг. 14. Полученную плазмиду обозначали pFN 935-12.
2. Субклонирование карбокси-терминальной области FBD в векторе экспрессии λPL.
ДНК-фрагмент EcoRI-HincII, кодирующий карбокси-терминальную область FBD, изолировали из плазмиды pFN 935-12 и подвергали лигированию с плазмидой pTY 194-80, переваренной ферментами EcoRI и SmaI, как это описано в публикации PCT N WO90/07577 настоящего заявителя (рисунок 46). Полученную плазмиду обозначали pFN 946-12.
3. Синтез и клонирование ДНК, соответствующей нуклеотидам 468-599 в FN.
Три пары химически синтезированных нуклеотидов подвергали лигированию с EcoRI-DdeI-фрагментом FN, изолированным из плазмиды pFN 932-18 (фиг. 11) в присутствии ДНК вектора pUС19 (полученной от фирмы GIBCO BRL CO,), переваренной ферментами EcoRI и XbaI, как это описано подробно в вышеупомянутой публикации РСТ (рисунок 47). Полученную плазмиду обозначали pFN 938-4.
4. Конструкция плазмиды, кодирующей полную FBD-область.
Для того, чтобы сконструировать плазмиду, которая кодирует полную FBD, от аминокислоты 1 до аминокислоты 262, ДНК-фрагмент EcoRI-XbaI, кодирующий FN, изолировали из плазмиды pFN 948-4 и вставляли в плазмиду pFN 946-12, переваренную EcoRI- и XbaI, как это описано в вышеупомянутой публикации РСТ (рисунок 48). Полученную плазмиду обозначали pFN-957. Эта плазмида содержит полную кодирующую последовательность для FBD, но не экспрессирует этот FBD-полипептид, так в ней отсутствует сайт связывания рибосом (RBS).
5. Экспрессия FBD под контролем R1 промотора λ в RBS СII.
NdeI-HindIII-фрагмент, содержащий FBD-кодирующую область и терминаторы транскрипции T1T2, изолировали из плазмиды pFN-957 и вставляли в плазмиду pTY 301, переваренную ферментами NdeI и HindIII, как это описано в вышеупомянутой публикации РСТ (рисунок 49). Полученная в результате плазмида, обозначаемая pFN 962-3, направляет экспрессию FBD-полиперптида под контролем PL промотора λ и сайта связывания рибосом CII. Штаммы Escherichia coli Al645 и A4255, трансформированные этой плазмидой экспрессировали только небольшие количества FBD-полипептида. Экспрессия FBD-полипептида обнаруживается только при помощи анализа пятен Уэстерна с использованием поликлональных антител, направленных против FN, получаемого из человеческой плазмы.
6. Экспрессия FBD-полипептида под контролем PL промотора λ , промотора β - лактамазы и сайта связывания рибосом.
Так как уровень экспрессии FBD-полипептида, полученный при помощи плазмиды pFN-3, был низким, заявитель добавил ДНК-фрагмент, кодирующий промотор β-лактамазы и RBS β-лактамазы (PBLA). ДНК-фрагмент, кодирующий PBLA, изолировали из плазмиды PBLAll (шифр хранения АТСС N 39788) и вставляли в плазмиду pFN 962-3, переваренную ферментом NdeI, достраивали ферментом Кленова и переваривали EcoRl (см. вышеупомянутую публикацию РСТ). Полученную плазмиду, обозначенную pFN 975-25, сдали на хранение в Американскую коллекцию типовых культур под шифром хранения АТСС N 67832. Эту плазмиду использовали для трансформации прототрофа Escherichia coli A4255 (F+).
Эти клетки Eschericnia coli, как было установлено, экспрессировали "полный" FBD-полипептид в концентрациях, составляющих примерно 5-8% от общего клеточного протеина. Полипептид мигрировал на SDS-PAGE гелях при восстанавливающих условиях со средней мол. м. 31 кД, поэтому его в дальнейшем обозначали как полипептид 31 кД FBD r31 кД.
С. Условия ферментации и роста
Клон, экспрессирующий FBD-полипептид r31 кД, подвергали ферментации в обогащенной среде (экстракт дрожжей и гидролизат казеина), содержащей ампициллин. Выращивание осуществляли при 30oC. Экспрессию получали при индукции при 42oC в течение 2 ч, а затем отделяли осадок бактериальных клеток, содержащий FBD-полипептид r31 кД. Точно так же клон, экспрессирующий FBD r20 кД, подвергали ферментации и получали осадок бактериальных клеток, содержащих FBD-полипептид r20 кД.
D. Ренатурация и очистка рекомбинантного полипептида (r31 кД) области связывания фибрина.
Вся процедура состояла из трех стадий.
1. Грубая обработка бактериального осадка.
2. Ренатурация/повторное окисление.
3. Очистка.
1. Грубая обработка.
Осадок cначала суспендировали в 5 объемах 50 мМ Трис-HCl/50 мМ Na-ЭДТД, pH 8 (буфер 1); затем обрабатывали 1,2 объемами буфера 1, содержащего 100 мг/л лизоцима (2 ч перемешивали при 37oC). В полученную в результате суспензию добавляли Тритон Х-100 (до 1%), спустя 30 мин при комнатной температуре суспензию центрифугировали, а осадок снова суспендировали и промывали дважды водой. r31 кД оставался в осадке, как было установлено при помощи SDS-PAGE гелей.
Промытый осадок суспендировали в 14 объемах 10 мМ Трис-HCl/5 мМ, ЭДТА/ 2 мМ PMSF/2 мМ 6-аминокапроат, pH 7,5 (буфер А), а затем последовательно обрабатывали буфером А, содержащим: а) 1% децил сульфата; б) 1% децил сульфата/5% глицерина; в) 5% глицерина. Финальную обработку осуществляли буфером А без добавок.
2. Ренатурация/повторное окисление
Принцип: осадок растворяли в 6 м гуанидин-HCl (GuCl) в присутствии восстанавливающего (тиол)агента, такого, как глютатион (GSH), и ренатурировали/повторно окисляли при более низкой концентрации CUCl путем добавления окисленного глютатиона (GSSG).
Промытый осадок со стадии 1 (выше) растворяли в 150-700 объемах 6 М GuCl/3 мМ GSH в буфере А. Концентрацию GuCl постепенно снижали сначала до 2 м, а затем до 1 м и 0,5 м, одновременно сохраняя концентрацию всех других компонент постоянной (объем на этой стадии соответствовал 500 - 1000-кратному объему осадка). При одной из промежуточных концентраций GuCl, а именно между 0,5 и 2 м, инициировали восстановление конформации при помощи добавления 0,3 мМ GSSG и инкубирования при комнатной температуре в течение 24 - 28 ч. Ренатурированный 31 кД затем подвергали диализу против буфера А без добавок.
3. Очистка.
Концентрация: большой объем реактивированного 31 кД сначала подвергали центрифугированию, чтобы удалить нерастворимую часть, которая не содержит 31 кД, а затем перед концентрированием и первичной очисткой на колонке с гепарин-сефарозой подвергали диализу против Трис-HCl, pH 7,8.
Усовершенствованные процедуры для реактивации и очистки фрагментов полипептида описаны в примере 5.
Пример 3. Фармакодинамика фрагментов полипептида области связывания фибрина r 31 кД, r 20 кД, r 18,5 кД и r12 кД.
Интенсивность и разрешение изображения сгустка ( тромба) регулируется взаимодействием скорости включения радиофармацевтического агента и скоростью очищения от него крови. Для того чтобы выявить метаболическое поведение области связывания фибрина r 31 кД и сравнить его с фибронектином (FN), в область связывания фибрина r31 кД и фибронектина плазмы включали 125I при помощи ICI-процедуры (24) и меченые формы вводили внутривенным способом крысам.
Установлено, что скорости очищения двух радиоактивных молекул различны, и спустя 5 ч циркулирует только 3% FBD r31 кД, но 20% FN.
Несколько крыс держали в отдельных метаболических клетках, а накопившуюся мочу и испражнения собирали через 7 ч и 24 ч. Примерно 30% инъецированной радиоактивности 1251-r31 кД выводилось с мочой в течение первых 7 ч, а спустя 24 ч выводилось более 90%. Вся радиоактивность в моче была растворима в трихлоруксусной кислоте, что является указанием на протеолитическое разрушение. Анализ различных органов (почки, желудок, печень, легкие, матка, яичники, надпочечники, толстая кишка, подвздошная кишка, кожа, головной мозг, глаза, мускулы, мочевой пузырь, сердце, селезенка, трахея, аорта и полая вена) не обнаружил какого-либо специфического накопления. В большинстве органов удельная радиоактивность (число отсчетов /мин/г/ткани) было ниже, чем для сыворотки.
Эти результаты указывают на то, что экзогенный рекомбинантный амино-терминальный полипептид FBD размером 31 кД постепенно разрушается и выводится из тела. Фармакологическое поведение не согласуется с кинетикой первого порядка, что может указывать на то, что этот полипептид умеренно распределяется в тканях и частях тела, отличных от крови. Это также следует из обнаруженного факта, состоящего в том, что степень разрушения не увеличивается в течение периода в 4 - 24 ч, что может быть результатом постепенного высвобождения полипептида из отдельных частей тела. Характерное и относительно раннее появление метаболитов в моче указывает на то, что этот полипептид легко выводится через почки. Отсутствие накопления материала в печени может служить указанием на то, что этот орган не является основным местом такого разрушения и не включается в детоксификацию.
Относительно короткий период полураспада FBD 31 кД является важным фактором для его использования с целью диагностической визуализации тромба. В рекомбинатный FBD 31 кД (r31 кД) можно включить радиоактивную метку или метку другого типа, а затем ввести его в кровь с целью визуализации тромба.
Более короткий период полураспада молекулы также является важным фактором, когда его используют для предотвращения образования сгустков. Необходимо отметить, что гепарин, терапевтический агент, используемый в настоящее время для этих целей, "страдает" слишком большим периодом полураспада.
Аналогичный эксперимент осуществляли с использованием иодированной области связывания фибрина 31 кД плазматического фибронектина: при этом отмечали те же фармакокинетики и распределения радиоактивности.
Заметим, что плазматический FBD в 31 кД содержит первые 259 аминокислот FN, в то время как рекомбинантный FBL 21 кД содержит перовые 262 аминокислоты FN и дополнительный N-концевой метионин.
Фармакокинетики полипептидов области связывания фибрина r20 кД, r18,5 кД и r12 кД.
Аналогичные эксперименты осуществляли с использованием полипептидов области связывания фибрина r20 кД, r18,5 кД и r 12 кД, полученных, как это описано в примерах 2, 4 и 5. Как было установлено, фармакокинетики этих полипептидов очень похожи на фармакокинетику полипептида r 31 кД.
Пример 4. Экспрессия и ферментация других полипептидов области связывания фибрина (FBD).
В примере 2 описана экспрессия частичного FBD r20 кД и FBD полной длины r31 кД, а в публикации РСТ N WO 90/07577 заявителя (примере 24) предложена улучшенная процедура для реактивации и очистки FBD 31 кД. Далее описывается конструкция плазмид для экспрессии других полипептидных фрагментов FBD.
А. Экспрессия полипептидов FBD r12 кД.
Плазмида pFN 975-25 (FNCC N 67832) экспрессирует FBD фибронектина полной длины r 31 кД. Из нее плазмиду pFN 196-2, которая экспрессирует часть FBD, конструировали, как это показано на фиг. 16. Этой плазмидой трансформировали штамм Escherichia coli A 1645, а затем штамм Escherichia coli A 4255, она сдана на хранение в штамме А 4255 в АТСС под шифром хранения N 68328. Эти трансформированные клетки эффективно экспрессируют часть полипептида FBD в количествах, составляющих примерно 5% от общего клеточного протеина. Этот полипептид имеет мобильность, соответствующую примерно 14,4 кД на SDS-полиакриламидных гелях в восстанавливающих условиях. Он содержит первые 109 аминокислот фибронектина и дополнительный метиониновый остаток на N-конце. На протяжении этой патентной заявки такой полипептид именуется как фрагмент полипептида r12 кД или FBD r12 кД.
B. Улучшенная экспрессия полипептида FBD в 12 кД.
Плазмида pFN 196-2 (ATCC N 68328), экспрессирующая фрагмент полипептида FBD 12 кД (2 "пальца") под контролем промотора λPL и сайта связывания рибосом β-лактамазы, была описана выше. Для того, чтобы повысить скорость экспрессии фрагмента 12 кД, плазмиду pFN 203-2 конструировали так, как это показано на фиг. 25 и 26 и указано в описании фигур. Плазмида pFN 203-2 экспрессирует фрагмент 12 кД под контролем λPL-промотора сайта связывания рибосом CII и последовательности завершения транскрипции trp размером 36 по. Плазмида pFN 203-2 сдана на хранение в ATCC в E. coli A4255 под шифром хранения N 68606. Эти трансформированные клетки, как было установлено, экспрессируют фрагмент полипептида FBD 12 кД в количествах, составляющих примерно 12 - 18% общего клеточного протеина.
Условия ферментации и роста.
Клон, экспрессирующий полипептид FBD r12 кД, ферментировали в обогащенной среде (экстракт дрожжей и гидролизат казеина), содержащий ампициллин. Выращивание осуществляли при 30oC. Экспрессию получали индукцией при 42oC в течение 2 ч, а затем получали лепешку бактериальных клеток, содержащих полипептид FBD r12 кД. Аналогичным образом получали осадок клеток, содержащих другие протеины.
C. Экспрессия модифицированного FBD-полипептида 12 кД (12 кД').
Плазмиду pFN 975-25 (ATCC N 67832), которая обеспечивает экспрессию FBD полной длины (r31 кД), использовали для конструирования плазмиды pFN 197-10, которая экспрессирует модифицированный полипептид r12 кД (r12 кД'), как это показано на фиг. 17. Последовательность FBD-фибронектина модифицировали для того, чтобы получить сайт NdeI сразу же после нуклеотида 340. Этой плазмидой трансформировали штамм Escherichia coli A1645, а затем штамм Escherichia coli A4255. Эти трансформированные клетки, как было показано, эффективно экспрессируют модифицированный r12 кД в количествах, составляющих примерно 5% общего клеточного протеина. Этот полипептид имеет мобильность, аналогичную немодифицированному FBD 12 кД (устанавливали на восстановленных SDS-полиакриламидных гелях). Он содержит первые 109 аминокислот фибронектина, а затем дополнительные аминокислоты, гистидин и метионин. На N-окончании полипептида имеется дополнительный метионин. Этот полипептид обозначали как полипептид r12 кД' или FBD r12 кД'.
D. Экспрессия полипептида FBD 18,5 кД.
Как описано выше (пример 2A), фрагмент FBD 20 кД, экспрессируемый плазмидой pFN 949-2 (ATCC N 68456), содержит до 20 дополнительных аминокислот из вектора pBR 322 из-за считывания после окончания гена FN в отсутствие правильно расположенного кодона завершения транскрипции TAA. Для того, чтобы обеспечить более аутентичный "3-пальцевый" фрагмент полипептида FBD, конструировали плазмиду, кодирующую полипептид FBD 18,5 кД.
Эта конструкция приведена на фиг. 23 и описана в описании фигуры. Полученная в результате плазмида, обозначенная pFN 208-13, экспрессирует фрагмент полипептида FBD 18,5 кД под контролем PL-промотора и сайта связывания рибосом β -лактамазы. Плазмида pFN 208-13 сдана на хранение в ATCC в A4255 E. coli под шифром хранения N 68456. Эта плазмида экспрессирует первые 154 аминокислоты фибронектина с дополнительным N-концевым метионином.
Пример 5. Восстановление конформации и очистка рекомбинантных полипептидов 20 кД и 12 кД области связывания фибрина в фибронектине.
Процедура восстановления структуры и очистки полипептидов r20 кД и r12 кД состоит из трех стадий:
1. Грубая обработка бактериального осадка.
2. Реактивация/повторное окисление.
3. Очистка.
1. Грубая обработка.
1.1. Промывка и экстрагирование осадка.
Осадок бактериальных клеток, полученный, как это описано в примере 2 для полипептида r20 кД и как это описано в примере 4 для полипептида r12 кД, разрушали и промывали по существу так же, как для полипептида r31 кД (см. публикацию PCT N WO 90/07577 заявителя, с. 121 и след.); однако в процедуру экстрагирования, используемую как для полипептида r20 кД, так и r12 кД, вносили изменения. Ниже приведен пример процедуры промывки и экстрагирования, осуществляемых на осадке клеток, содержащих полипептид r20 кД; полипептид r12 кД экстрагировали аналогичным образом.
1.2. Методика.
Бактериальный осадок, содержащий полипептид r20 кД, получали, как это описано в примере 2, используя для ферментации штамм Escherichia coli A4255, несущий плазмиду pFN 949-2. Часть осадка (14,8 г) суспендировали в 10 объемах 50 мМ Трис-HCl, 50 мМ ЭДТА (буфер B), pH 7,5. Суспензию гомогенизировали в течение 15 - 30 с со средней скоростью, обрабатывали ультразвуком 3 раза по 4 мин с пульсациями и центрифугировали со скоростью 15000 об/мин в течение 30 мин. Осадок снова суспендировали в 2,4 объемах (36 мл) буфера B. Добавляли лизоцим (0,1 мг/мл) и суспензию инкубировали в водяной ванне при 37oC в течение 2 ч при перемешивании. Добавляли Тритон X-100 до финальной концентрации 1%, перемешивали при комнатной температуре 30 мин и центрифугировали. Осадок снова суспендировали три раза в 148 мл воды (т.е. 10 объемах исходного осадка), гомогенизировали, перемешивали в течение 30 мин при комнатной температуре и центрифугировали. Результирующий осадок имел массу приблизительно 1,5 г, т.е. только 10% от исходной массы, однако оба полипептида r20 кД и r12 кД остаются в этом объеме, что было установлено при помощи электрофореза в SDS-полиакриламином геле. Промытый и экстрагированный осадок хранили в замороженном виде при -20oC до последующей обработки.
2. Солюбилизация и ренатурация полипептида.
2.1. Используемые реагенты и процедура отличаются в этом случае от тех, что использовались для полипептида r31 кД. Осадок полипептида r20 кД или r12 кД растворяли в 6 М гуанидин-HCl (GuCl) в присутствии 50 мМ β-меркаптоэтанола, а затем после десятикратного разбавления подвергали окислению воздухом.
2.2. Методика.
Замороженный осадок r20 кД (1,5 г) подвергали солюбилизации и гомогенизации в 10 объемах 10 мМ Трис-HCl, 5 мМ ЭДТА (буфер C), pH 8,0, содержащих дополнительно 6 М гуанидин-HCl. Образец восстанавливали добавлением 57 μл неразбавленного β-меркаптоэтанола (финальная концентрация 50 мМ) и перемешивали в герметически закрытом сосуде в течение 30 мин. Затем его по каплям (со скоростью примерно 5 мл/мин) добавляли в 10 объемов (148 мл) буфера C, pH 8,0 и давали возможность окислиться. При этом содержимое постоянно и осторожно перемешивали (в открытом химическом стакане) в течение 48 - 72 ч при комнатной температуре. В качестве алтернативы окисление осуществляли в закрытом сосуде в присутствии 0,3 мМ GSSG. Хотя на этой стадии уже наблюдается некоторое осаждение полипептида, суспензию, содержащую осадок, подвергали диализу в течение 24 ч против 15 объемов буфера C, pH 8,5 с тремя заменами буфера. Диализат затем подвергали центрифугированию в течение 45 мин со скоростью 15000 об/мин (22500 • g) в высокоскоростной центрифуге Бекмана, снабженной двигателем JA-17. При этом удаляются многие загрязняющие протеины и агрегаты r20 кД или r12 кД, которые продуцируются во время окисления.
3. Очистка и характеристика полипептида.
Так как расположение сайта связывания гепарина внутри области связывания фибрина неизвестно, не было уверенности, что новые, более короткие, полипептиды r20 кД и r12 кД будут связываться с гепарином-сефарозой. Однако заявитель обнаружил, что более короткие молекулы обладают этим свойством.
Заявитель установил, что колонка из фенил-сефарозы, как в случае r31 кД, для очистки окисленных полипептидов r20 кД или r12 кД не нужна. Здесь значительное улучшение в том, что касается удаления примесей, неправильно восстановленных молекул и димеров, достигается, если образец подвергнуть хроматографии на колонке из Q-сефарозы, причем перед тем, как осуществить хроматографию на колонке из гепарин-сефарозы. В некоторых случаях полипептид концентрировали на системе типа Pellicon (фирма Millipore Corp.), используя мембраны с соответствующим ограничением, а именно 10 кД для полипептида r20 кД и 3 кД для полипептида r12 кД, перед тем как загрузить материал на колонку из Q-сефарозы. Колонку гепарин-сефарозы также использовали для концентрирования обоих полипептидов. Ниже приведен пример процедуры очистки, используемой в случае полипептида r20 кД.
3.1. Хроматография на Q-сефарозе.
Одну треть окисленного r20 кД (47 мл) наносили на 10 мл проточную колонку из Q-сефарозы, которую предварительно уравновешивали буфером C, pH 8,5 (скорость потока 1,2 мл/мин). Вытекающую фракцию собирали и хранили (70 мл). Полипептиды, связанные с колонкой, элюировали буфером C, pH 8,5, содержащим 0,5 М NaCl, а колонку регенерировали при помощи 0,5 М NaOH.
3.2. Хроматография на гепарин-сефарозе.
Поток, прошедший через колонку Q-сефарозы, наносили на 10 мл колонку гепарин-сефарозы, предварительно уравновешенную буфером pH 8,5 (объемная скорость 0,5 мл/мин). Вытекающая фракция содержала главным образом примеси и неправильно ренатурированный полипептид r20 кД. Очищенный (до чистоты более 95%) полипептид r20 кД элюировали буфером C, pH 8,5, содержащим 0,5 NaCl, а колонку регенерировали в том же буфере, содержащем доолнительно 6 М гуанидина-HCl. Приведены таблицы для общей очистки r20 кД (табл. 1) и r12 кД (табл. 2).
3.3. Характеристика полипептидов.
Супернатант после отделения бактериального осадка для получения полипептидов r20 кД и r12 кД, а также порции последовательных фракций с колонки анализировали на наличие полипептида и анализировали также при помощи электрофореза в SDS-полиакриламидном геле; профили их элюирования получали на колонке из Superose 12, соединенной либо с FPLC, либо с ЖХВД. Эти профили на различных стадиях реактивации, а также очистки приведены для r20 кД (фиг.21) и для r12 кД (фиг. 22). Очищенные полипептиды r20 кД или r12 кД элюируют в виде отдельных четких полос. Эти профили подтверждают результаты, полученные в SDS-PAGE-гелях при невосстанавливающих условиях; полосы для образцов обоих полипептидов (r20 кД и r12 кД) являются недиффузионными, что указывает на наличие одной молекулярной формы. В случае r20 кД полоса невосстановленного полипептида проступает (как в случае полипептида r31 кД) быстрее, чем полоса для восстановленной формы. Такого различия, однако, не было отмечено в случае полипептида r12 кД. Дополнительные подробности о свойствах полипептидов FBD приведены в примере 9.
Эти FBD-полипептиды пригодны для радиомечения с целью использовать их в качестве радиофармацевтических агентов для визуализации тромбов и атеросклеротических патологий.
Преимущества использования для вышеупомянутых целей меньших по сравнению с r31 кД FBD-полипептидов (r20 кД и r12 кД) послужили причиной направленного поиска заявителем более простого способа их получения. Приемы, которые описаны выше, являются более оперативными и более простыми по сравнению с приемами, предложенными для реактивации и очистки полипептида r31 кД. Кроме того, предлагаемые процедуры приводят к более высокому выходу, чем процедура для полипептида r31 кД, и к более высокому выходу полипептида (до 10 мг/мл).
Пример 6. Биологическая активность полипептидов области связывания фибрина r31 кД, r20 кД и r12 кД.
Биологическая активность полипептида FBD r31 кД, которая касается его связывания со сгустками фибрина in vivo и in vitro связывания с бактерией и связывания с внеклеточной матрицей, описана в публикации PCT N WO 90/07577 заявителя, с. 134 и след. В этом примере приводятся сведения о биологической активности FBD-полипептидов r20 кД и r12 кД.
А. Сравнение связывания с предварительно образованным фибриновым сгустком 125I-меченых r31 кД, r20 кД, r12 кД и плазматического FBD.
Связывание с фибриновыми сгустками определяли следующим образом (реакция II).
Стадия 1. Образование фибринового сгустка.
Его можно получить с использованием одной из двух следующих процедур .
а) При помощи инкубирования при 37oC 20 μл обработанной цитратом цельной человеческой крови с 5 мМ CaCl2, 1 ед/мл тромбина и PBS в финальном объеме 250 μл. Реакцию прекращали спустя 45 мин при помощи центрифугирования и промывки осадка (дважды) 1 мл PBS.
b) При помощи инкубирования при 37oC 20 μл не обработанной цитратом цельной человеческой крови. Реакцию прекращали спустя 150 мин при помощи центрифугирования и промывки, как в процедуре а).
Стадия 2. Связывание 125I-FBD-полипептида с предварительно образованным фибриновым сгустком.
Сгустки инкубировали при 37oC в конечном объеме 260 μл PBS с 125I-rFBD-полипептидом. Как указано в каждом эксперименте, можно добавлять другие компоненты. Реакцию связывания прекращали спустя 45 мин при помощи центрифугирования и промывки три раза PBS. Пробирки, содержащие осадок 125I-rFBD-фибрина, измеряли на радиоактивность при помощи гамма-счетчика.
Результаты.
Полученные результаты показывают (фиг. 20), что плазматический 31 кД связывается в той же степени, что r31 кД, в то время как полипептиды r20 кД и r12 кД связываются только примерно в половине случаев по сравнению с полноразмерной (31 кД) молекулой. Однако уровень связывания полипептидов r20 кД и r12 кД все-таки достаточно высок, чтобы обеспечить возможность применения радиомеченных полипептидов r20 кД и r12 кД в качестве радиофармацевтических агентов для визуализации тромбов.
B. Связывание 125I-r12 кД со свежими или замороженными сгустками.
Для того, чтобы изучить эффект замораживания сгустков перед использованием в экспериментах со связыванием с FBD-полипептидами, осуществляли следующий эксперимент. Фибриновые сгустки либо использовали свежими, либо после хранения при -70oC в двухстадийной реакции связывания с 125I-r12 кД FBD, полученным, как это описано в примере 6.
Этот эксперимент осуществляли в присутствии трансглютаминазы или без нее. Результаты показали, что имеется лишь незначительный эффект замораживания на способность сгустков связывать FBD r12 кД. В общем случае замороженные сгустки без добавления трансглютаминазы дают результаты, аналогичные свежим сгусткам в присутствии трансглютаминазы; эффект на реакцию связывания экзогенной трансглютаминазы при использовании замороженных сгустков отсутствует.
C. Сравнение рекомбинантных FBD-полипептидов 12 кД, 20 кД и 31 кД в модели венозного тромба, индуцированного спиралью из нержавеющей стали.
Три рекомбинантных полипептида, меченных 125I, как это описано в примере 3, использовали в модели крысы, описанной ниже.
Самок крыс Вистар (200-250 г) подвергали анестезии при помощи введения Кетамина HCl и Ксилазина HCl. Делали срединную лапаротомию и вскрывали внутреннюю полую вену. Спираль из проволоки из нержавеющей стали вставляли в просвет вены в точке, расположенной несколько ниже соединения, и разрез зашивали. Каждое вставленное средство отдельно взвешивали перед вставкой и каждый вес фиксировали. Через 3 ч после операции животным внутривенным способом вводили 1 мл 0,9% раствора NaI для того, чтобы насытить иодидом щитовидную железу. Один час спустя крысам вводили внутривенным способом 125-I-rFBD/5 • 106 отсчетов/мин; 100 μг/кг). Полипептид метили, как это описано в примере 3. Через 24 ч после применения меченого полипептида брали кровь при помощи укола в сердце, после чего крыс усыпляли. Сегмент вены, несущей спираль, удаляли. В одной группе сегменты, несущие спираль, взвешивали как таковые и использовали для изменения радиоактивности (группа "Тромб на месте"). В другой группе разрезали вену в продольном направлении и спирали, несущие тромбы, аккуратно извлекали, взвешивали и измеряли радиоактивность. Уровни радиоактивности крови измеряли, используя периферийную кровь.
Результаты, приведенные на фиг. 19 показывают, что каждая из трех молекул специфически локализована в сгустках. Оказалось, что удельная радиоактивность сгустков выше для более длинных молекул, чем для более коротких полипептидов (143 000, 78500 и 63 000 отсчетов/мин/г для сгустков с r31 кД, r20 кД и r12 кД полипептидов соответственно), но эти отличия не были статистически значимыми. Значения удельных радиоактивностей для крови (спустя 24 ч) точно также связаны с молекулярным размером (7040, 5016 и 3300 отсчетов/мин/г для полипептидов r31 кД, r20 кД и r12 кД соответственно) и могут отражать различия в скорости очищения крови этих молекулярных видов. Следовательно, вычисления отношения удельных радиоактивностей сгустка к крови давали результаты, значения которых похожи для трех различных полипептидов и изменяются в области вблизи 20. Эти результаты указывают на то, что все три вида FBD (или другие фрагменты FBD) могут служить для визуализации тромбов.
Пример 7. Введение метки в полипептиды с целью применения для визуализации атеросклеротических поражений и тромбов.
В полипептиды области связывания фибрина, описанные в этой патентной заявке (полипептиды r31 кД, r20 кД и r12 кД), может быть введена радиоактивная метка. В примере 3 описана процедура введения метки в три указанных полипептида при помощи иода 125 (125I), который имеет большой период полураспада (60 дней).
Другим радиоактивным иодом, который можно использовать для введения метки в FBD-полипептиды, используя известные приемы, например, тот, что описан Уехарой и др. (1), является иод 131 (131I). 131I также имеет относительно продолжительный период полураспада (8 дней).
В оптимальном случае радиофармацевтический агент для клинической визуализации атеросклеротических повреждений и тромбов должен давать положительные результаты в течение первых нескольких часов после инъекции (33). Поэтому для такого испытания можно использовать более коротко живущие радиометки, например индий-III (IIIIn) или технеций-99М (99мТc) (период полураспада 67 ч и 6 ч соответственно (32).
Введение метки в FBD-полипептиды при помощи 99мTc может быть осуществлено с использованием известных приемов (21, 33, 34, 35). 99мTc является весьма эффективным диагностическим радионуклеотидом ввиду его короткого периода полураспада, уровня обнаружения в 140 KeB на гамма-счетчике, отсутствия облучения другими частицами, дешевизны и широкой доступности.
Другой коротко живущей меткой с низкой энергией является иод-123 (123I) с периодом полураспада 13,3 ч.
можно использовать для введения в FBD-полипептиды также криптон-81м (81мKr) и ксенон-133 (133Xe), которые имеют период полураспада 5,3 дня, как это указано Найтом (4). Потенциальной радиометкой является галлий-67 (67Ga): как указано Ямамото (36), 67Ga имеет период полураспада 78 ч. В одном из вариантов воплощения заявитель вводил метки в r31 КД, r20 кД, r18,5 кД и r12 кД полипептиды и плазматический фрагмент в 31 кД с использованием IIIIn, следуя процедуре, описанной для альбумина человеческой сыворотки в Hnatowich, D.J., Layne, W.W. и Chilcs, R.L., J.Appl. Radiat.Inst., т. 33, с. 327, (1982). Предварительные эксперименты показали, что меченые IIIIn FBD - полипептиды связываются с образованными ранее тромбами in vitro (измерения осуществляли при помощи двухстадийной реакции, пример 6) и с тромбами in vivo (измерения осуществляли при помощи модели, описанной в примере 6.C). Выявлено высокое отношение тромб:кровь в области 80 - 200 спустя 24 ч.
Процедура радиомечения протеинов 12 кД и 18,5 кД.
ДТПК - модификацию (диэтилентриаминпентауксусной кислотой) фрагментов полипептида FBD в 12 кД и 18,5 кД осуществляли в целом в соответствии с известными приемами (Hnatowich, D. J. Layne, W.W. and Childs, R.L. (1982) Int. J.Appl.Radiat-Isot т. 33, стр. 327-332; Knight, L.C. и др. (1987) Biochim, Biophys. Acta т. 924, с. 45-53), используя циклический ангидрид ДТПК. Порции раствора сухого хлороформа, содержащие рассчитанные количества ДТПК-эквивалентов, выпаривали и осуществляли реакцию с протеинами в забуференном либо фосфатом, либо бикарбонатом физрастворе (pH 7,4 и 8,0 ± 0,2 соответственно). Избыток (гидрализованной) ДТПК удаляли при помощи глубокого диализа. Мечение осуществляли при помощи не содержащего носителя IIIIn в HCl-растворе, нейтрализованном до примерно pH 6 при помощи ацетата натрия. В одном эксперименте (в PBS) метили полипептид 12 кД, получаемый в соответствии с описанием из примера 5, что давало отношение содержания тромб/кровь (в модели крысы), равное 86. При этом использовали расчетный молярный избыток ДТПК, равный 5, т.к. в прототипе 12 кД имеются 5 лизиловых ε -амино групп и 1 α -амино группа. При мечении при помощи IIIIn концентрацию свободного (несвязанного) IIIIn оценивали как менее 15% (при помощи TCX).
В другой серии экспериментов (в BBS) использовали отношение между ангидридом ДТПК и либо протеином 12 кД, либо протеином 18,5 кД 1:1.
Для того, чтобы оценить число ДТПК-остатков, включаемых в каждую молекулу полипептида 12 кД, ДТПК - модифицированный протеин (перед отделением избытка ДТПК) метили при помощи IIIIn (Найт и др., см. выше). Число включаемых ДТПК-остатков, как было установлено, составляет 0,12 на молекулу полипептида 12 кД. ДТПК-меченые фрагменты FBD r12 кД и r18,5 кД имели идентичные профили элюирования на Superose 12 (гель-фильтрация) с профилем элюирования для контрольного модифицированного протеина (времена удерживания 19,17 мин и 18,29 мин соответственно - контрольные значения приведены в табл.4). При введении метки IIIIn, после отделения избытка ДТПК было установлено, что количество свободного (несвязанного) IIIIn составляет 28 и 29% протеина 12 кД и 18,5 кД соответственно. Этим обеспечивается отношение тромб/кровь (в модели крысы) соответственно 27 и 25.
Визуализация с использованием металлов вместе с ионным ЯМР, ультразвуковым и рентгеновским облучением описана в патенте США N 4647447. Кроме того, в столбце 7, строка 42, упомянуто связывание антитела с хелатами металлов. Моноклональные антитела, меченные полимерными парамагнитными хелатами, и их использование в соответствии с приемами ИЯМР (ионного ядерного магнитного резонанса) также известны (Shreve, P. и др., Magnetic Resonance in Medicine, т. 3, с. 336-340. 1986 и Brady, T. и др., Proceedings of the Society of Magnetic Resonance in Medicine, Second Annual Meetinge, Soc. of Magnetic Resonance in Medicine, Inc. San Fransisco 1983, где содержится ссылка на Koutcher, J. и др. J.Nucl.Med., т. 25, с. 506-513, 1984).
Пример 8. Дополнительные эксперименты, подтверждающие биологическую активность различных FBD-полипептидов.
Биологическая активность FBD-полипептидов r31 кД, r20 кД, r12 кД описана в примере 6. В этом примере будут приведены дополнительные результаты, полученные с использованием фрагмента FBD 12 кД, который был получен в соответствии в описанием, приведенным в примерах 4 и 5, и фрагмента FBD 18,5 кД, полученного как это описано в примере 4.
I. Связывание с фибриновым сгустком.
Образование сгустка и FBD-связывание осуществляли, как это описано ниже (модифицированная версия двустадийной реакции, описанной в примере 6). Чтобы избежать артефактов агрегации и осаждения FBD-полипептидов, финальную стадию центрифугирования исключали, а сгусток переносили в новую пробирку и тщательно промывали.
а. Коагуляция "предварительно образованного сгустка".
Реакционные смеси (300 μл), полученные в силиконизированных пластиковых пузырьках (7 мл) от гамма-счетчика, содержали 150 μл смеси 1, состоящей из 0,2 X буфера Тирода ("1 x буфер Тирода": 1 мМ Хепес, pH 7,35, декстроза 0,2%, 27 мМ NaCl, 0,76 мМ NaH2PO4, 0,54 мМ KCl, 0,2 мМ MgCl2), 3 ед/мл Тромбина (фирма Сигма), 0,6% БСА (фирма Сигма), 15 мМ CaCl2, 150 мМ NaCl, 20 mM NaHCO3, pH 8,0, и 150 μл свежей, обработанной цитратом, человеческой крови.
Инкубирование проводили при 37oC в течение 3 ч. Сыворотку удаляли под вакуумом, а пробирки, содержащие фибриновый сгусток, хранили замороженными при -70oC. Предварительно образованные сгустки можно использовать в течение нескольких месяцев.
в. Связывание FBD с "предварительно образованным сгустком".
В пузырьки, содержащие "предварительно образованные сгустки" (после оттаивания при комнатной температуре), добавляли 300 μл 150 мМ NaCl, 20 мМ NaCOH3, pH 8,0, содержащих 1 • буфер Тирод, 0,6: БСА, 5 мМ CaCl2, и 0,15 μМ 125I-FBD. Реакцию связывания осуществляли (в отсутствии или присутствии 0,03% иодацетата натрия, который можно добавить в эту смесь, чтобы ингибировать активность эндогенной трансглютаминазы, фактора XIIIa) при 37oC в течение 18 ч. Далее сгусток переносили в силиконизированный пузырек, промывали 3 раза 1 мл "промывочного буфера" (20 мМ NaCHO3, 1% БСА, 1 мМ PMSF, 2 мМ ЭДТА) и проводили подсчет в гамма-счетчике.
Результаты сравнения плазматического и рекомбинантного 31 кД с рекомбинантным 18,5 кД, 12 кД, 45 кД (FBD в 12 кД, слитый с CBD 33 кД, полученный, как это показано на фиг.20) и CBD 33 кД приведены на фиг. 27. Все фрагменты FBD-полипептида связывались в одинаковой степени в то время, как CBD-полипептид связывался только в очень небольшой степени. 50 - 75% ингибирование, вызванное добавлением ингибитора фактора XIII иодацетата, показывает, что трансглютаминаза является активной в реакции связывания. Отсутствие эффекта ингибитора на связывание CBD 33 кД со сгустком указывает на то, что связывание CBD со сгустками происходит согласно другому, возможно, неспецифическому механизму.
II. Связывание с сосудистыми компонентами.
В дополнение к специфическому связыванию с фибрином FBD-полипептиды также демонстрируют некоторую степень неспецифического связывания с другими сосудистыми компонентами, с которыми они вступают в контакт. Примерами таких сосудистых компонент являются эндотелиальные клетки (EC), внеклеточная матрица (ECM) и даже сам фибронектин (FN). Это неспецифическое связывание является одним из факторов, который определяет "уровень отсчета" при осуществлении процедур диагностической визуализации. Чем ниже неспецифическое связывание, тем более эффективна визуализация и тем меньше необходимо применять радиоактивного реагента к пациенту. Было проведено сравнение неспецифического связывания с сосудистыми компонентами фрагмента FBD 12 кД и FBD-полипептида 31 кД.
Порции, содержащие 0,3 М 125I - 12 кД или 125I - 31 кД (5 • 105 отсчетов/мин μг и 7,5 • 105 отсчетов/мин μг соответственно в 1 мл PBS, включающего 0,1% BCA, добавляли в сдвоенном анализе в 35 мм чашки Петри (фирма Falcon), содержащие конфлюент эндотелиальных клеток (EC), внеклеточную матрицу (ECM), (Eldor и др., Blood, т. 65, с.1477, 1985) или иммобилизованный человеческий фибронектин (FN) (1 мл наносили на пластинку с PBS, содержащую 50 μг/мл FB, после инкубирования при 4oC в течение ночи, и инкубировали в течение 2 ч при комнатной температуре с 1 мл PBS, содержащим 1% BCA для блокировки). Символ "+TG" означает, что пластинки содержали также трансглютаминазу в концентрации 0,02 Ед/мл (фирма Сигма). Экспериментальные пластинки инкубировали 60 мин при 37oC в CO2-инкубаторе, промывали 3 раза 1 мл "промывочного раствора" (PBS, содержащий 2 мМ PMSF и 2 мМ ЭДТА). Затем связанную радиоактивность экстрагировали инкубированием 60 мин с "экстрагирующим раствором" (промывочный раствор, содержащий 1% дезоксихолата Na, 2 мМ PMSF, 2 мМ ЭДТА, 2 мМ NME и 2 мМ иодуксусной кислоты). Этот раствор затем переносили в пробирки и радиоактивность измеряли в гамма-счетчике.
Результаты показывают, что FBD-полипептид 12 кД связывается с сосудистыми компонентами (эндотелиальными клетками, внеклеточной матрицей и фибронектином) значительно слабее, чем 31 кД.
III. Бактериальное связывание.
Связывание FBD-полипептида 31 кД с S. aureus ранее было описано (см. Публикацию PCT WO 90/07577 заявителя с. 146 - 153). Аналогичные эксперименты, описанные ниже, показывают, что в контрасте с полипептидом FBD 31 кД фрагменты полипептидов FBD в 12кД и 18,5 кД не связываются с S. aureus непосредственно и не ингибируют связывание S. aureus с эндотелиальными клетками. Однако полипептид 20 кД несколько снижает связывание S. aureus, что можно объяснить дополнительными (неаутентичными) C-терминальными аминокислотами (см. пример 2), которые могут нарушать его активность.
В табл. 3 суммированы и сравниваются различные активности фрагментов FBD по изобретению.
Таким образом, очевидно, что фрагменты полипептида FBD в 18,5 кД и 12 кД обладают высокой специфичностью ковалентного связывания для фибрина вместе с более узким спектром активностей и более узкой по сравнению с 31 кД специфичностью по отношению к другим лигандам, таким, как сосудистые компоненты и бактерии. Это является предпочтительной характеристикой для агента визуализации тромба, которая гарантирует, что как диагностический реагент он обладает высоким сродством в отношении фибринсодержащего тромба и дает низкие уровни фона.
Пример 9. Характеристика фрагментов FBD.
I. Процедуры.
Фрагменты полипептидов FBD, полученные в соответствии с предлагаемыми в настоящей патентной заявке способами, анализировали и сравнивали в серии испытаний, осуществляемых при помощи следующих приемов, хорошо известных в этой области техники.
1. SDS - PAGE+ ME (β-меркаптоэтанол).
На 12,5% акриламидные плоские гели загружали протеин, который предварительно обрабатывали при помощи кипячения в течение 5 мин в буфере образца, содержащем 1% SDS - при восстанавливающих условиях (+1% ME). Электрофорез осуществляли с использованием 20 μг на полоску, а гели окрашивали бриллиантовой синью кумасси. Измеряли следующие параметры: a) мобильность, которая при сравнении с маркерами молекулярной массы (94, 67, 43, 30, 20,1 и 14,4 кД) может быть выражена в виде средней молекулярной массы для изучаемого протеина; b) однородность или чистоту, которую можно получить из относительных интенсивностей сильных и слабых полос.
2. SDS - PAGE - ME. На 12,5% акриламидные плоские гели нагружали протеин, который предварительно обрабатывали в течение 5 мин в буфере образца, содержащем 1% SDS - при невосстанавливающих условиях (-ME). Электрофорез осуществляли с использованием 20 μг на полоску и гели окрашивали бриллиантовой синью кумасси. Измеряли следующие параметры: a) мобильность, которая при сравнении с маркерами молекулярной массы (94, 67, 43, 30, 20,1 и 14,4 кД) можно выразить в виде средней молекулярной массы для изучаемого протеина; b) однородность или чистоту, которые можно получить из относительных интенсивностей сильных и слабых полос (в частности, при этих условиях можно оценить количества димеров, связанных дисульфидной связью).
3. Гель-фильтрация на Superose 12. Среднюю молекулярную массу и однородность препаратов протеина оценивали из профилей элюирования, полученных на колонке Superose 12 (HR10) 30, фирма Pharmacia Fine Chemicals, соединенной либо с аппаратом FPLC (жидкостной хроматографии с программированием скорости потока), снабженным контроллером для жидкостей хроматографии LCC-500 и записывающим средством (фирма Pharmacia Fine Chemicals), либо с системой ЖХВД (фирма Waters Associates), состоящей из 2 насосов (модели 501), инжектора (модели U6K) и автоматизированного контроллера градиента (модели 580), снабженного детектором с переменной длиной волны - Spectro - Monitor 3000 (LDC/Milton Roy) - и хромато-интегратором (фирма Merck-Hitachi, модели 2000). Эту колонку подвергали калибровке при помощи следующих стандартов молекулярной массы, для которых определяли время удерживания: БСА (67 кД), яичный альбумин (43 кД), химотрипсиноген (25 кД) и рибонуклеаза (13,7 кД). Объемные скорости составляли 0,8 мл/мин (использовался стандартный рабочий буфер, а именно 150 мМ NaCl - 20 мМ Трис.HCl, pH 7,8 - 8,0). Наблюдали за двумя параметрами: время удерживания и ширина полосы половинной высоты.
4. УФ-спектроскопия. Спектры получали при комнатной температуре в BBS или PBS при концентрациях 0,2 - 1 кг/мл на спектрофотометре (сканирующем) типа Филипс УФ/Вис модели РУ8720 (ширина полосы 2 нм), снабженном принтером/плоттером. Спектры измеряли на силикагелях типа Pye Unicam UV с длиной пробега 10 мм. Наблюдали за двумя параметрами: коэффициентом поглощения, а именно ε1% в λмакс спектров и отношением между поглощениями в λмакс и λмин.
5. Собственная флуоресценция. Данные получали на спектрофлуорометре модели ФП-770 при 25 ± 0,1oC. Длина волны возбуждения составляла 2250 нм и обе щели для возбуждения и эмиссии устанавливали на 5 нм. Концентрация протеина в анализе составляла 8 - 25 μг/мл либо в PBS, либо в свежем BBS, pH 7,5. Имеется заметная pH-зависимость обоих измеряемых параметров, т.е. λмакс (длина волны максимума спектра) и удельной интенсивности (интенсивность флуоресценции в максимуме спектра, нормализованная концентрацией протеина в мг/мл).
6. Аминокислотный состав. Это испытание осуществляли в соответствии с общепринятой методологией Стейна и Мура для аминокислотного анализа.
Использовали анализатор типа Biotronic LC 5000, серийный номер 515-01. Параметром, анализируемым этим методом, является число остатков каждой аминокислоты, исключая Cys и Trp.
7. Хроматография на гепарин-сефарозе. Образцы до 200 μл инъецировали в аналитическую колонку из гепарин-сефарозы (5,5 • 0,5 см), соединенную с ЖХВД-системой (фирма Waters Associates). Колонку предварительно уравновешивали 10 мМ фосфатом натрия, pH 6,5 мМ NaCl с объемной скоростью 0,5 мл/мин и промывали в течение 5 мин тем же буфером. Протеины элюировали в линейном градиенте от 75 до 500 мМ NaCl в буфере на 37,5 мин. Анализировали два параметра: время удержания (ret.time) и ширину полосы половинной высоты (half-ht.b.w.), которая определяет однородность пика.
8. Обращенно-фазовая ЖХВД хроматография. Образцы инъецировали на аналитическую колонку для обращенно-фазовой хроматографии типа Waters C18 Bondapak (30 • 0,39 см), соединенной с системой ЖХВД, которую предварительно уравновешивали 80% H2O, 0,1% ТФК% ацетонитрилом, 0,08% ТФК с объемной скоростью 1 мл/мин и промывали в течение 5 мин при помощи тех же растворителей. Протеины элюировали в линейном градиенте до 40% H2O - 0,1% ТФК: 60% ацетонитрила - 0,08% ТФК на 40 мин. Анализировали два параметра: время удерживания (ret.time) и ширину полосы половинной высоты (half-ht.b.w.), которая определяет однородность пика.
9. Триптические карты. Образцы 200 μг с различных режимов получения образцов переваривали в течение 10 мин при 37oC при различных долях трипсина (м/м в %: 0,25, 0,5, 1,0, 2,5, 5,0 и 10,0. Реакцию прекращали добавлением 5 мМ PMSF и последующим выдерживанием 30 мин на льду; затем пробу обрабатывали буферами образцов ± МЕ (см. разделы 1.1 и 1.2) и анализировали на 20% акриламидных плоских гелях, как это описано выше. Степень эквивалентности между структурами полос оценивали после окрашивания бриллиантовой синью кумасси.
10. Метод Эллмэна для определения тиола в протеинах. Такое определение осуществляли на денатурированных протеинах для того, чтобы обеспечить полный доступ к тиоловым группам.
Растворы 1. Гуанидин-HCl (самого чистого доступного качества) 7,2 М в 10 мМ Трис-HCl, pH 8 (GuCl).
2. DTNB (реагент Эллмэна) 5 • 10-3М в 100 мМ К-фосфатном буфере, pH 7.
Метод. Образцы протеина, содержащие 10 - 100 μМ тиоловых групп, доводили до объема 0,15 мл; добавляли чистый DTNB (без следов протеина) и 0,75 мл GuCl 7,5 М (финальная концентрация 6 м). После инкубирования в течение 15-30 мин при комнатной температуре "заготовку" протеиновых растворов анализировали в области 412 нм. 100 μл DTNB затем добавляли до конечной концентрации 5 • 10-4 М. После инкубирования в течение 30 мин при комнатной температуре образцы считывали в области 412 нм относительно "чистого" DTNB. Концентрацию вычисляли, используя ε = 13600 М-1 см-1.
11. Осаждение/адсорбция.
Пробиркам Эппендорфа, содержащим замороженный 125I-FBD, давали возможность оттаять при комнатной температуре, а затем резко перемешивали. Две порции по 5 μл брали для анализа радиоактивности. Раствор центрифугировали на высокой скорости в центрифуге Эппендорфа, в верхний слой сливали в другую силиконизированную пробирку. Две порции по 5 μл снова анализировали на количество отсчетов. Различия между радиоактивностью, полученной до и после центрифугирования, представляют "процент осаждения".
Если 125I-FBD хранят замороженным (при 70oC) в силиконизированных пробирках и буфере с высоким содержанием соли (0,6 М NaCl), протеин оказывается весьма стабильным. Однако, если хранение осуществляли в несиликонизированных пробирках в буфере с низким содержанием солей (150 мМ NaCl), 125I-FBD-осаждение может достигать 60-80% в течение 2-3 дней. При этих условиях и осаждение и адсорбция в пробирке являются существенными.
12. Реакция полипептидов FBD с 14С- путресцином.
Метод. Реакционные смеси (100 μл) в силиконизированных пробирках Эппендорфа содержат: 10 мМ CaCl2, 50 мМ Трис-HCl (pH 7,5), 5 мМ ДТТ, 120 μМ 14С-путресцина (фирма Сигма), 6 μM FBD и 0,05 ед/мл трансглютаминазы печени морской свинки (сигма). После инкубирования при комнатной температуре в течение 0,15, 30 и 60 мин порции (10 μл) добавляли в пробирки, содержащие 200 μл стоп-реагента (0,4 мг/мл БСА, 50 мМ ЭДТА, 150 мМ NaCl, 20 мМ NaHCO, pH 8,0) при 0oC (на льду). Добавляли холодную 20% ТХУ (250 μл) и затем инкубировали 10 мин на льду, добавляли еще 3 мл холодной 20% ТХУ и содержимое пробирки фильтровали на фильтре из стекловолокна (Whatmab GF\C). Фильтры промывали 3 раза холодной 20% ТХУ и один раз 70% этанолом. Осаждаемый ТХУ радиоактивный материала анализировали в бета-счетчике. Доступность Gln#3 FBD для трансглютаминирования вычисляли на основе удельной активности 14С-путресцина и концентрации FBD в реакционной смеси; включение 5% от общего количества отсчетов эквивалентно 100% доступности.
13. Самоассоциация.
Реакцию осуществляли в 300 μл 150 мМ NaCl - 20 мМ NaHCO3, pH 8,0, содержащего также 0,1 х буфер Тирода; 0,6% БСА; 5 мМ CaCl2; 0,15 μМ 125I-FBD, 6 μл трансглютаминазы (0,02 ед/мл) (см. раздел 12).
Реакционные смеси инкубировали при 37oC в течение 18 ч, затем осуществляли вакуумную вытяжку реакционного раствора, промывали 3 раза 1 мл "промывочного буфера" и измеряли радиоактивность на гамма-счетчике.
II. Результаты.
Все FBD-полипептиды содержат дополнительный метионин на амино-окончании, а вместо пироглютаматного остатка, который является блокированным N-окончанием в p31 кД (полученным в результате пост-трансляционной модификации из кодированного Gln) за N-концевым Met следует остаток Gln. Положительная идентификация FBD-фрагментов также подтверждается анализом пятен Уэстерна на гелях, которые проявляются под действием анти-20 кД.
В табл. 4 приведены результаты измерений для анализируемых FBD-полипептидов (r12 кД и r18,5 кД получены в результате экспрессии плазмид pFN 203-2 и pFN 208-13 соответственно).
Пример 10. Мечение in vivo тромбов при помощи IIIIn FBD 12 кД и 18,5 кД в модели крысы со спиралью из нержавеющей стали.
Используемая модель является по существу той же, что была описана в примере 6.С. Фрагменты рекомбинантного полипептида в 12 кД, 18,5 кД и 31 кД метили с использованием IIIIn при помощи ДТПК - процедуры (пример 7). Меченые материалы (с удельной активностью приблизительно 5 106 отсчетов/мин/μг) вводили внутривенным способом (5 • 106 отсчетов/мин/крысу) несущим спираль крысам через 5 ч после введения спиралей. Спирали, несущие тромбы, удаляли и осуществляли подсчет через 24 ч после применения метки. На фиг. 28 приведены результаты удельной радиоактивности в спиралях и крови, а на фиг. 29 приведены соответствующие отношения тромба в крови. Наиболее высокие значения обнаруживали в тромбах группы с FBD 31 кД (по сравнению с группами, содержащими фрагменты FBD в 12 кД и 18,5 кД). Однако отношения тромб/кровь выше для FBD-фрагментов 12 кД и 18,5 кД благодаря более низким значениям для крови по сравнению с FBD 31 кД. Это может быть объяснено узким спектром специфичностей и активностей более коротких фрагментов по сравнению с полипептидом 31 кД (пример 8, табл. 3).
Пример 11. Использование IIIIn-ДТПК-модифицрованных FBD-протеинов с высокой радиохимической чистотой для того, чтобы получить высокие отношения тромба к крови в модели крысы.
1. Модификация и радиомечение ДТПК-модифицированных протеинов FBD.
Методологию ДТПК-модификации и радиомечения ДТПК-модифицированных протеинов FBD, описанную в примере 7, предварительно усовершенствовали. Это позволило получать высокие отношения тромб/кровь в модели крысы с введенной спиралью.
1.1. ДТПК-модификации. Все три рекомбинантные молекулы (r31 кД, r18 кД и r12 кД) модифицировали при помощи 20-кратного избытка ДТПК в 0,1 М HEPES-буфере, pH 7,0, а избыток ДТПК удаляли при помощи гелевой фильтрации.
1.2. Введение радиоактивной метки. Одно из изменений, введенных в процедуру, заключалось во введении радиометки при помощи IIIInCl3 при низком pH (0,2 М цитратный буфер, pH 5,7) (для уменьшения минимального количества радиоколлоидов).
Для удаления ионов тяжелых металлов, которые могут вытеснить желатный IIIIn из ДТПК-модифицированного протеина, осуществляли замену буферов раствора радиомеченного FBD на обработанные chelex-100 буферы.
2. Протокол модификации и введения радиометки в протеины FBD.
Подробное описание усовершенствованной процедуры ДТПК-модификации и введения радиометки в полипептиды r31 кД, r18,5 кД и r12 кД FBD приведено ниже.
2.1. Обессоливание. Протеины (все в 0,5 м NaCl в присутствии ЭДТА и других ингибиторов протеаз) обессоливали и переносили в буфер HEPES (0,1 М, pH 7). FBD 31 кД (27 мл, 0,6 мг/мл) обессоливали при помощи диализа, в то время как полипептиды FBD 18,5 кД (5 мл, 8,7 мг/мл) и 12 кД (5 мл, 5,6 мг/мл) обессоливали на колонках гель-фильтрации типа PD-10.
2.2. ДТПК-модификация. Ее осуществляли с 20-кратным избытком ангидрида ДТПК в течение 1 ч при комнатной температуре в объеме 27 мл в случае FBD 31 кД и 7 мл в случае FBD 12 кД и 18,5 кД. Порции (100 μл) модифицированной смеси брали с целью определения количества ДТПК-остатков, которые были включены в протеины, а свободную ДТПК удаляли из оставшегося материала при помощи гель-фильтрации на колонке Sephadex G-25, 2,6 • 60 см, которую предварительно уравновешивали буфером HEPES. Фракции (30 мл), содержащие протеины, собирали и получали концентрации фрагментов в 0,35 мг/мл, 0,8 мг/мл и 0,9 мг/мл для FBD r31 кД, r18?5 кД и r12 кД соответственно. Как было установлено, степень модификации, которую определяли при помощи ТСХ на силикагеле (проявляли в 85% метаноле), составляла 1,1, 0,8 и 1,6 для вышеуказанных полипептидов соответственно. ДТПК-модифицированные фрагменты FBD хранили замороженными при -10oC, и оттаявшие порции давали воспроизводимые результаты при введении радиометки с использованием IIIIn.
2.3. Введение радиометки. Мечение осуществляли с использованием IIIIn-Cl3, который предварительно переводили в 0,2 М цитрат натрия, pH 5,7, при помощи добавления 125 μл 1 М цитрата натрия, pH 5,7, в 500 μл не содержащего носителя сырьевого раствора IIIInCl3(IIIIn: 3,2 мCi/мл). Реакционная смесь для введения метки содержала (конечные концентрации): FBD-полипептид 0,2 μг/мл, HEPES 60 мМ, HCl 10 мМ, цитрат натрия 0,2 М и IIIIn 0,8 μCi/μл. Реакции давали возможность протекать в течение 1 ч при комнатной температуре. Радиохимическую чистоту анализировали при помощи ТСХ на силикагеле (проявляли в 85% метаноле), и для всех фрагментов FBD-полипептидов она изменяется в области 91-95%. Таким образом, удельная активность радиомеченных протеинов FBD составляет примерно 3,6 μCi/μг. Так как ионы металлов, потенциально содержащиеся в качестве следовых примесей в буферах, используемых в процессе введения радиометки, могут вытеснять IIIIn, который связан с ДТПК-модифицированными FBD-фрагментами, радиомеченные полипептиды пропускали через слой 10 мл Sephadex-25, который предварительно уравновешивали и проявляли при помощи БСА-содержащего буфера, BBS, обработанного Chelex-100 (чтобы удалить примеси ионов металлов).
3. Биологическая активность.
Биологическую активность испытывали in vitro при помощи связывания IIIIn-меченого, ДТПК-модифицированного FBD с предварительно образованными сгустками, а также in vivo на крысах (в модели с индуцированными спиралью венозными тромбами).
3.1. Связывание с предварительно образованными сгустками.
Это испытание осуществляли так же, как оно описано в примере 6 для иодированного FBD. Удельная активность трех IIIIn-меченых ДТПК-модифицированных фрагментов FBD составила 6 • 106отсчетов/мин μг протеина. Результаты экспериментов приведены в табл. 5 (второй столбец).
3.2. Венозные тромбы у крыс.
Используемая модель (венозные тромбы, вызванные спиралью) описана в примере 6.С. В этих экспериментах каждая группа состояла из 7 крыс, которым инъецировали 5 • 106 отсчетов/мин IIIIn-меченого, ДТПК-модифицированного фрагмента FBD с удельной активностью 6 • 106 отсчетов/мин/μг. Результаты этих экспериментов приведены в табл. 5.
IIIIn-меченого ДТПК-модифицированного фрагмента FBD (с удельной активностью 6 • 106 отсчетов/мин/μг белка).
Результаты приведены в табл. 5 (3 последних столбца).
Литература
1. Uehara, A., et al., J. Nuclear Med. 29: 1264-1267, 1988.
2. Zoqhbi, S.S., et al., Invest. Radio. 20: 198-202, 1985.
3. Kakkar, V.V., et al., Lancet 1: 540-542, 1970.
4. Knight, L.C., Nuclear Med. Commun. 9: 849-857, 1988.
5. Knight, L.C., Nuclear Med. Commun. 9: 823-829, 1988.
6. Som. P., et al., J. Nuc. Med. 27: 1315-1320, 1986.
7. Palabrica, T.M., et al., Proc. Nat. Acad. Sci. USA 86: 1036-40, 1989.
8. Akiyama, S.K. and Yamada, K.M., Adv. Enzymol. 57: 1-57, 1987.
9. Pierschbacher, M.D., et al., J. Biol. Chem. 257: 9593-9597, 1982.
10. Pande, H. and Shively, J.E., Arch. Biochem. Biophys. 213: 258- 265, 1982.
11. Hayashi, M. and Yamada, K.M., J. Biol. Chem. 258: 3332-3340, 1983.
12. Sekiguchi, K. and Hakomori, S.-I., Proc. Natl. Acad. Sci. USA 77: 2661-2665, 1980.
13. Ruoslahti, E., et al., J. Biol. Chem. 256: 7277-7281, 1981.
14. Owens, R.J. and Baralle, F.E., EMBO J. 5: 2825-2830, 1988.
15. Obara, M., et al., FEBS Letters 213: 261-264, 1987.
16. Obara, M., et al., Cell 53: 699, 1988.
17. Ichihara-Tanaka, K., et al., J. Biol. Chem. 265: 401-407, 1990.
18. Mandel, et al. , Principal and Practice of Infectious Disease 2: 1531-1552, 1979.
19. Proctor, R.A., et al., J. Biol. Chem. 255: 1181-1188, 1980.
20. Eldor, A., et al., Thrombosis and Haemostatis 56(3): 333-339, 1986.
21. Fritzberg, A.R., Nucl. Med. 26: 7-12, 1987.
22. Young, R. A. and Davis, R.W., Proc. Natl. Acad. Sci. USA 80: 1194- 1198, 1983.
23. Hugh, T., et al., In DNA Cloning: A Practical Approach (D. Glover, ed.), IRL Press, Oxford, 1984.
24. Vogel, et al., Proc. Natl. Acad. Sci. USA 69: 3180-3184, 1972.
25. Bagly, D., et al., Methods in Enzymol. 45: 669-678 1976.
26. Wagner and Hynes, J. Biol. Chem. 254: 6746-6754, 1979.
27. McDonagh, R.P., et al., FEBS Lett. 127: 174-178, 1981.
28. Mosher, et al., J. Biol. Chem. 255: 1181-1188 (1980).
29. Russel, P.B., et al., J. Clin. Micro. 25: 1083-1087, 1987.
30. Bolton, A. E. and Hunter, W.M., Biochem. J. 133: 529, 1973.
31. Obara, et al., Cell 53: 649-657, 1988.
32. Fritzberg, A. R. , et al., Proc. Natl. Acad. Sci. 85: 4025- 4029, 1988.
33. Knight, L.C., et al., Radiology 173: 163-169, 1989.
34. Wasser, M.N.J.M., et al., Blood 74: 708-714, 1989.
35. Burger, J.J., et al., Methods in Enzymology 112: 43-56, 1985.
36. Yamamoto, K., et al., Eur. J. Nucl. Med. 14: 60-64, 1988.
37. Peterson, et al., in Fibronectin, edited by Moshen, Academic Press, USA, 1989: p. 1-24, particularly figure 2 on page 5.
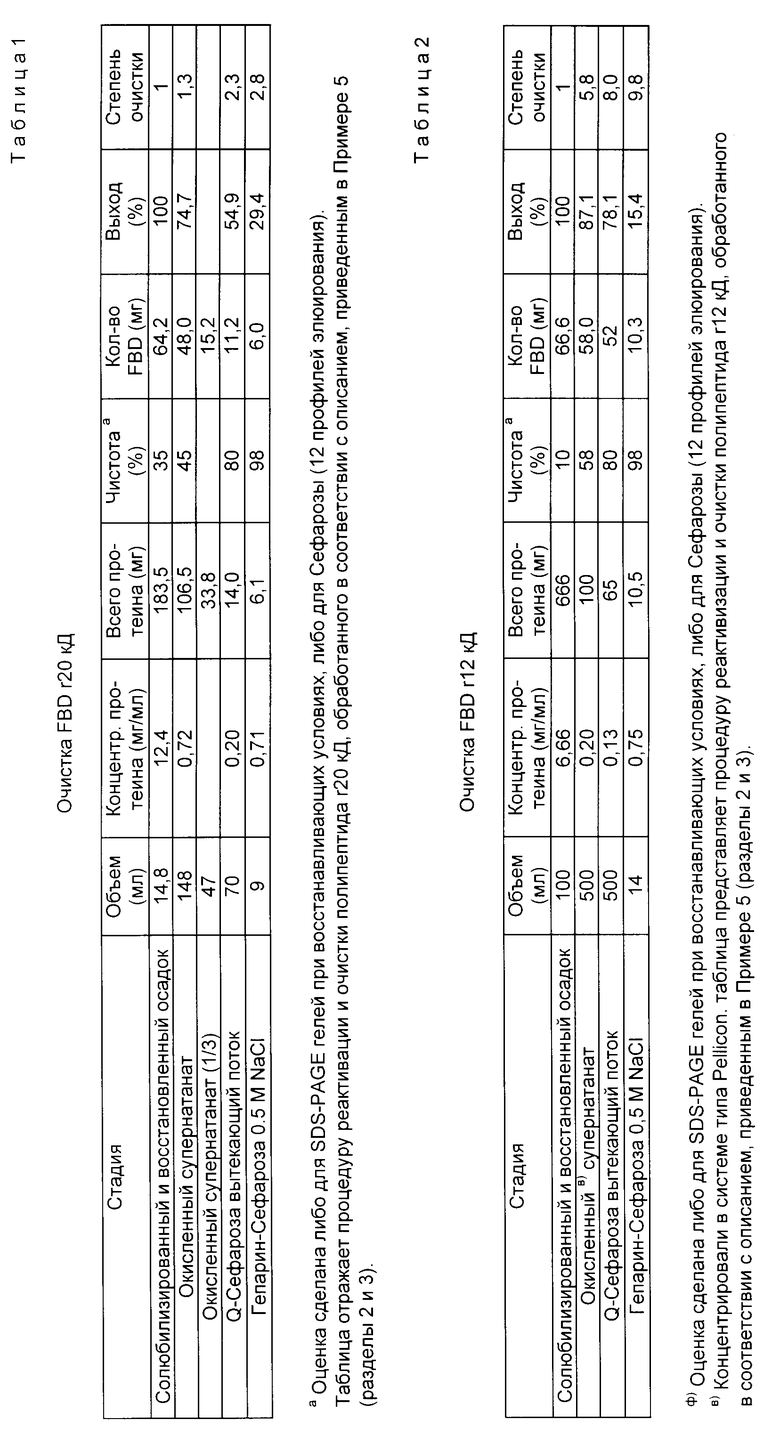


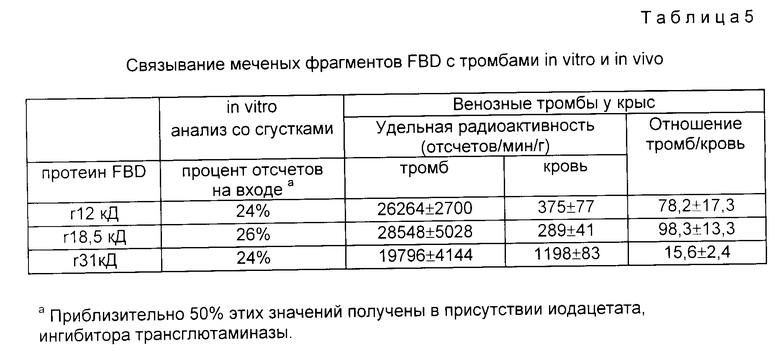

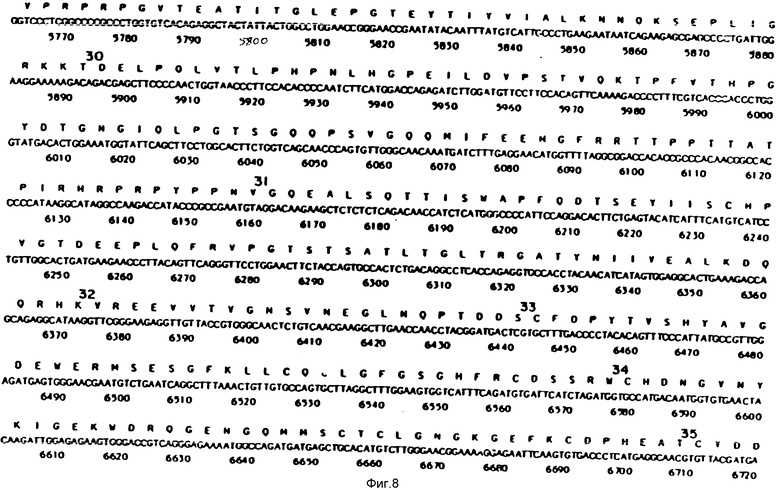
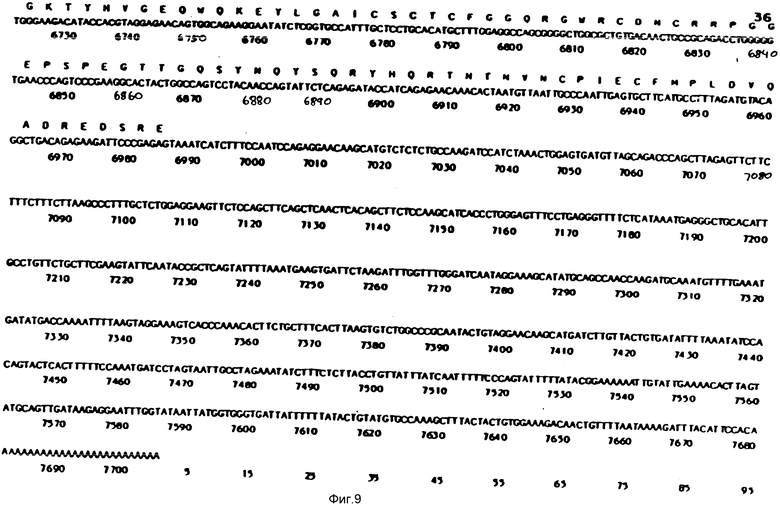


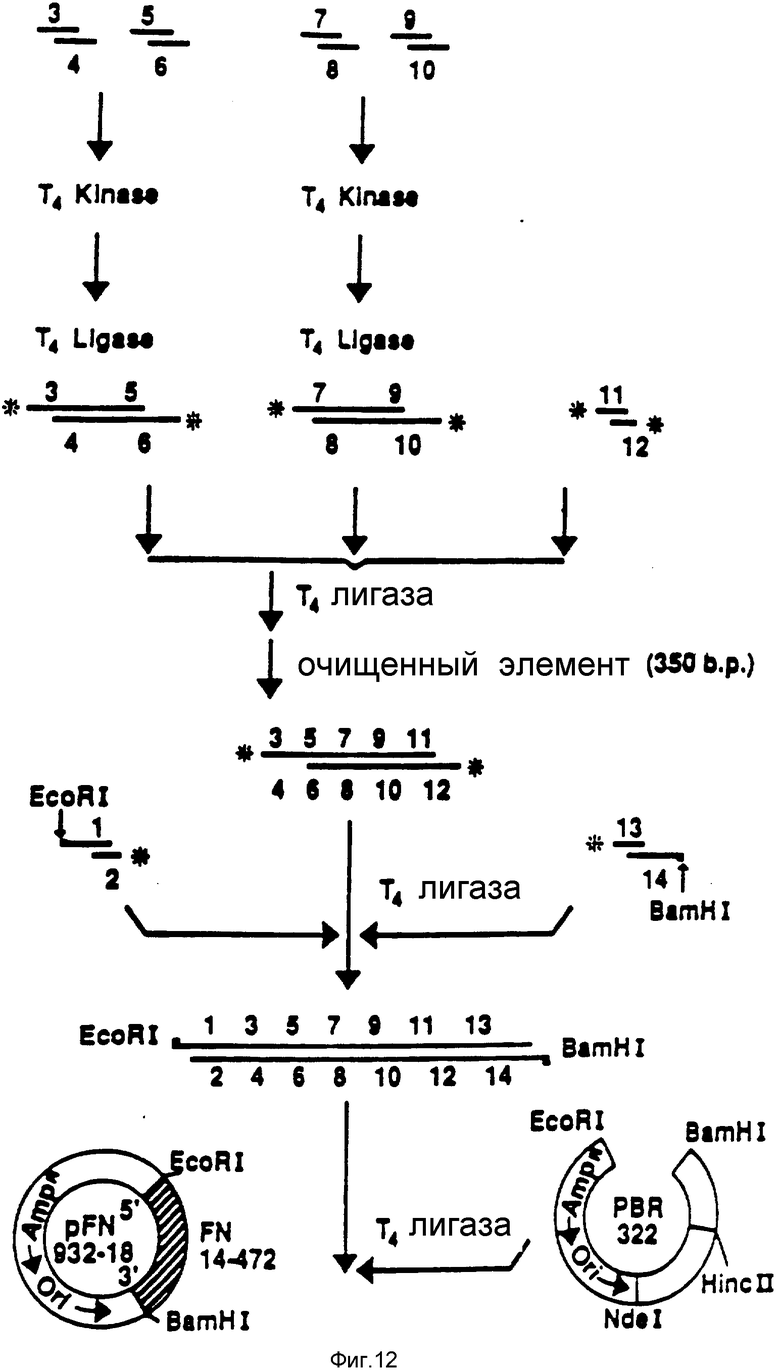
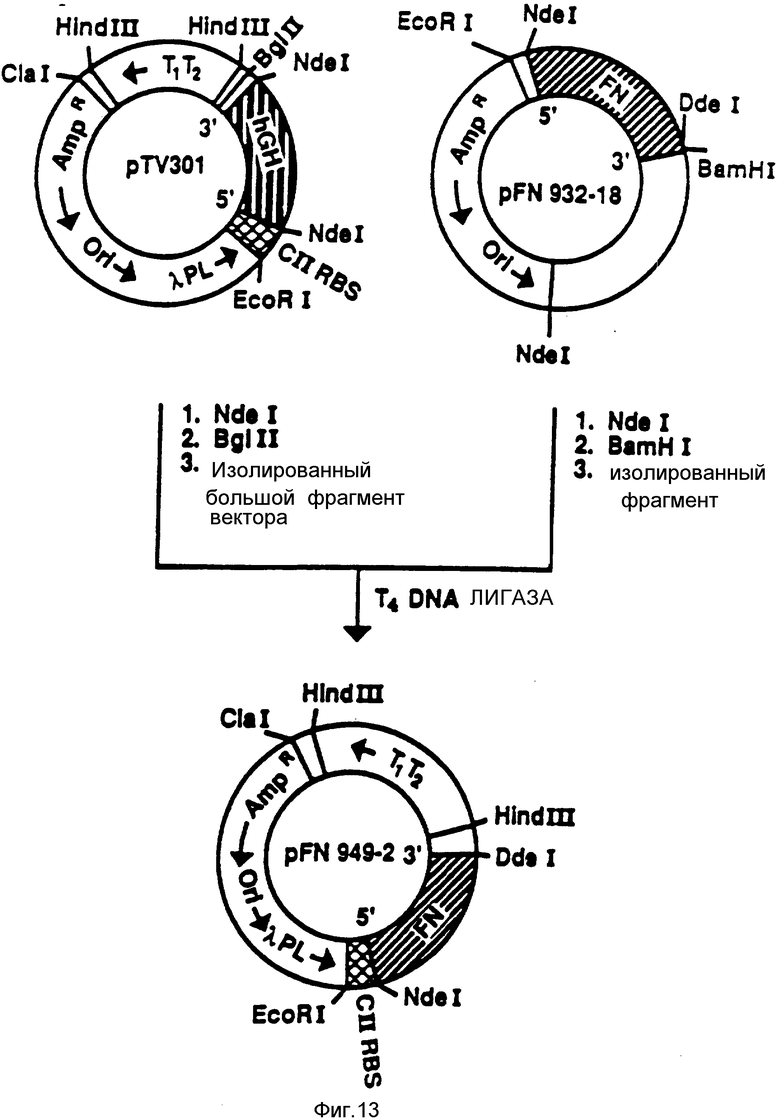
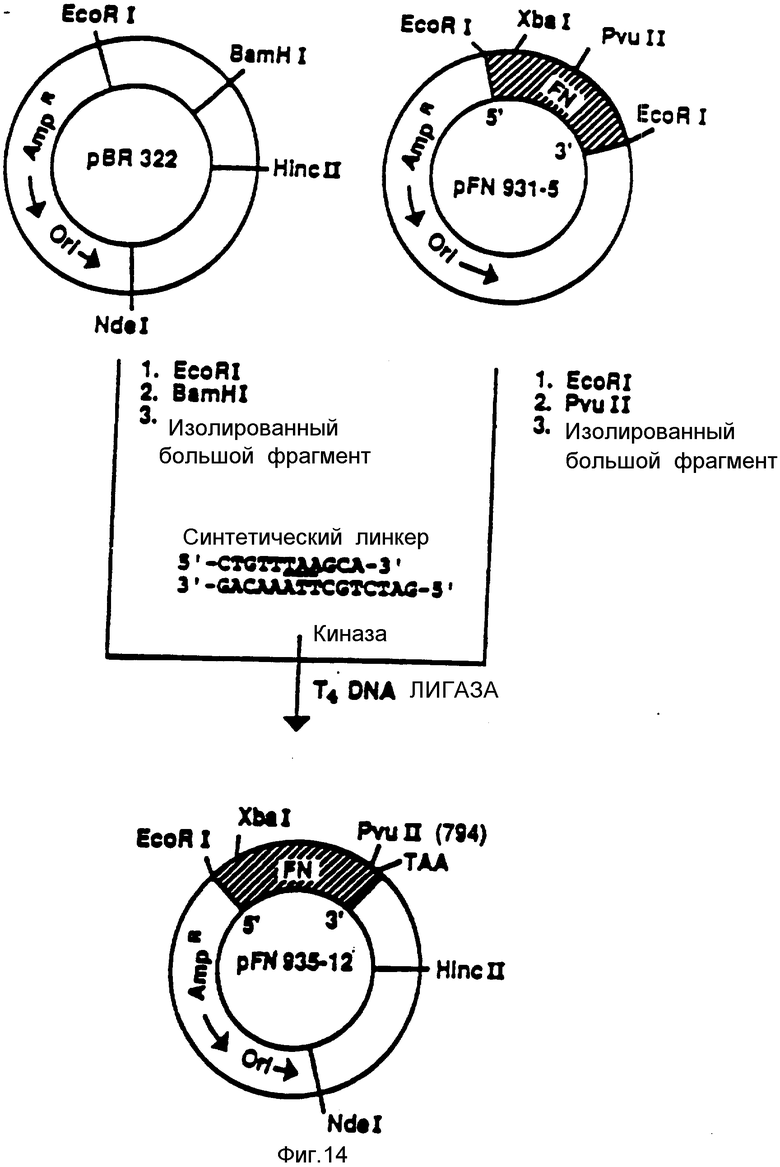
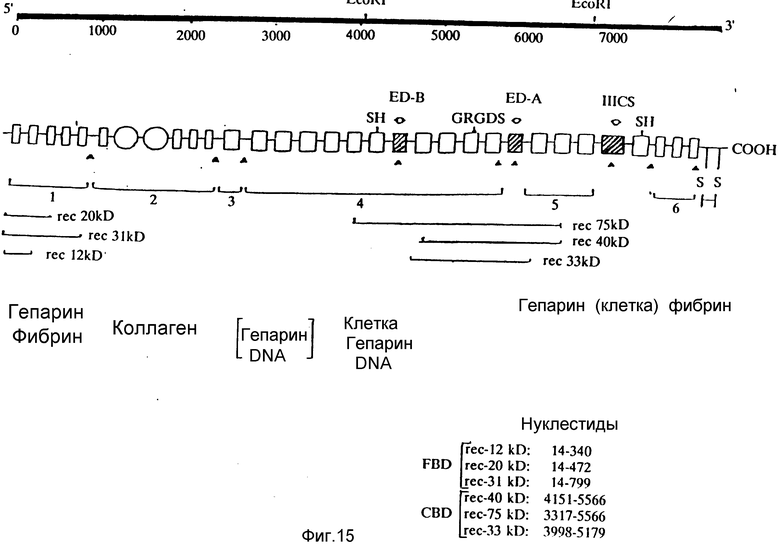
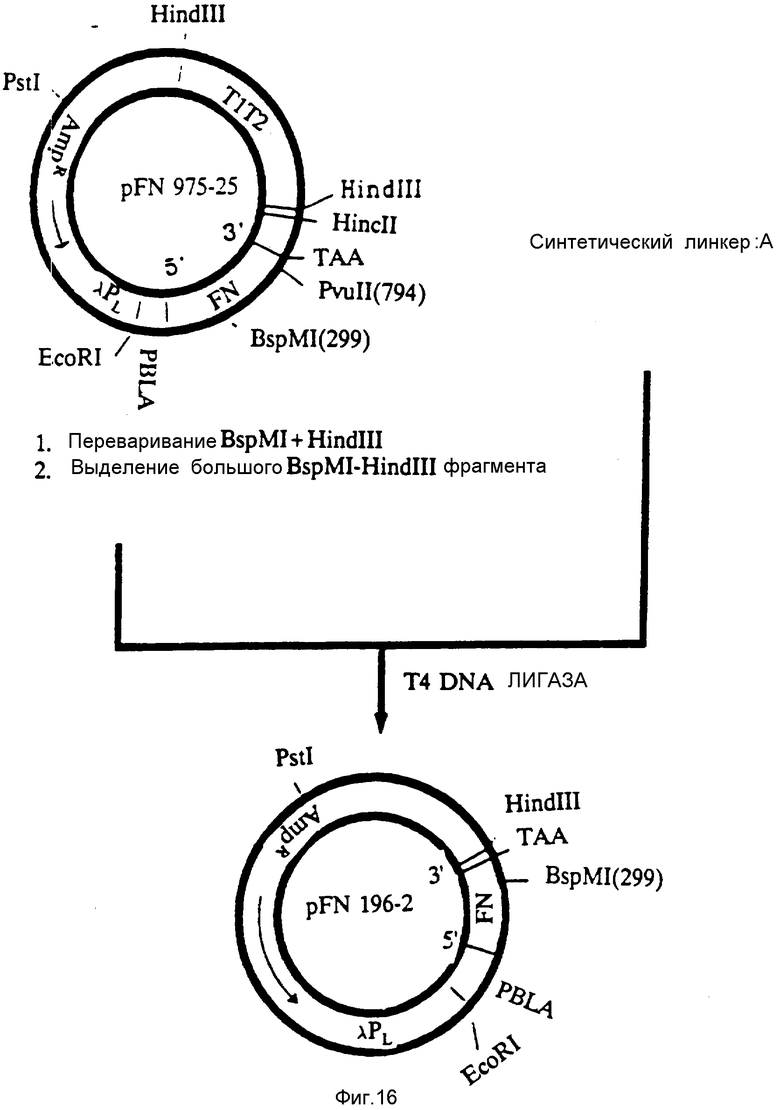
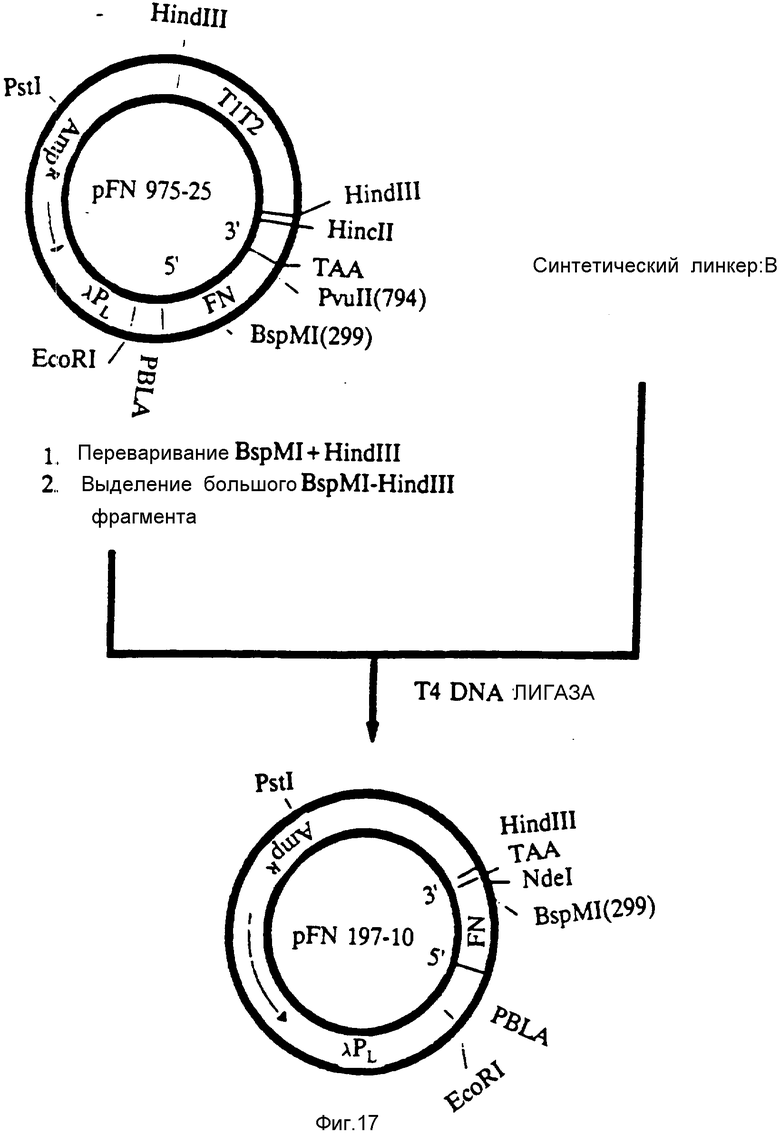
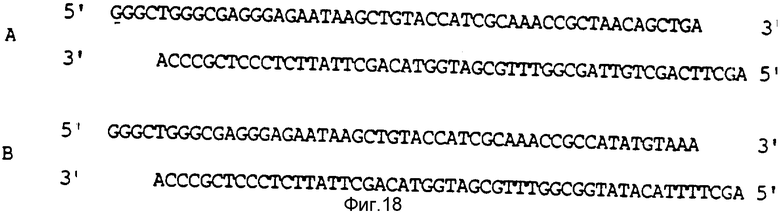
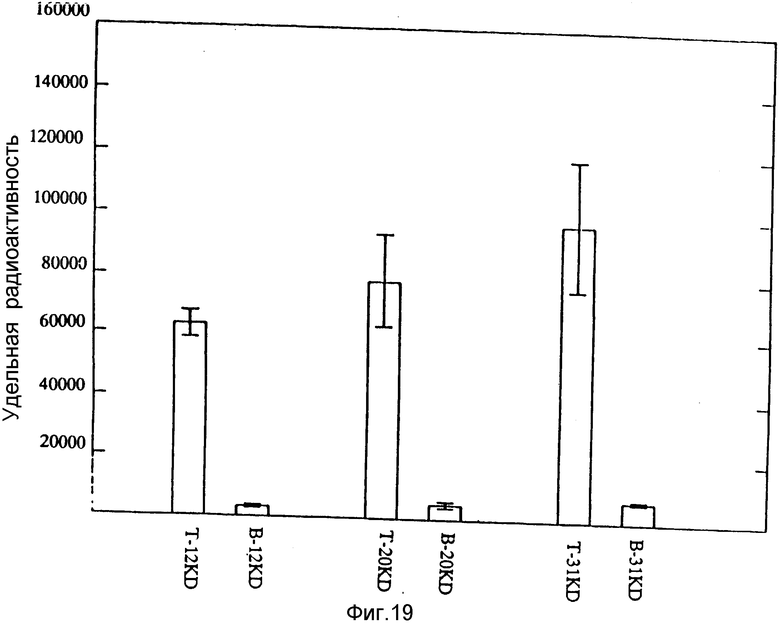
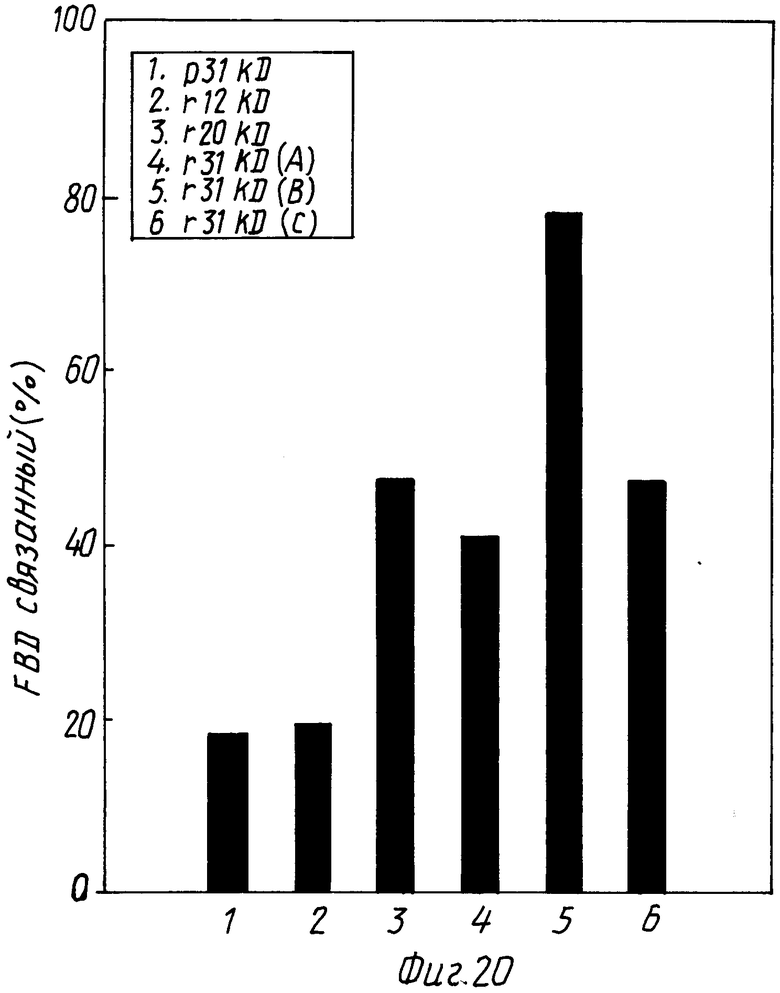
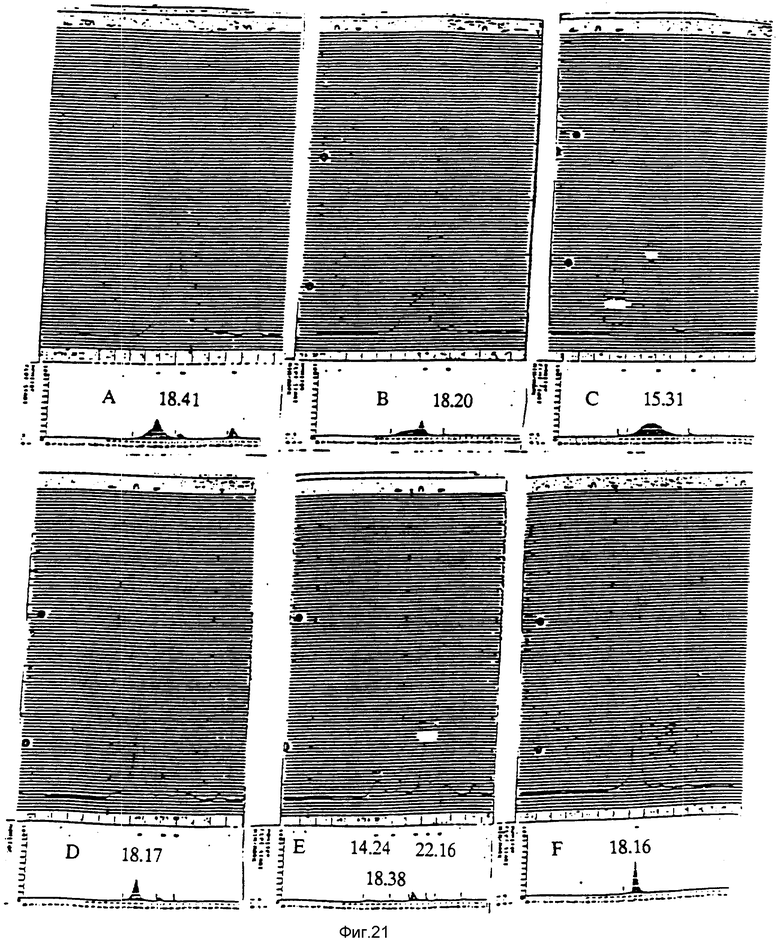
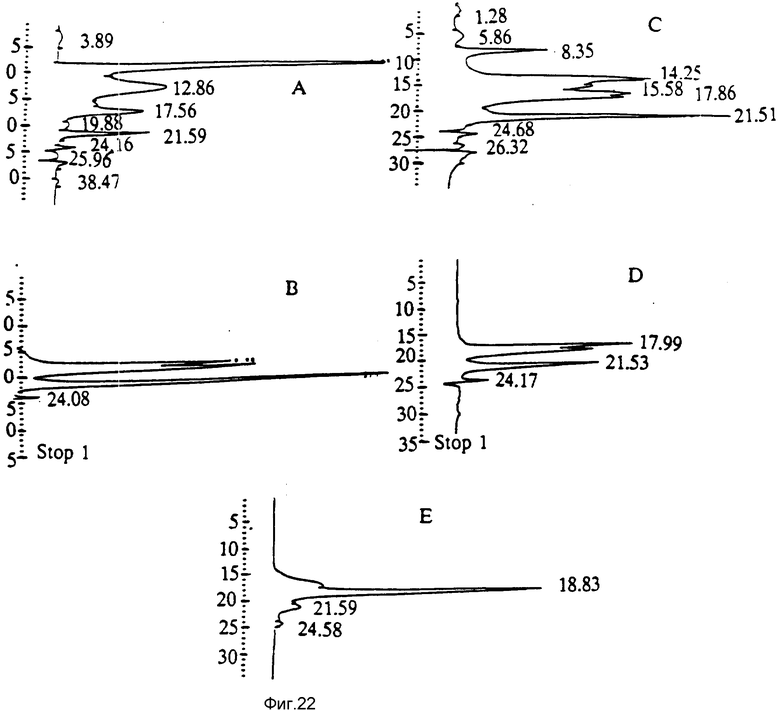
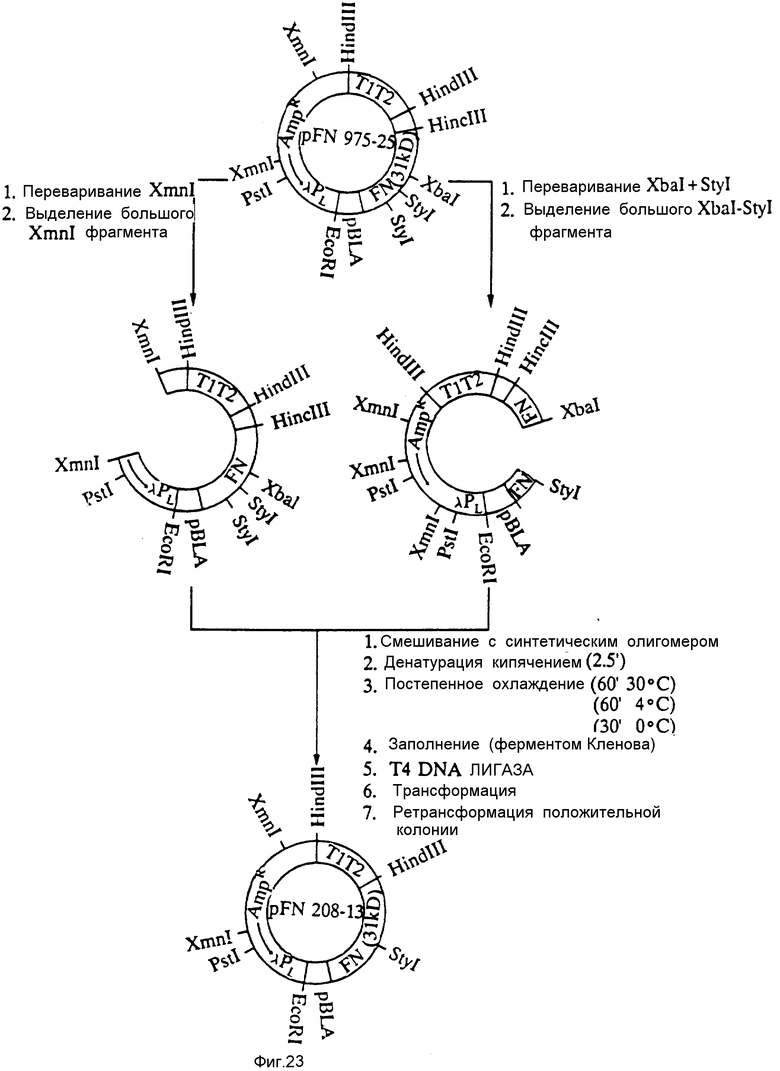
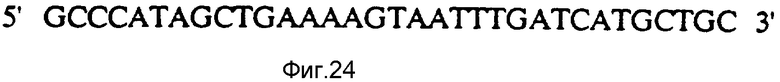
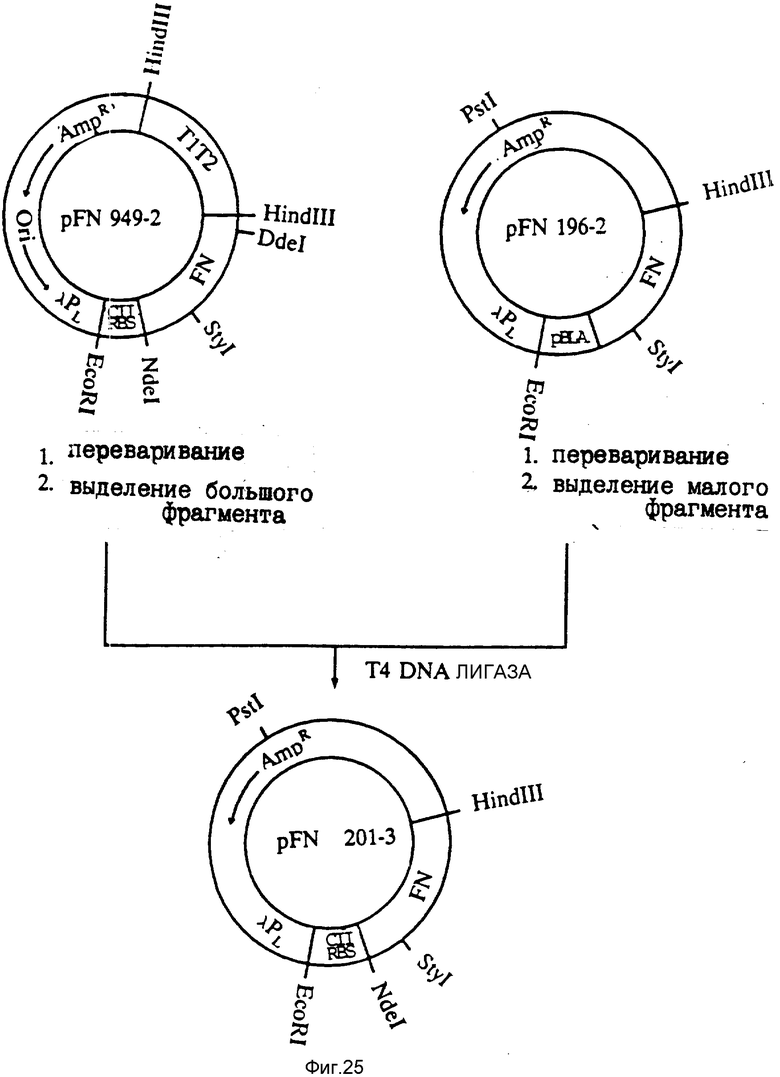
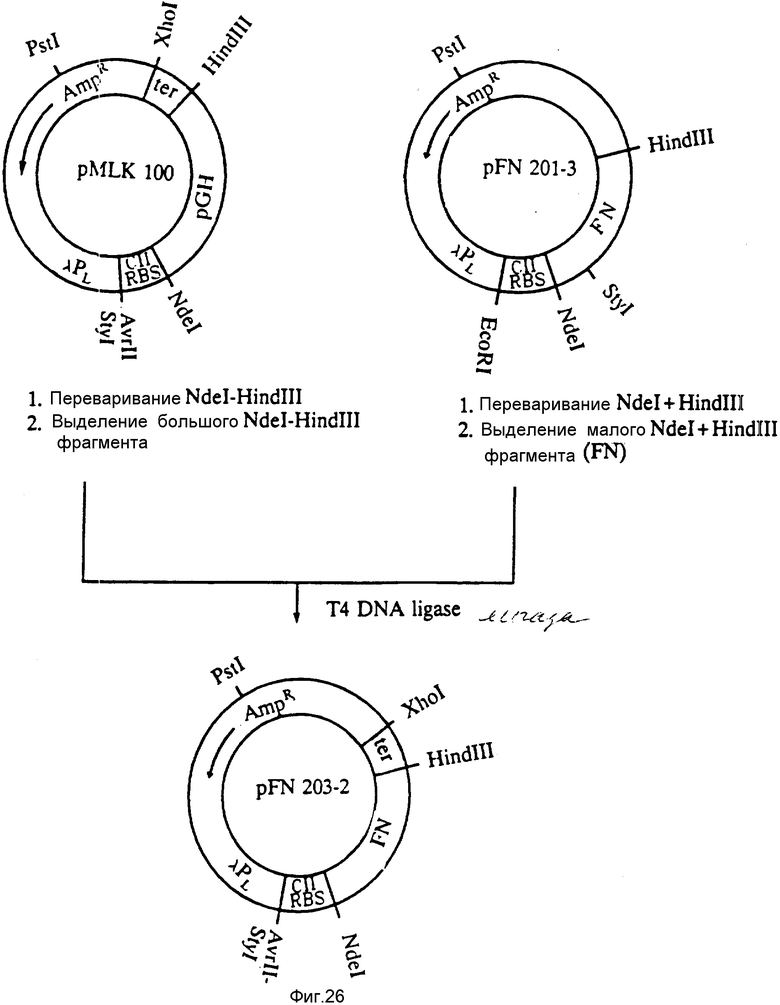
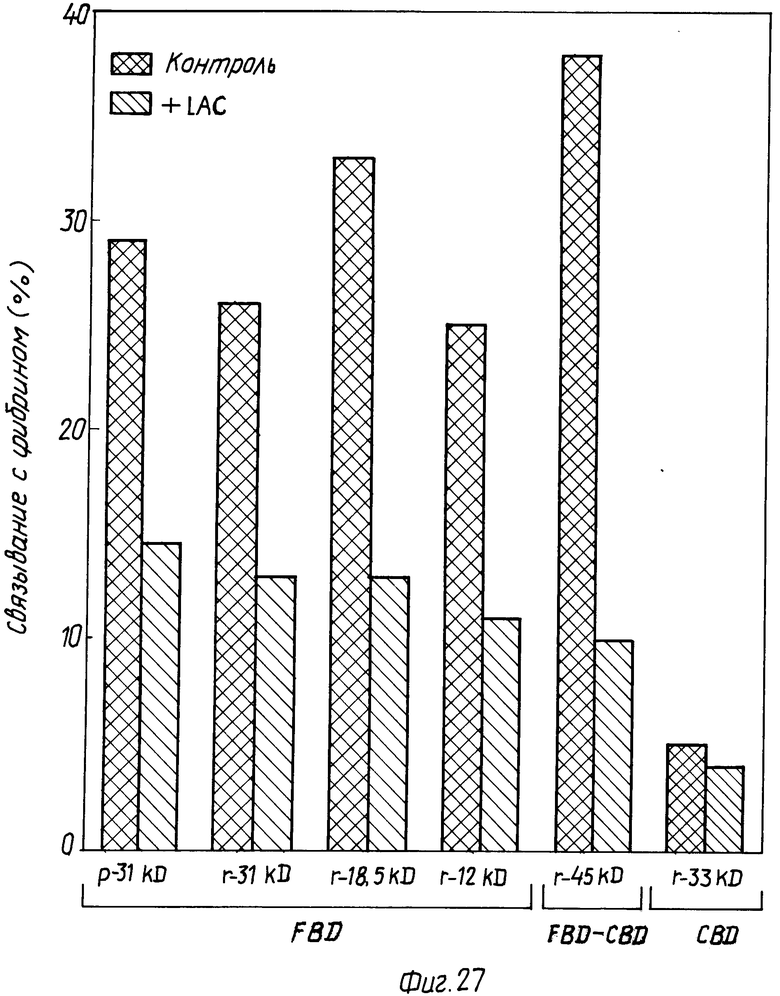
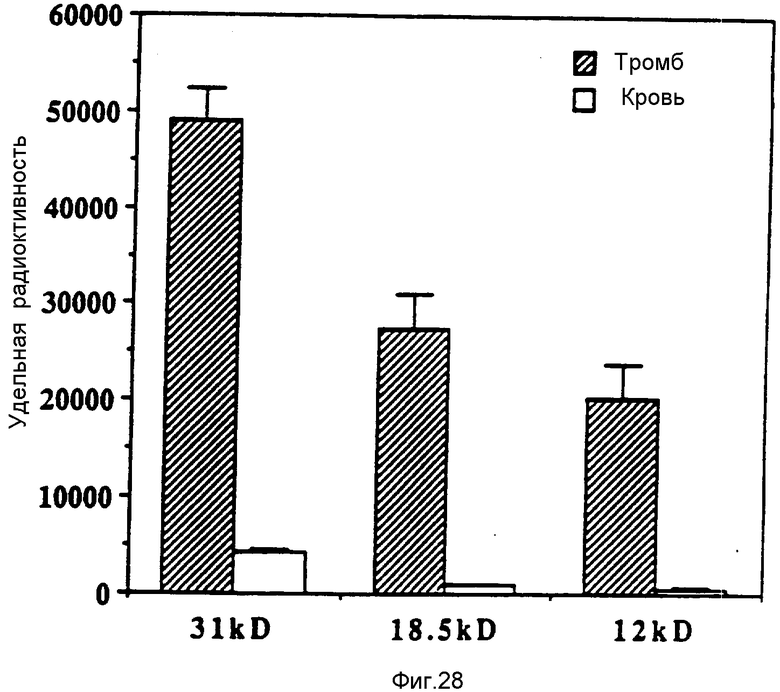
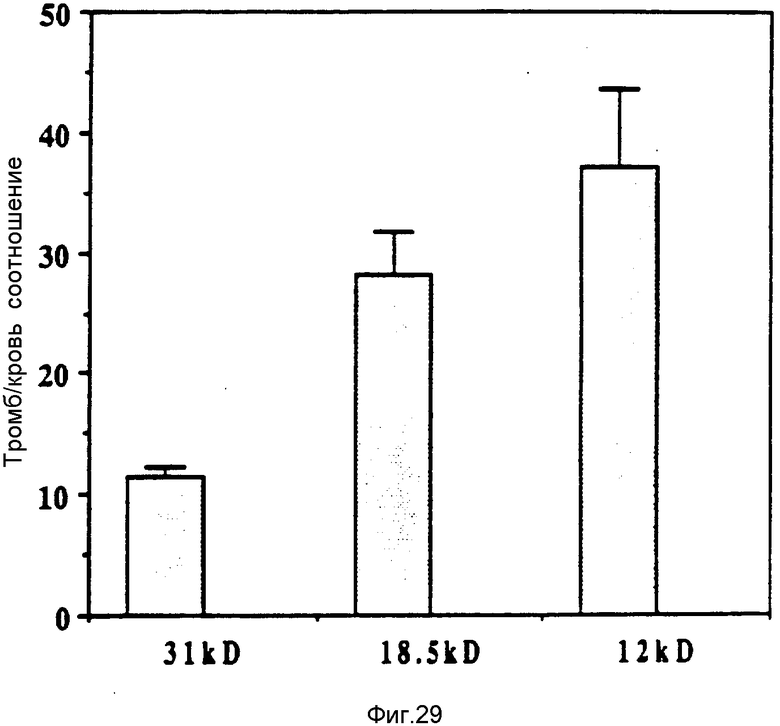
Визуализирующий агент может быть использован для обнаружения содержащего фибрин материала, а именно тромба или атеросклеротической бляшки. Агент представляет собой меченный визуализирующим маркером рекомбинантный полипептид, имеющий аминокислотную последовательность, идентичную области связывания природного человеческого фибронектина с фибрином. Маркером является радиоактивный изотоп, элемент, непрозрачный для рентгеновских лучей, или парамагнитный ион. Визуализирующий агент применим для раннего обнаружения внутрисосудистых атеросклеротических изменений и тромбов. 2 с. и 12 з.п. ф-лы, 29 ил., 5 табл.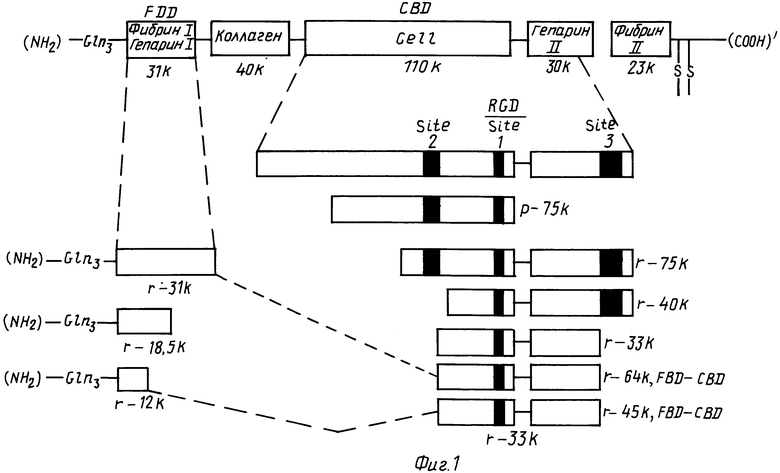
| Uehara A., et al | |||
| J | |||
| Nuclear Med., v.29, p.1264 - 1267, 1988. |
Авторы
Даты
1998-04-27—Публикация
1991-05-21—Подача