Изобретение относится к стабильному готовому к использованию раствору, который может вводиться внутривенной инъекцией и содержит противоопухолевый антрациклиновый гликозид, например, доксорубицин, а также к получению этого раствора в герметизированном контейнере и к способу лечения опухолей с использованием указанного готового к употреблению раствора.
Антрациклиновые гликозидные соединения являются хорошо известным классом соединений в антинеопластической группе агентов, и их типичным и наиболее широко используемым представителем является доксорубицин, см. Doxorubicin Anticancer Antibiotics, Federico Arcamone, 1981, publ.: Academic Press, New York, N.V.; Adriamycin Review, EROTC International Symposium, Brussels, May, 1974, edited by M.Staguet, publ. Eur. Press Medicon, Ghent, Belg.; Results of Adriamycin Therapy, Adriamycin Symposium at Frankfurt/Main 1974, edited by M.Ghione, J.Fetzer and H.Maier, publ.: Springer, New York, N.V.
В настоящее время антрациклиновые гликозидные противоопухолевые лекарства, в частности, например, доксорубицин, доступны только в форме лиофилизованных препаратов, которые нужно разводить перед введением.
Как производство, так и разбавление таких препаратов подвергают участвующий в этих операциях персонал (рабочих, фармацевтов, медицинский персонал, медсестер) риску отравления, который особенно серьезен из-за токсичности противоопухолевых соединений.
Действительно, в левой колонке на стр.175 в Martindale Extra Pharmacopeia 28th edition, описаны вредные эффекты антинеопластических лекарств и рекомендуется "Обращаться с ними с большой осторожностью, избегая контакта с кожей и глазами; их не следует вдыхать. Следует принять меры предосторожности для того, чтобы избежать экстравазации, так как может возникнуть боль и повреждение ткани".
Аналогичным образом в J.Work Environ Health, vol. 10(2), p. 71-74 (1984) и в статьях в Chemistry Industry, Issue Iuly 4, 1983, p.488 и в Drug-Topics-Medical-Economics-Co, Issue Februaru 7, 1983, п.89, описаны тяжелые поражения, наблюдавшиеся у медицинского персонала, подвергавшегося использованию цитостатических агентов, включая доксорубицин.
Для введения лиофилизованного препарата требуется двойная операция с лекарством, а именно лиофилизованный материал сначала нужно развести, а затем ввести и, кроме того, в некоторых случаях полное растворение порошка может потребовать длительного встряхивания из-за трудности растворения.
Риск, связанный с производством и разведением лиофилизованного препарата, мог бы быть значительно снижен, если бы был доступен готовый к употреблению раствор лекарства. В описании патента Франции 2 405 957 приведены составы для инъекций (стерильные водные растворы), содержащие N,N-дибензилдауномицин или его гидрохлорид. Однако, содержащаяся в них натрийкарбоксиметилцеллюлоза из-за ее сгущающих свойств может стать причиной образования тромбов после внутривенного введения раствора. Мы разработали стабильный, терапевтически приемлемый раствор антрациклинового гликозида, например, доксорубицина, который может вводится внутривенно инъекцией и его получение и введение не требуют ни лиофилизации, ни разбавления.
В соответствии с данным изобретением предлагается стерильный апирогенный раствор для инъекций противоопухолевого действия, заключенный в герметичную закрытую емкость, включающий 0,1-50 мг/мл физиологически приемлемой соли гликозида антрациклина, отличающийся тем, что он дополнительно содержит физиологически приемлемую кислоту в количестве, достаточном для создания pH раствора 2,5-5,0.
Антрациклиновый гликозид предпочтительно выбирают из группы, включающей в себя доксорубицин, 4'-эпи-доксорубицин (т.е. эпирубицин), 4'-дезокси-4'-йододоксорубицин, даунорубицин и 4-деметоксидаунорубицин (т.е. идарубицин).
Особенно предпочтительным антрациклиновым гликозидом является доксорубицин.
Любая физиологически приемлемая соль антрациклинового гликозида может быть использована для получения раствора по данному изобретению. Предпочтительно соль не в форме лиофилизола, который также содержит наполнитель. Примерами подходящих солей могут быть соли с минеральными неорганическими кислотами, такими как хлористоводородная, бромистоводородная, серная, фосфорная, и т. п. и соли с некоторыми органическими кислотами, такими как янтарная, винная, аскорбиновая, лимонная, метансульфокислота, этансульфокислота и т. п. Соль, образованная с хлористоводородной кислотой, является особенно предпочтительной солью, особенно если антрациклиновый гликозид представляет собой доксорубицин.
Можно использовать любой растворитель, который физиологически приемлем и способен растворять соль антрациклинового гликозида. Раствор по данному изобретению может также содержать один или больше дополнительный компонент, такой как сосолюбилизирующий агент (который может быть таким же, как растворитель), регулирующие изотоничность агент и консервант.
Подходящие растворители и сосолюлизирующие агенты могут быть, например, следующими: вода, физиологический солевой раствор и смеси воды и одного или более: (а) алифатического амида, например, N,N-диметилацетамида, N-гидрокси-2-этиллактамид и т.п., (б) спирта, например, этанола, бензилового спирта и т. п., (в) гликолями полиспирта, например, пропиленгликоля, глицерин и т.п., (г) сложного эфира полиспирта, например, диацетина, триацетина и т.п., (д) полигликоля или простого полиэфира, например, полиэтиленгликоль 400, простой метиловый эфир пропиленгликоля и т.п., (е) диоксолана, например, изопропилиденглицерина и т.п., диметилизосорбида и (ж) пирролидонового производного, например, 2-пирролидона, N-метил-2-пирролидона, поливинилпирролидон.
Подходящие регулирующие тоничность агенты могут представлять собой, например, физиологически приемлемые неорганические хлориды, например, хлорид натрия, декстрозу, лактозу, маннит и т.п.
Пригодные для физиологического введения консерванты могут представлять собой, например, сложные эфиры пара-гидроксибензойной кислоты (например, метиловый, этиловый, пропиловый, бутиловый эфиры или их смеси), хлоркрезол и т.п.
Вышеупомянутые растворители и сосолюбилизирующие агенты, агенты, регулирующие тоничность и консерванты могут использоваться либо индивидуально, либо в виде смеси двух и более компонентов.
Примерами предпочтительных растворителей являются вода, и смеси воды и одного или более этанола, полиэтиленгликоля и диметилацетамида. Особенно предпочтительным растворителем является вода.
Для доведения pH в интервале от 2,5 до приблизительно 5,0 добавляют физиологически приемлемую кислоту. Кислота может представлять собой физиологически приемлемую кислоту, например, неорганическую минеральную кислоту, такую как хлористоводородная, серная, фосфорная, и т.п., либо органическую кислоту, такую как уксусная, янтарная, винная, аскорбиновая, лимонная, глутаминовая кислоты, метансульфокислота, этансульфокислота и т.п.
Предпочтительный интервал pH готового к использованию раствора по данному изобретению равен 2,62-3,14, причем особенно предпочтительным значением pH является pH приблизительно 3.
В растворах по данному изобретению концентрация антрациклинового гликозида варьируется от 0,1 мг/мл до 50 мг/мл, предпочтительно от 1 до 20 мг/мл.
Предпочтительные интервалы концентрации могут слабо различаться для различных антрациклиновых гликозидов. Так например, предпочтительные концентрации для доксорубицина лежат в интервале приблизительно 2-50 мг/мл, предпочтительно 2-20 мг/мл, а особенно подходящие значения равны 2 мг/мл и 5 мг/мл. Аналогичные концентрации предпочтительны также для 4'-эпи-доксорубицина и 4'-дезокси-4'-йододоксорубицин. Предпочтительные интервалы концентрации для даунорубицина и 4-деметоксидаунорубицина равны 1-20 мг/мл, а особенно подходящими являются концентрации 1 мг/мл и 5 мг/мл.
Подходящей упаковкой для раствора антрациклинового гликозида могут быть любые известные контейнеры, предназначенные для парентерального использования, такие как пластиковые и стеклянные контейнеры, готовые к использованию шприцы т.п. Предпочтительным контейнером является герметизированный стеклянный контейнер, например, пузырек или амплуа.
Растворы согласно изобретению получают способом, включающим в себя растворение физиологически-приемлемой соли антрациклинового гликозида, предпочтительно не имеющей формы лиофилизата, который также содержит наполнитель в физиологически приемлемом растворителе, добавление физиологически приемлемых кислот как единственных агентов для доведения pH от 2,5 до 5,0, и пропускание полученного раствора через стерилизующий фильтр. Перед пропусканием раствора через стерилизующий фильтр к раствору может быть прибавлен один или больше дополнительный компонент, такой как сосолюбилизирующий агент, агент, регулирующий тоничность и консервант, например, относящийся к описанному выше типу.
В растворах по данному изобретению можно получать композиции, имеющие очень высокую концентрацию антрациклинового гликозидного активного соединения, даже до 50 мг/мл и выше. Это является значительным преимуществом по сравнению с имеющимися в настоящее время препаратами, где высокие концентрации антрациклинового гликозида могут быть получены лишь с значительными трудностями, обусловленными трудностью солюбилизации при разведении, которое проводится в основном с помощью солевого раствора. Присутствие в лиофилизованном порошке фармацевтического инертного носителя, например, лактозы, и то, что его содержание, как правило, превышает содержание активного соединения и равно до 5 частей носителя на 1 часть активного соединения, оказывает отрицательное влияние на растворимость, в результате чего могут возникать затруднения при растворении лиофилизованного препарата, особенно при получении концентраций антрациклинового гликозида, превышающих 2 мг/мл.
Растворы по данному изобретению отличаются хорошей стабильностью Было установлено, что растворы, полученные с различными растворителями, имеющие различные pH и концентрации стабильны в течение значительного времени при температурах, используемых для хранения фармацевтических препаратов. Это иллюстрируется в предоставленных ниже примерах.
Благодаря хорошо известной противоопухолевой активности антрациклиновых гликозидных активных соединений фармацевтические композиции по данному изобретению пригодны для лечения опухолей как у людей, так и у животных. Примерами опухолей, которые могут быть подвергнуты лечению, являются саркомы, включающие остеогенные саркомы и саркомы мягких тканей, карциномы, например, карцинома молочной железы, карцинома легких, карцинома мочевого пузыря, карцинома щитовидной железы, карцинома простаты и карцинома яичников, лимфомы, включая годкинсовскую и негодкинсовскую лимфомы, нейробластомы, меланомы, миеломы, опухоль Вилмса и лейкемии, включая лимфобластическую острую лейкемию и острую миелобластическую лейкемию.
Примерами конкретных опухолей, которые могут быть подвергнуты обработке, являются вирус саркомы Молони, асциты саркомы 180, твердая саркома 180, большая трансплантируемая лейкемия, лейкемия L1210 и лимфоцитарная лейкемия P 388.
Таким образом, рост опухоли, в частности, одной из перечисленных выше опухолей, может быть ингибирован путем введения пациенту, страдающему указанным опухолевым заболеванием, инъекционного раствора по данному изобретению, содержащего активное лекарственное соединение в количестве, достаточном для ингибирования роста указанной опухоли.
Инъекционные растворы по данному изобретению вводятся быстро внутривенной инъекцией или инфузией в соответствии с различными возможными схемами ввода доз. Подходящей схемой дозирования для доксорубицина может быть, например, введение 60-75 мг активного лекарственного соединения на м2 поверхности тела, одной быстрой инфузией, повторяемой через 21 день, по другой схеме каждые 28 дней в течение 3 дней внутривенно вводится доза 30 мг/м2 в день. Подходящей схемой дозирования для 4'-эпи-доксорубицина может являться, например, введение 75-90 мг/м2 в виде разовой инфузии, повторяемой через 21 день и аналогичное дозирование может применяться для 4'-дезокси-4'-иодо-доксорубицина.
Идарубицин, т.е. диметоксидаунорубицин может вводиться, например, внутривенно при разовой дозе 13-15 мг/м2 каждый 21 день при лечении твердых опухолей, а при лечении лейкемий предпочтительное дозирование включает в себя, например, введение через каждые 15-21 день внутривенно в течение 3 дней 10-12 мг/м2 в день, аналогичное дозирование может быть использовано, например, для даунорубицина.
Представленные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
В примерах контроль стабильности готовых к употреблению растворов проводят с помощью жидкостной хроматографии высокого давления (ЖХВД) при следующих экспериментальных условиях.
Жидкостной хроматограф: Varian, модель 5010.
Спектрофотометрический детектор: Knauer. модель 8700.
Интегрирующий самописец: Varian, модель CDS 401.
Клапан ввода образца: Rheodine, модель 7125, снабженный петлей для ввода образца объемом 10 мкл.
Хроматографическая колонка: Waters M-Bondapak C18 (длина 300 мм, внутренний диаметр 3,9 мм, средний размер частиц 10 мкм).
Температура колонки: комнатная (около 22±2oC).
Подвижная фаза: вода: ацетонитрил (69:31 по объему), доведена до pH 2 фосфорной кислотой, отфильтрована (стеклянный фильтр, пористость 1 мкм и меньше) и деаэрирована.
Скорость потока подвижной фазы 1,5 мл/мин.
Аналитическая длина волны 254±1 нм.
Чувствительность интегрирующего самописца : 512.
Скорость диаграммной бумаги 1 см/мин.
При этих условиях пик антрациклинового гликозида наблюдается при времени удерживания около 6 мин.
Полученные результаты представлены в примерах в виде таблиц.
Экстраполяцию аналитических данных для определения времени, при котором можно ожидать 90% первоначального определения (значение t90) проводят по зависимости Аррениуса.
Эта методика обработки аналитических данных хорошо известна и широко применяется и описана в литературе, см., например, Chemical Stability of Pharmaceuticals, Kennet A.Connors, Jordon L.Amidon, Loyd Kennon, publ. John Wiley & Sons, New York, N.Y. 1979.
Термин "тефлон" означает "Teflon TM".
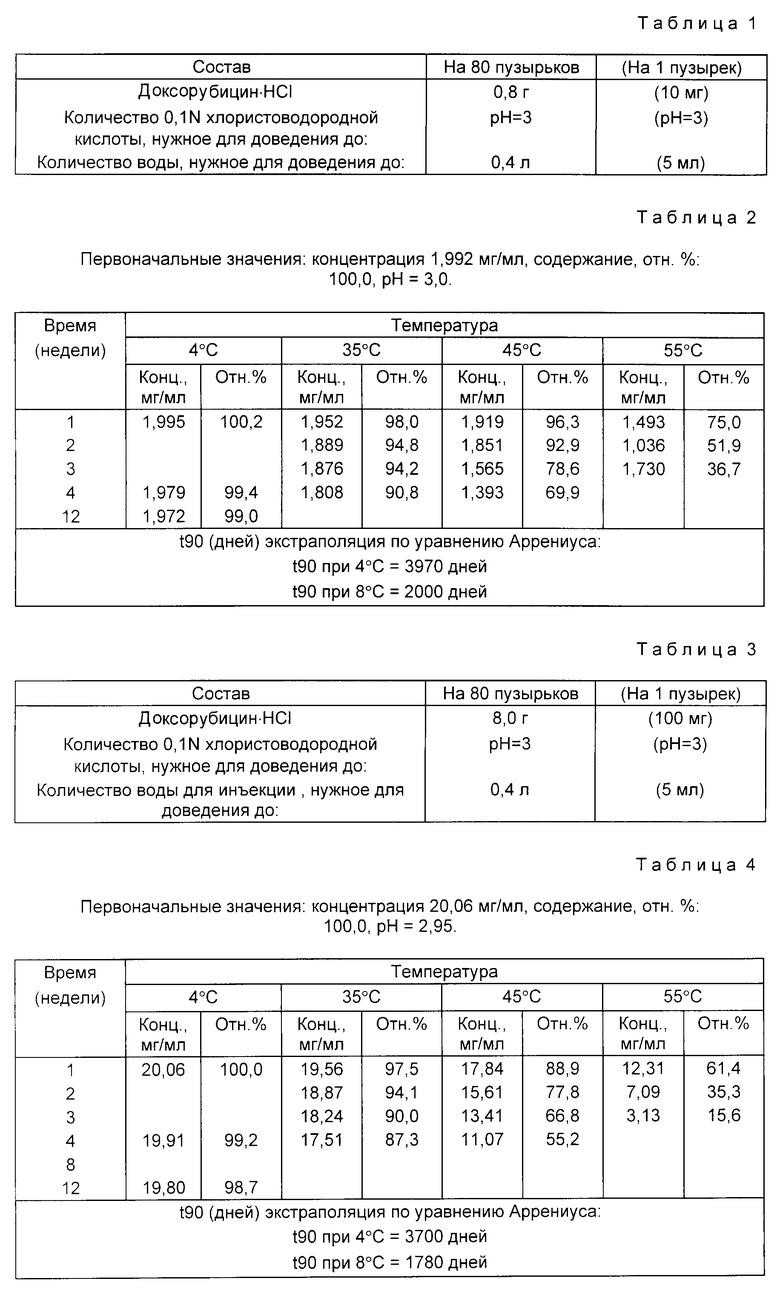
Доксорубицин•HCl (0,8 г) растворяют в 90% количества воды для инъекций, деаэрированной барботированием азота. pH раствора доводят до 3, по каплям прибавляя хлористоводородную кислоту. Затем добавляют добавочное количество деаэрированной воды для инъекций и доводят раствор до конечного объема (0,4 л).
Раствор фильтруют через микропористую мембрану с порами 0,22 мкм под давлением азота. Раствор объемами по 5 мл переносят в бесцветные стеклянные пузырьки типа 1 емкостью 5-7 мл. Затем пузырьки закрывают резиновыми крышками из хлорбутил-тефлона, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Испытывают растворы в пузырьках на стабильность. Пузырьки хранят при температурах 55, 45 и 35oC (экспресс-контроль стабильности) и при 4oC в течение 3 недель (55oC), 4 недель (45 и 35oC)и 12 недель (4oC).
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления (ЖХВД) для определения эффективности, представлены ниже в табл.2.
Схожие данные по стабильности могут быть получены также для аналогичных растворов, содержащих либо гидрохлорид доксорубицина в концентрации 5 мг/мл, либо хлористоводородные соли 4'-эпи-доксорубицина, 4'-дезоксидоксорубицина, 4'-дезокси-4'-иододоксорубицина, даунорубицина или 4-деметоксидаунорубицина в концентрации 2 мг/мл и 5 мг/мл.
Пример 2. Состав приведен в табл. 3.
Доксорубицин • HCl (8,0 г) растворяют в 90% количества воды для инъекций, дегазированной от воздуха барботированием азота. Затем по каплям прибавляют хлористоводородную кислоту, доводя pH раствора до 3. Затем прибавляют дополнительное количество дегазированной от воздуха воды для инъекций и доводят раствор до конечного объема (0,4 л).
Раствор фильтруют через микропористую мембрану с порами 0,22 мкм под давлением азота. Раствор объемами по 5 мл переносят в бесцветные стеклянные пузырьки типа 1 емкостью 5 - 7 мл. Затем пузырьки закрывают резиновыми крышками из хлорбутил-тефлона к пузырьку, и уплотняют алюминиевыми колпачками.
Испытывают растворы в пузырьках на стабильность. Пузырьки хранят при температурах 55, 45 и 35o С (экспресс-контроль на стабильность) и при 4o С до 3 недель (55oC), 4 недель (45 и 35oC) и 12 недель (4oC).
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления (ЖХВД) для определения эффективности представлены в табл. 4.
Схожие данные по стабильности можно получить для аналогичных растворов, содержащих хлористоводородную соль 4'-эпи-доксорубицина или 4'-дезоксидоксорубицина в той же концентрации 20 мг/мл.
Пример 3. Состав приведен в табл. 5.
Доксорубицин • HCl /0,800 г/ растворяют в 90% количества воды для инъекций, дегазированной от воздуха пропусканием азота. При перемешивании и пропускании азота прибавляют затем 11,11 - диметилацетамид, пропиленгликоль и этанол. После этого по каплям прибавляют хлористоводородную кислоту, доводят pH раствора до 3. Затем прибавляют дополнительное количество дегазированной воды для инъекций и доводят раствор до его конечного объема /0,400 л/
Раствор фильтруют через микропористую мембрану с порами 0,22 мкм под давлением азота. Раствор распределяют объемами по 5 мл в бесцветные стеклянные пузырьки типа 1 емкостью 5 - 7 мл. Затем пузырьки закрывают резиновыми пробками из хлорбутил-тефлона тефлоном к пузырьку и уплотняют алюминиевыми колпачками.
Испытывают растворы в пузырьках на стабильность. Пузырьки хранят при температурах 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/; 4 недель /45 и 35oC/ и 8 недель /4oC/.
Данные по стабильности, полученные для определения эффективности с помощью жидкостной хроматографии высокого давления /ЖХВД/ представлены ниже в табл. 6.
Такие же данные по стабильности могут быть получены также для аналогичных растворов, содержащих либо гидрохлорид доксорубицина в концентрации 5 мг/мл, либо гидрохлориды 4'-эпи-доксорубицина, 4'-дезоксидоксорубицина, 4'-дезокси-4'-иододоксорубицина, даунорубицина или 4-деметоксидаунорубицина при концентрации как 2 мг/мл, так и 5 мг/мл.
Пример 4. Состав приведен в табл. 7.
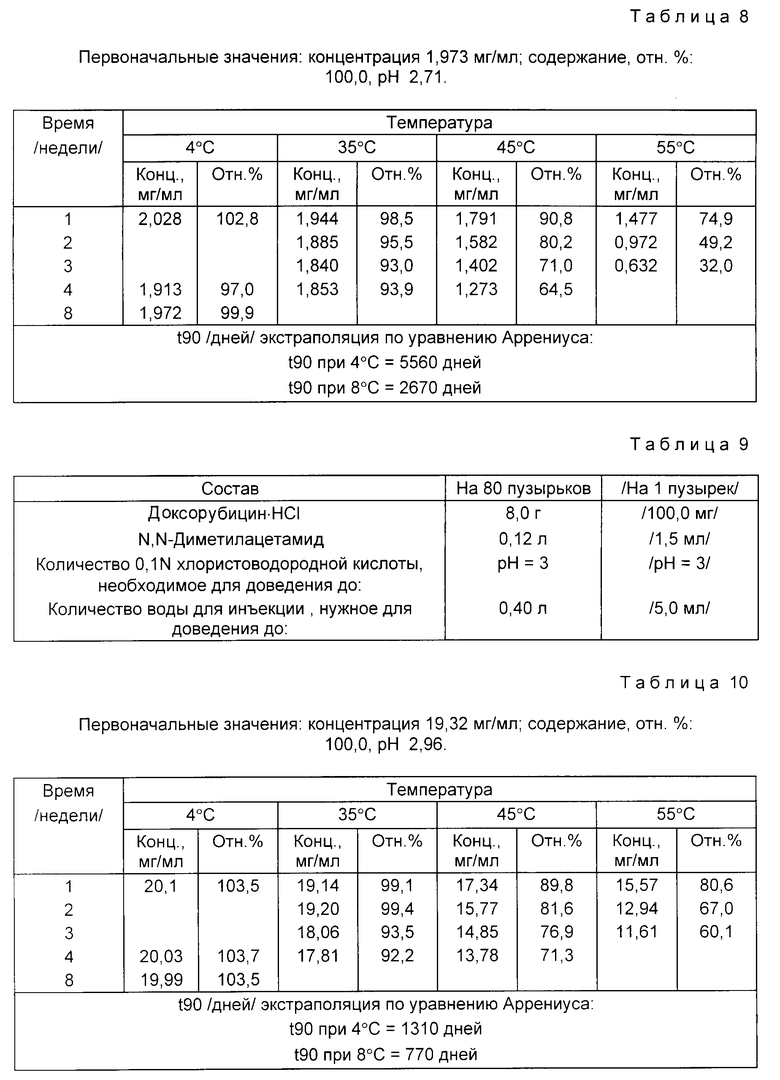
Доксорубицин • HCl /0,8 г/ растворяют в 90% количества воды для инъекций, дегазированной от воздуха пропусканием азота. При перемешивании и пропускании азота прибавляют и растворяют поливинилпирролидон. Затем по каплям прибавляют хлористоводородную кислоту, доводя pH раствора до 3. Затем прибавляют дополнительное количество дегазированной воды для инъекций, доводя раствор до конечного объема /0,4 л/.
Раствор фильтруют через микропористую мембрану с порами 0,22 мкм под давлением азота. Раствор объемами по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкостью 5 - 7 мл. Затем пузырьки закрывают резиновыми крышками из хлорбутил-тефлона, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Растворы в пузырьках испытывают на стабильность. Пузырьки хранят при температурах 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45 и 35oC/ и 8 недель /4oC/.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности, представлены ниже в табл. 8.
Такие же данные по стабильности могут быть получены для аналогичных растворов, содержащих либо гидрохлорид доксорубицина в концентрации 5 мг/мл, либо гидрохлориды 4'-эпи-доксорубицина, 4'-дезоксидоксорубицина, 4'-дезокси-4'-иододоксорубицина, даунорубицина или 4-деметоксидаунорубицина в концентрации как 2 мг/мл, так и 5 мг/мл.
Пример 5. Состав приведен в табл. 9.
Доксорубицин • HCl /8,00 г/ растворяют в 90% количества воды для инъекций, дегазированной от воздуха пропусканием азота. При перемешивании и пропускании азота прибавляют N,N-диметилацетамид. Затем по каплям прибавляют хлористоводородную кислоту, доводя pH раствора до 3. Прибавляют дополнительное количество дезагированной воды для инъекций, доводя раствор до конечного объема /0,40 л/.
Раствор фильтруют через микропористую 0,22-мкм-мембрану под давлением азота. Раствор объемами по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкостью 5-7 мл. Затем пузырьки закрывают резиновыми пробками из хлорбутил-тефлона, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Испытывают растворы в пузырьках на стабильность. Пузырьки хранят при 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45 и 35oC/ и 8 недель /4oC/.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности, представлены ниже в табл. 10.
Аналогичные результаты по стабильности могут быть получены для аналогичных растворов, содержащих хлористоводородную соль 4'-эпи- доксорубицина или 4'-дезоксидоксорубицина в такой же концентрации, равной 2 мг/мл.
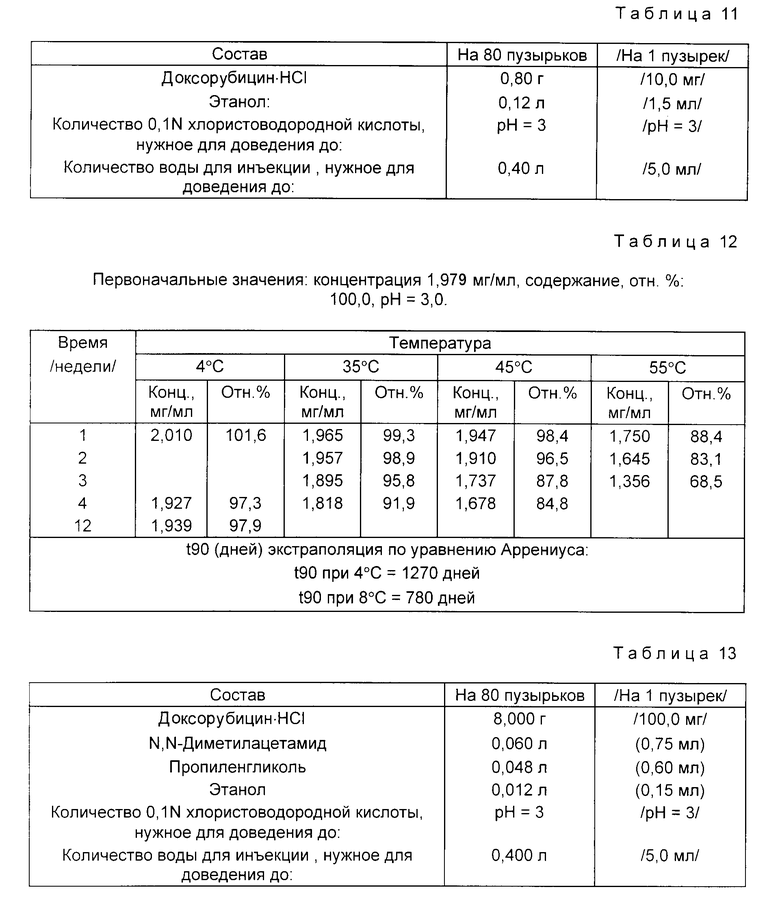
Доксорубицин • HCl /0,80 г/ растворяют в 90% количества воды для инъекций, дегазированной от воздуха пропусканием азота. При перемешивании и пропускании азота прибавляют этанол. Затем по каплям прибавляют 0,1 N хлористоводородную кислоту и доводят pH раствора до 3. В конце прибавляют дегазированную от воздуха воду для инъекций, доводя раствор до конечного объема /0,40 л/.
Раствор фильтруют через микропористую 0,22 мкм-мембрану под давлением азота. Раствор объемами по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкостью 5-7 мл. Затем пузырьки закрывают резиновыми хлорбутил-тефлоновыми пробками, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Испытывают растворы в пузырьках на стабильность. Пузырьки хранят при температурах 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45 и 35oC/ и 12 недель /4oC/.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности, представлены в табл. 12.
Схожие данные по стабильности можно получить для аналогичных растворов, содержащих либо гидрохлорид доксорубицина в концентрации 5 мг/мл, либо гидрохлорид 4'-эпи-доксорубицина, 4'- дезоксидоксорубицина, 4'-дезокси-4'-иододоксорубицина, даунорубицина или 4-деметоксидаунорубицина в концентрации как 2 мг/мл, так и 5 мг/мл.
Пример 7. Состав приведен в табл. 13.
Доксорубицн • HCl /8,000 г/ растворяют в 90% количества воды для инъекций, дегазированной от воздуха пропусканием азота. Затем при перемешивании и пропускании азота прибавляют N,N-диметилацетамид, пропиленгликоль и этанол. Затем по каплям прибавляют хлористоводородную кислоту, доводя pH раствора до 3. Послед этого прибавляют дополнительное количество дегазированной от воздуха воды для инъекций, доводя раствор до конечного объема /0,400 л/.
Раствор фильтруют через микропористую 0,22 мкм-мембрану под давлением азота. Раствор объемами по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкостью 5-7 мл. Затем пузырьки закрывают резиновыми хлорбутил-тефлоновыми пробками, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Растворы в пузырьках испытывают на стабильность. Пузырьки хранят при 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45 и 35oC/ и 8 недель /4oC/.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности, представлены в табл. 14.
Сходные данные по стабильности могут быть получены для аналогичных растворов гидрохлорида 4'-эпи-доксорубицина или 4'-дезоксидоксорубицина при той же концентрации 20 мг/мл.
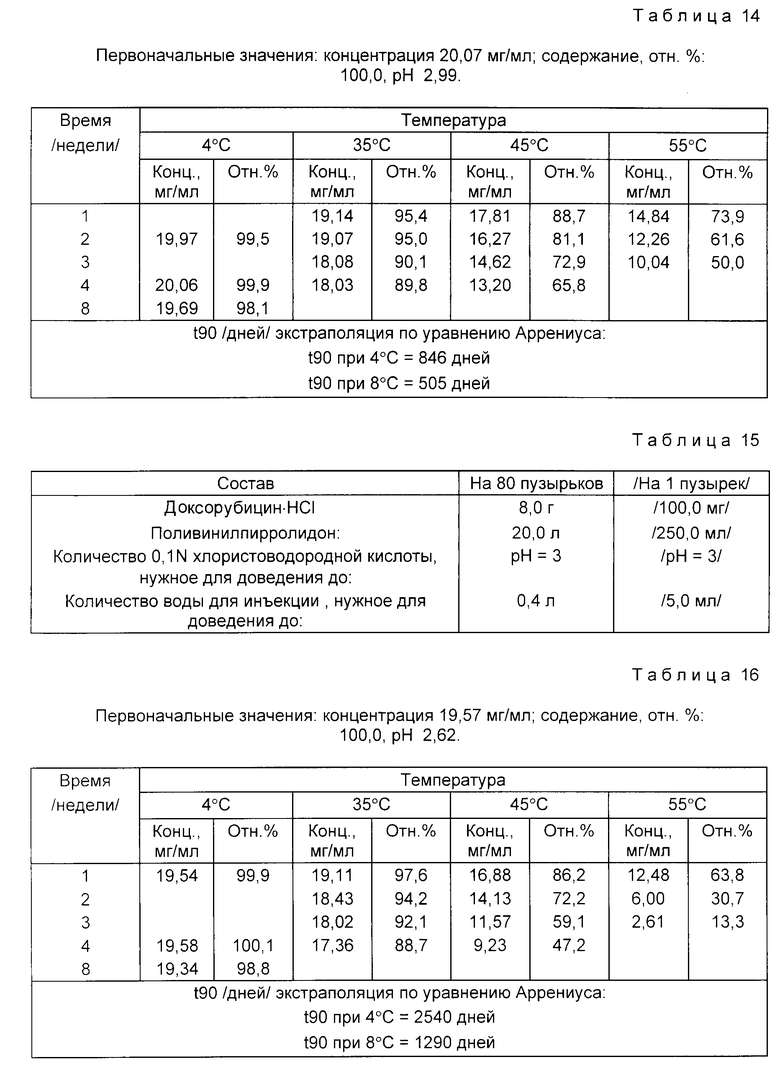
Пример 8. Состав приведен в табл. 15.
Доксорубицин • HCl /8,0/г/ растворяют в 90% количества воды для инъекций, дегазированной от воздуха пропусканием азота. При перемешивании и пропускании азота прибавляют и растворяют поливинилпирролидон. Затем по каплям прибавляют хлористоводородную кислоту и доводят pH раствора до 3. Затем прибавляют дополнительное количество дегазированной от воздуха воды для инъекций, доводя раствор до конечного объема /0,4 л/.
Раствор фильтруют через микропористую 0,22 мкм-мембрану под давлением азота. Раствор объемами по 5 мл распределяют по бесцветным стеклянным пузырькам типа 1 емкостью 5-7 мл. Затем пузырьки закрывают резиновыми хлорбутил-тефлоновыми пробками, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Растворы в пузырьках испытывают на стабильность. Пузырьки хранят при 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45oC и 35oC/ и 8 недель /4oC/.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности, представлены в табл. 16.
Сходные данные по стабильности можно получать для аналогичных растворов, содержащих гидрохлорид 4'-эпи-доксорубицин или 4'-дезоксидоксорубицина при такой же концентрации 20 мг/мл.
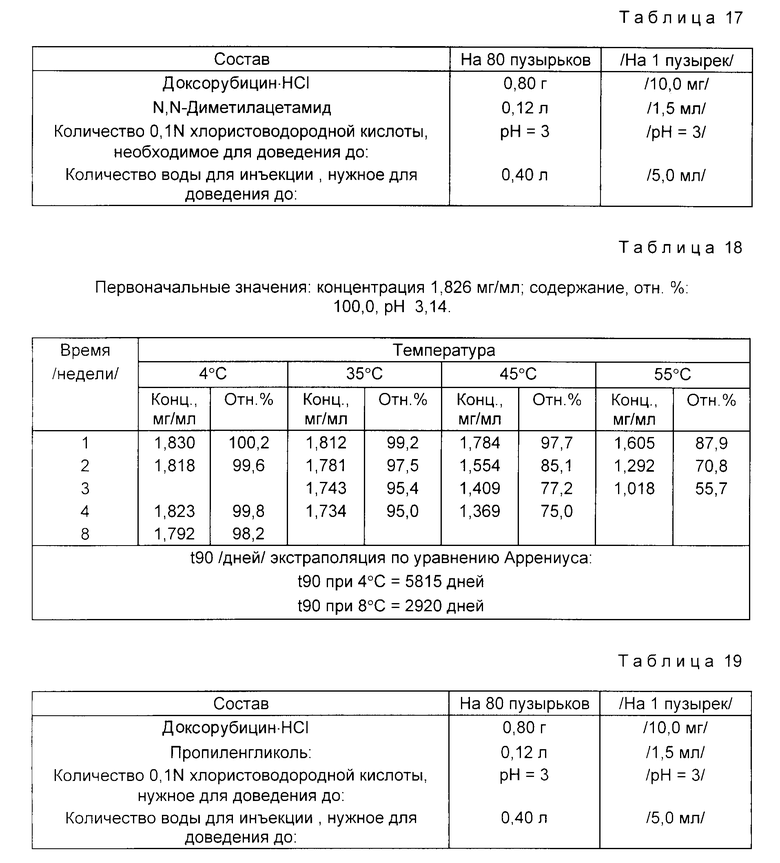
Пример 9. Состав приведен в табл. 17.
Доксорубицин • HCl /0,80 г/ растворяют в 90% количества воды для инъекций, дегазированной от воздуха пропусканием азота. При перемешивании и пропускании азота прибавляют N,N-диметилацетамид. Затем по каплям прибавляют 0,1 N хлористоводородную кислоту, доводя pH раствора до 3. В конце прибавляют дегазированную от воздуха воду для инъекций, доводя раствор до конечного объема /0,40 л/.
Раствор фильтруют через микропористую мембрану с порами 0,22 мкм под давлением азота. Раствор объемами по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкостью 5-7 мл. Затем пузырьки закрывают хлорбутил-тефлоновыми резиновыми пробками, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Растворы в пузырьках испытывают на стабильность. Пузырьки хранят при 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45oC и 35oC/ и 8 недель /4oC/.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности, представлены в табл. 18.
Сходные данные по стабильности могут быть получены для аналогичных растворов, содержащих либо гидрохлорид доксорубицина в концентрации 5 мг/мл, либо гидрохлорид 4'-эпи-доксорубицина, 4'-дезоксидоксорубицина, 4'-эпи-дезокси-4'-иододоксорубицина, даунорубицина или 4-деметоксидаунорубицина в концентрации как 2 мг/мл, так и 5 мг/мл.
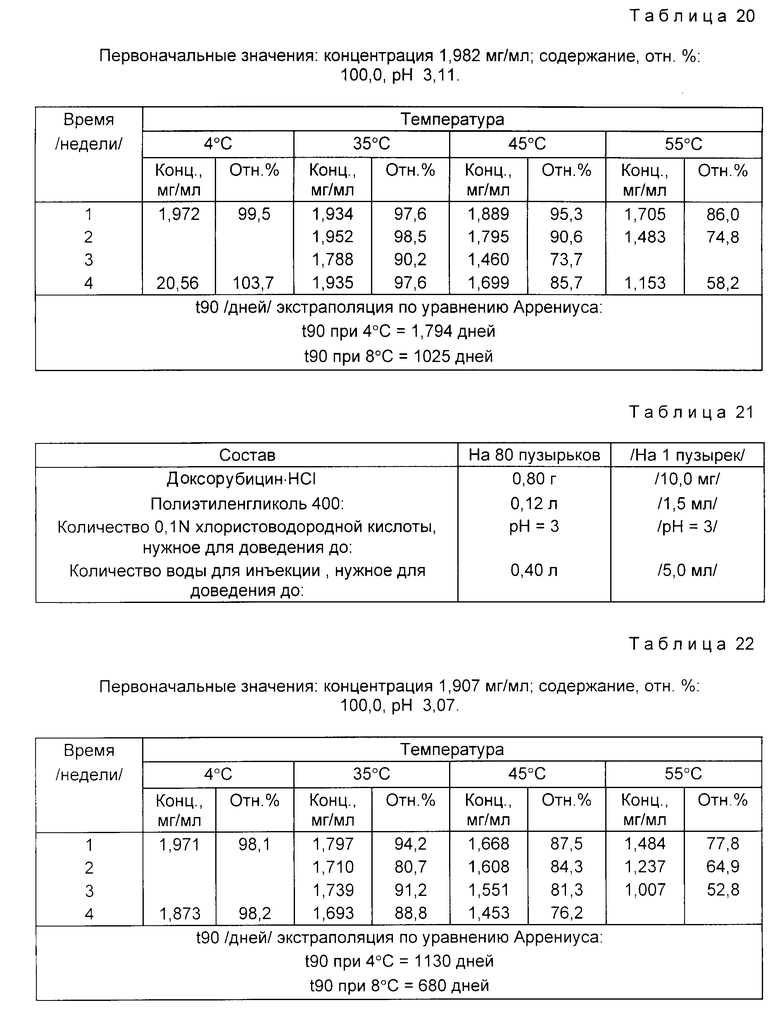
Доксорубицин•HC1 /0,80 г/ растворяют в 90 % количества воды для инъекций, дегазированной от воздуха пропусканием азота. При перемешивании и пропускании азота прибавляют пропиленгликоль. Затем по каплям прибавляют 0,1N хлористоводородную кислоту, доводя pH раствора до 3. В конце прибавляют дегазированную от воздуха воду для инъекций, доводя раствор до конечного объема /0,40 л/.
Раствор фильтруют через микропористую 0,22 мкм-мембрану под давлением азота. Раствор по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкостью 5-7 мл. Затем пузырьки закрывают резиновыми хлорбутил-тефлоновыми пробками, тефлоном к пузырьку, и уплотняют алюминиевыми колпачками.
Растворы в пузырьках испытывают на стабильность. Пузырьки хранят при 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45 и 35oC/ и 4 недель /4oC/.
Данные по стабильности, полученные с помощью хроматографии высокого давления для определения эффективности, представлены в табл. 20.
Сходные данные по стабильности можно получить для аналогичных растворов, содержащих либо гидрохлорид диксорубицина в концентрации 5 мг/мл, либо гидрохлорид 4'-эпи-дексорубицина, 4'-дезоксидоксорубицина, 4'-дезоакси-4'-иододоксорубицина, даунорубицина или 4-деметоксидаунорубицина в концентрации как 2 мг/мл, так и 5 мг/мл.
Пример 11. Состав приведен в табл. 21.
Доксорубицин•HC1 /0,80 г/ растворяют в 90% дегазированной от воздуха пропусканием азота воды для инъекций. При перемешивании и пропускании азота прибавляют полиэтиленгликоль 400. Затем по каплям прибавляют 0,1N хлористоводородную кислоту, доводя pH раствора до 3. В конце прибавляют дегазированную от воздуха воду для инъекций, доводя раствор до конечного объема /0,40 л/.
Раствор фильтруют через микропористую 0,22 мкм-мембрану под давлением азота. Раствор по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкости 5-7 мл. Затем пузырьки закрывают резиновыми хлорбутил-тефлоновыми пробками, тефлоном к пузырьку и уплотняют алюминиевыми колпачками.
Растворы в пузырьках испытывают на стабильность. Пузырьки хранят при 55, 45 и 35oC /экспресс-контроль стабильности/ и при 4oC до 3 недель /55oC/, 4 недель /45 и 35oC/ и 4 недель /4oC/.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности, представлены в табл. 22.
Сходные данные по стабильности можно получить для аналогичных растворов, содержащих либо гидрохлорид доксорубицина в концентрации 5 мг/мл, либо гидрохлорид 4'-эпи-доксорубицина, 4'- дезоксидоксорубицина, 4'-дезокси-4-'иододоксорубицина, даунорубицина или 4-деметоксидаунорубицина в концентрации как 2 мг/мл, так и 5 мг/мл.
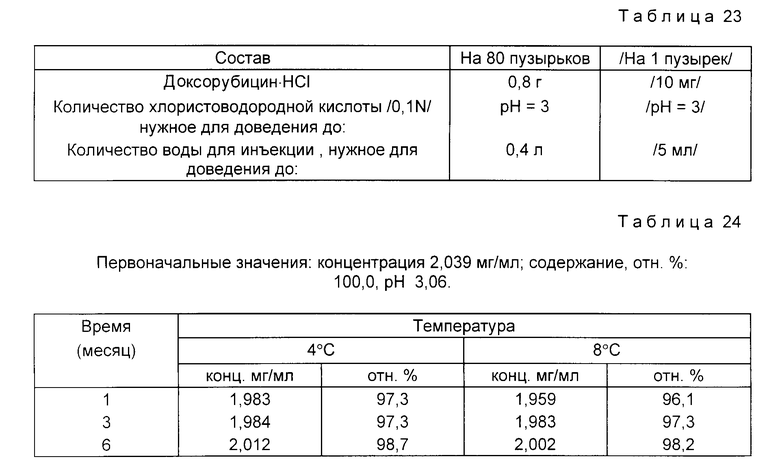
Пример 12. Состав приведен в табл. 23.
Доксорубицин HC1 /0,8 г/ растворяют в 90 % количества воды для инъекций, дегазированной от воздуха пропусканием азота. Затем по каплям прибавляют хлористоводородную кислоту, доводя pH раствора до 3. Затем прибавляют дегазированную от воздуха воду для инъекций, доводя до конечного объема /0,4 л/.
Раствор фильтруют через микропористую 0,22 мкм-мембрану под давлением азота. Раствор по 5 мл распределяют в бесцветные стеклянные пузырьки типа 1 емкостью 5-7 мл. Затем пузырьки закрывают резиновыми хлорбутил-тефлоновыми пробками тефлоном к пузырьку и уплотняют алюминиевыми колпачками.
Растворы в пузырьках испытывают на стабильность. Пузырьки хранят при 4 и 8oC до 6 мес.
Данные по стабильности, полученные с помощью жидкостной хроматографии высокого давления /ЖХВД/ для определения эффективности представлены в табл. 24.
В тех же условиях сходные данные по стабильности могут быть получены для других растворов, указанных в предыдущих примерах.
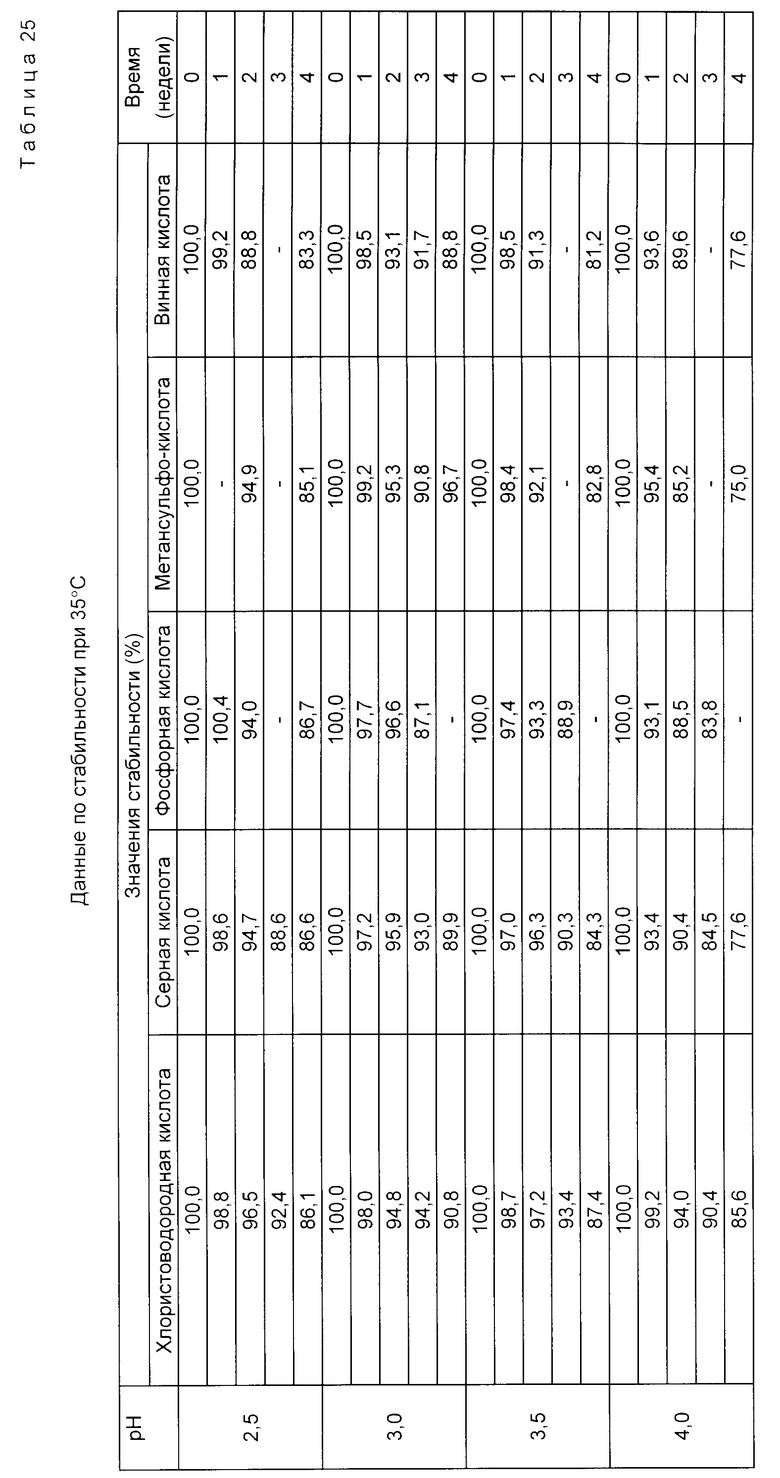
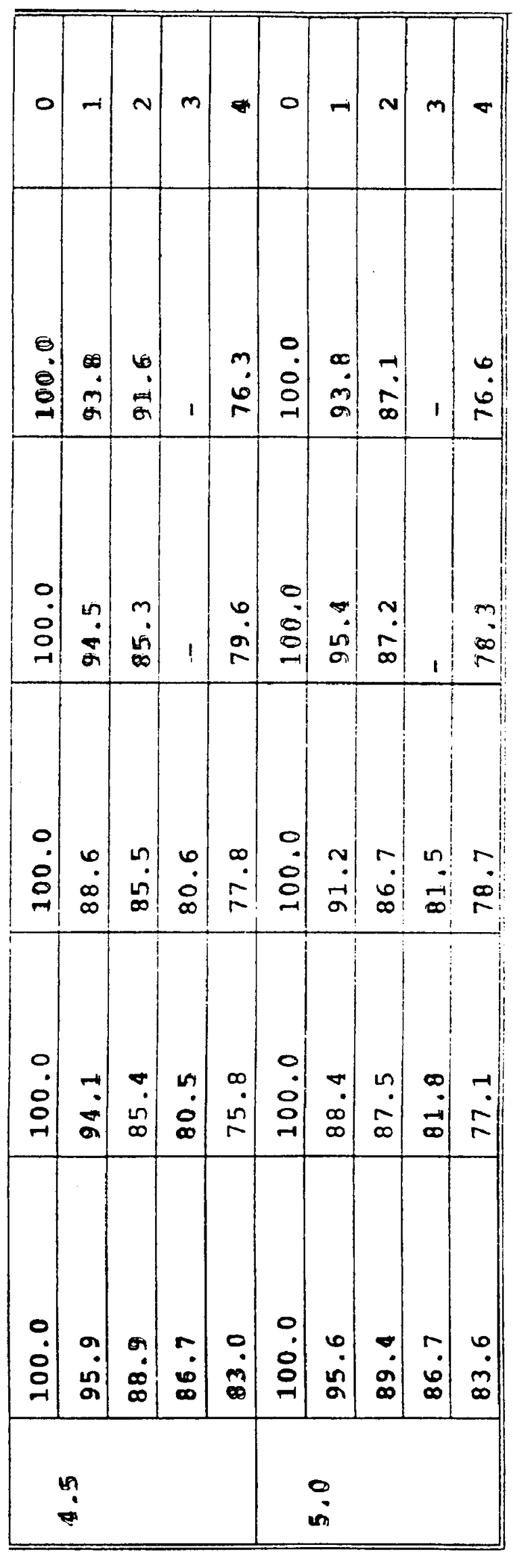
Пример 13. Ускоренное испытание на стабильность проводили при 35oC с целью сравнения стабильности растворов, pH которых регулировали с помощью различных кислот. Гидрохлорид доксорубицина растворяли в воде для инъекции при концентрации 2 мг/мл. pH аликвотных проб раствора регулировали до 2,5, 3,0, 3,5, 4,0, 4,5, 5,0 с использованием хлористоводородной, серной, фосфорной, метансульфоновой и винной кислот.
Растворы под давлением азота фильтровали через микропористую мембрану с размером пор 0,22 мкм. 5 мл-порции растворов затем вводили в стеклянные пузырьки из стекла типа 1 (максимальная емкость пузырьков - 8 мл). Пузырьки закрывали пробкой из хлорбутилового каучука с тефлоновым покрытием и алюминиевой герметизирующей крышкой. Герметичные пузырьки хранили при 35oC.
Пробы растворов брали из сосудов во время = 0 и затем ежедневно. Проводили испытание на стабильность доксорубицина в растворе. Первоначальная стабильность во время = 0 принималась равной 100%. Результаты представлены ниже в табл. 25. Они показывают очень сходную стабильность растворов.

Стерильный апирогенный инъекционный раствор предназначен для лечения опухолей. Раствор, заключенный в герметичную емкость, содержит 0,1 - 50 мг/мл физиологически приемлемой соли гликозида антрациклина и физиологически приемлемую кислоту. Количество кислоты - достаточное для создания pH раствора 2,5 - 5,0. 15 з.п. ф-лы, 13 табл.
| FR, патент, 2405957, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-05-10—Публикация
1992-06-24—Подача