Настоящее изобретение относится к растворимым синтетическим полимерсвязанным антрациклинам, их получению и к содержащим их фармацевтическим композициям.
Доксорубицин, 4'-эпидоксирубицин и 4-деметоксидаунорубицин являются примерами антрациклинов, которые известны в науке и которые в настоящее время используются для клинического лечения злокачественных опухолей (смотри, например. А. Аркамон, "Доксорубицин", Medicinal Chemistry monograph, т. 17, Academic Press, 1981).
Получены многие полимерные производные доксорубицина, наделенные противоопухолевой активностью. Среди них наиболее перспективным для клинического применения является растворимый полимерсвязанный доксорубицин, который состоит из гидрофильных остатков и пептидных цепей, с которыми связаны доксорубицин и 2-гидроксипропиламин. Это производное полимерсвязанного доксорубицина получается конденсацией гидрохлорида доксорубицина с метакриловым полимерным предшественником, содержащим пептидные цепи, активированного как п-нитрофениловый эфир, в диметилсульфоксиде в присутствии триэтиламина, с последующим аминолизом оставшихся эфирных групп 1-амино-2-гидроксипропаном. Инкубация этого материала с лизосомными энзимами (тритосомами) крыс разрывает амидную связь между концевой аминокислотой и доксорубицином [Дж.Копечек и др. Biomaterials 10, 335 (1989), Р.Дункан и др. Biochem. Pharmacol 39, 1125 (1990), Р. Дункин и др. J.Controlled Release 10, 51 (1989) 18, 123 (1993) и 19, 331 (1992)].
Проблема для традиционных способов, например, как описано выше, заключается в том, что трудно удалить доксорубицин из доксорубицинового полимерного конъюгата. Это обусловлено образованием π-комплексов между связующим и свободным доксорубицином, установлено, что материал ведет себя как одно целое при диализе, молекулярной фильтрации и гель-хроматографии [Дж. Фейджен и др. J.Controlled Release 1, 301 (1985)].
Полимерсвязанные антрациклиновые системы настоящего изобретения основаны на метакриловых полимерах, несущих гидрофильные остатки, пептидные концевые цепи, соединенные только с аминогруппой антрациклина, и остатки глицина, либо в виде свободной кислоты, либо в виде амидного производного. Эти системы имеют преимущество над существующим аналогом в том, что антрациклин может быть легко высвобожден от полимера, с которым он связан. К тому же полимерсвязанные антрациклины изобретения имеют более широкую противоопухолевую активность и более низкую токсичность, чем соответствующие свободные антрациклины.
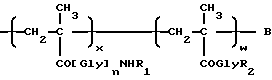
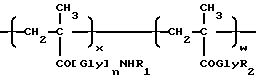
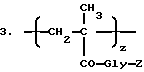
Таким образом, настоящее изобретение относится к полимерсвязанному антрациклину формулы A, который состоит, по сути, из трех единиц, представленных общими формулами 1, 2 и 3: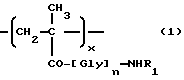
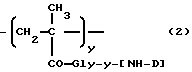
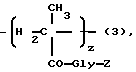
где Gly - глицин, n - 0 или 1,
x - 70-98 мол.%,
y - 1-29 мол.%,
z - 1-29 мол.%,
R1-C1-6-алкилгруппа, замещенная одной или более гидроксигруппами,
Y - остаток аминокислоты или пептидный,
[NH-D] - остаток аминогликозидантрациклина [NH2-D], и
Z - гидрокси или остаток формулы - NHR1, как определено выше.
Аминогликозидантрациклин, остатком которого является [NH-D], представлен здесь как [NH2-D] , где D обозначает структуру антрациклинаминогликозида минус аминогруппа сахарного остатка.
Полимерсвязанный антрациклин, предпочтительно, содержит от 90 до 98 мол. % единиц общей формулы 1, от 0 до 10 мол.% единиц общей формулы 2 и от 1 до 10 мол.% единиц общей формулы 3.
Ферментативный in vivo гидролиз пептидных цепей приводит к высвобождению только активного лекарства D-NH2, тогда как единица общей формулы 3 остается нетронутой.
Соответствующими алкилгруппами, которые могут представлять R1, являются C1-4-алкилгруппы, замещенные одной или более гидроксигруппами, примеры включают в себя гидроксиэтил-, 2-гидроксипропил и 3-гидроксипропилгруппы.
Пептидный спейсер Y должен быть восприимчив к внутриклеточному гидролизу. Спейсер может быть устойчивым к внеклеточному гидролизу. Пептидный спейсер может быть длиной от 1 до 10, например, 2-4 аминокислотных остатков. Обычно пептидный спейсер является трипептидом или тетрапептидом.
Каждый из составных аминокислотных остатков пептидного спейсера, y, которой является хиральным, может присутствовать в виде оптического D- или L-изомера или в виде D/L-смеси. Здесь используется традиционная трехбуквенная система обозначения аминокислот, где символы означают L-конфигурацию хиральной аминокислоты, если не указано особо. Пептидный спейсер y может присутствовать в виде рацемической смеси или в виде оптически чистого изомера.
Предпочтительно, Y выбирается из Gly-Phe-Gly (глицин-фенилаланин-глицин) Gly-Leu-Gly (глицин-лейцин-глицин), Gly-Pht-Leu-Gly или Leu-Leu-Gly с глицин-остатком, связанным в каждом случае с аминогликозидантрациклином.
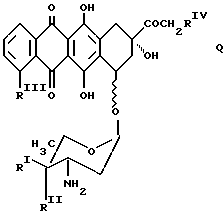
Аминогликозидантрациклиновый остаток [NH-D] является подходящим остатком антрациклинаминогликозида [NH2-D] следующей формулы Q: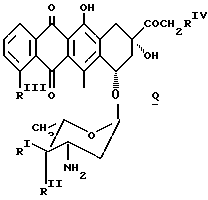
в которой один из RI и RII-водород, а другой - гидроксигруппа или иод,
RIII-водород или OCH3, а RIV - водород или гидроксигруппа.
Предпочтительными примерами антрациклинаминогликозида [NH2-D]является доксорубицин, 4'-эпидоксорубицин, 4-деметоксидаунорубицин, идарубицин и 4'-иодо, 4'-дезоксидоксорубицин.
Изобретение также представляет способ получения полимерсвязанного антрациклина A, который состоит, по сути, из единиц общих формул 1, 2 и 3, как определено выше.
Способ содержит:
i) взаимодействие полимерного промежуточного соединения B, где B состоит, в основном, из единиц следующих общих формул 1 и 4: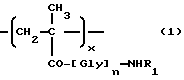
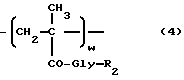
где x, n и R1 в формуле 1 являются такими, как определено выше, w - от 30 до 2 мол.%, а R2 -гидроксигруппа или уходящая группа, с антрациклиновым производным общей формулы (5)
HY - [NH-D] (5)
в которой [NH-D] и Y являются такими, как определено выше,
ii) взаимодействие продукта со стадии (i), где R2 - уходящая группа, с соединением общей формулы NH2R1, в которой R1 - такой, как определено выше, в случае, когда требуется получить полимерсвязанный антрациклин, где Z, единица общей формулы 3 представляет NHR1.
Уходящей группой, которую может представлять R2, является пригодная фенил-оксигруппа, которая замещается на фенильном кольце одной или более электронотнимающих групп. Примерами пригодных электронотнимающих групп включают в себя нитрогруппу (-NO2) и галоген. R2, предпочтительно, является уходящей группой.
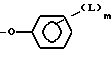
в которой L - электронотнимающая группа, например, -NO2 или галоген, такой как фтор или хлор, а m - целое число от 1 до 5, обычно от 1 до 3, предпочтительно, 1 или 2. Предпочтительно, R2 - п-нитрофеноксигруппа или 2,4-дихлорфеноксигруппа.
Соединения общей формулы (5) легко отделяются от полимерного конъюгата формулы A благодаря своей высокой олефильности.
Так, как описано выше, настоящий подход к получению полимерсвязанных антрациклинов позволяет преодолеть главный недостаток традиционной конденсации антрациклинов с полимерами, а именно трудность в отделении свободного антрациклина от полимерного конъюгата.
Полимерные промежуточные соединения B, состоящие, в основном, из единиц общих формул 1 и 4, как определено ранее, получаются радикальной сополимеризацией метакрильных соединений следующих формул 6 и 7: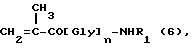
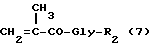
где n, R1 и R2 - такие, как определено выше.
Некоторые полимеры, состоящие, в основном, из единиц общих формул 1 и 4, известны из литературы: например, полимер B1, состоящий из единиц общей формулы 1, в которой R1 представляет -CH2CH(OH)CH3, n=O, и единиц общей формулы 4, в которой R2 представляет п-нитрофенольный остаток, получается радикальной сополимеризацией осаждением N-(2-гидроксипропил)-метакриламида 6a: R1= CH2CH(OH)CH3, n= 0 с N-метакрилоилглицил-п-нитрофенилэфиром 7a: R2=O-C6H4pNO2, как описано в работе Дж. Копечек, Makromol. Chem., 178; 2159 (1977). Полимерные промежуточные соединения, состоящие из единиц общих формул 1 и 4, в которых R2 представляет гидроксильную группу, могут быть получены радикальной гомогенной полимеризацией.
Некоторые мономеры общих формул 6 и 7 являются известными. Соединения общей формулы 6, в котором n=0 и R1 -алкил, несущий гидроксильную группу, получаются взаимодействием метакрилоилхлорида с алифатическим алкилом, несущим вторичные гидроксигруппы. С другой стороны, соединения общей формулы 6, в которой n= 0 и R1-остаток алкила, несущего первичную гидроксильную группу, могут быть получены из метакриловой кислоты и аминосоединений в присутствии катализатора конденсации, такого как 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин.
Пептидил-антрациклиновые производные общей формулы 5 являются дополнительным аспектом настоящего изобретения. Способы их получения являются известными. Например, так как это важно для взаимодействия соответствующего N-защищенного пептида с антрациклином, N-защитная пептидильная группа должна выбираться из таких групп, которые удаляются в условиях, способных придать стабильность антрациклину. Примером является трифенилметильная группа.
Пентидилантрациклиновые соединения общей формулы 5 могут быть получены способом, который содержит:
(i) взаимодействие N-защищенного пептида общей формулы 8 или 9:
R5 -Y-OH (8),
R3-Y-P (9)
где R3 - кислоточувствительная защитная аминогруппа, R - уходящая группа, а Y - аминокислотный остаток или пептидный спейсер, как указано выше, с антрациклинаминогликозидом NH2 - как указано выше, с получением промежуточного соединения общей формулы 10:
R3 - Y- [NH-D] (10)
где [NH-D], Y-R3 - такие, как определено выше, и
(ii) удаления защитной группы R3 с получением пептидилантрациклина общей формулы 5 в форме свободного основания. P может быть уходящей группой, как определено и подтверждено примерами выше для R2. Кроме того, P может быть пентафторфенилокси- или N-гидроксисукцинимидогруппой. Примеры кислоточувствительной защитной группы R3 включают в себя тритил- и дифениламиногруппы.
Пептидил-производные общих формул 8 и 9 получаются следующими стандартными методами синтеза, которые известны из литературы о пептидах. Защита аминофункции кислоточувствительной группой, такой как трифенилметил, обычно осуществляется в соответствии с работой Теодоропулоса и др. J. Org. Chem. 47, 1324(1982).
Реакционные условия, выдерживаемые для получения соединений общих формул 8, 9 и 10, предназначаются для того, чтобы избежать рацемизации, полученные пептидил-производные сохраняют поэтому конфигурацию исходных аминокислот.
Для получения антрациклиновых производных общей формулы 5, соединение общей формулы 9 может взаимодействовать с гидрохлоридной солью антрациклина в безводном полярном растворителе, таком как диметилформамид, в присутствии эквивалентных количеств органического основания, такого как триэтиламин, например, при комнатной температуре в течение 15 часов с получением промежуточного соединения общей формулы 10, которое очищается хроматографией, а затем деблокируется от производного соединения общей формулы 5, например, в водной 75%-ной уксусной кислоте при комнатной температуре.
Необходимо отметить, что реакция антрациклинов, несущих гидроксильную группу в положении C-14, таких как доксорубицин и 4'-эпидоксорубицин, в виде гидрохлоридной соли, с активированными пептидил-производными общей формулы 9 в присутствии органического основания, необходимого для деблокирования 3'-аминогруппы антрациклинов в полярном растворителе, дает смесь производного общей формулы 10 антрациклинов, замещенных как по аминогруппе сахарного остатка, так и в C-14 положении. Бис-(3'-N, 14-O-пептидил)-производные удаляются из смеси хроматографией.
Соединения общей формулы 10 могут быть также получены конденсацией N-защищенного пептида общей формулы 8 с антрациклином в форме гидрохлоридной соли в безводном полярном растворителе, таком как диметилсульфоксид в присутствии эквивалентного количества катализатора конденсации, такого как 1-этоксикарбонил-2-этокси-1-дигидрохинолин. Этот метод не дает бис-пептидил-производных антрациклинов, несущих C-14 гидроксигруппы.
Конденсация промежуточного продукта B с пентидилантрациклиновыми производными общей формулы 5, необязательно следующая за замещением остающихся уходящих групп, дает полимерсвязанные антрациклины, состоящие, в основном, из единиц общих формул 1, 2 и 3. Должно быть подчеркнуто, что этот метод позволяет избежать образования эфирных связей между первичными гидроксильными группами и концевыми глицил-активированными эфирами.
Полимерсвязанные лекарства общей формулы A, в которой остаток Z единицы общей формулы 3 представляет группу NHR1, как описано ранее, получаются, предпочтительно, взаимодействием промежуточного соединения B, в котором R2 - уходящая группа, как определено выше, с антрациклиновым производным общей формулы 5 в безводном полярном органическом растворителе, таком как диметилформамид или диметилсульфоксид. Реакция может обычно идти в течение от 8 до 24 часов. Реакция обычно проводится при температуре от 15 до 30oC, предпочтительно, при комнатной температуре в течение 15 часов, затем оставшиеся уходящие группы замещаются взаимодействием конъюгата с соединением общей формулы NH2R1, как указано выше, в течение периода времени от 0,5 до 3 часов при комнатной температуре.
Полимерсвязанные лекарства общей формулы A, в которой остаток Z единицы общей формулы 2 представляет гидроксильную группу, получаются, предпочтительно, взаимодействием промежуточного соединения общей формулы B, в которой R2 - гидроксильная группа, с антрациклиновым производным общей формулы 5 в безводном полярном органическом растворителе, таком как диметилформамид или диметилсульфоксид. Реакция обычно длится в течение 8 - 24 часов. Реакция обычно проводится при температуре от 15 до 30oC, предпочтительно, при комнатной температуре в течение 15 часов.
Например, для получения полимерсвязанного антрациклина, в котором Z - остаток NHR1, как указано выше, промежуточное соединение общей формулы B, в которой R2 - уходящая группа, такая как п-нитрофенокси, обрабатывается пептидилантрациклином общей формулы 5, при комнатной температуре в течение 15 часов. Соединение B, соответственно, используется в количестве 14% масса/объем, а соединение 5 в количестве 2,2% масса/объем (м/о). Затем добавляется соединение общей формулы NH2R1, как указано выше, обычно при 0,1% м/о, и реакционная смесь выдерживается при комнатной температуре в течение 3 часов. Конъюгат высаживается ацетоном, растворяется абсолютным этиловым спиртом, обычно при концентрации 8% (м/м), и высаживается снова ацетоном с получением требуемого полимерсвязанного антрациклина.
В описанном выше способе удается избежать образования эфирных связей между C-14 гидроксилированным антрациклином и концевым глицил-активированным эфиром благодаря отсутствию какого-либо органического основания в процессе конденсации.
В другом примере, для получения полимерсвязанного антрациклина общей формулы A, в которой Z - гидроксильная группа, промежуточное соединение общей формулы B, как указано выше, в котором R2 - гидроксильная группа, обрабатывается в безводном диметилсульфоксиде пептидилантрациклина общей формулы 5 при комнатной температуре, в течение 15 часов. Соединение B, соответственно, используется при 14% м/о, а соединение 5 при 2,3% м/о. Конъюгат затем высаживается ацетоном, растворяется в абсолютном этиловом спирте, обычно при концентрации 8% м/м) и высаживается снова ацетоном с получением полимерсвязанного антрациклина общей формулы A, как определено выше.
Содержание антрациклина в конъюгатах общей формулы A определяется анализом агликона, высвобождаемого из связанного антрациклина посредством кислотного гидролиза, так, адриамидинон является агликоновым остатком диксорубицина, а 4'-эпирубицин и 4-деметоксидауномицином является агликоновым остатком деметоксидаунорубицина.
Полимерсвязанные антрациклины настоящего изобретения показывают хорошую водорастворимость, биосовместимость, стабильность при физиологическом pH, и высвобождаются из свободного активного лекарства, D-NH2, после инкубации с лимосомными энзимами (ферментами).
Соединения формулы A проявляют повышенную противоопухолевую активность в экспериментальных образцах и пониженную общую токсичность по сравнению со свободным антрациклином.
Полимерсвязанные антрациклины общей формулы A имеют противоопухолевую активность. Человек или животное могут поэтому подвергаться лечению способом, заключающимся в применении ими терапевтически эффективного количества полимерсвязанного антрациклина общей формулы A. Состояние пациента (человека или животного) может быть таким образом улучшено.
Приемлемый интервал дозировки зависит от способа применения лекарства и возраста, массы и состояния лечащегося пациента. Полимерсвязанные антрациклины общей формулы A обычно применяются парентеральным способом, например, внутримышечно, внутривенно или при введении шариков. Пригодный интервал дозировки составляет от 5 до 800 мг/м2 антрациклинового эквивалента, например, от 20 до 500 мг/м2. Пригодный режим определяет применение раствора 25 мг антрациклинового эквивалента /м2 внутривенно при объеме 10 мл/кг массы тела в течение 2-недельного периода через 5,9 и 15 дней.
Полимерсвязанные антрациклины общей формулы A могут быть включены в рецептуру фармацевтической композиции вместе с фармацевтически приемлемым носителем или разбавителем. Обычно полимерсвязанные антрациклины включаются в рецептуры для парентерального применения, например, при растворении в стерильной воде или в воде для инъекций.
Нижеследующие примеры дополнительно иллюстрируют изобретение. Примеры 1-6 относятся к способам синтеза для получения мономеров общих формул 6 и 7 и полимерных промежуточных соединений общей формулы B.
Пример 1
[N-(метакрилоилглицил)]-2-гидроксипропиламид (6b)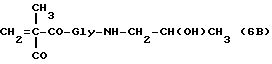
Метакрилоилглицил-п-нитрофениловый эфир (7a: 5,28 г, 20 ммолей), полученный, как описано в работе Makromol Chem. 178, 2159 (1977), растворяется в безводном тетрагидрофуране (20 мл) и обрабатывается 1-амино-2-гидроксипропаном (3,2 мл, 40 ммолей). Через 20 минут при комнатной температуре растворитель удаляется при пониженном давлении, и указанное в заголовке соединение общей формулы 6b (3,3 г, выход 82,5%) получается после кристаллизации смесью ацетон /этиловый эфир. TCX (тонкослойная хроматография) на Kieselgel-пластине F254 (Merck), вымывающая система: метиленхлорид/ацетон (90:10 по объему), Rf=0,47.
Пример 2
[N-(метакрилоиглицил)]-гидроксиэтиламид (6c)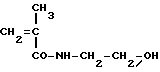 (6c)
(6c)
К перемешиваемой смеси 1-этоксикарбонил-2-этокси-1,2- дигидрохинолина (37 г, 0,15 ммоля) в безводном толуоле (150 мл) по каплям в течение 15 минут добавляется растворенная в безводном толуоле (300 мл) метекриловая кислота (14 мл, 0,165 моля). Реакционная смесь перемешивается при комнатной температуре в течение 24 часов. Указанное в заголовке соединение общей формулы 6c получается после высаживания п-гексаном. TCX на Kieselgel-пластине F254 (Merck), вымывающая система: метиленхлорид/ацетон (90:10 по объему) Rf=0,35
Пример 3
[N-(метакрилоилглицил)]2,3-дихлорфениловый эфир (7b)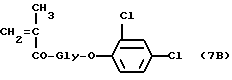
Указанное в заголовке соединение общей формулы 7b получается из метакрилоилглицина (2,66 г, 20 ммолей), полученного, как описано в работе Makromol Сhem. 178, 2159, (1977), и 2,4-дихлорфенола (3,26 г, 20 ммолей) в безводном тетрагидрофуране (50 мл) в присутствии ДСС (4,2 г, 21 ммоль). Соединение общей формулы 7B (4,7 г, выход 82%) кристаллизуется из этилацетата и п-гексана, TCX на Kieselgel-пластине F254 (Merck), вымывающая система - этиловый эфир Rf=0,47
Пример 4
Сополимер N-метакрилоиламина-2-гидроксипропана и N-метакрилоилглицина (B2)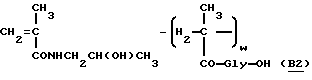
N-метакрилоиламид-2-гидроксипропан (25,2 г, 0,18 моля) метакрилоилглицин (2,86 г, 20 ммолей) и α,α′ -азоизобутиронитрил (5,9 г) растворяются в безводном метиловом спирте (164 мл). Смесь выдерживается при 60oC в атмосфере азота в течение 20 часов, затем реакционная смесь добавляется к ацетону (2000 мл) при перемешивании. Осадок собирается, промывается ацетоном и сушится до постоянного веса с получением указанного в заголовке полимера B2 (2,6 г). Содержание карбоксильных групп (N):10 мол.%
Пример 5
Сополимер [N-(метакрилоилглицил)-] 2-гидроксипропаноламида и N -(метакрилоилглицил)-2,4-дихлорфенилового эфира (B3)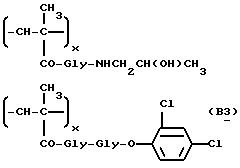
Соединение общей формулы 6b (14,4 г, 72 ммоля) и соединение общей формулы 7b (5,19 г, 18 ммолей) полимеризуются в безводном ацетоне (300 мл) в присутствии α,α′ -азоизобутиронитрила (1 г, 6 ммолей), как описано в работе 178, 2159 (1977), до указанного в заголовке соединения общей формулы B3. Полимерный материал извлекается фильтрацией из реакционной смеси, растворяется в абсолютном этиловом спирте и переосаждается ацетоном. Содержание хлора: расчетное - 6,89 мол.%, экспериментальное - 2,84 мол.%
Пример 6
Сополимер [N-(метакрилоилглицил)] -гидроксиэтиламида и N- метакрилоилглицина (B4)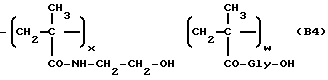
Указанное в заголовке полимерное промежуточное соединение общей формулы B4 получается из N-метакрилоиламида-2-гидроксиэтана (6c:23,2 г, 0,18 ммоля), метакрилоилглицина (2,86 г, 20 ммолей) и α,α′ -азоизобутиронитрила (5,9 г) в безводном метиловым спирте (164 мл), как описано в примере 2. Содержание карбоксильных групп (w) - 10%.
Примеры 7-12 относятся к способам получения пептидилантрациклинов общей формулы 5.
Пример 7
N-триметил-L-фенилаланил-L-лейцилглицил-4-нитрофенилэфир
(C6H5)3 C-L-Phe-L-Zeu-Gly- OC6H4pNO2 (9a)
N-тритил-L-фениланин (20,3 г, 50 ммолей), полученный, как описано в работе J. Org. Chem. 47, 1324 (1982), растворяется в безводном тетрагидрофуране (150 мл) и к нему добавляется безводный N-гидроксибензотриазол (8 г). Смесь охлаждается при 0oC и обрабатывается 1,3-дициклогексилкарбодиимидом (11,7 г, 50 ммолей), через 10 минут к ней добавляется по каплям раствор 1-лейцилглицинэтилэфир-п-толуолсульфонатной соли (20 г, 50 ммолей) в смеси безводного тетрагидрофурана (100 мл) и N-метилморфолина (7 мл). Реакционная смесь выдерживается при 0oC в течение 1 часа и при комнатной температуре - до утра, затем фильтруется, и растворитель удаляется при пониженном давлении. Сырой материал, растворенный этилацетатом, промывается один за другим охлажденным 5%-ным водным раствором лимонной кислоты (3х100 мл), охлажденным 5% водным раствором бикарбоната натрия и водой, затем концентрируется и хроматографируется на силикагеле с вымыванием смесью метиленхлорида и метанола (99: 1 по объему) с получением N- тритил-L-фенилаланил-L-лейцилглицинэтилового эфира (18 г, 30 ммолей), который превращается в соответствующую кислоту общей формулы 8а) (17г) обработкой в 95%-ном этиловом спирте (400 мл) 1N гидроокисью натрия (30 мл) в течение 2 часов при комнатной температуре. ТСХ на Kieselgel-пластине F254 (Merck), вымывающая система: метиленхлорид/метанол (80:20 по объему), Rf = 0,53.
H1-ЯМР (200 МГц, CDCl3).
0,88 (д, J =5,9 Гц, 6H δ+δ, Leu),1,2-1,2 (м, 3H, β ±Leu), 2,00 (дд, J= 5,7 Гц, J-13,4 Гц, 1H, β Phe), 2,83 (дд, J=5,2 Гц, J=13,4 Гц, 1H, β′ Phe), 3,51 (т, J=5,4, 1H, α Phe), 3,99 (д, J=4,4 Гц, 2H, α+α′ Gly), 4,55 (м, 1H, α Leu), 6,8-7,4 (м, 22H, NHgly, NHLeu, 4- C6H5).
Соединение общей формулы 8a растворяется в безводном тетрагидрофуране (450 мл) и к нему добавляется п-нитрофенол (5,5 г, 40 ммолей). Смесь охлаждается при 0oC, к ней добавляется по каплям раствор 1,3-дициклогексилкарбодиимида (8,24 г, 40 ммолей), и смесь выдерживается до утра при 4oC. После этого реакционная смесь фильтруется, и растворитель удаляется при пониженном давлении. Остаток растворяется этилацетатом и охлаждается при 0oC. Через час смесь фильтруется и растворитель удаляется с получением, после кристаллизации из этилового эфира, указанного в заголовке соединения общей формулы 9 a ( 20 г, выход 97%) ТСХ на Kieselgel пластине F254 (Мerck, вымывающая система - этиловый эфир,
Rf=0,80. АД-МС: м/з 699 [M+H]+
H1-ЯМР (200 МГц, CDCl3)
0,86 (д, J= 6,2 Гц, 3H, δ Leu), 0,88 (д, J=6,4 Гц, 3H δ′ Leu), 1,2-1,8 (м, 3H, β ±Leu) 1,9 (дд, J=5,9 Гц, J=13,5 Гц, 1H, β Phe), 2,89 (дд, J = 4,6 Гц, J=13,5, 1H, β′ Phe), 3,52 (дд, J = 4,6 Гц, J=5,9 Гц, 1H, α Phe), 4,0-4,4 (м, 3H, α Leu, α+α′Gly), 6,78 (т, J=5,7 Гц, 1H, NH GLY), 7,04 (д, J=7,7 Гц, 1H, NН Leu), 6,8-7,4 (м, 22 Гц, 4-C6H5 и 2,6 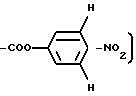
8,25 (м, 2H, 5,5COO 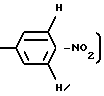
Пример 8
N-тритил-глицил-L-фенилаланил-L-лейцилглицил-п-нитрофениловый эфир
(C6H5)3C-Gly-L-Phe-L-Leu-Gly- OC6H4pNO2(9b)
Промежуточный N-тритил-L-фенилаланил-L-лейцилглицилэтиловый эфир (6 г, 10 ммолей), полученный, как описано в примере 7, обрабатывается 75%-ным водным раствором уксусной кислоты при комнатной температуре в течение часа с получением L-фенилаланил-L-лейцилглицилэтилового эфира, который конденсируется N- тритилглицином (3 г, 10 мм), в присутствии N- гидроксибензотриазола и 1,3 - дициклогексилкарбодиимида с получением, после гидролиза этилового эфира и активации п-нитрофенолом, как описано в примере 7, указанного в заголовке соединения общей формулы 9b (3,8 г, выход 50%) ТСХ Kieselgel - пластине F254 (Merck), вымывающая система - этиловый эфир, RF =0,63. АД-МС м/з 755 [M+H}+
Пример 9
3'-N-(глицил-L-лейцил-L-фенилаланил)доксорубицин (5a)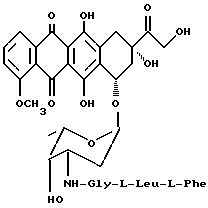
Проводится реакция доксорубицингидрохлорида (2,9 г, 5 ммолей), растворенного в безводном диметилформамиде (50 мл) и триэтиламине (0,5 мл) с N-тритил-фенилаланиллейцилглицил-п-нитрофенилэфиром (9a: 3,5 г, 5 ммолей), полученным, как описано в примере 7. Реакционная смесь выдерживается до утра при комнатной температуре, затем высаждается смесью 1:1 этилового эфира и n-гексана. Твердое вещество очищается на силикагельной колонке с вымыванием смесью метиленхлорида и метанола (98:2 по объему) с получением N-защищенного пептидилдоксорубицина общей формулы 10a (4,6 г). ТСХ на Kieselgel - пластине F254 (Merck), вымывающая система: метилен-хлорид/ метиловый спирт (95:5 по объему) , Rf=0,35.
АД-МС: м/с 1103 [M+H]+
Соединение общей формулы 10а, растворяется в 75%-ном водном растворе уксусной кислоты (250 мл) в течение часа, затем раствор разбавляется смесью 1:1 воды и метиленхлорида (2500 мл) и доводится до pH 7 твердым бикарбонатом натрия. Органическая фаза отделяется, и растворитель удаляется при пониженном давлении с получением указанного в заголовке соединения общей формулы 5а (3,45 г, выход 80%) ТСХ на Kieselgel- пластине F254 (Merck), вымывающая система - метиленхлорид /метиловый спирт/ уксусная кислота/вода (80:20:7:3) по объему, Rf = 0,5.
AД-МС:м/з [M+H]+
H1-ЯМР (400 МГц, DМСО)
0,8 (д, J= 6,4 Гц, 3H δ Leu), 0,83 (д, J=6,4 Гц, 3H, δ′ Leu), 1,10 (д, J = 6,8 Гц, 3H, 6' CH3), 1,3-1,6 (м, 4H, β ± Leu и 2' экв. H), 1,83 (ддд, J= 2,8 Гц, J=13,2 Гц, J= 13,2 Гц, 1H, 2' ахн) , 2,09 (дд, J = 6,0 Гц, J = 14,5 Гц, 1H, 8 ахH) , 2,18 (д, J = 14,5 Гц, 1H, 8-экв), 2,8-3,2 (м, 4H, 10 CH2 и β Phe), 3,36 (м, 1H, 4'), 3,64 (м, 2H, α Gly), 3,95 (с, 3H, OCH3), 3,9-4,1 (м, 2H, 3' и α Phe) 4,15) (кв, J=6,4 Гц, 1H, 5' H) 4,29 (кв. J =7,7 Гц, 1H, α Leu), 4,55 (с, 2H, 14 CH2), 4,7-5,0 (м, 3H, 7H и 4'OH и 14 OH), 5,20 (д, J=3,4 Гц, 1H, 1'H), 5,46 (с, 1H, 90H) 7,1-7,3 (м, 5H, Ar, Phe), 7,54 (д, J = 8,5 Гц, 1H, 3' NH), 7,63 (м, 1H, 3H), 7,88 (м, 2H, 1H и 2H), 8,17 (м, 4H, NH3 + NHGly), 8,70 (д, J= 8,1 Гц, 1H, NH Leu) 13,23 (с, 1H, 11OH), 14,00 (с, 1H, 60H)
Пример 10
3'-N-(глицил-L-лейцил-L-фенилаланилглицил)-доксорубицин (5b)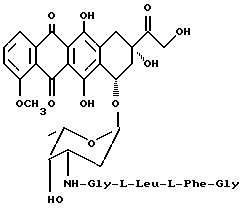
Проводится реакция доксорубицингидрохлорида (2,9 г 5 ммолей) с N-тритил-глицил-L-фенилаланил-L-лейцилглицил-п-нитрофениловым эфиром (9b: 3,8 г, 5 ммолей), полученным, как описано в примере 8, и затем реакционная смесь обрабатывается 75%-ным водным раствором уксусной кислоты, как описано в примере 9, с получением указанного в заголовке соединения общей формулы 5b (4 г, выход 90%) ТСХ на Kieselgel-пластине F254 (Merck), вымывающая система - метиленхлорид/метиловый спирт/уксусная кислота/вода (80:20:7:3 по объему, Rf= 0,44 АД/МС: м/с 938 [M+H]+
Пример 11
4-деметокси-3'-N(глицил-L-лейцил-L-фенилаланил) даунорубицин (5с)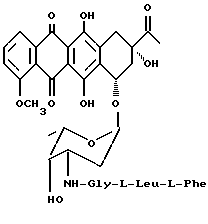
Указанное в заголовке соединение общей формулы 5с (3 г, выход 75%) получается из 4-деметоксидаунорубицингидрохлорида (2,9 г, 5 ммолей) и N-тритил-фенилаланиллейцилглицил-п-нитрофенилэфира (9а :3,5 г, 5 ммолей) аналогично методике, описанной в примере 9. ТСХ на Kieselgel-пластине F254 (Merck), вымывающая система - метиленхлорид/метиловый спирт/уксусная кислота/ вода (80:20:7:3 по объему) Rf = 0,51
АД-МС: м/з 815 [M+H]+
H1-ЯМР (200 МГц, CDCl3)
0,84 (д, J=6,0 Гц, 3H, δ Leu), 0,88 (д, J=6,0 Гц, 3H δ′' Leu) 1,27 (д, J= 6,4 Гц, 3H, 6'CH3) 1,4-1,7 (м, 3H β +Leu), 1,7-2,0 (м, 2H, 2' CH2), 2,06 (дд, J= 4,2 Гц, J= 14,9 Гц, 1H, 8 ахН), 2,32 (д, J=14,9 Гц, 1H, 8 экв H), 2,40(с, 3H, COCH3), 2,70 (дд, J =8,6 Гц, J=13 Гц, 1H, β Phe), 3,13 (дд, J = 4,2 Гц, J= 13,7 Гц, 1H, β′ Phe), 2,94, 3,23 (дд, J = 19,2 Гц, и 2H, + 10CH2), 3,5-3,8 (м, 3H, 4'H α Phe и α GLY) 3.9-4,3 (м, 4H, 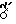 Gly, α Leu, 5' H 3'H), 5,19 (м, 1H, 7H), 5,45 (д, J=2,7 Гц, 1H, 1' H), 6,9-8,4 (м, 12H, 1H, 2H, 3H, 4H, Ar Phe 3' NH, NH GLY NH Leu).
Gly, α Leu, 5' H 3'H), 5,19 (м, 1H, 7H), 5,45 (д, J=2,7 Гц, 1H, 1' H), 6,9-8,4 (м, 12H, 1H, 2H, 3H, 4H, Ar Phe 3' NH, NH GLY NH Leu).
Пример 12
4'-эпи-3'-N(глицил-L-лейцил-L-фенилаланил)-доксорубицин (5d)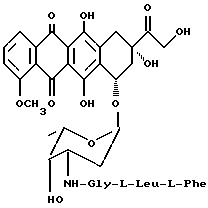
Указанное в заголовке соединение общей формулы 5d (3,25 г, выход 68%) получается из 4'-эпидоксорубицингидрохлорида (2,9 г, 5 ммолей) и N-тритил-фенилаланиллейцилглицил-p-нитрофенилэфира (9a: 3,5 г, 5 ммолей) в соответствии с методикой, описанной в примере 9. ТСХ на Kieselgel-пластине F254 (Merck), вымывающая система - метиленхлорид/метиловый спирт/уксусная кислота/вода (80:20:7:3 по объему), Rf = 0,46
АД-МС: м/з [M + H]+
H1-ЯМР (400 МГц, DМСО)
0,79 (д, J = 6,3 Гц, 3H, δ Leu), 0,81 (д, J = 6,3 Гц, 3H, δ′ Leu), 1,19 (д, J = 5,9 Гц, 3H, 6'CH3), 1,3-1,6 (м, 4H, 2'Hax β,β′ Leu, Leu), 1,82 (дд, J = 4,7 Гц, J = 12,5 Гц, 1H, 2'Heq), 2,1-2,3 (м, 2H, 8-CH2), 2,59 (дд, J = 8,2 Гц, J = 13,7 Гц, 1H, β Phe), 2,9-3,1 (м, 4H, β′ Phe 10-CH2, h'H), 3,41 (дд, 4,7 Гц, J = 8,2 Гц, α Phe), 3,54 (дд, J = 5,5 Гц, J = 16,4 Гц, α Gly), 3,67 (дд, J = 6,2 Гц, J = 16,4 Гц, 1H, α′ Gly), 3,8 (м, 1H, 3'H), 3,90 (м, 1H, 5'H), 3,95 (с, 3H, OCH3). 4,18 (м, 1H, α Leu), 4,55 (м, 2H, 14-CH2), 4,3-5,0 (м, 3H, 14-OH, 7H, 4'-OH), 5,17 (д, J = 3,1 Гц, 1H, 1'H), 5,46 (с, 1H, 9-OH), 7,1-7,3 (м, 5H, Ar-Phe), 7,53 (д, J = 8,2 Гц, 1H, NH-Gly), 7,60 (м, 1H, 3H), 7,86 (м, 2H, 1H, 2H, 8,05 (д, J = 6,4 Гц, 1H, NH-Leu), 8,11 (т, J = 5,9 Гц, 1H, NH-Gly).
Пример 13
Сополимер 3-метакрилоиламино-2-гидроксипропана, 3'-N(метакрилоилглицил-L-фенилаланил-L-лейцилглицил)доксорубицина и N-метакрилоилглицина (A1)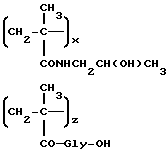

Полимерный предшественник общей формулы B2 (7,15 г, 5 ммолей-COOH), полученный, как описано в примере 4, 3'-N-(глицил-лейцил-L-фенилаланил)доксорубицин (5a: 2,36 г, 2,5 ммоля) растворяются в безводном диметилформамиде (100 мл), затем к раствору добавляется N-этоксикарбонил-2-этокси-1,2-дигидрохинолин (0,7 г, 2,5 ммоля). Смесь перемешивается при комнатной температуре в течение 24 часов, затем выливается в этиловый эфир (800 мл). Осадок растворяется в этиловом спирте (100 мл), высаживается ацетоном (800 мл) и сушится до постоянного веса с получением указанного в заголовке соединения общей формулы A1 (7 г).
Содержанием доксорубицин • HCl: 9% (м/м)
Пример 14
Сополимер 3-метакрилоиламино-2-гидроксипропана, 3'-N-(метакрилоилглицил-L-фенилаланил-лейцилглицил)доксорубицина и (N-метакрилоилглицил)-2-гидроксипропаноламида (A2)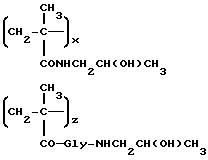
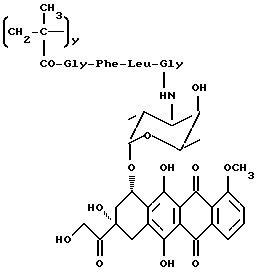
Полимерный предшественник общей формулы B1 (10 г, 2,7•10-3 экв. п-нитрофенилэфира), полученный, как описано в работе Makromol. Chem. 178, 2159 (1977), растворяется в сухом диметилформамиде (60 мл), после чего к раствору добавляется 3'-N(глицил-лейцил-L-фенилаланил)доксорубицин (5a: 1,53 г, 1,72 ммоля). Смесь перемешивается при комнатной температуре в течение 24 часов, после чего к ней добавляется L-аминопропанол (0,13 мл). Через час реакционная смесь добавляется к перемешиваемой смеси ацетон/этиловый эфир (1,2 л 3: 1 по объему) и фильтруется. Осадок растворяется этиловым спиртом (150 мл) и высаживается смесью ацетон: этиловый эфир (1,2 л, 4:1 по объему) с получением полимерного соединения общей формулы A2 (10 г).
Содержание доксорубицин • HCl: 9% (м/м)
Примеры 13-18 иллюстрируют способы получения полимерсвязанных антрациклинов общей формулы A.
Пример 15
Сополимер 3-метакрилоиламино-2-гидроксипропана, 4-деметокси-3'-N- (метакрилоилглицин-L-фенилаланил-L-лейцилглицил)даунорубицина и N-метакрилоилглицина (A3)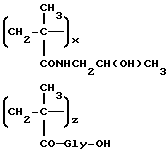
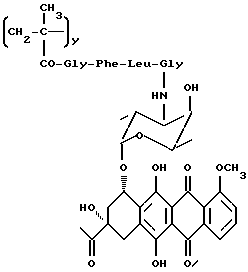
Указанное в заголовке соединение общей формулы A3 получается взаимодействием 4-деметокси-3'-N-(глицил-L-лейцил-L-фенилаланил)даунорубицина (5d: 1,48 г, 1,72 ммоля) с полимерным предшественником общей формулы B2 (10 г) в присутствии N-этоксикарбонил-2-этокси-1,2-дигидрохинолина (0,48 г) в безводном диметилформамиде, как описано в примере 13.
Пример 16.
Сополимер 3-метакрилоиламино-2-гидроксипропана, 4'-эпи-3'-N-(метакрилоилглицил-L-фенилаланил-L-лейцилглицил)доксорубицина и 1-N-(метакрилоилглицил)-2-гидроксипропана (A4)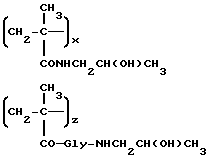
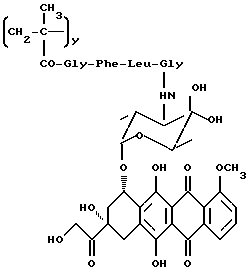
4'-эпи-доксорубициновый полимерный конъюгат общей формулы A4 (10 г) получается взаимодействием 4'-эпи-3'-N-(глицил-L-лейцил-L-фенилаланил)доксорубицина (5e: 1,48 г, 1,72 ммоля) с полимерным предшественником общей формулы B1, а затем с 1-аминопропанолом (0,13 мл), как описано в примере 14.
Содержание 4'-эпидоксорубицин • HCl: 9% (м/м)
Пример 17
Сополимер 3-метакрилоиламино-2-гидроксипропана, 4'-эпи-3'-N-(метакрилоилглицил-L-лейцилглицил)доксорубицина и N-метакрилоилглицина (A5)
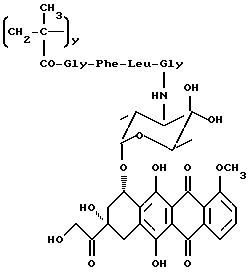
Указанное в заголовке соединение общей формулы A5 получается, как описано в примере 13, из полимерного промежуточного соединения общей формулы B2, 4'-эпи-3'-N-(глициллейцил-L-фенилаланил)доксорубицина (5e) и N-этоксикарбонил-2-этокси-1,2-дигидрохинолина в безводной диметилформамиде.
Пример 18.
Сополимер N-(метакрилоилглицил)-гидроксиэтиламида, 3'-N-метакрилоилглицил-L-фенилаланил-L-лейцилглицил)доксорубицина и N-метакрилоилглицина (A6)
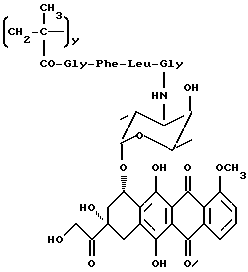
Указанное в заголовке доксорубициновое полимерное пролекарство общей формулы A6 получается конденсацией полимерного промежуточного соединения общей формулы B4 и 3'-N-(глицил-лейцил-L-фенилаланил)доксорубицина (5e) и N-этоксикарбонил-2-этокси-1,2-дигидрохинолина в безводном диметилформамиде, как описано в примере 13.
Пример 19.
Противоопухолевая активность соединения общей формулы A1 на M 5076
Противоопухолевая активность соединения общей формулы A1, описанного в примере 13, определяется следующим образом.
Пример 19
Сополимер A1
x: 90.59; y: 4.52; z: 3.87 мол.%;
М.В. = 33.400; МВ/МН = 1.69.
Пример 20
Сополимер A2
x: 95.56; y: 2.54; z: 1.88 мол.%;
М.В. = 33.400; МВ/МН = 1.69 (полидисперсность)
Пример 21
Сополимер A3
x: 90.61; y: 4.73; z: 3.64 мол.%;
М.В. = 32.900; МВ/МН = 1.71.
Пример 22
Сополимер A4
x: 95.56; y: 2.54; z: 1.88 мол.%;
М.В. = 32.900; МВ/МН = 1.71.
Пример 23
Сополимер A5
x: 90.59; y: 4.52; z: 3.87 мол.%;
М.В. = 32.900; МВ/МН = 1.71.
Пример 24
Сополимер A6
Содержание доксорубицина в виде его гидрохлоридной соли: 8.5% (вес./вес. )
x: 95.45; y: 1.95; z: 1.66 мол.%;
М.В. = 29.800; МВ/МН = 1.73.
Материалы и методы.
1. Применение лекарства.
Все лекарственные растворы получаются непосредственно перед использованием. Лечение заключается в применении в объеме 10 мл/кг массы тела на 5, 9 и 15 дни.
Антрациклины растворяются в стерильной воде, и концентрации определяются спектрофотометрически.
Лиофилизованные полимеры растворяются в воде с получением исходного раствора 25 мг антрациклинового эквивалента на 1 мл в соответствии с приведенной концентрацией, дальнейшее разбавление проводится в воде.
2. Твердая опухоль.
M 5076 мышиная ретикулосаркома получается серийным внутримышечным проходом и трансплантируется (5•105 клетки/мышь) подкожно в C 75 B 1/6 мыши для оценки активности на первичной опухоли.
3. Оценка противоопухолевой активности и токсичности.
Рост опухоли определяется измерением с помощью циркуля, и масса опухоли определяется согласно Герану и др. (смотри Cancer Chemother. Rep. 3, 1 (1972).
Противоопухолевая активность определяется временем (дни) достижения 1 г массы опухоли и выражается как замедление роста опухоли (ЗРО = TGD).
Среднее увеличение времени выживания (Т/С %) рассчитывается с использованием следующей формулы:
Т/С = (среднее время выживания (Т/С %) /среднее время выживания контрольной группы)•100
Токсичность оценивается на основании снижения массы тела и грубого вычисления, главным образом, по уменьшению селезенки и печени.
Нейротоксичность определяется как число мышей с дефектом двигательной функции.
Результаты приводятся в таблице 1.
Пример 20.
Противоопухолевая активность соединения общей формулы A3 от M 5076.
Противоопухолевая активность соединения общей формулы A3, описанного в примере 15, определяется с использованием метода и материалов из примера 19. Результаты приводятся в таблице 2.
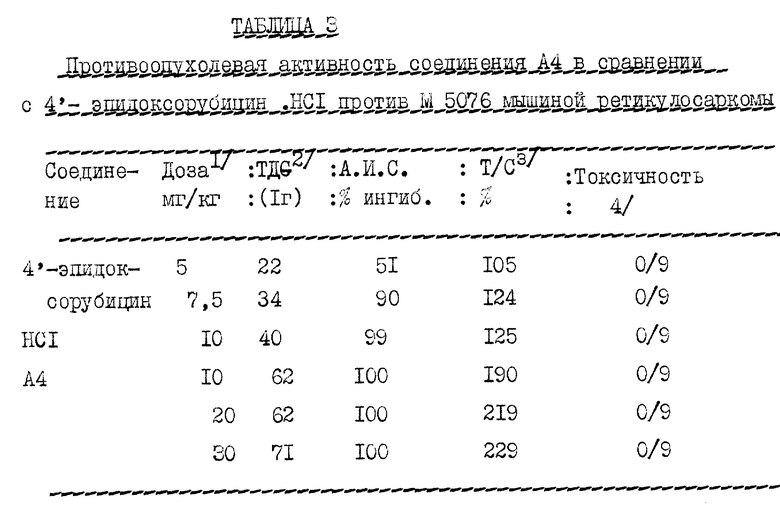
Противоопухолевая активность соединения общей формулы A4 (сополимер 3-метакрилоиламино-2-гидроксипропана, 4'-эпи-3'-N-(метакрилоилглицил-L-лейцилглицил)доксорубицина и 1-N-(метакрилоилглицил)-2-гидроксипропана) в сравнении с 4'-эпидоксорубицин • HCl
Противоопухолевая активность определяется по одинаковой программе (графику) для 4'-эпидоксорубицин • HCl и соединения формулы A4.
Против мышиной ретикулосаркомы соединение общей формулы A4 является более активным, чем свободное лекарство при всех испытанных дозах (смотри таблицу 3).
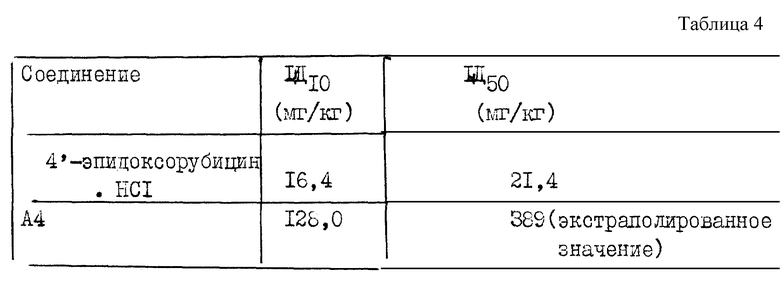
Токсичность соединения общей формулы A4 (сополимер 3-метакрилоиламино-2-гидроксипропана, 4'-эпи-3'-N-(метакрилоилглицил-L-фенилаланил-L-лейцилглицил)доксорубицина и 1-N-(метакрилоилглицил-2-гидроксипропана) в сравнении с 4'-эпидоксорубицин • HCl.
Токсичность оценивается на здоровой C 57BIF-мыши, при обработке внутривенно, единичными зонами 4'-эпидоксорубицин•HCl (13,2-16,15-19-20,6-25,2 и 33,2 мг/кг) и соединения A4 (50-63-79-100-120-140 мг/кг).
Для определения LD10 и LD50 в здоровой C 57BIF-мыши используется анализ с определением вероятности эффекта после 3-недельного восстановления.
Терапевтический индекс рассчитывается с использованием следующей формулы: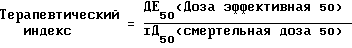
Эффективная доза 50 является дозой, вызывающей 50% снижение роста опухоли. Безопасность животных наблюдается в течение 90 дней.
Значения LD10 и LD50 в C 57BI/F-мыши приведены в таблице 4.
Малая токсичность соединения A4 позволяет применять более высокие дозы продукта и получать равные или лучшие результаты, чем с 4'-эпидоксорубицин•HCl, и получать лучший терапевтический индекс. Терапевтический индекс для 4'-эпидоксорубицин•HCl и соединение A4 равняется, соответственно, 3 и 40.
3. Пример препаративной формы композиции
Раствор для инъекций
Ингредиенты - Количество мг на ампулу
Сополимер A1 - 500 (эквивалент ≈45 мг доксорубицингидрохлорида)
Лактоза - 250
Полисорбат - 80
Вода для инъекций - по потребности до 20,0 мл.
Лактозу, полисорбат и сополимер растворяют при перемешивании в воде для инъекций (ВДИ) и деаэрируют пропусканием водорода (≈ 80% от требуемого конечного объема воды). Полученный раствор доводят до конечного объема добавлением необходимого количества ВДИ.
Раствор фильтруют в стерильных условиях через микропористую мембрану 0.22 мкм. По 20 мл раствора асептически помещают в стерильные, типа I ампулы из бесцветного стекла, имеющие емкость 50-57 мл.
Раствор замораживают в ампулах при температуре от -40 до -45oC в течение 4-5 часов.
Затем продукт лиофилизуют и сушат на конечной стадии в течение 4-6 часов при 40oC.
Ампулы запаивают. Лиофилизованный продукт перед введением разбавляют либо стерильной водой, или хлоридом натрия для инъекций.
Препаративные формы, содержащие сополимеры A3 и A4, готовят по вышеуказанной методике.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМЕРНЫЙ КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2149646C1 |
| СВЯЗУЮЩИЙ АГЕНТ ДЛЯ БИОАКТИВНЫХ ПРЕПАРАТОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2116087C1 |
| ПОЛИМЕРНЫЙ КОНЪЮГАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2130462C1 |
| ПРОИЗВОДНЫЕ АЗА-АНТРАЦИКЛИНОНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2159245C2 |
| АНТРАЦИКЛИНОВЫЙ ГЛИКОЗИД, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2118328C1 |
| ПРОИЗВОДНЫЕ 3'-АЗИРИДИНО-АНТРАЦИКЛИНА, СПОСОБЫ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2149163C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТРАЦИКЛИНОВЫЕ ГЛИКОЗИДЫ, СВЯЗАННЫЕ С ПОЛИМЕРНЫМ ПРОИЗВОДНЫМ | 1992 |
|
RU2118171C1 |
| ПРОИЗВОДНЫЕ АНТРАЦИКЛИНОНА И ИХ ИСПОЛЬЗОВАНИЕ ПРИ АМИЛОИДОЗЕ | 1995 |
|
RU2167661C2 |
| ПРОИЗВОДНЫЕ АНТРАЦИКЛИНА | 1995 |
|
RU2159619C2 |
| 14-ЗАМЕЩЕННЫЕ МАРКФОРТИНЫ | 1994 |
|
RU2131877C1 |




Изобретение относится к новым растворимым синтетическим полимерсвязанным антрациклинам, проявляющим противоопухолевую активность, к способу их получения и содержащим их фармацевтическим композициям. Описывается полимерсвязанный антрациклин общей формулы А, полученный взаимодействием полимерного промежуточного соединения формулы В, где n равно 0 или 1, x составляет от 70 до 98 мол. %, w составляет от 30 до 2 мол.%, R1 является CH2CH(OH)CH3 или СH2CH2OH группой и R2 является 2,4-дихлорфенокси, п-нитрофенокси или гидроксигруппой; с производным антрациклина общей формулы 5: H-Y-[NH-D] , где [NH-D] является остатком антрациклинаминогликозида формулы Q, где один из RI и RII является водородом, а другой - гидроксигруппой или иодом, RIII является водородом или OCH3, а RIV является водородом или гидроксигруппой; Y является пептидной частью, выбранной из Gly-Phe-Gly, Gly-Leu-Gly, Phe-Leu-Gly, Gly-Phe-Leu-Gly, или Leu-Leu-Gly; если R2 является гидроксигруппой, в присутствии N-этоксикарбонил-2-этокси-1,2-дигидрохинолина; и, если необходимо, проводят обработку полученного полимерсвязанного антрациклина 2-гидроксипропиламином, причем реакцию проводят в безводном полярном растворителе, при температуре от 15 до 30oC в течение 8 - 24 ч; причем полученный полимерсвязанный антрациклин имеет среднемолекулярный вес 29800-33400 г/моль и полидисперсность 1,4-1,8. 5 с. и 3 з.п.ф-лы, 4 табл.
где n равно 0 или 1;
x составляет от 70 до 98 мол.%;
w составляет от 30 до 2 мол.%;
R1 является CH2CH(OH)CH3 или CH2CH2OH группой;
R2 является 2,4-дихлорфенокси, n-нитрофенокси или гидроксигруппой,
с производным антрациклина общей формулы 5
H - Y - [NH - D],
где [NH - D] является остатком антрациклинаминогликозида формулы Q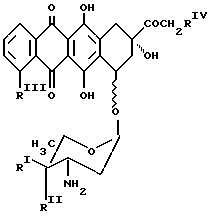
где один из RI и RII является водородом, а другой - гидроксигруппой или иодом;
RIII является водородом или OCH3;
RIV является водородом или гидроксигруппой;
Y является пептидным спейсером, выбранным из Gly-Phe-Gly, Gly-Leu-Gly, Phe-Leu-Gly, Gly-Phe-Leu-Gly или Leu-Leu-Gly; если R2 является гидроксигруппой,
в присутствии N-этоксикарбонил-2-этокси-1,2-дигидрохинолина, и, если необходимо, проводят обработку полученного полимерсвязанного антрациклина 2-гидроксипропиламином, причем реакцию проводят в безводном полярном растворителе, при температуре 15 - 30oC в течение 8 - 24 ч.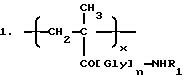
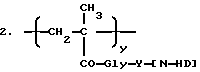
где z составляет от 1 до 29 мол.%;
y составляет до 29 мол.%;
Z является гидроксигруппой или остатком формулы - NHR1, где R1, R2, n, X и Y определены в п.1.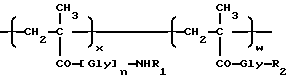
где n равно 0 или 1; x состаляет от 70 до 98 мол.%;
w составляет от 30 до 2 мол.%;
R1 является CH2CH(OH)CH3 или CH2CH2OH группой;
R2 является 2,4-дихлорфенокси, n-нитрофенокси или гидроксигруппой,
с антрациклиновым производным общей формулы 5
H - Y - [NH - D],
где [NH - D] является остатком антрациклинаминогликозида формулы Q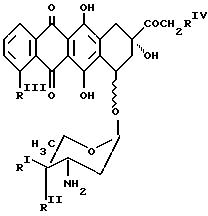
где один из RI и RII является водородом, а другой - гидроксигруппой или иодом;
RIII является водородом или OCH3;
RIV является водородом или гидроксигруппой;
Y является пептидной частью, выбранной из Gly-Phe-Gly, Gly-Leu-Gly, Phe-Leu-Gly, Gly-Phe-Leu-Gly или Leu-Leu-Gly; если R2 является гидроксигруппой,
в присутствии N-этоксикарбонил-2-этокси-1,2-дигидрохинолина, и, если необходимо, проводят обработку полученного полимерсвязанного антрациклина 2-гидроксипропиламином, причем реакцию проводят в безводном полярном растворителе, при температуре 15 - 30oC в течение 8 - 24 ч.
H - Y - [NH - D],
где Y является Gly-Phe-Gly, Gly-Leu-Gly, Phe-Leu-Gly, Gly-Phe-Leu-Gly или Leu-Leu-Gly;
NH - D является остатком антрациклинаминогликозида NH2D формулы Q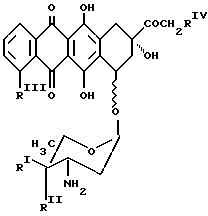
где один из RI и RII является водородом, а другой является гидроксигруппой или иодом;
RIII является водородом или OCH3;
RIV является водородом или гидроксигруппой.
H - Y - [NH - D],
где Y является Gly-Phe-Gly, Gly-Leu-Gly, Phe-Leu-Gly, Gly-Phe-Leu-Gly, Leu-Leu-Gly;
NH - D является остатком антрациклинаминогликозида NH2-D формулы Q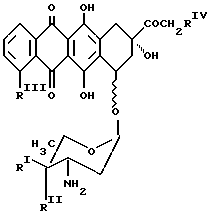
где один из RI и RII является водородом, а другой - гидроксигруппой или иодом;
RIII является водородом или OCH3;
RIV является водородом или гидроксигруппой;
включающий i) взаимодействие N-защищенного пептида общей формулы 9
R3 - Y - P,
где R3 является тритилом;
P является n-нитрофеноксигруппой;
Y - такой, как определен выше,
с антрациклинаминогликозидом [NH2 - D], определенном выше, с получением промежуточного соединения общей формулы 10
R3 - Y - [NH - D],
в которой [NH - D], Y и R3 определены выше;
ii) удаление защитной группы R3 с получением пептидилантрациклина общей формулы 5 в форме свободного основания.
| Способ получения гликозида | 1987 |
|
SU1590045A3 |
| ЦИЛИНДРИЧЕСКИЙ ТРИЕР | 0 |
|
SU298385A1 |
| ПНЕВМАТИЧЕСКИЙ КОЛЬЦЕВОЙ СЧЕТЧИК | 0 |
|
SU392487A1 |
| EP 0514515 A1, 1992 | |||
| Macromolekulare chemie, Macromolecular Symposia 70/71, 1993, Basel CH, p.157 - 162 | |||
| R.Duncan et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аркамон А.Ф | |||
| Доксорубицин | |||
| - Medical chemistry monograph, т.17, Academic Press, 1981. | |||
Авторы
Даты
2000-02-27—Публикация
1994-04-08—Подача