Изобретение относится к борьбе с ретровирусами, более конкретно к иммуногену для предотвращения и лечения ретровирусных заболеваний, преимущественно спида.
На дату приоритета данного изобретения специальная литература не содержит сведений о создании высокоэффективного средства для борьбы с ретровирусами, преимущественно ретровирусом HIV.
Задачей изобретения является создание высокоэффективного средства для борьбы с ретровирусами, преимущественно ретровирусом HIV.
Поставленная задача решается предлагаемым иммуногеном для предотвращения или лечения ретровирусных заболеваний, преимущественно спида, содержащим неинфекционные частицы ретровируса, свободные от белков наружной оболочки, или выбранные антигены, выделенные из ретровируса.
Изобретение далее поясняется на примере ретровируса HIV.
Когда индивидуум становится зараженным HIV, вирус предпочтительно приспособляется к определенному классу клеток, называемых лимфоцитами T4, которые отличаются присутствием поверхностного маркера клеток, называемого CD 4. Эти белые кровяные клетки (лейкоциты) играют существенную роль в иммунной системе, функционируя как решающие компоненты как гуморальной, так и клеточной иммунной реакции. Основное содержание губительного воздействия HIV может быть приписано функциональному подавлению или разрушению T4-лимфоцитов
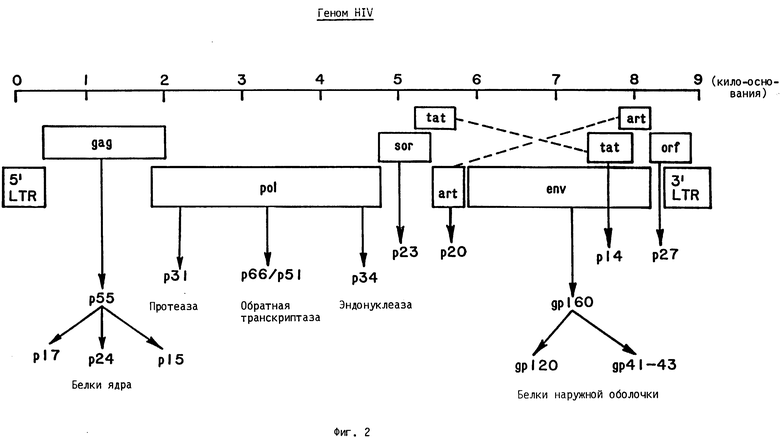
Вирион интактного HIV является приблизительно сферическим и имеет диаметр приблизительно 110 мм. Вирион имеет наружную мембрану, покрытую шишками или шипами, выполненными из глюкопротеина gp. 160/120. Кроме того, существует трансмембранный белок, обозначенный gp41. Внутри вириона находятся два структурных белка: наружная оболочка составлена фосфопротеином p17 и внутренний нуклеоид, или центральное ядро, выполнен из фосфопротеина p24. Вирусная РНК присутствует внутри ядра вместе с двумя копиями обратной транскриптазы p66/51, которая необходима для синтеза вирусной ДНК из матрицы РНК. Схематическая модель HIV представлена на фиг. 1.
Как показано на фиг. 2, геном РНК HIV кодирует три основных структурных гена: gag, pol и env, которые фланкированы на обоих концах длинными концевыми дупликациями (LTR). Ген gag кодирует специфические белки ядра, p55, p39, p24, p17 и p15. Гены pol кодируют обратную транскриптазу p65/p51 и протеазу p31. Гены env кодируют гликопротеин наружной мембраны gp120 и его предшественник gp160, а также трансмембранный гликопротеин gp41. Некоторые из генов являются чрезвычайно вариабельными, в частности, гены env. Кроме того, существуют пять других генов, не присутствующих в других ретровирусах, которые либо вовлечены в транскрипционную или трансляционную регуляцию, либо кодируют другие структурные белки. Структура гена HIV известна. Она описана Ратнером и др. Nature, 313, стр. 277 (1985).
HIV присоединяется к клеткам хозяина путем взаимодействия мембранных гликопротеинов с поверхностным рецептором клетки. Оказывается, что при контакте HIV с клеткой T4 протеин gp120 взаимодействует с рецептором CD4. Вирусная оболочка затем слияется с клеточной мембраной, и внутреннее ядро вируса входит в зараженную клетку, где транскрипция РНК в вирус ДНК катализируется обратной транскриптазой. Провирус может оставаться в клатке в латентной форме в течение нескольких месяцев или лет, и все это время зараженный индивидуум является бессимптомным. Однако, если вирус позднее активируется, вызывая вирусную репликацию и иммуносупрессию, индивидуум будет затем восприимчивым к условно-патогенным заражениям, включая рак, ассоциируемым со спидом.
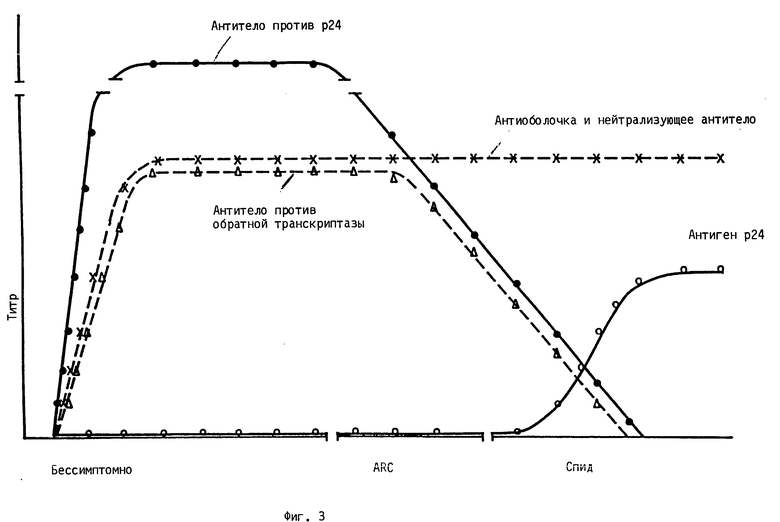
На фиг. 3 представлено схематическое воспроизведение уровня некоторых антител и антигенов, присутствующих в развитии из бессимптомного состояния до состояния ARC (связанный со спидом комплекс) и до спида у HIV - сероположительных пациентов, зараженных HIV.
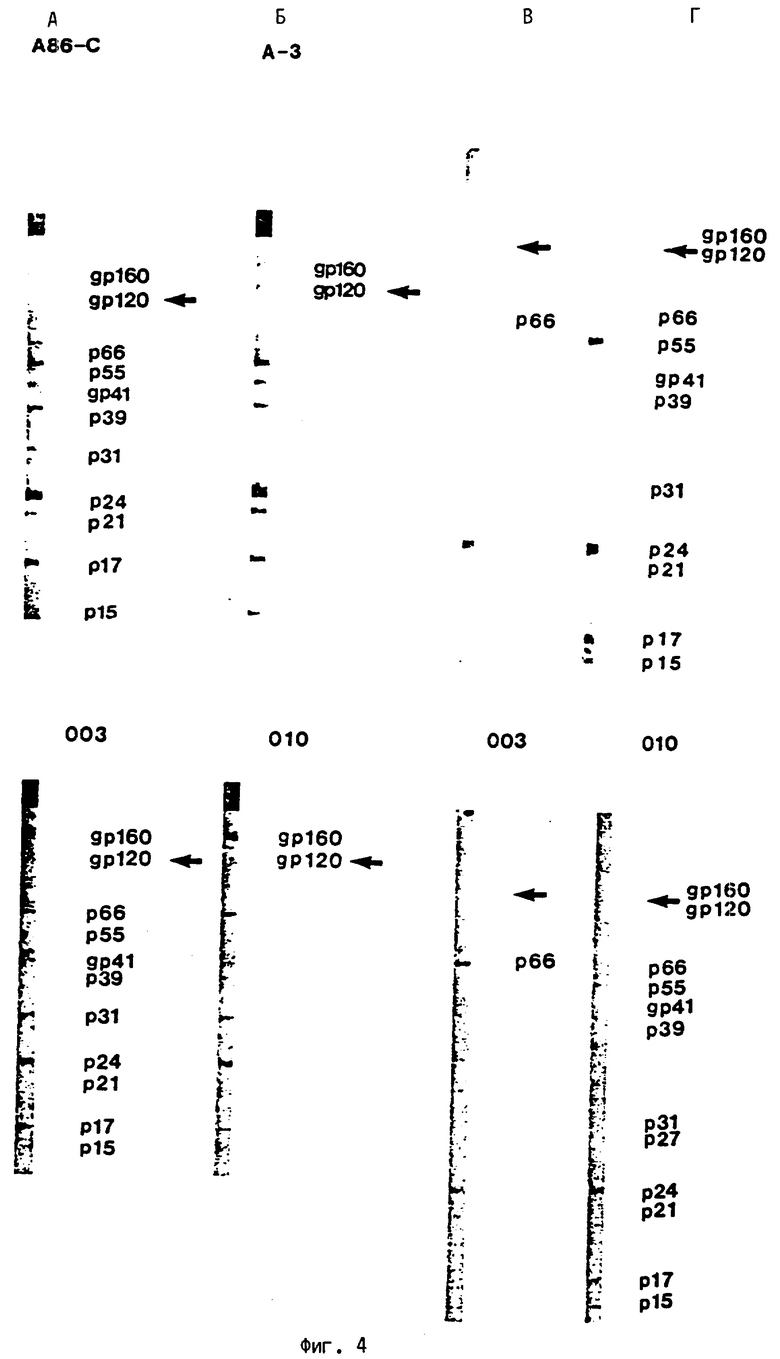
На фиг. 4 представлены результаты анализа по Вестерну иммуногена по примеру 1, которые показывают, что он свободен от белков наружной оболочки при скрининге гомологичными и гетерологичными сыворотками, которые содержат высокие титры антитела против белков наружной оболочки.
А. Коммерческие полоски по Вестерну с пятнами HIV в результате скрининга гетерологичными сыворотками шимпанзе;
Б. Полоски по Вестерну с пятнами иммуногена в результате скрининга гетерологичными сыворотками шимпанзе;
В. Коммерческие полоски с HIV-пятнами по Вестерну в результате скрининга гомологичными сыворотками человека;
Г. Полоски по Вестерну с пятнами иммуногена в результате скрининга гомологичными сыворотками человека.
Как показано схематически на фиг. 3, высокие уровни антитела против gp160/120 (наружная оболочка), которые присутствуют в бессимптомной фазе заражения HIV, также продолжают существовать в симптомной фазе. Уровень антитела p24 в бессимптомной фазе является высоким, но, по-видимому, снижается в симптомной фазе. Аналогично HIV-сероположительные сыворотки содержат антитело, которое ингибирует функцию обратной транскриптазы. У пациентов, в которых антитело против обратной транскриптазы присутствует на высоких уровнях, попытки относительно выделения вируса менее часто положительны, нежели у тех, в которых оно отсутствует. Поэтому следует, что уменьшение клеточных и гуморальных иммунозащитных факторов, таких как T4-клетки и антитела против GAG, включая анти-p24, и антитела против pol, включая антитело против обратной транскриптазы, связано с развитием HIL до спида.
Используемый в данном описании термин "HIV" включает типы 1 и 2 и является сининимом HTLV-III, LAV-1 и LAV-2. HIV относится к вирусу в общем смысле и включает все формы, подтипы и вариации.
Используемый в данном описании термин "белок наружной оболочки" относится к той части мембранного гликопротеина ретровируса, которая выступает за пределы мембраны, в противоположность трансмембранному белку, gp41. Белок наружной оболочки HIV является синонимом gp120 и его предшественника gp160.
Используемый в данном описании термин "gp120" или "gp160/120" относится к гликопротеинам, имеющим либо антигенную специфичность, либо биологическую функцию белка наружной оболочки; gp160, как полагают, является предшественником gp120.
Используемый в данном описании термин "генный продукт" относится к полипептиду или белку, который кодируется геном. Термин, как предполагают, включает в себя белковые производные, такие как гликопротеины. Понятно, что в аминокислотную последовательность генного продукта могут быть внесены ограниченные модификации без нарушения биологической функции или иммуногенности генного продукта, и только часть первичной последовательности может потребоваться для иммуногенности.
Идентификация HIV-специфических генов и генных продуктов основана на терминологии HIV типа 1, представленной на фиг.1. Предполагается, однако, что ссылка на специфический ген или генный продукт HIV типа 1, на основе его молекулярной массы будет также включать соответствующий ген или генный продукт HIV типа 2 и, когда присутствует гомологичный ген, другие ретровирусы. Генные продукты других типов и родов могут иметь незначительно отличающиеся молекулярные массы. Например, gp41 HIV типа 1 эквивалентен gp36 типа 2, тогда как gp120 типа 1 соответствует gp130 типа 2.
HIV можно культивировать из пробы периферической крови зараженных индивидуумов. Например, одноядерные клетки из периферической крови, такие как лифоциты, могут быть получены путем наслоения пробы гепаринизированной венозной крови по градиенту плотности Ficoll-Hypaque и центрифугирования пробы. Одноядерные клетки затем собирают, активируют, например, фитогемагглютинином в течение двух-трех дней и культивируют в подходящей среде, предпочтительно пополненной интерлейкином 2. Вирус может быть обнаружен либо анализом на обратную транскриптазу, анализом с захватом антигена для p24, иммунофлюоресценцией, либо электронной микроскопией для обнаружения присутствия вирусных частиц в клетках. Все эти методы хорошо известны специалистам в данной области. После выделения вирус может быть включен в другие клетки.
Важно использовать неинфекционную вакцину с тем, чтобы избежать проникновения инфекции в хозяина. Различные методы хорошо известны для придания болезнетворному организму неинфекционности. Вирус можно инактивировать или сделать репликационно-недостаточным. Предпочтительно, однако, обрабатывать его комбинацией бета- пропиолактона и гамма-излучения. При этом бета-пропиолактон должен находиться в контакте с вирусом как минимум 2,5 ч. Чтобы полностью удалить какой-либо остаточный бета-пропиолактон, бета-пропиолактон должен оставаться в растворе в течение как минимум пяти часов при температуре 37oC.
Выделенный вирус затем обрабатывают так, чтобы удалить белки наружной оболочки. Такое удаление предпочтительно осуществляют неоднократными замораживанием и оттаиванием вируса в сочетании с физическими методами, которые вызывают набухание и сокращение вирусных частиц, хотя также можно использовать другие физические и нефизические методы, такие как разрушение ультразвуком, в отдельности или в сочетании друг с другом.
Как уже указывалось выше, предлагаемый иммуноген может также представлять собой в основном очищенные генные продукты ретровируса, такого как HIV, за исключением белков наружной оболочки. Такие генные продукты включают те продукты, которые кодируются генами gag (p55, p39, p24, p17 и p15), генами pol (p66/p51 и p31-34), и трансмембранный гликопротеин gp41. Эти генные продукты могут быть использованы отдельно или в комбинации. Альтернативно генные продукты остальных пяти генов генома HIV могут быть также использованы в качестве иммуногена. Генные продукты могут быть выделены и очищены от вируса или могут быть получены клонированием и экспрессией подходящего гена в организме хозяина, такого как бактериальные, грибковые или млекопитающие клетки, хорошо известными в данной области методами. Альтернативно антигены могут быть синтезированы с использованием хорошо известных методов, таких как автоматизированный пептидный синтез. Аминокислотная последовательность генных продуктов выведена из никлеотидной последовательности.
Для иммунизации человека или животного предлагаемый иммуноген может применяться вместе со вспомогательными веществами. Но он может также применяться в своей водной форме без вспомогательного вещества. При этом дозу выбирают так, чтобы она была иммунологически эффективной, и она, как правило, составляет от 1 до 100 мкг белка, предпочтительно около 30 мкг белка.
Активную иммунизацию осуществляют и предпочтительно повторяют раз с минимальным интервалом по меньшей мере 90 дней, хотя дополнительные ревакцинации могут подходить в соответствии с изменениями в уровне иммунной активности на основе, например, уменьшения количества антител против HIV-генным продуктам, другим, нежели белки наружной оболочки. Такую иммунизацию предпочтительно осуществляют первоначально путем внутримышечной инъекции с последующей внутрикожной инжекцией, хотя может быть использована любая комбинация внутрикожной и внутримышечной инъекции.
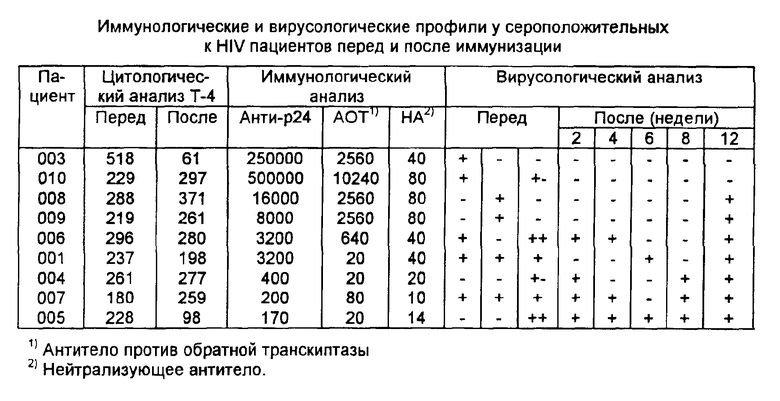
Предпочтительно иммунокомпетентность или иммунную активность сероположительного индивидуума определяют перед иммунизацией с тем, чтобы определить подходящий путь лечения. В качестве метода такого определения сыворотки пациентов подвергают скринингу на присутствие антител против p24 (например, при помощи иммуноферментного твердофазного анализа), антитела против обратной транскриптазы и/или уровня клеток T4 при помощи хорошо известных методов. Пациенты, проявляющие индикаторы низкой иммунокомпентентности, например низкие титры p24 или антитела против обратной транскриптазы или низкие количества клеток T4, являются подходящими кандидатами для пассивной иммунотерапии, предпочтительно в сочетании (проводимой перед или совместно) с активной иммунизацией.
Серонегативные индивидуумы могут быть вакцинированы с тем, чтобы вызвать иммунозащитные факторы для предотвращения инфекции. Предпочтительно вакцину вводят первоначально путем внутримышечной инъекции с последующим введением бустера, осуществляемым либо внутримышечно, либо внутрикожно. Физиологически эффективная доза содержит предпочтительно от 1 до 100 мкг и более предпочтительно около З0 мкг иммуногена. Вакцину предпочтительно вводят в сочетание с адъювантом, т.е. вспомогательным веществом, наиболее предпочтительно адъювантом для обеспечения получения препарата типа "вода в масле". Различные подходящие адъюванты хорошо известны в данной области.
Кроме того, поскольку антитела против gp160/120 могут содействовать вирусной абсорбции клетками, эти специфические антитела могут быть удалены из пациента, зараженного HIV, перед иммунотерапией. Иммуносорбентные колонки, выполненные из полых целлюлозных волокон, модифицируют с тем, чтобы ковалентно связать лиганды, реакционноспособные с антителами против gp160/120. Такие лиганды включают антигены gp160/120, полученные из очищенных гликопротеинов, которые в свою очередь получены из только что собранных вирусных частиц или из культурального супернатанта HIV-продуцирующих T4-лимфоцитов. Альтернативно такие лиганды могут быть получены методами рекомбинантной ДНК с использованием трансфецированных клеток. Альтернативно идиотипы, реакционноспособные с антителами против gp160/120, могут быть использованы для этих целей.
Такие анти-идиотипные антитела могут быть получены методами, хорошо известными в данной области.
Пример 1. Получение вирусных частиц, свободных от белков наружной оболочки.
Клетки, зараженные штаммом HIV No. HZ 321 (выделившимся из плазмы 26-летней африканской женщины из Саира) выращивают в среде А, состоящей из RPMI 1640 с 10%-ной эмбриональной сыворотки крупного рогатого скота, 25 мМ буфера HEPES, 50 мкг/мл гентамицина и 100 мгк/мл стрептомицина.
Культуры увеличивают в объеме путем подачи исходных клеток в центрифужные пробирки и доведения объема приблизительно до 8 л добавкой предварительно нагретой среды А. При этом степень разведения составляет приблизительно 1:5. Затем осуществляют второе разведение в соотношении 1:3.
Супернатант от 5-7-дневной суспензии HIV-зараженных клеток фильтруют через фильтр размером 0,45 мкм. Свежеприготовленный раствор 1:40 бета-пропиолактона прибавляют к супернатанту до конечной концентрации 1:4000. Раствор инкубируют в течение пяти часов при температуре 37oC и pH поддерживают на уровне 7,2-7,4.
Через 5 ч 20 мл раствора супернатанта удаляют, чтобы определить уровень инфективности и количество оставшегося бета- пропиолактона. Затем супернатант замораживают при температуре -70oC. Замороженный супернатант затем подвергают гамма-облучению кобальтом60 мощностью 4,5 mR.
Раствор супернатанта затем оттаивают и концентрируют путем 40- кратной фильтрации через выполненные с мол.м. 100000 фильтры. Концентрат подают в снабженные мешалкой колбы Т-21, предварительно обработанные 70%-ным изопропанолом, и центрифугируют при 28000 об/мин в течение одного часа. Супернатант удаляют и осадок повторно суспендируют в содержащем ЭТУК натриевом буфере до общего конечного объема приблизительно 24 мл. 4 мл этой суспензии расслаивают над 8 мл 30%-ной сахарозы в полиалломерных пробирках, предварительно обработанных 70%-ным изопропанолом, и центрифугируют в течение одного часа при 28000 об/мин. Супернатант сливают из З0%-ной сахарозы и осадок ресуспендируют в указанном натриевом буфере.
Градиент в ультрасветлых центрифужных пробирках, предварительно обработанных 70%-ным изопропанолом, устанавливают путем прибавления 3 мл 45%-й сахарозы в пробирку и наложения сверху 6 мл 30%-й сахарозы. 3 мл вышеописанной суспензии наслаивают на раствор. Пробирки центрифугируют в течение 60 мин при 28000 об/мин.
Раствор над слоями при 35%-м переходе отсасывают пипеткой и сливают. Слои из всех пробирок соединяют в одной конической пробирке и разбавляют в соотношении 1: 10 фосфатсодержащим буферным солевым раствором. Раствор центрифугируют в полиалломерных пробирках, предварительно обработанных 70%-ным изопропанолом, в течение одного часа при 28000 об/мин. Супернатант удаляют и осадки в пробирках ресуспендируют в указанном фосфатсодержащим буферном растворе при концентрации 1 мл на 10 л исходного вещества.
Альтернативно особенно, когда иммуноген получают в больших количествах, стадию облучения можно осуществлять после объединения слоев. Затем вирус расслаивают на градиенте 15-50%-ной сахарозы. Вирусные слои объединяют и ресуспендируют в вышеуказанном фосфатсодержащем буферном растворе. Вирус центрифугируют при 28000 об/мин в течение одного часа и ресуспендируют в упомянутом буферном растворе до конечной концентрации равной 1,0 мг/мл.
Количество имеющегося белка определяют в соответствии с методом Бредфорда (см. Anal. Biochem, 72, стр.248, 1976 г). Белок разбавляют вышеуказанным фосфатсодержащим буферным раствором до концентрации равной 1,0 мг/мл.
Уровень остаточного бета-пропиолактона в иммуногене определяют с использованием капиллярного газо-жидкостного хроматографа. При этом приготовляют стандартные растворы бета-пропиолактона и масляной кислоты, имеющие концентрации между 1 и 500 частями на миллион. Пробы объемом 2 мкм вводят в капиллярный хроматограф в соответствии с рекомендацией изготовителя. Предел обнаружения составляет 0,1 ч/мил. Иммуноген содержит менее чем 0,05 ч/мил. бета-пропиолактона.
Восемь проб иммуногена анализируют на содержание бета-пропиолактона капиллярной газовой хроматографией, используя масляную кислоту в качестве внутреннего стандарта. Используют следующие хроматографические условия: колонка: 30 м • 0,25 мм, кварцевое стекло, открытая, трубчатая; стационарная фаза: 100%-ный цианопропил-кремний; температура ввода пробы 140oC; рабочая температура: 70oC/1 мин, 20oC/мин до 130oC; методика ввода пробы: нерасщепляющая. При вышеприведенных условиях время удерживания бета-пропиолактона и масляной кислоты соответствует 7,52 мин и 6,70 мин соответственно. Ввод 2 мкл 1 ч/мил. раствора бета-пропиолактона приводит к получению пика, который может быть измерен количественно. Концентрация 1 ч/мил. раствора до 1/10 его объема упариванием растворителя при температуре 40oC при пониженном давлении не приводит к ощутимой потери бета-пропиолактона. Предел обнаружения после концентрации составляет 0,1 ч/мил./0,1 мкг/мл.
Чтобы подтвердить то, что иммуноген свободен от белков наружной оболочки, иммун2оген вначале разделяют на 11,0%-ных полиакриламидных гелях с применением додецилсульфата натрия в соответствии со способом Лэммли, см. Nature 227, стр. 680, 1970 г). Очищенный материал затем переносят на нитроцеллюлозную бумагу в соответствии с методом, предложенным Таубином и др. (см. Proc. Nature. Acad. Sci., 76, стр. 4350, 1979 г) и иммуноокрашивают в соответствии с методом, предложенным Цанг и др. (см. Meth. Enzymalogy, 92, стр.377, 1983 г). Как можно видеть на фиг.4, пятна полученного таким образом иммуногена не имеют полосу, соответствующую gp120/160, как указано в контрольных испытаниях, при взаимодействии с сыворотками, содержащими высокие титры анти-gp160/120.
Как показано на фиг.4, коммерческие полоски с имеющимися на них белками HIV, подвергнутые скринингу с гетерологичной сывороткой (шимпанзе А86-С и А-3) и содержащие высокие титры антител против белков наружной оболочки, gp160/120, являются негативными (нереакционноспособными) на полосках, полученных при анализе полученного вышеописанным образом иммуногена, свободного от наружной оболочки. Гомологические человеческие сыворотки (003 и 010), содержащие высоко-титры антител против белков наружной оболочки, gp160/120, являются реакционноспособными с коммерческими полосками, но негативными с полосками, полученными из иммуногена, свободного от наружной оболочки. Как гомологические, так и гетерологические сыворотки вступают во взаимодействие с другими генными продуктами HIV.
Отсутствие белков наружной оболочки на предлагаемом иммуногене подтверждают электронной микроскопией. К иммуногенному препарату последовательно добавляют 2,5%-ный глутаральдегид и осмиевый ангидрид, дегидратируют с помощью растворов этанола разных концентраций и заливают в EPON-812. Тонкие шлифы получают с помощью прибора LKB Microtom (фирма LKB, Уписала, Швеция) с использованием алмазного скальпеля. Толщина шлифов составляет 60 нм. Шлифы окрашивают уранилацетатом и лимоннокислым свинцом, наблюдают и фотографируют с использованием электронного микроскопа марки Цейс 109. Служащие в качестве контроля клетки, зараженные HIV, подготовляют с использованием той же методики. При этом обнаруживают, что иммуноген на имеет темно-окрашенную наружную оболочку, которая присуща контрольным пробам и которая отражает gp160/120 на вирусной поверхности.
Пример 2. Иммунотерапия сероположительных индивидуумов.
Девять пациентов, сероположительных к HIV, лечат иммунотерапией при даче иммуногена по примеру 1. При этом иммуноген эмульгируют в соотношении 1:1 в неполном адъюванте Фройнда в эмульсификаторе марки Spex 8000 Mixer Mill инофирмы Спекс Индастриз Инк. , США; 1,0 мл раствора, содержащего 100 мкг белка, вводят внутримышечно. Бустер 100 мкг белка без адъюванта вводят через 90 дней путем внутрикожной инъекции.
Присутствие вируса HIV в лимфоцитах периферической крови пациентов определяют как до, так и после иммунизации путем сокультивирования вместе со свежеприготовленными лимфоцитами периферической крови, стимулированными фитогемагглютинином и интерлейкином-2 в соответствии с методом Галло и др. (см. J. Clin. Microb., 25, стр. 1291, 1987 г). Оборудование для обнаружения присутствия антигенов HIV, таких как p24, коммерчески доступно (например, от инофирмы Е.И.Дю-Пон энд Де-Немурс Ко., Инк, США). Каждого пациента обследуют три раза перед иммунизацией и через 2, 4, 6, 8, 12 и 14 недель после иммунизации.
В таблице представлены результаты исследований. Пациенты 010 и 003, из которых HIV выделен перед иммунизацией, не проявляют выделяемый вирус вплоть до 12 недели после иммунизации. Пациенты 008 и 009 не являются переносчиками вируса вплоть до 8 недели после иммунизации. Все четыре пациента проявляют высокие титры анти-p24 (> 1:5000) и антитела против обратной транскриптазы (> 1: 1000) перед иммунизацией. Остальные пять пациентов, которые проявляют низкие титры анти-p24 и антитела против обратной транскриптазы перед иммунизацией, продолжают проявлять выделяемый вирус после иммунизации.
Средство может быть использовано для борьбы с ретровирусами, в частности для предотвращения и лечения спида. Оно представляет собой иммуноген, содержащий неинфекционные частицы ретровируса HIV, свободные от его наружной оболочки, или по крайней мере один антиген, выделенный из данного ретровируса. 1 табл, 4 ил.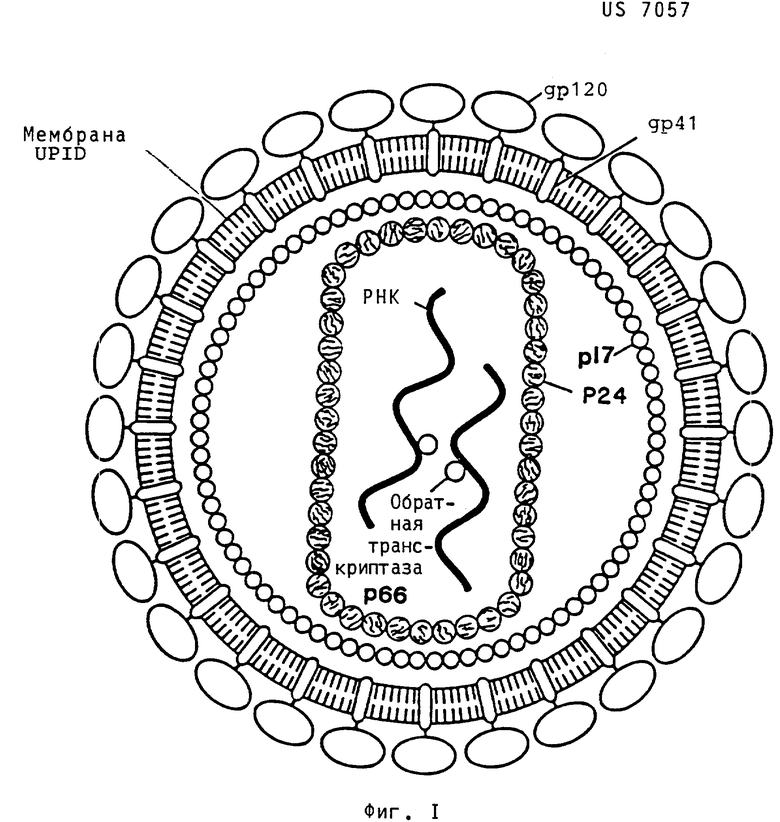
Иммуноген для предотвращения или лечения СПИДа, содержащий частицы ретровируса, отличающийся тем, что он содержит неинфекционные частицы ретровируса HIV, свободные от его наружной оболочки, или по крайней мере один антиген, выделенный из данного ретровируса.
| СПОСОБ ПОЛУЧЕНИЯ ДИЭТИЛОВОГО ЭФИРА р-ХЛОРТЕТРАГИДРОФУРИЛПРОПИЛМАЛОНОВОЙ КИСЛОТЫ | 0 |
|
SU213894A1 |
| EP 0214709 (United Biomedical, Inc), 18.03.87, A 61 K 39/21 | |||
| РЕЗЕРВИРОВАННЫЙ ТРИГГЕР | 0 |
|
SU213921A1 |
Авторы
Даты
1998-05-20—Публикация
1988-06-09—Подача