Изобретение относится к микроорганизмам для продуцирования триптофана и способам их получения.
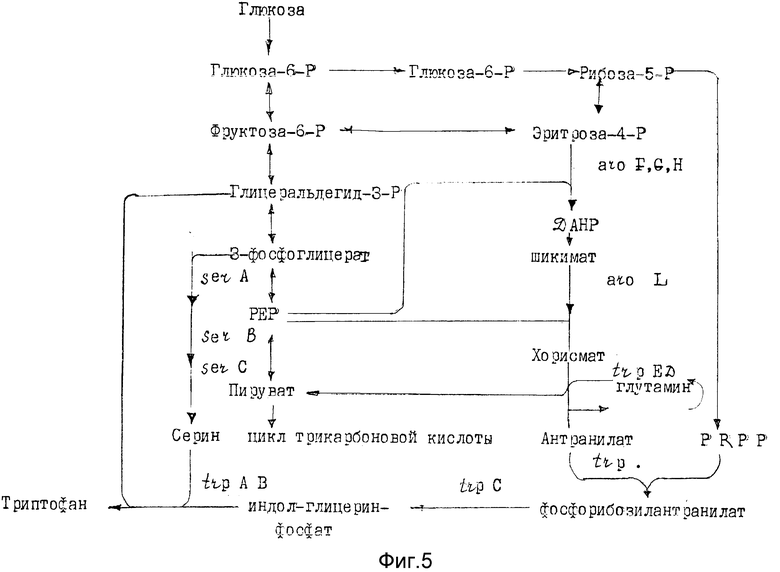
Известно, что метаболизм триптофана во всех до сих пор исследованных микроорганизмах протекает по единому пути биосинтеза (Somerville, R.Z., Hermann, K. M. , 1983, Aminoacids, Biosynfhesis and Jenetic Regulation, Adelison-Wesley Publishing Company, США: 301-322 и 351-378; Aida и др., 1986, Biotechnology of amino acid production, progress in industrial microbiology, т.24, Elsevier Science Publishers, Амстердам: 188 - 206). Метаболизм триптофана, его связь с метаболизмом серина, а также кодирующие важнейшие ферменты гены представлены на фиг. 5.
Известные способы продуцирования триптофана основываются на том, что измененный trpE-ген, который колирует нечувствительную к триптофану антранилатсинтазу, вместе с другими генами trp- оперона экспримируется на пригодном автономно-реплицируемом векторе. Благодаря более высокому числу генов приходят к повышенной экспрессии trp-генов и соответственно к повышенному количеству отдельных ферментов метаболизма триптофана. Это приводит к сверхпродуцированию триптофана.
Примеры таких способов описаны для ряда организмов: например для E. coli: европейский патент N 0293207, патент США N 4371614; для бациллы (Bacillus): патент США N 4588687; для коринебактерии и бревибактерии: европейский патент N 0388474. В случае этих способов возникает ряд проблем при осуществлении процесса. Это может быть нестабильность и потеря вектора или замедленный рост продуцирующего штамма.
В европейском патенте NA-0401375 (заявитель; Kyowa Hakko Kogyo Co.) описывается способ продуцирования L-триптофана с помощью штаммов коринебактерий и бревибактерий, которые содержат рекомбинантные плазмиды. Эти плазмиды несут генетическую информацию для синтеза ферментов DAHP-синтазы, антранилатсинтазы, индол-3-глицерин-Р-синтазы, триптофансинтазы и фосфоглицератдегидрогеназы. Применяют устойчивые к регуляции по типу обратной связи аллели антранилатсинтазы.
Далее, известно повышение продуцирования триптофана в штаммах с регулированным метаболизмом триптофана за счет введения нескольких генов дикого типа ser A или ser A, В, С. Так, в Chemical Abstracts (С.А.)III (1989) 16 86 88 g и С.А. III (1989) 16 86 89 r описывается применение штаммов Bacillus, которые переэкспримируют ser A -аллель дикого типа, соответственно все гены дикого типа метаболизма серина (ser A, ser B и ser C) на плазмидах для продуцирования триптофана. В ВОИС-А-87/01130 описывается использование ser A-, ser B-, ser C-аллелей дикого типа для продуцирования триптофана в E.coli.
Повышение выхода триптофана за счет предотвращения разложения серина в клетке известно из европейского патента N A- 0149539 (заявитель: Stauffer Chemical Company). В этой заявке на патент описываются E.coli K12 - мутанты, в которых разрушен разлагающий серин фермент сериндеаминаза (Sda). Там описывается также применение таких штаммов для продуцирования аминокислот. В примере VIII описывается использование такого штамма для сверхпродуцирования триптофана из антранилата. Улучшенный по сравнению со штаммом с интактной сериндеаминазой выход триптофана в европейской заявке на патент объясняется тем, что в микроорганизмах, в которых запас триптофана на предшествующей стадии очень высок, серин, соответственно производительность биосинтеза серина является фактором, лимитирующим скорость продуцирования триптофана.
Наиболее близким к предлагаемому является способ получения триптофана путем глубинного культивирования продуцирующих его микроорганизмов Bacillus sibtilis ВНИИгенетика-15 в условиях аэрации на питательной среде (SU, авторское свидетельство, 990814, кл. C 12 P 13/22, 1983).
Задачей изобретения является поиск микроорганизмов, которые в повышенной степени продуцируют триптофан, и разработка способов, которые позволяют получать такие микроорганизмы.
Задача решается благодаря штаммам микроорганизмов, которые отличаются тем, что они обладают разрегулированным метаболизмом триптофана и разрегулированным по крайней мере за счет устойчивого к регуляции по типу обратной связи ser A-аллеля метаболизмом серина.
В изобретении под устойчивыми к регуляции по типу обратной связи ser A-аллелями нужно понимать мутанты ser A-гена, которые кодируют фосфоглицератдегидрогеназу с чувствительностью к серину, пониженной по сравнению с соответствующей фосфоглицератдегидрогеназой дикого типа соответствующего микроорганизма.
Благодаря предлагаемой согласно изобретению комбинации по меньшей мере одного устойчивого к регуляции по типу обратной связи ser A-аллеля с микроорганизмом с разрегулированным метаболизмом триптофана удивительным образом повышается выход триптофана вплоть до в 2,6 раза по сравнению с выходом, которого можно достигать с помощью тех же микроорганизмов без устойчивого к регуляции по типу обратной связи ser A-аллеля при прочих равных условиях культивирования.
То, что предлагаемые в изобретении штаммы в повышенной степени продуцируют триптофан, является неожиданным, так как устойчивые к регуляции по типу обратной связи ser A-аллели обладают эффектом только при высоком внутриклеточном уровне серина (Tosa T., Piger L.T., 1971, Journal of Bacteriology, т. 106: 972 - 982; Winicov J., Piger L.T. 1974, Journal of Biological Chemistry, т. 249, с. 1348 - 1355). Согласно уровню техники (например, европейский патент NA-0149539), микроорганизмы с разрегулированным метаболизмом триптофана, однако, имеют низкий уровень серина. Поэтому благодаря предлагаемому согласно изобретению введению устойчивого к регуляции по типу обратной связи ser A-аллеля в микроорганизмы с разрегулированным метаболизмом триптофана нельзя ожидать никакого повышения продуцирования триптофана.
Так как в случае всех известных микроорганизмов метаболизм триптофана протекает по представленному на фиг. 5 пути метаболизма и применяемые для получения предлагаемых в изобретении штаммов способы в принципе известны и применимы ко всем микроорганизмам, предлагаемые согласно изобретению штаммы получаются из любых микроорганизмов.
Для получения предлагаемого согласно изобретению штамма предпочтительно пригодны бактерии. Особенно предпочтительны грамотрицательные бактерии, в особенности E.coli.
Предлагаемые согласно изобретению штаммы можно получать таким образом, что в любом триптофан-прототрофном исходном штамме полностью или частично ликвидируется регуляция метаболизма триптофана и в этот штамм вводится устойчивый к регуляции по типу обратной связи ser A-аллель.
Предлагаемые согласно изобретению штаммы также можно получать таким образом, что в триптофан-ауксотрофных исходных штаммах восстанавливают способность синтезировать триптофан, причем реконструированный метаболизм триптофана разрегулирован, и в такие штаммы вводят устойчивый к регуляции по типу обратной связи ser A-аллель.
Разрегулирование метаболизма триптофана в микроорганизмах возможно за счет ряда различных способов, которые известны из уровня техники.
Возможностью разрегулирования метаболизма триптофана является изменение фермента антранилатсинтазы. Этот фермент во всех микроорганизмах катализирует первую стадию специфического в отношении триптофана биосинтеза. Он подавляется в своей активности триптофаном и в зависимости от количества триптофана тем самым регулирует поток метаболитов за счет пути биосинтеза триптофана. Фермент кодируется trp E-геном.
Измененные trp E-гены, которые кодируют антранилатсинтазы с пониженной по сравнению с соответствующей антранилатсинтазой дикого типа чувствительностью по отношению к триптофану, в дальнейшем обозначаемые также как устойчивые к регуляции по типу обратной связи trpE-аллели, можно получать путем мутагенеза и последующей селекции триптофан-прототрофного исходного штамма. Для этой цели соответствующий штамм подвергают индуцирующей мутации обработке (Miller J.H. 1972, Expenments in Molecular Jentefics, Cold Spring Harbor Laboratory, США: 113-185).
Обработанный штамм выращивают на питательной среде, которая содержит по меньшей мере один антагонист триптофана в количестве, достаточном для подавления штамма в росте. Примерами пригодных антагонистов триптофана являются 4-метилитриптофан, 5-метилтриптофан, 6-метилтриптофан, галогенированные триптофаны, триптазан, индол, индолакриловая кислота.
Резистентные клоны испытывают на чувствительность к триптофану их антранилатсинтазы. Для определения чувствительности к триптофану антранилатсинтазы можно использовать любой метод, который позволяет определять активность этого фермента в присутствии триптофана. Например, хорисмат в пригодной буферной системе можно вводить во взаимодействие с его реакционным компонентом глутамином при ферментативном катализе (Bauerle R. и др., 1987, Methods in Eugymology. 142, 366-386). Из тест-смеси кинетически отбирают аликвоту и с помощью ВЭЖХ-анализа определяют образующееся во времени количество продукта реакции. Образующееся во времени (в единицу времени) количество антранилата является прямой мерой активности антранилатсинтазы. Тест осуществляют в присутствии и в отсутствие триптофана, чтобы определить чувствительность испытуемой антранилатсинтазы.
Также можно получать нечувствительные к триптофану trp E-аллели путем прямого способа генной инженерии (Bauerle R. и др., 1987, Mefhods in Engymology, 142, 366 - 386). Описано число мутаций в аминокислотной последовательности антранилатсинтазы различных организмов, которое приводит к пониженной чувствительности фермента по отношению к триптофану (например, для сальмонеллы; Caliguiri M. G. , Baucrle R., 1991, J.of Biol. Chem., 266, 8328 - 8335, для бревибактерии, коринебактерии: Mafsui k. и др., 1987, J.Bact., 169, 5330 - 5332).
Известны методы, которые позволяют проводить в ДНК-фрагменте, в специфическом сайте, мутацию. Такие методы описаны в следующих публикациях: Sakar G., Sommerauer S.S., 1990, Bio Techniques, 8, 404-407 описывают зависящий от реакции цепи полимеразы сайт-направленный мутагенез; Ausubel F.M. и др. 1987, Current Protocols in Molecular Biology, Greene Publishing Associates описывают зависящие от фага М13 методы; Smith M., 1985, Ann. Rev. Genet. 19 423 - 462 описывает другие методы.
ДНК-фрагмент, который охватывает trpE-ген дикого типа, рекомбинируется с помощью уже описанных стандартных способов для получения рекомбинантной ДНК на векторе. Благодаря применению вышеуказанных методов сайт-направленного мутагенеза один или несколько нуклеотидов ДНК-последовательности изменяют так, что кодированная теперь геном аминокислотная последовательность соответствует аминокислотной последовательности нечувствительной к триптофану антранилатсинтазы. С помощью описанных способов в любом trp E-гене можно проводить одну или несколько мутаций, которые способствуют тому, что кодированная антранилатсинтаза имеет приводящую к нечувствительности к триптофану аминокислотную последовательность.
Дополнительно желательны, но необязательны в предлагаемом согласно изобретению штамме следующие свойства: дефектный белок-репрессор триптофана, дефектный аттенуационный контроль экспрессии trp-оперона, дефектная триптофаназа. Эти свойства могут достигаться в предлагаемом согласно изобретению штамме проще всего путем выбора исходного штамма, который уже имеет одно или несколько соответствующих свойств. Получение или выбор можно осуществлять путем комбинации указанных далее методов селекции.
Белок-репрессор триптофана представляет собой высший регуляторный белок биосинтеза триптофана. Вместе с триптофаном в качестве апорепрессора этот белок репримирует экспрессию trp-оперон-генов. Белок кодирует геном trp R.
Мутанты-репрессоры триптофана можно выбирать, например, среди мутантов, которые резистентны против антагонистов триптофана, например, 5-метилтриптофан. Примеры описываются в J. Mol. Biol. 44, 1969, 185-193, или Genetics, 52, 1965, 1303-1316.
Наряду с контролем с помощью trp R-кодированного белка trp-оперон дополнительно подлежит аттенуационному контролю. Ответственным за регуляцию является ДНК-участок до первого гена trp-оперона. Мутации или делеции в этой области могут приводить к разрегулированию. Такие мутанты можно выбирать среди мутантов, которые резистентны к антагонистам триптофана, как 5-метилтриптофан. Между прочим, такие мутации, особенно делеции, получают тем, что благодаря способу сайт-направленного мутагенеза индуцируют это изменение сайт-специфически в аттенуационной области ДНК. За счет уже описанных способов сайт-специфического мутагенеза можно рекомбинировать инактивированную аттенуационную область в хромосоме предлагаемого в изобретении штамма на участке природной аттенуационной области.
Фермент триптофаназа (tna A) катализирует разложение триптофана на индол, пируват и NH3. Желательно, чтобы этот фермент был неактивен в штаммах продуцирования триптофана. Штаммы, которые дефектны в этом ферменте, можно получать таким образом, что организмы подвергают мутагенной обработке и среди мутантов ищут такие, которые более не в состоянии использовать триптофан в качестве источника углерода и азота. Подобный пример описывается в J. Bact. 85, 1965, 680-685. Альтернативно также можно с помощью вышеуказанных способов проводить сайт-специфические делеции в tnaA-гене, которые приводят к инактивации.
Ряд дополнительных мутаций исходного штамма пригоден для того, чтобы способствовать дальнейшему увеличению продуцирования триптофана. Так, наряду со способом биосинтеза триптофана дополнительно предпочтителен нечувствительный к регуляции общий путь биосинтеза ароматических аминокислот (способ через шикимовую кислоту). Поэтому штаммы, которые обладают нечувствительной к регуляции синтазой дегидроарабиногептулозоновой кислоты и белок-репрессор тирозина (tyr R) которых инактивирован за счет мутации штаммов для получения предлагаемых согласно изобретению штаммов. Также предпочтительны штаммы, метаболизм фенилаланина и тирозина которых нарушен. Благодаря этому обеспечивается исключительное превращение молекулы-предшественника хорисмата в триптофан. Такие штаммы имеют, например, мутации или делеции в генах phe A и/или tyr A.
Известен ряд штаммов, которые разрегулированы в одной или нескольких стадиях биосинтеза триптофана или в способе получения через шикимовую кислоту и перепродуцируют триптофан. Примерами являются Bacillus subtilis Ferm BP-4, Ferm P 1483 (патент ФРГ N 3123001); Brevi - bacterium flavum АТСС 21427 (патент США N 3849251); Corynebacterium glutamicum АТСС 21842-21851 (патент США N 3594279, патент США N 3849251); Micrococcus luteus АТСС 21102 (патент США N 3385762), E. coli АТСС 31743 (патент Канады N 1182409). Эти штаммы также пригодны в качестве исходных штаммов для получения предлагаемых согласно изобретению штаммов. Они показывают, что штаммы продуцирования триптофана согласно изобретению можно получать в самых различных группах организмов.
Наряду со штаммами с разрегулированным метаболизмом триптофана для получения предлагаемых согласно изобретению штаммов необходим по меньшей мере один ген, который кодирует фосфоглицератдегидрогеназу с пониженной по сравнению с соответствующей фосфоглицератдегидрогеназой дикого типа чувствительностью к серину.
Фосфоглицератдегидрогеназа (PGD) кодируется геном ser A. Последовательность ser A-гена дикого типа известна (Tobey K.L.,Grant G.A., 1986, J. Bac. 261, N 26, 1279-1283). Сверхэкспрессия продукта, вырабатываемого ser A-геном дикого типа, через плазмидный вектор также известна (Schuller и др., 1989, J. Biol. Chem, 264, 2645-2648).
Получение устойчивых к регуляции по типу обратной связи ser A-аллелей с помощью классических генетических способов описывается у Tosa T., Piger L.T. , 1971, J. Bac., 106 N 3, 972-982. При этом селекцию осуществляют через резистентность мутантов по отношению к аналогу серина - серингидроксамату. Мутации в этом литературном источнике подробнее не охарактеризовываются; влияние мутации на метаболизм не исследуется.
Устойчивые к регуляции по типу обратной связи ser A-аллели, например, также получают тем, что микроорганизмы подвергают мутагенезу. В качестве мутагенов принимают во внимание УФ-облучение и любые химические мутагены, как например этилметансульфонат или N-метил-N'-нитро-N-нитрозогуанидин. Дозировку и длительность экспозиции выбранного мутагена определяют обычным способом (Miller J.H., 1972, Experiments in molecular Genetics, Cold Spruig Harbor Laboratories, США, 113-143).
Обработанные мутагеном популяции организмов подвергают селекции на клоны с ser A-генами, которые кодируют нечувствительные к серину фосфоглицератдегидрогеназы. Например, обработанную мутагеном популяцию инкубируют на твердой среде культивирования, которая содержит серингидроксамат в достаточном количестве, чтобы подавлять рост нерезистентных бактерий. Резистентные клоны испытывают на чувствительность в серину их фосфоглицератдегидрогеназы. Например, вариант осуществления этого способа описывается у Tosa и Piger, 1972, J. Bact., 100, N 3, 972-982.
Аллели, которые кодируют нечувствительную к серину фосфоглицератдегидрогеназу, также можно получать с помощью способов генной инженерии.
Участок PGD, который способствует регуляции серина, находится в C-концевой области белка. Поэтому вставки, замещения или делеции отдельных или нескольких аминокислот предпочтительно осуществляют в 25% C-концевых аминокислот, PGD-белка, особенно предпочтительно в 50% C-концевых аминокислот PGD-белка. Это приводит к пониженной чувствительности PGD к серину.
Аллели, которые кодируют такие PGDs, получают тем, что изменяют 3'-область ser A-гена, который кодирует указанные C-концевые области PGD. Для этой цели неизмененный ser A-ген путем применения известных специалисту приемов для получения рекомбинантной ДНК, таких как рестрикция, лигирование и трансформация (Maniatis T., Fritsch E.F., и Sambrook J., Molecular Cloning; A Laboratory Manual, 1982, Cold Spring Harbor Laboratory), рекомбинируют на векторе клонирования. Специфические изменения в 3'-области структурного гена достигается, например, путем приемов сайт-направленного мутагенеза.
Примеры нечувствительных к серину PGDs, которые пригодны для экспрессии в микроорганизмах с разрегулированным метаболизмом триптофана, приводятся в табл. 1 в виде представленных их C-концевых аминокислотных последовательностей. Вплоть до представленной области белковые последовательности ферментов не отличаются от последовательностей дикого типа.
Для того чтобы испытывать генные продукты ser A-аллелей на PGD-активность и чувствительность к серину, применяют следующие тесты:
PGD-Активность определяют путем обнаружения прямой или обратной реакции фермента по методу Mckitrick J.C. и Lewis J.P., 1980, J.Bact., 141 235-245. Активность фермента при этом измеряется без серина и с различными концентрациями серина. Указанный тест пригоден для определения чувствительности к серину любой фосфоглицератдегидрогеназы. Также можно применять любой другой способ измерения PGD-активности.
В качестве меры чувствительности к серину фермента служит Ki-значение, т. е. концентрации серина, которые подавляют активность фермента на 50% Ki-значения и C-концевые аминокислотные последовательности некоторых устойчивых к регуляции по типу обратной связи ser A-аллелей, а также ser A-гена дикого типа (ser AWT) представлены в табл. 1.
Для получения предлагаемых согласно изобретению штаммов предпочтительно пригодны ser A-аллели с Ki-значением 100 μM - 50 мМ.
Для экспрессии PGD-белков в предлагаемом согласно изобретению штамме можно использовать любой рекомбинантный вектор, который приводит к экспрессии нечувствительного к серину ser A-аллеля. Пригодный для получения предлагаемых в изобретении штаммов рекомбинантный вектор охватывает по меньшей мере ser A-ген, который кодирует PGD, обладающую пониженной по сравнению с диким типом чувствительностью по отношению к серину, и долю вектора, который автономно реплицируется в реципиентном штамме.
Примеры векторов, которые автономно реплицируются в E.coli, указаны у Pouwels P.H., Enger - Ualk B.E., Brammer W.J., 1985, Cloning Vectors, Elsevier, Амстердам. Такими векторами являются:
плазмиды с высоким числом копий, например pBR 322, pUC12;
плазмиды со средним числом копий, например pACYC1184, 177;
плазмиды с низким числом копий, например pSC101,
векторы-фаги, например M13, λ -векторы.
Сравниваемые векторы описываются для большого числа бактерий (например, в европейском патенте N 0401735 для коринебактерий и бревибактерий или в C. A. 111 (1989) 168588g).
Предпочтительно пригодны векторы с числом копий от среднего до низкого; особенно предпочтительны векторы с p15A-репликоном, такие как pACYC184 (АТСС 37033) или pACICI77 (АТСС 37031).
Большое число векторов для других бактерий описано в литературе (Pouwels и др., 1985, Cloning Vectors Elsevier Science Publishers, Амстердам).
Пригодные рекомбинантные векторы можно получать с помощью стандартных способов для получения рекомбинантной ДНК. Эти способы подробно описаны, например, у Maniatis T., Fntsch E.F., и Sambrook H., 1982, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, США; или Ausubel F.M. и др., 1987, Current Protocols in Molecular Biology, Greene Publishing Associates, США.
Получение рекомбинантных векторов, например, возможно благодаря тому, что ДНК донорного организма, который имеет ser A-ллель в хромосоме или на рекомбинантном векторе, кодирующий нечувствительную к серину PGD, фрагментируют с помощью рестрикционных ферментов. Фрагментированную ДНК легируют с помощью обычных методов, например путем использования фермента Т4-ДНК-лигазы, с также переведенной в линейную форму с помощью рестрикционных ферментов векторной молекулой. Смесь после легирования используют для того, чтобы трансформировать реципиентные штаммы с разрегулированным метаболизмом триптофана известными способами, такими как кальцийхлоридный шок или электропорация. Векторы, которые содержат желательные ser A-аллели, могут получаться в реципиентных штаммах, например, благодаря вышеуказанным способам, например селекции на резистентность к антибиотикам или комплементирование ser A-мутаций.
В следующем варианте осуществления предлагаемых согласно изобретению штаммов ser A-аллели интегрируют в виде единичных копий в хромосомы. Это может достигаться, во-первых, благодаря тому, что вышеописанные стратегии в отношении мутагенеза и селекции осуществляют с помощью триптофанразрегулированного исходного штамма. Во-вторых, также можно ser A-аллели, которые находятся на рекомбинатных векторах, интегрировать в хромосому продуцируемого штамма. Число методов для такой интеграции известно. Описания этих способов (приемов) см. в следующих публикациях:
Интеграция через посредство Lambda - фагов: Balakrishnan и Backmann, 1998, Gene, 67, 97-103; Simons R.W. и др. 1987, Gene, 53, 85-89; rec D-зависимая замена гена: Shervell и др., 1987, J. Bact., 141,235-245; другие методы: Silhavy и др., 1988, Experiments with Gene Fusions, Cold Spring Harbor Laboratory.
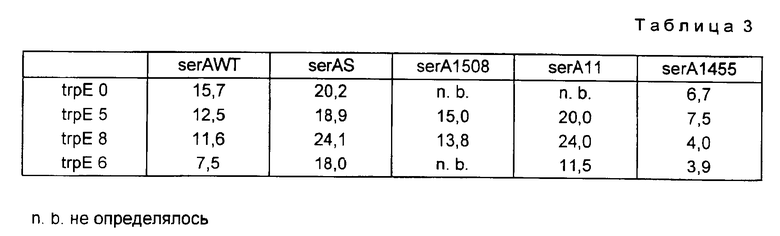
При ферментации предлагаемых согласно изобретению штаммов оказалось, что штаммы, содержащие устойчивый к регуляции по типу обратной связи ser A-аллель с Ki-значением для серина от 100 μM до 50 мМ и с разрегулированным метаболизмом триптофана и содержащие trp E-аллель с Ki-значением для триптофана 0,1 мМ - 20 мМ, дают самый высокий выход триптофана.
Пример 1. Скрининг устойчивых к регуляции по типу обратной связи trp E-аллелей и интеграция этих аллелей в хромосому.
Для поиска устойчивых к регуляции по типу обратной связи trpE-аллелей используют триптофан-аналог: 5-метилтриптофан. В качестве мутагенного агента служит N-метил-N'-нитро-N-нитрозо-гуанидин (NG). Используемым исходным штаммом является E. coli К12 УМС9 АТСС 33927. При осуществлении мутагенеза руководствуются указаниями Miller (Miller J.H., 1972, Experiments in Molecular Genetics, Cold Spring Harbor Laboratory, Cold Spring Harbor Нью-Йорк, 125-129).
Примерно 2•109 клеток УМС9 из экспоненциальной фазы роста культуры, выращиваемой в LB, помещенных в 4 мл 0,1 М натрийцитратного буфера с pH 5,5, инкубируют в течение 30 мин при 37oC с 50 мкг/мл NG. После двухкратной промывки с помощью 0,1 М фосфатного буфера с pH 7,0, 0,1 мл клеток выдерживают в течение ночи при 37oC при встряхивании в LB. Затем 0,1 мл клеток из различных разбавлений (10-3, 10-4, 10-5 в 0,9% NaCl) наносят на пластины с минимальной средой со 100 мкг/мл 5-метилтриптофана. Наряду с 5-метилтриптофаном минимальная среда содержит 5 г/л глюкозы; 5 мг/л витамина B1; 3 г/л KH2PO4; 12 г/л K2HPO4; 0,3 г/л MgSO4•7H2O; 0,1 г/л NaCl; 5 г/л (NH4)2SO4; 14,7 мг/л CaCl2•2H2O; 2 мг/л FeSO4•7H2O; 1 г/л Na3-цитрата и 15 г/л агара. Спустя 24 - 48 ч выдерживания при 37oC субкультивируются резистентные 5-метилтриптофану клоны и разъединяются на вышеуказанных пластинах.
Для характеристики полученных мутантов определяют Ki-значение для вырабатываемого trpE-геном продукта триптофана (Bauerle R. и др., 1987, Methods in Enzymology, 142, 366-386). При этом мутанты можно подразделять на два класса. Мутанты класса 1 включают устойчивые к регуляции по типу обратной связи антранилатсинтазы. Мутанты класса 2 включают ферменты с повышенной антранилатсинтаза-активностью при неизменном Ki-значении.
Для охарактеризования на молекулярном уровне соответствующие ДНК-области различных мутантов клонируют и секвенируют. Для этой цели соответствующую хромосомную ДНК изолируют и расщепляют в смеси с рестрикционными ферментами NheI и ClaI. Фрагменты величиной примерно 5 к.о. (тысяч пар оснований) изолируют и лигируют с размером 4158 п.о. (комплементарных пар гетероциклических оснований ДНК) NheI/ClaI - фрагментом pBR 322. Легированную смесь трансформируют в trpE-штамм E.cоli КВ 862 (DSM 7196). Селектируют на клоны, которые могут расти на минимальной среде без триптофана. Все комплементирующие плазмиды содержат величиной 5 к.о. Nhe I/Cla I-фрагмент. Наряду с trpE- и trpD-генами этот размером 5 к.о. NheI/ClaI-фрагмент содержит также ДНК-области, идущие вверх от trpE (примерно 0,8 к.о.) и вниз от trpD (примерно 1 к. о. ). В табл. 2 перечислены различия аминокислотных последовательностей и Ki-значения мутантов класса 1. В непредставленных областях последовательности мутантов совпадают с последовательностью дикого типа.
Анализ на секвенирование мутантов класса 2 показывает, что мутации имеют место либо в области оператора trp-промотора, либо в ДНК-области, которая кодирует trp-лидерный-пептид. Обозначаемые с помощью ΔtrpL1 и соответственно ΔtrpL2 мутации имеют 136 п.о. и соответственно 110 п.о. - делецию в ДНК-области, которая кодирует лидерный пептид. В случае ΔtrpL1 мутации делеция охватывает область от нуклеотидной позиции 33 вплоть до позиции 168, в случае ΔtrpL2 мутации - область от нуклеотидной позиции 11 до позиции 120 в хранящейся под AC-номером V 00372 в EMBL-банке данных последовательности.
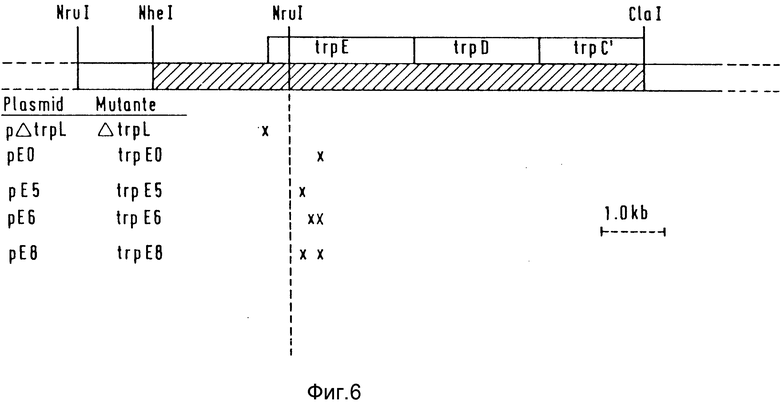
Для того чтобы достичь более сильной экспрессии устойчивых к регуляции по типу обратной связи trp E-аллелей, комбинируют оба класса мутантов. Для этой цели применяют мутацию ΔtrpL1 класса 2. На фиг. 6 схематически представлено положение Δtrp L1-мутации (класс 2) и мутаций trp E0, trp E5, trp E6 и trp E8 (класс 1).
Из плазмиды pΔtrPL (фиг. 6) выделяют размером 1,6 к.о. NruI-фрагмент, который несет ΔtrpLI-мутацию, и обменивают на соответствующий NruI-фрагмент дикого типа плазмид pE0, pE5, pE6, соответственно, pE8 (фиг. 6). Полученные плазмиды обозначают pIE0, pIE5, pIE6, соответственно pIE8 и применяют для хромосомной интеграции путем гомологичной рекомбинации. Для этой цели из указанных плазмид выделяют соответствующий, величиной примерно 5 к.о., хромосомный NheI / ClaI-фрагмент, такой как описанный в примере 2, из агарозы с низкой температурой плавления и трансформируют в линейной форме в recD - штамм PD 106 ( Δtrp LD 102). В качестве метода трансформации используют CaCl2-метод согласно Cohen и др. , 1972, Proc. Natl. Acad. Sci., USA 69, 2110-2114. Штамм PD 106 депонирован согласно будапештскому соглашению от 28.07.1992 в немецкой коллекции микроорганизмов (DSM) под номером 7195 (DSM 7195). Селекционируют на клоны, которые могут расти на минимальной среде без триптофана и чувствительны к ампициллину, т.е. свободны от плазмиды. Благодаря P1-трансдукции (Miller J.H., 1972, Experiments in Molecular Genetics. Cold Sping Harbor, Нью-Йорк, 201-205) trpE-аллели, которые кодируют различно устойчивые в регуляции по типу обратной связи trpE-ферменты и, смотря по обстоятельствам, скомбинированы с ΔtrpLI-мутацией, из соответствующих штаммов переводятся в KB 862. Штамм KB 862, согласно будапештскому соглашению от 28.07.1992 г. , депонирован в немецкой коллекции микроорганизмов (DSM) под номером 7196 (DSM 7196). Селекцию осуществляют при выращивании на свободной от тритофана минимальной среде. Полученные штаммы обозначают как PD 103 (trp E0), KB 862 (trp E5), SV 164 (trp E8) и SV 163 (trp E6).
Пример 2. Получение ser A-генов, которые кодируют нечувствительные к серину фосфоглицератдегидрогеназы.
ser A-Ген дикого типа из E.Coli - штамма E.coli B (ATCC 23226) клонируют на плазмидном векторе pUC 18.
Для того чтобы получить хромосомную ДНК этого штамма, его выращивают в течение ночи при 37oC в питательной среде Луриа. Клетки бактерий собирают путем центрифугирования (4000 g). Лизис клеток и очистку ДНК осуществляют согласно протоколу, описанному Ausubel и др., 1987, 2.4.1 - 2.4.2, Current Protocols in Molecular Biology, Greene Publishing Associates. Полученное количество ДНК определяют спектрофотометрически при длине волны 260 нм. Выходы составляют 600 мкг/100 мл.
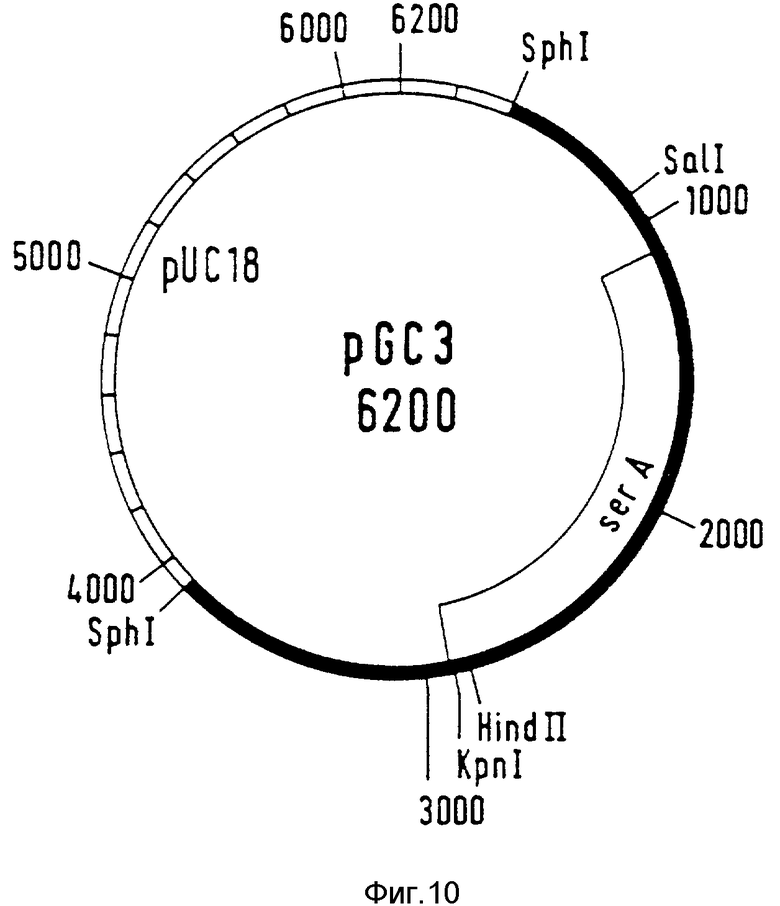
10 мкг Хромосомной ДНК расщепляют с помощью рестрикционного фермента SphI (Boehringer Mannheim GmbH) при указанных изготовителем условиях. Примерно 3 мкг смеси фрагментов лигируют с 0,2 мкг также SphI-разрезанного автономного реплицируемого плазмидного вектора pUC18 (фирма Boehringer Mannheim GmbH) за счет фермента T4-лигазы (фирма Boehringer Mannheim GmbH) при предписанных изготовителем условиях. Лигированную смесь используют для того, чтобы трансформировать ser A-мутанты PC 1523 (CGSC # : 5411) (CGSC E.coli Genetic Stock Centre, Department of Biology 255 OML, Jale University, Postbox 6666, New Haven, CT, USA). В качестве способа трансформации применяют CaCl2-метод Cohen и др., 1972, Proc. Natl. Acad. Sci., США, 69, 2110-2114. Трансформированные бактерии высевают на минимальную среду без серина. Клоны, которые растут без серина, содержат ser A-ген из E.coli на 3,5 к.о. SphI-фрагмента. Последовательность дикого типа Ser A-гена воспроизведена на фиг. 7-9 (SEQ ID N 13; SEQ ID N 14). Рекомбинантный вектор с ser A-геном обозначен как pGC3 (фиг. 10).
ser A-Аллель ser A5 получают тем, что плазмиду pGC3 разрезают с помощью рестрикционных ферментов SalI и KpnI (фирма Bochringer Mannhein GmbH), согласно указаниям изготовителя. Полученные фрагменты разделяют путем электрофореза на геле агарозы. SalI - KpnI-Фрагмент величиной 2,0 к.о., который содержит полный ser A-ген вплоть до 8 C-концевого кодона, выделяют очищенным из геля. Для этой цели проводят электрофорез на "низкоплавкой" агарозе (фирма Boehringer Mannheim GmbH) так, что ДНК можно извлечь путем простого расплавления агарозы. 0,2 мкг этого фрагмента лигируют с эквимолекулярными количествами HindIII / SalI - разрезанного pUC18 и синтетически полученного двунитевого олигонуклеотида с помощью T4-лигазы (фирма Boehringer Mannheim GmbH) согласно указаниям изготовителя. Нуклеотидная последовательность этого олигонуклеотида следующая:
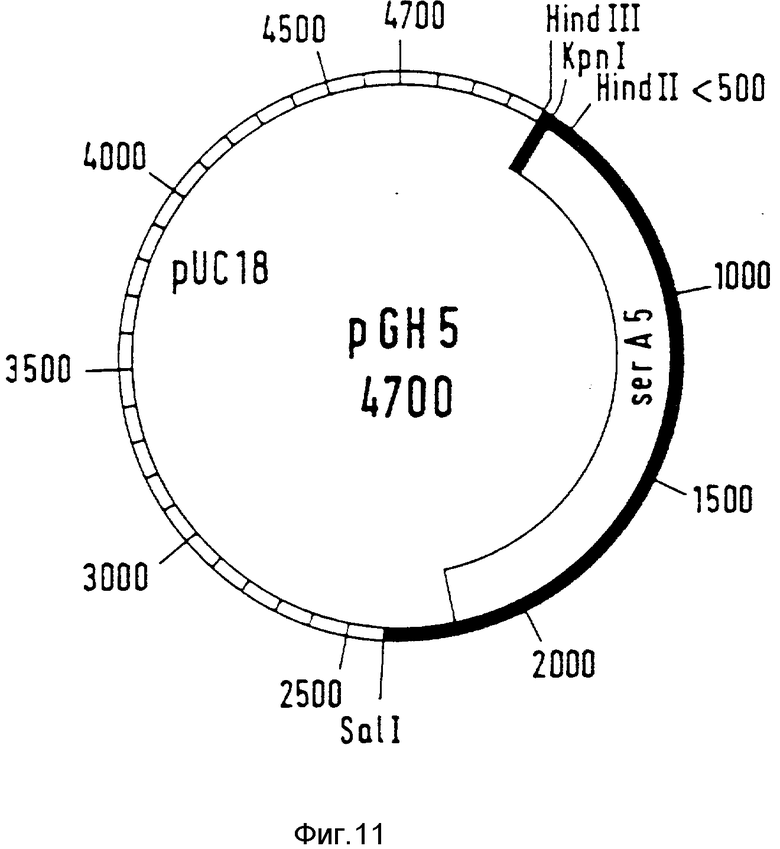
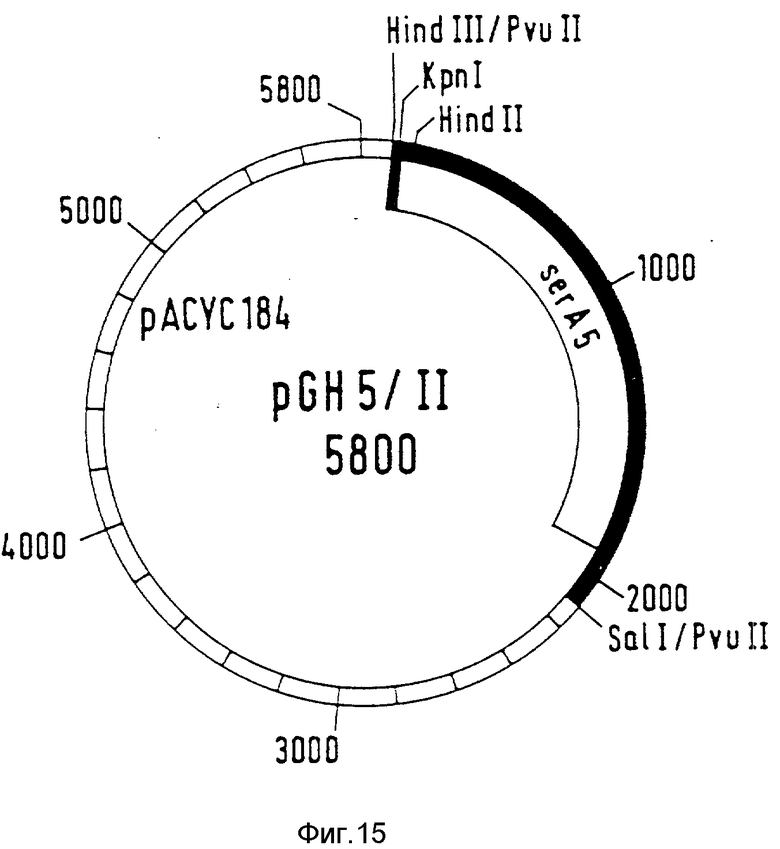
Этот олигонуклеотид дополняет 7 и 8 последних C-концевых кодонов ser A-генов. Вместо восьмого кодона вводится Stop-триплет TAA. Кодированная с помощью этого ser A-гена фосфоглицератдегидрогеназа таким образом сокращается на одну C-концевую аминокислоту. Аминокислотная последовательность измененной PGD представлена в табл. 1 (ser A5). Рекомбинантная плазмида обозначается как pGH5 (фиг. 11). С помощью лигированной смеси трансформируют ser A-мутанты PCI523.
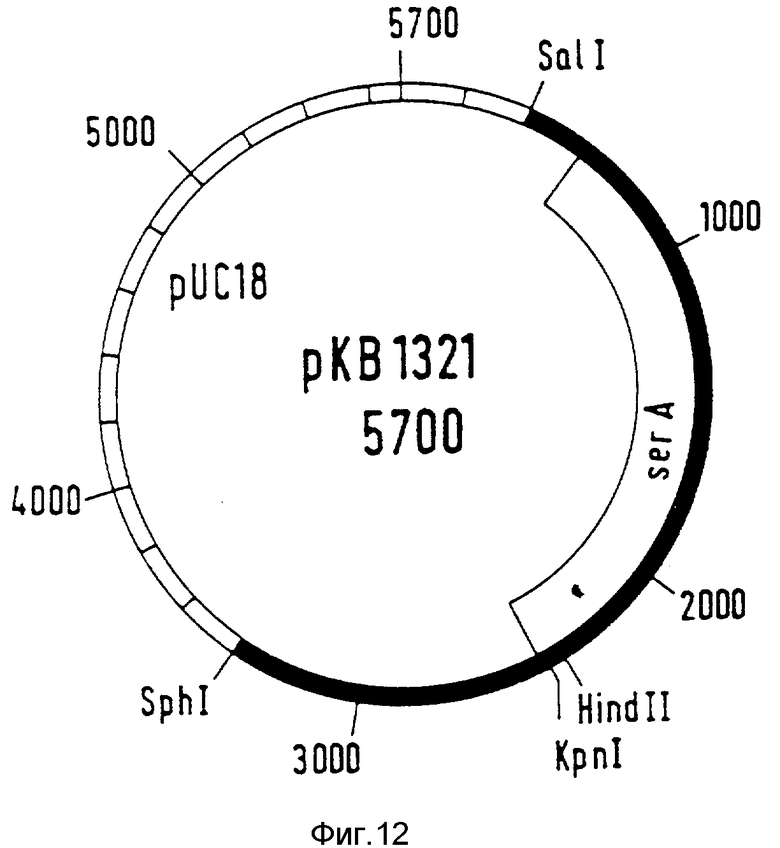
ser A-Аллель ser AI508 получают следующим образом. Плазмиду pGC3 разрезают с помощью SphI / SalI (фирма Boehringer Mannhein GmbH) согласно указаниям изготовителя. Фрагмент величиной 3 к.о., который несет полный ser A-ген, очищают электрофоретически и лигируют с разрезанным с помощью SphI / SalI вектором pUC 18. Полученная в результате плазмида обозначается как pKBI321 (фиг. 12).
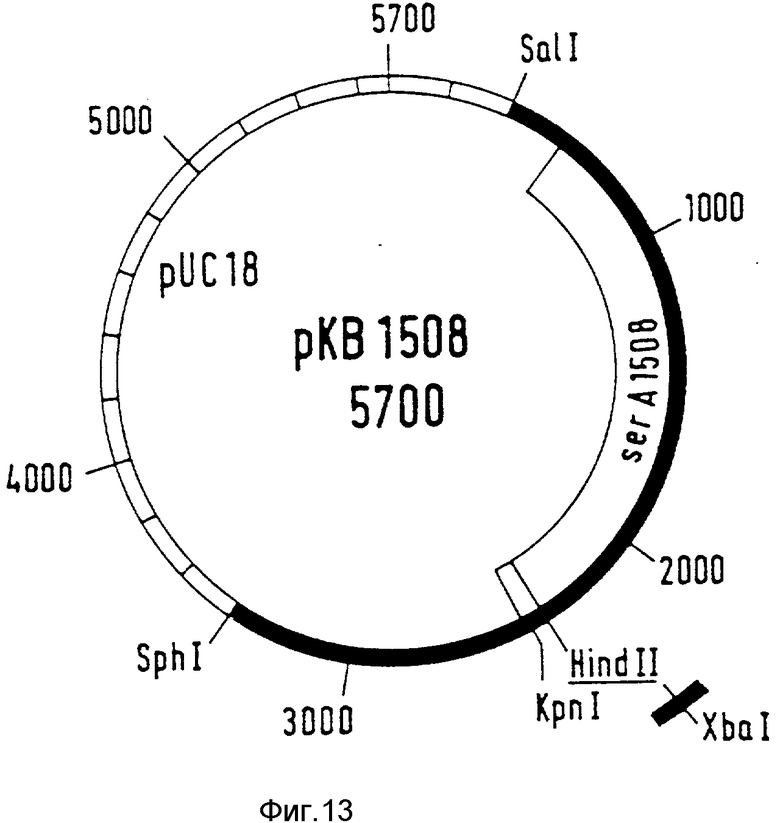
pKB1321 с рестрикционной эндонуклеазой Hind II (фирма Boehringer Mannheim GmbH) инкубируют в условиях, которые позволяют осуществлять только частичное разрезание (0,05 ед. фермента на 1 мкг ДНК в течение 10 мин, остальные реакционные условия согласно указаниям изготовителя). Благодаря этому образуется фракция фрагментов, которая разрезана в позиции 1793 ser A-гена с помощью Hind II. В этот сайт путем лигирования вводят ДНК-линкер с XbaI-сайтом. Последовательность ДНК-линкера следующая:
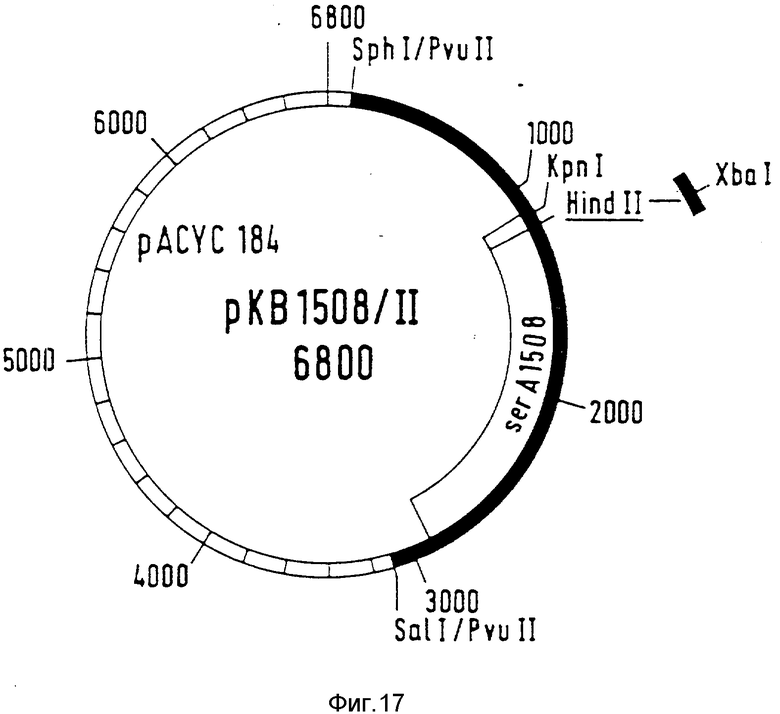
Вставка приводит к PGD, которая на этом участке содержит 4 дополнительные аминокислоты. Ее последовательность представлена в табл. 1. Плазмида со вставкой обозначается как pKB1508 (фиг. 13). Ее трансформируют в ser A-мутант PC1523.
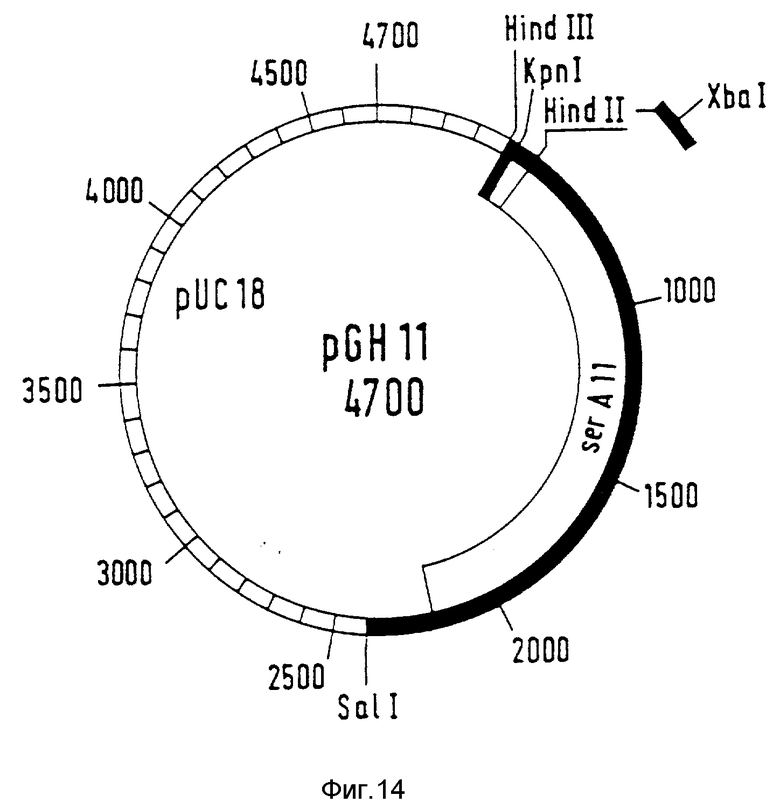
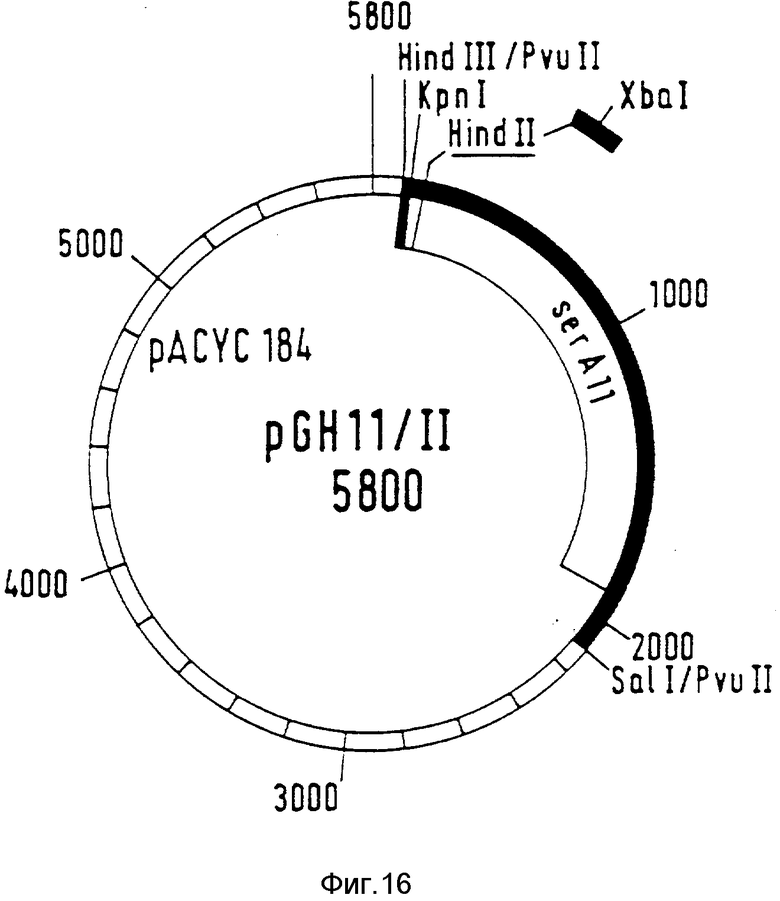
ser А-Аллель ser A II получают тем, что плазмиду pGH5 разрезают с помощью SalI и kpnI (фирма Boenringer Mannheim GmbH) согласно указаниям изготовителя и фрагмент размером 2,8 к.о. из смеси фрагментов выделяют очищенным после гель-электрофореза из "низкоплавкой" агарозы. Этот фрагмент содержит векторную часть из pUC18 и C-концевую область ser A5. Плазмиду pKB 1508 также разрезают с помощью SalI /kpnI. ДНК-фрагмент величиной 2,0 к.о. элюируют из низкоплавящегося геля агарозы. Этот фрагмент содержит ser A-аллель ser A 1508 с инсерционной мутацией, однако отсутствуют 8 C-концевых кодонов. Оба фрагмента лигируют друг с другом и таким образом трансформируют ser A-мутанты PC 1523. Полученную в результате рекомбинантную плазмиду обозначают как pGH11 (фиг. 14). Кодированная фосфоглицератдегидрогеназа объединяет инсерционную мутацию ser A 1508 с делеционной мутацией ser A5. Область с мутациями в кодированной аминокислотной последовательности представлена в табл. 1.
Для экспрессии измененных ser A-аллелей в продуцирующих штаммах их переклонируют в векторе pACVC (АТСС 37033), векторе со средним числом копий. Для этой цели плазмиду pGH5 и плазмиду pGH11 разрезают с помощью SalI / Hind III и, смотря по обстоятельствам, величиной примерно 2 к.о., содержащие ser A-аллели ser A5 и ser A1 ДНК-фрагменты выделяют из "низкоплавких" гелей агарозы. Фрагменты в разделенных смесях обрабатывают фрагментом Кленова ДНК-полимеразы-1 из E.coli (фирмы Boehringer Mannheim GmbH) согласно предписанию изготовителя, чтобы 5'-выступающие концы среза рестрикционных ферментов перевести в ровные концы. Для этой цели 1 мкг соответствующего фрагмента в 20 мкл реакционной смеси смешивают с 5 ед. фермента Кленова, 0,5 мМ dATP, dGTP, dTTP и dCTP рекомендуемым изготовителем буфером и инкубируют в течение 15 мин при 30oC.
С ровными концами ДНК-фрагменты лигируют, смотря по обстоятельствам, с разрезанным с помощью PvuII вектором pACIC 184. Лигированные смеси используют для трансформации ser A-мутантов PC 1523. Комплементирующие плазмиды получили названия pGH5/11, соответственно pGH 11/11 (фиг. 15, 16). Плазмиду pKB 1508 разрезают с помощью SalI / SphI. Фрагмент величиной 3 к.о., который содержит ser A-аллель ser A 1508, очищают путем гель-электрофореза. Фрагмент, который, как описано выше, становится ровным на концах, лигируют с разрезанным с помощью PvuII вектором pACYC 184, и лигированную смесь трансформируют в E. coli PC 1523. Комплементирующие плазмиды получили названия pKB 1508/11 (фиг. 17).
Плазмиды pGH5/11 (ser A5), pGH11/11 (ser A11) и pKB 1508/11 используют для трансформации штаммов PD 103 (tr pE0), KB 862 (tr pE5) SV 164 (tr pE8), SV 163 (tr pE6).
Пример 3. Конструирование хромосомного, устойчивого к регуляции по типу обратной связи ser A5-аллеля с помощью рекомбинантного λ-профага.
Для интеграции в хромосомный Lambda - "сайт связывания" (att λ) ser A5-аллель клонируют в плазмиде pRS 551 (Simons и др., 1987, Gene 53, 85 - 96). Для этой цели величиной примерно 2 к.о. ser A5-несущий Hind III / SalI-фрагмент выделяют из плазмиды pGH5. 5'-Выступающие концы дополняют с помощью фрагмента Кленова ДНК-полимеразы 1 (фирма Boehringer Mannheim GmbH) согласно указаниям изготовителя и после присоединения EcoRI-линкеров (Maniatis и др., 1982, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, Нью-Йорк, с. 396 - 397), размером 2 к.о. фрагмент лигируют с расщеплением с помощью EcoRI вектором pR S551. Рекомбинантную плазмиду выбирают и обозначают как pRS5.
Путем приготовления лизата по методу агаровых слоев на несущем pRS5 rec A+-штамме (например, Y MC9 АТСС 33927) с λRS45-фагом получают ин виво, путем гомологичной рекомбинации, гетерогенный λ-лизат, который наряду с λRS45-фагом содержит также рекомбинантные, ser A5-несущие λ RS45-производные (Simons и др., 1987, Gene, 53, 85 - 96).
Для селекции на рекомбинантных λRS45-производных применяют ser A-штамм PC 1523 (CGSC # : 5421). Для этой цели PC1523 инфицируют с помощью гетерогенного λ-лизата (см. выше) и затем пассируют на содержащих канамицин (25 мг/л) LB-планшетах. Полученные лизогенные, резистентные к канамицину клоны затем испытывают на их способность расти на планшетах с минимальной средой без серина. Серин-прототрофный клон выбирают и применяют для получения гомогенного ser A5-лизата (путем УФ-индукции; Simons и др., 1987, Gene, 53, 85 - 96).
С помощью этого гомогенного ser A5-λ-лизата инфицируют продуцирующий триптофан штамм. Полученный штамм SV164 att λ :: ser A5, ферментируют, как описано в примере 4. Соответствующие среды вместо тетрациклина в качестве агента селекции содержат, смотря по обстоятельствам, 25 мг/л канамицина.
Выходы триптофана составляют 12,5 г/л по сравнению с 3,5 г/л при использовании такого же штамма, но без ser A5.
Пример 4. Продуцирование триптофана коринебактериями.
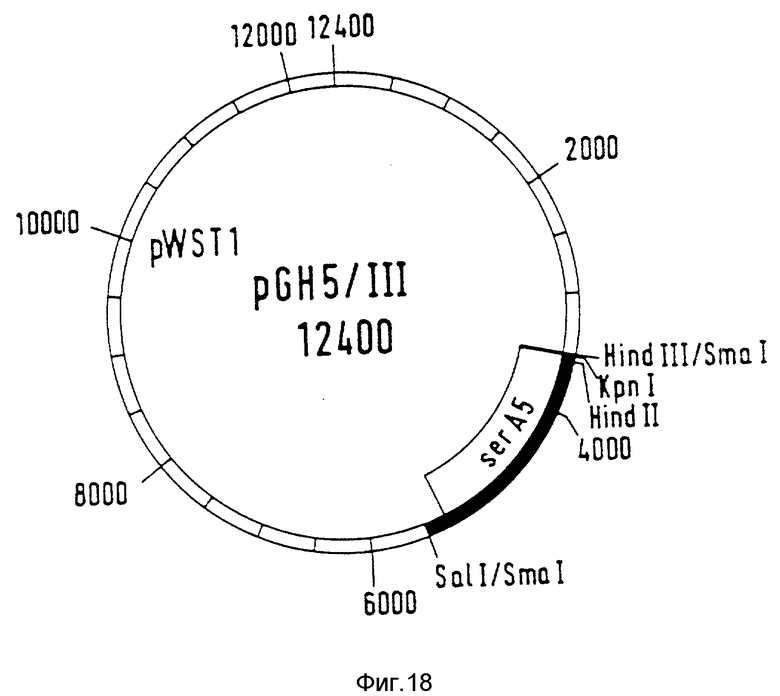
Плазмиду pGH5 разрезают с помощью рестрикционных ферментов SalI и Hind III (фирма Boehringer Mannheim GmbH) и величиной 2 к.о., содержащий ser A-ген ДНК-фрагмент выделяют из низкоплавкого геля агарозы. ДНК-фрагмент, как описано в примере 2, выравнивают на концах путем воздействия фрагмента Кленова ДНК-полимеразы 1 из E.coli (фирма Boehringer Mannheim GmbH). Вектор pWST1 разрезают с помощью рестрикционного фермента SmaI (фирма Boehringer) и лигируют с ровным на концах ДНК-фрагментом. Вектор pWSTI представляет собой челночный вектор E. coli /коринебактерии и может реплицироваться как в E. coli, так и также в коринебактериях. Коринебактериальный репликон этого вектора происходит из штамма Corinebacterium glutamicum АТСС 19223. Получение вектора pWSTI описано в патенте США N A-4 965197. Лигированную смесь используют для трансфоромации E. coli-штамма РС 1523. Комплементирующие плазмиды получили названия pGH5/III (рис. 18).
Плазмиду pGH5/III используют для трансформации продуцирующей триптофан Corynebacterium glutamicum АTСС 21851. Трансформация протекает через электропорацию согласно подробно описанному у Wolf H. и др., 1989, Appl. Microbiol. Biotechnol. , 30, 283-289 способу. Клоны, которые несут рекомбинантную плазмиду pGH5/III, селекционируют на агаровых пластинах с 25 мг/л канамицина по устойчивости к канамицину кодированной плазмидой.
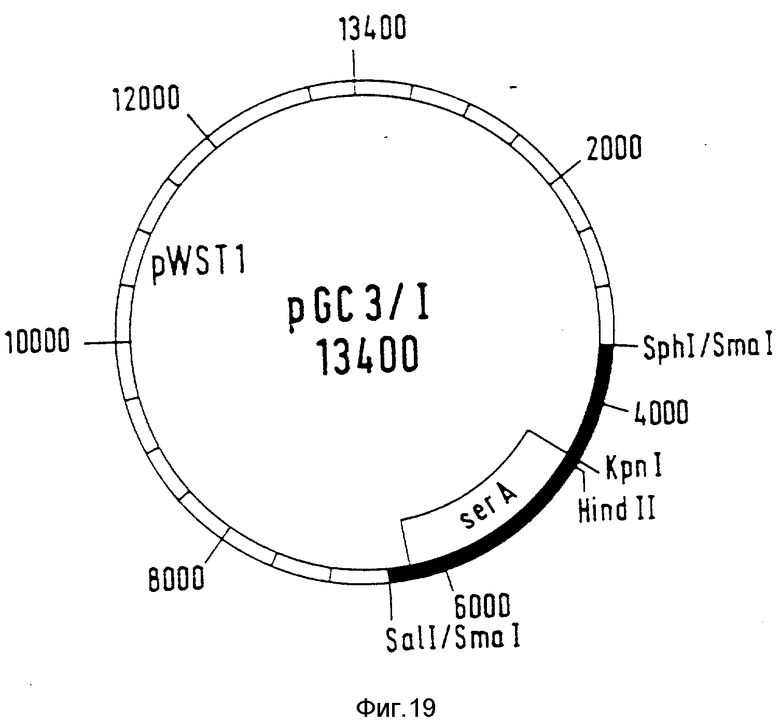
Плазмиду pGC3 разрезают с помощью рестрикционных ферментов SphI и SalI. Величиной 2 к.о. ДНК-фрагмент, который несет аллель ser A-дикого типа, очищают и лигируют вышеуказанным образом с вектором pWSTI. Полученный вектор pGC3/1 (фиг. 19) используют для трансформации Corynebacterium glutamicum АТСС 21851.
Аналогичным образом получают штамм Corynebacterium glutamicum АТСС 21581, который несет ser A-аллель 1455 на плазмиде.
При ферментации оказывается, что в случае штамма, который несет ser А5-аллель на плазмиде, достигаются самые высокие выходы триптофана.
Пример 5. Влияние различных, кодируемых плазмидой ser A-аллелей на продуцирование триптофана различными trp E-штаммами.
С помощью различных, представленных в табл. 3, продуцирующих триптофан штаммов, инфицируют внесенные в колбу Эрленмейера емкостью 100 мл и 10 мл LB-среды (1% триптона, 0,5% дрожжевого экстракта, 0,5% NaCl), которая смешана с 15 мг/л тетрациклина. После инкубации в течение 8 - 9 ч при встряхивании при 150 об./мин при 30oC соответствующие предкультуры переносят в 100 мл SMI-среды. SMI-среда содержит 5 г/л глюкозы; 3 г/л KH2PO4; 12 г/л K2HPO4; 0,1 г/л (NH4)2SO4; 0,3 г/л MgSO4 • 7H2O; 15 мг/л CaCl2 • 2 H2O; 2 мг/л FeSO4 • 7 H2O; 1 г/л Na3 цитрата • 2 H2O; 1 мл/л раствора микроэлементов (см. ниже); 40 мг/л L-фенилаланина; 40 мг/л L-тирозина; 5 мг/л витамина B1 и 15 мг/л тетрациклина. Раствор микроэлементов составляется из 0,15 г/л Na2MoO4 • 2 H2O; 2,5 г/л H3BO3; 0,7 г/л CoCl2 • 6H2O; 0,25 г/л CuSO4 • 5 H2O; 1,6 г/л MnCl2 • 4 H2O и 0,3 г/л ZnSO4 • 7 H2O. Культуры встряхивают в колбах Эрленмейера емкостью 1 л при 30oC в течение 12-16 ч при скорости 150 об./мин. После этой инкубации OD600 составляет 2-4. Дальнейшую ферментацию осуществляют в ферментерах BIOSTAT®M фирмы Braun-Melsungen. Используют емкость для культивирования общим объемом 2 л.
Среда содержит 17,5 г/л глюкозы; 5 г/л (NH4)2SO4; 0,5 г/л NaCl; 0,3 г/л MgSO4 • 7 H2O; 15 мг/л CaCl2 • 2 H2O; 75 мг/л FeSO4 • 7H2O; 1 г/л Na3 цитрат • 2H2O; 1,5 г/л KH2PO4, 1 мл раствора микроэлементов (см. выше); 5 мг/л витамина B1 (тиамин); 0,75 г/л L-фенилаланина; 0,75 г/л L-тирозина; 2,5 г/л дрожжевого экстракта (Difco); 2,5 г/л триптона (Difco) и 20 мг/л тетрациклина.
Концентрацию глюкозы в ферментере устанавливают путем закачки 700 г/л (вес/объем) раствора глюкозы (автоклавирован), при 17,5 г/л. Перед инокуляцией в ферментационную среду добавляют тетрациклин вплоть до конечной концентрации 20 мг/л. Далее устанавливают pH-значение 6,7 путем закачки 25%-ного раствора NH4OH.
В емкость ферментера закачивают 100 мл предкультуры для инокуляции. Начальный объем составляет примерно 1 л. Культуры сначала перемешивают со скоростью мешалки 400 об./мин и пропускают 1,5 м3 стерилизованного через стерильный фильтр сжатого воздуха. Ферментацию проводят при температуре 30oC.
pH-Значение поддерживают равным 6,7 за счет автоматической поправки с помощью 25%-ного раствора NH4OH. Насыщение кислородом в культуральной жидкости ни в один момент времени ферментации не должно падать ниже 20%. Насыщение кислородом при ферментации контролируют за счет скорости мешалки.
Через двух-, трехчасовой интервал определяют содержание глюкозы в питательном растворе, оптическую плотность и выход триптофана. Определение содержания глюкозы осуществляют ферментативно с помощью анализатора глюкозы фирмы YSI. Концентрацию глюкозы устанавливают при 5 - 20 г/л за счет непрерывной добавки.
Содержание триптофана в среде после ферментации определяют с помощью ВЭЖХ. Среду разделяют на нуклеосил 100-7/C8 (250/4 мм; Macherey-Nagel). Колонка работает в изократическом режиме со скоростью истечения 2 мл/мин. В качестве элюирующего средства используют смесь воды с ацетонитрилом (83 : 17), к которой добавляют 0,1 мл H3PO4 (85%-ной) на литр. Детектируют либо с помощью диодного детектора (Diodenarraydetektor), либо при установленной длине волны 215, соответственно 275 нм. Спустя 44-50 ч ферментацию прерывают. Продуцированные количества триптофана в г/л при этой ферментации спустя 48 ч представлены в табл. 3.
Выход триптофана при различных комбинациях ser A/trp E см. в табл. 3.
Протокол секвенирования.
(2) Информация к SEQ ID N 1
(I) Характеристика последовательности:
(А) длина: 52 аминокислоты
(B) род: аминокислота
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: C-концевой
(VI) Первоначальное происхождение
(А) организм: Escherichia coli
(В) штамм: В
(VII) Непосредственное происхождение:
(В) клон: pGC3
(XI) Описание последовательности: SEQ ID N 1:
(2) Информация к SED ID N 2
(I) Характеристика последовательности:
(А) длина: 51 аминокислота
(В) род: аминокислота
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: C-концевой
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(B) штамм: В
(VII) Непосредственное происхождение:
(В) клон: pGH5
(XI) Описание последовательности: SED ID N 2:
(2) Информация к SEQ ID N 3
(I) Характеристика последовательности:
(А) длина: 56 аминокислот
(B) род: аминокислота
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: С-концевой
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(В) штамм: В
(VII) Непосредственное происхождение:
(В) клон: pKB 1508
(XI) Описание последовательности SEQ ID N 3:
(2) Информация к SEQ ID N 4
(I) Характеристика последовательности:
(А) длина : 55 аминокислот
(B) род : аминокислота
(C) форма нити : однонитевая
(D) топология : линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: С-концевой
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(В) штамм : В
(VII) Непосредственное происхождение:
(В) клон: pGH II
(XI) Описание последовательности SEQ ID N 4:
(2) Информация к SEQ ID N 5
(I) Характеристика последовательности:
(А) длина : 47 аминокислот
(B) род : аминокислота
(C) форма нити : однонитевая
(D) топология : линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: С-концевой
(VI) Первоначальное происхождение:
(А) организм : Escherchia coli
(B) штамм: В
(VII) Непосредственное происхождение:
(В) клон: pKB 1455
(XI) Описание последовательности SEQ ID N 5: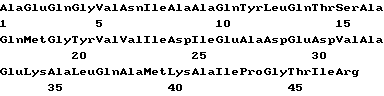
(2) Информация к SEQ ID N 6
(I) Характеристика последовательности:
(А) длина: 32 аминокислоты
(B) род: аминокислота
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: внутренний
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(B) штамм: Y MC9
(XI) Описание последовательности SEQ ID N 6: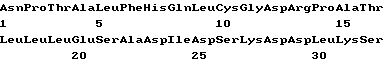
(2) Информация к SEQ ID N 7
(I) Характеристика последовательности:
(А) длина: 32 аминокислоты
(B) род: аминокислоты
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(III) Антисмысловая: нет
(V) Род фрагмента: внутренний
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(В) штамм: PD 103
(XI) Описание последовательности SEQ ID N 7: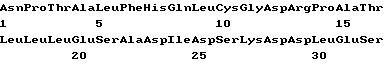
(2) Информация к SEQ ID N 8
(I) Характеристика последовательности:
(А) длина: 32 аминокислоты
(B) род: аминокислота
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: внутренний
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(B) штамм: КВ 862
(XI) Описание последовательности SED ID N 8: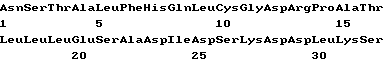
(2) Информация к SEQ JD N 9
(I) Характеристика последовательности:
(А) длина: 32 аминокислоты
(B) род: аминокислота
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: внутренний
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(B) штамм: SV 163
(XI) Описание последовательности SED ID N 9: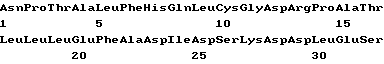
(2) Информация к SEQ ID N 10
(I)Характеристика последовательности:
(А) длина: 32 аминокислоты
(B) род: аминокислота
(C) форма нити: однонитевая
(D) топология: линейная
(II) Род молекулы: белок
(III) Гипотетичность: JA
(V) Род фрагмента: внутренний
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(B) штамм: SV 164
(XI) Описание последовательности SEQ JD N 10: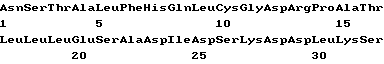
(2) Информация к SEQ ID N 11
(I) Характеристика последовательности:
(А) длина: 32 пары основания
(B) род: нуклеиновая кислота
(C) форма: двунитевая
(D) топология: линейная
(II) Род молекулы: DNS
(III) Гипотетичность: нет
(III) Антисмысловая: нет
(VI) Первоначальное происхождение:
(А) организм: синтетизированный ин витро DNS-фрагмент
(XI) Описание последовательности SEQ ID N 11: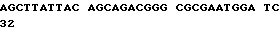
(2) Информация к SEQ ID N 12:
(I) Характеристика последовательности:
(А) длина : 12 пар оснований
(B) род: нуклеиновая кислота
(C) форма: двунитевая
(D) топология: линейная
(II) Род молекулы: DNS
(III) Гипотетичность: нет
(III) Антисмысловая: нет
(VI) Первоначальное происхождение:
(А) организм: синтезированный ин витро DNS-фрагмент
(XI) Описание последовательности SEQ ID N 12: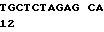
(2) Информация к SEQ ID N 13
(I) Характеристика последовательности:
(А) длина: 1233 пар оснований
(B) род: нуклеиновая кислота
(C) форма нити: двунитевая
(D) топология: линейная
(II) Род молекулы: DNS (геномная)
(III) Предположительно: нет
(III) Антисмысловая: нет
(VI) Первоначальное происхождение:
(А) организм: Escherichia coli
(B) штамм: В
(IX) Признаки:
(А) название/ключ: CDS
(B) положение: 1..1233
(C) род обнаружения: экспериментальный
(D) прочие данные: стартовый кодон - 1, ЕС-число=1.1.1.95, продукт="D-3-фосфоглицератдегидрогеназа", доказательство - экспериментальное, ген = "ser A, стандартное название - "ser A", ссылка = (/1/).
(X) Опубликованная информация: Tobey K.L., Grant G.A. The Nucleotide sequence of the ser A gene of Escherichia coli and the amino acid sequence of the encoded protein, d-3-phosphoglycerate dehydrogenase. -J. Biol. Chem., 261, p. 12179 - 12183, 1986.
(XI) Описание последовательности SEQ ID N 13, 14 см. на фиг. 1 - 4.







Изобретение относится к микробиологии, а именно к способам получения микроорганизмов для продуцирования триптофана и способам продуцирования триптофана. Изобретение позволяет получить микроорганизмы с повышенной степенью продуцирования триптофана. В штамм микроорганизма вводят устойчивый к регуляции по типу обратной связи Ser A - аллель с величиной Ki для серина между 0,1 мМ и 50 мM. Полученный микроорганизм используют в качестве продуцента триптофана. 2 с.п. ф-лы, 19 ил., 3 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WO, заявка, 87/01130, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| SU, авторское свидетельство, 990814, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1998-05-20—Публикация
1993-09-23—Подача