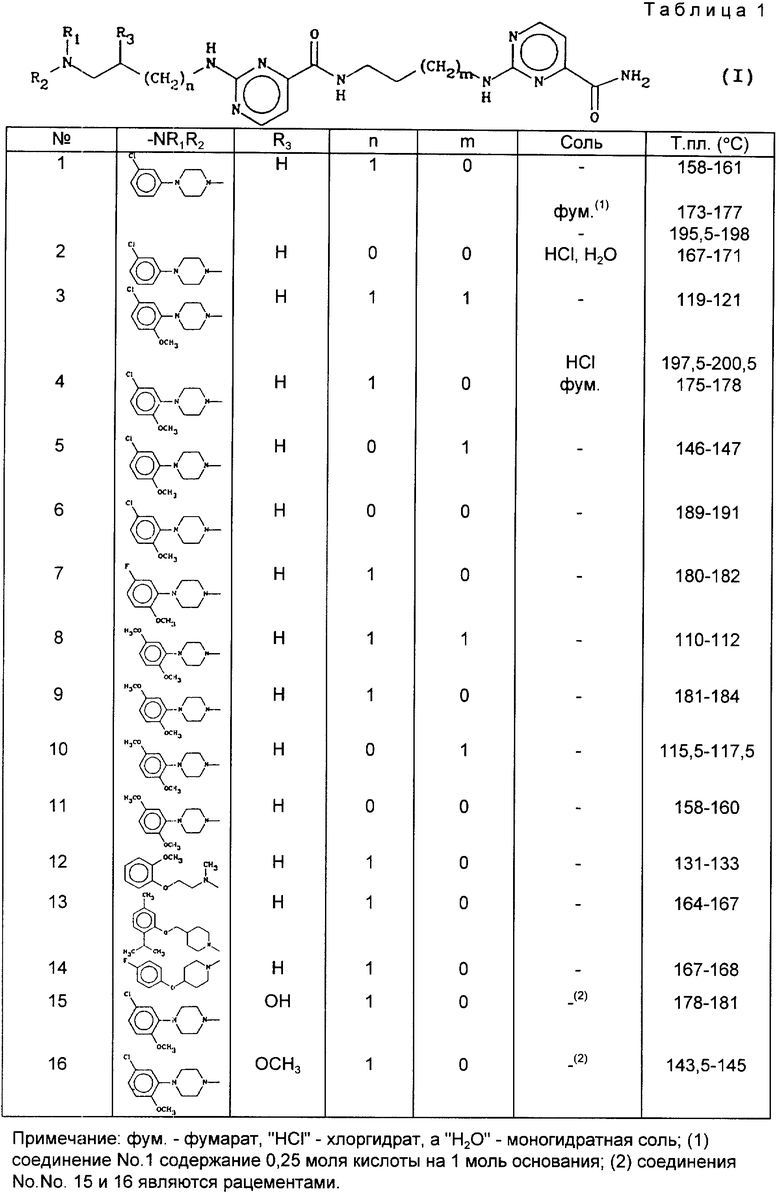
Настоящее изобретение относится к производным 2-амино-N-[[[4- аминокарбонил) пиримидин-2-ил] амино] алкил] пиримидина-карбоксамида, к способу их получения и к фармкомпозициям на их основе. Соединения изобретения отвечают общей формуле (I): ,
,
где
n = 0 или 1;
m = 0 или 1;
R1 - метильная группа;
R2 - фенокси(C1-C2)алкильная группа, где фенильное кольцо может быть замещено метоксигруппой; или R1R2N -4-фенилпиперазин-1-ил, где фенильная группа замещена 1 и 2 заместителями, выбранными из галогена или метоксигруппы; или R1R2N- 4- феноксипиперидин-1-ил, где фенильное кольцо замещено галогеном или метоксигруппой; или R1R2N- 4-феноксиметил- пиперидин-1-ил, где фенильное кольцо замещено двумя группами низшего алкила;
R3 - водород, и если n = 1, то R3 - гидрокси- или метокси- группа.
Соединения изобретения могут существовать в виде оснований или аддитивных солей с кислотами. Кроме того, если молекула содержит асимметричный атом углерода, соединение может существовать в оптически чистой форме или форме смеси оптических изомеров.
Известны производные 2-аминопиримидин-4-карбоксамида [1], обладающие фармацевтической активностью.
Известны также фармацевтически активные производные 2-аминопиримидин-4-карбоксамидов [2], которые наиболее близки по структуре к соединениям согласно изобретению и отвечают общей формуле: ,
,
где
m = 2 или 3;
n = 2 или 3;
R1 - атом водорода или метил;
X - атом галогена, водорода, низший алкокси, метил и 1-метилэтил.
Заявитель разработал новую группу производных 2-аминопиримидин-4-карбоксамидов, вышеуказанной формулы I, обладающих антагонистической активностью в отношении 1-адренергических рецепторов на уровне нижнего отдела мочевых органов.
Наиболее интересными с точки зрения активности являются производные общей формулы I, где R1R2N-4-фенилпиперазин-1-ил, где фенильная группа замещена 1 или 2 заместителями, выбранными из галогена или метоксигруппы.
Наиболее предпочтительными соединениями этой группы являются производные общей формулы I, где R1R2N- 4-(5-хлор-2-метоксифенил)пиперазин-1-ил, в частности, производное общей формулы I, представляющее собой N-[2-[[4- (аминокарбонил)пиримидин-2-ил] амино] этил] -2-[[3-[4- (5-хлор-2-метоксифенил)пиперазин-1-ил]пропил]амино] пиримидин-4-карбоксамид.
Изобретение относится также к способу получения производных 2- амино-N-[[[4-(аминокарбонил)пиримидин-2-ил] амино] алкил]пиримидин- 4-карбоксамида общей формулы I: ,
,
где
n = 0 или 1;
m = 0 или 1;
R1 = метил;
R2 = фенокси (C1-C2) алкил, где фенильное кольцо, может быть замещено метоксигруппой, или R1R2N - 4-фенилпиперазин-1-ил, где фенильная группа замещена 1 или 2 заместителями, выбранными из галогена или метоксигруппы; или R1R2N- 4-феноксипиперидин-1-ил, где фенильное кольцо замещено галогеном или метоксигруппой; или R1R2N- 4-феноксиметилпиперидин-1-ил, где фенильное кольцо замещено двумя группами низшего алкила;
R3 - водород, и если n = 1, то R3 - гидрокси- или метоксигруппа;
или их кислотноаддитивных солей,
заключающемуся в том, что амид общей формулы II: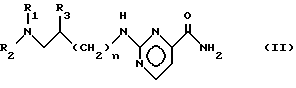 ,
,
где
R1, R2, R3 и n определены выше,
путем взаимодействия с алифатическим спиртом (C1-C4) в присутствии кислоты, и при температуре 0-100oC преобразуют в сложный эфир общей формулы III: ,
,
где
R' - алкил (C1-C4),
последний конденсируют с амином общей формулы IV : ,
,
где
R4 - атом водорода или защитная группа амина, m = 0 или 1,
процесс ведут в алифатическом спирте при температуре от 0 до 60oC и от полученного амина общей формулы V: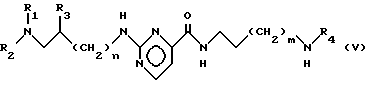 , в случае необходимости, отщепляют защитную группу амина и амин общей формулы V, где R4 = атом водорода, подвергают взаимодействию с 2-хлорпиримидин-4-карбоксамидом в апротонном растворителе в присутствии основания при температуре 20-40oC.
, в случае необходимости, отщепляют защитную группу амина и амин общей формулы V, где R4 = атом водорода, подвергают взаимодействию с 2-хлорпиримидин-4-карбоксамидом в апротонном растворителе в присутствии основания при температуре 20-40oC.
Производные 2-аминопиримидин-4-карбоксамида общей формулы (II) могут быть получены методами, аналогичными описанным в заявках на патенты FR-2678271 и EP-0480794.
Монозащищенные диамины общей формулы (IV) могут быть получены методами, аналогичными описанным в Synthesis (1984) 1032-1033 и Synthesis (1990) 366-368.
Следующие примеры иллюстрируют получение некоторых соединений в соответствии с изобретением. Элементарный микроанализ и спектры инфракрасного излучения и ядерного магнитного резонанса подтверждают структуры полученных соединений. Номера соединений, данные в скобках в названиях, соответствуют номерам, данным в таблице, приведенной ниже.
Пример 1 (Соединение 4)
Хлоргидрат N-[2-[[4-(аминокарбонил) пиримидин-2-ил] амино] этил]-2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил] пропил] амино] пиримидин-4-карбоксамида
1.1 2-[[3-[4-(5-Хлор-2-метоксифенил)пиперазин-1-ил]пропил] амино]пиримидин-4-карбоксилат метила
В колбу емкостью 0,5 л вводят 7,8 г (19,2 ммолей) 2-[[3-[4-(5- хлор-2-метоксифенил)пиперазин-1-ил] пропил]амино]пиримидин-4- карбоксамида в 300 мл метанола, затем пропускают газовый поток соляной кислоты в течение нескольких минут и нагревают смесь с обратным холодильником в течение 1 ч. 45 мин.
Выпаривают растворитель под уменьшенным давлением, к остатку добавляют 200 мл дихлорметана, затем охлаждают до 0oC. Смесь подщелачивают насыщенным водным раствором бикарбоната натрия. Органическую фазу высушивают на сульфате натрия, фильтруют, а затем выпаривают растворитель при пониженном давлении. Остаток очищают путем хроматографии на колонке силикагеля (элюант: смесь дихлорметан/метанол от 100/0 до 90/10), затем рекристаллизируют в циклогексане. Получают 5,84г (13,9 ммолей) сложного эфира. Точка плавления: 118,5-119oC.
1.2. [2-[[[2-[[3-[4-(5-Хлор-2-метоксифенил)пиперазин- 1-ил]пропил]амино] пиримидин-4-ил]карбонил]амино]этил] 1,1- диметилэтилкарбамат
В колбу емкостью 500 мл вводят 5,07 г (31,65 ммолей) (2- аминоэтил) 1,1-диметилэтилкарбамата, 10 г (23,8 ммолей) 2-[[3-[4-(5- хлор-2-метоксифенил)пиперазин-1-ил] пропил] амино] пиримидин-4- метилкарбоксилата в 50 мл пропан-2-ола, смесь нагревают с обратным холодильником в течение 14 ч. Растворитель выпаривают при пониженном давлении, остаток очищают путем хроматографии на колонке с силикагелем (элюант: дихлорметан/метанол от 100/0 до 90/10) для получения 10,77 г (19,65 ммолей) целевого соединения в виде масла, которое используется в данной форме на следующем этапе.
1.3. N-(2-аминоэтил)-2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил] пропил]амино]пиримидин-4-карбоксамид
В колбу емкостью 0,5 л вводят 10,77 г (19,65 ммолей) соединения [2-[[[2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил] пропил]амино] пиримидин-4-ил] карбонил] амино] этил] 1,1-диметил- этилкарбамата в 50 мл воды, затем прикапывают 25 мл концентрированной соляной кислоты. Смесь охлаждают до 0oC смесью лед/соль/вода, затем добавляют порциями 30%-й едкий натр до щелочного pH. Экстрагируют дихлорметаном, высушивают органическую фазу на сульфате натрия, фильтруют и выпаривают растворители при пониженном давлении и получают 8,8 г (19,65 ммолей) целевого соединения в виде масла, которое используют в данной форме на следующем этапе.
1.4. Хлоргидрат N-[2[[4-(аминокарбонил)пиримидин-2-ил] амино]этил]-2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил] пропил] амино] пиримидин-4-карбоксамида
В колбу емкостью 0,5 л в атмосфере аргона вводят 8,8 г (19,65 ммолей) N-(2-аминоэтил)-2-[[3-[4-(5-хлор-2-метоксифенил) пиперазин-1-ил] пропил] амино] пиримидин-4-карбоксамида, 3,1г (19,7 ммолей) 2-хлорпиримидин-4-карбоксамида, 4,0 г (29 ммолей) карбоната калия в 250 мл ацетонитрила нагревают с обратным холодильником в течение 18 ч. Смесь охлаждают до комнатной температуры, нерастворимый остаток отфильтровывают, затем промывают его водой. Растворяют полученный продукт в смеси дихлорметан/метанол, затем очищают его путем хроматографии на колонке с силикагелем (элюант: дихлорметан/метанол от 100/0 до 85/15). После рекристаллизации в смеси ацетонитрила и дихлорметана получают 7,03 г (12,35 ммолей) целевого соединения в виде основания. Точка плавления: 196-199oC.
Для получения хлоргидрата растворяют его в количестве 3,03 г (5,32 ммолей) в смеси 50 мл дихлорметана и 50 мл метанола, добавляют 53,2 мл 0,1Н соляной кислоты в пропан-2-оле.
Выпаривают растворители при пониженном давлении и остаток рекристаллизуют в смеси метанола и этилацетата. В результате получают 2,63 г хлоргидрата. Точка плавления: 197,5-200,5oC.
Пример 2 (Соединение 11)
N-[2[[4-(аминокарбонил)пиримидин-2-ил] амино] этил]-2-[[2- [4-(2,5-диметоксифенил)пиперазин-1-ил]этил]амино]пиримидин-4- карбоксамид
2.1. 2-[[2-[4-(2,5-Диметоксифенил)пиперазин-1-ил] этил] амино]пиримидин-4-метилкарбоксамид.
В колбу емкостью 1 л вводят 8,76 г (22,66 ммолей) 2-[[2-[4-(2,5- диметоксифенил)пиперазин-1-ил]этил]амино]пиримидин-4-карбоксамида в 650 мл метанола, затем пропускают газовый поток соляной кислоты в течение нескольких минут и нагревают смесь с обратным холодильником в течение 5 ч. Выпаривают растворитель при пониженном давлении, к остатку добавляют 300 мл дихлорметана, затем подщелачивают смесь насыщенным водным раствором бикарбоната натрия. Органическую фазу высушивают на сульфате натрия, фильтруют, затем выпаривают растворитель при пониженном давлении. После очищения путем хроматографии на колонке с силикагелем (элюант: смесь дихлорметан/метанол - от 100/0 до 90/10), затем рекристаллизуют в циклогексане, получают 6,93 г (17,26 ммолей) сложного эфира. Точка плавления: 85,5-87oC.
2.2 N-(2-аминоэтил)-2-[[2-[4-(2,5-диметоксифенил)пиперазин-1-ил] этил] амино]пиримидин-4-карбоксамид
В колбу емкостью 0,25 л вводят 1,5 г (3,74 ммоля) 2-[[2-[4-(2,5 диметоксифенил)пиперазин-1-ил] этил] амино] пиримидин- 4-метилкарбоксилата в 20 мл дихлорметана и 150 мл метанола, затем 3 мл этилендиамина (2,7 г, 44,9 ммоля). Смесь перемешивают в течение 4 ч. при комнатной температуре, затем выпаривают растворители при пониженном давлении. Неочищенный остаток растворяют в 150 мл дихлорметана, органическую фазу промывают пять раз водой. Высушивают на сульфате натрия, фильтруют и выпаривают растворитель при пониженном давлении и получают 1,6 г (3,74 ммоля) целевого продукта в виде масла, которое используют в данной форме на следующем этапе.
2.3. N-[2[[4-(аминокарбонил)пиримидин-2-ил]амино]этил]- 2-[[2-[4-(2,5-диметоксифенил)пиперазин-1-ил]этил]амино] пиримидин-4-карбоксамид
В колбу емкостью 0,5 л вводят 1,6 г (3,74 ммоля) N-(2-аминоэтил) -2-[[2-[4-(2,5-диметоксифенил)пиперазин-1-ил] этил] амино] пиримидин-4-карбоксида, 0,59 г (3,74 ммоля) 2-хлорпиримидин-4- карбоксамида и 0,8 г (5,8 ммолей) карбоната калия в 200 мл ацетонитрила, смесь нагревают с обратным холодильником в течение 16 ч. Выпаривают растворитель при пониженном давлении и к неочищенному остатку добавляют 200 мл воды и 500 мл дихлорметана. Органическую фазу высушивают на сульфате натрия, затем выпаривают растворитель при пониженном давлении и очищают остаток путем хроматографии на колонке с силикагелем (элюант: смесь дихлорметан/метанол -от 100/0 до 90/10), затем рекристаллизации в смеси ацетонитрил/дихлорметан. Получают 1,1 г (2 ммоля) целевого соединения. Точка плавления: 158-160oC.
Пример 3 (Соединение 12)
N-[2-[[4-(аминокарбонил)пиримидин-2-ил] амино] этил] -2- [[3-[[2-(2-метоксифенокси)этил]метиламино]пропил]амино] пиримидин-4-карбоксамид.
3.1. 2-[[3-[[2-(Метоксифенокси)этил] метиламино] пропил] амино]пиримидин-4-метилкарбоксилат
В колбу емкостью 0,5 л вводят 12,7 г (35,3 ммолей) 2-[[3-[[2-(2- метоксифенокси)этил]метиламино]пропил]амино]пиримидин-4- карбоксамида и 300 мл метанола, затем пропускают поток соляной кислоты в газовой фазе в течение нескольких минут и нагревают с обратным холодильником в течение 4 ч.
Растворитель выпаривают при пониженном давлении, к остатку добавляют 100 мл дихлорметана и охлаждают до 0oC. Смесь подщелачивают насыщенным водным раствором бикарбоната натрия, декантируют и сушат органическую фазу на сульфате натрия, фильтруют, затем выпаривают растворитель при пониженном давлении.
После очищения путем хроматографии на колонке с силикагелем (элюант: смесь дихлорметан/метанол - от 96/4 до 88/12), получают 8,7 г целевого соединения в виде масла, которое используется в данной форме на следующем этапе.
3.2. N-(2-аминоэтил)-2-[[3-[[2-(2-метоксифенокси) этил]метиламино]пропил]амино]пиримидин-4-карбоксамид
В трехгорлую колбу емкостью 0,25 л вводят 3,0 г (8 ммолей) 2-[[3-[[2-(2-метоксифенокси)этилметиламино]пропил]амино]пиримидин-4- метилкарбоксилата и 4,8 г (80 ммолей) этилендиамина в 100 мл смеси 1/1 метанол/дихлорметан. Реакционную среду перемешивают в течение 48 ч при комнатной температуре, затем выпаривают растворители при пониженном давлении.
Поглощают неочищенный осадок с помощью 100 мл дихлорметана, промывают органическую фазу водой (2 • 100 мл), высушивают на сульфате натрия, фильтруют, затем выпаривают растворитель при пониженном давлении и получают 3,05 г целевого соединения в масляной форме) которое используется на следующем этапе.
3.3. N-[2-[[4-(аминокарбонил)пиримидин-2-ил]амино] этил]-2-[[3-[[2-(2-метоксифенокси)этил]метиламино]пропил]амино] пиримидин-4-карбоксамид
В трехгорлую колбу емкостью 0,25 л водят 3,0 г (7,45 ммолей) N- (2-аминоэтил)-2-[[3-[[2-(2-метоксифенокси)этил] метиламино] пропил] амино]пиримидин-4-карбоксамида, 1,23 г (7,8 ммолей) 2-хлорпиримидин- 4-карбоксамида, 1,55 г (11,2 ммолей) карбоната калия, 0,1 г иодида натрия в 40 мл N,N-диметилформамида, реакционную среду нагревают при 60oC в течение 15 ч. Охлаждают до комнатной температуры, продукт реакции выливают в 100 мл воды и экстрагируют этилацетатом (3•100 мл). Органическую фазу промывают водой, высушивают на сульфате натрия, фильтруют и выпаривают растворителем при пониженном давлении. После рекристаллизации в этилацетате получают 1,95 г целевого соединения. Точка плавления 131-133oC.
Пример 4. (Соединение 13)
N-[2-[[4-(аминокарбонил)пиримидин-2-ил] амино] этил] -2- [[3-[4-[[5-метил-2-(1-метилэтил)фенокси] метил]пиперидин-1-ил] пропил]амино]пиримидин-4-карбоксамид
4.1. 2-[[3-[4[[5-Метил-2-(1-метилэтил)фенокси] метил] пиперидин-1-ил] пропил]амино]пиримидин-4-метилкарбоксилат
В колбу емкостью 1 л вводят 6,3 г (14,8 ммолей 2-[[3-[4-[[5-метил-2- (1-метилэтил)фенокси] метил]пиперидин-1-ил]пропил]амино] пиримидин-4-карбоксамида и 250 мл метанола, затем пропускают поток соляной кислоты в газовой фазе в течение нескольких минут и нагревают с обратным холодильником в течение 1 ч 30 мин.
Выпаривают растворитель при пониженном давлении, к остатку добавляют 150 мл дихлорметана и охлаждают до 0oC. Смесь подщелачивают насыщенным водным раствором бикарбоната натрия, декантируют и высушивают органическую фазу на сульфате магния, фильтруют, затем выпаривают растворитель при пониженном давлении.
После очистки путем хроматографии на колонке с силикагелем (элюант: смесь дихлорметан/метанол - от 100/0 до 90/10), получают 4,3 г целевого соединения в виде масла, которое используется на следующем этапе.
4.2. [2-[[[2-[[3-[4-[[5-Метил-2-(1-метилэтил)фенокси]метил] пиперидин-1-ил]пропил]амино]пиримидин-4-ил]карбонил] амино]этил]1,1-диметилэтилкарбамат
В колбу емкостью 0,1 л вводят 4,3 г (9,76 ммолей) 2-[[3-[4-[[5- метил-2-(1-метилэтил)фенокси] метил] пиперидин-1-ил] пропил]амино] пиримидин-4-метилкарбоксилата и 1,9 г (11,7 ммолей) (2-аминоэтил)1,1- диметилэтилкарбамата в 15 мл смеси 2/1 пропан-2-ола с метанолом, смесь нагревают с обратным холодильником в течение 10 ч. Растворитель выпаривают при пониженном давлении и очищают остаток на колонке с нейтральным глиноземом (элюант: циклогексан/этилацетат - от 80/20 до 0/100) и получают 2,8 г целевого соединения в виде масла, которое используется на следующем этапе.
4.3. N-(2-аминоэтил)-2-[[3-[4-[[5-метил-2-(1- метилэтил)-фенокси]метил] пиперидин-1-ил]пропил]амино]пиримидин- 4-карбоксамид
В колбу емкостью 0,25 л вводят 2,8 г (4,92 ммоля) [2-[[[2-[[3-[4- [[5-метил-2-(1-метилэтил)фенокси] метил]пиперидин-1-ил]пропил] амино]пиримидин-4-ил] карбонил] амино] этил] 1,1-диметилэтилкарбамата, растворенного в 20 мл дихлорметана, затем добавляют 20 мл трифторуксусной кислоты и смесь нагревают с обратным холодильником в течение 5 ч. Растворители выпаривают при пониженном давлении, к неочищенному остатку добавляют 70 мл воды, затем 1Н едкого натра. Экстрагируют дихлорметаном (3 • 150 мл), затем промывают органическую фазу водой - (100 мл), сушат на сульфате натрия, фильтруют, затем выпаривают растворитель при пониженном давлении. Получают 2,31 г целевого соединения в виде масла, которое используют на следующем этапе.
4.4. N-[2-[[4-(аминокарбонил)пиримидин-2-ил] амино] этил] - -2-[[3-[4-[[5-метил-2-(1-метилэтил)фенокси] метил] пиперидин-1-ил] пропил]амино]пиримидин-4-карбоксамид
В колбу емкостью 0,25 л в атмосфере аргона вводят 2,31 г (4,92 ммоля) N-(2-аминоэтил)-2-[[3-[4-[[5-метил-2-(1-метил-этил)фенокси] метил] пиперидин-1-ил] пропил] амино] пиримидин-4- -карбоксамида, 0,82 г (5,2 ммолей) 2-хлорпиримидин-4-карбоксамида, 0,89 г (6,4 ммолей) карбоната калия и 75 мл ацетонитрила и нагревают с обратным холодильником в течение 30 ч.
Растворитель выпаривают, затем к неочищенному остатку добавляют 100 мл воды и экстрагируют дихлорметаном (3 • 100 мл). Органическую фазу промывают водой (100 мл), высушивают ее на сульфате натрия, фильтруют, а затем выпаривают растворитель при пониженном давлении. Продукт очищают путем хроматографии на колонке с силикагелем (элюант: дихлорметан/метанол - от 100/0 до 90/10) и рекристаллизируют его в ацетонитриле. В результате получают 1,75 г целевого соединения. Точка плавления: 164-167oC.
Пример 5 (Соединение 15)
(±)-N-[2-[[4-(аминокарбонил)пиримидин-2-ил]амино]этил]- 2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил]-2-гидроксипропил] амино]пиримидин-4-карбоксамид
5.1. (±)-2-[[3-[4-(5-Хлор-2-метоксифенил)пиперазин-1-ил]- 2-гидроксипропил]амино]пиримидин-4-метилкарбоксилат.
В колбу емкостью 1 л вводят 4,7 г (11,6 ммолей) (±)-2-[[3-[4- (5-хлор-2-метоксифенил)пиперазин-1-ил] -2-гидроксипропил] амино] пиримидин-4-карбоксамида и 450 мл метанола, затем пропускают поток соляной кислоты в газовой фазе в течение нескольких минут и нагревают с обратным холодильником в течение 2 ч. Выпаривают растворитель при пониженном давлении, к остатку добавляют 300 мл дихлорметана и охлаждают до 0oC. Смесь подщелачивают насыщенным водным раствором бикарбоната натрия, деконтируют и снова экстрагируют дихлорметаном. Высушивают органическую фазу на сульфате натрия, фильтруют и выпаривают растворитель при пониженном давлении. Продукт очищают путем хроматографии на колонке с силикагелем (элюант: смесь дихлорметан/метанол - от 100/0 до 90/10) и рекристаллизуют в циклогексане. Получают 3,07 г целевого сложного эфира. Точка плавления: 119-122oC.
5.2. (±)-[2-[[[2-[[3-[4-(5-Хлор-2-метоксифенил) пиперазин-1-ил]-2-гидроксипропил] амино] пиримидин-4-ил]карбонил] амино]этил] 1,1-диметилэтилкарбамат
В колбу емкостью 0,25 л вводят 2,21 г (5,07 ммолей) (±)-2-[[3- [4-(5-хлор-2-метоксифенил)пиперазин-1-ил]-2-гидроксипропил]амино] пиримидин-4-метилкарбоксилата и 2,6 г (16,2 ммолей) (2-аминоэтил) 1,1- диметилкарбамата в 25 мл пропан-2-ола, реакционную смесь нагревают в течение 16 ч. Растворитель выпаривают при пониженном давлении и очищают продукт путем хроматографии на колонке с силикагелем (элюант: дихлорметан/метанол, от 100/0 до 90/10). Получают 2,8 г пастообразного целевого соединения, которое используется на следующем этапе.
5.3. (±)-N-(2-аминоэтил)-2-[[3-[4-(5-хлор-2- метоксифенил)пиперазин-1-ил]-2-гидроксипропил]амино]пиримидин-4- карбоксамид
В колбу емкостью 0,5 л вводят 2,8 г (4,96 ммолей) (±)-[2-[[[2- [[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил] -2-гидроксипропил] амино] пиримидин-4-ил] карбонил] амино] этил-1,1-диметилэтилкарбомата, растворенного в нескольких миллиметрах метанола, затем прикапывают 7 мл концентрированной соляной кислоты. После 15 мин перемешивания, смесь охлаждают до 0oC смесью лед/соль/вода, затем добавляют маленькими порциями 1Н едкий натр до щелочного pH. Экстрагируют дихлорметаном, органическую фазу высушивают на сульфате натрия, фильтруют и выпаривают растворители при пониженном давлении. Получают 2,3 г целевого соединения в виде масла, которое используется на следующем этапе.
5. 4. (±)-N-[2-[[4-(аминокарбонил)пиримидин-2-ил] амино] этил]-2-[[3-[4-(5-хлор-2-метоксифенил)пиперазин-1-ил] -2- гидроксипропил] амино]пиримидин-4-карбоксамид
В колбу емкостью 0,5 л в атмосфере аргона вводят 2,32 г (4,96 ммоля) (±)-N-(2-аминоэтил)-2-[[3-[4-(5-хлор-2-метоксифенил) пиперазин-1-ил]-2-гидроксипропил] амино] пиримидин-4-карбоксамида, 0,8 г (5,1 ммолей) 2-хлорпиримидин-4-карбоксамида, 1г (7,2 ммолей) карбоната калия в 150 мл ацетонитрила и нагревают с обратным холодильником в течение 17 ч.
Смесь охлаждают до комнатной температуры, отделяют нерастворимый осадок путем фильтрации и очищают его путем хроматографии на колонке с силикагелем (элюант: дихлорметан/метанол от 100/0 до 85/15). После рекристаллизации в ацетонитриле получают 0,6 г целевого соединения. Точка плавления: 178-181oC.
В табл. 1 иллюстрируются химические структуры и физические свойства некоторых соединений изобретения.
Соединения изобретения были исследованы на их активность в качестве антагонистов α1 - адренергических рецепторов на уровне нижнего отдела мочевых органов.
Их активность in vitro была исследована на изолированном мочеточнике кролика.
Приготавливают кольца из мочеточника взрослого самца кролика по методу Ueda et al., Eur. J. Pharmacol., (1984), 103, 249-254, затем после сенсибилизации норадреналином определяют кривую концентрации - результат с фенилэфрином в присутствии или без исследуемого соединения. Оценивают эффективность каждого соединения как антагониста α1 -адренергетических рецепторов путем расчета pA2, антилогарифма молярной концентрации антагониста, при которой концентрация агониста должна быть удвоена, чтобы произвести тот же эффект, что и в его отсутствии. Результаты приведены в нижеследующей таблице.
Активность ин виво соединений согласно изобретению была исследована с точки зрения их влияния на гипертонию мочеточника, вызванную стимуляцией симпатических волокон гипогастрического нерва у анестезированной кошки.
Анестезируют взрослых самцов кошек натрийсодержащим пентобарбиталом, подготавливают их по методике Theobald, J. Auton. Pharmac, (1983), 3, 235-239, вызывая гипертонию мочеточника путем стимуляции симпатических волокон гипогастрического нерва. Отмечают контрактурные ответы мочеточника на электрическое стимулирование гипогастрического нерва до и после внутривенного введения исследуемых соединений, при дозах 1-1000 мкг/кг. Оценивают эффект каждого соединения в качестве антагониста α1 - адренергических рецепторов, путем расчета DI50, которая ингибирует на 50% гипертонию мочеточника.
Результаты приведены в табл. 2. Номера соединений соответствуют номерам в табл. 1. В табл. 2 приведена активность соединений, обнаруженная в тесте in vitro на мочеточнике кролика (UIL) в качестве антагонистов α1 -адренергических рецепторов (выражено в pA2), и в тесте in vivo (выражено в DI50) на эффект антагонизма α1 -адренергических рецепторов.
Результаты исследований показывают, что соединения согласно изобретению имеют, in vitro, антагонистическую активность к α1/ -адренергическим рецепторам гладкой мускулатуры нижнего отдела мочевых органов (мочеточника) стимулированных α1- -адренергическим агонистом (фенилэфрином) в тесте ин виво они ингибируют гипертонию мочеточника, вызванную стимуляцией симпатического нерва.
Проведенные испытания относительно токсичности соединений показали следующее: спустя 14 дней после обработки соединениями согласно изобретению крыс дозами 400, 800 и 1200 мг/кг/день и собак дозами 50 мг/кг/день никакой смертности не было обнаружено. Следовательно, новые соединения относятся к категории нетоксичных соединений.
Изобретение относится также к фармацевтической композиции, обладающей антагонистической активностью в отношении α1- -адренергических рецепторов, содержащей в качестве активного начала соединение формулы I, описанной выше.
Соединения согласно изобретению могут быть использованы для симптоматического лечения заболеваний и недугов, влекущих за собой гиперактивность α1- -адренергической системы на уровне нижнего отдела мочевого аппарата и, в частности, для лечения расстройств мочеиспускания при доброкачественной гипертрофии простаты, таких как дизурия и поллакиурия.
Композиции могут быть представлены в любой форме, годной для энтерального или парантерального введения и содержать помимо активного начала фармацевтически приемлемые экципиенты. Композиции могут находиться в форме таблеток, драже, желатиновых капсул, растворов или суспензий, для питья или впрыскивания, свеч, с содержанием дневной дозы 0,1-500 мг активного начала.
Ниже приведены несколько примеров формулировок различных препаративных форм:
Таблетки - %
Соединение примера 3 - 0,1
Лактоза - 70,0
Гидроксипропилметилцеллюлоза - 5,8
Целлюлоза микрокристаллическая - 20
Карбоксиметил-крахмал натрия - 2,0
Коллоидальная двуокись кремния - 0,1
Стеарат магния - 2,0
Итого - 100%
Желатиновые капсулы - %
Соединение примера 8 - 20,0
Лактоза - 50,0
Гидроксипропилметилцеллюлоза - 9,0
Целлюлоза микрокристаллическая - 15,0
Карбоксиметил-крахмал натрия - 2,7
Каллоидальная двуокись кремния - 0,3
Стеарат магния - 3,0
Итого - 100%
Составы для инъекций объемом 5 мл:
Соединение примера 13 - 4 мг
Глюкоза - 250 мг
Вода - до 5 мл
Составы для инъекций объемом 5 мл:
Соединение примера 14 - 6 мг
Глюкоза - 250 мг
1 Вода - до 5 мл
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2-АМИНОПИРАЗИН-5-КАРБОКСАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ МЕДИЦИНСКИЙ ПРЕПАРАТ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2128176C1 |
| 3-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 3,4,5,6,7,8-ГЕКСАГИДРОПИРИДО[4',3':4,5]-ТИЕНО[2,3-D]ПИРИМИДИНА | 1997 |
|
RU2198888C2 |
| ПРОИЗВОДНЫЕ 1Н-ПИРИДО[3,4-В]ИНДОЛ-4-КАРБОКСАМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2180904C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛО[1,5-a]ПИРИМИДИНА И ТИЕНО[3,2-b]ПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ IRAK-4 | 2011 |
|
RU2604062C2 |
| ПРОИЗВОДНЫЕ 5-ФЕНИЛ-3-(ПИПЕРИДИН-4-ИЛ)-1,3,4-ОКСАДИАЗОЛ-2(3Н)-ОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1996 |
|
RU2167160C2 |
| ПРОИЗВОДНЫЕ 4-ПИРИМИДИНОНОВ ИЛИ ИХ ОРГАНИЧЕСКИЕ ИЛИ МИНЕРАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2073675C1 |
| ПРОИЗВОДНЫЕ N-(3-АМИНОПРОПИЛ)-N-ФЕНИЛ-5,6,7,8-ТЕТРАГИДРОНАФТАЛИН-2-КАРБОКСАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2138479C1 |
| ПРОИЗВОДНЫЕ ХИНОЛИН-2(1Н)-ОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2167874C2 |
| АМИНЫ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ПРЕДОТВРАЩЕНИЯ ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК | 1997 |
|
RU2176502C2 |
| 4-ФЕНОКСИ-НИКОТИНАМИДЫ ИЛИ 4-ФЕНОКСИ-ПИРИМИДИН-5-КАРБОКСАМИДЫ | 2011 |
|
RU2565077C2 |

Соединения изобретения, отвечающие общей формуле I, приведенной в описании, где m = 0 или 1, R1 - метильная группа, в этом случае R2 - фенокси (C1-C4)алкильная группа или R1 и R2 образуют вместе, и с связанным с ними атомом азота, 4-феноксипиперидин-1-ильную группу, феноксиметилпиперидин-1-ильную группу или 4-фенилпиперазин-1-ильную группу, а R3 - атом водорода или, и только при n = 1, гидроксигруппа или метоксигруппа. 3 с. и 3 з.п.ф-лы, 2 табл.

где n = 0 или 1;
m = 0 или 1;
R1 = метил;
R2 = фенокси (C1 - C2)алкил, где фенильное кольцо может быть замещено метоксигруппой, или R1R2N - 4-фенилпиперазин-1-ил, где фенильная группа замещена 1 и 2 заместителями, выбранными из галогена или метоксигруппы, или R1R2N - 4-феноксипиперидин-1-ил, где фенильное кольцо замещено галогеном или метоксигруппой, или R1R2N - 4-феноксиметил-пиперидин-1-ил, где фенильное кольцо замещено двумя группами низшего алкила;
R3 - водород, причем, если n = 1, то R3 - гидрокси- или метоксигруппа,
или их кислотно-аддитивные соли.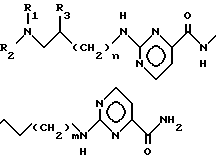
где n = 0 или 1;
m = 0 или 1;
R1 - метил;
R2 - фенокси (C1 - C2)алкил, где фенильное кольцо может быть замещено метоксигруппой, или R1R2N -4-фенилпиперазин-1-ил, где фенильная группа замещена 1 или 2 заместителями, выбранными из галогена или метоксигруппы, или R1R2N - 4-феноксипиперидин-1-ил, где фенильное кольцо замещено галогеном или метоксигруппой, или R1R2N - 4-феноксиметилпиперидин-1-ил, где фенильное кольцо замещено двумя группами низшего алкила;
R3 - водород, причем, если n = 1, то R3 - гидрокси- или метоксигруппа;
или их кислотно-аддитивных солей, отличающийся тем, что амид общей формулы II
где R1 - R3 и n определены выше,
путем взаимодействия с алифатическим спиртом C1 - C4 в присутствии кислоты и при 0 - 100oC преобразуют в сложный эфир общей формулы III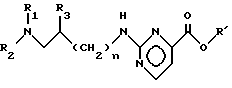
где R1 - C1 - C4-алкил, последний конденсируют с амином общей формулы IV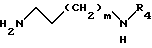
где R4 - водород или защитная группа амина;
m = 0 или 1,
процесс ведут в алифатическом спирте при 0 - 60oC и от полученного амина общей формулы V
в случае необходимости отщепляют защитную группу амина и амин общей формулы V, где R4 - водород, подвергают взаимодействию с 2-хлорпиримидин-4-карбоксамидом в апротонном растворителе в присутствии основания при 20 - 40oC.
Приоритет по признакам:
03.07.92 - соединения формулы I, где R1R2N - 4-фенилпиперазин-1-ил, фенильное кольцо которого замещено одним или двумя заместителями, выбранными из атомов галогена и групп метокси;
14.12.92 - соединения формулы I, где R1R2N - 4-феноксипиперидин-1-ил, фенильная группа которого замещена галогеном или метоксигруппой, или R1R2N - 4-феноксиметил-пиперидин-1-ил, фенильное кольцо которого замещено двумя группами низшего алкила.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| EP, 0435749А, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| EP, 0511072А, C 07 D 239/42, 1992 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| FR, 2678271, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| EP, 0480794, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-05-27—Публикация
1993-07-02—Подача