Изобретение относится к медицинской иммунобиотехнологии и может быть использовано в производстве и при контроле препаратов, содержащих столбнячный антитоксин.
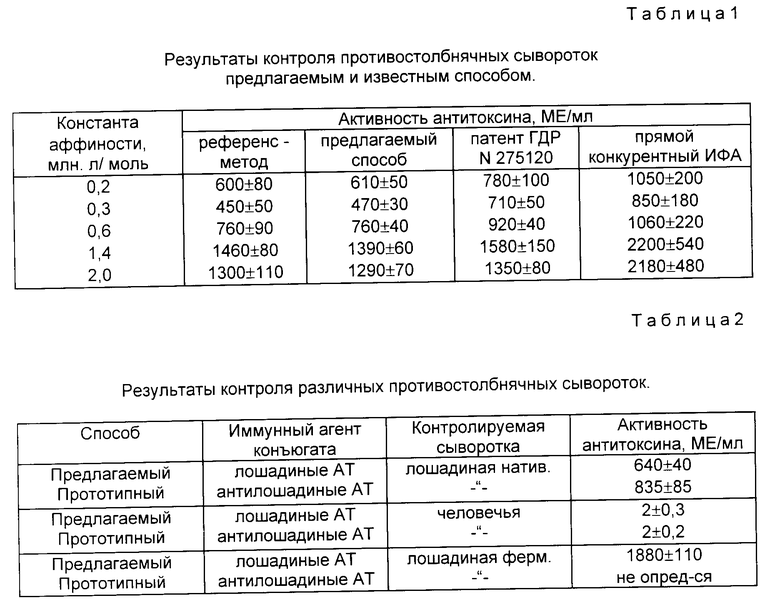
Известен способ определения активности столбнячного антитоксина в твердофазном иммуноферментном анализе (ИФА), предусматривающий иммобилизацию лиганда - противостолбнячных антител - на полистироле с последующим внесением испытуемой пробы и иммуноферментного конъюгата (столбнячного анатоксина, меченного щелочной фосфатазой), инкубированием реакционной смеси и колориметрическим учетом результата с помощью калибровочного графика (H. Fey, G. Stiffler-Rosenberg. Messung von Tetanus-Antitoxin beim Pferd mit dem Enzyme Linked Immuno Sorbent Assay. Schweizer Archiv fur Tierheilkunde, Bd. 119, H.11, S. 437-446, 1977).
Известен также способ определения активности столбнячного антитоксина в твердофазном ИФА путем иммобилизации столбнячного анатоксина на полистироловом планшете с последующим внесением и инкубированием испытуемой пробы, обработкой иммуноферментным конъюгатом (антителами к IgG человека, меченными щелочной фосфатазой) и колориметрированием с использованием калибровочного графика (Tetanus IgG EIA Test Kit with Microstrips. Labsystems, Finland, 1983).
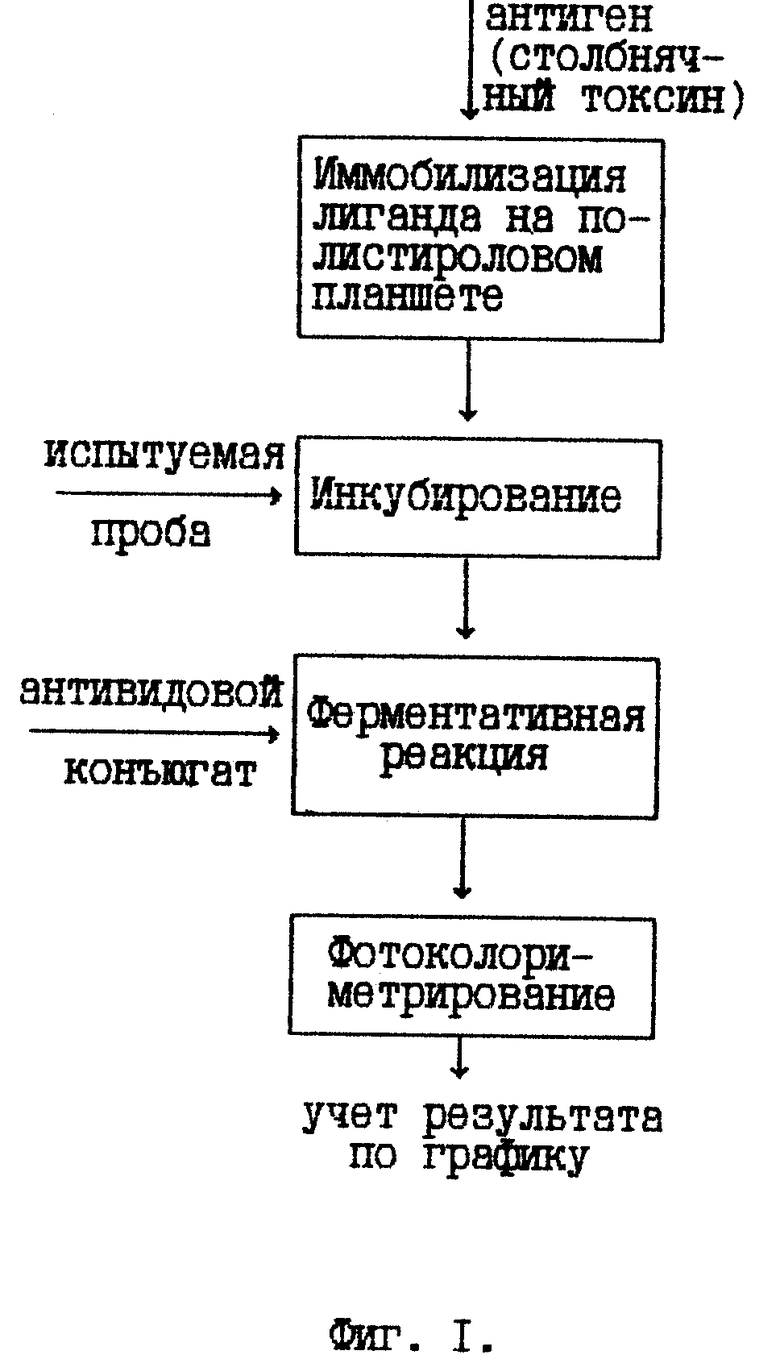
Наиболее близким к заявляемому является способ определения активности столбнячного антитоксина в твердофазном ИФА, предусматривающий иммобилизацию лиганда - столбнячного токсина - на полистироловом планшете с последующим внесением и инкубированием испытуемой пробы, обработкой иммуноферментным конъюгатом (антивидовыми антителами или столбнячным токсином, меченными пероксидазой хрена) и учетом результата колориметрированием с использованием градуировочной кривой (патент ГДР N 275120, кл. G 01 N 33/543, приоритет 23.08.88).
Однако указанные способы обладают низкой точностью контроля гипериммунных сывороток, а используемые при этом антительные иммуноферментные конъюгаты должны быть видоспецифичными, что неудобно для пользователя.
Целью изобретения является повышение точности способа при контроле гипериммунных сывороток, а также удобства осуществления способа.
Указанная цель достигается тем, что в способе определения активности столбнячного антитоксина, предусматривающем иммобилизацию лиганда на полистироле с последующим инкубированием на нем испытуемой пробы, обработку иммуноферментным конъюгатом и колориметрический учет результата, инкубируют референтную сыворотку и разведения испытуемой пробы в присутствии столбнячного антигена, в качестве лиганда и иммунного агента конъюгата используют противостолбнячные антитела, а результат учитывают по формуле:
A = ST,
где
A - активность противостолбнячных антител в пробе, ME/мл;
S - специфическая активность референтной сыворотки, ME/мл;
T - разведение испытуемой пробы, интерполированное для экстинкции референтной сыворотки.
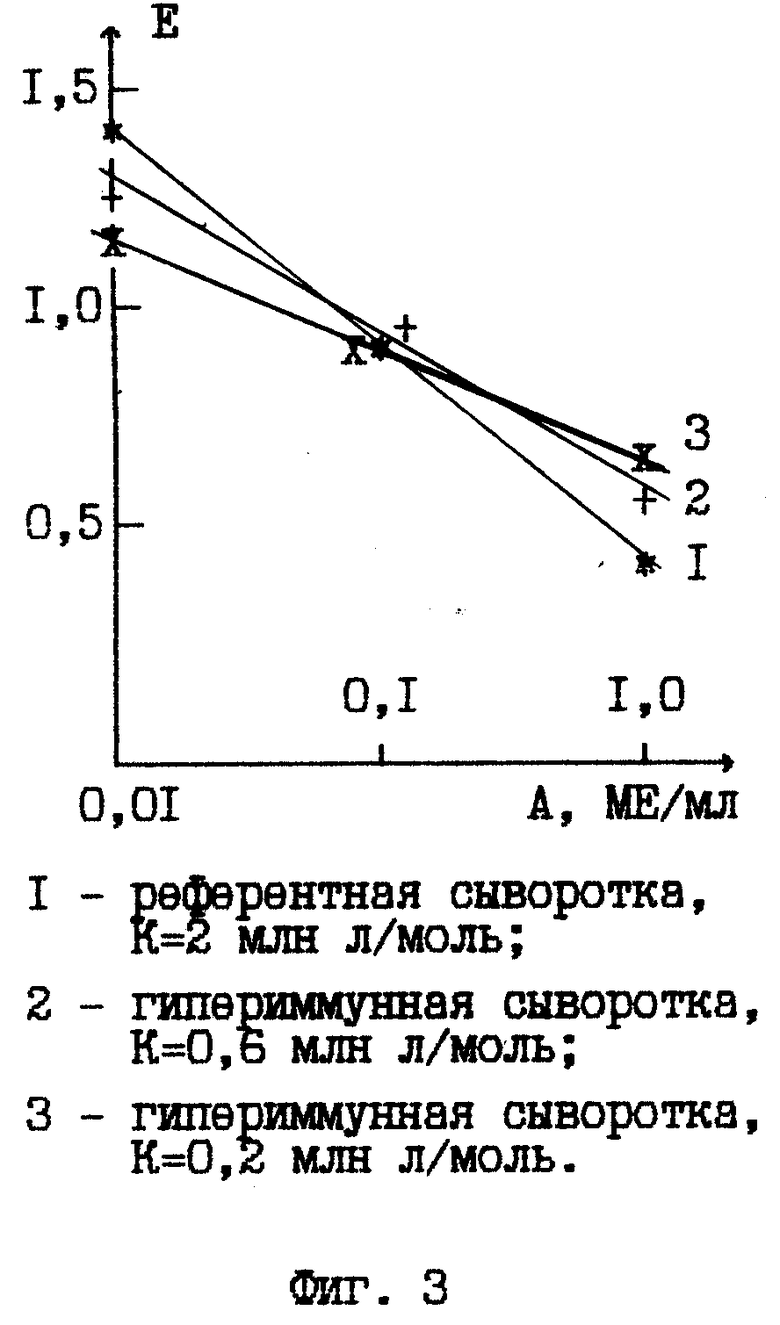
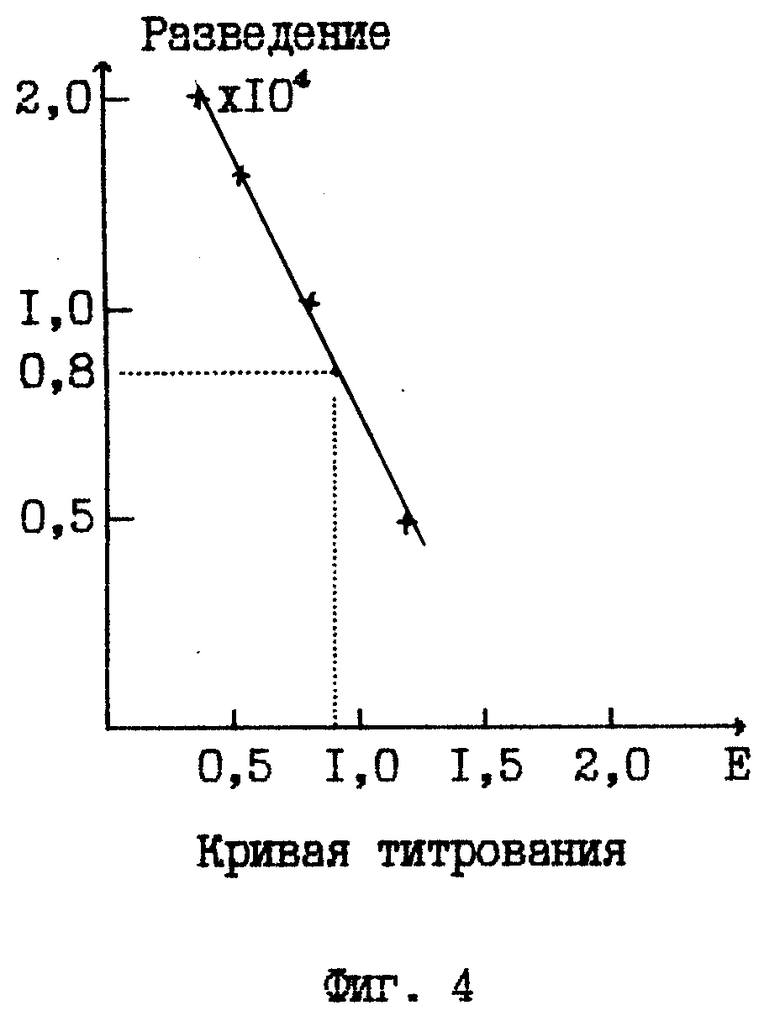
На фиг. 1 дана технологическая схема прототипного способа; на фиг. 2 - технологическая схема предлагаемого способа; на фиг. 3 - результаты контроля активности противостолбнячных антител в референтной и гипериммунных сыворотках; на фиг. 4 - кривая титрования к примеру 1.
Внесенные изменения поясняются технологическими схемами предлагаемого и прототипного способов (фиг. 1 и 2).
Нами установлено, что причиной погрешности способа является неизвестная ранее зависимость результатов ИФА от аффинности гипериммунной сыворотки. Эта зависимость проиллюстрирована на фиг. 3 графиками измерения экстинкции в ИФА для различных разведений референтной и испытуемых противостолбнячных гипериммунных сывороток, активности которых предварительно установлены референс-методом нейтрализации токсина на белых мышах (Методическое руководство по лабораторной оценке качества бактерийных и вирусных препаратов, М., 1972, с. 235-264). У каждого графика на фиг. 3 указаны константы аффинности К. Как видно из графиков, при твердофазном ИФА ошибка измерений минимальна и практически не зависит от аффинности в окрестности значения активности референтной сыворотки, относительно которого определяют активность проб в референс-методе (A= 0,1 ME/мл). Поэтому для повышения точности измерений необходимо либо вносить соответствующую поправку в результат по данным предварительного измерения аффинности, что практически невыполнимо, либо, как предлагается в настоящем способе, измерять экстинкцию для референс-сыворотки и ряда разведений испытуемой пробы с последующим интерполированием к значению экстинкции референс-сыворотки и расчетом искомой активности по формуле (1).
Использование в качестве лиганда противостолбнячных антител, как указано в приведенном выше обзоре аналогов, известно. В предлагаемом способе оно имеет новое назначение: обеспечивает возможность технического осуществления интерполяции результата в точке с минимальной погрешностью, что неочевидно, поскольку, как показали наши исследования, другие варианты ИФА, в частности, прямой конкурентный метод, при контроле гипериммунной сыворотки не обеспечивают стабильности измерений (коэффициент вариации η > 20%).
Сочетание данного лиганда с используемым иммунным агентом конъюгата (противостолбнячными антителами) позволяет не только обеспечить высокую чувствительность способа, но и исключить требование видовой специфичности способа.
Пример. 96-луночный полистироловый планшет обрабатывают противостолбнячными лошадиными антителами в физиологическом растворе (концентрация антител 5 мкг/мл) из расчета 200 мкл/лунка, выдерживают в течение 16 ч при комнатной температуре и 3-кратно промывают 0,01 М фосфатно-солевым буферным раствором, дополнительно содержащим твин-80 (CNaCl=0,5 М; CТВИН=0,1%), pH 7,2 (ФСБ-Т).
Готовят рабочие растворы:
1) противостолбнячной стандартной сыворотки ГИСК (активность 4 ME/мл) в 40-кратном разведении (S=0,1 ME/мл);
2) испытуемой пробы противостолбнячной гипериммунной сыворотки в разведениях Т1=5000; Т2=10000; Т3=15000 и Т4=20000;
3) столбнячного анатоксина разведением в 500 раз концентрированного анатоксина с активностью 800 ЕС/мг при концентрации белка 0,5 мг/мл.
В лунки планшета с иммобилизованными противостолбнячными антителами вносят по 100 мкл разведений стандартной и испытуемой сывороток, а также физраствора, добавляют по 100 мкл разведения анатоксина и инкубируют в течение 16 ч при комнатной температуре. Далее планшет промывают, как указано выше.
Иммуноферментный конъюгат, содержащий противостолбнячные кроличьи антитела, меченные пероксидазой хрена, разводят ФСБ-Т до концентрации по пероксидазе 50 нг/мл и вносят по 200 мкл в лунки планшета. Планшет инкубируют 1 ч при 37oC и промывают, как указано выше.
В лунки вносят по 200 мкл субстратной смеси, включающей ортофенилендиамин (0,2 мг/мл) и перекись водорода (0,015%) в цитратном буфере (pH 4,5), и инкубируют при комнатной температуре в темном месте в течение 30 мин. Затем в лунки вносят по 50 мкл 50%-ной серной кислоты для остановки реакции.
Продукты реакции колориметрируют при λ = 492 нм . В данном примере экстинкция для пробы со стандартной сывороткой равна 0,910, а для физраствора - 1,767. Отношение экстинкций 0,910:1,767=0,51, что свидетельствует об оптимальном выборе рабочей точки измерений.
По результатам колориметрирования разведений испытуемой пробы строят кривую титрования в координатной плоскости E - lg T (фиг. 4). По кривой титрования определяют, что значению экстинкции референтной (стандартной) сыворотки E=0,91 соответствует разведение испытуемой пробы T=8000.
Согласно формуле (1), активность столбнячного антитоксина в испытуемой пробе составляет:
A=ST=0,1•8000=800 ME/мл.
В табл. 1 приведены результаты определения активности пяти серий гипериммунных лошадиных противостолбнячных сывороток с различной аффинностью по данным 8 параллельных измерений предлагаемым, прототипным и прямым конкурентным способами ИФА, а также биологическим референс-методом. Как видно из таблицы, средние значения измерений предлагаемым способом соответствуют результатам референс-метода, но существенно (в 1,3-1,7 раза) отличаются от результатов, получаемых в прототипе и прямом конкурентном ИФА При этом по сравнению с референс-методом снижена вариация измерений, что подтверждается уменьшением погрешности среднего значения антитоксической активности. Эти выводы статистически значимы по критерию Стьюдента при p=0,05.
Помимо повышения точности, в предлагаемом способе не предъявляется требований к видовой принадлежности контролируемой сыворотки. Это вытекает из его технической сущности и дополнительно подтверждается табл. 2, где приведены результаты контроля противостолбнячных сывороток разной видовой принадлежности предлагаемым и прототипным способом (по 3 параллельных испытания). В табл. 2 лошадиная ферментированная сыворотка  не имеет видовой принадлежности, что очевидно.
не имеет видовой принадлежности, что очевидно.
Поскольку известные способы определения активности противостолбнячных антител в гипериммунных сыворотках в ИФА имеют значительную погрешность, в СНГ единственным разрешенным в установленном порядке является вышеуказанный базовый биологический способ. По сравнению с этим способом отпала необходимость титрования на мышах в течение 4 сут, что не только ускоряет анализ (длительность предлагаемого способа 1 сут), но и удешевляет его. В этой связи на этапе испытания способа при контроле 1 тысячи проб экономия составила 47 тысяч рублей, что подтверждается актом испытания.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки эффективности вакцинации против коклюша, дифтерии и столбняка | 2016 |
|
RU2626679C1 |
| СПОСОБ ПОСТАНОВКИ ТВЕРДОФАЗНОЙ ИММУНОФЕРМЕНТНОЙ РЕАКЦИИ | 1994 |
|
RU2133962C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БЕЛКОВ, СПЕЦИФИЧНЫХ К ФОСФОРИЛХОЛИНУ | 1991 |
|
RU2014609C1 |
| Способ постановки реакции торможения непрямой гемагглютинации | 1989 |
|
SU1712879A1 |
| ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДИФТЕРИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1999 |
|
RU2174408C2 |
| Иммуноферментная тест-система для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета | 2016 |
|
RU2625031C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИТОКСИЧЕСКОЙ СЫВОРОТКИ | 1992 |
|
RU2062617C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К HBs-АНТИГЕНУ И БЛОКАТОР В ТЕСТ-СИСТЕМЕ | 2001 |
|
RU2206095C1 |
| Тест-система для количественной детекции антител против 146S компонента вируса ящура генотипа O/EA-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа | 2023 |
|
RU2817382C1 |
| Способ и набор для иммуноферментного определения количественного содержания антитоксических противодифтерийных IgG антител в сыворотках крови людей | 2020 |
|
RU2744521C1 |
Изобретение относится к медицинской иммунобиотехнологии и может быть использовано в производстве к при контроле препаратов, содержащих столбнячный антитоксин. Столбнячный антитоксин определяют в иммуноферментном анализе путем иммобилизации лиганда на полистироле с последующим инкубированием на нем испытуемой пробы, обработкой иммуноферментным конъюгатом и учетом результата колориметрированием. С целью повышения точности контроля гипериммунных сывороток и удобства осуществления способа,, инкубируют референтную сыворотку и разведения испытуемой пробы в присутствии столбнячного антигена, в качестве лиганда и иммунного агента конъюгата используют противостолбнячные антитела, а результат учитывают по формуле:
А = SТ,
где А - активность противостолбнячных антител в пробе, МЕ/мл;
S - специфическая активность референтной сыворотки, МЕ/мл;
Т - разведение испытуемой пробы, интерполированное для экстинкции референтной сыворотки.
4 ил., 2 табл.
Способ определения активности столбнячного антитоксина в твердофазном иммуноферментном анализе, предусматривающий иммобилизацию лиганда на полистироле с последующим инкубированием на нем испытуемой пробы, обработкой иммуноферментным конъюгатом и учетом результата колориметрированием, отличающийся тем, что инкубируют референтную сыворотку и разведения испытуемой пробы в присутствии столбнячного антигена, в качестве лиганда и иммунного агента конъюгата используют противостолбнячные антитела, а результат учитывают по формуле
A = ST,
где A - активность противостолбнячных антител в пробе, МЕ/мл;
S - специфическая активность референтной сыворотки, МЕ/мл;
T - разведение испытуемой пробы, интерполированное для экстинкции референтной сыворотки.
| DE, патент N 2751120, G 01 N 33/543, 1988. |
Авторы
Даты
1998-06-20—Публикация
1992-12-29—Подача