Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности созданию тест-системы для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа.
Ящур - особо опасное, карантинное, высококонтагиозное заболевание животных, которое вызывает РНК(+)-содержащий вирус семейства Picornaviridae рода Aphthovirus с длиной нуклеиновой кислоты около 8500 н.о. Выделяют 7 серотипов вируса ящура: О, А, С, Азия-1, SAT-1, SAT-2, SAT-3. При репродукции вируса ящура образуется основной иммуногенный компонент - полные частицы, или 146S компонент, состоящий из одной молекулы вирусной РНК и 60 копий полипептида, каждый из которых представлен белками VP2, VP4, VP3, VP1 [1, 2].
Для борьбы с ящуром рекомендуется вакцинопрофилактика. В ФГБУ «ВНИИЗЖ» производят инактивированные сорбированные и эмульсионные противоящурные вакцины из штаммов 7 серотипов вируса [3].
В РНК-содержащих вирусах вариациям в геноме благоприятствуют высокие частоты мутаций во время репликации вируса, а возникающие линии и сублинии обусловлены мутациями и рекомбинацией. Антигенные вариации возникают из-за аминокислотных мутаций, которые изменяют распознавание вирусных белков иммунной системой организма. Наиболее вариабельным является протеин VP] вируса ящура, поскольку на него приходится не менее 90% мутаций всех структурных генов. Самыми вариабельными областями являются участки 40-60, 130-160 и 190-213 а.о. [4]. Участок поверхностного белка VP1 в регионе 130-160 а.о. отличается высокой вариабельностью, поскольку участвует в процессе связывания с рецепторами клетки-хозяина [5, 6].
В последние годы в мире (особенно на Африканском континенте) циркулирует вирус ящура генотипа О/ЕА-3. Изолят «О/ЕНТ/2/2011» вируса ящура был выделен от свиньи на территории Федеративной Демократической Республики Эфиопия в населенном пункте Дебре Зейт (Бишофту) в районе Восточная Шева в 2011 г. и поступил в ФГБУ «ВНИИЗЖ» из Всемирной справочной лаборатории института Пирбрайта (the World Reference Laboratory for Foot-and-Mouth Disease, the Pirbright institute, Великобритания) для проведения научных исследований в 2023 г.
При проведении научных исследований в ФГБУ «ВНИИЗЖ» был охарактеризован и получил название - штамм «О №2241/Эфиопия/2011». Проанализировали первичную структуру 1D-гена нуклеиновой кислоты данного вируса с помощью двух систем праймеров O-1C244F/EUR-2B52R и O-1C272BF/EUR-2B52R. При этом выделен фрагмент кДНК полученного изолята размером 639 п. н. По результатам секвенирования определено, что полученный изолят принадлежит генотипу О/ЕА-3.
В ФГБУ «ВНИИЗЖ» данный изолят был адаптирован к различным чувствительным клеточным линиям, в том числе, к монослойной и суспензионной перевиваемой клеточной линии почки новорожденного сирийского хомячка BHK-21/SUSP/ARRIAH и получен штамм «О №2241 /Эфиопия/2011» (генотип О/ЕА-3).
Штамм вируса ящура «О №2241/Эфиопия/2011» депонирован во Всероссийской государственной коллекции экзотических типов вирусов ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ», под регистрационным номером: №481 - деп / 23-31 - ГКШМ ФГБУ «ВНИИЗЖ».
Экспериментально подтверждена возможность использования штамма «О №2241/Эфиопия/2011» вируса ящура для изготовления средств диагностики и профилактики ящура генотипа О/ЕА-3.
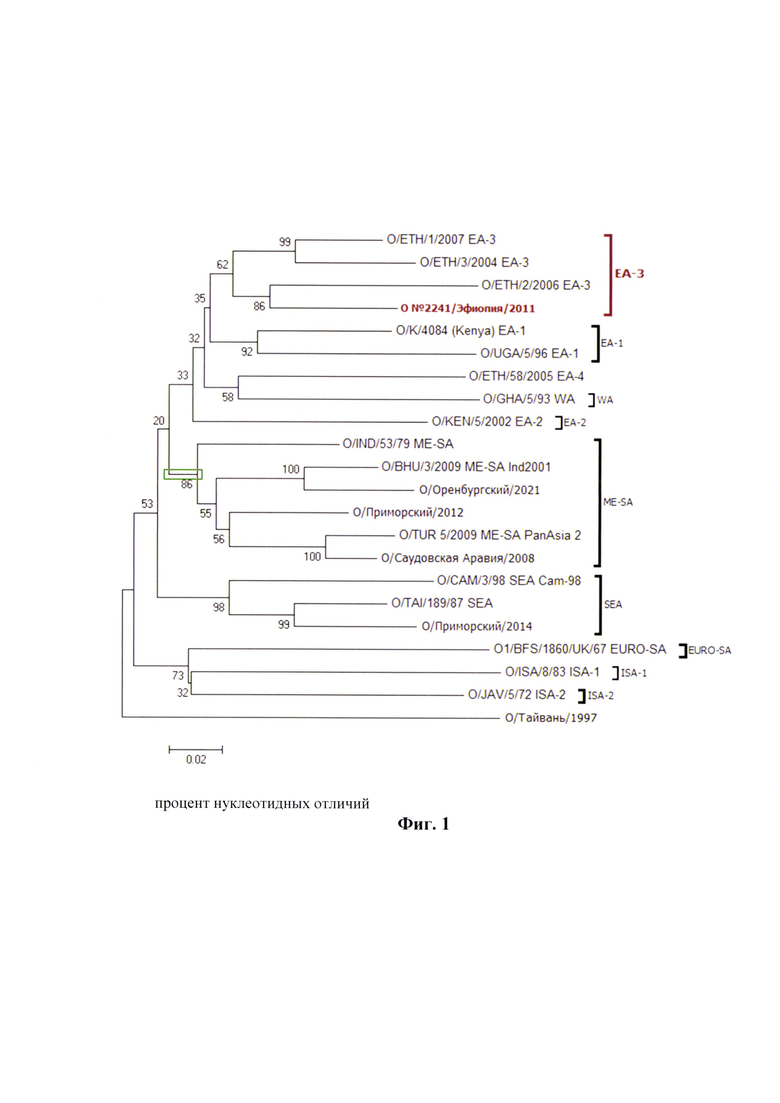
Филогенетическая принадлежность выделенного изолята и полученного на его основе штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 представлена на фиг. 1.
Иммунизация является эффективным инструментом борьбы с болезнью. В связи с активным распространением данного генотипа вируса ящура на территории Африки и соседних регионов, а также угрозой проникновения изолятов на территорию Российской Федерации и необходимостью защиты животных от него, в ФГБУ «ВНИИЗЖ» разработали вакцину, в состав которой входит антиген вируса ящура данного штамма.
Возникла необходимость создания высокоспецифичных и высокочувствительных диагностических тест-систем для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа.
Защита от ящура после вакцинации определяется уровнем специфических антител против 146S компонента возбудителя данного заболевания в сыворотке крови животных [4, 5]. В соответствии с рекомендациями МЭБ (OIE) [1] для определения иммунного статуса животных применяют реакцию микронейтрализации (РМН) и иммуноферментный анализ (ИФА).
РМН считается чувствительным и специфичным методом, однако проведение анализа имеет ряд следующих ограничений: 1) большая продолжительность времени постановки реакции (не менее 3 суток), 2) высокая стоимость процедуры, связанная с применением чувствительной клеточной линии, наличием СО2-инкубатора, 3) предполагает использование живого вируса ящура, который является биологическим агентом II группы опасности.
В свою очередь, ИФА обладают многими преимуществами, включая экспрессность, высокую специфичность и чувствительность, пригодность для крупномасштабного скрининга полевых образцов и отсутствие требований к специальным лабораторным условиям, например, культуре клеток или среде углекислого газа [7, 8]. Исходя из этого для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных целесообразно применять ИФА.
ИФА также разделяют на твердофазные и жидкофазные варианты. Жидкофазный блокирующий непрямой вариант ИФА имеет ряд следующих преимуществ: 1) эпитопы антигена наиболее доступны в пространстве для специфичных антител, и это позволяет получать наиболее приближенные результаты к реакции нейтрализации в клеточной линии; 2) анализ максимально из всех модификаций данного анализа приближен к классической реакции нейтрализации, поскольку частицы антигена не прикреплены к субстрату; 3) обладает высокими показателями аналитической и диагностической чувствительности, специфичности и общей точности [7, 8, 9].
Sharma G.K. и др. (2015) предложили способ определения антител против вируса ящура типов А, О, Азия-1 с помощью жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА [10]. Данная методика позволяла идентифицировать широкий спектр противоящурных антител, но при этом специфичность по отношению к вирусу ящура генотипа О/ЕА-3 не более 26%, а, следовательно, точное выявление иммуноглобулинов G не представляется возможным.
Данный способ предполагал применение в качестве блокирующего компонента не иммунную сыворотку лошади, которая содержит различные белковые соединения, в том числе, возможно, гомологичные участки аминокислотных последовательностей относительно антигенных детерминант. Авторы тест-системы применяли моноклональные антитела, использование которых увеличивает спектр выявления различных генетических линий вируса ящура в рамках одного серотипа, но при этом существенно снижается специфичность относительно выявления антител против изолятов/штаммов конкретного генотипа, в частности О/ЕА-3. В качестве красителя использовали тетраметилбензидин (ТМВ), являющийся агрессивным канцерогеном и нестабильным компонентом для проведения цветной реакции. Для остановки реакции применяли серную кислоту, являющуюся опасным соединением.
Указанная выше тест-система не представлена на рынке в качестве набора для детекции противоящурных антител в сыворотках крови животных и остаются недоступны для широкого потребителя диагностикумов. В свою очередь на мировом рынке в настоящее время имеются европейские наборы для детекции антител против вируса ящура типа О - IZSLER (Италия) и РrioСНЕСК (Нидерланды).
Тест-система в наборе IZSLER предназначена для детекции противоящурных антител с помощью твердофазного прямого «сэндвич»-варианта ИФА [11]. Комплектующие набора IZSLER (Instituto Zooprofilattico Sperimentale della Lombardia e dell'Emilia Romagna Brescia, Italy The Pirbright Institute) следующие:
1. Герметичные микропланшеты, сенсибилизированные инактивированным вирусом ящура типа О.
2. Конъюгат (моноклональные антитела против вируса ящура типа О, конъюгированные с пероксидазой).
3. Положительный контроль сыворотки против вируса ящура типа О.
4. Отрицательный контроль.
5. Буферный раствор для ИФА - фосфатно-солевой буфер с твином-20 (ФСВ-Tween-20).
6. Буфер для разведения сыворотки крови и конъюгата.
7. Субстрат (раствор хромогена ТМВ).
8. Раствор для остановки реакции (0,6N раствор серной кислоты).
Достоинством данного набора является применение моноклональных антител, однако они были получены ранее 2011 года (период, когда появился штамм «О/Эфиопия/2011», с 2011 года он стал использоваться в качестве производственного штамма) и не могут с высокой достоверностью и точностью детектировать специфические антитела в сыворотках крови животных. Специфичность и чувствительность указанной тест-системы для выявления антител против вируса ящура генотипа О/ЕА-3 не выше 32%, что подтверждают данные реакции микронейтрализации в чувствительной перевиваемой монослойной клеточной линии почки свиньи IB-RS-2. Таким образом, применяемая тест-система не позволяет получать точных результатов именно в отношении изолятов и штаммов вируса ящура генотипа О/ЕА-3.
Наиболее близким прототипом для разработанной нами тест-системы является тест-система PrioCHECK [12] (Prionics Lelystad B.V., Netherlands) для выявления антител к вирусу ящура типа О.
Комплектующие для соответствующего набора представлены ниже:
Компонент 1 - Планшеты иммунологические.
Компонент 2 - Конъюгат (30х). Разбавленный конъюгат не стабилен, готовят непосредственно перед применением.
Компонент 3 - Буфер для разведения (5х).
Компонент 4 - Неиммунная сыворотка крови лошади.
Компонент 5 - Деминерализованная вода.
Компонент 6 - Промывочный буфер (200х).
Компонент 7 - Референтная сыворотка 1 (позитивная) (жидкая).
Компонент 8 - Референтная сыворотка 2 (менее позитивная) (жидкая).
Компонент 9 - Референтная сыворотка 3 (еще менее позитивная) (жидкая).
Компонент 10 - Референтная сыворотка 4 (отрицательный контроль) (жидкая).
Компонент 11 - Субстрат хромогена (ТМВ).
Компонент 12 - Стоп-раствор (1 N раствор серной кислоты). Данные отражены в инструкции производителя.
Диагностикум удобен в применении и позволяет за 5-6 ч получить результаты исследования. Данная тест-система включает в себя конъюгат, который представляет собой меченые моноклональные антитела против вируса ящура серотипа О, исходя из этого является типоспецифичной, но без более узкой дифференциации. Разработана прототипная тест-система в конце 90-гг XX в. и получены соответствующие антитела против антигенов вируса ящура различных генотипов, созданных с использованием изолятов, кроме активно циркулирующего с 2011 г. генотипа О/ЕА-3. Изоляты и штаммы данной линии имеют существенные отличия от других линий серотипа О. Анализируя нуклеотидную и аминокислотную последовательность высоковариабельного пептида вируса ящура VP1, ученые пришли к выводу о наличии достаточного количества существенных замен, позволяющих отнести вирус к иному генотипу. Исходя из выше отраженного, прототипная тест-система не является высокочувствительной и специфичной по отношению к вирусу ящура генотипа О/ЕА-3. Данная тест-система выявляет антитела к данному генотипу не более чем на 34%. Исходя из этого, требуется разработать высокочувствительную, специфичную тест-систему для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа.
Прототипная тест-система основана на твердофазном конкурентном «сэндвич»-варианте ИФА, однако эта форма хоть и является одним из вариантов серологических реакций, но при этом значительно отдалена по пространственным преимуществам связывания антигена и антител в отличие от реакции микронейтрализации.
Прототипный вариант предполагает наличие в своем составе нативных контрольных сывороток крови животных, что снижает сохранность компонентов тест-системы в течение длительного периода времени и есть риск контаминации микроорганизмами.
Прототипный вариант имеет также некоторое ограничение в применении, а именно, рабочий раствор конъюгата не стабилен и быстро разрушается. В составе набора он представлен в виде 30-кратного концентрата. В таком состоянии в отличие от лиофилизированного компонента срок хранения заметно сокращается. Следует также отметить, что данная тест-система не предусматривает контроля конъюгата, что не позволяет получать более достоверные данные по оптическим плотностям и титру антител против вируса ящура.
В прототипной тест-системе применяется прямой конъюгат, что удобно в применении, однако при этом повышается вероятность шумовых фоновых явлений, что может негативно отражаться на конечных результатах количественного исследования сывороток крови животных.
В прототипной тест-системе для проявления цветной реакции используют краситель ТМВ, который обладает канцерогенными свойствами.
Учитывая найденные ограничения в применении имеющихся тест-систем, в том числе прототипной, для проведения точного анализа гуморального иммунитета животных после инокуляции противоящурными вакцинами, содержащими инактивированный вирус ящура штамма
«О №2241/Эфиопия/2011» генотипа О/ЕА-3, актуальной является разработка серологической тест-системы для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа с учетом выше приведенных недостатков.
На сегодняшний день с помощью жидкофазного блокирующего «сэндвич»-варианта ИФА с особенностями проведения реакции и определенным составом компонентов реакции разработаны «Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма А №2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации», «Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма О №2047/Саудовская Аравия/2008 генотипа О/МЕ-SA/PanAsia2 в сыворотках крови животных после иммунизации» и «Способ быстрого количественного определения уровня гуморального иммунитета животных к штамму О №2311/Забайкальский/2016 генотипа O/ME-SA/Ind-2001 вируса ящура после вакцинации с помощью жидкофазного «сэндвич»-варианта ИФА» [13-15].
При этом в настоящее время ветеринарная служба Российской Федерации не располагает современной отечественной тест-системой ИФА, которая позволила бы с высокой достоверностью осуществлять количественную детекцию антител против 146S компонента вируса ящура генотипа О/ЕА-3, используемого в вакцинных препаратах.
Целью изобретения является создание тест-системы для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа.
Поставленная цель достигается тем, что предлагаемая тест-система содержит следующие иммуноспецифические компоненты:
1) культуральный лиофилизированный 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3;
2) сенсибилизирующие антитела - лиофилизированные иммуноглобулины G кролика против 146S компонента вируса ящура «О №2241/Эфиопия/2011» генотипа О/ЕА-3;
3) детекторные антитела - лиофилизированные иммуноглобулины G морской свинки против 146S компопнента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3;
4) контроль 1 - лиофилизированная положительная сыворотка крови телят к 146S компоненту вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 с процентом ингибиции >80%;
5) контроль 2 - лиофилизированная положительная сыворотка крови телят к 146S компоненту вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 с процентом ингибиции от 50% до 80%;
6) контроль 3 - лиофилизированная сыворотка крови телят, не содержащая антитела к антигену вирусу ящура - отрицательный контроль;
7) лиофилизированный 1%-ный бычий сывороточный альбумин для блокирования открытых сайтов связывания на дне лунок планшета;
8) антивидовой конъюгат - лиофилизированные иммуноглобулины кролика против Ig G морской свинки, конъюгированные с пероксидазой хрена.
Предлагаемая тест-система содержит также неспецифические компоненты: карбонатно-бикарбонатный буфер (рН 9,5-9,7) для разведения антигена, 20-кратный концентрат буферного раствора, хромогенный субстрат - ABTS+, «стоп»-раствор - 0,8%-ный раствор лаурилсульфата натрия.
Цель достигается благодаря тому, что метод жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА наиболее приближен к классической РМН в естественных условиях, поскольку 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011 » генотипа О/ЕА-3 находится в свободном состоянии в жидкой фазе, открыт для связывания со специфическими сенсибилизирующими и детекторными антителами.
Реакция основана на взаимодействии исследуемой сыворотки крови животного и инактивированного вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 в жидкой фазе в лунках кругло донного планшета с образованием иммунных комплексов. Параллельно с этим проводится сенсибилизация лунок плоскодонного планшета иммуноглобулинами G кролика против 146S компонента вируса ящура того же генотипа.
После этого сенсибилизированные лунки блокируют с помощью 1%-ного бычьего сывороточного альбумина, добавляют полученные иммунные комплексы из круглодонного планшета, инкубируют, вносят восстановленную суспензию детекторных антител. Образовавшийся сложный иммунный комплекс выявляют с помощью антител против иммуноглобулинов G морской свинки, конъюгированных с пероксидазой хрена и хромогенного субстрата.
Технический результат от изобретения заключается в разработке высокоспецифической и чувствительной тест-системы, предназначенной для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа, вследствие применения инактивированного 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 и при получении специфических компонентов реакции в жидкой фазе.
В состав разработанной тест-системы входят следующие иммуноспецифические компоненты:
1. культуральный лиофилизированный 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 - 1 флакон (0,5 см3);
2. сенсибилизирующие лиофилизированные антитела - иммуноглобулины G кролика против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 - 1 флакон (0,5 см3);
3. детекторные лиофилизированные антитела - иммуноглобулины G морской свинки против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 - 1 флакон (0,5 см3);
4. контроль 1 - положительная лиофилизированная сыворотка крови крупного рогатого скота к 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, с процентом ингибиции >70% -1 флакон (0,2 см3);
5. контроль 2 - положительная лиофилизированная сыворотка крови крупного рогатого скота к 146S компоненту вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, с процентом ингибиции от 50% до 70% - 1 флакон (0,2 см3);
6. контроль 3 - нормальная лиофилизированная сыворотка крови крупного рогатого скота, не содержащая антител к антигену вируса ящура - 1 флакон (0,2 см3);
7. 1%-ный бычий сывороточный альбумин лиофилизированный для блокирования открытых сайтов связывания на дне лунок планшета - 2 флакона (по 4,0 см3);
8. антивидовой лиофилизированный конъюгат - иммуноглобулины кролика против IgG морской свинки, конъюгированные с пероксидазой хрена -1 флакон (0,5 см3).
Предлагаемая тест-система также содержит неспецифические компоненты:
9. карбонатно-бикарбонатный буфер (рН 9,5-9,7) для разведения антигена;
10. 20-кратный концентрат буферного раствора;
11. хромогенный субстрат - ABTS+;
12. «стоп»-раствор - 0,8%-ный раствор лаурилсульфата натрия.
В состав тест-системы входят 3 иммунологических 96-луночных плоскодонных полистироловых планшета для проведения ИФА и 3 полимерных 96-луночных круглодонных планшетов для проведения реакции в жидкой фазе.
В отличии от прототипа в разработанной тест-системе применяется культуральный инактивированный 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, который представлен в виде лиофилизированной суспензии. Данный факт дает возможность выявлять именно антитела против 146S компонента вируса ящура указанного генотипа с высокими показателями чувствительности (более 99,7%) и специфичности (99,9%), что более чем на 46% выше по сравнению с наиболее близким прототипом. Кроме того, лиофилизированный компонент остается стабильным не менее 4 лет по сравнению с антигеном в нативном состоянии, что является преимуществом в использовании данной тест-системы. Активность полученного 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 составляет 1:5000.
В отличии от прототипа применяются сенсибилизирующие и детекторные антитела кролика и морской свинки, соответственно, высокоспецифичные по отношению к 146S компоненту вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, поскольку были получены с применением высокоочищенного 146S компонента с высокой активностью. Указанные в тест-системе ИФА иммуноглобулины G кролика и морской свинки против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 представлены в виде лиофильного компонента, что позволяет антителам находится в стабильном состоянии не менее 4 лет с активностью не менее 1:9000 и 1:5000, соответственно.
В отличии от прототипа сыворотки крови КРС, контроль 1 и 2, получены против высокоочищенного инактивированного 146S вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, что позволяет достичь высокой специфичности и чувствительности при контроле работы тест-системы. Указанные компоненты представлены в виде лиофилизата, что позволяет хранить их не менее 4 лет с сохранением высокой активности в ИФА. Для контроля 1 активность составляет не менее 1:5000, для контроля 2 - не менее 1:5000.
В отличие от прототипа для блокирования открытых сайтов связывания применяется 1%-ный бычий сывороточный альбумин, белковые составляющие которой обеспечивают полное закрытие открытых участков на дне иммунологического планшета. Данный компонент также представлен в лиофильном виде, что позволяет хранить его в данном состоянии не менее 4 лет.
В отличии от прототипного варианта представленная тест-система предусматривает контроль антигена и конъюгата, что дает возможность учитывать фоновые значения и, тем самым, получать достоверные абсолютные данные по экстинкции и значению титра антител против 146S компонента вируса ящура генотипа О/ЕА-3.
В отличии от прототипа в предложенной тест-системе применяется непрямой конъюгат, что позволяет снижать вероятность шумовых фоновых явлений и получать более достоверные результаты определения титра антител против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 в сыворотках крови животных. Активность конъюгата составляет 1:3000.
Сущность изобретения отражена на графических изображениях:
Фиг. 1 - Филогенетическая принадлежность штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 вируса ящура.
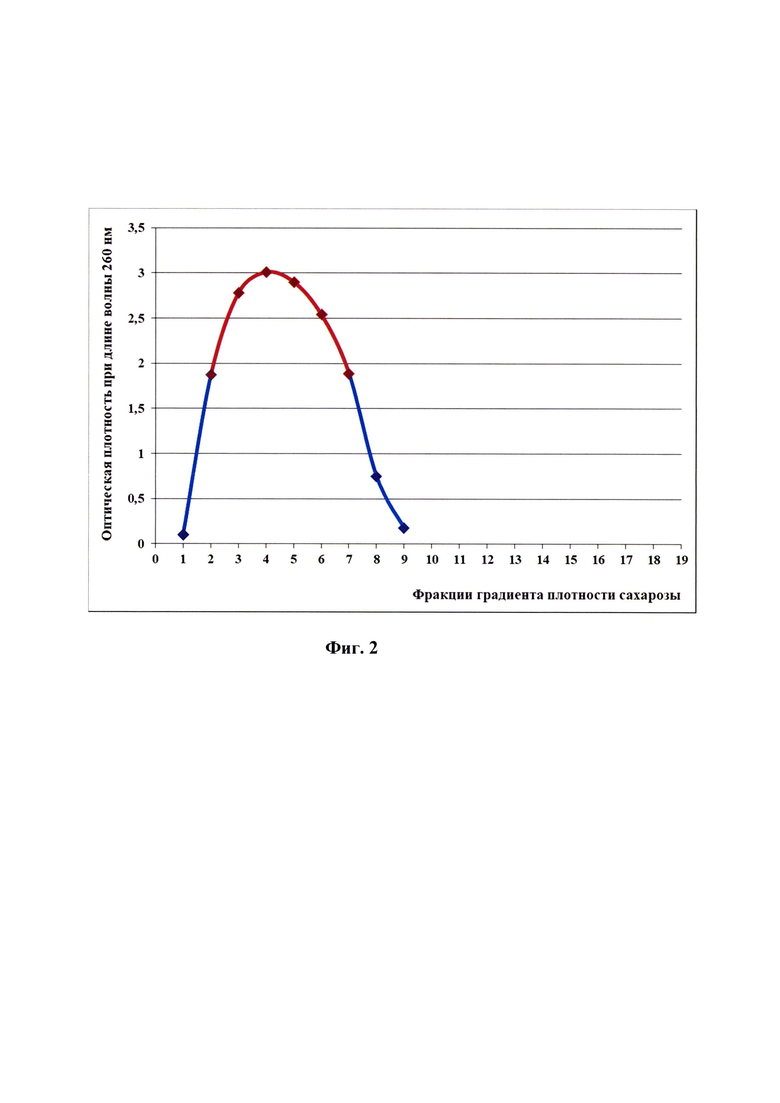
Фиг. 2 - Спектральный профиль фракций 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3.
Фиг. 3 - Электрофореграмма для 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 в 12% полиакриламидном геле.
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 1 представляет последовательность нуклеотидов ID-гена штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 вируса ящура;
SEQ ID NO:2 представляет последовательность аминокислот белка VP1 штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 вируса ящура.
Разработанная тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА основана на специфическом блокировании антигена вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 антителами, содержащимися в исследуемой пробе сыворотки в жидкой фазе. Смесь «исследуемая сыворотка/антиген» переносится в лунки планшета, предварительно иммобилизованного сенсибилизирующими антителами кролика против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3.
Наличие антител к 146S компонента вируса ящура генотипа О/ЕА-3 в исследуемой пробе будет выражаться в формировании иммунного комплекса и уменьшении количества свободного антигена, который связывается сенсибилизирующими антителами. Фиксированный в лунках антиген взаимодействует с детекторными антителами морской свинки, которые выявляются в реакции с иммунопероксидазным конъюгатом против IgG морской свинки и последующим окрашиванием с помощью субстрата ABTS+. Интенсивность окрашивания обратно пропорциональна концентрации специфических антител в исследуемой пробе. Интенсивность цветной реакции учитывают с помощью спектрометра.
Перед началом работы лиофилизированные препараты (антигена - 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, конъюгат, положительные и отрицательный контроли, 1%-ный бычий сывороточный альбумин) восстанавливают до необходимого объема дистиллированной водой.
Проводят приготовление рабочих растворов.
Раствор №1 (карбонатно-бикарбонатный буфер - КББ). Готовят по стандартной методике 100 мл КББ раствора (рН 9,5-9,7) для сенсибилизации планшетов.
Раствор №2 (промывочный раствор). Раствор используется для приготовления рабочего раствора для межэтапной промывки планшетов и подготовки проб для исследования, а так же как основа для приготовления рабочего буферного раствора для разведения детекторных антител и иммунопероксидазного конъюгата. Готовят 2 л стандартного буферного раствора TBS с добавлением 0,05% Tween-20 (рН 7,4-7,6).
Раствор №3 (буфер для восстановления антител и конъюгата). Рабочий буферный раствор для разведения детекторных антител и иммунопероксидазного конъюгата (рН 7,4-7,6) готовится из раствора №2 с добавлением 1% бычьего сывороточного альбумина. Для этого к 36 см3 раствора №2 следует добавить 4,0 см3 бычьего сывороточного альбумина, восстановленной из лиофилизированного препарата с помощью дистиллированной воды. Готовится непосредственно перед использованием.
Этапы проведения реакции для предлагаемого изобретения представлены ниже.
1. Сенсибилизация планшетов. Восстановленную суспензию сенсибилизирующих антител готовят в разведении 1:10000 в растворе №1 (карбонатно-бикарбонатный буферный раствор). Во все лунки иммунологического полистиролового 96-луночного планшета для ИФА вносят по 100 мкл суспензии сенсибилизирующих антител, накрывают крышкой и инкубируют в течение 18-20 часов при температуре (2-8)°С.
2. Промывание лунок планшета осуществляют с использованием Washer любой марки, либо вручную раствором №2. Процедуру повторяют два раза.
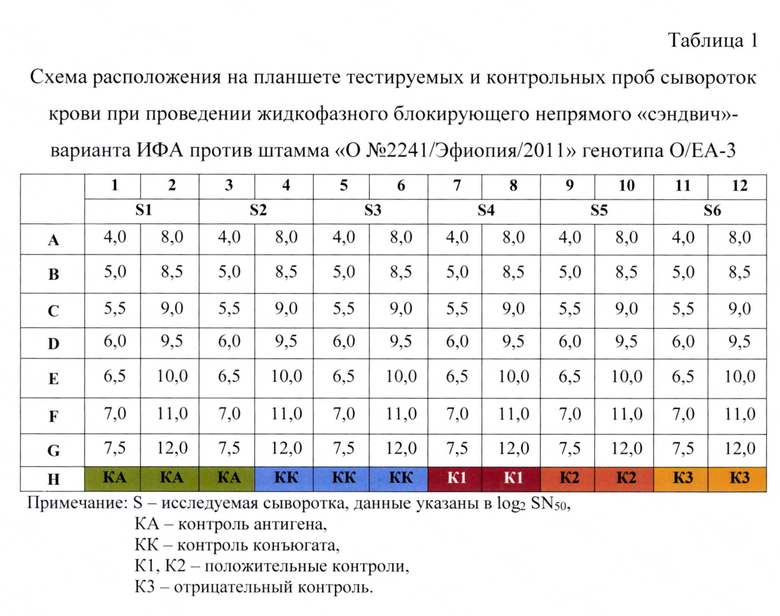
3. Серологическая реакция в жидкой фазе. Параллельно с сенсибилизацией планшета проводят иммунную реакцию связывания антигена с испытуемыми и контрольными пробами сыворотки крови. Готовят следующие разведения сывороток крови животных: 4,0; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0: 9,5; 10,0; 11,0; 12,0 log2 SN50 (1:16-1:4096) в растворе №2. Для этого во все лунки полимерного планшета за исключением лунок HI-6, которые оставляют для контроля антигена (КА) и контроля конъюгата (КК), вносят по 0,047 см3 (47 мкл) буферного раствора и 0,003 см3 (3 мкл) пробы. В лунки HI-6 вносят по 0,05 см3 (50 мкл) буферного раствора. Испытуемые и контрольные пробы располагают на планшете согласно таблице 1.
В качестве контроля 1 используют положительную сыворотку крови свиней против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 - процент ингибиции больше 80%, контроля 2 - положительную сыворотку крови свиней против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 - процент ингибиции 50-80%, контроля 3 - нормальную сыворотку свиней - процент ингибиции меньше 50%.
Во все лунки планшета добавляют по 0,05 см3 рабочего разведения антигена (146S компонент) в растворе №2 в соответствии с разведением 1:5000. После перемешивания содержимого лунок планшета при помощи шейкера или легким встряхиванием вручную планшет закрывают крышкой и инкубируют в течение 18-20 часов при температуре (2-8)°С.
4. Улавливание антигена. В промытые лунки сенсибилизированного планшета вносят по 0,05 см3 смеси контрольных и испытуемых проб и антигена, планшет закрывают крышкой и инкубируют в течение 60±5 мин при температуре (37±0,5)°С.
5. Промывание лунок планшета. Проводят, как представлено выше (п.2). Процедуру повторяют 4 раза.
6. Внесение детекторных антител. Во все лунки планшета, за исключением лунок с КК (контроль конъюгата), куда добавляют по 0,05 см3 раствора №3, вносят по 0,05 см3 рабочего разведения детекторных антител (1:5000) в растворе №3. Планшет накрывают крышкой и инкубируют в течение 60±5 мин при температуре (37±0,5)°С.
7. Промывание лунок планшета. Проводят, как представлено выше (п. 2). Процедуру повторяют 4 раза.
8. Внесение конъюгата. Во все лунки планшета вносят по 0,05 см3 рабочего разведения конъюгата (1:2000) в растворе №3. Планшет накрывают крышкой и инкубируют в течение 60±5 мин при температуре (37±0,5)°С.
9. Промывание лунок планшета. Проводят, как представлено выше (п. 2). Процедуру повторяют 4 раза.
10. Проявление цветной реакции. Во все лунки планшета вносят по 0,05 см3 субстрата ABTS+, закрывают крышкой и выдерживают 15 минут при температуре (18-23)°С.
11. Остановка реакции. Реакцию останавливают добавлением в каждую лунку планшета 0,05 см3 0,8% раствора лаурилсульфата натрия.
12. Учет результатов ИФА. Сразу после остановки реакции измеряют значение экстинкции (Е) продуктов реакции в каждой лунке при длине волны 415 нм, используя спектрофотометр для микропланшетов с вертикальным лучом света. Значения Е контрольных и исследуемых проб переводят в значение процента ингибиции (PI, %) по формуле:
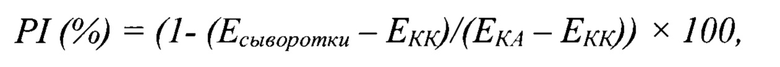
где Есыворотки - среднее значение оптической плотности смеси сыворотки с инактивированным 146S компонентом вируса ящура генотипа О/ЕА-3;
EKA - среднее значение оптической плотности контроля антигена (146S компонента);
ЕКК - среднее значение оптической плотности контроля конъюгата.
Результаты реакции достоверны в том случае, если данные удовлетворяют следующим критериям:
- разница между значениями ЕКА и ЕКК не менее 0,35 оптических единиц (о.е.);
- контроль 1 имеет значение PI >70%;
- контроль 2 имеет значение PI в пределах 50-80%;
- контроль 3 имеет значение PI <50%.
Исходя из полученных данных берут последнее разведение сыворотки, для которого процент ингибиции составляет >50%. Такое разведение считают титром антител против 146S компонента вируса ящура, вызванного генотипом О/ЕА-3.
В результате проведенных экспериментов были оптимизированы условия постановки реакции. Активность детекторных антител, определенная в непрямом варианте ИФА, составила 1:5000, антивидового конъюгата - 1:3000; сенсибилизирующих антител - 1:9000, антигена (146S компонент) вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 - 1:5000, контроля 1 -1:5000, контроля 2 - 1:5000, контроля 3 - 1:5000.
С использованием разработанной тест-системы проведено исследование образцов сывороток крови животных с определением титра антител и проведен сравнительный анализ с результатами реакции микронейтрализации в чувствительной перевиваемой монослойной клеточной линии почки свиньи (IB-RS-2) [1].
Разработанная тест-система позволяет тестировать одновременно в формате 96-луночного планшета 6 проб сывороток в следующих разведениях, выраженных в двоичном логарифме: 4,0; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0: 9,5; 10,0; 11,0; 12,0 log2 (1:16-1:4096).
В качестве рабочего антигена применяли инактивированный 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3.
Контроль штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 вируса ящура на специфичность. Специфичность штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 определена с помощью ОТ-ГГЦР с последующим секвенированием ID-гена, соответствующего белку VP1, отвечающему за изменчивость вируса ящура. По результатам исследования нуклеотидной последовательности указанного гена была выявлена принадлежность штамма «О №2241/Эфиопия/2011» к генотипу О/ЕА-3. Расчет проводился в соответствии с Байесовской теорией вероятности. Специфичность подтверждена также в реакции связывания комплемента со штаммоспецифической сывороткой.
Концентрация общего вирусного белка в исследуемом антигене вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 составила 3,56 мкг/мл, концентрация 146S компонента - 2,63 мкг/мл, 146S+75S компонента -3,42 мкг/мл, 12S - 0,14 мкг/мл.
Экспериментально подтверждена возможность использования штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 вируса ящура для контроля антигенной и иммуногенной активности, а также для изготовления биопрепаратов для диагностики и специфической профилактики ящура типа О.
Морфологические признаки
Штамм «О №2241/Эфиопия/2011» вируса ящура серотипа О относится к отряду Picornavirales, семейству Picornaviridae, роду Aphthovirus, виду Foot-and-Mouth Disease virus и обладает морфологическими признаками, характерными для возбудителя ящура: форма вириона иксаэдрическая, размер 24 нм. Вирион состоит из молекулы одноцепочечной положительно заряженной молекулы РНК и 60 копий полипептида, каждый из которых представлен белками VP4, VP2, VP3, VP1.
Антигенные свойства
По антигенным свойствам штамм «О №2241/Эфиопия/2011» вируса ящура относится к серотипу О. Вирус стабильно нейтрализуется гомологичной антисывороткой. У переболевших животных в сыворотке крови образуются типоспецифические антитела, выявляемые в иммуноферментном анализе (ИФА) и реакции микронейтрализации (РМН).
Методом нуклеотидного секвенирования была определена первичная структура ID-гена белка VP1 штамма «О №2241/Эфиопия/2011» вируса ящура. Сравнительный анализ нуклеотидных последовательностей показал, что штамм «О №2241/Эфиопия/2011» вируса ящура принадлежит к генотипу О/ЕА-3 (Фиг. 1).
Антигенное родство (r1 штамма «О №2241/Эфиопия/2011» вируса ящура изучено в РМН, в перекрестном исследовании штамма со специфическими сыворотками, полученными на производственные штаммы вируса ящур.
Титр референтных сывороток крови КРС, полученных путем иммунизации животных моновалентными вакцинами из производственных штаммов вируса ящура серотипа О, против 102 ТЦД50 гомологичного и гетерологичного вируса определяли в РМН при перекрестном титровании, рассчитывая значения с использованием уравнения линейной регрессии, и выражали в lg. Значение r1 определяли, как антилогарифм разности lg титров сыворотки против гетерологичного и гомологичного вируса [1, 4].
Значение r1 РМН интерпретировали следующим образом:
при ≥0,3 - исследуемый и производственный штаммы вируса ящура являются родственными;
при ≤0,3 - исследуемый образец штамма вируса ящура значительно отличается от производственного штамма.
Максимальное родство отмечается при значении r1 РМН, стремящимся к 1,0.
Показатели антигенного родства при изучении штамма «О №2241/Эфиопия/2011» составили r1от 0,05 до 0,19, что свидетельствует об отсутствии явного антигенного родства с производственными штаммами вируса ящура серотипа О, а именно для штамма «О/Тайвань/1997» (генотип O/CATHAY/CAM 94) - 0,05, штамма «О/Приморский/2014» (генотип O/SEA/Mya-98) - 0,10, штамма «О/Приморский/2012» (генотип О/МЕ-SA/PanAsia) - 0,14, штамма «О/Саудовская Аравия/2008» (генотип О/МЕ-SA/PanAsia2) - 0,12, штамма «О/Оренбургский/2021» (генотип O/ME-SA/Ind-2001е)-0,19.
Полученные данные свидетельствуют об отсутствии антигенного родства с производственными штаммами вируса ящура серотипа О.
Гено- и хемотаксономическая характеристики
Штамм «О №2241/Эфиопия/2011» вируса ящура является РНК(+)-содержащим вирусом с молекулярной массой 8,08×106Д. Нуклеиновая кислота представлена одноцепочной линейной молекулой молекулярной массой 2,8×106 Д. Вирион имеет белковую оболочку, состоящую из четырех основных белков VP1, VP2, VP3 и VP4. Липопротеидная оболочка отсутствует.
Основным антигенным белком является VP1. В вирионе содержится приблизительно 31,5% РНК и 68,5%) белка. Вирусная РНК является инфекционной и участвует в образовании белков-предшественников в инфицированных клетках. Предшественники, в свою очередь, расщепляются с образованием более стабильных структурных и неструктурных полипептидов вируса.
Физические свойства
Масса вириона составляет 8,4×10-18 г. Плавучая плотность 1,46 г/см3. Устойчивость к внешним факторам
Штамм «О №2241/Эфиопия/2011» вируса ящура устойчив к эфиру, хлороформу, и ацетону. Наиболее стабилен при рН 7,45-7,70. Сдвиги рН в кислую и сильно щелочную сторону ведут к инактивации вируса. Чувствителен к формальдегиду, УФ-облучению, γ-облучению, высоким температурам (выше 38,4°С).
Дополнительные признаки и свойства
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен для парнокопытных животных.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 5 пассажей (срок наблюдения) на перевиваемых культурах.
Биотехнологические характеристики
Штамм «О №2241/Эфиопия/2011» вируса ящура репродуцируется в перевиваемых культурах клеток: почки сибирского горного козерога (ПСГК-30), почки свиньи (IB-RS-2), почки сирийского хомячка (ВНК-21).
Сущность изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Получение инактивированного 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3.
Для получения инактивированного 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 для диагностических целей проводили суспензионное культивирование вируса в клеточной линии ВНК-21 в течение 9-11 ч с получением вирусной суспензии с титром инфекционной активности не ниже 7,0 lg ТЦД50/см3. Полученную вирусную суспензию инактивировали с помощью аминоэтилэтиленимина и осветляли с применением полигексаметиленгуанидина.
Инактивированную культуральную суспензию, содержащую 146S компонент вируса ящура, осветляли в течение 30 мин при 6000 об/мин и температуре 4±2°С. Надосадочную жидкость отбирали и добавляли в нее полиэтиленгликоль с молекулярным весом 6000 Д (ПЭГ-6000) до конечной концентрации 8% и хлорида натрия (сухой) до конечной концентрации 0,85%, интенсивно перемешивали и выдерживали при температуре 2,0±0,5°С в течение 24 часов. Вирусную суспензию осаждали при 6000 об/мин в течение 60 мин, осадок растворяли в 1/15 М фосфатно-солевом буферном растворе (ФСБ), концентрируя в 600 раз (1/600 от первоначального объема).
К полученному преципитату добавляли 50% хлороформа, интенсивно перемешивали и фракционировали с помощью центрифуги в течение 30 мин. при 3000 об/мин. Отбирали верхнюю водную фракцию, содержащую 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3. Отбирали 100 мкл образца для последующего электрофоретического анализа в 12% полиакриламидном геле.
Перед помещением в градиент сахарозы антиген вируса ящура обрабатывали NP-40 в концентрации 1,5%.
Для выделения 146S компонента готовили линейный градиент сахарозы с концентрациями 10, 20, 30, 40, 50%. Обработанный с помощью NP-40 антиген вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 наливали по 15 мл в центрифужные пробирки, затем последовательно подслаивали растворы сахарозы. Пробирки помещали в металлические центрифужные стаканы и после тщательно выполненного уравновешивания центрифугировали при скорости 25000 об/мин и температуре 2,0±0,2°С в течение 3,5 часов. Фракционирование градиента сахарозы производили с помощью перистальтического насоса, отбирая фракции по 1 мл в отдельные пробирки. Начало и конец пика 146S компонента определяли по спектральному профилю, объединяя фракции, входящие в этот диапазон.
При использовании перистальтического насоса сначала визуально оценивали пробирку с градиентом сахарозы. Опалесцирующий слой, содержащий 146S компонент, располагается приблизительно в 30%-м слое сахарозы. В этом случае отбирали последнюю верхнюю фракцию 50%-ного слоя, все фракции 30%-ного слоя и нижнюю фракцию 20%-ного слоя сахарозы. 146S компонент переосаждали с помощью ультрацентрифугирования в течение 4 часов при скорости 25000 об/мин и температуре 2±0,5°С и ресуспендировали осадок в 1/15 М фосфатно-солевом буферном растворе.
Результаты спектрометрического исследования полученных фракций антигена вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 в виде антигенного профиля представлены на фиг. 2. Проведен электрофорез в 12% полиакриламидном геле в денатурирующих условиях, в которых находится 146S компонент вируса ящура данного штамма (фиг. 3).
Пример 2. Получение гипериммунной сыворотки крови кроликов (сенсибилизирующие антитела) против 146S компонента вируса ящура генотипа О/ЕА-3.
Для получения специфических сывороток крови против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 применяли клинически здоровых кроликов средней упитанности массой 2,5-3,0 кг.
Для гипериммунизации животных применяли концентрированный очищенный инактивированный 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, полученный как описано в примере 1, из которого готовили эмульсию с использованием масляного адъюванта Montanide ISA-71R VG (в соотношении адъювант/антиген=70/30 по массе). Полученную вакцину вводили в мышцу задних конечностей кролика на 0, 21 и 42 дни в объеме 0,5 см3. Через 7 дней после последней иммунизации кроликов тотально обескровливали и получали сыворотку крови - содержащую сенсибилизирующие антитела, которую лиофильно высушивали и хранили при температуре 4-8°С.
Пример 3. Получение гипериммунной сыворотки крови морских свинок (детекторные антитела) против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3.
Для гипериммунизации морских свинок использовали эмульсию очищенного препарата концентрированного инактивированного 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3, полученного как описано в примере 1. Приготовление вакцины и схема иммунизации такая, как в примере 2.
Пример 4. Определение активности 146S компонента вируса ящура генотипа О/ЕА-3, сенсибилизирующих и детекторных антител.
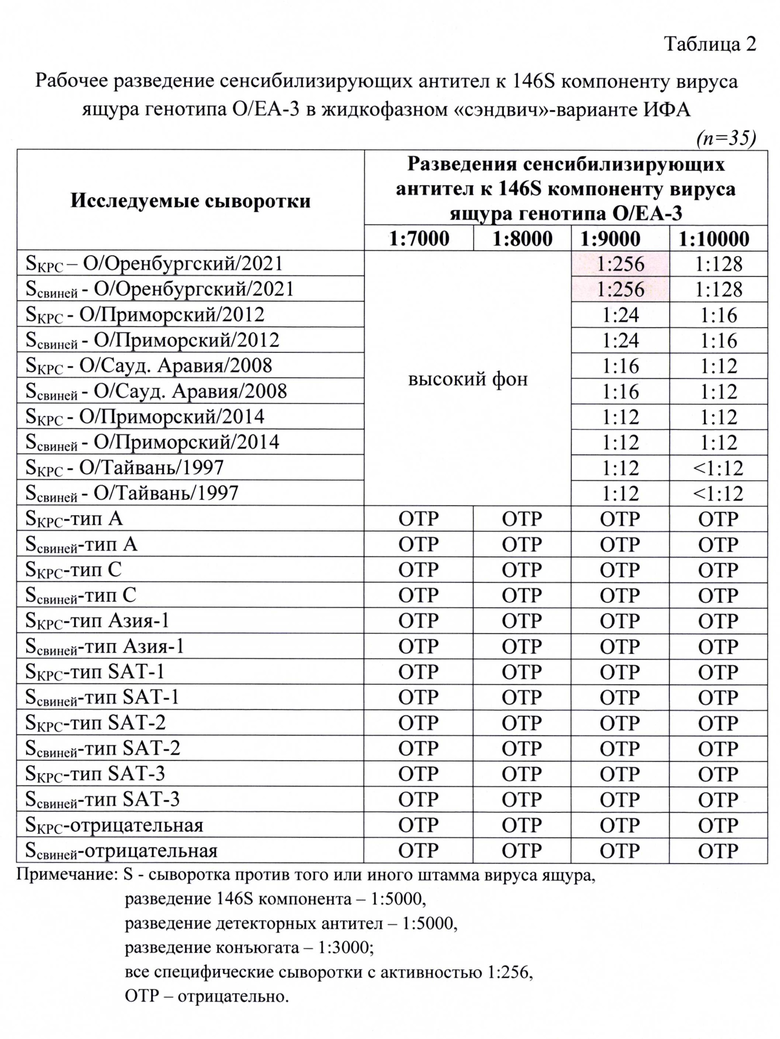
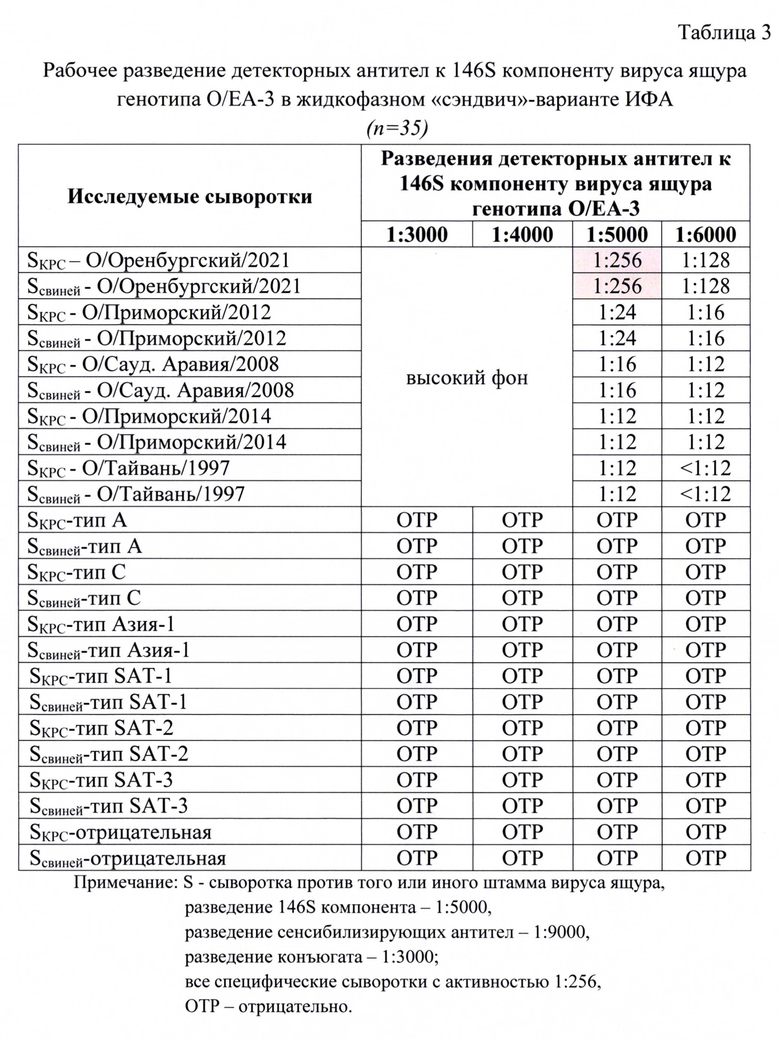
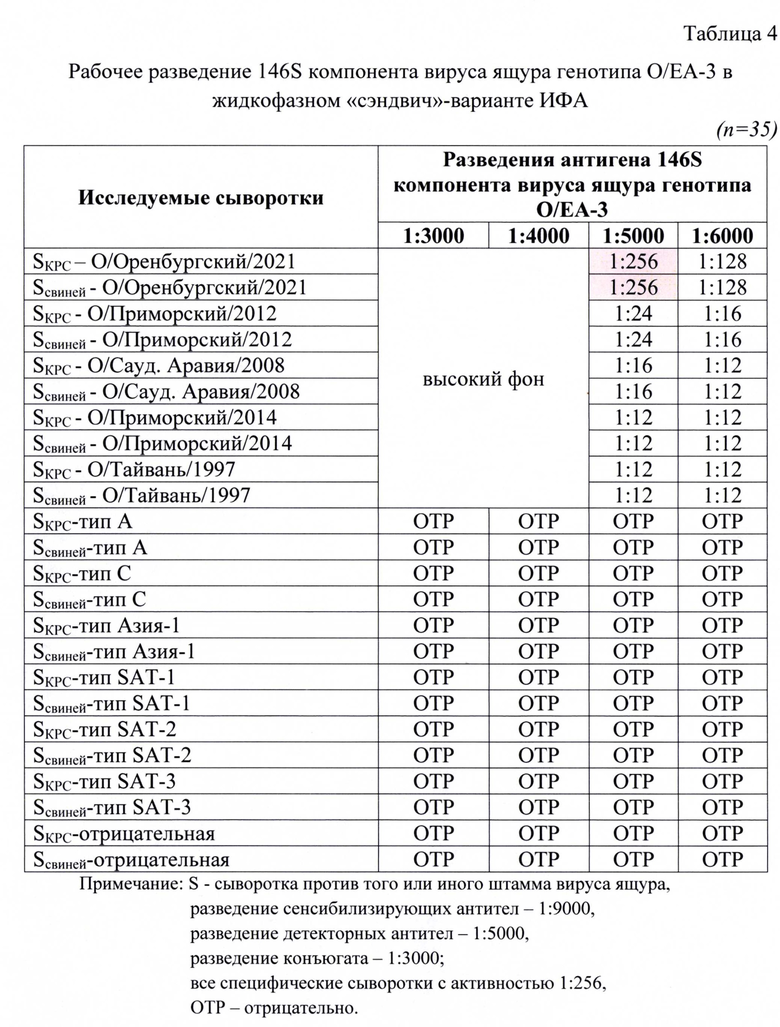
Индивидуальные пробы сывороток проверяли на активность и специфичность в жидкофазном блокирующем непрямом «сэндвич»-варианте ИФА. Был проведен подбор оптимальных рабочих разведений указанных компонентов для получения достоверных результатов в ИФА. Полученные данные анализа представлены в таблицах 2, 3, 4.
Для анализа исследовали следующие разведения сенсибилизирующих антител: 1:7000, 1:8000, 1:9000, 1:10000. Разведения остальных компонентов были постоянны: для антигена - 1:5000, для детекторных антител - 1:5000, конъюгата - 1:3000. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к 146S компоненту определенных штаммов вируса ящура с активностью 1:256. Их таблицы 2 следует, что при разведении сенсибилизирующих антител 1:9000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведений антител наблюдали высокие фоновые значения, что не позволяло получить корректный результат. При большем разведении наблюдали снижение детектируемого значения титра антител в сыворотках крови животных. При исследовании неспецифических и отрицательных сывороток отмечали отрицательные результаты, что свидетельствовало о высокой специфичности разработанной тест-системы.
Для анализа исследовали следующие разведения детекторных антител: 1:3000, 1:4000, 1:5000, 1:6000. Разведения остальных компонентов были постоянны: для антигена - 1:5000, для сенсибилизирующих антител - 1:9000, конъюгата - 1:3000. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 1:256. Их таблицы 3 следует, что при разведении детекторных антител 1:5000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведений антител наблюдали высокие фоновые значения, что не позволяло получить корректный результат. При большем разведении наблюдали снижение детектируемого значения титра антител в сыворотках крови животных. При исследовании неспецифических и отрицательных сывороток отмечали отрицательные результаты, что свидетельствовало о высокой специфичности разработанной тест-системы.
Для анализа исследовали следующие разведения антигена: 1:3000, 1:4000, 1:5000, 1:6000. Разведения остальных компонентов были постоянны: для детекторных антител - 1:5000, для сенсибилизирующих антител - 1:9000, конъюгата - 1:3000. В качестве контрольных сывороток для анализа применяли сыворотки, специфичные к определенным штаммам вируса ящура с активностью 1:256. Их таблицы 4 следует, что при разведении антигена 1:5000 достигалось получение достоверного результата (1:256 или 8,0 log2 SN50). При меньших разведениях наблюдали высокие фоновые значения, что не позволяло получить корректный результат. При большем разведении наблюдали снижение детектируемого значения титра антител в сыворотках крови животных.
При исследовании неспецифических и отрицательных сывороток отмечали отрицательные результаты, что свидетельствовало о высокой специфичности разработанной тест-системы.
Таким образом, в ходе лабораторных исследований доказано, что рабочие разведения 146S компонента вируса ящура генотипа О/ЕА-3, сенсибилизирующих и детекторных антител составили 1:5000, 1:9000, 1:5000, соответственно.
Пример 5. Применение тест-системы для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа.
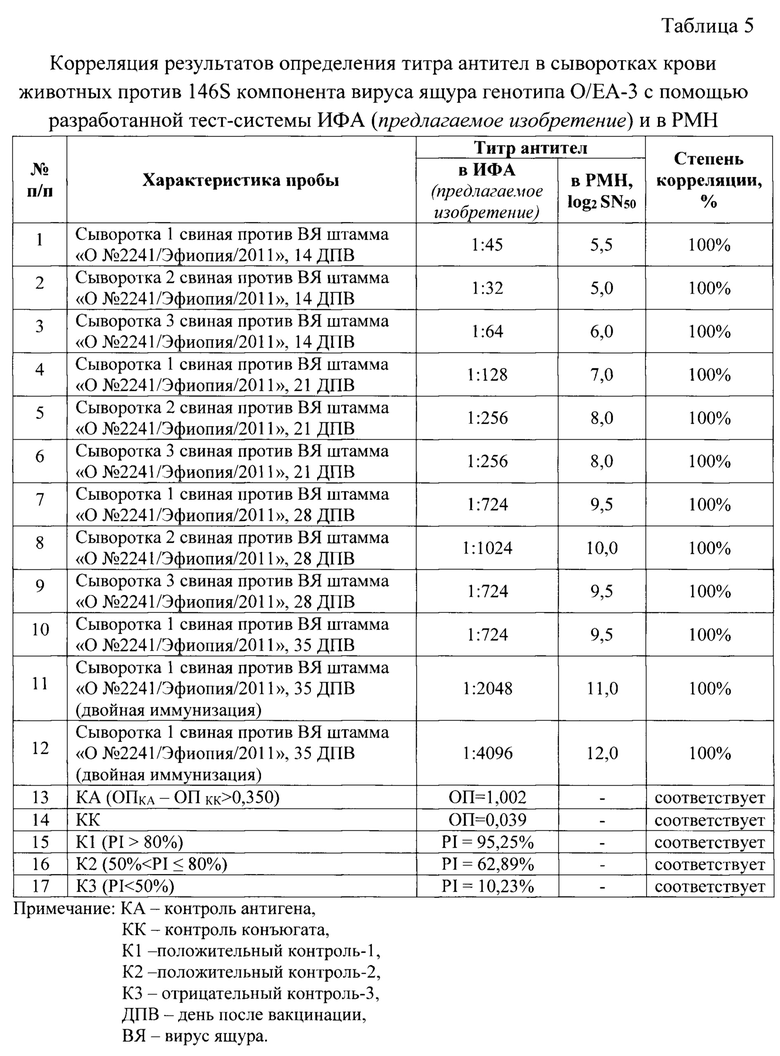
Исследовали 12 сывороток крови животных, полученных после иммунизации инактивированными эмульсионными вакцинами против ящура, содержащими антиген вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3. Определили значения титра специфических антител с применением разработанной тест-системы, а также данные сыворотки были исследованы в реакции микронейтрализации в чувствительной перевиваемой монослойной клеточной линии IB-RS-2, рекомендованной OIE [1]. Полученные результаты отражены в таблице 5, из которой следует, что степень корреляции результатов разработанной тест-системы ИФА (предлагаемое изобретение) и классического метода (РМН - реакция микронейтрализации) высокая.
Пример 6. Определение диагностических показателей разработанной тест-системы для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа.
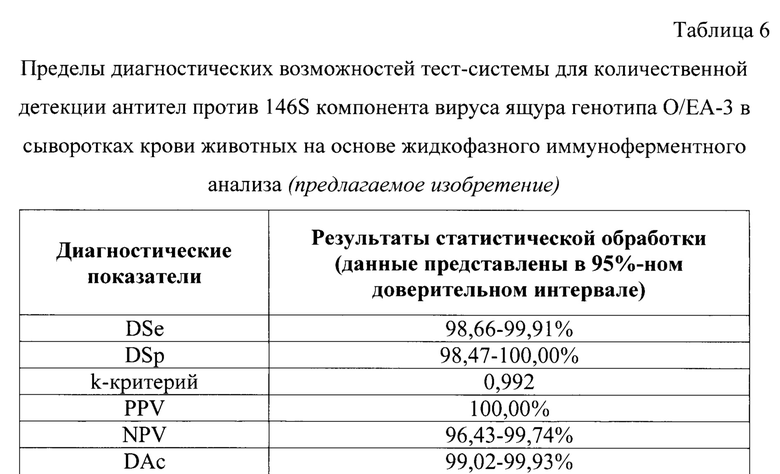
Для исследования представленной тест-системы (предлагаемое изобретение) для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа исследовали стандартные диагностические показатели. Для определения чувствительности предложенной тест-системы анализировали 650 сывороток крови животных, которые являлись заведомо положительными по данным реакции микронейтрализации в чувствительной перевиваемой монослойной клеточной линии почки свиньи IB-RS-2. Титр антител для данных сывороток крови находился в диапазоне 1:32-1:4096 (пробы имеют защитный титр антител по данным OIE (МЭБ) - не менее 1:32). Постановку ИФА проводили, как отражено выше. Разработанной тест-системой (предлагаемое изобретение) определили, что из 650 образцов сывороток крови 647 определены в качестве положительных, а 3 - в качестве отрицательных (определен титр -1:16). Для исследования специфичности метода тестировали 240 отрицательных сывороток крови животных. В результате исследования с помощью ИФА (предлагаемое изобретение) определили, что из 240 отрицательных проб - 240 определены в качестве отрицательных. Пользуясь представленными выше статистическими методами анализа, определили, что в 95%-ном доверительном интервале диагностическая чувствительность (DSe) составила 98,66-99,91%, диагностическая специфичность (DSp) - 98,47-100,00%, k-критерий - 0,992; прогностичность отрицательного результата (NPV) - 96,43-99,74%, общая точность (DAc) - 99,02-99,93 (табл. 6).
Таким образом предлагаемая «Тест-система для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа» является специфичной и чувствительной, позволяющей проводить анализ сывороток крови животных с определением титра антител против 146S компонента вируса ящура генотипа О/ЕА-3, который входит в состав вакцинных препаратов против ящура.
Источники информации
1. OIE. Manual of diagnostic tests and vaccines for terrestrial animals. -Paris, 2018. - Chapter 2.1.8.
2. Anon Global Strategy for control of foot-and-mouth disease. - In, Bangkok, Thailand, - 2012. - P. 27-29.
3. Динамика развития противоящурного гуморального иммунитета у крупного рогатого скота, иммунизированного трехвалентной сорбированной вакциной типов А, О, Азия-1 / Д.В. Михалишин, Т.Н. Лезова // Труды Федерального центра охраны здоровья животных. - Владимир, 2007. - Т. 5. - С. 75-82.
4. Wong C.L., Yong C.Y., Ong Н.K., Но K.L., Tan W.S. Advances in the Diagnosis of Foot-and-Mouth Disease // Front Vet Sci. - 2020 Aug 21. - V.7. - P. 477.
5. Fry E.E., Stuart D.I., Rowlands D.J. The structure of foot-and-mouth disease virus // Curr Top Microbiol Immunol - 2005. - V. 288. - P. 71-101.
6. Cao Y., Lu Z., Sun J., Bai X., Sun P., Bao H., Chen Y., Guo J., Li D., Liu X., Liu Z. Synthesis of empty capsid-like particles of Asia I foot-and-mouth disease virus in insect cells and their immunogenicity in guinea pigs // Vet. Microbiol. - 2009. -V. 137(1-2).-P. 10-17.
7. Hamblin C, Barnett I.T., Hedger R.S. A new enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies against foot-and-mouth disease virus. I. Development and method of ELISA // J. Immunol. Methods. - 1986. -V. 93(1).-P. 115-121.
8. Grubman M.J., Moraes M.P., Diaz-San Segundo F., Pena L., de los Santos T. Evading the host immune response: how foot-and-mouth disease virus has become an effective pathogen // FEMS Immunol Med Microbiol. - 2008. - V. 53(1). - P. 8-17.
9. Ma L.N., Zhang J., Chen H.T., Zhou J.H., Ding Y.Z., Liu Y.S. An overview on ELISA techniques for FMD // Virol J. - 2011 Sep 4. - V. 8. - P. 419.
10. Diagnostic assays developed for the control of foot-and-mouth disease in India / Sharma G.K., Mahajan S., Matura R., Subramaniam S., Ranjan R., Biswal J., Rout M., Mohapatra J.K., Dash B.B., Sanyal A., Pattnaik B. Diagnostic assays developed for the control of foot-and-mouth disease in India // World J Virology. - 2015. - V. 4(3). - P. 295-302.
11. IZSLER ELISA. URL: https://www.fao.org/fileadmin/user_upload/eufmd/docs/Open_Session2012/Appendices/75_New_Elisa_for_diagnosis_Brocchi_.pdf (Дата обращения: 20.02.2023).
12. PrioCHECK ELISA. URL: http://vetprofilab.ru/f/priocheck_fmdv_antibody_elisa_kit_cut.pdf (Дата обращения: 27.01.2023).
13. Патент РФ №2787714, 11.01.2023. Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма А №2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации // Заявка №2022108324.
14. Патент РФ №2791614, 13.03.2023. Тест-система на основе жидкофазного блокирующего непрямого «сэндвич»-варианта ИФА для определения титра антител против вируса ящура штамма О №2047/Саудовская Аравия/2008 генотипа Щ/ME-SA/PanAsia2 в сыворотках крови животных после иммунизации // Заявка №2022119118.
15. Патент РФ №2796393, 23.05.2023. Способ быстрого количественного определения уровня гуморального иммунитета животных к штамму О №2311/Забайкальский/2016 генотипа O/ME-SA/Ind-2001 вируса ящура после вакцинации с помощью жидкофазного «сэндвич»-варианта ИФА // Заявка №2022113420.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="FMDV ELISA O
EA-3.xml" softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2023-06-15">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-06-15</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>512</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-06-15</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin>FGBI "ARRIAH"</ApplicantNameLatin>
<InventorName languageCode="ru">Доронин Максим
Игоревич</InventorName>
<InventorNameLatin>Doronin Maksim Igorevich </InventorNameLatin>
<InventionTitle languageCode="ru">Тест-система для количественной
детекции антител против 146S компонента вируса ящура генотипа O/EA-3
в сыворотках крови животных на основе жидкофазного иммуноферментного
анализа</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>639</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..639</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>accacctccccaggcgaatcggccgaccctgtgactgccaccgtcgaaa
actacggcggtgagacacaggcccagaggcgccaacacacggacgtctcgttcattcttgacagatttgt
gaaggtaacaccaaaagaccaaatcaatgtgctggacttgatgcagacccctgctcacacgctggttgga
gcgctccttcgcactgccacttactacttcgcagatttagaagtggcggtgaaacacgaggggaacctca
catgggtccctaacggagcaccagaatcagctctggacaacaccaccaatccaacagcctaccacaaggc
accacttactagacttgccttgccctacacggcaccacaccgcgtgttggcaaccgtttacaacggaaac
tgcaagtatggtgagacgttggcgtccaacgtgaggggcgatctccaggtgttggcccagaaggcggcga
gaccgctgcccacctctttcaactacggcgccatcaaggctacgcgggtgactgaattgctttaccgcat
gaagagggctgaaacatactgcccacggcccctgttggccgttcacccaagcgaggccaggcacaagcag
aagatagtggcgcctgtgaagcaactcctg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>213</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..213</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FMDV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>TTSPGESADPVTATVENYGGETQAQRRQHTDVSFILDRFVKVTPKDQIN
VLDLMQTPAHTLVGALLRTATYYFADLEVAVKHEGNLTWVPNGAPESALDNTTNPTAYHKAPLTRLALPY
TAPHRVLATVYNGNCKYGETLASNVRGDLQVLAQKAARPLPTSFNYGAIKATRVTELLYRMKRAETYCPR
PLLAVHPSEARHKQKIVAPVKQLL</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для определения титра антител против полных вирусных частиц штамма "О/Кения/2017" вируса ящура с применением жидкофазного "сэндвич"-варианта ИФА | 2023 |
|
RU2821894C1 |
| Тест-система для определения титра антител против структурных белков вируса ящура штамма "А/Танзания/2013" с помощью жидкофазного иммуноферментного анализа | 2023 |
|
RU2818811C1 |
| Тест-система для определения титра антител против 146S частиц вируса ящура генотипа SAT-2/IV с помощью жидкофазного ИФА | 2023 |
|
RU2811996C1 |
| Тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма А N2269/ВНИИЗЖ/2015 генотипа A/ASIA/G-VII в сыворотках крови животных после иммунизации | 2022 |
|
RU2787714C1 |
| Тест-система для выявления антител к структурным белкам вируса ящура штамма "SAT-1/Кения/2017" с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2821044C1 |
| Тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма "О-N2356/Пакистан/2018" генотипа O/ME-SA/PanAsia2 в сыворотках крови животных | 2023 |
|
RU2812210C1 |
| Тест-система для определения титра антител против структурных белков вируса ящура штамма "О N2212/Приморский/2014" генотипа O/SEA/Mya-98 в сыворотках крови животных на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2815540C1 |
| Тест-система для определения титра антител против структурных белков вируса ящура штамма "Азия-1 N 2356/14/2018" с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2812211C1 |
| Тест-система на основе жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА для определения титра антител против вируса ящура штамма О N2047/Саудовская Аравия/2008 генотипа O/ME-SA/PanAsia2 в сыворотках крови животных | 2022 |
|
RU2791614C1 |
| Тест-система для определения уровня антител против антигена вируса ящура генотипа A/ASIA/SEA-97 с помощью жидкофазного блокирующего непрямого "сэндвич"-варианта ИФА | 2023 |
|
RU2804845C1 |

Изобретение относится к области биотехнологии. Описана тест-система для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа. Технический результат изобретения заключается в разработке высокоспецифической и чувствительной тест-системы, предназначенной для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа, вследствие применения инактивированного 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 и при получении специфических компонентов реакции в жидкой фазе. 1 з.п. ф-лы, 3 ил., 6 табл., 6 пр.
1. Тест-система для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в сыворотках крови животных на основе жидкофазного иммуноферментного анализа, содержащая:
- специфические компоненты: культуральный лиофилизированный 146S компонент вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3; сенсибилизирующие антитела - лиофилизированные иммуноглобулины G кролика против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3; детекторные антитела -лиофилизированные иммуноглобулины G морской свинки против 146S компонента вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3; контроль 1 - лиофилизированная положительная сыворотка крови телят к 146S компоненту вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 с процентом ингибиции >80%; контроль 2 - лиофилизированная положительная сыворотка крови телят к 146S компоненту вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 с процентом ингибиции от 50% до 80%; контроль 3 - лиофилизированная сыворотка крови телят, не содержащая антитела к антигену вирусу ящура, - отрицательный контроль; лиофилизированный 1%-ный бычий сывороточный альбумин для блокирования открытых сайтов связывания на дне лунок планшета; антивидовой конъюгат - лиофилизированные иммуноглобулины кролика против Ig G морской свинки, конъюгированные с пероксидазой хрена;
- неспецифические компоненты: карбонатно-бикарбонатный буфер рН 9,5-9,7 для разведения антигена; 20-кратный концентрат буферного раствора; хромогенный субстрат - ABTS+; «стоп»-раствор - 0,8%-ный раствор лаурилсульфата натрия,
отличающаяся тем, что в качестве антигена вируса ящура содержит 146S компонент культурального инактивированного вируса ящура штамма «О №2241/Эфиопия/2011» генотипа О/ЕА-3 и для определения процента ингибиции используется модифицированная формула:
PI (%)=(1- (Есыворотки - ЕКК)/(ЕКА – ЕКК)) × 100, при этом за титр антител принимается наибольшее разведение исследуемой сыворотки крови, для которой значение процента ингибиции составляет ≥50%.
2. Тест-система по п. 1, является специфичной и чувствительной, позволяющей проводить анализ сывороток крови животных для количественной детекции антител против 146S компонента вируса ящура генотипа О/ЕА-3 в расширенном диапазоне титра антител 4,0-12,0 log2 SN50 (1:16-1:4096).
| Способ определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины с применением метода обратной транскрипции-полимеразной цепной реакции в режиме реального времени | 2017 |
|
RU2674076C1 |
| Способ опосредованного определения титра вируса ящура в неинактивированном сырье для вакцины при амплификации вирусной нуклеиновой кислоты и детекции РНК-ампликонов с применением технологии молекулярных биконов | 2020 |
|
RU2756557C1 |
| Доронин М.И., Луговская Н.Н., Михалишин Д.В., Клюкина Н.Д., Оковытая Т.В., Гочмурадов Ы.М | |||
| Подводный аппарат для наблюдения за подводными работами | 1925 |
|
SU2269A1 |
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
Авторы
Даты
2024-04-15—Публикация
2023-08-15—Подача