Изобретение относится к медицине, радиобиологии и биофизике. Дополнительно способ может быть использован в химии, биологии, токсикологии и сельском хозяйстве. Способ регистрирует концентрацию химических и эндогенных радиопротекторов в организме живого млекопитающего (in vivo), в биологических жидкостях и физиологическом растворе (in vitro) для локализации действия и отбора по кинетическим измерениям на различных видах млекопитающих препаратов радиопротекторов, представленных в виде микрокапсул, микросфер, липосом, в интересах получения средств защиты человека от ионизирующих излучений ядерных (атомных) устройств и радиоактивного заражения местности.
Способ предоставляет возможность достигать следующее: электрохимически регистрировать все разнообразие серосодержащих радиопротекторов, несмотря на отсутствие у них способности окисляться или восстанавливаться в областях потенциала, достижимого при измерениях на млекопитающих и водных растворах; выявлять конформационную перестройку химической структуры молекулы радиопротектора при его растворении и переходе из кристаллического состояния в раствор; определять временные параметры образования радиозащитных форм радиопротекторов из их предшественников - прекурсоров и транспортных форм за счет метаболизма в организме живых млекопитающих или в моделируемых в пробирке условиях; локализовать появление радиозащитной химической формы радиопротектора в органах и тканях живого млекопитающего; отбирать радиозащитные вещества, которые реализуют свою защиту посредством воздействия на обмен и уровень эндогенных радиопротекторов, в частности цистеина и глютатиона; объяснить природу изменения окислительно-восстановительного равновесия организма, регистрируемого потенциометрическим методом, при защите млекопитающих серосодержащими радиопротекторами их адсорбцией на индикаторном электроде.
Известен метод радиоактивных изотопов (Федосеев В.М. Изотопные методы в исследованиях механизма действия противолучевых веществ. Некоторые аспекты противолучевой химической защиты. -М.: МОИП, 3 - 16, 1980, который не позволяет в реальном масштабе времени регистрировать кинетику изменения концентрации радиопротекторов в организме живого млекопитающего; для него необходимо подбирать реагенты, условия выделения и индикации каждого радиопротектора; требует синтеза дорогостоящих радиопротекторов, включающих радиоактивную метку, и ведения отбора проб биологического материала; создает потенциальную возможность радиоактивного заражения среды работы, обитания и организма человека.
Задача изобретения: удешевление, повышение безопасности метода, обеспечение электрохимического определения всего разнообразия серосодержащих радиопротекторов, локализация их действия в организме и отбор препаратов, защищающих человека от ионизирующих излучений.
Способ реализован и пояснен на фиг. 1 - 7.
Стандартные условия измерения. В объекте измерения к рабочему гладкому платиновому электроду длиной 1,1 мм, диаметром 0,2 мм относительно вспомогательного хлорсеребряного электрода подсоединяют поочередно источник отрицательного и положительного постоянного напряжения. Это обеспечивает его последовательное участие в электрохимическом процессе в качестве катода или анода. Длительности импульсов отрицательного и положительного напряжения равны 2,2 с (установленные возможности способа 1 подтверждены до исследованных длительностей 10 с). Величину напряжения каждой полярности устанавливают до анализа и не изменяют в процессе анализа. Область потенциала выбирают так, чтобы обеспечить десорбцию радиопротекторов при снижении концентрации и сохранить необходимую чувствительность их регистрации по измеряемой величине токов зарядки и перезарядки двойного электрического слоя (по емкостному току) рабочего электрода. Измерения в области диффузионной кинетики используют для выявления по фарадеевскому току электрохимического восстановления или окисления радиопротекторов. Если их электрохимическое превращение происходит, то фарадеевский ток минимизируют, уменьшая величины напряжения импульсов обеих полярностей, до достижения необходимого уровня чувствительности способа. В электрохимической ячейке рабочий электрод и вывод проточного вспомогательного хлорсеребряного электрода крепят жестко относительно друг друга. Ячейку термостатируют при температуре 25 ± 0,5oC. В качестве электролита используют физиологический раствор Рингера для теплокровных с процентным содержанием солей: NaCl 0,9%; KCl О,042%; NaHCO3 0,015%; CaCl2 0,024%. Парциальное давление кислорода поддерживают равным 34 ± 4 мм рт.ст. Животным рабочий электрод вводят подкожно над бедренной веной, внутримышечно и в селезенку. Вспомогательный электрод электрохимически контактирует с животным через агаровый мостик, введенный подкожно. После опыта на животных рабочий электрод обтирают несколько раз ватой, смоченной в физиологическом растворе, а затем ватой, смоченной в этиловом спирте. С использованием способа исследованы следующие радиопротекторы: цистеамин (МЭА) с химическими группами (SH, NH2) адсорбируется на рабочий электрод (+); МЭА- битартрат (SH, NH2, COOH, OH), (+); цистеин, (SH, NH2 COOH), (+); глютатион восстановленный (GSH), (SH, NH, NH2, COOH), (+); цистафос, (SPO3HNa, NH2, (+); гаммафос (SPO3H2, NH2), (+); цистамин, (SS, NH2), глютатион окисленный (GSSH), (SS, NH, NH2, COOH), (+); 2-аминоэтилтиосерная кислота (2АЭТСК), (SSO3H, NH2), (+); S-2- аминоэтилизотиуроний бромид (АЭТ), (S, NH, NH2), (+); контрольные вещества: метионин, (S, NH2, COOH), (+); глицин (NH2, COOH), свойство адсорбироваться на рабочий электрод отсутствует (-); таурин, (NH2, SO3)H, (-); цистеиновая кислота, (HOOC, SO3H), (-). Из сопоставления строения молекул исследованных радиопротекторов и веществ следует, что соединения, содержащие серу в виде -SH, -C-S-C-, -C-S-S-C-, -SPO3HNa, -SPO3H2, -SSO3H адсорбируются на гладком платиновом электроде и регистрируются способом, а вещества с группами SO3H, COOH, NH2 не регистрируются. Показатель точности опыта Р при определении концентрации серосодержащих радиопротекторов равен 2,3% (Зайцев Г.Н. Методика биометрических расчетов, М: Наука, с. 43, 1973).
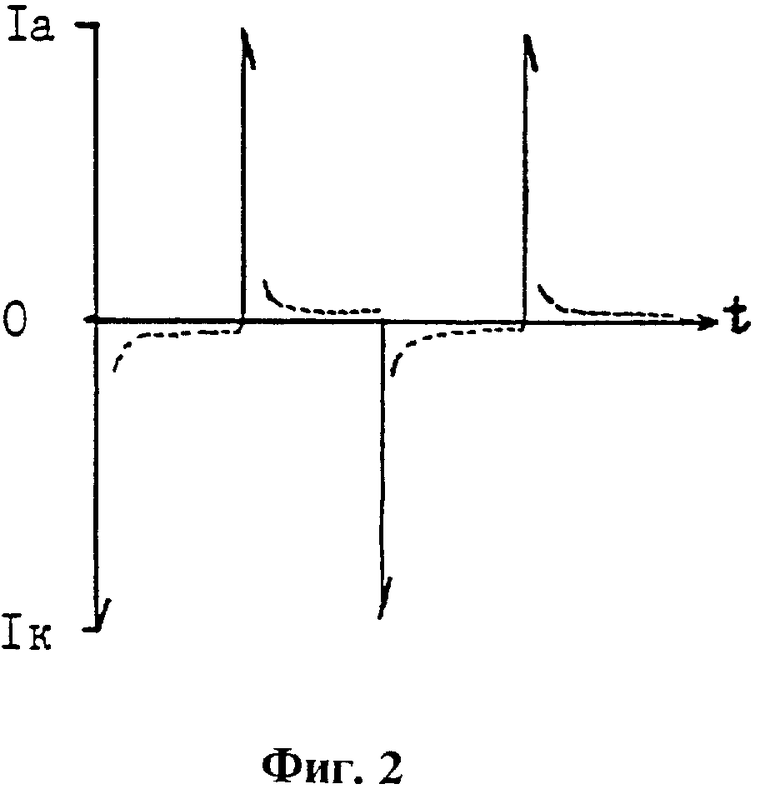
На фиг. 1 приведена осциллограмма временной формы накладываемого на электродную пару импульсов напряжения, время переключения одной полярности на другую равно 10 млс, одна метка соответствует 200 млс, длительности импульсов напряжения положительной и отрицательной полярности равны 2,2 с; на фиг. 2 приведена осциллограмма временной формы тока, проходящего через электродную пару, в условиях наложения на нее импульсов напряжения, представленных на фиг. 1.
Способ иллюстрируется следующими примерами.
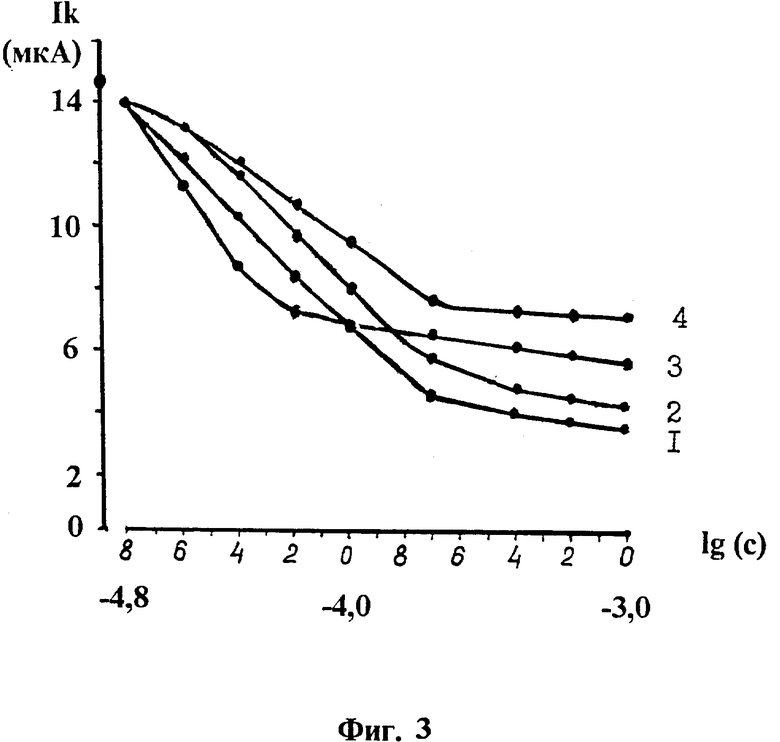
Пример 1. Калибровочные кривые для определения концентрации серосодержащих радиопротекторов, (фиг.3), lg(c) логарифм концентрации радиопротекторов в молях, Ik емкостный ток при наложении отрицательного импульса напряжения на рабочий электрод, (мкА) микроамперы, амплитуда импульсов напряжения ± 0,6 В, 1 меркаптоэтиламин битартрат, 2 АЭТ, 3 2АЭТСК, 4 цистафос. Построение калибровок. Величина емкостного тока в физиологическом растворе без радиопротекторов при стандартных условиях и наложении отрицательного импульса напряжения на рабочий электрод равна 14,5 мкА. Внесение радиопротектора в ячейку приводит к снижению емкостного тока, который в зоне малых и средних концентраций снижается нелинейно в зависимости от увеличения концентрации, но снижение идет до строго определенной величины, соответствующей определенной концентрации. Зона высоких концентраций характеризуется тем, что в ней снижение емкостного тока достигает предела и дальнейшее увеличение концентрации не приводит к его дальнейшему снижению. Если при измерении раствора с неизвестной концентрацией радиопротектора величина емкостного тока оказывается в зоне высоких концентраций, то способом разбавления переводят концентрацию в область малых или средних концентраций калибровочной кривой, а затем по величине емкостного тока определяют концентрацию, полученную в результате разбавления. На основании этого рассчитывают концентрацию до разбавления. Исходно для построения калибровочной кривой в электрохимических ячейках с физиологическим раствором составляют ряд возрастающих концентраций радиопротектора. Измерение начинают с ячейки, в которой находится наименьшая концентрация. После измерения в первой ячейке электродную пару переносят в ячейку с чистым физиологическим раствором и при сменяемом растворе электрохимически очищают поверхность рабочего электрода от радиопротектора. По мере очистки емкостный ток будет возрастать и достигнет исходной величины 14,5 мкА. Это свидетельствует о том, что поверхность электрода соответствует исходному состоянию и пригодна для повторных измерений. Затем аналогичным образом проводят измерения во второй и последующих ячейках до достижения области высоких концентраций, когда увеличение концентрации уже не приводит к дополнительному снижению емкостного тока.
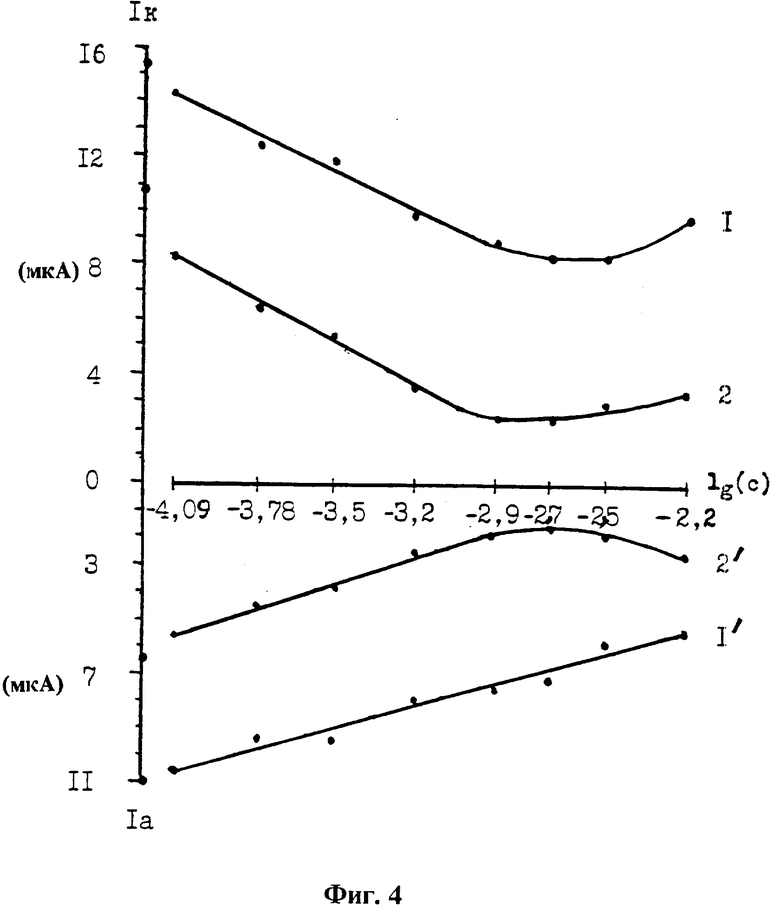
Пример 2. Калибровочные кривые для определения концентрации серосодержащего радиопротектора, дающего фарадеевский ток (фиг. 4), изменение величины емкостного тока в зависимости от потенциала и концентрации GSH: Ik и Ia - емкостный ток соответственно при наложении отрицательного и положительного импульсов напряжения на рабочий электрод, (мкА) микроамперы, lg(c) - логарифм концентрации GSH, l, l' - амплитуда импульсов напряжения ± 0,6 В, 2,2' - ± 0,4 В. Тангенсы угла наклона калибровочных графиков рассчитаны, когда рабочий электрод включался в качестве катода. Линейность снижения величины емкостного тока от логарифма концентрации при ± 0,6 В заключается в пределах с 8,1 • 10-5 по 1,3• 10-3, тангенс угла наклона равен 0,48, а при ± 0,4 В - в пределах с 8,1•10-5 по 6,5±10-4, тангенс угла наклона равен 0,53. Величина тангенса угла наклона свидетельствует о том, что чувствительность регистрации GSH выше при ± 0,4 В чем при ± 0,6 В. Изменение угла наклона калибровок в различных областях потенциала свидетельствует о том, что на емкостный ток накладывается ток фарадеевского процесса, вклад которого возрастает с увеличением потенциала и концентрации радиопротектора. Закономерности электрохимического поведения цистеина аналогичны GSH.
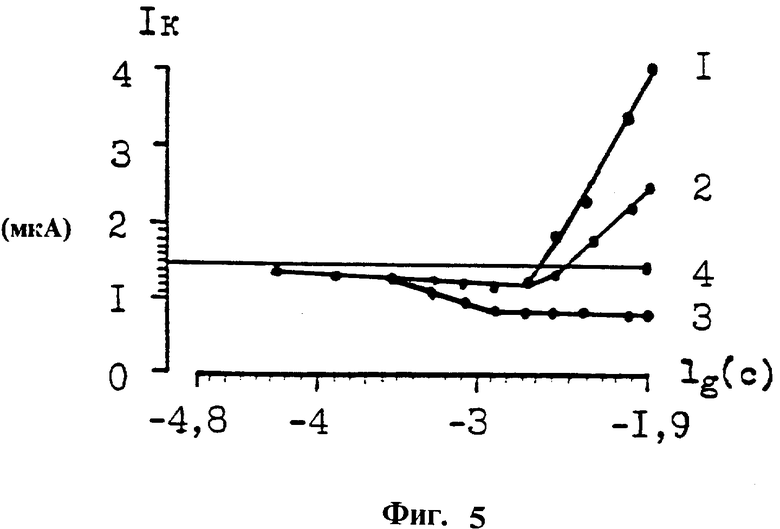
Пример 3. Определение наличия фарадеевского тока у радиопротекторов (фиг. 5), изменение величины диффузионного тока Ik, измеряемого к концу действия отрицательного импульса напряжения на рабочем электроде в зависимости от логарифма концентрации lg(c) GSH 1, цистеина 2, АЭТ 3, контроль-физиологический раствор при стандартных условиях 4, область потенциала ± 0,6 В, (мкА) микроамперы. По фарадеевскому току GSН регистрируют с концентрации 3,2•10-3 М, цистеин с концентрации 5,95•10-3 М, АЭТ снижает диффузионный ток, что свидетельствует о том, что он блокирует активные центры рабочего электрода и тормозит восстановление кислорода. Измерение емкостного тока позволяет регистрировать биогенные радиопротекторы - GSH и цистеин в концентрациях в десятки раз ниже, чем это возможно в области диффузионной кинетики по измерению фарадеевского тока, в частности, для GSH 3,2•10-3: 8,1•10-5 М ~ в 40 раз.
Пример 4. Дифференцирование тиоловой формы от тиофосфорнокислотной или тиосернокислотной формы радиопротектора.
Конкретные единичные примеры. Процедура.
Амплитуды импульсов напряжения равны + 0,3 В, - 0,2 В, регистрируется емкостный ток при наложении отрицательного импульса напряжения на рабочий электрод. Единичный опыт для цистафоса: время в мин, емкостный ток в мкА (0 - 6,5, концентрация цистафоса 0,1 мг/мл или 5,5• 10-4 М, 1 - 2,9; 2 - 2,3; 4 - 1,9; 6 - 1,7; 8 - 1,6; 10 - 1,6, ополаскивание электродной пары в чистом физиологическом растворе и перенос ее в ячейку с чистым физиологическим раствором, 4 - 3,2; 14 - 6,5); единичный опыт для цистеина: (0 - 7,5, концентрация цистеина 0,05 мг/мл или 4,13•10-4 М, 1 - 2,2; 2 - 1,8; 4 - 1,5; 6 - 1,4; 8 - 1,3; 10 - 1,3, ополаскивание электродной пары в чистом физиологическом растворе и перенос ее в ячейку с чистым физиологическим раствором, 1 - 1,7; 3- 1,9, перенос в другую ячейку с чистым физиологическим раствором, 20 - 6,5, через 2 ч. достигнут исходный уровень 7,5 мкА).
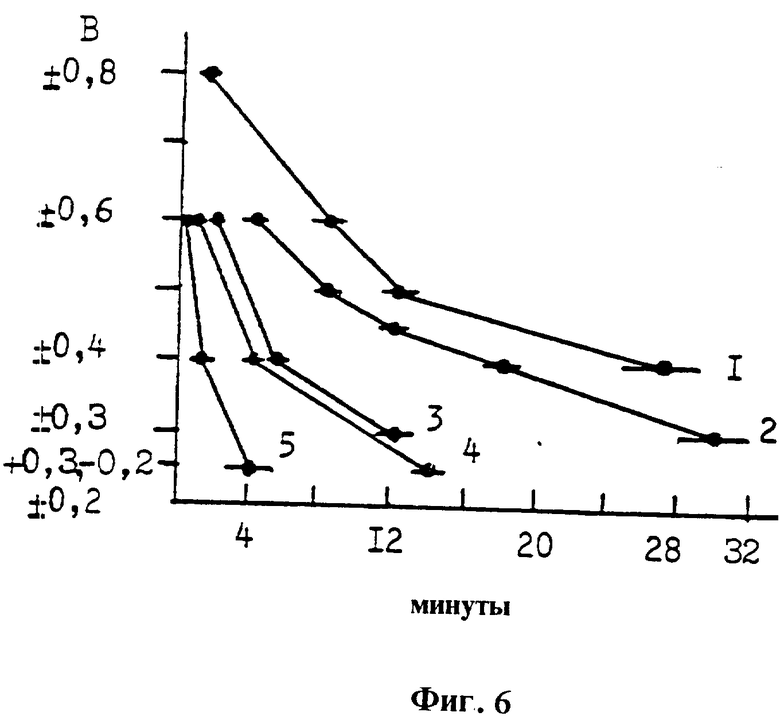
Статистическая обработка результатов по цистафосу и другим радиопротекторам приведена на фиг. 6, время десорбции серосодержащих радиопротекторов с поверхности платинового электрода в зависимости от области потенциала: (В) фиксированные амплитуды импульсов напряжения положительной и отрицательной полярности, время десорбции (мин). Процессы адсорбции и десорбции серосодержащих радиопротекторов и веществ на рабочем электроде развиваются во времени. Скорость их развития зависит от величины напряжения обеих полярностей, накладываемых на электродную пару, и химического строения регистрируемого вещества. В ячейке с чистым физиологическим раствором и стандартными условиями в областях потенциала ±0,6 В измеряют исходную величину емкостного тока. Переносят рабочий и вспомогательный электроды в электрохимическую ячейку с радиопротектором и после установления предельного снижения емкостного тока (в примере концентрация радиопротекторов была 1 АЭТ 2,61• 10-4 М, 2 цистеин 8,2•10-4 М, 3 GSH 6,5•10-4 М, 4 цистафос 1,1•10-3 М, 5 2АЭТСК 6,4•10-4 М, сменяют физиологический раствор с радиопротектором на чистый физиологический раствор, регистрируют время, за которое достигается исходная величина емкостного тока. По данной схеме определяют время десорбции каждого радиопротектора в зависимости от фиксированных областей потенциала. Из сравнения скорости десорбции трех радиопротекторов с близким молекулярным весом, но разными функциональными группами следует, что цистеин с SH-группой десорбируется с электрода значительно большее время, чем цистафос с SPO3HNa-группой и 2АЭТСК с SSO3H-группой. То есть, время десорбции является дифференцирующим признаком формы радиопротектора. Так как тиоловая форма радиопротектора является радиозащитной, то по скорости десорбции радиопротекторов выявляется время, когда из цистафоса и 2АЭТСК за счет метаболизма в организме образуется их тиоловая радиозащитная форма МЭА, обеспечивающая защиту млекопитающих от ионизирующей радиации. Молекулы АЭТ и метионина имеют в своем строении атом серы, заключенный между двумя углеродами, но метионин при ±0,6 В десорбируется в пределах одной минуты, а АЭТ более восьми минут, что свидетельствует о существенной перестройке молекулы АЭТ в растворе, которая, вероятно, играет важную роль в защите млекопитающих от ионизирующей радиации. Увеличение времени десорбции всех радиопротекторов с уменьшением амплитуды импульсов напряжения, подаваемых на электродную пару, свидетельствует об их адсорбции на индикаторный платиновый электрод и при регистрации потенциометрическим методом окислительно - восстановительного равновесия организма.
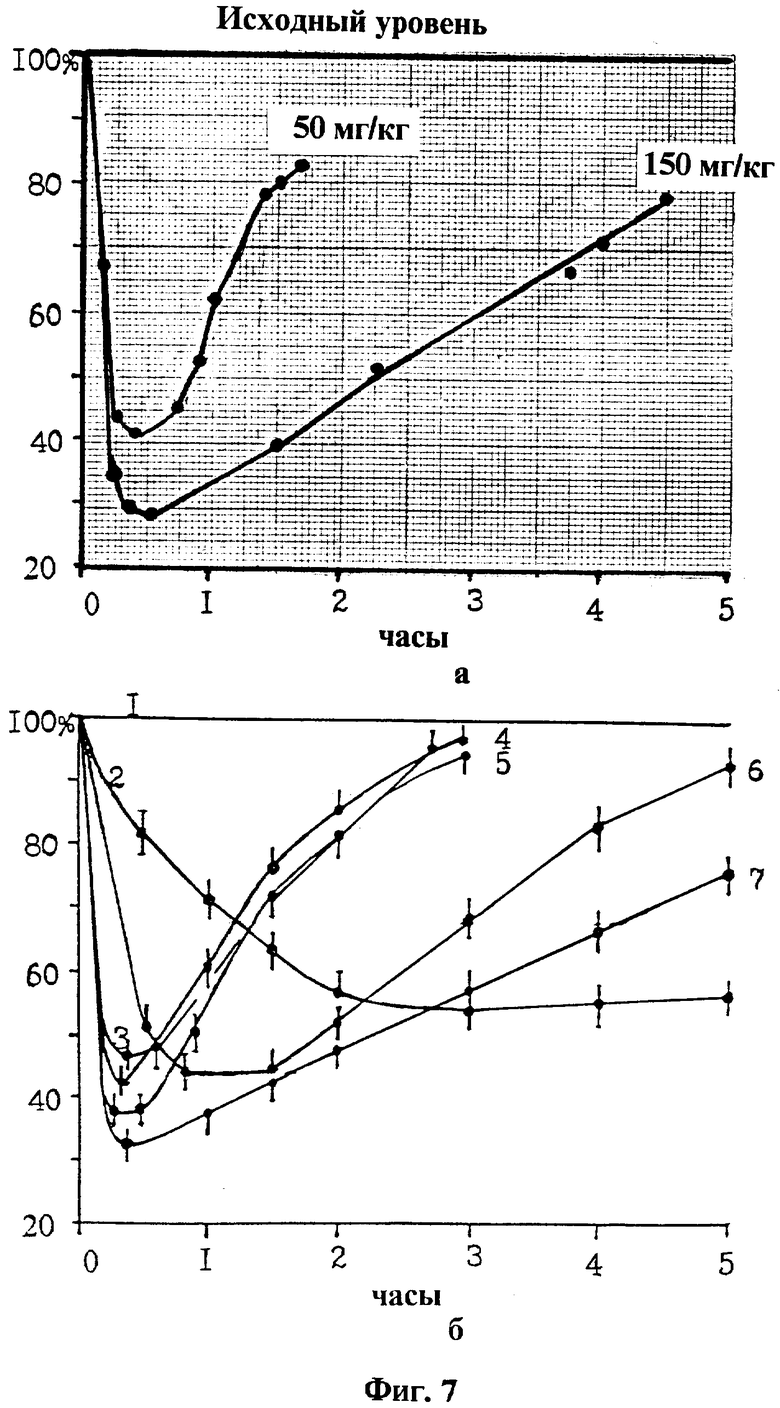
Пример 5. Определение времени максимальной защиты организма млекопитающего от ионизирующей радиации при применении серосодержащих радиопротекторов. Возможности применения способа для отбора препаративных форм радиопротекторов - микрокапсул, микросфер, липосом с серосодержащими радиопротекторами или их прекурсорами. В соответствии с существующими правилами в лабораторной практике фиксированным лабораторным животным вводят в орган или ткань рабочий электрод и через агаровый мостик, введенный подкожно, обеспечивают его электрохимический контакт с проточным хлорсеребряным вспомогательным электродом, измеряют величину емкостного тока, проходящего в цепи электродов, при наложении отрицательного импульса напряжения на платиновый электрод. После установления емкостного тока на постоянный уровень животным вводят исследуемые радиопротекторы или контрольные вещества.
Конкретные единичные примеры. Процедура. Результаты опытов (фиг. 7а).
Белую лабораторную крысу-самца Крюковской популяции массой 180 г фиксируют в положении лежа на спине за четыре конечности и верхние передние зубы (резцы) на препаративном столике, изготовленном из плексигласса. Рабочий гладкий платиновый электрод вводят в бедренную мышцу правой нижней ноги, а подкожно в левую нижнюю ногу вводят кончик агарового мостика, противоположный конец которого опускают в стаканчик, где находится вывод проточного вспомогательного хлорсеребряного электрода. Это обеспечивает электрохимический контакт рабочего и вспомогательного электродов. Измеряют емкостный ток во времени. Через несколько минут после начала измерения емкостный ток устанавливается на постоянном уровне, который принимают за 100%.
Навеску АЭТ из расчета мг 50 мг/кг массы животного вносят в шприц, растворяют в 0,5 мл физиологического раствора и вводятся внутрибрюшинно. Иглу шприца перед использованием необходимо незначительно затупить, чтобы избежать случайного повреждения кишечника у животного. После введения АЭТ распространяется в организме и достигает мышцу, что регистрируется снижением емкостного тока. Минимальный уровень снижения емкостного тока до 41%, соответствующий максимальной концентрации радиопротектора в ткани, достигается к 20-ой мин. За счет ферментативного разложения и выведения из организма концентрация АЭТ снижается. Снижение концентрации АЭТ отражает возвращение емкостного тока к исходному уровню. Через 80 мин емкостный ток достигает 79% от исходного уровня.
Другую белую лабораторную крысу Крюковской популяции массой 190 г фиксируют на препаративном столике. Рабочий гладкий платиновый электрод вводят в бедренную мышцу правой нижней ноги, а подкожно в левую нижнюю ногу вводят кончик агарового мостика, противоположный конец которого опускают в стаканчик, где находится вывод проточного вспомогательного хлорсеребряного электрода. Измеряют емкостный ток во времени.
Навеску АЭТ из расчета 150 мг/кг массы животного растворяют в 0,5 мл физиологического раствора и вводятся внутрибрюшинно. После введения АЭТ распространяется в организме и достигает мышцы, что регистрируется снижением емкостного тока. Минимальный уровень снижения емкостного тока до 30%, соответствующий максимальной концентрации радиопротектора в ткани, достигается к 20-ой мин. За счет ферментативного разложения и выведения из организма концентрация АЭТ снижается. Снижение концентрации АЭТ отражает возвращение емкостного тока к исходному уровню. Так как доза препарата во втором случае была в три раза больше, чем в первом, то емкостный ток достигает 78% от исходного уровня лишь через 270 мин.
Статистическая обработка результатов по АЭТ и другим радиопротекторам приведена на фиг. 7б, изменение емкостного тока отнесено к исходному уровню в процентах после введения серосодержащих радиопротекторов млекопитающим. Кинетика снижения емкостного тока после введения радиопротектора свидетельствует о скорости распространения защитного вещества в организме, а кинетика его возвращения к исходному уровню - о скорости уменьшения концентрации радиопротектора за счет его выведения и разрушения в организме под воздействием ферментативных систем. Предельный уровень снижения емкостного тока свидетельствует о том, что радиопротектор находится в максимальной концентрации в ткани и организм защищен в максимальной степени от ионизирующей радиации. Рабочий электрод находится в бедренной мышце лабораторных белых мышей (массой около 22 г) в/б раздельно введены 1 таурин 250 мг/кг, 2 2АЭТСК 350 мг/кг. Лабораторные белые крысы: 3 GSH 400 мг/кг введен в/б, рабочий электрод находится в бедренной мышце, 4, 6, соответственно п/к в области шеи введены 50, 150 мг/кг АЭТ, рабочий электрод находится в селезенке, 5, 7, соответственно в/б ведены 50, 150 мг/кг АЭТ, рабочий электрод находится в бедренной мышце. Разбор конкретных кинетик: 1 таурин в организме не превращается в радиопротектор и не снижает величину емкостного тока. 2 2АЭТСК не распространяется в организме, поэтому снижение емкостного тока связано с образованием МЭА при действии ферментативных систем на 2АЭТСК. МЭА распределяется по органам и тканям и обеспечивает защиту животных от ионизирующей радиации, но защита возникает в отдаленный период времени после введения и достигает максимума через 1,5 ч. Из этого следует, что 2АЭТСК является прекурсором радиопротектора МЭА. Цистафос в отличии от 2АЭТСК не является прекурсором, а рассматривается в качестве транспортной формы МЭА из-за того, что защита возникает уже через 15-20 мин после его введения, то есть переход цистафоса в МЭА идет с существенно большей скоростью, чем это наблюдается при переходе 2АЭТСК в МЭА. 3 GSH является эндогенным радиопротектором, поэтому при экзогенном введении он быстро распространяется в организме и обеспечивает защиту в ближайшее время после введения. 4, 5, 6, 7 АЭТ является высокоэффективным радиопротектором, быстро распространяется по органам и тканям и относительно длительное время сохраняется в организме. Его радиозащитное действие сохраняется в зависимости от дозы до нескольких часов. Таким образом, способ позволяет регистрировать кинетику распределения и изменения концентрации серосодержащих радиопротекторов в органах и тканях различных живых млекопитающих, что непосредственным образом связано с проявлением ими свойства защищать животных от ионизирующей радиации. Для увеличения времени, радиозащитного действия радиопротекторы изготавливают в препаративных формах (микрокапсулы, микросферы, липосомы) с тем, чтобы они обеспечивали постоянное поступление защитных веществ в организм и поддерживали его повышенную устойчивость к ионизирующей радиации длительное время. В зависимости от технологии производства препаративные формы различаются по своим параметрам. Для оценки некоторых из них предназначен способ. В частности, возможно прогнозирование величины и временных параметров повышенной радиопротекторами и их препаративными формами радиоустойчивости человека на основе сравнительного изучения кинетики появления и распада в организме человека, других млекопитающих серосодержащих радиопротекторов с последующим определением радиозащитной эффективности в экспериментах по облучению ионизирующей радиацией лишь защищенных животных и, исходя из этого, экстраполирования пригодности средств защиты для профилактики радиационного поражения людей.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАДИОПРОТЕКТОР | 1992 |
|
RU2049469C1 |
| СПОСОБ ЗАЩИТЫ ЖИВОТНЫХ ОТ ВЫСОКОДОЗОВОГО ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ | 2019 |
|
RU2701155C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСОВ НА ОСНОВЕ АЦИКЛИЧЕСКИХ АМИНОВ, ОБЛАДАЮЩИХ РАДИОПРОТЕКТОРНЫМИ СВОЙСТВАМИ | 1991 |
|
RU2032660C1 |
| ЭЛЕКТРОСТИМУЛЯТОР ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 1997 |
|
RU2153365C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО АНАЛИЗА | 2000 |
|
RU2199734C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПАЛЛАДИЯ И ПРОИЗВОДНЫХ АРОМАТИЧЕСКИХ АМИНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2022968C1 |
| СПОСОБ КОММУТАЦИОННОЙ ХРОНОАМПЕРОМЕТРИИ | 2008 |
|
RU2382356C1 |
| Устройство для контроля потенциостатических приборов | 1985 |
|
SU1422122A1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ЗАЩИТЫ ОРГАНИЗМА ОТ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ | 2005 |
|
RU2350353C2 |
| Способ дифференциальной импульсной вольтамперометрии | 1986 |
|
SU1413512A1 |
Изобретение может быть использовано в медицине, химии, радиобиологии, биофизике, токсикологии и сельском хозяйстве. На электродную пару поочередно подают разнополярные импульсы напряжения и по измеряемой величине емкостного тока рабочего электрода определяют их концентрацию и качество. По фарадеевскому току выявляют электрохимическое превращение радиопротекторов, при наличии его минимизируют, уменьшая потенциалы до сохранения десорбции радиопротекторов с поверхности электрода. Качественный анализ радиопротекторов ведут, основываясь на том, что время десорбции радиопротектора с тиоловой группой занимает значительно большее время, чем десорбция аналогичных ему соединений с тиофосфорнокислотной или с тиосернокислотной группами. Способ позволяет удешевить, повысить безопасность метода, обеспечить электрохимическое определение всего разнообразия серосодержащих радиопротекторов, локализовать их действия в организме и производить отбор препаратов, защищающих человека от ионизирующих излучений. 2 з.п.ф. 6 ил.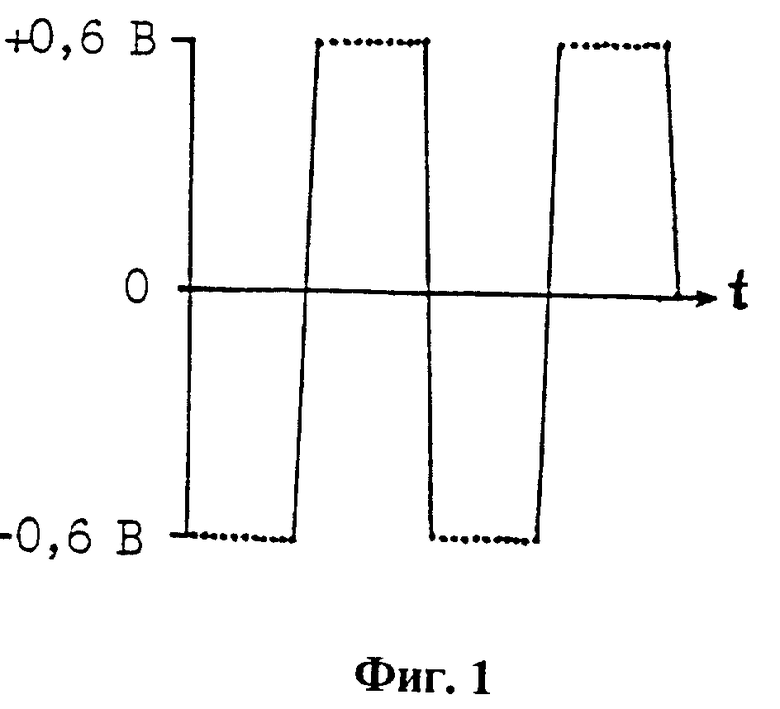
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Федосеев В.М | |||
| Изотопные методы в исследованиях механизма действия прот иволучевых веществ | |||
| Труды Московского общества испытателей природы "Некото рые аспекты противолучевой химической защиты" - М., 1980, с.3-16 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ определения репарационной способности радиопротекторов | 1989 |
|
SU1693552A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ определения фосфамида в биологических средах | 1988 |
|
SU1624319A1 |
Авторы
Даты
1998-06-27—Публикация
1997-03-14—Подача