Изобретение относится к медицинской радиологии и может быть использовано для защиты живых организмов от воздействия высокодозового ионизирующего излучения.
В аварийных ситуациях и в условиях военных конфликтов, которые могут сопровождаться интенсивным воздействием ионизирующих излучений на организм человека, возникает необходимость применения высокоэффективных радиопротекторов, пригодных для использования различными слоями населения.
Защита от действия ионизирующего излучения и острого лучевого поражения может осуществляться двумя способами. Либо это истинная протекция, определяемая введением в организм радиопротектора до облучения (радиопротекторное воздействие), либо это терапевтическое действие препарата, направленное на купирование последствий уже произошедших после облучения (пострадиационное терапевтическое воздействие). Наиболее важным свойством препаратов, направленных на защиту организма от воздействия высокодозового облучения, является их способность полной (приближающейся к 100%) защиты организма от абсолютно летальных доз гамма радиации. Крайне востребованным могло бы быть свойство радиопротектора сохранять свои защитные свойства в течение длительного (несколько суток) времени до получения летальной дозы гамма радиации.
Известны радиозащитные свойства химических соединений.
Наиболее известными эффективными радиопротекторами среди сероазотсодержащих органических соединений, меркаптоалкиламинов, являются гаммафос (WR-2721, амифостин, этиофос), АЭТ (Аминоэтилизотиуроний), МЭА (Цистеамин, аминоэтиол, b-меркаптоэтиламин), меркамин, тизанидина.
Известно средство профилактики острой лучевой болезни [RU 2599844, C1, A61K 31/433, 20.10.2016], в качестве которого используют тизанидин - 5-Хлор-4-(2-имидазолин-2-ил-амино)-2,1,3-бензотиадиазола гидрохлорида - в виде официальных лекарственных препаратов «Тизанидин Тева», «Сирдалуд» и «Тизалуд» в качестве средства профилактики острой лучевой болезни.
Недостатком средства является относительно низкая эффективность.
Среди «классических» радиопротекторов, наиболее известен цистамин (препарат РС-1) - бис-(β-аминоэтил)-дисульфида гидрохлорид. В экспериментах на животных демонстрирует высокую противолучевую эффективность, ослабляет эффект обучения в 1,3-1,5 раза. Применяется в клинике для ослабления побочных эффектов лучевой терапии, входит в состав некоторых спецаптечек и противорадиационных комплектов. Разовые дозы, рекомендованные для перорального применения в целях защиты от летального облучения, составляют для мышей 500-600 мг/кг (по соли) и для человека - 1,2 г (6 таблеток по 0,2 г). При сохранении радиологической угрозы прием препарата можно повторить не раньше, чем через 4-5 часов.
Основным недостатком всех серосодержащих радиопротекторов является то, что они обладают кратковременным действием. Кроме того, существенным недостатком этого класса препаратов является то, что, серосодержащие радиопротекторы дают эффекты радиозащиты в дозах, близких к токсическим. Так для цистамина показано, что при сравнении острых токсических и защитных доз, защитная доза для крыс представляет собой 50-52% величины ЛД50/48, для мышей 73-78 ЛД50/48. В целом, для достижения защитного эффекта необходима определенная концентрация аминотиолов в организме. Известно, что при повышении дозы радиопротектора его защитное действие беспредельно не возрастает. При достижении определенной концентрации серосодержащих радиопротекторов в организме дальнейшее повышение дозы не приводит к усилению радиозащитного действия. Оптимальная защитная доза аминотиолов достигает 30-70% величины их среднелетальных доз (ЛД50), что ограничивает их использование. Применение этих доз вызывает у лабораторных животных серьезные острые побочные действия: падение артериального давления, брадикардию, снижение минутного объема крови с нарушением кровоснабжения тканей. Отмечаются тошнота, рвота, дефекация, судороги скелетных мышц, гибель в результате паралича дыхательного центра.
Так для цистамина показано, что его введение сказывается на общем состоянии и деятельности центральной нервной системы, отрицательно влияет на сердечно-сосудистую и дыхательную системы, снижает дыхательный коэффициент, тормозит двигательную активность желудочно-кишечного тракта, усиливает слюноотделение, вызывает рвоту, диарею [Шашков B.C. и др. Эффективность серотонина, мексамина, АЭТ и цистамина при повторном введении после гамма-облучения // Радиобиология. - 1971. - Т. XI, вып. 4. - С. 621-623]. Указанные недостатки определяют ограниченность применения серосодержащих радиопротекторов.
В качестве радиопротектора длительного действия для перорального применения из числа синтетических эстрогенов был предложен известный лекарственный препарат диэтилстильбэстрол (ДЭС). Однако радиозащитный эффект ДЭС развивается лишь спустя 2-3 суток после введения. Кроме того, было обнаружено, что ДЭС является потенциальным канцерогеном, что делает сомнительными перспективы его практического применения как радиопротектора [Владимиров В.Г. и др. Радиопротекторы: структура и функции / Киев, Наукова Думка. - 1989, 196 с].
Известно предложение использовать в качестве радиопротектора препарат фосфадитилэтаноламин [RU 2049469, C1, A61K 31/66, 10.12.1995].
Это новое свойство обнаружено у препарата, который известен как препарат, используемый при лечении заболеваний, сопровождающихся явлениями гемолиза различной этиологии. В качестве радиопротектора препарат фосфатидилэтаноламин вводят внутрибрюшинно или ректально однократно в количестве 37,5 мг/кг массы за 15 или 30 мин до облучения или через 15 или 30 мин после облучения. Однако недостаточная эффективность и ограниченность области применения этого соединения связана с тем, что он относится к группе препаратов пострадиационного терапевтического действия.
Известны исследования влияния природного антиоксиданта дигидрокверцетина (ДГК) на процесс свободнорадикального окисления липидов в плазме крови и печени мышей при общем внешнем однократном гамма-облучении в дозе 3,5 Гр. [Кондакова Н.В. и др. Радиопротекторная активность дигидрокверцетина в экспериментах in vitro и in vivo // Биомедицинские технологии. - 1998. - С. 66-70].
Обнаружено, что содержание продуктов липидной пероксидации, реагирующих с 2-тиобарбитуровой кислотой, у облученных животных, получавших ДГК перорально в течение 155 суток после радиационного воздействия (опыт), было достоверно ниже по сравнению с аналогичным показателем у облученных животных, не получавших антиоксиданта (контроль). Недостатком этого радиопротектора также является относительно низкая его эффективность, поскольку, он назначается при умеренных (1-1,5 Гр) и малых (10-50 сГр) дозах радиации. Кроме того, как подтвердили результаты экспериментальных исследований, при его применении не удается, несмотря на восстановление показателей красной крови, реологические показатели и исходный уровень липидной пероксидации в эритроцитах, восстановить исходные показатели количества лейкоцитов и тромбоцитов.
Известен радиопротектор кратковременного действия [RU 2144357, С1, A61K 31/66, 10.12.1995], в качестве которого применяют нафтизина-2-(α-нафтилметил)имидазолина нитрата в качестве средства для внутримышечного введения при экстренной профилактике лучевых поражений.
Нафтизин, относится к производным имидазолина и представляет собой 2-(α-нафтилметил) имидазолин нитрат. По химическому строению нафтизин отличается от норадреналина, метазона, фетанола, но, подобно этим соединениям, он оказывает а-адреномиметическое действие. По сравнению с норадреналином и мезатоном вызывает более длительное сужение периферических сосудов. Известны опыты по использованию нафтизина как профилактического радиозащитного средства, проведенные на мышах, крысах, кроликах, собаках. Животных подвергали общему равномерному кратковременному гамма-облучению на стационарных установках в дозах 2,9, или 3,3 Гр (в контроле - ЛД100/45) при мощности дозы излучения соответственно 1,9 или 0,3-0,5 Гр/мин. Опыты показали, что оптимальная радиозащитная доза нафтизина составляет 0,3 мг/кг. Нафтизин обладает высокой противолучевой эффективностью, защищая от гибели до 85% собак, подвергнутых гамма-облучению в абсолютно летальных дозах. Радиозащитное действие препарата проявляется в полной мере через 5 мин после его применения и сохраняется на протяжении 2 ч. Однако действие препарата сохраняется только на протяжении нескольких часов, то есть препарат обладает кратковременной защитой от радиации. Поэтому описанный выше радиопротектор также недостаточно эффективен.
В качестве радиозащитного средства предлагается использовать интеркалирующее в двуцепочечную молекулу ДНК соединение B1 Ortho methyl paraNN dimethylamino Hoechst [ЕР 2044938, A61K 31/44, 28.07.1995]. Основным недостатком радиопротектора является трудность в создании требуемой концентрации в крови, необходимой для осуществления радиозащитных свойств без серьезных побочных эффектов.
К числу известных в клинической практике радиопротекторов относятся также препараты из группы индолилалкиламинов мексамин и индралин (Б-190). К недостаткам мексамина, ограничивающим возможность его широкого использования в качестве противолучевого средства, относится медленное развитие радиозащитного эффекта и побочное действие. Оптимальная радиозащитная доза для мышей при пероральном введении составляет 250 мг/кг [Жеребченко П.Г. Противолучевые свойства индолилалкиламинов / М.: Атомиздат. - 1971, 135 с].
Индралин (Б-190) является прямым альфа-адреномиметиком. Механизм защиты препаратов этой группы связывают со спазмом сосудов и циркуляторными изменениями кровоснабжения в радиочувствительных органах и тканях, в результате чего развивается гипоксия, определяющая защиту этих тканей. Препарат применяют в количестве 0,45 г (3 таблетки по 0,15 г) за 5-10 минут до предполагаемого облучения, защитное действие продолжается в течение 1 часа. Б-190 - средство экстренной медицинской помощи для снижения тяжести последствий внешнего радиационного воздействия. Применяется в чрезвычайных условиях и аварийных ситуациях при прогнозировании доз облучения, вызывающих развитие острой лучевой болезни. Б-190 обеспечивает сохранение жизни в 90% случаев при получении абсолютно смертельной дозы облучения. На сегодняшний день он является самым эффективным радиопротектором в мире. Повторное применение препарата допускается через 1-1,5 часа после первого приема. Чем больше доза препарата, тем большее количество сосудов подвергается суживающему действию, и помимо гипоксии радиочувствительных органов и тканей (например, костного мозга) возможно развитие гипоксии головного мозга и других органов. Может отмечаться гипертензия и брадикардия.
В Российской Федерации прекращено использование аптечек индивидуальных АИ-2 и АИ-4, препарат цистамин снят с производства. Взамен вышеуказанных индивидуальных аптечек, а также индивидуальных перевязочных пакетов для сил гражданской обороны теперь используется Комплект Индивидуальный Медицинский Гражданской Защиты (КИМГЗ). По приказу Минздрава от 15.02.13 №7 он, предназначен для оказания первой медицинской помощи (в порядке само- и взаимопомощи) при возникновении чрезвычайной ситуации в очагах поражения, с целью предупреждения или максимального ослабления эффектов воздействия поражающих факторов химической, радиационной и биологической природы.
КИМГЗ, которым обеспечивается личный состав формирований, выполняющий задачи в районах возможного радиоактивного загрязнения (заражения), комплектуется лекарственными препаратами, обеспечивающими радиозащитный, антиэметический и анксиолитический эффекты, в количествах не менее:
калия йодид (радиопротектор), таблетки 125 мг - 1 таблетка;
калий-железо гексацианоферрат (комплексообразующее соединение, выводящее радиоизотопы), таблетки 500 мг - 2 таблетки;
ондансетрон (противорвотное средство), таблетки, покрытые оболочкой, 4 мг - 2 таблетки.
КИМГЗ дополнительно комплектуется радиозащитным лекарственным препаратом Б-190, таблетки 150 мг, в количестве не менее 3 таблеток.
Описанные радиопротекторы относятся к группам химических веществ, обеспечивающих защиту организма от неблагоприятных последствий радиационного поражения следующими принципиальными механизмами. Серосодержащие вещества, дигидрокверцетин (ДГК), формируют ловушки свободных радикалов образующихся из молекул воды, кислорода и азотистых оснований в результате действия γ лучей. Фосфадитилэтаноламин способствует защите биологических мембран от поражающего действия радиации. Группа индолилалкиламинов и нафтизин индуцирует общеорганизменную гипоксию, что кратно снижает количество образованных свободных радикалов и обеспечивает сохранение клеточных структур.
Аналогом предложенного технического решения является способ повышения радиационной устойчивости организма мелкого рогатого скота, подвергшегося ионизирующему облучению [RU 2613102, C1, A61K 36/00, 15.03.2017], заключающийся в применении препарата куркумина в количестве 3,125-3,47 мг чистого вещества куркумина на 1 кг живой массы, вводимого внутримышечно в дозе 10,0 см3 через 0,5-1,0 ч после облучения, при величине 4,0-5,0 Гр поглощенной дозы, и внутримышечно в дозе 10,0 см3 через 0,5-1,0 ч после облучения и дополнительно в дозе 10,0 см3 на 3-и и 5-е сутки после облучения, при величине 5,0-6,0 Гр поглощенной дозы.
Недостатком этого технического решения является относительно узкая область применения, ограниченная мелким рогатым скотом.
Наиболее близким по технической сущности к предложенному является способ биологической профилактики лучевой болезни [RU 2568905, C1, A61K 36/15, 20.11.2015], включающий введение биологического препарата однократно за 30-35 дней до облучения крыс высокодозовым ионизирующим излучением, при этом, предварительно проводят профилактическое облучение гамма-лучами в дозе 0,75-1,5 Гр, биологический препарат вводят в течение 5-10 дней до облучения высокодозовым ионизирующим излучением в качестве биологического препарата используют водный экстракт зелени пихты сибирской с водой или кормом в дозе 8,0-10,0 мл/кг.
Недостатком наиболее близкого технического решения является его относительно низкая эффективность.
Задачей настоящего изобретения является разработка способа защиты животных от высокодозового ионизирующего излучения, обладающего более высокой эффективностью и расширяющего арсенал технических средств, используемых для защиты животных от высокодозового ионизирующего излучения.
Требуемый технический результат заключается в повышении эффективности защиты животных от высокодозового ионизирующего излучения и расширении, на этой основе, арсенал технических средств, используемых для защиты животных от высокодозового ионизирующего излучения.
Поставленная задача решается, а требуемый технический результат достигается тем, что, в способе защиты животных от высокодозового ионизирующего излучения, заключающемся в том, что, мышам внутривенно вводят одноразово биологический препарат, согласно изобретению, в качестве биологического препарата, который одноразово вводят внутривенно в период от 30-60 минут до 12 суток до облучения высокодозовым ионизирующим излучением 9-10 Гр, используют препарат суммарной РНК дрожжей S. cerevisiae, содержащий 2-10% молекул в двуцепочечной форме в дозе 7-10 мг, или содержащий не менее 90% молекул в двуцепочечной форме в дозе 0,16-10 мг.
Предложенный способ основан на том, что, непосредственная и пролонгированная защита экспериментальных животных (мышей) от высокодозового ионизирующего излучения (до смертельных доз гамма радиации в 9-10 Гр) основывается на спасении стволовых костномозговых гемопоэтических предшественников (стволовых клеток крови - СКК) фрагментами двуцепочечной РНК (дцРНК), интернализованных в эти СКК.
Достигаемый при осуществлении изобретения технический результат заключается в повышении эффективности системы радиологической защиты биологических объектов и достигается путем расширения арсенала технических средств путем предложения помимо известных нового эффективного с пролонгированным действием и иным механизмом действия радиопротектора дцРНК, выделенной из пекарских дрожжей S. cerevisaiae.
В целом, предложенный технический результат основан на естественной способности свободных фрагментов дцРНК достигать внутренних компартментов СКК. В результате интерференции репаративного процесса репарации повреждений ДНК хромосом, вызванных облучением или по иному механизму действия, доставленные в СКК фрагменты дцРНК спасают эти клетки от апоптотического разрушения. Спасенные СКК мигрируют в селезенку, где формируют пул иммунных клеток и клеток крови, за счет которых происходит восстановление разрушенной иммунной и кроветворной системы и спасение животного от лучевой болезни.
В современной литературе отсутствуют указания на предлагаемый способ радиопротекции, основанный на спасении СКК препаратом дцРНК.
Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает и критерию практической (промышленной) применимости.
На чертеже представлены следующие иллюстрирующие материалы.
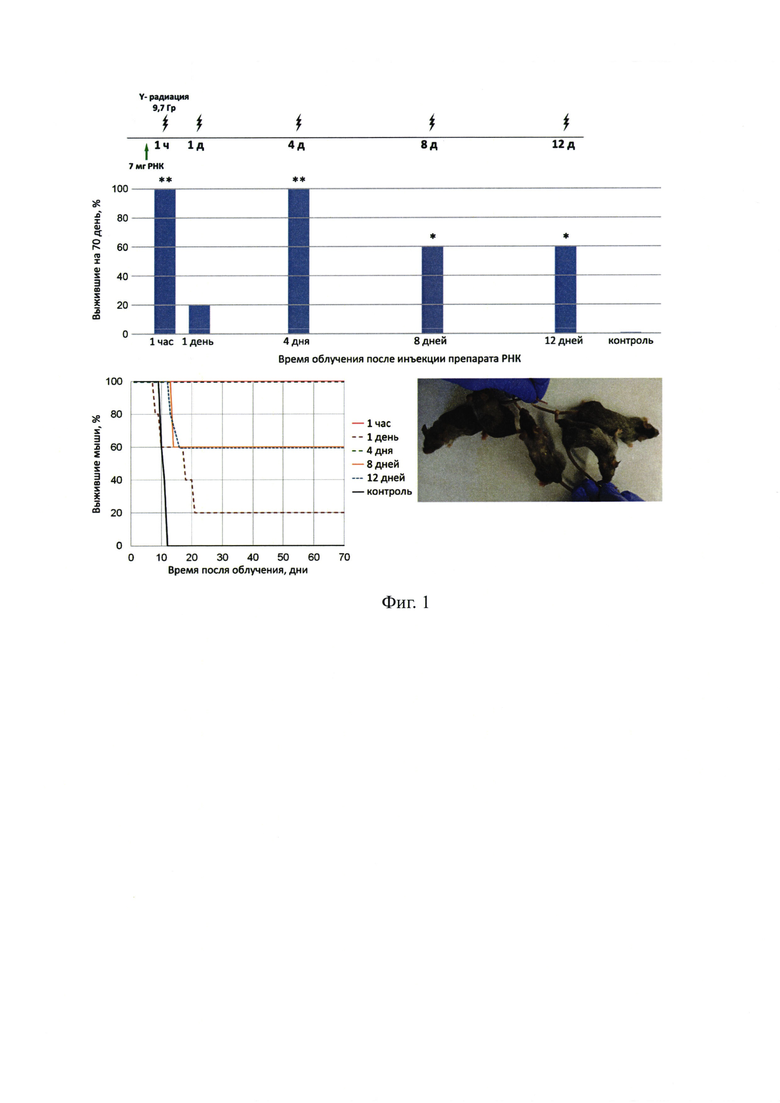
На фиг. 1 - характеристика прямого и пролонгированного радиопротекторного действия препарата РНК, выделенной из дрожжей Saccharomyces cerevisiae, при облучении в абсолютно летальной дозе 9.4 Гр, где А - схема эксперимента и диаграмма выживания мышей (достоверность подсчитана с помощью критерия хи-квадрат в программе Statistica 10 относительно контрольной группы, * p<0,05 ** p<0,01), В - график выживания экспериментальных групп, С - животные, облученные на 4 сутки после введения радиопротектора РНК дрожжей, через 90 суток после облучения.
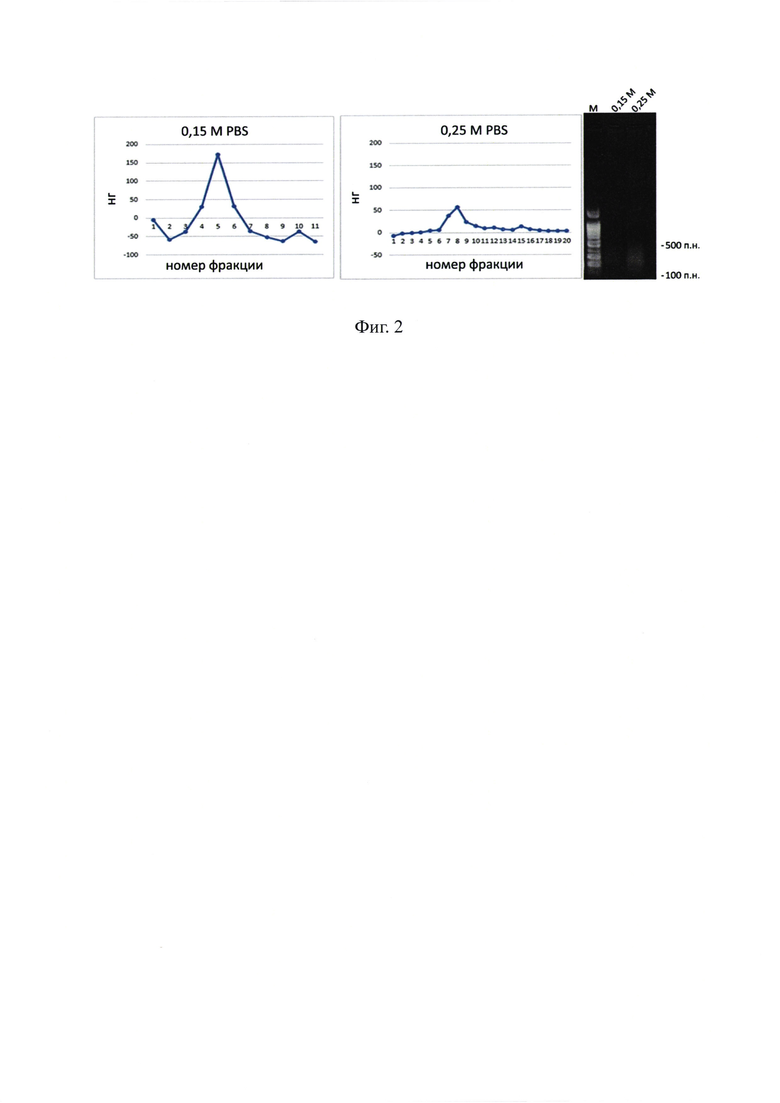
На фиг. 2 - хроматография суммарной РНК дрожжей на ГАП. На графиках представлены профили элюции нуклеиновых кислот в 0.15 М и 0.25 М PBS. На правом блоке представлен электрофоретический анализ подвижности фракций нуклеиновых кислот 0.15 М и 0.25 М в 1% агарозном геле, окраска бромистым этидием. М - маркер молекулярного веса 1 kb.
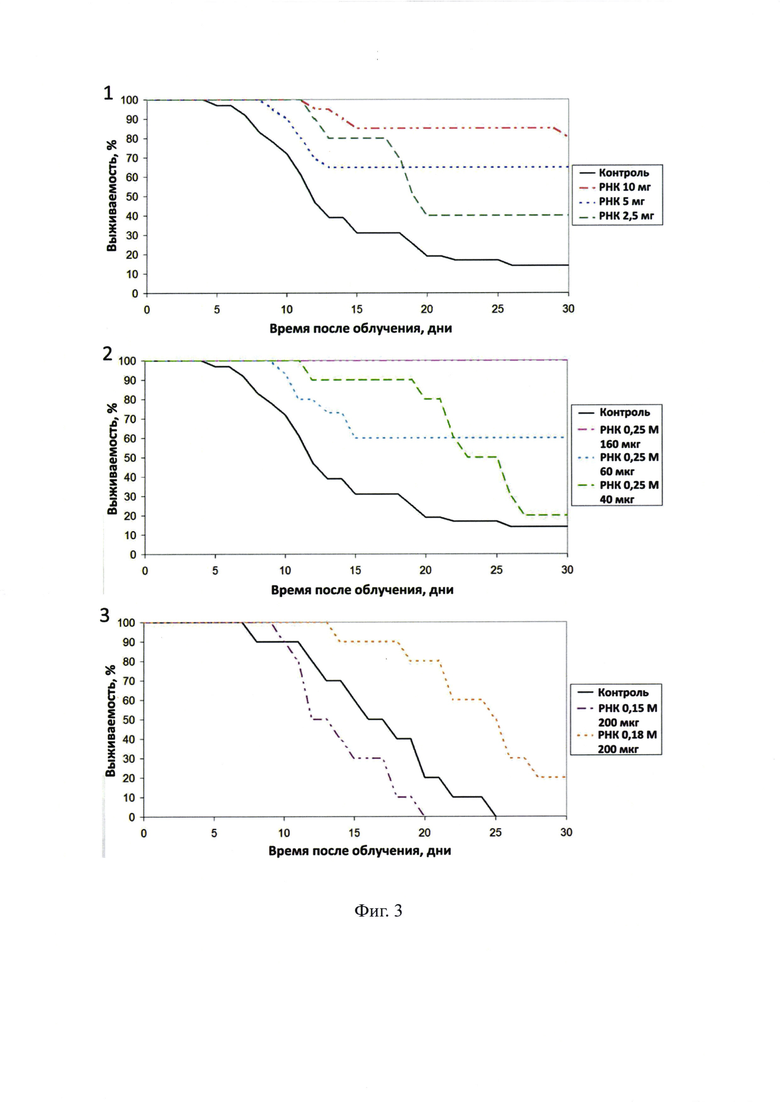
На фиг. 3 - радиопротекторное действие препарата суммарной РНК и ее фракций, полученных элюцией с ГАП 0,15 М, 0,18 М и 0,25 М PBS. Мышей-самцов СВА облучали на гамма-установке (137Cs) в дозе 9,7 Гр при мощности дозы 1,4 Гр/мин. Препараты вводили внутрибрюшинно за 40 мин до облучения. 1 - препарат суммарной РНК в дозах 10 мг, 5 мг и 2,5 мг; 2 - фракция РНК, полученная элюцией 0,25 М PBS, в дозах 160 мкг, 60 мкг и 40 мкг.3 - фракции РНК, полученные при элюции 0,15 М и 0,18 М PBS, в дозе 200 мкг.
На фиг. 4 - оценка содержания ДНК в препарате суммарной РНК дрожжей по цветной реакции Дише. Представлены результаты цветной реакции различных количеств (10-5000 мкг) препарата ДНК в сравнении с препаратом нуклеиновых кислот, полученным после гидролиза 80 мг суммарной дрожжевой РНК. Верхняя часть рисунка - цветные изображения образцов после реакции Дише. На нижней части рисунка приведены цветовые гаммы полученных образцов в сравнении с цветами шкалы понтонов.
На фиг. 5 - группы гомологии и видовая принадлежность секвенированных последовательностей.
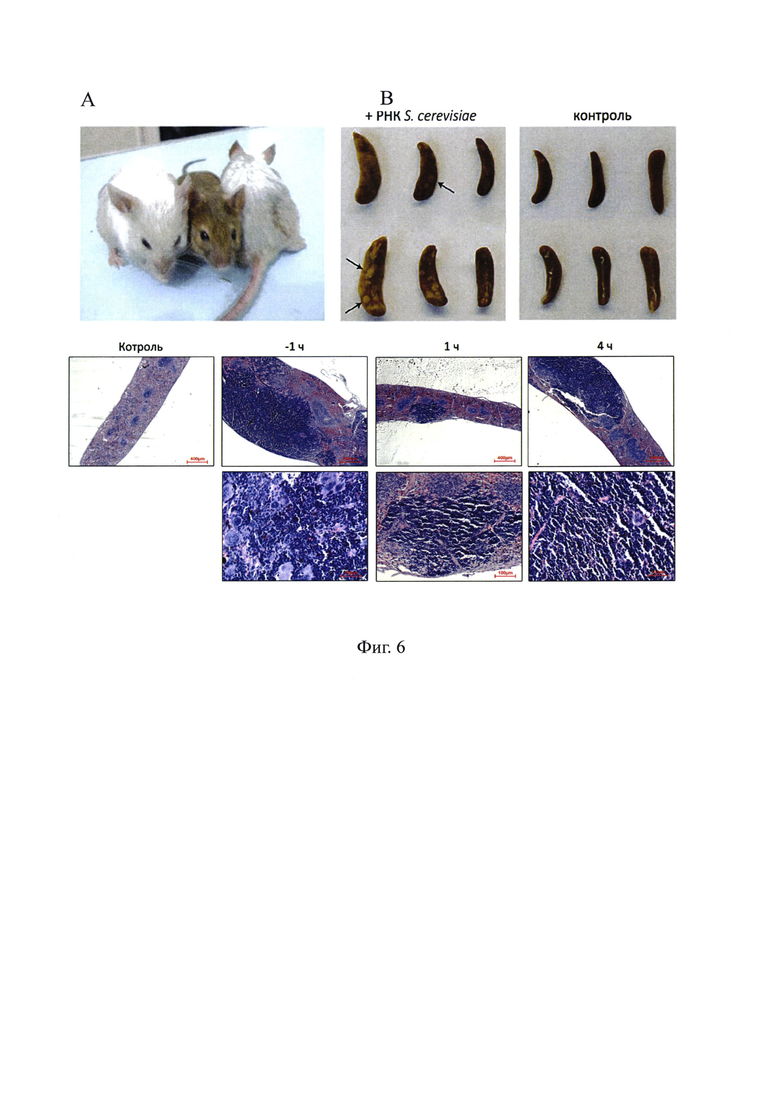
На фиг. 6 - результаты фенотипического сравнения животных, подверженных обработке высокодозовым ионизирующим облучением (по бокам), и интактных животных (в центре). Экспериментальные животные представлены на 150-ые сутки после облучения. В - селезеночные колонии, сформированные у животных, обработанных препаратом дрожжевой РНК, и у контрольных животных. Стрелками указаны лейкоцитарные колонии, являющиеся показателем (критерием) выживаемости экспериментальных мышей. В группе после введения РНК наблюдалось в среднем более 27 колоний на селезенку, в контрольной группе - в среднем меньше 1 колонии на селезенку. С - гистологические срезы селезенок экспериментальных животных на 9-ый день после облучения.
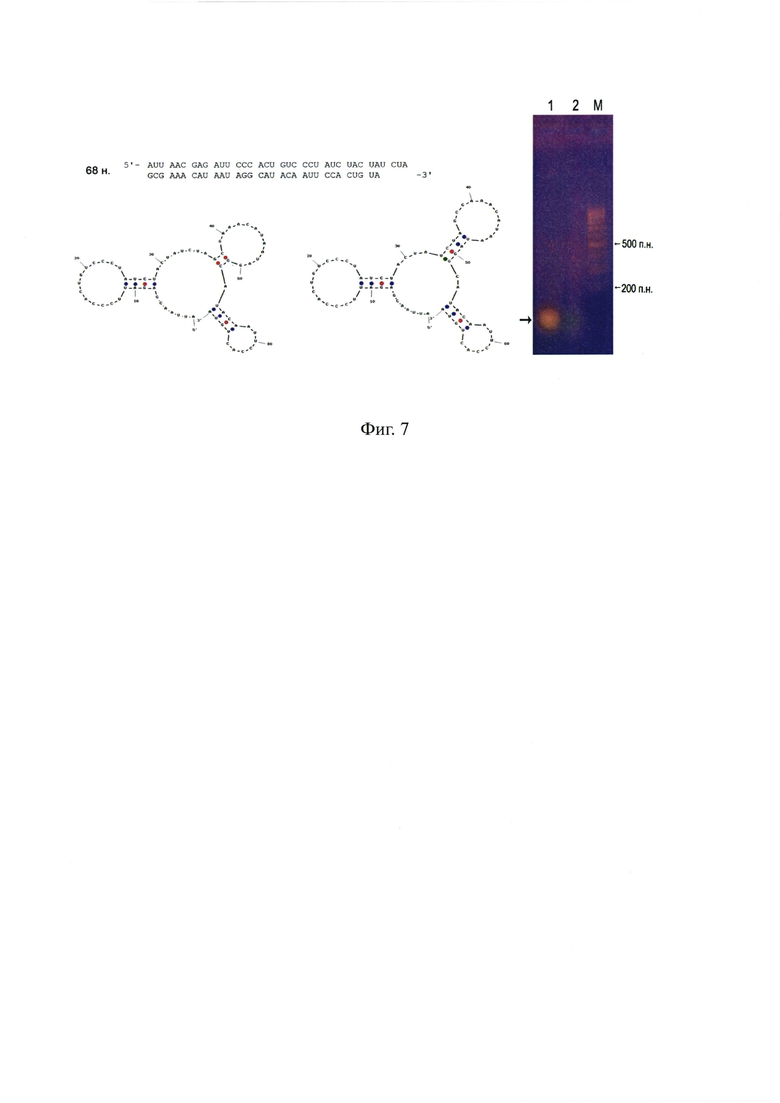
На фиг. 7 - дизайн искусственной молекулы дцРНК, несущей на конце флуорохромную метку 36-FAM. Левая панель - демонстрация возможных спаренных участков искусственной конструкции. Правая панель - демонстрация отожженной синтетической 36-FAM, дцРНК (1) и неотожженной 36-FAM оцРНК (2) на агарозном форезе, маркер молекулярного веса - 100 bp (М).
На фиг. 8 - интернализация искусственной двуцепочечной РНК в клетки костного мозга мыши. А - фиксированные цитологические препараты клеток костного мозга: а - интернализация TAMRA меченой ДНК (красное свечение); b - интернализация 36-FAM меченой двуцепочечной РНК (зеленое свечение). В - совместная локализация 36-FAM дцРНК и Cy5 CD34 антител в системе ex vivo.
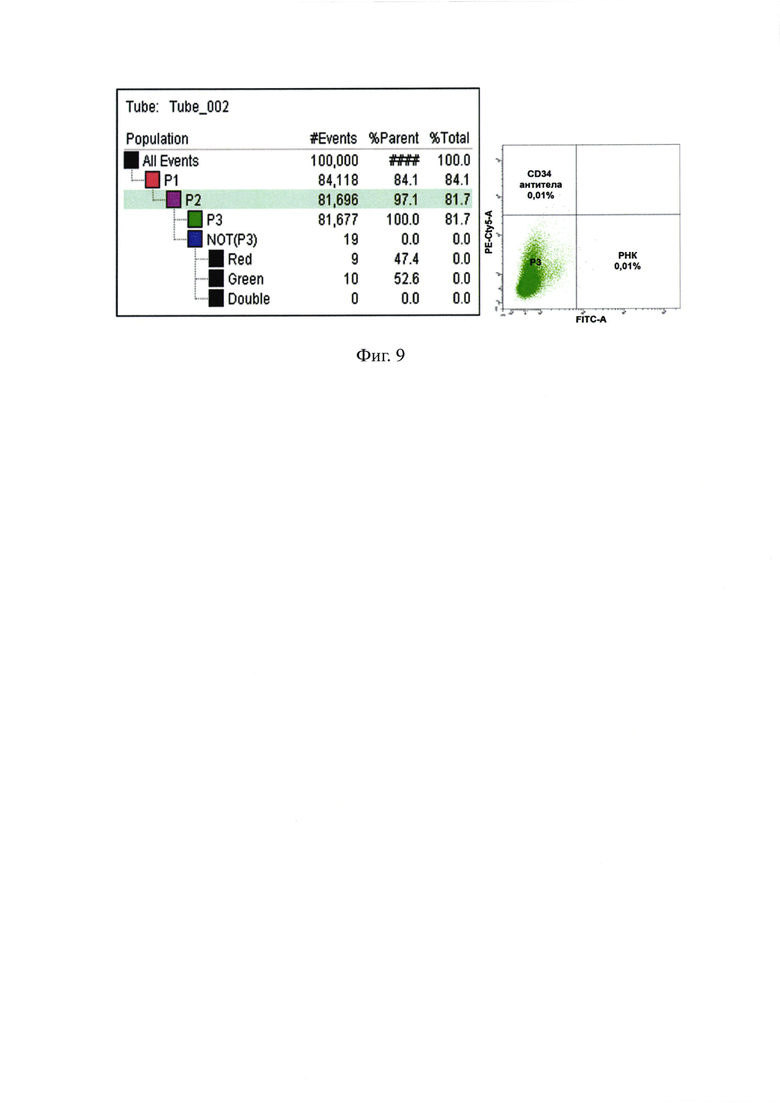
На фиг. 9 - результаты FACS-анализа суспензии клеток костного мозга после инкубации с 36-FAM дцРНК и Cy5 CD34 антителами.
Предложенный способ радиационной защиты реализуется следующим образом.
Предварительно отметим теоретические предпосылки предложенного способа. Способ основан на двух открытых недавно коллективом авторов общебиологических феноменах: 1 - способность низкодифференцированных клеток различного генеза интернализовать фрагменты экстраклеточных двуцепочечных нуклеиновых кислот естественным механизмом интернализации и 2 - способность фрагментов двуцепочечных нуклеиновых кислот, доставленных во внутренние компартменты низкодифференцитрованных клеток различного генеза, включая СКК интерферировать различные типы репарационных процессов, а именно, репарации межцепочечных сшивок, индуцированных действием кросслинкирующих цитостатиков, двуцепочечные разрывы, индуцированные радиацией. В результате такой интерференции, возникшей в определенный момент репаративного процесса, низкодифференцированные клетки или погибают, или восстанавливают свою функциональную целостность. Таким образом, обнаружены универсальный для низкодифференцированных клеток различного генеза молекулярный маркер и однотипный способ воздействия на геном этих клеток через интерференцию репаративного процесса, доставленными во внутренние компартменты этих клеток фрагментов двуцепочечных нуклеиновых кислот.
Предложенный способ защиты животных от высокодозового ионизирующего излучения заключается в том, что, мышам внутривенно вводят одноразово биологический препарат. В качестве биологического препарата, который одноразово вводят внутривенно в период от 30-60 минут до 12 суток до облучения высокодозовым ионизирующим излучением 9-10 Гр, используют препарат суммарной РНК дрожжей S. cerevisiae, содержащий 2-10% молекул в двуцепочечной форме в дозе 7-10 мг, или содержащий не менее 90% молекул в двуцепочечной форме в дозе 0,16-10 мг.
Для проверки реализуемости способа и его ожидаемой высокой эффективности проведены экспериментальные исследования.
При проведении исследований использовалось стандартное лабораторное оборудование фирмы BioRad, Eppendorf. Мыши облучались на гамма-установке ИГО 1 (Россия). Секвенирование проводили по протоколам фирмы Applied Biosystems в Межинститутском центре секвенирования ДНК СО РАН, с использованием 16-капиллярного автоматического секвенатора ДНК ABI3130xl. Концентрацию нуклеиновых кислот и дериватов нуклеиновых кислот измеряли на спектрофотометре NanoDrop 2000 (Thermo Scientific). Микроскопический анализ проводился в ЦКП микроскопического анализа биологических объектов ИЦиГ СО РАН с использованием мироскопов Axioskop 2 и Axio Imager.M1. FACS анализ проводился в ЦКП проточной цитофлуорометрии ИЦиГ СО РАН на приборе BD FACSAria.
В работе использовались: препарат суммарной РНК дрожжей (полирибонат) (НПО «Вектор»), суммарная РНК дрожжей РНК (НПО Биолар), ГАП (гидроксиапатит) (Boeringer), агароза (Медиген), маркер молекулярных весов ДНК (100 bp и 1 kb) (Медиген), набор для синтеза кДНК (Медиген), набор ПФУ полимеразы (Медиген), система для клонирования (Медиген), набор для проведения DOP ПЦР (Медиген), набор для секвенирования; Big Dye (Applieg Biosystems, USA), DEPC (Медиген), праймеры M13, DOP-PCR праймеры, антитела к гистону γН2АХ (anti-phospho-histone+ goat anti rabbit IgG FITC-conjugate, Sigma, США), антитела к CD34 (BD Bioscience).
Штамм E. coli XL1-Blue MRF любезно предоставлен лабораторией иммуногенетики ИМКБ СО РАН.
Клонирование проводили в плазмидный вектор Bluescript (НПО Вектор).
Для выравнивания последовательностей и анализа их хромосомной локализации были использованы данные Gene bank и программы Vector NTI и Genome.ucsc.edu. «Кометные хвосты» анализировались программой Casp (Casplab). Подсчет клеток проводился с помощью программы ImageJ.
В качестве экспериментальных животных использовались 3-х месячные мыши линии СВА и CC57BL обоих полов.
Облучение мышей проводили на гамма-установке (источник Cz137) дозой 9,4 Гр при мощности дозы 0,7 Гр/мин в течение 12 мин 42 сек. Подопытных и контрольных животных облучали группами по 9-10 животных, последовательно, в контейнере размером 20×20×40 см, во избежание гипоксического шока. Радиопротекторное действие препарата оценивали по гибели экспериментальных животных в промежуток времени до 30-90 суток.
Очистка препарата РНК проводилась следующим образом. 1 г препарата сухой РНК (НПО Биолар) растворяли в 20 мл DEPC H2O и центрифугировали 10 мин, 3220 g, 4°С. Супернатант экстрагировали равным объемом фенол/хлороформ. Водную фракцию отбирали и РНК осаждали 2 объемами этанола в присутствии 0,3M NaAc (рН 5,2). Осадок РНК промывали 70% этанолом, высушивали и растворяли в 10 мл DEPC H2O. Концентрацию РНК измеряли на спектрофотометре NanoDrop 2000. Раствор РНК стерилизовали через фильтр 0,22 мкм (Millipor) и хранили на -20°C.
Хроматографию проводили на колонке объемом 10 мл, диаметром 1 см. Сухой гидроксиапатит (ГАП) подвергали набуханию в 10 мл воды, после чего заполняли колонку. Колонку промывали 30 мл 0,01 М фосфатного буфера (PBS) (3 объема колонки). Наносили на колонку раствор РНК и промывали 0,01 М PBS, рН 7,4 (30 мл). Элюировали РНК 0,15М PBS, затем промывали 0,18 М PBS и повторно элюировали нуклеиновые кислоты 0,25 М PBS.
Полученный при хроматографии раствор РНК в PBS диализовали против ТЕ-буфера (H2O обработанная DEPC; 10 mM Tris-HCl, 10 mM ЭДТА, рН 7,4) при +4°C в течение суток с двумя сменами буфера.
Концентрацию нуклеиновых кислот и дериватов нуклеиновых кислот измеряли на спектрофотометре (NanoDrop 2000, Thermo Scientific) при соответствующих длинах волн в зависимости от эксперимента.
Электрофорез препаратов нуклеиновых кислот проводился в 1% или 1,5% агарозном геле с содержанием 2 мкг/мл бромистого этидия в трис-ацетатном буфере (0,04 М трис-ацетат, 0,002 М ЭДТА, рН 7,6).
Качественная реакция на ДНК (реакция Дише) проводилась следующим образом. Метод основан на способности дезоксирибозы образовывать соединение синего цвета с дифениламином при нагревании в среде, содержащей смесь ледяной уксусной и концентрированной серной кислот. С рибозой РНК аналогичная реакция дает зеленое окрашивание. Дифениламиновый реактив представляет собой 1% (W/V) раствор дифениламина в смеси ледяной уксусной кислоты и 2,75% (W/V) концентрированной серной кислоты (p20=1,836). К осадку нуклеиновых кислот добавляют 0,5 мл раствора едкого натра (0.1М) и приливают равный объем дифениламинового реактива. Раствор нагревают в течение 15-20 мин на кипящей водяной бане. Появляется характерное для субстрата окрашивание [Шапиро. Практикум по биологической химии. 2-е изд. Минск, 1976.].
Клонирование кДНК копий молекул РНК, элюирующихся с ГАП 0,25 М PBS. Для получения кДНК с РНК использовалась система ревертазного синтеза и набор DOP-PCR master kit (Медиген). Реакции проводились согласно прилагаемой инструкции. кДНК копии клонировали в векторе Bluescript после «полировки» концов фрагментов с использованием Pfu полимеразы, и трансформировали в электрокомпетентные клетки XL1- Blue MRF-. После анализа электрофоретической подвижности ДНК, выделенной из полученных трансформантов, отобранные клоны были секвенирование с использованием протокола фирмы Applied Biosystems, США [Маниатис Т. Методы генной инженерии. Молекулярное клонирование: Пер. с англ. // Маниатис Т., Фрич Э., Сэмбук Дж. - Москва: Мир, 1984].
Секвенированные клоны анализировались в программе Vector NTI. Последовательности были выравнены и собраны в гомологичные группы. Контекстный анализ, проводили на сайте http://genome.ucsc.edu, используя инструмент Blat.
Клетки костного мозга мышей вымывали из трубчатых костей средой RPMI-1640, тщательно ресуспендировали. Суспензию аккуратно наслаивали на 3 мл смеси фикол-урографин (15% урографин, 7% фиколл, ρ 1,119), центрифугировали при 400 g, 4°C в течение 40 мин. После центрифугирования вся клеточная масса разделялась на клетки, составляющие интерфазное кольцо (мононуклеары) и осадок. Мононуклеары отбирали в новую пробирку, промывали 4 мл RPMI-1640 и осаждали центрифугированием при 400 g, 4°C в течение 5 мин. Супернатант сливали, а осадок клеток ресуспендировали в 1 мл RPMI-1640 для подсчета количества в камере Горяева [Маниатис Т. Методы генной инженерии. Молекулярное клонирование: Пер. с англ. // Маниатис Т., Фрич Э., Сэмбук Дж. - Москва: Мир, 1984].
Для создания искусственной молекулы РНК были анализированы все возможные комбинации гомологичных участков секвенированных клонов кДНК на наличие шпилек. Анализ проводился с помощью программы OligoAnalyzer 3.1. Была найдена комбинация последовательностей двух клонов, которая могла формировать три коротких АТ-богатых шпильки, с минимальными значениями энергии Гиббса, которые не мешали формированию дуплексов при отжиге. Для синтеза комплементарных молекул РНК, содержащих флуоресцеин на 3'-конце, был использован метод автоматического фосфитамидного твердофазного синтеза. Синтез проводят путем пошагового удлинения олигонуклеотидой цепи, ковалентно связанной с помощью "якорной" группы с нерастворимым полимерным носителем. Синтетический цикл состоит из четырех стадий: деблокирования 5'-гидроксильной группы, последующей конденсации с очередным синтоном, кэпирования и окисления. Процесс повторяется до тех пор, пока олигомер не достигнет заданной длины, после чего проводят его полное деблокирование и выделение. Синтез был выполнен в лаборатории химии РНК ИХБФМ СО РАН. Для отжига по 20 pmol комплементарных цепей молекул РНК, объединяли в 1× буфере для отжига. Пробирку с РНК нагревали до 100°C и оставляли медленно охлаждаться до комнатной температуры. Отожженные цепи хранили при 4°C. Буфер для отжига ×10: 0,2 М Tris-HCl (рН 7,5); 0,1 М MgCl2; 0,5 М NaCl [molbiol.edu.ru].
Для интернализации меченой нуклеиновой кислоты в клетки костного мозга к 500 тыс клеток костного мозга, ресуспендированных в 200 мкл RPMI-1640, добавляли 0.1 мкг меченой флуорохромом нуклеиновой кислоты, и инкубировали в течение часа в темноте при комнатной температуре. После инкубации, клетки дважды промывали средой и ресуспендировали в 200 мкл RPMI-1640. Суспензию клеток осаждали на предметное стекло цитоспином. Препарат заключали в DAPI/DAPCO/глицерин и анализировали с помощью микроскопа Axio Imager.M1. Либо суспензия переносилась в планшет и анализировалась с помощью микроскопа Axioskop 2 [Dolgova E.V. et al. "Delayed death" phenomenon: a synergistic action of cyclophosphamide and exogenous DNA // Gene. - 2012. - Vol. 495. - №2. - P. 134-145].
Для патоморфологического анализа селезенки фиксировались в нейтральном 4% формальдегиде и заливались в парафиновые блоки. Парафиновые срезы проводились через серию спиртов и окрашивались гематоксилином-эозином.
В работах использовались услуги ЦКП проточной цитометрии ИЦиГ СО РАН, ЦКП микроскопического анализа биологических объектов СО РАН, ЦКП «SPF-виварий» ИЦиГ СО РАН.
Статистический анализ проводили при помощи программы Statistica 10.
Рассмотрим более подробно базовые экспериментальные подтверждения радиозащитного действия дцРНК, выделенной из S. cerevisiae.
Проведем анализ эффекта непосредственного и пролонгированного радиопротекторного действия препарата дрожжевой РНК.
Для проведенных исследований был использован коммерчески доступный препарат дрожжевой РНК, продемонстрировавший в предварительных тестах 100% радиозащитный эффект при летальной дозе облучения 9.4 Гр. Была оценена длительность радиозащитного действия препарата РНК дрожжей. Очищенная, стерильная РНК дрожжей вводилась экспериментальным животным в количестве 7-10 мг за час, за сутки, за 4, 8 и 12 суток до облучения летальной дозой радиации 9.4 Гр. Введение такого количества экзогенного материала нуклеиновых кислот приводило к кратковременному токсическому шоку (мыши в течение 10-15 минут неподвижно лежали). Результаты эксперимента приведены на фиг. 1. Оказалось, при облучении, проводимом до облучения и на 4 сутки от введения препарата РНК, к 70 суткам наблюдения выживает 100%, на 8 и 12 сутки 40-60% животных. Оказался неожиданным факт практически полной гибели экспериментальной группы мышей, облученных через сутки после введения препарата РНК.
Рассмотрим радиопротекторное действие двух фракций дрожжевой РНК
Что является активным началом, определяющим радиопротекторный эффект препарата РНК, выделенной из дрожжей Saccharomyces cerevisiae?
Аналитическое исследование препарата суммарной РНК дрожжей свидетельствовало, что в препарате присутствуют две четко разграниченные фракции, одна из которых элюируется с ГАП как одноцепочечная РНК при элюции 0.15 М PBS. Вторая фракция элюируется в условиях, характерных для двуцепочечных нуклеиновых кислот, при 0.25 М PBS (фиг. 2).
Проведенные эксперименты по радиопротекции обеих фракций свидетельствовали, что радиопротекторные свойства характерны только для фракции, элюирующейся в 0.25 М PBS. При этом количество вводимого препарата, необходимое для радиопротекторного действия, многократно сокращалось. Если для достижения 80%-100% радиозащитного эффекта требуется 7-10 мг препарата РНК на мышь, то при использовании фракции, элюирующейся в 0.25 М PBS, количество препарата, равное 160 мкг на мышь, полностью защищает животное от абсолютно летальной дозы γ-облучения (фиг. 3).
Проанализируем тип нуклеиновых кислот, составляющих фракцию 0,25 М.
Одним из вопросов, касающихся фракции дрожжевой РНК, обладающей радиопротекторным действием, элюирующейся в условиях, характерных для двуцепочечных структур ДНК или РНК (0,25 М PBS), был вопрос о типе нуклеиновых кислот этой фракции. В этой связи были проведены эксперименты по характеристике молекулярного состава обеих фракций суммарной РНК дрожжей.
Для исследования, как и для экспериментов по радиопротекции, фракционирование нуклеиновых кислот препарата дрожжевой РНК осуществляли методом адсорбционной хроматографии на колонке с ГАП. Было проведено два независимых выделения, в обоих выделениях был получен близкий результат. Препарат суммарной РНК дрожжей (полирибонат) (НПО «Вектор» г. Новосибирск) в количестве 20 мг растворяли в 3 мл 0,01 М PBS. Хроматографию проводили на колонке объемом 10 мл, диаметром 1 см. Для 0,25 М объем фракций составил 1,5 мл. Фракции, содержащие нуклеиновые кислоты, объединяли и диализовали против диэтилпирокарбонат (DEPC) обработанной H2O в течение 18 часов. Концентрация измерялась на спектрофотометре NanoDrop в 1 N NaOH. Измерение проводилось при коэффициенте экстинкции, равном 33. В репрезентативном эксперименте для фракции, элюирующейся при 0,15 М, концентрация составила 93,6 нг/мкл, для фракции 0,25 М концентрация составила 37,0 нг/мкл. Размер элюирующихся нуклеиновых кислот находился в пределах 50-400 п.н. (фиг. 2).
Для определения типа нуклеиновых кислот фракций, были проведены различные эксперименты с использованием обработки нуклеазами (ДНКаза I, SI нуклеаза) после денатурации или щелочью, или кипячением, или без таковой, которые не дали однозначно трактуемых результатов. В результате, для анализа принадлежности анализируемой фракции к тому или иному типу нуклеиновых кислот был выбран метод анализа нуклеиновых кислот, описанный в работе [Спирин. Спектрофотометрическое определение суммарного количества нуклеиновых кислот // Биохимия. - 1958. - Т. 23. - №5. - С. 656-662], модифицированный согласно Шмидта-Таннгаузера. Расчет содержания нуклеиновых кислот в гидролизованной фракции велся согласно формуле, приведенной в работе Спирина. В Таблице 1 приведены результаты проведенных измерений. При осаждении хлорной кислотой не удалось визуализировать выпадения какого-либо значимого осадка, что косвенно свидетельствовало об отсутствии в образце ДНК. Также проведенный спектрофотометрический анализ содержания вещества нуклеиновых кислот в предполагаемом осадке после центрифугирования и перерастворения подтвердил предыдущее наблюдение об отсутствии материала нуклеиновых кислот во фракции, осажденной хлорной кислотой. Супернатант обеих фракций был проанализирован на содержание фосфора, как это требуется по методу Спирина в модификации Шмидта-Таннгаузера. Результаты измерений приведены в Таблице 1.

Содержание дериватов рибонуклеиновых кислот в пересчете на Na-PHK (X) в препарате в процентах определяли по формуле:
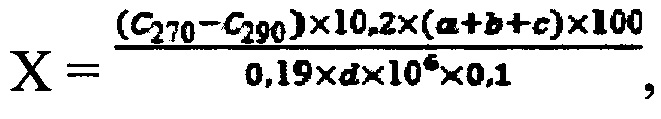 где:
где:
C270 и C290 - концентрация растворов при 270 и 290 нм;
10,2 - коэффициент пересчета содержания нуклеинового фосфора на содержание натрия рибонуклеата;
0,19 - разность удельных показателей поглощения (Е) ДНК при длинах волн 270 и 290 нм при концентрации фосфора 1 мкг/мл;
1 - толщина поглощающего слоя кюветы, см, либо 0,1 - если измерение проводили при помощи Nanodrop;
a - объем добавленного гидроксида натрия, мл;
b - объем добавленной хлорной кислоты, мл;
c - объем разведения сухой навески, мл;
d - навеска препарата в пересчете на сухое вещество, г;
106 - перевод граммов в микрограммы.
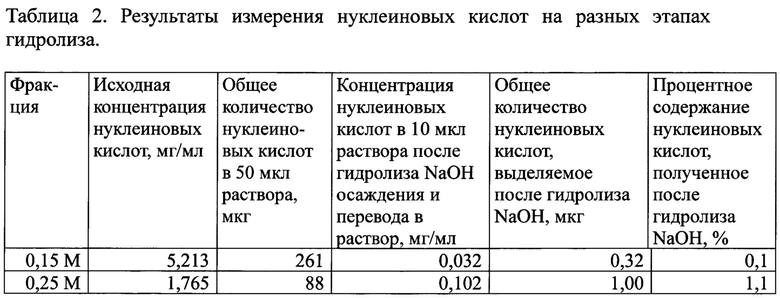
Проведенные расчеты свидетельствуют, что количество РНК в образцах, составляет 92% для фракции «0,15 М» и 90% для фракции «0,25 М». Нам не удалось показать 100% присутствия молекул РНК в обеих фракциях в двух экспериментальных повторах. Такой результат мог быть связан с двумя обстоятельствами. В первом случае не 100% содержание РНК молекул в образце могло быть связано с ошибкой вследствие малых объемов проб. Вторая возможность могла быть связана с тем, что во фракции «0,25 М» присутствуют молекулы ДНК. Для выявления возможного присутствия ДНК в анализируемой фракции было проведено несколько серий экспериментов. Первоначально была предпринята попытка определить количество нуклеиновых кислот, сохранившееся в форме двуцепочечного полимера после гидролиза слабой щелочью путем количественного осаждения изопропанолом. Были взяты две пробы нуклеиновых кислот из фракции «0,15 М» и фракции «0,25 М». Пробы были гидролизованы слабой щелочью (см. материалы и методы). После гидролиза образцы нейтрализовали добавлением Tris-HCl (рН 7,5) и не деградированный материал нуклеиновых кислот осаждали равным объемом изопропанола из 0,3 М ацетата натрия (рН 5,2). Результаты эксперимента суммированы в Таблице 2.
Оказалось, что фракция, смываемая 0.25 М PBS, содержит более 1% материала нуклеиновых кислот в двуцепочечной форме. Что это могло значить? Во-первых, самое простое объяснение связано с контаминацией фракции двуцепочечной РНК молекулами ДНК. Во-вторых, фракция «0.25 М» могла содержать РНК/ДНК гибриды. В-третьих, даже при химическом гидролизе могут сохраняться не деградированные двуцепочечные формы РНК.
Чтобы оценить присутствие ДНК были проведены эксперименты по качественному анализу образцов с использованием дифениламина и специфической цветной реакции на дезоксирибозу. 100-500 мг исходного препарата РНК гидролизовались 24 ч слабой щелочью. После гидролиза проводилось осаждение двуцепочечной полимерной формы нуклеиновых кислот как изопропанолом, так и HClO4. Предполагалось, что если в 10 мг исходной РНК присутствует до ~10% двуцепочечной формы нуклеиновых кислот, а в во фракции «0.25 М» присутствует 1% предположительно ДНК (что составляет 10 мкг), то при выделении из большого количества исходного препарата РНК будет достигнут выход (предположительно ДНК) порядка 20-100 мкг, что будет давать уверенную цветную реакцию. Полученные результаты (фиг. 4) свидетельствуют, что в препарате РНК, если и присутствуют остаточные ДНК, то их количество пренебрежительно мало, и, исходя из соображения «количества действующего вещества» принимать участие в радиопротекторном действии не может. И, таким образом, можно полагать, что во фракции 0,25 М присутствуют практически только молекулы двуцепочечной РНК.
Проанализируем первичную последовательность клонированных фрагментов двуцепочечной РНК фракции 0,25 М.
Является ли определяющей для осуществления радиопротекторного действия первичная структура молекул двуцепочечной РНК препарата РНК, выделенной из дрожжей S. cerevisiae?
Для ответа на этот вопрос было необходимо проанализировать первичную последовательность молекул РНК, выделяемой в двуцепочечной форме. Также было необходимо определить принадлежность составляющих двуцепочечных РНК фрагментов к генетическим локусам хромосом дрожжей. Определение типа нуклеиновых кислот фракции 0.25 М как двуцепочечной РНК определило стратегию клонирования последовательностей РНК, входящих в состав фракции. Для получения кДНК с указанной РНК был использован подход, включающий DOP ПЦР, синтез кДНК, амплификацию синтезированных кДНК, полировку концов с использованием Pfu полимеразы и клонирования затупленных фрагментов в плазмиду pBlueScript, гидролизованную рестриктазой EcoR V, дающей тупые концы. Были проведены два независимых раунда синтеза кДНК. В первом эксперименте размер кДНК и ПЦР фрагментов находился в пределах 10-110 п.о. Результатом второго синтеза были фрагменты размером 100-400 п.о. Образцы были объединены и ДНК клонирована. В результате генно-инженерных операций была получена библиотека из 43 клонов, которые были наработаны и сиквенированы. Последовательности секвинированных клонов были объединены в группы гомологий, которые представлены на фиг. 5. Происхождение найденных РНК находится в подписи к каждой группе гомологий.
Анализ последовательностей секвенированных клонов свидетельствует, что в популяции выделяемых молекул присутствуют две категории двуцепочечной РНК. Первая, последовательности которых находятся в базах данных как относящиеся к S. cerevisiae. Определенные РНК молекулы в своем большинстве принадлежат к рибосомальным РНК или РНК, относящимся к белкам, ассоциированных с рибосомами. И вторая, последовательности которых не определены как принадлежащие к какому-то виду организмов в принципе. Такая картина может быть связана с контаминацией неопределенными микроорганизмами культуры дрожжей при их промышленной наработке. Также возможна ситуация, что не все последовательности пекарских дрожжей идентифицированы и присутствуют в базах данных. Приведенные данные предполагают, что для радиозащитного действия нуклеотидные последовательности фрагментов РНК не имеют значения. Основным является двуцепочечная структура РНК. В этой связи неопределенность принадлежности некоторых полученных РНК структур к определенному виду организмов является для целей работы не существенным фактом. Важным является то, что эти структуры имеют двуцепочечную форму.
Охарактеризуем систему клеток, на которую оказывается воздействие, приводящее к проявлению радиопротекторных свойств препарата РНК, выделенной из дрожжей S. cerevisiae.
Анализ состояния экспериментальных животных, выживших после летальных доз γ-радиации в отдаленные сроки после проведенного облучения, свидетельствовал о значительных нарушениях в клетках, формирующих кожный покров мышей. В течение 50-150 дней после обработки мыши прогрессивно седели (фиг. 6А). Анализ развития селезеночных колоний после проведенного облучения проведенного на 9-12 сутки после воздействия предполагал, что главной мишенью воздействия препарата РНК являлись стволовые клетки крови костного мозга. Спасенные от разрушения ионизирующим облучением гемопоэтические предшественники способны выходить на периферию и заполнять опустошенные вследствие обработки радиацией иммунокомпетентные органы, например, селезенку. В результате мобилизации спасенных стволовых клеток крови в белой пульпе селезенки формируются селезеночные колонии, из которых развивается новая иммунная и кроветворная системы организма взамен разрушенных радиацией (фиг. 6B). Был проведен анализ гистологический срезов селезенок контрольных и экспериментальных мышей (фиг. 6С). В селезенках контрольных групп капсула и перегородки отчетливо выражены. Лимфатические фолликулы достаточно многочисленные, однако резко сокращены в размерах до периартериальной зоны (фиг. 6С). В пространстве красной пульпы различимы скопления апоптотирующих клеток с признаками баллонной дистрофии, отчего такие участки кажутся вспененными. Воспалительно-клеточная реакция не выражена, ни в местах деструкции клеточных элементов, ни на дистанции от них. В дополнение к перечисленному, клеточный состав красной пульпы характеризовался отсутствием мегакариоцитов.
У мышей, которым ввели препарат РНК за 1 ч до облучения («-1 ч»), капсула сохраняет целостность. Визуально создается впечатление, что большая часть паренхимы занята сплошной массой пролиферирующих лимфоцитов, (фиг. 6С). Лимфатические фолликулы на оставшейся площади среза органа выглядят несколько опустошенными. В красной пульпе увеличено содержание нейтрофильных гранулоцитов. Местами встречаются скопления мегакариоцитов
У группы «1 ч», которой препарат РНК ввели через час после облучения. Капсула на всем протяжении сохранена. Обнаруживается один крупный очаг пролиферации лимфоцитов, занимающий менее 1/10 объема паренхимы (фиг. 6С). Фолликулы белой пульпы редуцированы в отношении топографических зон. В большинстве из них определяется только периартериальная область. В целом несколько увеличено содержание нейтрофильных гранулоцитов.
У группы «4 ч», получившей препарат РНК через 4 часа после облучения, капсула не нарушена, выглядит отчетливо. По меньшей мере, половину объема стромы занимают крупные очаги пролиферации лимфоидных элементов. Белая пульпа представлена довольно многочисленными мелкими лимфатическими фолликулами, несколько гетерогенными по степени дифференцированности их функциональных зон. В клеточном составе красной пульпы довольно многочисленны нейтрофильные гранулоциты. На отдельных участках обнаруживаются крупные скопления мегакариоцитов (фиг. 6С).
Полученный результат свидетельствует об активной пролиферации клеточных элементов в паренхиме селезенок мышей, обработанных до облучения и через 4 часа после экспозиции к γ лучам.
Рассмотрим интернализацию двуцепочечной РНК в клетки костного мозга мышей.
Для проверки гипотезы о попадании молекул двуцепочечной РНК во внутренние компартменты стволовых гемопоэтических клеток и их спасении от повреждения, вызванного гамма облучением, был разработан экспериментальный дизайн и проведены исследования.
Первоначально была сконструирована искусственная молекула РНК, состоящая из двух частей, принадлежащих двум секвенированным клонам №6 и №17.
Прямая последовательность:
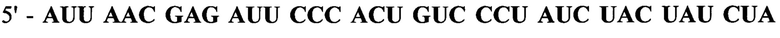
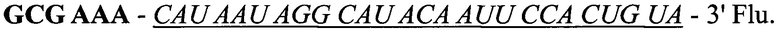
Комплементарная последовательность:

Жирным шрифтом обозначена последовательность клона №6. Курсивом обозначена последовательность клона №17. Конструкция была синтезирована твердофазным способом. На 3' конец молекулы РНК была присоединена флуоресцентная метка 36-FAM. Для целей экспериментов были синтезированы две комплементарные цепи РНК. Перед экспериментом необходимое количество материала комплементарных цепей, взятых в эквимолярном количестве, отжигалось. Эффективность отжига проверялась по свечению с бромистым этидием и электрофоретически на присутствие не отожженных РНК. Структура синтетической молекулы была подобрана таким образом, чтобы возможность формирования двуцепочнечных участков была минимальной (фиг. 7).
Синтезированный отожженный зонд использовался для оценки эффективности интернализации искусственной двуцепочечной РНК в клетки костного мозга мыши. В некоторых случаях, в качестве контрольного образца использовался стандартизованный и охарактеризованный во многих наших публикациям TAMRA ПЦР меченый ДНК-зонд AluI фрагмента человека.
Было проведено несколько серий экспериментов. Образцы клеток костного мозга были проанализированы как на фиксированных цитологических препаратах, так и в системе ex vivo с использованием конфокального микроскопа. Подготовка проб для фиксированных цитологических препаратов состояла из следующих процедур: Клетки костного мозга мыши вымывались из бедренных и плечевых костей. После очистки мононуклеаров на фикол/верографиновом градиенте клетки инкубировали в течение часа с зондом. Соотношение зонда составляло 200 нг материала нуклеиновых кислот на 106 клеток. После инкубации клетки осаждались «цитоспином» на предметное стекло, покрывались смесью DAPCO/DAPI/глицерин и анализировались на флуоресцентном микроскопе (Axio Imager М2). Результаты экспериментов представлены на фиг. 8А. В ex vivo экспериментах была проведена совместная локализация двуцепочечной РНК, меченной 36-FAM, и антител к CD34, меченных Cy5 (фиг. 8B). Известно, что CD34+ клетки костного мозга представляют собой плюри/мультпотентные стволовые гемопоэтические предшественники. Цитологическое подтверждение присутствия двуцепочечной РНК в таких клетках было бы одним из принципиальных доказательств осуществления радиопротекции через спасение этого типа клеток в результате попадания в них двуцепочечных фрагментов РНК.
Клетки костного мозга инкубировали в течение часа с меченой 36-FAM РНК и антителами к CD34 меченными Cy5 и сортировали в зеленом лазере. Оказалось, что в клетках костного мозга мыши присутствуют клетки, способные захватывать двуцепочечную РНК. Более того эти клетки одновременно несут маркер стволовых клеток КМ мыши CD34. Было оценено количество таких клеток микроскопически. На фиксированных препаратах обнаруживалось незначительное число клеток, захвативших молекулы двуцепочечной РНК, процент которых был оценен как 0.025% от общего числа клеток костного мозга мыши. В ex vivo экспериментах, при сортировки меченых клеток в образце был выявлен 0.01% клеток, несущих специфический сигнал (фиг. 9).
Низкий по сравнению с имеющимися литературными данными процент клеток, несущих метку может быть связан с тем, что захватывают меченую РНК наиболее низкодифференцированные, плюрипотентные предшественники, от жизнеспособности которых и зависит восстановление иммунной и кроветворной системы облученного животного.
В заключение рассмотрим основную концепцию радиопротекторного действия рибонуклеиновых кислот, которая на настоящий момент времени выглядит следующим образом. Фрагменты экстраклеточных двуцепочечных рибонуклеиновых кислот доставляются в стволовые клетки крови за счет нового до конца не охарактеризованного механизма. Или за счет простого экранирования продуктов перекисного окисления, образованных гамма радиацией, или, в более сложном варианте, за счет участия в репарации повреждений хроматина, эти фрагменты способствуют или сохранению, или корректному восстановлению поврежденного хромосомного континуума. Стволовые клетки крови выживают после смертельного облучения. Далее происходит мобилизация выживших стволовых клеток и их локализация в селезенке, где формируется пул клеток, являющихся источником восстановления иммунной и кроветворной систем организма.
Таким образом, новый радиопротектор с непосредственным и пролонгированным радиозащитным действием, и с иным механизмом действия, представляющий собой дцРНК, выделенную из пекарских дрожжей S. cerevisiae. позволяет достичь требуемый результат, заключающийся в повышении эффективности защиты животных от высокодозового ионизирующего излучения и расширении, на этой основе, арсенала технических средств, используемых для защиты животных от высокодозового ионизирующего излучения. Полученный технический результат может служить основой для разработки способов зажиты населения страны в чрезвычайных ситуациях.
Список использованных источников
1. RU 2599844, C1, A61K 31/433, 20.10.2016
2. Шашков B.C. и др. Эффективность серотонина, мексамина, АЭТ и цистамина при повторном введении после гамма-облучения // Радиобиология. - 1971. - Т. XI, вып. 4. - С. 621-623.
3. Владимиров В.Г. и др. Радиопротекторы: структура и функции / Киев, Наукова Думка. - 1989, 196 с.
4. RU 2049469, C1, A61K 31/66, 10.12.1995
5. Кондакова Н.В. и др. Радиопротекторная активность дигидрокверцетина в экспериментах in vitro и in vivo // Биомедицинские технологии. - 1998. - С. 66-70.
6. RU 2144357, С1, A61K 31/66, 10.12.1995
7. ЕР 2044938, A61K 31/44, 28.07.1995
8. Жеребченко П.Г. Противолучевые свойства индолилалкиламинов / М.: Атомиздат. - 1971, 135 с.
9. RU 2613102, С1, A61K 36/00, 15.03.2017
10. RU 2568905, C1, A61K 36/15, 20.11.2015
11. Шапиро. Практикум по биологической химии. 2-е изд. Минск, 1976.
12. Маниатис Т. Методы генной инженерии. Молекулярное клонирование: Пер. с англ. // Маниатис Т., Фрич Э., Сэмбук Дж. - Москва: Мир, 1984.
13. molbiol.edu.ru
14. Dolgova E.V. et al. "Delayed death" phenomenon: a synergistic action of cyclophosphamide and exogenous DNA // Gene. - 2012. - Vol. 495. - №2. - P. 134-145.
15. Спирин. Спектрофотометрическое определение суммарного количества нуклеиновых кислот // Биохимия. - 1958. - Т. 23. - №5. - С. 656-662.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2322264C1 |
| Радиопротекторное, радиомитигаторное и радиосенсибилизирующее средство на основе натриевой соли аминодигидрофталазиндиона натрия (лекарственного препарата Тамерон) и других солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона | 2022 |
|
RU2804886C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИЗБИРАТЕЛЬНЫМ РАДИО- И ХИМИОЗАЩИТНЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2339386C1 |
| СПОСОБ ЭРАДИКАЦИИ СТВОЛОВЫХ ИНИЦИИРУЮЩИХ РАКОВЫХ КЛЕТОК | 2013 |
|
RU2542410C1 |
| Способ получения препарата для профилактики и лечения радиационных поражений организма животных и способ профилактики и лечения радиационных поражений организма животных | 2019 |
|
RU2697828C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2345792C2 |
| СПОСОБ ЛЕЧЕНИЯ АСЦИТНОЙ ФОРМЫ РАКА | 2015 |
|
RU2595864C1 |
| Способ оценки эффективности радиозащитных лекарственных средств с использованием гуманизированных мышей | 2023 |
|
RU2817986C1 |
| СПОСОБ ПРИМЕНЕНИЯ РАСТИТЕЛЬНОГО ПОЛИСАХАРИДА В КАЧЕСТВЕ РАДИОПРОТЕКТОРА И СТИМУЛЯТОРА КОЛОНИЕОБРАЗОВАНИЯ СТВОЛОВЫХ КЛЕТОК СЕЛЕЗЕНКИ ОБЛУЧЕННЫХ ЖИВОТНЫХ | 2013 |
|
RU2537033C1 |
| РАДИОЗАЩИТНОЕ СРЕДСТВО | 2010 |
|
RU2428192C1 |



Изобретение относится к области медицинской радиологии и представляет собой способ защиты животных от высокодозового ионизирующего излучения, заключающийся в том, что мышам внутривенно вводят одноразово биологический препарат, отличающийся тем, что в качестве биологического препарата, который одноразово вводят внутривенно в период от 30 до 60 минут до 12 суток до облучения высокодозовым ионизирующим излучением 9,4 Гр, используют или препарат суммарной РНК дрожжей S. cerevisiae, содержащий 2% молекул в двуцепочечной форме, в дозе 7 мг, или очищенный от одноцепочечной фракции препарат РНК дрожжей S. cerevisiae, содержащий не менее 90% молекул в двуцепочечной форме, в дозе 0,16 мг. Использование заявленного способа обеспечивает повышение эффективности защиты животных от высокодозового ионизирующего излучения и расширяет арсенал технических средств. 9 ил., 2 табл.
Способ защиты животных от высокодозового ионизирующего излучения, заключающийся в том, что мышам внутривенно вводят одноразово биологический препарат, отличающийся тем, что в качестве биологического препарата, который одноразово вводят внутривенно в период от 30 до 60 минут до 12 суток до облучения высокодозовым ионизирующим излучением 9,4 Гр, используют или препарат суммарной РНК дрожжей S. cerevisiae, содержащий 2% молекул в двуцепочечной форме, в дозе 7 мг, или очищенный от одноцепочечной фракции препарат РНК дрожжей S. cerevisiae, содержащий не менее 90% молекул в двуцепочечной форме, в дозе 0,16 мг.
| НИКОЛИН В.П | |||
| и др | |||
| Экспериментальное исследование препарата дрожжевой РНК как возможного радиопротектора при радиотерапии злокачественных опухолей // Бюлл | |||
| эксперим | |||
| Биологии и медицины | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Деревянное стыковое устройство | 1920 |
|
SU163A1 |
| ЗАГРЕБЕЛЬНЫЙ С.Н | |||
| и др | |||
| Выделение суммарной РНК из пекарских дрожжей // Прикладная биохимия и микробиология, 2006, т.42, N1, с.93-97 | |||
| Винтовой пресс для прессования шерсти, хлопка и тому подобного | 1950 |
|
SU91139A1 |
| СПОСОБ ЛЕЧЕНИЯ ЛУЧЕВОЙ БОЛЕЗНИ У ЖИВОТНЫХ | 1991 |
|
RU2077888C1 |
| CN 104844516 A, 19.08.2015. | |||
Авторы
Даты
2019-09-25—Публикация
2019-03-29—Подача