Изобретение касается способа непрерывного получения смеси циклоалканона, циклоалканола и циклоалкилгидропероксида, согласно которому соответствующий циклоалкан подвергают окислению, в котором циклический алкан содержит 5 - 20 атомов углерода, в непрерывном процессе с воздействием кислородсодержащего газа без металлического катализатора при температуре в 130 - 200oC.
Такой способ получения смеси циклогексанона, циклогексанола и циклогексилгидропероксида в непрерывном процессе описан в патенте EP, A-0092867.
Недостаток известного способа состоит в том, что избирательность реакции окисления в отношении образования требуемых продуктов (циклогексанона, циклогексанола и циклогексилгидропероксида) является сравнительно низкой из-за образования значительного количества побочных продуктов.
Цель изобретения состоит в том, чтобы предложить способ, в котором избирательность реакции окисления циклоалкана в отношении образования требуемых продуктов является более высокой. В частности, целью изобретения является способ, у которого более высокой оказывается избирательность в отношении образования циклоалкилгидропероксида.
Эта цель достигается тем, что окисление, по крайней мере частично, проводится в присутствии фенольного соединения, содержащегося в количестве 0,002 - 2 ммоль в расчете на 1 кг реакционной смеси (ммоль/кг).
Установлено, что при использовании способа, отвечающего изобретению, избирательность реакции окисления в отношении образования циклоалканона, циклоалканола и, в частности, циклоалкилгидропероксида является более высокой, без снижения скорости по сравнению со способом, в котором не используется фенольное соединение.
В патенте SU, A-686329 раскрыт способ получения циклододецилгидропероксида окислением циклододекана в присутствии 0,01-30 мас.% фенольного соединения. Эксперименты проводились с использованием 1 мас.% (1170 ммоль/кг) фенола, 2,5 мас.% (230 ммоль/кг) крезола и 0,2 мас.% (18 ммоль/кг) резорцина. Поразительным является то, что значительно меньшее количество фенольного соединения, чем раскрытое в этих экспериментах, оказывает благоприятный эффект на избирательность в отношении образования циклоалканона, циклоалканола и циклоалкилгидропероксида и, в частности, циклогексанона, циклогексанола и циклогексилгидропероксида.
В статье, опубликованной в журнале "Кинетика и катализ", СССР (1960, 1(1), 46-62), упоминаются фенол и α - нафтол, используемые в качестве ингибиторов в катализируемой реакции окисления н-декана. Неожиданным, следовательно, является то, что реакция окисления циклоалкана согласно изобретению практически не замедляется при добавлении фенольного соединения.
Использование фенольного или дигидроксибензолпроизводного соединений при проведении окисления циклогексанона с целью повышения избирательности описано в патенте SU, A-197555. В противоположность способу, отвечающему изобретению, реакцию окисления катализируют металлическим катализатором при температуре 200 - 250oC и получают смесь циклогексанола и циклогексанона. Кроме того, согласно примерам, приведенным в патенте SU, A-197555, используют большое количество фенольного соединения в расчете на 1 кг реакционной смеси 190 и 140 ммоль/кг). Представляется, следовательно, неожиданным, что добавление небольших количеств фенольного соединения к некатализируемой реакции окисления и осуществление этого способа при пониженной температуре оказывают положительный эффект на избирательность при той же степени превращения.
Использование фенольного соединения при проведении некатализируемого окисления циклододекана описано в статье, опубликованной в журнале "Нефтехимия", СССР (1964, 3(4), 295-301). В этой статье описано исследование механизма реакции окисления циклододекана. Фенольное соединение вводят в периодически проводимый процесс уже после того, как окислилась часть циклододекана. В статье не говорится, что введение такого фенольного соединения в непрерывный процесс может сопровождаться ростом избирательности.
Фенольное соединение содержит одну или несколько групп в соответствии с формулой I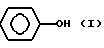
и растворяется в циклоалкане в условиях проведения реакции.
Таким фенольным соединением предпочтительно является органическое соединение с молекулярным весом менее примерно 1000 и с числом ароматических колец 1 - 5.
Приемлемая группа фенольных соединений может быть представлена формулой II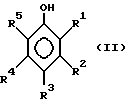
где группы от R1 до R5 могут независимо представлять собой группу -O-R6 или группу R7, где группы R6 и R7 могут независимо представлять собой H или органические группы с числом атомов углерода от 1 до 30, замещенные или незамещенные простой эфирной, карбонильной, гидроксильной, аминовой, амидной или сложноэфирной группами, и/или где группы R1 и R2, или R2 и R3, или группы R3 и R4 или группы R4 и R5 могут вместе образовывать алифатическое или ароматическое кольцо с числом атомов углерода 5, 6, 7, 8, 10 или 12.
Примерами фенольных соединений, замещенных или незамещенных, является фенол, 2,6-ди-трет-бутилфенол, 2,6-ди-трет-бутил-4-метилфенол, м-крезол, бисфенол-А, бифенол, п-трет-бутилфенол, 2-гидроксинафталин, 2,6-диметилфенол, 2,4-ди-трет-бутилфенол, 2,4,6-три-трет-бутилфенол, 2,4-диметил-6-трет-бутилфенол, 1-гидроксинафталин, гидрохинон, пирокатехин, резорцин, п-феноксифенол и о-фенилфенол.
Предпочтительно используют м-крезол, 2,4-ди-трет-бутилфенол, 2,6-ди-трет-бутилфенол и фенол.
Могут быть также использованы смеси упомянутых соединений. Могут быть использованы смеси фенольных соединений, получаемых при приготовлении какого-то конкретного фенольного соединения, поскольку тогда отпадает необходимость проводить дальнейшую очистку.
Концентрация фенольного соединения обычно составляет менее 2 ммоль/кг, предпочтительно менее 1 ммоль/кг и, в частности, менее 0,9 ммоль/кг. Концентрация фенольного соединения обычно превышает 0,002 ммоль/кг, предпочтительно превышает 0,01 ммоль/кг и, в частности, выше 0,05 ммоль/кг. Изобретение также касается способа, в котором концентрация фенольного соединения составляет по массе менее 0,01% от массы реакционной смеси. Упомянутые выше концентрации представляют собой концентрации, основанные на количестве фенольного соединения, вводимого в реакционную смесь. Фактическая средняя концентрация при протекании реакции окисления будет ниже упомянутой выше концентрации, поскольку часть фенольного соединения будет исчезать при окислении.
В целом изобретение касается окисления циклических алканов с числом атомов углерода от 5 до 20. В частности, изобретение касается окисления циклоалканов с числом атомов углерода от 6 до 12. Примерами подходящих циклических алканов являются циклогексан, циклооктан и циклододекан. В частности, изобретение касается окисления циклогексана, поскольку продукты окисления, такие как циклогексанол, циклогексанон и циклогексилгидропероксид, взятые раздельно или в смеси, находят широкое применение. Точнее изобретение, в частности, касается окисления циклогексана, в котором используют фенол в качестве фенольного соединения, поскольку фенол может быть легко получен. Циклогексилгидропероксид может быть, например, использован в качестве окислителя при приготовлении алканового эпоксидного соединения из соответствующего алкена. Циклогексилгидропероксид, находящийся в смеси, может быть также подвергнут разложению с получением смеси циклогексанона и циклогексанола. Эта так называемая К/А-смесь представляет собой продукт, который используют как таковой при приготовлении, например, адипиновой кислоты. Разложение циклогексилгидропероксида обычно происходит после охлаждения смеси в присутствии катализатора переходного металла, такого как кобальт или хром. Разложение циклогексилгидропероксида предпочтительно следует вести с добавлением по способу, описанному в патенте EP,A-004105 или патенте EP,A-092867.
Температура, при которой проводят окисление, обычно составляет 130-200oC. Целесообразно, чтобы температура превышала 160oC. Температура предпочтительно не должна превышать 190oC.
Давление, при котором проводят окисление, обычно составляет 0,1-5 МПА. Целесообразно, чтобы давление превышало 0,4 МПа. Давление предпочтительно не должно превышать 2,5 МПа. В случае проведения окисления циклогексана давление обычно устанавливают выше 0,6 МПа, но ниже 2,0 МПа.
Окисление ведут в непрерывном режиме и предпочтительно осуществляют в системе реактора, соединенных последовательно, или в секционированном трубчатом реакторе. Реакцию обычно ведут автотермически или с регулированием температуры. Температуру обычно регулируют изменением тепла реакции потоком газа, промежуточным охлаждением или иным способом, известным специалистам этой области техники. Чтобы была уверенность, что переходные металлы (которые вызывают разложение циклоалкидгидропероксида) не попадут в окисляемую смесь, целесообразно выбирать реакторы с инертной внутренней стенкой. С этой целью могут быть, например, использованы реакторы с внутренней стенкой из пассивированной стали, алюминия, тантала, стекла или эмали. Это особенно важно при малых производственных мощностях, когда оказывается неблагоприятным соотношение поверхности стенки с жидкостным объемом. При больших мощностях специальное придание инертных свойств стенке не является абсолютно необходимым. При попадании в окисляемую смесь незначительного количества металлических ионов, которые не оказывают существенного влияния на реакцию, можно говорить о проведении в рамках изобретения некатализируемого окисления циклоалкана. В противоположность некатализируемому окислению циклоалкана катализируемое окисление, которое обычно включает добавление металла, такого как кобальт и хром, дает реакционную смесь с относительно низким содержанием циклоалкилгидропероксида в сравнении с суммарным содержанием циклоалканона и циклоалканола.
Обычно продукт некатализируемого окисления циклогексана содержит по крайней мере количество циклогексилгидропероксида (выраженное в мас.%), которое является сопоставимым с суммарным количеством циклогексанола и циклогексанона (выраженным в мас.%). Часто после взаимодействия содержание циклогексилгидропероксида в смеси оказывается более чем двухкратно превышающим суммарное содержание циклогексанола и циклогексанона. В противоположность этому катализируемое окисление дает смесь, которая содержит менее 50% циклогексилгидропероксида в сравнении с суммарным количеством циклогексанола и циклогексанона (выраженным в мас.%). Часто количество пероксида оказывается даже менее 40% в сравнении с суммарным количеством циклогексанола и циклогексанона (выраженным в мас.%).
Концентрация циклоалкилгидропероксида в реакционной смеси, покидающей (последний) реактор окисления, обычно составляет 0,1 - 8,0 мас.%. Концентрация циклоалканона в этой смеси обычно составляет 0,1 - 10 мас.%. Концентрация циклоалканола в этой смеси обычно составляет 0,1 - 15 мас.%. Степень превращения циклоалкана относительно этой реакционной смеси составляет 0,5 - 25%. Степень превращения циклогексана - 2-6%.
При использовании последовательности соединенных реакторов или секционированного трубчатого реактора фенольное соединение можно подавать раздельно в каждый реактор (или секцию). Установлено, что концентрацию фенольного соединения в первых реакторах целесообразно делать относительно низкой в сравнении с концентрацией в последнем реакторе или реакторах. Может оказаться также преимущественным подавать фенольное соединение только в один или несколько реакторов, а не во все реакторы.
В качестве кислородсодержащего газа может быть выбран кислород в чистом виде, воздух с повышенным или пониженным содержанием кислорода, или кислород, смешанный с азотом или другим инертным газом. Предпочтительным является воздух, однако воздух может быть смешан с дополнительным количеством инертного газа для устранения риска возникновения взрывов. В общем случае для устранения риска возникновения взрывов в реакторы подают такое количество кислородсодержащего газа и таким образом, чтобы концентрация кислорода в отходящем газе оставалась ниже предела взрываемости. Подаваемое количество кислорода (рассчитанное по чистому кислороду) обычно составляет 0,1-50 Nл в расчете на 1 л циклоалкана. Это количество зависит от скорости реакции, и целесообразно, чтобы кислород присутствовал в небольшом избытке, однако оказанное не носит критический характер, поскольку количество кислорода обычно не является ограниченным.
Изобретение далее будет пояснено следующими, не ограничивающими его примерами.
Пример 1. В стеклянный реактор с двойной стенкой (с объемом, вмещающим жидкость, образованную из 270 г циклододекана (при 170oC), снабженный четырьмя отбойными перегородками, турбинной мешалкой, холодильниками, термометром и двумя питающими трубками, через одну из питающих трубок вводили расплавленный циклододекан, делая это насосом со скоростью 732 г/ч, и через другую трубку - раствор добавки к расплавленному циклододекану, делая это вторым насосом со скоростью 90 г/ч. Время пребывания в этом случае составляло 20 мин. В качестве добавки использовали 2,6-ди-трет-бутилфенол. Скорость подачи добавки устанавливали такой, чтобы концентрация в реакторе составляла 0,96 ммоль/кг. Продукт выпускали из реактора через сливную трубку, используя регулировочный клапан. Температура реакции составляла 170oC. Скорость мешалки составляла 2000 об/мин. Воздух подавали через дно реактора через газораспределительную систему со скоростью 30 Nл/ч. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 73,4, 4,4 и 15,2 мол.% (суммарно 93 мол.%) при степени превращения циклододекана 4,4 мол.%.
Пример 2. Пример 1 повторяли. Скорость ввода добавки регулировали так, чтобы концентрация в реакторе составляла 0,094 ммоль/кг. Из анализа истекающей из реактора жидкости следует, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 61,6, 12,1 и 18,4 мол.% (суммарное количество 92,1 мол. %) при степени превращения циклододекана 4,4 мол.%.
Пример 3. Пример 1 повторяли. Скорость ввода добавки устанавливали такой, чтобы концентрация в реакторе составляла 0,48 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 68,0, 4,3 и 18,1 мол.% (суммарно 90,4 мол.%) при степени превращения циклододекана 5,0 мол.%.
Сравнительные эксперименты A и B. Пример 1 повторяли, но добавку не вводили. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 54,6, 13,3 и 18,8 мол.% при степени превращения циклододекана 4,67 мол. %. Этот эксперимент повторяли. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 51,7, 15,3 и 19,5 мол.% (суммарно 86,5 мол.%) при степени превращения циклододекана 4,7 мол.%.
Пример 4. Пример 1 повторяли, в качестве добавки использовали фенол. Скорость ввода добавки устанавливали такой, чтобы концентрация в реакторе составляла 1,0 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 59,6, 14,8 и 18,7 мол.% (суммарно 93,1 мол.%) при степени превращения циклододекана 4,4 мол.%.
Пример 5. Пример 4 повторяли, скорость ввода добавки устанавливали такой, чтобы концентрация в реакторе составляла 0,8 ммоль/кг, и поступление циклододекана понижали до такой величины, при которой степень превращения циклододекана составляет 4,7 мол.%. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 58,0, 12,5 и 17,8 мол.% (суммарно 92,0 мол.%).
Пример 6. Пример повторяли, скорость ввода добавки устанавливали такой, при которой концентрация в реакторе составляет 0,48 ммоль/кг, и превращение циклододекана составляет 5,1 мол.%. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 61,4, 6,3 и 15,3 мол.% (суммарно 91,1 мол.%).
Сравнительный эксперимент С. Пример 6 повторяли, но добавку не вводили. Степень превращения циклододекана составляла 5,1 мол.%, как и в случае примера 6. Анализ истекающий из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 48,6, 11,7 и 17,4 мол.% (суммарно 77,6 мол.%).
Пример 7. Пример 1 повторяли, в качестве добавки использовали 2,6-ди-трет-бутил-4-метилфенол. Скорость ввода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 0,94 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 59,2, 13,2 и 18,5 мол.% (суммарно 91,9 мол.%) при степени превращения циклододекана 4,5 мол.%.
Пример 8. Пример 7 повторяли. Скорость ввода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,9 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 63,1, 8,6 и 17,0 мол.% (суммарно 88,7 мол.%) при степени превращения циклододекана 4,6 мол.%.
Пример 9. Пример 1 повторяли, в качестве добавки использовали м-крезол. Скорость ввода добавки устанавливали такой, при которой ее концентрации в реакторе составляет 1,1 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 65,0, 8,1 и 18,5 мол.% (суммарно 91,6 мол.%) при степени превращения циклододекана 4,3 мол.%.
Пример 10. Пример 1 повторяли, в качестве добавки использовали 4-метоксифенол. Скорость ввода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,0 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 60,7, 13,2 и 17,8 мол.% (суммарно 91,7 мол.%) при степени превращения циклододекана 4,4 мол.%.
Пример 11. Пример 1 повторяли, в качестве добавки использовали 2,4,6-три-трет-бутилфенол. Скорость ввода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,0 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 65,7, 9,9 и 16,4 мол.% (суммарно 92,0 мол.%) при степени превращения циклододекана 4,5 мол.%.
Пример 12. Пример 1 повторяли, в качестве добавки использовали 2,4-ди-трет-бутилфенол. Скорость ввода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,1 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 67,4, 5,4 и 18,3 мол.% (суммарно 91,1 мол.%) при степени превращения циклододекана 4,5 мол.%.
Пример 13. (Эксперимент с циклогексаном проводили в устройстве, приспособленном для проведения опытов под давлением и аналогичном устройству, описанному в примере 1. В качестве добавки использовали 2,6-дибутил-трет-4-метилфенол. Скорость ввода добавки устанавливали такой, при которой ее концентрация в реакторе составляла 1,25 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклогексилгидропероксида, циклогексанола и циклогексанона составляет 92,3 мол.% при степени превращения циклогексана 3,5 мол.%.
Пример 14. Повторяли пример 12, в качестве добавки использовали фенол. Скорость подачи добавки делали такой, при которой ее концентрация в реакторе составляет 0,6 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклогексилгидропероксида, циклогексанола и циклогексанона составляет 91,5 мол.% при степени превращения циклогексана 3,4 мол.%.
Пример 15. Пример 14 повторяли. Концентрация фенола составляла 0,3 ммоль/кг, и суммарная избирательность была 91,9 мол.% при степени превращения циклогексана 3,5 мол.%.
Сравнительный эксперимент D. Повторяли пример 11, но без добавки. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклогексилгидропероксида, циклогексанола и циклогексанона составляет 89,4 мол.% при степени превращения циклогексана 3,4 мол.%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОНОВ C-C | 1999 |
|
RU2154050C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОГЕКСИЛГИДРОПЕРОКСИДА | 1993 |
|
RU2121996C1 |
| Способ получения циклоалканолов и циклоалканонов с -с | 1977 |
|
SU735588A1 |
| НЕПРЕРЫВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ОЧИЩЕННОГО ЦИКЛОГЕКСАНОНА | 2014 |
|
RU2661867C2 |
| Способ получения циклоалканолов ициКлОАлКАНОНОВ | 1979 |
|
SU806670A1 |
| СПОСОБ ПОЛУЧЕНИЯ СМЕСИ, СОДЕРЖАЩЕЙ ЦИКЛИЧЕСКИЙ НАСЫЩЕННЫЙ АЛКАНОН И СООТВЕТСТВУЮЩИЙ ЕМУ АЛКАНОЛ | 1992 |
|
RU2078753C1 |
| СПОСОБ КАТАЛИТИЧЕСКОГО ОКИСЛЕНИЯ АЛКАНА | 2002 |
|
RU2284986C2 |
| Способ получения гидроперекисей циклоалкилов Б.Я.Ладыгина | 1978 |
|
SU799325A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОЛОВ И ЦИКЛОАЛКАНОНОВ | 1968 |
|
SU218761A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОГЕКСАНОНА И ЦИКЛОГЕКСАНОЛА | 2019 |
|
RU2723547C1 |
Для получения смеси циклоалканона циклоалканола и циклоалкилгидропероксида соответствующий циклоалкан, который содержит 5 - 20 атомов углерода, подвергают окислению в непрерывном процессе под воздействием воздуха или кислородсодержащего газа при температуре 130 - 200oC. При этом окисление, по крайней мере частично, проводят в присутствии 0,002 - 2 ммоль фенольного соединения в расчете на 1 кг реакционной смеси (ммоль/кг). Предпочтительно используют фенольное соединение, которое имеет мол. м. менее 1000 и содержит 1-5 ароматических колец. При этом достигается более высокая избирательность в отношении образования циклоалкилгидропероксида. 10 з. п. ф-лы.
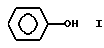
и растворимо в циклоалкане в условиях проведения реакции.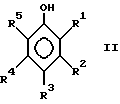
где группы от R1 до R5 могут независимо друг от друга представлять собой группу -O-R6 или группу R7, где R6 и R7 могут независимо представлять собой H или органические группы с числом атомов углерода от 1 до 30, замещенные или незамещенные простой эфирной, карбонильной, гидроксильной, амино, амидо или сложноэфирной группами, и/или R1 и R2, или R2 и R3, или R3 и R4, или R4 и R5 могут вместе образовывать алифатическое или ароматическое кольцо с числом атомов углерода 5, 6, 7, 8, 10 или 12.
| EP, 092867, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| SU, 686329, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-07-27—Публикация
1993-12-02—Подача