Изобретение относится к медицине, а именно к фармакологии.
Целью изобретения является разработка противоопухолевого средства местно-резорбтивного действия, обладающего высокой активностью при низких концентрациях действующего начала и не вызывающего побочных токсических эффектов, на основе рекомбинантного человеческого интерлейкина-2 (ИЛ-2), действие которого может быть усилено присутствием в составе препарата рекомбинантных альфа-2-интерферона (ИФН) и/или фактора некроза опухолей альфа (ФНО).
Известно, что цитокины, такие, как интерлейкин-2, альфа-2-интерферон и фактор некроза опухоли альфа обладают способностью останавливать опухолевый рост за счет подавления деления опухолевых клеток и стимуляции активности цитотоксических лимфоцитов и макрофагов [1, 2]. Действие этих медиаторов иммунного ответа, применяемых в виде чистых препаратов, полученных генноинженерным путем, проявляется при их введении в кровоток животных и людей путем инъекции.
Известный препарат рекомбинантного ИЛ-2, используемый для лечения опухолей путем его внутреннего введения, проявляет свою эффективность за счет системной активации клеток-киллеров, поражающих опухолевые клетки [1, 3]. Препарат при его парентеральном способе введения не может быть признан достаточно эффективным, т.к. проявляет свое положительное действие лишь в отношении двух типов раковых заболеваний (меланома и опухоли почек) и в незначительном проценте случаев [4]. Кроме того, другим основным недостатком инъекционной формы интерлейкина является необходимость использования высоких доз препарата (более 103 ME на кг массы тела), при которых у больных проявляется комплекс тяжелых токсических эффектов вплоть до комы [2, 4]. Третьим недостатком препарата является его нестабильность при введении в кровяное русло, где период его инактивации измеряется минутами [1].
Известна противоопухолевая композиция, включающая интерлейкин-2, альфа-2-интерферон и двунитевую РНК (дн-РНК) [5]. Добавление в композицию дн-РНК в качестве "катализатора", снижающего токсичность цитокинов, позволило снизить необходимые дозы ИЛ-2 и ФНО, одновременно расширив область их терапевтического применения. Но при использовании такой дн-РНК/цитокин терапии для получения положительного эффекта вливания препарата проводили не чаще двух раз в неделю с использованием дозы интерлейкина порядка 103-104 ME на кг массы тела, т.е. дозы, которая, как известно [1, 2], уже способна вызывать токсические реакции.
Задача, которую решает наше изобретение, состоит в лечении различных онкологических заболеваний путем локальных накожных аппликаций средства, содержащего в качестве активного начала человеческий рекомбинантный интерлейкин-2 (ИЛ-2) или его комбинацию с препаратом рекомбинантного человеческого альфа-2-интерферона, либо с препаратом фактора некроза опухолей альфа, или комбинацию всех трех цитокинов, взятых в определенной пропорции, и приготовленного в виде мази, крема или геля. Локальным применением средства в зоне опухолевого роста достигается продолжительная иммуностимуляция, но при этом за счет применения нетоксичных доз цитокинов отсутствуют специфические для такой терапии осложнения.
Существенными признаками изобретения являются местное - накожное - применение противоопухолевого средства на основе рекомбинантного человеческого интерлейкина-2, используемого в низких дозах, и усиление его эффективности путем дополнительного введения в его состав рекомбинантного препарата фактора некроза опухолей альфа и/или рекомбинантного препарата человеческого альфа-2-интерферона.
То, что кожа и кожные реакции связаны с внутренними процессами организма, известно давно, но работы последних лет показали, что кожа имеет полный набор клеточных элементов и их продуктов, с помощью которых она функционирует как иммунный орган [6]. Кожа является первичной мишенью во время различных иммунных реакций и участвует как в генерации локальных иммунных ответов, так и распространяющихся на всю иммунную систему [6].
Накожное нанесение предлагаемого средства и возможность его продолжительного применения обеспечивает длительное иммуномодулирующее воздействие как на уровне региональных лимфатических узлов, так и на уровне всего организма. При этом в эксперименте достигается лечебный эффект в отношении опухолей (карцинома Эрлиха), известных своей резистентностью к ИЛ-2 терапии.
В качестве фармацевтически приемлемого носителя использовали стандартную смесь, которую готовили по общепринятой для приготовления мазей технологии на ланолиново-вазелиновой основе, ИЛ-2 вводили в состав мази перемешиванием с носителем. Активность получаемой мази на основе ИЛ-2 составляла 1000-20000 ME на 1 г носителя, в зависимости от прибавленного количества ИЛ-2 с заданной активностью. Смешивая сочетания двух или трех цитокинов с носителем, получали мази, обладающие различным набором активностей каждого из участвующих компонентов, за счет чего мази обладали кумулятивным эффектом (табл. 1).
В результате применения таких составов при лечении злокачественных опухолей получали высокий лечебный эффект: полное излечение или резкое торможение в росте и развитии опухолей у 40-90% животных, причем наибольший эффект был достигнут при применении комбинированных мазей: (ИЛ-2 + ИФН) - 60-70%, (ИЛ-2 + ФНО) - 40-60%, (ИЛ-2 + ИФН + ФНО) - 80-90%.
Изучение противоопухолевого действия мазей проводили на беспородных белых мышах-самцах весом 16-18 г.
Способ получения мазей стандартный: в носитель вводили в виде водного раствора нативный или стабилизированный сывороточным альбумином ИЛ-2 с заданной активностью. Тщательным растиранием при комнатной температуре (20oC ± 5oC) в течение 10-15 минут добивались гомогенности состава. Аналогичным образом готовили мази из смеси цитокинов.
Мазевая основа (носитель) хорошо всасывается кожей и не реагирует с вводимыми в нее лекарственными препаратами.
Мазевую основу готовили в разных сочетаниях (в масс. частях) (см. табл. 2).
Для приготовления мазей также использовали носители, в которых смешивали глицерин с вазелином и ланолином. Проверяли такие составы (в масс. частях) (см. табл. 3).
Вазелин кожей не всасывается, но выполняет покровную функцию. Цитокины в мазях на таких носителях обладают лечебным действием. Аналогичный лечебный эффект был достигнут при накожном нанесении цитокинов в виде геля на основе глицерина в качестве гелеобразующего начала. Соотношение цитокинов в гелях сохраняется таким же, как и в мазях.
Противоопухолевую активность цитокинов при их накожном применении проверяли также, добавляя их в вышеуказанном соотношении в кремы "Ланолиновый" и "Спермацетовый" производства АО "Невская косметика". Жировая основа кремов не инактивировала используемые цитокины.
Мази сохраняют свою активность в течение 6 месяцев при хранении в защищенном от света месте при температуре 6oC ± 4oC.
Активность цитокинов в мази проверяли через 1 день после приготовления мазевого состава, через 1 неделю, через каждый месяц в течение 6 месяцев. Инактивация цитокинов не была отмечена.
Определение активности цитокинов осуществляли по стандартным методикам [7-9] . Для этого навески приготовленного мазевого препарата (3 г) обрабатывали медицинским эфиром (10 мл), встряхивая в течение 10 минут до полного растворения основы мази. Раствор центрифугировали при 1000 об/мин. Нижнюю (водную) фазу использовали для определения активности цитокинов по известным методикам. Результаты изучения стабильности цитокинов в мази через 6 месяцев после ее приготовления приведены в таблице 4.
Полученные данные находятся в соответствии с допустимыми погрешностями опыта. Активность цитокинов не изменялась на протяжении всего срока наблюдения (6 месяцев).
Лечебный эффект мазей изучали, прививая мышам опухоли: лимфому L-1210 и карциному Эрлиха. В качестве терапевтических агентов использовали цитокиновые мази, которые в экспериментах наносили однократно на зону опухолевого роста на 4-й день имплантации опухоли, втирая в кожу больных животных. Учет результатов осуществляли, измеряя диаметр опухоли или определяя процент мышей-опухоленосителей в леченных и контрольных группах животных. Для сравнения эффективности мазевой терапии с традиционными методами лечения с помощью ИЛ-2, часть привитых животных была подвергнута лечению интерлейкином-2 инъекционно (подкожное введение).
Контрольной (нелеченной) группе мышей прививали карциному Эрлиха или лимфому L-1210. Вторую контрольную (нелеченную) группу привитых опухолью мышей обрабатывали одной мазевой основой (носителем) без цитокиновых компонентов, втирая ее в кожу в зоне опухолевого роста.
Наблюдение проводили в течение 10-14 дней от момента имплантации опухоли.
Эксперименты показали, что мази обладают высоким противоопухолевым эффектом при низких (нетоксических) концентрациях цитокинов (на 1-2 порядка ниже применяемых в лечении традиционными методами введения).
Это достигается за счет использования природного синергизма действия интерлейкина-2, альфа-2-интерферона и фактора некроза опухолей альфа.
Сущность изобретения представлена на рисунках 1-4 и в таблице 2.
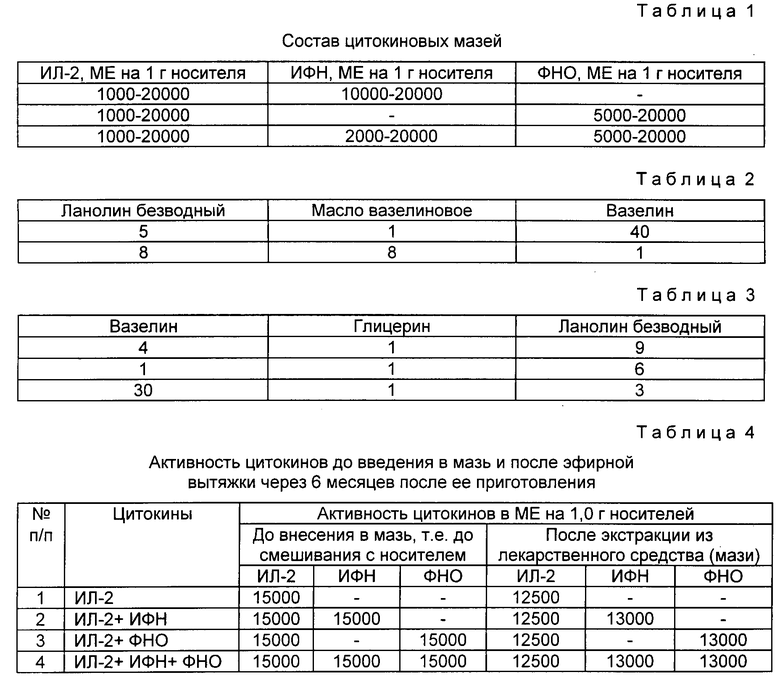
На фиг. 1 представлены результата опыта по проверке противоопухолевой активности инъекционной и мазевой формы интерлейкина-2 в отношении лимфомы L-1210.
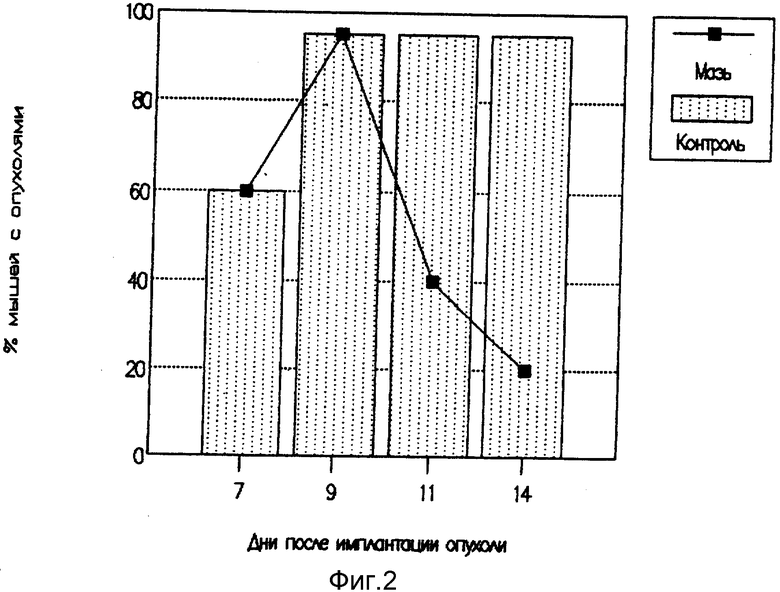
Фиг. 2 иллюстрирует эффективность поздней терапии лимфомы L-1210 интерлейкиновой мазью.
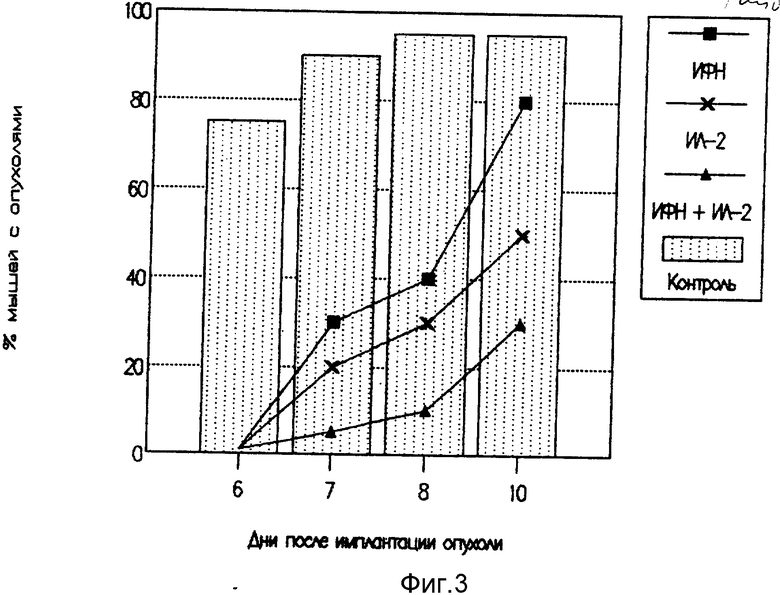
На фиг. 3 представлены результаты действия различных по составу цитокиновых мазей на карциному Эрлиха.
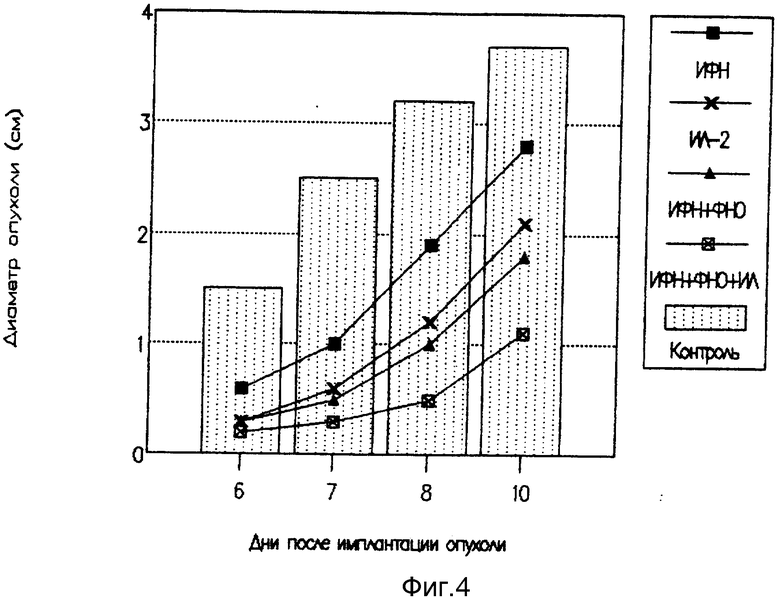
Фиг. 4 также иллюстрирует противоопухолевую активность цитокиновых мазей в отношении карциномы Эрлиха.
Из этих рисунков видно, что при накожном (местном) применении цитокиновых мазей был достигнут выраженный лечебный эффект в отношении двух типов опухолей у мышей (карцинома Эрлиха и лимфома L-1210). При этом противоопухолевая активность цитокиновых мазей отмечена как в случае терапии чувствительной к ИЛ-2 опухоли (лимфома L-1210), так и в отношении опухоли, известной своей резистентностью к лечению интерлейкином-2 (карцинома Эрлиха).
Так, сочетанное применение мази, содержащей ИЛ-2 с активностью 5000 ME/г носителя и ФНО с активностью 5000 ME/г носителя привело к высокому лечебному эффекту - полному извлечению или резкому торможению роста и развития опухолей (как карциномы Эрлиха, так и лимфомы L-1210) у 40-60% животных.
Лечение мышей от карциномы Эрлиха или лимфомы L-1210 с помощью цитокиновых мазей привело к следующему: у 40-90% животных наблюдалось полное излечение, либо резкое торможение в росте и развитии опухолей, причем наибольший эффект был достигнут при применении комбинированных мазей.
Примеры выполнения опытов:
Пример 1. Мазь на основе ИЛ-2 готовили растиранием водного раствора ИЛ-2 с активностью 10000 ME с таким составом (в масс. частях) - 5 частей ланолина безводного : 1 часть масла вазелинового : 40 частей вазелина. Мазь обладает активностью ИЛ-2 10000 ME/г основы.
Пример 2. Мазь на основе ИЛ-2 готовили растиранием водного раствора ИЛ-2 с активностью 20000 ME с таким составом (в масс. частях) - 8 частей ланолина безводного : 8 частей масла вазелинового : 1 часть вазелина. Мазь обладает активностью ИЛ-2 20000 ME/г основы.
Пример 3. Мазь на основе ИЛ-2 и ФНО готовили растиранием водного раствора ИЛ-2 с активностью 10000 ME и водного раствора ИФН с активностью 20000 ME с таким составом (в масс. частях) - 4 части вазелина : 1 часть глицерина : 9 частей ланолина. Мазь обладает активностью ИЛ-2 5000 ME и активностью ИФН 5000 ME/г основы.
Пример 4. Гель на основе ИЛ-2, ФНО и ИФН готовили растиранием водного раствора ИЛ-2 с активностью 5500 ME, водного раствора ИФН с активностью 2000 ME и водного раствора ФНО с активностью 7500 ME с глицерином. Гель обладает активностью ИЛ-2 10000 ME и активностью ИФН 20000 ME/г основы.
Пример 5. Мазь на основе ИЛ-2 и ИФН готовили растиранием водного раствора ИЛ-2 с активностью 20000 ME и водного раствора ИФН с активностью 20000 ME с таким составом (в масс. частях) - 8 частей ланолина безводного : 8 частей масла вазелинового : 1 часть вазелина. Мазь обладает активностью ИЛ-2 20000 ME и активностью ИФН 20000 ME/г основы.
Пример 6. Мазь на основе ИФН готовили растиранием водного раствора 20000 ME ИФН с таким составом (в масс. частях) - 1 часть глицерина : 6 частей ланолина. Мазь обладает активностью 20000 ME ИФН/г основы.
Пример 7. Мазь на основе ИФН и ФНО готовили растиранием водного раствора ИФН с активностью 20000 ME и водного раствора ФНО 7500 ME с таким составом (в масс. частях) - 30 частей вазелина : 1 часть глицерина : 3 части ланолина. Мазь обладает активностью ИФН 20000 ME и активностью ФНО 7500 ME/г основы.
Пример 8. Контрольная (нелеченная) группа из 10-15 беспородных белых привитых карциномой Эрлиха мышей. Карцинома Эрлиха была имплантирована мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Начиная с 6-го дня рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составляло 95-100%, диаметр опухолей составлял 3,5-4,0 см.
Пример 9. Контрольную (нелеченную) группу из 10-15 привитых карциномой Эрлиха беспородных белых мышей на 4-й день после ведения опухолевых клеток обрабатывали 100 мг мазевой основы (носителя) с таким составом (в масс. частях) - 30 частей вазелина : 1 часть глицерина : 3 части ланолина - путем втирания ее в кожу в зоне опухолевого роста. Карцинома Эрлиха была имплантирована мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Начиная с 6-го дня рост опухолей регистрировался методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составляло 95-100%, диаметр опухолей составлял 3,5-4,0 см.
Пример 10. Контрольная (нелеченная) группа из 10-15 привитых лимфомой L-1210 мышей линии DBA-2. Лимфома L-1210 была имплантирована мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Начиная с 6-го дня рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составило 95-100%, диаметр опухолей составлял 3,5-4,0 см.
Пример 11. Контрольную (нелеченную) группу из 10-15 привитых лимфомой L-1210 мышей линии DBA-2 обрабатывали на 4-й день после введения опухолевых клеток 100 мг мазевой основы (носителя) с таким составом (в масс. частях) - 4 части вазелина : 1 часть глицерина : 9 частей ланолина - путем втирания ее в кожу в зоне опухолевого роста. Лимфома L-1210 была имплантирована мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Начиная с 6-го дня рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составляло 95-100%, диаметр опухолей составлял 3,5-4,0 см.
Пример 12. Лечение мышей линии DBA-2, зараженных лимфомой L-1210. Лимфому имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. На 4-й день после введения опухолевых клеток мышам втирали в зону опухолевого роста 100 мг мази, содержащей ИЛ-2 с активностью 10000 ME/г основы (состав мази см. выше - пример 1). Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолью составляло 20-25%.
Пример 13. Лечение мышей линии DBA-2, зараженных лимфомой L-1210. Лимфому L-1210 имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. К 9-10 дню после имплантации опухолевых клеток количество мышей с пальпируемыми опухолями составило 95-100%. На 9, 10 и 11 дни после введения опухолевых клеток мышам втирали в зону опухолевого роста 100 мг мази, содержащей ИЛ-2 с активностью 10000 ME/г основы (состав мази см. выше - пример 1). Рост опухолей регистрировали методом пальпации. К 14 дню после имплантации опухоли количество мышей с опухолью снизилось до 20%.
Пример 14. Лечение беспородных белых мышей, зараженных карциномой Эрлиха. Карциному Эрлиха имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. На 4-й день после введения опухолевых клеток мышам втирали в зону опухолевого роста 100 мг мази, содержащей ИЛ-2 с активностью 20000 ME/г основы (состав мази см. выше - пример 2). Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составило 40-45%.
Пример 15. Лечение беспородных белых мышей, зараженных карциномой Эрлиха. Карциному Эрлиха имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. На 4-й день после введения опухолевых клеток мышам втирали в зону опухолевого роста 100 мг мази, содержащей в одном грамме основы 20000 ME ИФН (состав мази см. выше - пример 6). Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составило 60-80%.
Пример 16. Лечение беспородных белых мышей, зараженных карциномой Эрлиха. Карциному Эрлиха имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. На 4-й день после введения опухолевых клеток мышам втирали в зону опухолевого роста 100 мг мази, содержащей в одном грамме основы 20000 ME ИЛ-2 и 20000 ME ИФН (состав мази см. выше - пример 5). Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составило 20-25%.
Пример 17. Лечение беспородных белых мышей, зараженных карциномой Эрлиха. Карциному Эрлиха имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Учет результатов осуществляли, измеряя диаметр опухоли. Лечение проводили однократно путем нанесения 100 мг на кожу бедра на 4-й день после имплантации опухоли. Использовали мазь, содержащую в одном грамме основы 20000 ME ИФН (состав мази см. выше - пример 6). Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли средний диаметр опухоли составлял 2,5-2,8 см.
Пример 18. Лечение беспородных белых мышей, зараженных карциномой Эрлиха. Карциному Эрлиха имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Учет результатов осуществляли, измеряя диаметр опухоли. Лечение проводили однократно путем нанесения 100 мг на кожу бедра на 4-й день после имплантации опухоли. Использовали мазь, содержащую в одном грамме основы 20000 ME ИФН и 7500 ME ФНО (состав основы см. выше - пример 7). Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли средний диаметр опухоли составлял 1,8-2,0 см.
Пример 19. Лечение беспородных белых мышей, зараженных карциномой Эрлиха. Карциному Эрлиха имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Учет результатов осуществляли, измеряя диаметр опухоли. Лечение проводили однократно путем нанесения 100 мг геля на кожу бедра на 4-й день после имплантации опухоли. Использовали гель, содержащий в одном грамме основы 5500 ME ИЛ-2, 7500 ME ФНО и 2000 ME ИФН (состав геля см. выше - пример 4). Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли средний диаметр опухоли составлял 0,9-1,1 см.
Пример 20. Для сравнения эффективности мазевой терапии с традиционными методами лечения с помощью ИЛ-2 группу мышей (10-15) линии DBA-2, зараженных лимфомой L-1210, подвергали лечению инъекционной формой препарата. Лимфому L-1210 имплантировали мышам внутримышечно в дозе 2•105 клеток/мышь в правую заднюю лапу. Подкожное введение в объеме 0,2 мл коммерческого препарата человеческого рекомбинантного ИЛ-2 с активностью 100000 ME/мл проводили три дня подряд на 4-е, 5-е и 6-е сутки после имплантации опухоли. Рост опухолей регистрировали методом пальпации. К 10-14 дню после имплантации опухоли количество мышей с опухолями составляло 95-100%.
Анализируя результаты экспериментов, приведенных в примерах 1-20, установили, что цитокиновые мази были эффективны против карциномы Эрлиха и лимфомы L-1210 в разной степени. Наибольший лечебный эффект был достигнут при применении комбинированной мази, содержащей интерлейкиновый и интерфероновый компонент (рис. 3). По литературным данным подобный лечебный эффект в отношении карциномы Эрлиха в экспериментах на мышах достигался путем многократных инъекций интерлейкина-2 в дозе, в 100 и более раз превышающей применяемую нами дозу [3]. Использование мази, содержащей ИЛ-2, оказывало противоопухолевый эффект даже при ее применении на поздних сроках развития опухоли (фиг. 2).
Как видно из рисунка 4, накожное применение мнокогомпонентной цитокиновой мази приводило к отчетливому терапевтическому эффекту даже в случае десятикратного снижения концентрации отдельных компонентов по сравнению с монопрепаратами. Наибольшей эффективностью обладала мазь, содержащая три компонента.
Сравнительное изучение эффективности мазевой терапии лимфомы L-1210 с традиционным инъекционным методом лечения с помощью Ил-2 показало, что к 10 дню более 95% мышей в контрольной (нелеченной) группе и группе, получавшей инъекционную форму интерлейкина, имели выраженный опухолевый рост. Эффективность инъекций ИЛ-2 проявлялась только на 6 и 7 сутки (фиг. 1). В то же время после мазевой терапии к 10-14 дню число животных-опухоленосителей не превышало 22-30%. Эффект от терапии средством накожного применения, содержащим ИЛ-2, был значительно более выражен по сравнению с известным способом терапии с помощью инъекций.
Таким образом, была показана высокая противоопухолевая эффективность мазевого средства, содержащего низкие (нетоксичные) концентрации цитокинов, достигаемая за счет использования природного синергизма действия интерлейкина-2, альфа-2-интерферона и фактора некроза опухолей альфа. Во всех указанных случаях применение в низких дозах интерлейкина-2 и его комбинаций с альфа-2-интерфероном и фактором некроза опухолей альфа приводило к лечению онкологических заболеваний за счет продолжительной иммуностимуляции мазевыми препаратами.
Список цитируемой литературы
1. Кетлинский С.А., Симбирцев А.С., Воробьев А.А. "Эндогенные иммуномодуляторы", Санкт-Петербург, Гиппократ (1992).
2. Keith M.Heaton, Elizabeth A. Grimm. Cytokine combination in immunotherary for solid tumors: a review. Cancer Immunol. Immunother. (1993) 37: 213-219.
3. Ronaid B. Herberman. Summary: Potential of Interleukin-2 for the Therapy of Cancer. Jornal of Biological Response Modifiers. (1984) 3:527-532.
4. Kendal A. Smith. Lowerst Dose Interleukin-2 Immunotherapy. Blood (1993) 81(6):1414-1423.
5. Хем Ричерс, Инк, Вильям А. Картер. Патент СССР: 1836103, опубликован 23.08.93, Бюлл. 31. Противоопухолевая композиция.
6. Зимина И. В. , Лопухина Ю.М., В.Я.Арион. Кожа как иммунный орган: клеточные элементы и цитокины. Иммунология (1994), 1:8-12.
7. Кондратьева Г. А., Екимова Е.Д., Иовлев В.И. Определение противовирусной и антипролиферативной активности интерферона человека микрометодом. В кн.: "Реаферон" сб. трудов НИИ гриппа. Л. (1988), С. 105-109.
8. Baarsch M.J., Wannemuehler M.J., Molifor T.W., Murtaugh M.P. Detection of TNF α from porcine alveolar makrofager using an L-929 fibroblast bioassay. J. immun. methods (1991) 140:15-22.
9. Gillis S., Term M.M., Ou W., Smith K.A. T-cell grouth factor: parameters of production and a quantitative assay and activity. J. immunol. (1978), 120(6):2027-2032.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОБЕЗБОЛИВАЮЩЕЕ И ПРОТИВОЗУДНОЕ СРЕДСТВО | 1997 |
|
RU2147440C1 |
| ИММУНОСТИМУЛИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2432171C2 |
| КОМПОЗИЦИЯ ДЛЯ ВОЗДЕЙСТВИЯ НА ОПУХОЛЕВЫЕ КЛЕТКИ | 1991 |
|
RU2114633C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО НА ОСНОВЕ НАНОЧАСТИЦ, НЕСУЩИХ РЕКОМБИНАНТНЫЙ ФАКТОР НЕКРОЗА ОПУХОЛИ АЛЬФА ЧЕЛОВЕКА | 2008 |
|
RU2386447C1 |
| СТАБИЛИЗИРОВАННАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНОЙ, ПРОТИВООПУХОЛЕВОЙ, ИММУНОМОДУЛИРУЮЩЕЙ, АКТОПРОТЕКТОРНОЙ, АНТИМУТАГЕННОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2690677C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИНФЕКЦИОННОГО МОНОНУКЛЕОЗА, ВЫЗВАННОГО ВИРУСОМ ЭПШТЕЙНА-БАРР, У ДЕТЕЙ | 2005 |
|
RU2285262C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ЛЕЧЕБНЫМ ДЕЙСТВИЕМ ПРИ РАЗЛИЧНЫХ КОЖНЫХ ПАТОЛОГИЯХ | 2014 |
|
RU2549475C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЙ МЛЕКОПИТАЮЩИХ ПУТЕМ ВОЗДЕЙСТВИЯ СЛАБЫХ КОМБИНИРОВАННЫХ ЭЛЕКТРОМАГНИТНЫХ ПОЛЕЙ | 2002 |
|
RU2207889C1 |
| Новое химическое соединение L-лизина 9-оксоакридинил-10-ацетат, стимулирующее продукцию интерлейкина-24 и фактора некроза опухолей - бета | 2019 |
|
RU2730530C1 |
| СРЕДСТВО ДЛЯ ТОРМОЖЕНИЯ РАЗВИТИЯ КАРЦИОНОМЫ ЭРЛИХА | 2012 |
|
RU2538716C2 |
Изобретение предназначено для лечения опухолей. Противоопухолевое средство содержит интерлейкин-2 (1000 - 20000 МЕ на 1 г носителя). Оно выполнено в форме для местного накожного применения. Дополнительно может содержать α-2-интерферон (10000 - 20000 МЕ на 1 г носителя) или фактор некроза опухолей альфа (5000 - 20000 МЕ на 1 г носителя). Средство может дополнительно и одновременно содержать 2000 - 20000 МЕ α-2-интерферона и 5000 - 20000 МЕ фактора некроза опухолей альфа на 1 г носителя. Средство обладает высокой активностью при низких концентрациях действующего начала и не вызывает побочных токсических эффектов. 3 з.п.ф-лы, 4 ил., 4 табл.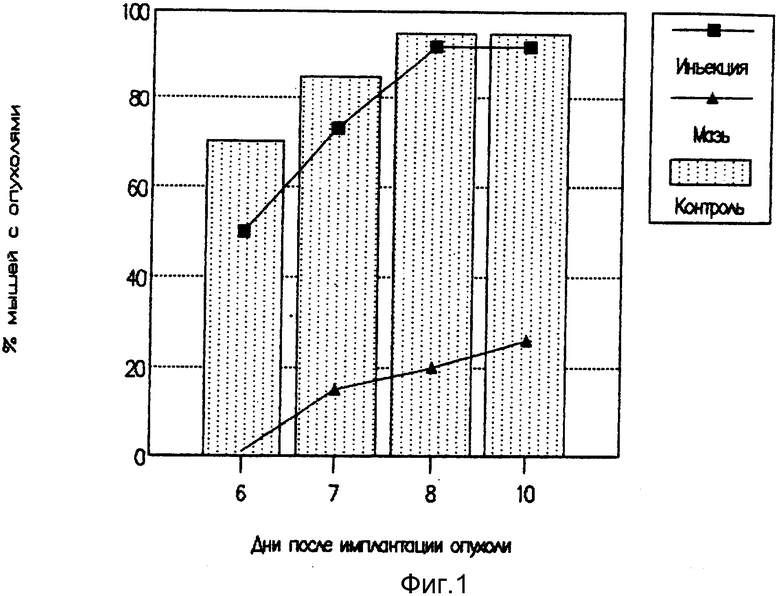
| SU, 1836103 А, 03.03.88 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ, ПРОТИВОГРИБКОВОЙ, ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 1990 |
|
RU2007164C1 |
| US 5419900 А, 30.05.95. | |||
Авторы
Даты
1998-08-20—Публикация
1995-08-22—Подача