Область техники.
Изобретение относится к химии, фармацевтике и медицине, а именно к новому химическому соединению из класса производных 9-оксоакридинил-10-ацетата: L-лизина 9-оксо-акридинил-10-ацетат, которое стимулирует продукцию интерлейкина-24 (IL-24) и фактора некроза опухолей бета (TNF-β), и обладает противоопухолевой активностью. Изобретение может быть использовано в противоопухолевой терапии, в частности, в качестве адъюванта в комплексном лечении онкологических заболеваний.
Предшествующий уровень техники.
Известны химические соединения, относящиеся к классу производных 9-оксоакриди-нил-10-ацетатов, полученные путем направленного химического синтеза и проявляющие различные виды биологической активности. Учитывая, что 9-оксоакридинил-10-ацетат мало растворим в воде и проявляет низкую биодоступность, для повышения его биодоступности используют или специальные лекарственные формы в виде микрочастиц, имеющих большую поверхность солюбилизации (патент РФ 2545755), либо различные химические производные с неорганическими и органическими основаниями.
Так, например, для натрия 9-оксоакридинил-10-ацетата впервые была показана интерфероногенная активность (патент США 3681360, патент РФ 2031650, патент РФ 2080108) с заявленным противовирусным действием (Grossberg S.E. // Antimicrob Agents Chemother. 1980 Jul; 18(1):20-26.; Storch E. // Eur J Immunol. 1982 Sep; 12(9):793-796.).
Позднее у натриевой соли 9-оксоакридинил-10-ацетата было обнаружено свойство воздействовать на эстрогенные и прогестиновые рецепторы (патент РФ 2126253), а также повышать чувствительность к андрогенам (Патент РФ 2328285), что позволило разработать лекарственные препараты на основе данной молекулы для применения в гинекологии.
Для литиевого производного 9-оксоакридинил-10-ацетата (Патент РФ 2202547) установлена аналогичная интерфероногенная и противовирусная активность и, дополнительно, антимикробная и противогрибковая, очевидно связанная с действием иона лития.
Позднее для создания парентеральных лекарственных препаратов и повышения биодоступности и стабильности при хранении путем химического синтеза был получен ряд новых по химическому строению и проявляемой биологической активности производных 9-оксоакридинил-10-ацетата: с группой алифатических 1-алкиламино-1-дезоксиполиолов (патент РФ 2135474), обладающих интерфероногенной активностью и активирующих популяции Т- и В-лимфоцитов.
Для производного 9-оксоакридинил-10-ацетата с 1-дезокси-N-метиламино-D-глюкозой (патент РФ 2036198) также было показано интерфероногенное, противопаразитарное и радиопротекторное действие, обусловленное индукцией эндогенного альфа-интерферона.
Для получения производных 9-оксоакридинил-10-ацетата с дополнительным противовоспалительным, антибактериальным и противогрибкововым действием были синтезированы сложные соединения 9-оксоакридинил-10-ацетата с рядом различных биологически-активных аминопроизводных углеводов, например, 2-дезокси-2-амино-D-глюкозой(хитозамином) (патент РФ 2093510) и 3-O-(N,N-диметиламино-н-пропил)-1,2: 5,6-ди-О-изопропилиден-D-гексозой (патент РФ 2197248, патент РФ 2080108, патент РФ 2363466, патент РФ 2325160, патент ЕА 005929).
Ближайшим аналогом заявляемого соединения по химической структуре является 1-дезокси-1-N-[-метил-(2-акридон-9-он-10-ил-ацетат)]-аммоний-D-глюцитола, меглюмина 9-оксоакридинил-10-ацетат (Евразийский патент 000382) структурной формулы 1, являющийся индуктором пролонгированного действия эндогенных альфа, бэта и гамма-интерферонов.

Биологическая активность известного соединения позволяет использовать его при лечении широкого спектра заболеваний человека и животных: лечение териоидита (патент РФ 2306932), кандидоза полости рта (патент РФ 2642053), рецидивирующего вагинального кандидоза (патент РФ2309761), гриппа (патент РФ 2281097), вирусного гепатита у детей (патент РФ 2154478), артритов (патент РФ 2417091, РФ 2169563), гнойно-деструктивных поражений слизистых оболочек и кожи (патент РФ 2414221, РФ 2361626, РФ 2295348), онихомикозов (патент РФ 2391100), силоаденита (патент РФ 2413507), бруцеллеза (патент РФ 2423143), туберкулеза (патент РФ 2296996) вирусных инфекций (патент РФ 2281097, РФ 2526253, РФ 2538083, РФ 2228756, РФ 2459629), вторичных иммунодефицитов (патент РФ 2364396, РФ 2320293), хореоретинитов (патент РФ 2275933), одонтогенного верхнечелюстного синусита (патент РФ 2460528), гиперпластического ларингита (патент РФ 2214249), тонзиллита (патент РФ 2357732), псориаза и нейродермита (патент РФ 2292215), плоскоклетчного рака (патент РФ 2332277), трансплантации аутологичных клеток (патент РФ 2325934), ожогов (патент РФ 2166960), стафилококковой инфекции (патент РФ 2441656).
Однако свойство данного соединения стимулировать продукцию противоопухолевых цитокинов интерлейкина-24 (IL-24) и фактора некроза опухолей ФНО-β (TNF-β) в организме и его противоопухолевая активность не известны из доступных источников информации.
Краткое описание изобретения.
Задачей изобретения является создание нового химического соединения, стимулирующего продукцию цитокинов интерлейкина-24 и фактора некроза опухолей бета и проявляющего противоопухолевую активность при низкой токсичности.
Поставленная задача реализуется новым химическим соединением: L-лизина 9-оксоакридинил-10-ацетатом формулы:
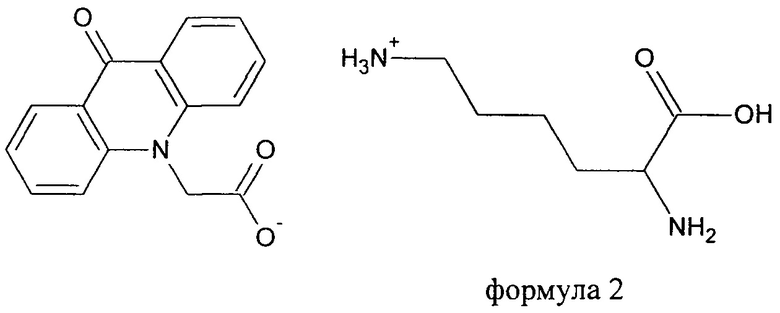
В настоящее время в научно-технической литературе не описаны новые перспективные производные 9-оксоакридинил-10-ацетата с такими L-изомерами природных «основных» аминокислот, таких как L-лизин, L-аргинин и L-гистидин, а также не известна их биологическая активность.
Для получения ряда новых соединений 9-оксоакридинил-10-ацетата и изучения их биологической активности был проведен химический синтез новых перспективных производных 9-оксоакридинил-1-ацетата и трех аминокислот L-аргинина, L-глутамина и L-лизина.
Взаимодействие 9-оксоакридинил-10-ацетат с L-аргинином который, является сильным основанием (pKa3=12,48) неожиданно привело к образованию чрезвычайно малорастворимого в воде и органических растворителях (этанол, метанол, ацетонитрил, ДМСО, хлороформ) соединения L-аргинина 9-оксоакридинил-10-ацетата с выходом практически 100%. Низкая растворимость в воде (0,01% при 100°С) делает это соединение потенциально неприемлемым для создания эффективных парентеральных лекарственных форм и потенциально низкоэффективным при пероральном использовании. Однако данный комплекс 9-оксоакридинил-10-ацетата с L-аргинином благодаря своим физико-химическим свойствам может быть использован для выделения и очистки 9-оксоакридинил-10-ацетата.
Попытка получения нового производного 9-оксоакридинил-10-ацетата с использованием еще одной основной природной альфа-аминокислоты L-гистидином с привела к отрицательному результату - после проведения реакции в высушенном осадке реакционной массы были обнаружены исходные соединения без признаков солеобразования или образования координационный соединений.
Взаимодействие 9-оксоакридинил-10-ацетата, представляющего собой слабую карбоновую кислоту (pK=3,7) и алифатической аминокислоты L-Лизина с выраженными свойствами основания (рКа2=9,06, рКа3=10,54) привело к образованию истинного водного раствора L-лизина 9-оксоакридинил-10-ацетата, из которого путем лиофилизации был выделен чистый L-лизина 9-оксоакридинил-10-ацетат в виде аморфного моногидрата. Дополнительная вакуумная сушка привела к получению свободного от кристаллогидратной воды соединения.
Таким образом, единственно возможным новым производным 9-оксоакридинил-10-ацетата для всех исследованных природных «основных» аминокислот L-аргинина, L-лизина и L-гистидина для создания эффективного лекарственного препарата для парентерального и перорального применения неожиданно оказалось производное незаменимой аминокислоты - L-лизина 9-оксоакридинил-10-ацетат - заявляемое химическое соединение (далее - «новое соединение») в данном изобретении.
Пример получения L-лизина 9-оксоакридинил-10-ацетата:
0,01 моля аминокислоты L-лизина растворяли в 100 мл воды очищенной, нагревают до 60°С и порциями добавлют 2,54 г (0,01 моля) 9-оксоакридинил-10-ацетат. Полученную реакционную массу интенсивно перемешивают в течение 60 минут до полного растворения 9-оксоакридинил-10-ацетат, полученный раствор фильтруют через стерилизующий фильтр (диаметр пор 0,22 мкм). Фильтрат высушивают в лабораторной лиофильной сушке модели LP03 в течение 24 часов до постоянной массы.
Согласно примеру получения, взаимодействие 9-оксоакридинил- 10-ацетата, представляющего собой карбоновую кислоту (рК=3,7) и алифатической аминокислоты L-лизина с выраженными свойствами основания (рКа2=9,06, рКа3=10,54) приводит к образованию истинного водного раствора L-лизина 9-оксоакридинил-10-ацетата, из которого путем лиофилизации был выделен чистый L-лизина 9-оксоакридинил-10-ацетат моногидрат. Дополнительная вакуумная сушка позволяет получить свободное от кристаллогидратной воды новое химическое соединение формулы 2.
Физико-химические свойства L-лизина 9-оксоакридинил-10-ацетата приведены в таблице 1.
Таким образом, хорошая растворимость в воде и физиологически приемлемое значение рН водных растворов (7,0-7,2) L-лизина 9-оксоакридинил-10-ацетата, в отличие от L-аргинина 9-оксоакридинил-10-ацетата, делает его перспективным для создания лекарственного препарата и пригодным для получения истинных растворов, таблеток, кремов, мазей, суппозиториев и других лекарственных форм.
Изучение безопасности и биологической активности нового соединения в сравнении с соединением по прототипу (далее - «прототип») проводили в экспериментах на животных (опыт 1). Содержание животных и проведение всех манипуляций с их участием, включая эвтаназию, проводились с соблюдением национального законодательства и международных правил GLP (Good Laboratory Practice, ГОСТ Р-53434-2009 "Принципы надлежащей лабораторной практики").
Проведенный сравнительный анализ безопасности применения прототипа и L-лизина 9-оксоакридинил-10-ацетата установил, что по уровню летальности, клинической картине, летальным дозам, новое соединение характеризуется низкой токсичностью, что является важным преимуществом при создании лекарственных препаратов для противоопухолевой терапии, которая предполагает длительные курсы лечения.
При изучении биологической активности нового соединения (опыты 2, 3) было выявлено его ранее не описанное свойство стимулировать продукцию цитокинов интерлейкина-24 (IL-24) и фактора некроза опухолей бета (TNF-β) в организме.
Известно, что проявление противоопухолевой резистентности организма опосредуется системой цитокинов [Floros Т. // Semin Oncol. 2015.V.42.N4.P.539-548] и естественных киллерных клеток ЕК (NK) [Li Y. // Chin J Cancer Res. 2018.V30.N2.P173-196.; Weilei Hu. // Front Immunol. 2019.N10. P.1205.].
Одними из таких значимых цитокинов, непосредственно регулирующих апоптоз опухолевых клеток являются интерлейкин-24 (IL-24) и фактор некроза опухолей ФНО-β (TNF-β).
Интерлейкин-24 продуцируется активированными макрофагами, моноцитами и Т-лимфоцитами [Бережная Н.М. // Онкология (Украина). 2014. Т. 16. №2. С. 130142.; Rasslian М. // Expert Opin Biol Ther. 2019. V.19. N3. P. 211-223.; Menezes ME. // Adv. Cancer Res. 2018.N138. P. 143-182.; Menezes M.E. // Adv Exp Med Biol. 2014.N818.P. 127-53.].
Считается, что IL-24 играет важнейшую роль в противовирусной защите организма через механизмы апоптоза инфицированных вирусом гриппа клеток организма [Laengle J. // Antiviral Res. 2015.V.123.P.93-104.; Seong R.K. //J Microbiol. 2016. V.54.N10.P.695-700.].
Фактор некроза опухолей TNF-β продуцируется активированными лимфоцитами. [Tang Н. // Cell Mol Immunol. 2017. V.14. N. 10. P. 809-818.]
TNF-β играет важнейшую роль в росте, дифференциации и индукции апоптоза опухолевых клеток [Bjordahl R.L. // Curr Opin Immunol. 2013.V.25.N2.P222-229.
В настоящее время известно, что некоторые биологические объекты, в частности синегнойная палочка (Pseudomonas aeroginosa), вызывает индукцию IL-24 при кератитах у мышей [Ross В.Х. III. Immunol. 2017.S.1.V.198.N9.P.3536-3547.]. Ранее было установлено что фитогеммаглютенин и липополисахариды также вызывают индукцию IL-24 и в периферических мононуклеарных клетках крови [Poindexter N.J. // J. Leukoc Biol. 2005. V.78. N3. P.745-752.; Garn H. // Immunobiology. 2002.V.205. N3. P321-334.] и TNF-beta в Т-лимфоцитах Ranneh Y. // Arch Immunol Ther Exp (Warsz). 2019.V 5. N.10. P. 1007.]
Анализ источников информации показал, что настоящее время не известны химические соединения из класса производных 9-оксоакридинил-10-ацетата: L-лизина 9-оксоакридинил-10-ацетат, вызывающие одновременный синтез как IL-24, так и TNF-β.
Результаты изучения нового соединения в опытах 1-5 свидетельствуют о его высокой противоопухолевой активности и безопасности.
В опыте 6 показано значительное потенцирующее действие нового соединения в составе стандартной химиотерапии цитостатиками.
Опыт 7 доказывает противоопухолевое и радиосенсибилизирующее действие нового соединения в комбинации с лучевой терапией.
Результаты, полученные в этих опытах, подтверждают эффективность применения нового соединения в качестве адъюванта в комплексном лечении онкологических заболеваний.
Таким образом, новое химическое соединение стимулирует продукцию цитокинов интерлейкина-24 и фактора некроза опухоли - бета и обладает противоопухолевой активностью при низкой токсичности.
Опыт 1. Сравнительная оценка безопасности (острой токсичности) прототипа и нового соединения при однократном введении.
Исследование проводилось на 195 самцах-альбиносах лабораторных мышей (SHR). Выбор вида животных обусловлен тем, что лабораторные мыши альбиносы SHR являются стандартным объектом токсикологических и фармакологических исследований, их физиолого-биохимические характеристики, неврологические характеристики, особенности поведения и питания сопоставимы с человеком, что делает выбор такой тест-системы оптимальным для решения задач данного исследования.
В качестве тестируемых объектов исследовали химические соединения:
1. меглюмина 9-оксоакридинил-10-ацетат (прототип);
2. L-лизина 9-оксоакридинил-10-ацетат (новое соединение).
Введение исследуемых соединений животным осуществлялось однократно внутривенно, медленно при помощи инфузомата в хвостовые вены. Общий объем введения составлял 0,5-0,51 мл, доведение до требуемого объема осуществляли путем разведения соединений в 0,9% растворе натрия хлорида.
В исследовании были использованы следующие дозы исследуемых соединений: 0 мг/кг (контроль) 25 мг/кг, 50 мг/кг, 100 мг/кг, 200 мг/кг, 400 мг/кг, 600 мг/кг, 800 мг/кг, 1000 мг/кг, 1200 мг/кг, 1400 мг/кг, 1600 мг/кг, 1800 мг/кг, 2000 мг/кг, массы тела животного.
Результаты опыта обработаны методом наименьших квадратов с использованием пробит-анализа в программе «GraphPadPrism 7.0».
Оценивали летальность и клиническую картину 2 раза в день на протяжении 14 суток. Клиническую картину у выживших животных оценивали по следующим показателям: внешний вид шерсти, конечностей, глазных яблок, ушей, носа, зубов, мышечный тонус, двигательная активность, характер дыхания, зрачковый рефлекс, реакция на тактильные/болевые/световые раздражители, наличие или отсутствие вокализации, слюнотечения, атаксии, тремора или судорог, кровотечения, выделений.
Результаты влияния прототипа и нового соединения на летальность животных приведены в таблице 2.

Летальность животных наступала в течение 24-72-х часов после введения исследуемых химических соединений в зависимости от дозы. Клиническая картина, предшествовавшая гибели, характеризовалась падением массы тела по отношению к фоновым данным, бледностью кожных покровов и цианозом конечностей, адинамией, сменявшейся миорелаксацией, и учащенным дыханием. Гибель животных во всех случаях возникала вследствие развития острой сердечно-сосудистой недостаточности.

В целом, при применении прототипа в диапазоне доз 25-800 мг/кг и нового соединения в диапазоне доз 25-1200 мг/кг состояние животных в течение 14-ти дней наблюдения соответствовало таковым у здоровых контрольных животных. Не регистрировалось никаких отклонений в работе систем жизнеобеспечения и когнитивной сферы мышей.
Отклонения от нормы, заключавшиеся в наличии взъерошенности шерстного покрова и снижении реакции на раздражители, наблюдались у части животных из групп, получавших прототип в дозах свыше 800 мг/кг, а в группах, получавших новое соединение свыше 1200 мг/кг в течение первых 10-ти дней наблюдения. Наблюдалось увеличение частоты дыхательных движений (до 200%), дисфункция нервной системы мышей, заключающаяся в угнетении локомоторной активности, вялости и снижении мышечного тонуса при взятии в руки. Указанные выше нарушения были транзиторными, наблюдались в первые 2-3 часа после введения соединений, разрешались самостоятельно и не имели последствий на протяжении периода наблюдений.
Расчет летальных доз исследуемых соединений показал, существенную разницу в токсикологических показателях: LD50 прототипа и нового соединения составили 769,9±74,0 и 1223,6±181,4 мг/кг соответственно.
Таким образом, по ключевому показателю LD50токсичность нового соединения в 1,5 раза ниже, чем у соединения по прототипу.
Для изучения противоопухолевой активности прототипа и нового соединения было исследовано влияние их влияние на индукцию IL-24 и фактора некроза опухолей-бета (TNF-β) у здоровых животных.
Опыт 2. Влияние прототипа и нового соединения на продукцию IL-24 у здоровых животных.
Исследование проводилось на 168 самцах-альбиносах лабораторных мышей. Анализ научной литературы указывает на возможность определения IL-24 в крови животных данного вида.
В качестве тестируемых объектов исследовали соединения:
1. меглюмина 9-оксоакридинил-10-ацетат (прототип);
2. L-лизина 9-оксоакридинил-10-ацетат (новое соединение).
Статистическая обработка производилась при помощи пакета программ SPSS for Windows. Проверка характера распределения данных производилась расчетом критерия Колмогорова-Смирнова. Сравнение средних данных независимых выборок при помощи U-критерия Манна-Уитни. Сравнение средних данных зависимых выборок производилось при помощи критерия Фридмана. Достоверным уровнем отличий считали вероятность не менее 95% (р<0,05), что является стандартом в медико-биологических исследованиях.
Введение прототипа и нового соединения животным осуществлялось методом внутривенной инъекции в хвостовые вены. Были исследованы следующие дозы 10, 100 и 200 мг/кг массы тела животного. Оценку уровня IL-24 в крови животных и показателей системы крови производили через 1, 3, 6, 10, 11 сутки после начала эксперимента.
Взятие крови производили в одноразовые шприцевые системы с антикоагулянтом (ЭДТА), мануальным методом из хвостовых вен животного. После окончания процедуры взятия крови, она подвергалась обработке для проведения иммуноферментного анализа.
Методика исследования уровня IL-24 в крови - иммуноферментный анализ (ИФА, ELISA Kit for Interleukin 24 (IL24), согласно инструкции фирмы-производителя Cloud-Clone Corp.).
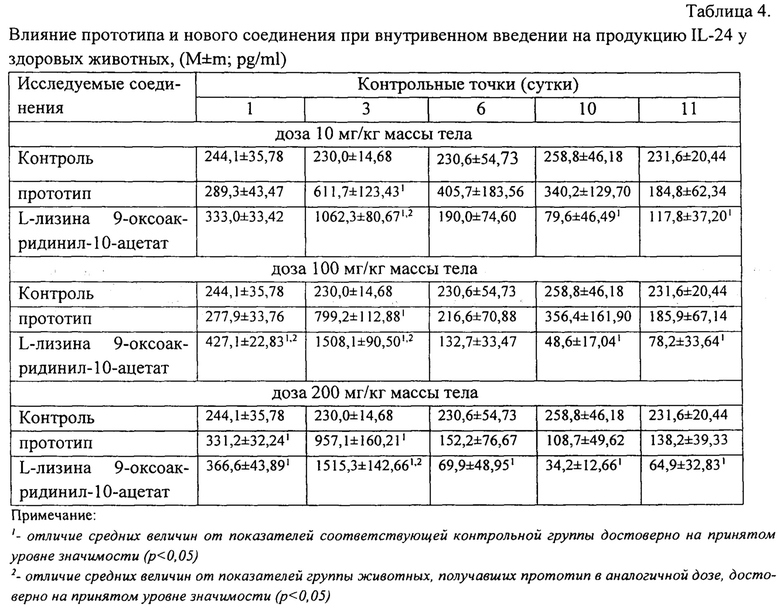
Установлено, что прототип и новое соединение в дозах 10 мг/кг, 100 мг/кг и 200 мг/кг массы тела в сутки, достоверно вызывали увеличение продукции интерлейкина-24 (IL-24) в организме здоровых животных. Увеличение продукции IL-24 при применении обоих соединений отмечалось уже через 24 часа после начала эксперимента.
Самые высокие значения содержания IL-24 в крови животных отмечались через 72 часа после первого введения соединений при всех исследуемых дозах. Максимальные значения концентрации IL-24 в крови мышей в этот период наблюдений регистрировались в обеих группах животных, получавших дозу - 200 мг/кг.
При этом, при введении L-лизина 9-оксоакридинил-10-ацетата на третьи сутки эксперимента содержание IL-24 в крови мышей статистически значимо превышало аналогичный показатель в группах животных, получавших прототип на 74% (р=0,016), 89% (р=0,004) и 58% (р-0,037), соответственно. Результаты представлены в табл. 4.
Таким образом, впервые установлена способность как прототипа, так и нового соединения стимулировать продукцию IL-24. При этом, экспериментально подтверждено значительное преимущество L-лизина 9-оксоакридинил-10-ацетата перед прототипом по влиянию на продукцию IL-24. Так, новое соединение оказывает выраженное и интенсивное воздействие на продукцию IL-24, что заключается в более раннем образовании высоких концентраций этого цитокина в крови животных, а также в более высоких абсолютных и средних значениях этого показателя на 1-3 сутки по сравнению с прототипом.
Опыт 3. Влияние прототипа и нового соединения на продукцию фактора некроза опухолей-бета (TNF-β) у здоровых животных.
Исследование проводилось на 36 самцах-альбиносах лабораторных мышей. Анализ научной литературы указывает на возможность определения TNF-β в крови животных данного вида.
В качестве тестируемых объектов исследовали химические соединения:
1. меглюмина 9-оксоакридинил-10-ацетат (прототип);
2. L-лизина 9-оксоакридинил-10-ацетат (новое соединение).
Статистическая обработка производилась при помощи пакета программ SPSS for Windows. Проверка характера распределения данных производилась расчетом критерия Колмогорова-Смирнова. Сравнение средних данных независимых выборок при помощи U-критерия Манна-Уитни. Сравнение средних данных зависимых выборок производилось при помощи критерия Фридмана. Достоверным уровнем отличий считали вероятность не менее 95% (р<0,05), что является стандартом в медико-биологических исследованиях.
Введение прототипа и L-лизина 9-оксоакридинил-10-ацетата животным осуществлялось в хвостовые вены. Мышам исследуемые соединения вводились ежедневно один раз в сутки, в течение 10 (десяти) дней эксперимента в дозе - 100 мг/кг массы тела животного.
Оценку уровня TNF-β в крови животных и показателей системы крови производили через 1, 3, 6, 10, 11 сутки после начала эксперимента. Взятие крови производили в одноразовые шприцевые системы с антикоагулянтом (ЭДТА), мануальным методом из хвостовых вен животного. После окончания процедуры взятия крови, она подвергалась обработке для проведения иммуноферментного анализа. Иммуноферментный анализ TNF-β, проводили согласно инструкции фирмы-производителя Cloud-Clone Corp.
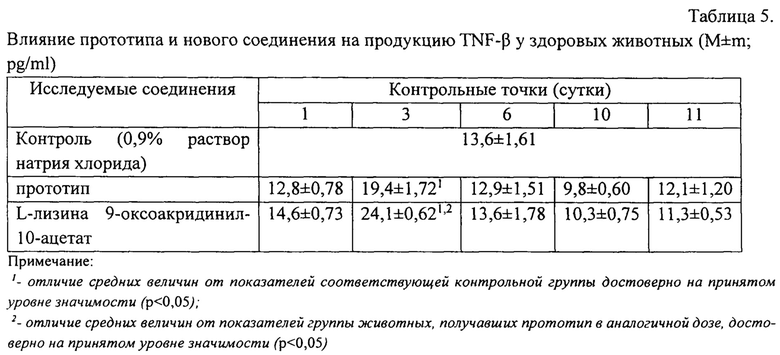
Парентеральное введение прототипа и нового соединения в дозе 100 мг/кг массы тела в сутки на протяжении 10 дней, вызывало увеличение продукции TNF-β в организме здоровых животных в первые 5 дней от момента начала курсового введения. Самые высокие значения содержания TNF-β в крови животных отмечались через 72 часа после первого введения исследуемых соединений.
Через 24 часа после первого введения исследуемых соединений уровень TNF-β в крови мышей, получавших L-лизина 9-оксоакридинил-10-ацетат был значительно выше аналогичного показателя в группе мышей, получавших прототип - в среднем на 14% (р=0,150).
Через 72 часа после первого введения исследуемых соединений регистрировался максимальный уровень TNF-β в крови мышей в подопытных группах, достоверно отличающийся от контрольных значений. При этом, при введении L-лизина 9-оксоакридинил-10-ацетата содержание TNF-β в крови мышей статистически значимо превышало аналогичные показатели у животных, получавших прототип, в среднем на 24% (р=0,025), соответственно. Результаты представлены в таблице 5.
В результате экспериментально установлены значительные преимущества нового соединения по сравнению с прототипом в отношении его влияния на продукцию TNF-β, что отражает более быстрый подъем концентрации этого цитокина в крови животных, более высокие абсолютные и средние значения этого показателя на 1-3 сутки по сравнению прототипом.
Таким образом, установленный факт одновременной стимуляции продукции IL-24 и TNF-β при использовании нового химического соединения является новым свойством L-лизина 9-оксоакридинил-10-ацетата и основанием к изучению его противоопухолевой активности.
Для установления влияния L-лизина 9-оксоакридинил-10-ацетата на рост и развитие первичных злокачественных новообразований были проведены эксперименты по установлению его воздействия на развитие клеточной линии глиомы С6 (опыт 4) и на экспериментальных животных на развитие метастазов эпидермоидной карциномы легкого Льюиса (опыт 5).
Опыт 4. Влияние нового соединения на рост и развитие первичных злокачественных новообразований головного мозга на клеточной линии глиомы С6.
Для моделирования опухолевого процесса была использована клеточная линия глиомы С6 полученная из Центра коллективного пользования Института цитологии РАН. Выбор тест-системы обусловлен ее высокой биологической эквивалентностью онкологическим заболеваниям у человека (первичные злокачественные новообразований головного мозга).
Воспроизведение новообразования производили общепринятым способом, посредством культивирования в регулируемых условиях. Для параллельной оценки влияния исследуемых соединений на неизмененные ткани использовали клеточную линию нетрансформированных фибробластов человека линии DF-2.
L-лизина 9-оксоакридинил-10-ацетат добавляли в среду для культивирования в дозах 1,5, 10 и 100 мкг/мл среды.
Оценивали следующие показатели развития новообразования:
- Пролиферация - клетки культивировали в присутствии прототипа и нового соединения и спустя 48 часов подсчитывали их количество стандартным методом.
- Колониеобразование: клетки рассевали в 6-ти луночные культуральные планшеты в концентрации 250 клеток на лунку и культивировали в стандартных условиях. Через 12 часов к клеткам добавляли исследуемые соединения. Спустя 4 суток получившиеся клеточные колонии фиксировали, окрашивали и подсчитывали их количество. Анализ действия исследуемых соединений на пролиферацию проводили на основе изменения количества колоний.
- Клеточная смерть: анализ количества мертвых клеток проводится путем оценки количества фермента лактатдегидрогеназы в культуральной среде. При гибели клеток этот фермент попадает в среду и его количество является дифференциальной характеристикой количества погибших клеток.
- Метаболизм (МТТ-тест): МТТ-тест является наиболее доступным и часто используемым методом анализа клеточного метаболизма. Основан на ферментном восстановлении не окрашенной соли тетразолия (МТТ) в живых метаболически активных клетках.
Результаты исследований влияния нового соединения на пролиферативную активность клеток экспериментальной глиомы С6 выявили отсутствие ингибирования колониеобразования в дозах 1 и 5 мкг/мл среды и способность ингибировать оцениваемый показатель в дозах 10 и 100 мкг/мл среды - отмечалась выраженная положительная дозозависимость в отношении ингибирования колониеобразования (табл. 6).

При этом, анализ влияния L-лизина 9-оксоакридинил-10-ацетата на пролиферативную активность нетрансформированных фибробластов линии DF-2 не выявил негативного влияния на этот показатель развития клеток. Даже в максимальной дозе (100 мкг/кг) снижение степени колониеобразования нетрансформированных фибробластов не достигало статистически значимого уровня (табл. 7).

Кроме того, экспериментально доказано клинически и статистически значимое влияние нового соединения на интенсивность гибели клеток экспериментальной глиомы С6 при экспозиции в течение 24 часов. В клеточных популяциях экспериментальной глиомы С6, развивавшихся на фоне применения L-лизина 9-оксоакридинил-10-ацетата в максимальной дозе 100 мкг/мл среды, уровень летальности клеток был достоверно выше по сравнению с контрольными значениями (р<0,001) (табл. 8).
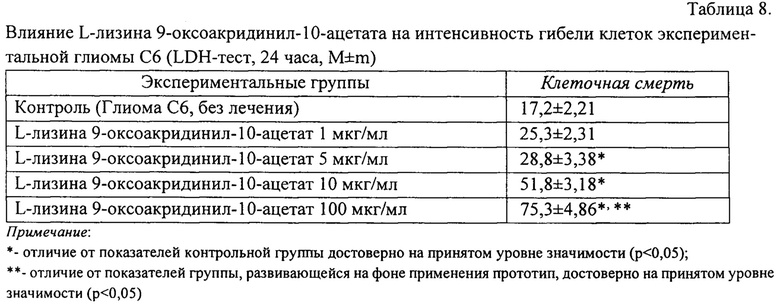
Результаты анализа влияния нового соединения на способность клеток экспериментальной глиомы С6 к выживанию через оценку уровня метаболической активности при экспозиции в течение 24 часов приведены в таблице 9. Максимальное, статистически значимое ингибирование активности клеток было отмечено при применении высоких L-лизина 9-оксоакридинил-10-ацетата в дозе 100 мкг/мл среды.

Таким образом, новое соединение вызывает статистически и клинически значимое снижение темпов развития клеточной линии глиомы С6 - ингибирует пролиферативную и миграционную активность неопластических клеток в 4 раза выше по сравнению с контролем, уменьшает интенсивность метаболизма и ускоряет процессы клеточной гибели. При этом существенного негативного воздействия на развитие культуры клеток нетрансформированных фибробластов не отмечено, что свидетельствует не только о высокой противоопухолевой активности, но и безопасности нового соединения.
Опыт 5. Влияние нового соединения на развитие метастазов эпидермоидной карциномы легкого Льюиса.
Исследование проводилось на 22 самцах лабораторных мышей линия C57Bl6. Анализ научной литературы указывает на возможность трансплантации карциномы Льюиса животным данного вида и линии. Эпидермоидная карцинома легкого Льюиса, солидное перевиваемое (трансплантируемое) новообразование, было трансплантировано подопытным животным в объеме 2*106 клеток/мышь, подкожно в область последней трети правого бока.
Содержание животных и проведение всех манипуляций с их участием, включая эвтаназию, проводились с соблюдением национального законодательства и международных правил GLP (Good Laboratory Practice, ГОСТ Р-53434-2009 "Принципы надлежащей лабораторной практики").
Статистическая обработка производилась при помощи пакета программ SPSS for Windows. Проверка характера распределения данных производилась расчетом критерия Колмогорова-Смирнова. Сравнение средних данных независимых выборок при помощи U-критерия Манна-Уитни. Сравнение средних данных зависимых выборок производилось при помощи критерия Фридмана. Достоверным уровнем отличий считали вероятность не менее 95% (р<0,05), что является стандартом в медико-биологических исследованиях.
Введение животным L-лизина 9-оксоакридинил-10-ацетата осуществлялось в хвостовые вены, ежедневно один раз в сутки, в течение 5 дней в дозах 100 мг/кг массы тела животного.
Методика исследования: морфологический анализ аутопсийного материала (ткани). Формула расчета индекса ингибирования метастазирования (ИИМ):
ИИМ (%)=(Мк-Мэ/Мк) × 100%,
где, Мк - среднее числе метастазов в контрольной группе,
Мэ - среднее числе метастазов в экспериментальной группе.
Результаты влияния нового соединения на ингибирование метастазирования у животных представлены в таблице 10.

Парентеральное введение L-лизина 9-оксоакридинил-10-ацетата в дозе 100 мг/кг массы тела в сутки, вызывало клинически значимое снижение интенсивности метастазирования. На 14 сутки от момента трансплантации новообразования среднее количество метастазов в легкие у мышей, получавших L-лизина 9-оксоакридинил-10-ацетат было достоверно ниже, чем в контрольной группе животных, превышая клинически значимый уровень интенсивности ингибирования метастазирования (более 25%).
Таким образом, новое соединение оказывает существенное влияние на процесс метастазирования и снижает количество метастазов на 47,5% по сравнению с контрольной группой животных.
Для оценки эффективности применения L-лизина 9-оксоакридинил-10-ацетата в качестве адъюванта в противоопухолевой терапии совместно с химиотерапией и лучевой терапией был проведен ряд опытов по его совместному применению с различными химиопрепаратами и радиационным излучением (опыты 6-7).
Опыт 6. Влияние нового соединения на развитие глиомы С6 при экстракарниальной трансплантации совместно со стандартной химиотерапией в эксперименте на животных.
Исследование проведено на 84 самцах-альбиносах серых крыс. Для моделирования опухолевого процесса был использован штамм глиомы С6 полученный из Центра коллективного пользования Института цитологии РАН. Выбор тест-системы обусловлен ее удовлетворительными темпами развития в организме животного, а также высокой биологической эквивалентностью онкологическим заболеваниям у человека (первичные злокачественные новообразования головного мозга).
Воспроизведение новообразования производили общепринятым способом, посредством прямой трансплантации злокачественных клеток, полученных от животных-опухоленосителей. Развитие глиомы С6 изучалось при трансплантации подкожно в область латеральной поверхности правого бедра, в объеме 106 кл/животное.
Содержание животных и проведение всех манипуляций с их участием, включая эвтаназию, проводились с соблюдением национального законодательства и международных правил GLP (Good Laboratory Practice, ГОСТ Р-53434-2009 "Принципы надлежащей лабораторной практики").
В качестве стандартной химиотерапии использовали цитостатики, обладающие удовлетворительной эффективностью в отношении моделируемого заболевания в следующих схемах дозирования:
- доксорубицин: 2 мг/кг массы тела на 2, 5 и 8 сутки после трансплантации опухоли;
- циклофосфамид: 35 мг/кг массы тела на 2 сутки после трансплантации опухоли.
Внутривенное введение L-лизина 9-оксоакридинил-10-ацетата производилось в дозе 100 мг/кг массы тела животного ежедневно на протяжении 5 суток.
Для изучения влияния 9-оксоакридинил-10-ацетат на развитие глиомы С6 были выделены следующие экспериментальны группы:
Группа 1 - животные с глиомой С6, получавшие 0,9% натрия хлорид (Контроль);
Группа 2 - животные с глиомой С6, получавшие доксорубицин, 2 мг/кг;
Группа 3 - животные с глиомой С6, получавшие Циклофосфамид, 35 мг/кг;
Группа 4 - животные с глиомой С6, получавшие L-лизина 9-оксоакридинил-10-ацетат, 100 мг/кг;
Группа 5 - животные с глиомой С6, получавшие доксорубицин, 2 мг/кг, L-лизина 9-оксоакридинил-10-ацетат, 100 мг/кг;
Группа 6 - животные с глиомой С6, получавшие циклофосфамид, 35 мг/кг, L-лизина 9-оксоакридинил-10-ацетат, 100 мг/кг.
В исследуемых группах оценивали следующие показатели развития новообразования:
- Среднюю продолжительность жизни (СПЖ) животных (сутки).
- Увеличение продолжительности жизни, по формуле:
УПЖ(%) = [(СПЖ(опыт) - СПЖ(контроль)) / СПЖ(контроль)] × 100%.
- Клинически значимый уровень УПЖ>25%.
- Торможение роста опухоли (ТРО) по формуле:
ТРО(%) = [(Vконтроль - V опыт) / Vконтроль] × 100%, где, V - объем опухоли в см3.
- Клинически значимый уровень ТРО>50%.
Для этого предварительно оценивали объем опухолевого узла (изменение объема узла в контрольных точках исследования; три взаимно перпендикулярных размера - a×b×c, см3).
Проводимое цитостатическое лечение с использованием стандартных цитостатиков, используемых в терапии глиомы С6 (докосрубицин, циклофосфамид) способствовало статистически значимому увеличению средней продолжительности жизни животных с опухолью на 39,4% и 42,6% соответственно (р<0,05).
Применение химиотерапии с использованием нового химического соединения также оказало ингибирующее действие на темпы развития опухолевого процесса, что выразилось в увеличении продолжительности жизни крыс с глиомой С6 на 28,9% (р<0,05), достигающей клинически значимого уровня (более 25%).
В тоже время, применение стандартной химиотерапии доксорубицином или циклофосфамидом в сочетании с L-лизина 9-оксоакридинил-10-ацетатом приводило к значительному увеличению продолжительности жизни животных (табл. 11).
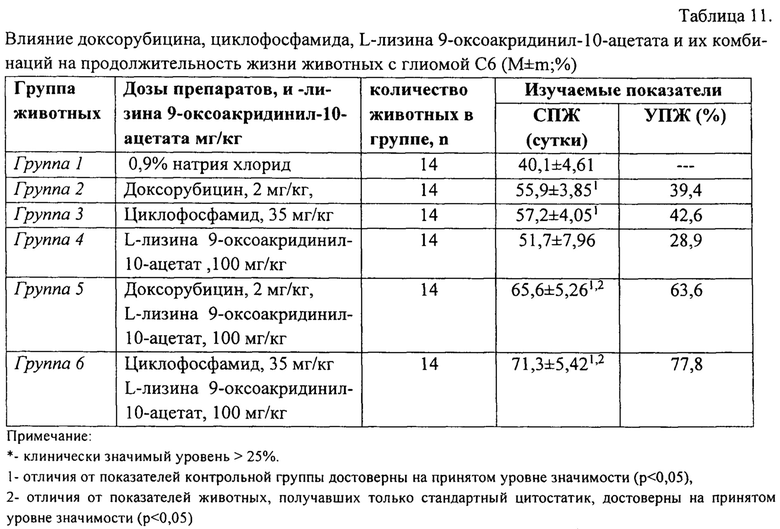
Химиотерапия с применением доксорубицина и циклофосфамид также была эффективной и в отношении торможения роста первичного опухолевого узла глиомы С6 на протяжении первых 2-3 недель эксперимента (табл. 12). В дальнейшем наблюдалось ослабление фармакологического действия цитостатиков и, начиная с 30 суток эксперимента, статистически значимых отличий от показателей контрольной группы не зарегистрировано.
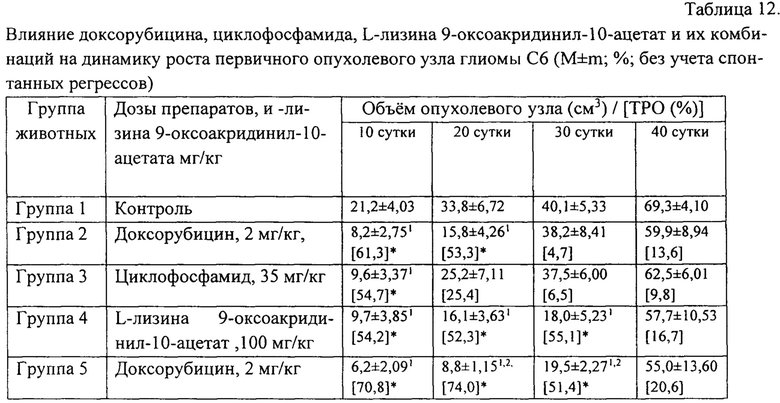

Монотерапия глиомы С6 новым соединением в дозе 100 мг/кг массы тела животного неожиданно оказалась также высокоэффективной и сопоставимой в большинстве контрольных точек исследования с показателями в группах крыс, получавших только стандартные цитостатики.
Адьювантное (совместное) применение L-лизина 9-оксоакридинил-10-ацетата и стандартной химиотерапии установило более высокую эффективность терапии. Так, в группах животных, получавших комбинированное лечение, были зарегистрированы самые низкие темпы прироста объема опухолевой массы (табл. 12), а на 30 сутки эксперимента наблюдались статистически значимые отличия по оцениваемому признаку не только с контрольными значениями, но и с показателями в группах крыс, получавших стандартную химиотерапию.
Таким образом, применение нового соединения вызывает статистически значимое снижение темпов роста и развития экспериментальной глиомы С6, что проявляется в снижении динамики роста первичного опухолевого узла и, как следствие, в увеличении продолжительности жизни крыс с глиомой С6 на 28,9% по сравнению с контролем.
Кроме того, применение нового соединения в комбинации с докосрубицином и циклофосфамидом приводит к значительному увеличению продолжительности жизни животных, что доказывает эффективность комплексной терапии глиомы С6.
Опыт 7. Сравнительный анализ радиосенсибилизирующего действия нового соединения при проведении экспериментальной лучевой терапии злокачественных новообразований на модели метастатического колоректального рака у мышей линии BALB/c.
Исследование проведено на 104 самцах мышей линии BALB/c, для моделирования опухолевого процесса был использован штамм аденокарциномы толстой кишки, полученный из Центра коллективного пользования Института цитологии РАН. Выбор тест-системы обусловлен ее удовлетворительными темпами развития и распространения в организме животного с вовлечением в патологический процесс различных органов и систем, а также высокой биологической эквивалентностью онкологическим заболеваниям у человека (колоректальный рак).
Воспроизведение новообразования производили общепринятым способом, посредством прямой трансплантации злокачественных клеток, полученных от животных опухоленосителей, в объеме 0,2 мл взвеси опухолевой массы в 0,9% растворе натрия хлорида в соотношении 1:10, подкожно в область правого бока.
Содержание животных и проведение всех манипуляций с их участием, включая эвтаназию, проводились с соблюдением национального законодательства и международных правил GLP (Good Laboratory Practice, ГОСТ Р-53434-2009 "Принципы надлежащей лабораторной практики").
В качестве экспериментальной химиотерапии на фоне применения лучевой терапии использовали L-лизина 9-оксоакридинил-10-ацетат.
Были выделены 4 экспериментальные группы:
Группа 1 - животные, которым была трансплантирована аденокарцинома толстой кишки (n=26);
Группа 2 - животные, которым была трансплантирована аденокарцинома толстой кишки и на 5 сутки после трансплантации производили лучевую терапию (n=26);
Группа 3 - животные, которым была трансплантирована аденокарцинома толстой кишки и начиная со 2 суток на протяжении 3 суток от начала эксперимента вводили L-лизина 9-оксоакридинил-10-ацетат (n=26);
Группа 4 - животные, которым была трансплантирована аденокарцинома толстой кишки и начиная со 2 суток на протяжении 3 суток от начала эксперимента вводили L-лизина 9-оксоакридинил-10-ацетат и на 5 сутки осуществляли лучевую терапию (n=26).
Каждая группа мышей была разделена на 2 подгруппы, в которых оценивали:
1. продолжительность жизни мышей и динамику роста первичного опухолевого узла (n=6);
2. рост опухолевого узла и динамику метастазирования в контрольных точках исследования (n=20; 10+5+5).
Лучевую терапию проводили на стандартной гамма-установке РХ-гамма-30, ВО «Изотоп». Доза облучения составила 2 Гр.
Введение L-лизина 9-оксоакридинил-10-ацетата проводилось внутривенно, в растворе 0,9% натрия хлорида в дозе 100 мг/кг массы тела животного.
Оценивали следующие показатели развития новообразования:
1. Торможение роста опухоли (ТРО), по формуле:
TPO(%) = [(Vк-Vo)/Vк] × 100%,
где Vk - объем опухоли в контрольной группе в см3.
Vo - объем опухоли в опытной группе в см3.
Для этого предварительно оценивали объем опухолевого узла (изменение объема узла в контрольных точках исследования; три взаимно перпендикулярных размера - a×b×c; см3), Клинически значимый уровень ТРО>50%.
2. Среднюю продолжительность жизни (СПЖ) животных (сутки).
3. Увеличение продолжительности жизни (УПЖ, %), клинически значимый уровень УПЖ>25%.
4. Частоту метастазирования опухоли (по органам) - процент животных с метастазами по отношению к общему количеству животных в группе.
5. Среднее число метастазов на одно животное в каждой группе (по органам).
6. Индекс ингибирования метастазирования (ИИМ), по формуле:
ИИМ (%) = [(Ак×Вк) - (А×В) / Ак×Вк]×100%,
где, А - частота метастазирования у животных опытной группы;
Ак - частота метастазирования у животных контрольной группы,
В - среднее число метастазов у одного животного в опытной группе.
Вк - среднее число метастазов у одного животного в контрольной группе
Клинически значимый уровень>75%.
Контрольными точками исследования являлись 14,28 и 42 сутки от момента трансплантации опухоли. В указанные периоды проводили полную некропсию животного и оценивали размеры опухоли и ее распространенность в организме. Макроскопически измененные лимфатические узлы и печень изучали при помощи бинокулярной лупы (десятикратное увеличение) и при наличии оснований осуществляли гистологической анализ общепринятым способом, с подготовкой микропрепаратов и окраской гематоксилин-эозином с целью верификации метастазов новообразования.
Статистическая обработка производилась при помощи пакета программ SPSS for Windows. Данные приведены в виде М±m (средняя арифметическая ± ошибка средней арифметической). Проверка характера распределения данных производилась расчетом критерия Колмогорова-Смирнова. Сравнение средних величин количественных данных независимых выборок производили при помощи t-критерия Стьюдента. Анализ качественных данных производили путем расчета χ2-критерия Пирсона. Точные доверительные интервалы (ДИ) для долей вычисляли по методу Клоппера-Пирсона с помощью свободно доступной программы Confint. Достоверным уровнем отличий считали вероятность не менее 95% (р<0,05), что является стандартом в медико-биологических исследованиях.
При указанном выше объеме трансплантируемого опухолевого материала новообразование развивалось у всех животных, включенных в исследование. При этом время выявления первичного опухолевого узла в экспериментальных группах существенно отличалось. В целом, для аденокарциномы толстой кишки было характерно относительно медленное развитие опухоли, динамика роста новообразования приведена в таблице 13.
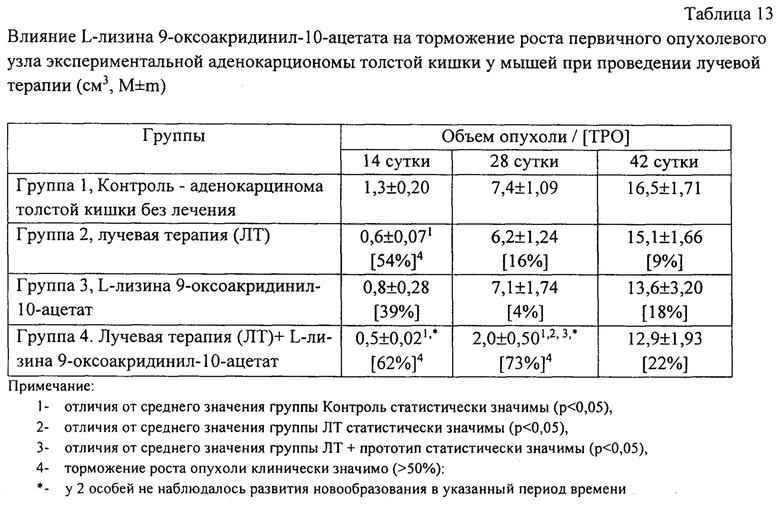
Лучевая терапия опухоли у мышей была клинически эффективной на начальных этапах роста аденокарциномы толстой кишки. На 14 сутки эксперимента в группе животных, получавших лечение ЛТ, наблюдалось статистически значимое торможение роста опухоли до 54% (р=0,044).
При этом установлено, что действие однократного гамма-облучения на используемой модели опухолевого роста имеет кратковременный характер - замедление развития АКАТОЛ под действием ионизирующего излучения практически не прослеживалось в отдаленный период наблюдений на 28 и 42 сутки (табл. 13).
Химиотерапия с использованием нового соединения оказала незначительный эффект на модели опухолевого процесса по сравнению с лучевой терапией. Однако, лучевая терапия на фоне применения L-лизина 9-оксоакридинил-10-ацетата неожиданно показала значительное и пролонгированное воздействие на динамику роста новообразования: на 14-е сутки, и на 28-е сутки отмечалось достоверное уменьшение объема первичного опухолевого узла по сравнению с группой животных, не получавших лечение (табл. 13). Так, на 14-е сутки эффект ингибирования развития новообразования достигал 62%, при этом, не отмечалось развития новообразования на уровне пальпируемого узла. На 28-е сутки исследования средний объем опухоли у животных этой группы статистически значимо отличался не только от контрольных значений, но и от показателей в группах мышей, получавших только лучевую терапию, торможение роста опухолевого узла в этот период времени составляло 73%.
Высокая эффективность применения нового соединения в комбинации с лучевой терапией, отразилась и на интегральном показателе терапевтического действия - увеличении средней продолжительности жизни животным (табл. 14).
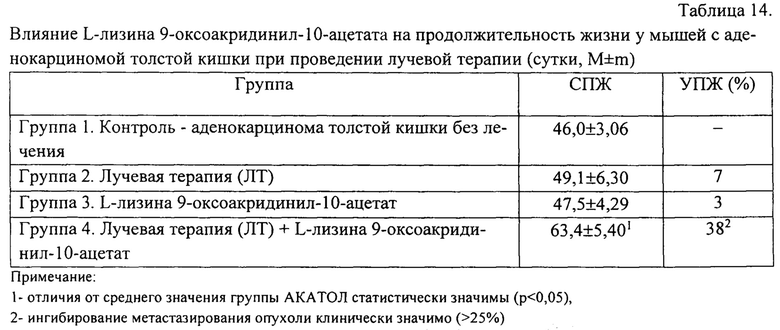
Однократное отдельное применение гамма-излучения и нового соединения в терапии аденокарциномы толстой кишки практически не оказывает существенного влияния на увеличение продолжительности жизни животных и составляет 7% и 3% соответственно.
При этом, совместное применение гамма-излучения и нового соединения является терапевтически эффективным за счет радиосенсибилизирующего действия L-лизина 9-оксоакридинил-10-ацетата, что подтверждается торможением роста первичного опухолевого узла экспериментальной аденокарциномы толстой кишки на 73% и увеличением продолжительности жизни животных на 38% по сравнению с контрольной группой (табл. 14).
Таким образом, результаты опытов подтверждают эффективность применения нового соединения в качестве адъюванта в комбинированной терапии онкологических заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2022 |
|
RU2782931C2 |
| ПРИМЕНЕНИЕ 9-ОКСОАКРИДИН-10-УКСУСНОЙ КИСЛОТЫ И/ИЛИ ЕЕ СОЛИ В КОМБИНАЦИИ С АНТИЭСТРОГЕНОМ И/ИЛИ ПРОГЕСТИНОМ ДЛЯ ЛЕЧЕНИЯ ЭСТРОГЕНЗАВИСИМЫХ ОПУХОЛЕЙ, СПОСОБ ЛЕЧЕНИЯ И НАБОРЫ | 2007 |
|
RU2346691C2 |
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ СРЕДСТВО С АНТИКОАГУЛЯНТНОЙ, ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2412712C1 |
| ФАРМАКОЛОГИЧЕСКАЯ КОМБИНАЦИЯ ПОЛИКАТИОННОГО НОСИТЕЛЯ ПЭГ-ПЭИ-ТАТ С ЗАКЛЮЧЕННОЙ В НЕМ ПЛАЗМИДОЙ, НЕСУЩЕЙ ТЕРАПЕВТИЧЕСКИЕ ГЕНЫ HSVtk И GM-CSF ДЛЯ ЦЕЛЕЙ ГЕНОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2575077C2 |
| КОМПЛЕКСНОЕ ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2020 |
|
RU2751776C2 |
| ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ, ПОКРЫТЫЕ ОКСИДОМ МАГНИТНОГО МЕТАЛЛА, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2472530C2 |
| СРЕДСТВО ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2018 |
|
RU2699558C2 |
| Способ биотерапии лабораторных крыс с перевитой глиобластомой | 2019 |
|
RU2722268C1 |
| СПОСОБ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА ГЛИОБЛАСТОМЫ ГОЛОВНОГО МОЗГА ЧЕЛОВЕКА В ОБЛАСТЬ CORTEX PARIETALIS ГОЛОВНОГО МОЗГА ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2020 |
|
RU2742449C1 |
| Способ терапии метастатического рака с использованием вируса Сендай | 2017 |
|
RU2662916C1 |
Изобретение относится к химии, фармацевтике и медицине, а именно к новому химическому соединению L-лизина 9-оксоакридинил-10-ацетат, которое стимулирует продукцию интерлейкина-24 (IL-24) и фактора некроза опухолей бета (TNF-β), и обладает противоопухолевой активностью. Технический результат: получено и описано новое химическое соединение, стимулирующее продукцию цитокинов интерлейкина-24 и фактора некроза опухолей бета и проявляющее противоопухолевую активность при низкой токсичности, L-лизина 9-оксоакридинил-10-ацетат формулы:
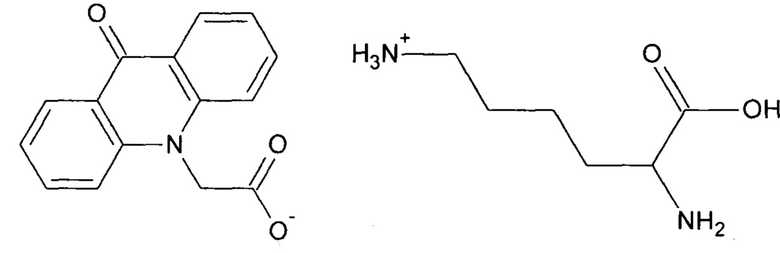
2 н. и 1 з.п. ф-лы, 14 табл., 1 пр.
1. Новое химическое соединение L-лизина 9-оксоакридинил-10-ацетат формулы:
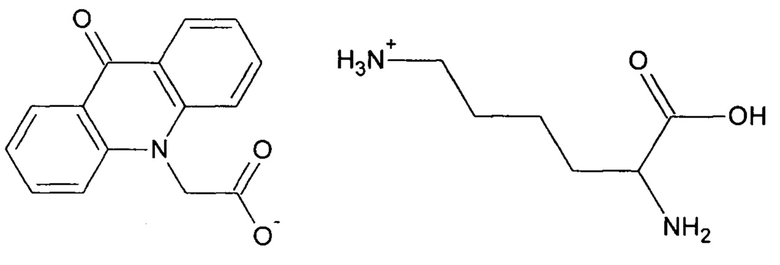
стимулирующее продукцию интерлейкина-24 и фактора некроза опухолей - бета.
2. Соединение по п. 1, проявляющее противоопухолевую активность.
3. Применение соединения по п. 1 в качестве адъюванта в комбинированной терапии онкологических заболеваний.
| СПОСОБ И НАБОР ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЖЕНСКОЙ РЕПРОДУКТИВНОЙ СИСТЕМЫ С ПРИМЕНЕНИЕМ 9-ОКСОАКРИДИН-10-УКСУСНОЙ КИСЛОТЫ, И/ИЛИ ЕЕ СОЛИ, И/ИЛИ ЕЕ СЛОЖНОГО ЭФИРА | 2007 |
|
RU2363466C2 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2020-08-24—Публикация
2019-10-29—Подача