Предлагаемое изобретение относится к органическому синтезу, конкретно к способу получения новых замещенных 1,10-фенантролинов общей формулы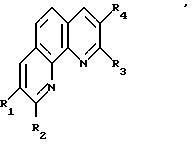
где R1 = -C2H5, i -C3H7; -C4H9 R3 = C3H7; i-C4H9; -C5H11 R2 = Ph, -C3H7; i -C4H9; -C5H11 R4=C2H5; i -C3H7; -C4H9.
В народном хозяйстве о-фенантролин и его производные находят широкое применение как полупродукты в синтезе соединений, обладающих фармакологической, пестицидной активностью и в аналитической химии.
Известен ряд способов получения замещенных 1,10-фенантролинов, которые базируются на реакции Скраупа - конденсации 8-аминохинолинов с глицерином в присутствии серной кислоты, соединений мышьяка.
Наиболее близким к предлагаемому изобретению является метод [E.H.Case. Substituted 1,10 - Phenonthrolines I The Sinthesis of Certfin Mono- and Polymethyl-1,10-phenanthrolines //J.Am.Chem. Sic.Vol.70., p.3994 (1948)] синтеза ди-, три- и тетраметил-о-фенантролинов по Скраупу, исходя из соответствующего 8-аминохинолина и глицерина, α- -метилакролеиндиацетата по следующей схеме: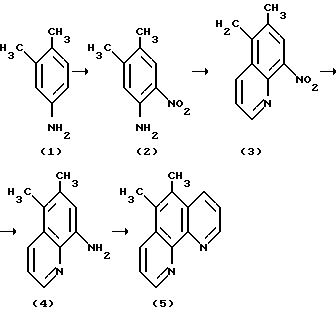
I-я стадия - получение 2-нитро-4,5-диметиланилина (2) нитрованием диметиланилина (I) (условия реакции стандартны - 0oC, перемешивание в смеси серной и азотной кислот, выход конечного продукта - 41%). II-я стадия - синтез нитрохинолина (3) реакцией Скраупа - взаимодействием динитроанилина (2) с глицерином в среде концентрированной серной кислоты с эквимолярным количеством пентоксида мышьяка при 100oC (выход (3) - 63%). Стадия III-я- восстановление нитрохинолина (3) до аминохинолина (4) и заключительная стадия IY - конденсация аминохинолина (4) по Скраупу с получением 5,6-диметил-о-фенантролина (5) с 9%-м выходом. Условия реакции аналогичны стадии II. По этой же схеме, применяя вместо глицерина α- метилакролеиндиацетат, 1,3,3-триметоксибутан, диацетат кротонового альдегида, синтезирован ряд ди-, три- и тетраметил-1,10-фенантролинов с выходами 2,3-22%.
В работе [F. H. Case. Substituted 1,10-Phenanthrolines II Di-and tri-methyl Phenanthrolines Reloted to 5-methyl-1,10-phenanthroline // J.Am.Chem. Soc. Vol. 71, p.21 (1949).] вместо глицерина использованы другие субстраты - метилвинилкетон, гидрокси-2-метил-3-бутанон. Принципиальная схема и ключевые реакции аналогичны описанным выше. Выход метилзамещенных о-фенантролинов колеблется от 4 до 30%.
К недостаткам описанных способов следует отнести:
1. Низкий выход целевого продукта (2-30%).
2. Многостадийность схемы реакции.
3. Использование в процессе токсичных реагентов - соединений мышьяка.
4. Применение концентрированной серной и азотной кислот.
5. Трудность выделения и очистки конечного продукта (многократная экстракция и перекристаллизация).
6. Наличие большого количества продуктов смолообразования.
7. Большой расход исходных реагентов, обусловленный многостадийностью процесса и необходимостью выделения целевых продуктов каждой стадии.
8. Необходимость утилизации большого количества отходов и сточных вод, загрязненных продуктами разложения соединений мышьяка и серной кислоты.
9. Данный способ не позволяет получить замещенных фенантролинов с большей длиной алкильной цепи.
В связи с ростом потребности народного хозяйства в производных 1,10-фенантролина авторами были продолжены работы по созданию эффективных и удобных для промышленной реализации методов синтеза замещенных фенантролинов разнообразной структуры, в том числе содержащих алифатические и ароматические заместители.
Задачей данной работы является разработка нового каталитического способа синтеза замещенных 1,10-фенантролинов, базирующегося на применении доступных и дешевых исходных мономеров и реагентов.
Поставленная задача достигается конденсацией о-фенилендиамина или 8-аминохинолина с соответствующим алифатическим альдегидом или соответствующими алифатическими и ароматическими альдегидами в присутствии катализатора, состоящего из треххлористого празеодима (P2Cl3), фосфорорганического соединения (PR3) и диметилформамида в молярном соотношении, равном 0,5 - 1,5 : 2 - 4:4 - 15, температуре реакции 140-160oC в течение 6-8 ч. Молярное соотношение в случае конденсации 8-аминохинолина с алифатическими альдегидами равно 1:2, а при соконденсации указанного амина со смесью алифатического и ароматического альдегида - 1:1:1. Конденсацию о-фенилендиамина с алифатическими альдегидами проводили при молярной соотношении 1:4. Выход целевых продуктов достигает 50-80%.
В качестве фосфорорганических соединений берут трифенилфосфин (PPh3), трипропилфосфин (PPi3), трибутилфосфин (PBu3), триаминфосфин (PAm3). Использованы алифатические альдегиды - масляный (C4H8O), изовалериановый (C5H10O), капроновый (C6H12O) и бензальдегид (C7H6O).
Реакция протекает по следующей общей схеме: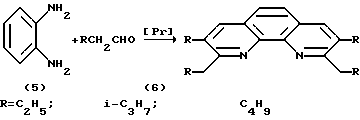
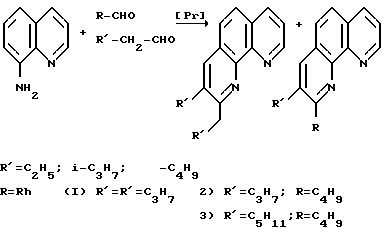
На первом этапе происходит конденсация двух молекул альдегида с образованием α,β - непрерывного альдегида кротонового типа (I). Затем образовавшийся димер альдегида in situ реагирует с ароматическим амином по реакции Михаэля (II). Причем две аминогруппы о-фенилендиамина реагирует нацело с эквимолярным количеством димера альдегида, что в пересчете на исходный альдегид соответствует соотношению о-фенилендиамин-альдегид = 1:4. (В случае 8-минохинолина соотношение амин-альдегид взято равным 1:2 по аналогичным соображениям). В результате нуклеофильной атаки карбонильной группы аминоальдегида происходит замыкание цикла с получением оксипроизводного о-фенантролина, который претерпевает ряд внутримолекулярных превращений, что в конечном счете приводит к образованию замещенного о-фенантролина (III)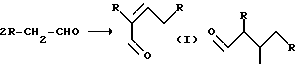
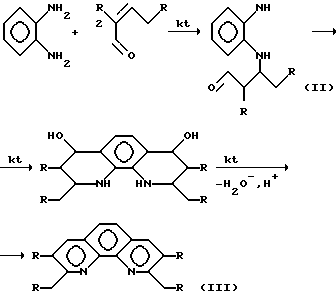
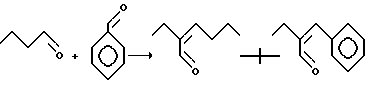
В случае совместной конденсации алифатического и ароматического альдегидов на первой стадии реакции возможно образование димеров двух типов: первый - результат взаимодействия двух молей алифатического альдегида, второй - алифатического и ароматического альдегида. В результате ряда причин, среди которых превалируют стерические факторы, наблюдается преимущественное образование димера алифатического альдегида. Таким образом, генерированные in situ димеры взаимодействуют с амином и образуют в конечном счете две различные молекулы замещенных фенантролинов, которые легко выделяются фракционированием в вакууме.
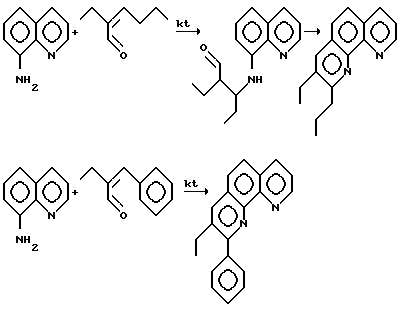
Ниже приведена принципиальная схема на примере взаимодействия 8-аминохинолина со смесью масляного и бензальдегидов.
К преимуществам предлагаемого изобретения относятся:
1. Высокий выход целевого продукта. Метод открывает новые возможности в синтетической органической практике, поскольку известными методами невозможно получать с высокими выходами алкил- и арилзамещенные 1,10-фенантролина, генерируя in situ α,β- непредельные альдегиды.
2. Упрощение технологии получения производных о-фенантролина за счет отказа от использования серной кислоты, соединений мышьяка.
3. Малый выход продуктов смолообразования.
4. Простота выделения и очистки целевых продуктов.
5. Отсутствие в процессе синтеза токсичных реагентов.
Данное изобретение иллюстрируется следующими примерами:
Пример 1. Раствор 0,1 гр PrCl3 (0,4 ммоля), 0,3 гр PPh3 (1,2 ммоля) в 1 мл ДМФА перемешивают в токе аргона при 10oC в течение 15 мин. Затем полученный раствор катализатора переносят в стальной автоклав (V = 17 см3), куда предварительно загружают 2,9 гр (20 ммолей) 8-аминохинолина, 3,6 мл (40 ммолей) масляного альдегида. Автоклав нагревают при постоянном перемешивании 6 ч при 150oC, затем охлаждают. Реакционную массу трижды экстрагировали эфиром (3 x 50 мл), объединенные экстракты сушили над безводным MgSO4, растворитель отгоняют, а остаток фракционируют в вакууме. Получают 2-пропил-3-этил-1,10-фенантролин 4,03 гр (80% выход).
Пример 2. Раствор 0,1 гр PrCl3 (0,4 ммоля), 0,3 гр PPh3 (1,2 ммоля) в 1 мл ДМФА перемешивают в токе аргона при 10oC в течение 15 мин. Полученный раствор катализатора вносят в стальной автоклав, куда предварительно загружают 2,9 гр (20 ммолей) 8-аминохинолина, 1,8 мл (20 ммолей) масляного альдегида, 1,9 мл (20 ммолей) бензальдегида. Автоклав после нагрева при постоянном перемешивании (160o, 6 ч) охлаждают и реакционную массу обрабатывают, как указано выше. Получают смесь 2,01 гр (40%) 2-пропил-3-этил-1,10-фенантролина и 1,97 гр (35%) 2-фенил-3-этил-1,10-фенантролина, которая разделяется фракционированием в вакууме.
Пример 3. Раствор 0,1 гр PrCl3 (0,4 ммоля), 0,3 гр PPh3 (1,2 ммоля) в 1 мл ДМФА вносят в стальной автоклав, куда предварительно загружают 2,2 гр (20 ммолей) о-фенилендиамина, 7,2 мл (80 ммолей) масляного альдегида. Автоклав после нагрева при постоянном перемешивании (160o, 6 ч) охлаждают и реакционную массу обрабатывают, как указано выше. Получают 3,5 гр (54%) 2,9-дипропил-3,8-диэтил-1,10-фенантролина.
(1) 2-пропил-3-этил-1,10-фенантролин. Спектр ПМФ (δ, м.д.): 1,08т (3H, CH3), 1,35т (3H, CH3), 1,95т (2H, CH2), 2,91к (2H, CH2), 3,15т (2H, CH2), 7,67 - 9,2м (6H, аром.).
Спектр ЯМР C13 (δ, м. д. ): 14,48к, 23,62т, 25,18т, 38,27т, 122,19д, 125,35д, 126,3д, 127,52с, 128,34с, 134,45д, 135,88д, 143,6с, 146,13с, 150,43с, 150,15д, 162,23с.
(2) 2-изобутил-3-изопропил-1,10-фенантролин. Спектр ПМВ (δ, м.д.): 1,08д (6H, CH3), 1,34д (6H, CH3), 2,3м (1H, CH), 3,1д (2H, CH2), 3,4м (1H, CH), 7,5 - 9,21м (6H, аром.). Спектр ЯМР C13 (δ, м.д.): 22,59к, 23,83к, 28,92д, 29,88д, 43,8т, 122,19д, 125,26д, 126,44д, 127,42с, 128,21с, 128,77д, 131,86д, 132,20с, 135,91с, 142,57с, 150,01д, 160,84с.
(3) 2-пентил-3-бутил-1,10-фенантролин. Спектр ПМР (δ, м.д.): 0,93т (3H, CH3), 0,98т (3H, CH3), 1,4 - 1,9м (10H, CH2), 2,85т (2H, CH2), 3,2т (2H, CH2), 7,5 - 9,2м (6H, аром.). Спектр ЯМР C13 (δ, м.д.): 14,01к, 14,18к, 22,59т, 22,88т, 30,8т, 32,38т, 32,82т, 32,06т, 36,49т, 122,21д, 125,36д, 126,26д, 127,41с, 128,33с, 135,38д, 135,9д, 135,99с, 143,9с, 146,18с, 150,17д, 162,56с.
(4) 2-фенил-3-этил-1,10-фенантролин. Спектр ПМР (δ, м.д.): 1,23т (3H, CH3), 2,86к (2H, CH2), 7,2 - 7,6м (5H, фенил-), 7,5 - 9,17м (6H. аром.). Спектр ЯМР C13 (δ, м.д.): 14,82к, 26,05т, 122,47д, 126,47д, 127,9д, 128,1с, 128,5с, 135,3д, 135,9д, 137,35с, 144,2с, 146,3с, 150,26д, 162,1с, 128,05д, 126,2д, 129,37д, 141,0с.
(5) 2,9-дипропил-3,8-диэтил-1,10-фенантролин. Спектр ПМР (δ, м.д.): 0,97т (6H, CH3), 1,12т (6H, CH3), 1,67м (4H, CH3), 2,31к (4H, CH2), 3,07т (4H, CH2), 7,4 - 8,7 м (4H, аром.). Спектр ЯМР C13 (δ, м.д.): 14,3н, 23,4т, 24,07т, 37,18т, 122,77с, 124,13с, 125,16д, 126,5с, 128,97с, 133,14с, 134,78с, 143,5с, 144,18с, 151,13с, 151,28д, 161,32с.
(6) 2,9-диизобутил-3,8-диизопропил-1,10-фенантролин. Спектр ПМР (δ, м.д. ): 0,86д (12H, CH3), 1,03д (12H, CH3), 2,1м (2H, CH), 2,9д (4H, CH2), 7,5 - 8,6м (4H, аром.). Спектр ЯМР C13 (δ, м.д.): 21,14к, 22,87к, 27,47д, 28,8д, 44,1т; 123,8с, 124,1с, 126,3д, 126,78д, 127,1с, 128,07с, 129,1д; 132,05д, 132,67с, 136,03, 141,3с, 151,3д, 161,5с.
(7) 2,9-диамид-3,8-дибутил-1,10-фенантролин. Спектр ПМР (δ, м.д.): 0,87т (6H, CH3), 0,93т (6H, CH3), 1,3 - 1,92м (20H, CH2), 2,73т (4H, CH2), 3,15т (4H, CH2), 7,7 - 8,9м (4H, аром.). Спектр ЯМР C13 (δ, м.д.): 13,7к, 14,2к, 21,14т, 23,18т, 30,7т, 31,8т, 31,7т, 32,03т, 35,4т, 121,2д, 124,3с, 125,4с, 126,8с, 128,7с, 135,3д, 135,7д, 136,5с, 141,3с, 145,76с, 151,8д, 161,7с.
Данные элементного анализа перечисленных соединений соответствуют вычисленным значениям.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛИЧЕСКИХ АЛЮМИНАТОВ ЛИТИЯ | 1996 |
|
RU2156768C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4,5-ДИАЛКИЛ(ФЕНИЛ)-1,4Z,9-ДЕКАТРИЕНОВ | 1995 |
|
RU2145319C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1,10-ФЕНАНТРОЛИНОВ | 2006 |
|
RU2313525C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ ТРЕО-5,6-ДИЗАМЕЩЕННЫХ ГЕПТ-1-ЕНОВ И ТРЕО-5,6-ДИЗАМЕЩЕННЫХ ДЕКА-1,9-ДИЕНОВ | 1994 |
|
RU2109717C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-7,8-БЕНЗО-1,6-НАФТИРИДИНОВ | 2006 |
|
RU2313526C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,2-БИС/(ДИАЛКОКСИ)АЛЮМА/-ЦИС-1,2-ДИФЕНИЛ(АЛКИЛ)ЭТИЛЕНОВ | 1996 |
|
RU2156766C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-ЭТИЛ-2-АРИЛ-, 1-ЭТИЛ-3-АРИЛ-, 1-ЭТИЛ-2,4-ДИАРИЛ-, 1-ЭТИЛ-2,5-ДИАРИЛ-АЛЮМАЦИКЛОПЕНТАНОВ И 1-ЭТИЛ-2-АРИЛ-АЛЮМАЦИКЛОПРОПАНОВ | 1999 |
|
RU2157811C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,2-БИС/(ДИАЛКИЛАМИН)АЛЮМА/-ЦИС-1,2-ДИФЕНИЛ(АЛКИЛ)ЭТИЛЕНОВ | 1996 |
|
RU2155768C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-ЭТИЛ-2,3,4,5-ТЕТРААЛКИЛ(АРИЛ)АЛЮМАЦИКЛОПЕНТАДИЕНОВ И 1-ЭТИЛ-2,3-ДИАЛКИЛ(АРИЛ)АЛЮМАЦИКЛОПРОПЕНОВ | 1997 |
|
RU2130025C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ЭТИЛ-2,3-ДИФЕНИЛ (АЛКИЛ) АЛЮМАЦИКЛОПРОПЕНОВ | 1996 |
|
RU2152393C1 |

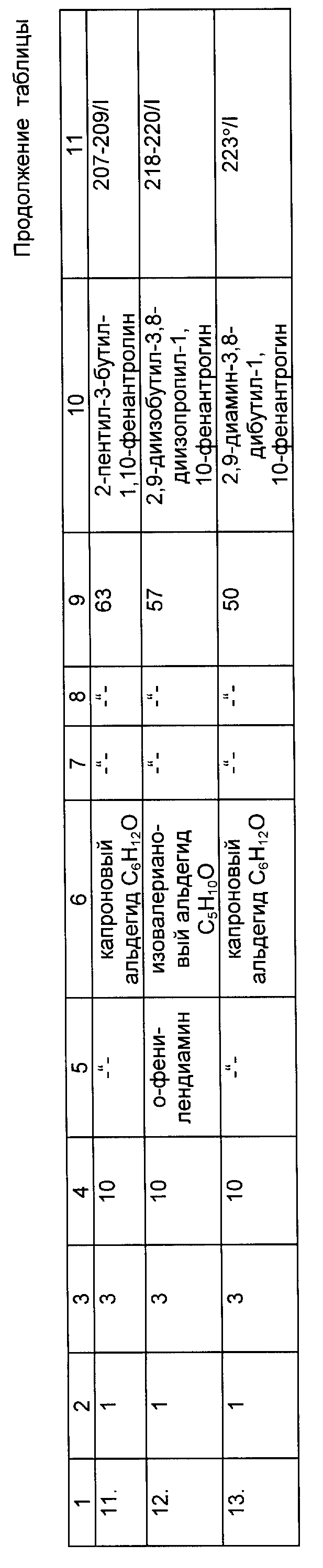
Изобретение относится к органической химии, конкретно к способу получения новых замещенных 1,10-фенантролинов общей формулы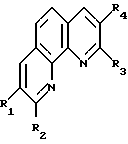
где R1 обозначает этил, изопропил, н-бутил; R2 обозначает фенил, пропил, изобутил, пентил; R3 обозначает пропил, изобутил, пептил, атом водорода; R4 обозначает этил, изопропил, н-бутил, атом водорода, отличающийся тем, что о-фенилендиамин или 8-аминохинолин подвергается взаимодействию с соответствующими альдегидами или соответствующими алифатическими и ароматическими альдегидами при молярном соотношении 1:2 - 4, температуре 140 - 160o в течение 6 - 8 ч, в присутствии катализатора, содержащего треххлористый празеодим, фосфорорганическое соединение (PR3) и диметилформамид в молярном соотношении 0,5 - 1,5:2 - 4:4 - 15. Выход целевых продуктов 50 - 80%. Полученные предлагаемым способом новые вещества могут найти применение в аналитической химии и как полупродукты в синтезе соединений, обладающих фармакологической и пестицидной активностью. 1 табл.
Способ получения замещенных 1,10- фенантролинов общей формулы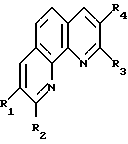
где R1 обозначает этил, изопропил, н-бутил;
R2 обозначает фенил, пропил, изобутил, пентил;
R3 обозначает пропил, изобутил, пентил, атом водорода;
R4 обозначает этил, изопропил, н-бутил, атом водорода,
отличающийся тем, что о-фенилендиамин или 8-аминохинолин подвергается взаимодействию с соответствующими алифатическими альдегидами или соответствующими алифатическими и ароматическими альдегидами при молярном соотношении 1: 2-4, температуре 140-160oC в течение 6-8 ч, в присутствии катализатора, содержащего треххлористый празеодим и фосфорорганическое соединение.
| E.H | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Am | |||
| Chem | |||
| Soc., vol | |||
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| ПОРИСТАЯ МАССА ДЛЯ НАПОЛНЕНИЯ СОСУДОВ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ХРАНЕНИЯ АЦЕТИЛЕНА И ДРУГИХ СЖАТЫХ ГАЗОВ | 1925 |
|
SU3994A1 |
| F.H | |||
| Case | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Am | |||
| Chem | |||
| Soc., vol 71, p 21 | |||
| Автоматическое или полуавтоматическое телефонное устройство | 1925 |
|
SU1949A1 |
Авторы
Даты
1998-10-10—Публикация
1995-01-05—Подача