Изобретение относится к новым N-замещенным производным 3-азабицикло[3.2.0] -гептана и его солям с физиологически переносимыми кислотами, обладающим нейролептическим действием.
Известно, что замещенные основаниями производные бутирофенона или производные амида бензойной кислоты оказывают действия как нейролептические средства или средства защиты головного мозга (патент США 4605655, европейский патент 410114, патент ФРГ 1289845, европейский патент 400661, патент ФРГ 2941880, европейский патент 190472).
При этом наблюдаемое средство к σ- рецепторам наряду со сродством к допамину и серотонину играет, по-видимому, особую роль.
Теперь было найдено, что N-замещенные производные 3-азабицикло[3.2.0]-гептана формулы I
где
R1 обозначает фенил, в случае необходимости одно- или двузамещенный атомами галогена, C1-C4-алкилом, группами трифторметила, гидрокси, C1-C4-алкокси, амино, монометиламино, диметиламино, циано или нитрогруппами, пиридил-, тиенил-,
R2 обозначает атом водорода или фенил,
n обозначает число 1, 2, 3 или 4,
A обозначает атом водорода или группу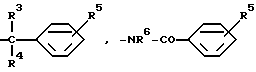
или
-CH=CH2,
R3 представляет атом водорода, гидроксил или фенил, замещенный в случае необходимости атомом фтора, атомом хлора или атомом брома,
R4 обозначает атом водорода, или
R3 и R4 представляют вместе атом кислорода,
R5 обозначает атом водорода, атом фтора, атом хлора или атом брома, гидроксигруппу, нитрогруппу, C1-C4-алкил-группу или метоксигруппу, и
R6 представляет атом водорода или метил,
и их соли с физиологически переносимыми кислотами имеют ценные фармакологические свойства.
В формуле 1 заместители R1-R6 и n имеют преимущественно следующие значения:
R1 - фенил, замещенный в случае необходимости фтором, хлором, метокси, трифторметилом, нитро, гидрокси или амино,
R2 - водород,
n - 2 и 3,
R3 - гидроксил, p-фторфенил,
R4 - водород или вместе с R3 кислород,
R5 - водород, фтор, хлор,
R6 - водород, метил.
Особенно предпочтительными можно назвать следующие соединения:
1-(4-фтор-фенил)-4-[экзо-6-фенил-3-азабицикло[3.2.0]-гептан- 3-ил]бутан-1-он,
1-(4-фтор-фенил)-4-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] - гептан-3-ил]-бутан-1-он,
1-фенил-4-[экзо-6-фенил-3-азабицикло[3.2.0]гептан-3-ил]бутан- 1-он,
1-фенил-4-[экзо-6-p-фенил-3-азабицикло[3.2.0]гептан-3-ил]бутан- 1-он,
1-(4-фтор-фенил)-4-[экзо-6-фенил-3-азабицикло[3.2.0] гептан- 3-ил] бутан-1-ол,
1-(4-фтор-фенил)-4-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0]гептан- 3-ил] бутан-1-ол,
1-фенил-4-[экзо-6-фенил-3-азабицикло[3.2.0]гептан-3- ил]бутан-1-ол,
1-фенил-4-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3- ил]бутан-1-ол,
1-(бис-4-фторфенил)-4-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3- ил]бутан,
N-(3-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил] пропил)-4-фтор- бензамид,
N-(2-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил] этил)-4- фтор-бензамид,
N-(2-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил]этил)-N-метил- 4-фтор-бензамид,
N-(2-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил] этил)-N- метил-бензамид,
N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] пропил)- 4-фтор-бензамид,
N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] этил)- бензамид,
и
N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил]этил)- N-метил-бензамид.
Соединения по изобретению формулы I можно получать в результате того, что соединение формулы II
Nu-(CH2)n-A
в которой
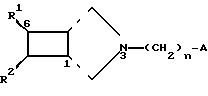
A и n имеет указанные значения и Nu представляет нуклеофильную отходящую группу, подвергают взаимодействию с производным 3-азабицикло[3.2.0]гептана формулы III
где
R1 обозначает атом водорода или одно- или двузамещенную в случае необходимости атомами галогена, C1-C4-алкилом, трифторметилом, группами гидрокси, C1-C4-алкокси, амино-монометиламино, диметиламино, циано-, или нитрогруппами фенил-, пиридил-, тиенил- или пирролгруппу,
R2 представляет атом водорода или замещенную в случае необходимости галогеном, метокси, гидрокси или амино группу фенила,
и полученные таким путем соединения переводят в случае необходимости в кислотно-аддитивные соли с физиологически переносимыми кислотами.
В качестве нуклеофильных отходящих групп для Nu применяют преимущественно атомы галогена, особенно бром или хлор.
Превращение целесообразно проводить в присутствии инертного основания, такого как триэтиламин или карбонат калия, в качестве связывающего кислоту средства, в инертном растворителе, таком как простой циклический насыщенный эфир, особенно тетрагидрофуран или диоксан, или в бензольном углеводороде, таком как толуол или ксилол.
Превращение происходит, как правило, при температурах от 20 до 150oC и заканчивается в общем в пределах от 1 до 10 часов.
Соединения по изобретению формулы I можно перекристаллизовывать из обычных органических растворителей, предпочтительно из низшего спирта, такого как этанол, или очищать хроматографией на колонке.
Рацематы можно разделять на энантиомеры простым способом в результате классического расщепления при помощи оптически активных карбоновых кислот, например производных винной кислоты, в инертном растворителе, например, в низших спиртах.
Производные 3-азабицикло[3.2.0]гептана формулы I можно обычным способом переводить в кислотно-аддитивную соль фармакологически переносимой кислоты, преимущественно смешиванием раствора с эквивалентом соответствующей кислоты. Фармацевтически переносимыми кислотами являются, например, соляная кислота, фосфорная кислота, серная кислота, метансульфокислота, сульфаминовая кислота, малеиновая кислота, фумаровая кислота, щавелевая кислота, винная кислота или лимонная кислота.
Соединения по изобретению имеют ценные фармакологические свойства. Они могут найти применение как нейролептические средства (особенно атипичные), антидепрессивные средства, седативные средства, снотворные средства, защитные средства для центральной нервной системы или мышечные релаксанты. Многие из названных действий у соединений по изобретению могут появляться в комбинациях. Выявление фармакологического действия производят как на живом организме, так и в пробирке, причем характеристика вещества возможна, в частности, благодаря частично очень высокому и селективному сродству к субтипам рецепторов, например, допамин D1-, D2-, D3-, D4-рецепторам; серотонин 1A, 1D- и 2-рецепторам; альфа 1- и 2-рецепторам; гистамин 1- и мускарин-рецепторам.
Для характеристики новых веществ в отношении их действия на живом организме были привлечены следующие методы:
а) Влияние на ориентировочную моторику
Мыши показывают в новом окружении повышенную деятельность при обследовании, которая выражается в повышенной двигательной активности. Эту двигательную активность измеряют в клетках с фотоячейками за время 0-30 минут после посадки животных (NMRI-мышей, женского пола) в клетки.
ED50: доза, которая снижает двигательную активность по сравнению с контрольными животными, обработанными плацебо, на 50%.
б) Антагонизм относительно апоморфина
NMRI-мыши женского пола получают 1,21 мг/кг апоморфина подкожно. Апоморфин вводят при этой дозе для двигательного активирования, которое выражается, когда животные удерживаются в клетках из проволочной сетки, в постоянном карабкании. Карабкание оценивают при помощи счета (каждые 2 минуты в течение 30 минут):
0: у животного четыре лапы на полу
1: у животного две лапы на проволоке
2: у животного четыре лапы на проволоке (карабкание).
Благодаря предварительной обработке антипсихотическими средствами можно тормозить состояние карабкания.
ED50: доза, которая тормозит на 50% активность карабкания животных по сравнению с контрольными животными, обработанными плацебо.
в) L-5-HTP-антагонизм
Sprague-Dawley-крысы получают L-5-HTP при дозе 316 мг/кг внутрибрюшинно. После этого животные проявляют синдром возбуждения, по симптомам которого
-спонтанное топтание и
тремор-
при помощи счета (0 = нет, 1 = умеренный, 2 = отчетливо выраженный) каждые 10 минут в течение от 20 до 60 минут после приема L-5-HTP производят оценки. В среднем после приема L-5-HTP достигают счета 17. Испытываемые вещества дают перорально за 60 минут до приема L-5-HTP. В качестве ED50 вычисляют дозу, которая в среднем снижает контрольный счет на 50%.
Приведенные методы применяют, чтобы характеризовать вещества как антипсихотические средства. При помощи торможения L-5-HTP-синдрома можно показать антагонистическое действие в отношении серотонина, действие которое характерно для так называемых нейролептических средств.
Вещества по изобретению показывают в этих тестах хорошее действие.
Изобретение относится соответственно также к терапевтическому средству, отличающемуся содержанием соединения формулы I или его фармакологически переносимой кислотно-аддитивной соли в качестве активного вещества наряду с обычными носителями и разбавителями, а также к применению новых соединений при борьбе с болезнями.
Соединения по изобретению можно давать обычно орально, парентерально, внутривенно или внутримышечно.
Дозировка зависит от возраста, состояния и веса пациента, а также от вида применения. Как правило, ежедневная доза активного вещества составляет приблизительно между 1 и 100 мг/кг веса тела при оральном приеме и между 0,1 и 10 мг/кг веса тела при парентеральном приеме.
Новые соединения можно применять в обычных галеновых формах использования в твердом или жидком виде, например, как таблетки, пленочные таблетки, капсулы, порошки, грануляты, драже, свечи, растворы, мази, кремы или распылители. Последние изготавливают обычным образом. При этом активные вещества можно перерабатывать с обычными галеновыми вспомогательными средствами, как таблеточные связующие, наполнители, консерванты, таблеточные разрушающие средства, средства регулирования текучести, пластификаторы, смачиватели, диспергаторы, эмульгаторы, растворители, средства замедления, антиокислители и/или рабочие газы (ср. : H. Sucker et al. Pharmazeutische Technologie (Фармацевтическая технология), Thieme-Verlag, Stuttgart, 1978). Полученные таким путем формы для применения содержат активное вещество обычно в количестве от 1 до 99 вес.%.
Необходимые в качестве исходных веществ для синтеза новых соединений вещества формулы II известны.
Вещества формулы III можно получать, подвергая амин формулы IV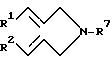
где
R1 и R2 имеют вышеуказанные значения и R7 обозначает водород, ацетил, бензил или трифторацетил, фотохимическому 2+2-циклоприсоединению и затем в случае необходимости отщепляют ацильную или бензильную группу.
Фотореакция хорошо удается в инертном растворителе, преимущественно в ацетоне, при температурах от 20 до 80oC. В качестве источника света особенно хорошо пригодна ртутная лампа высокого давления. В случае необходимости выгодно осуществлять фотоциклоприсоединение в кварцевой аппаратуре, в атмосфере азота, в случае необходимости при добавке около 1 моля соляной кислоты на 1 моль амина.
Фотоциклоприсоединение в большинстве случае протекает высокодиастереоселективно относительно бициклических соединений III с экзоконфигурацией по отношению к R1 и R2: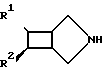
Расщеплением рацемата, например, при помощи оптически активных производных винной кислоты можно выделять оба энантиомера в чистом виде.
Отщепление ацильного остатка (R7) целесообразно осуществлять омылением известными методами. Аналогично отщепляют бензильный остаток.
Амины формулы IV известны из литературы или их можно получать в результате того, что или альдегид R1-CHO превращают с хлоридом винилмагния до аллилового спирта V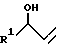
затем перегруппировывают с хлористым водородом до хлористого аллила VI
и наконец превращают с соответствующим аллиламином VII,
или подвергают коричный альдегид VIII
прямо восстановительному аминированию с аллиламином VII.
Следующие примеры служат для пояснения изобретения:
A) Получение исходных материалов
1. экзо-6-(p-фтор)-фенил-3-азабицикло[3.2.0]гептан
19,4 г (102 ммол) N-аллил-N-[3-(4-фторфенил)аллил]амина в 130 мл ацетона смешивали с 130 мл 10%-ной соляной кислоты и с 600 мг кетона Михлера и в атмосфере азота в течение 55 часов облучали при помощи ртутной лампы высокого давления в 150 ватт в кварцевой аппаратуре при комнатной температуре. После этого сгущали реакционную исходную смесь и распределяли остаток между хлористым метиленом и водой. При помощи водного раствора аммиака устанавливали щелочную реакцию и экстрагировали водную фазу еще два раза хлористым метиленом. Соединенные органические фазы сушили с сульфатом натрия и сгущали. Выход 19,3 г (99%), точка плавления 165-166oC (малеинат).
Для разделения антиподов смешивали 15,0 г (78,5 ммол) рацемата с раствором 31,7 г (78,5 ммол) (-)-ди-O-толуол-L-винной кислоты в 300 мл кипящего этанола. Осаждающиеся при охлаждении при перемешивании кристаллы (13,8 г) отсасывали при дополнительной промывке этанолом и перекристаллизовывали из 200 мл этанола при добавке 200 мл воды. Высвобождение основания давало (+)-антипод (5,5) с [α]D = +97,0oC.
(EtOH, c = 0,969).
Кристаллизовали из вышеназванного маточного раствора в течение ночи 14,2 г соли, которая была перекристаллизована (сгущение до 300 мл) из 400 мл этанола (отфильтровывание нерастворимой части при температуре кипения). Высвобождение основания давало 4,0 г (-)-антипода, [α]D = -96,0oC.
(EtHO, c = 0,940).
Экзо-фенил-конфигурации обнаруживали при помощи рентгено-структурного анализа.
2. экзо-6-фенил-3-азабицикло[3.2.0]гептан
50,0 г (28,9 ммол) N-циннамил-N-аллиламина в 1600 мл ацетона смешивали с 300 мл 10%-ной соляной кислоты и облучали в атмосфере азота в течение 48 часов при помощи ртутной лампы высокого давления в 150 ватт в кварцевой аппаратуре при комнатной температуре. Затем сгущали реакционную исходную смесь и распределяли остаток между хлористым метиленом и водой. Устанавливали при помощи водного раствора аммиака щелочную реакцию и экстрагировали водную фазу еще два раза хлористым метиленом. Соединенные органические фазы сушили с сульфатом натрия и сгущали.
Выход: 49,0 г (98%) вязкого масла.
Точка плавления 177-178oC (малеинат).
3. экзо-6,7-дифенил-3-бензил-3-азабицикло[3.2.0]гептан
70,0 г (206 ммол) бис-(N-циннамил)-бензиламина в 2500 мл ацетона смешивали с 0,8 г кетона Михлера и в атмосфере азота 25 часов облучали при помощи ртутной лампы высокого давления в 150 ватт в аппаратуре из стекла "дуран" при комнатной температуре. Затем сгущали реакционную исходную смесь и распределяли остаток между хлористым метиленом и водой. Устанавливали при помощи водного раствора аммиака щелочную реакцию и экстрагировали водную фазу еще два раза хлористым метиленом. Соединенные органические фазы сушили с сульфатом натрия и сгущали. Очистку сырого продукта (65,0 г) проводили хроматографией на колонке (силикагель, растворитель -толуол этанол 98/2). Получают 58,0 (83,0%) продукта, точка плавления: 230 - 232oC (гидрохлорид).
4. экзо-6,7-дифенил-3-азабицикло[3.2.0]гептан
К 12,0 г (35,4 ммол) экзо-6,7-дифенил-3-бензил-3-азабицикло[3.2.0]гептана в смеси из 300 мл n-пропанола и 16 мл воды добавляли 16,0 г (254 ммол) формиата аммония и 2,0 г палладия (10%-ного) на угле и кипятили реакционную смесь 4 часа при флегме (выделение двуокиси углерода). После охлаждения отсасывали от катализатора, промывали дополнительно пропанолом и хлористым метиленом и сгущали фильтрат. Распределяли остаток между хлористым метиленом и водой, устанавливали при помощи водного раствора аммиака щелочную реакцию и экстрагировали фазу еще два раза хлористым метиленом. Соединенные органические фазы сушили с сульфатом натрия и сгущали. Получают 8,1 г (92%) продукта, точка плавления 140-142oC (малеинат).
5. экзо-6-фенил-3-бензил-3-азабицикло[3.2.0]гептан
9,2 г (35,0 ммол) N-циннамил-N-аллил-бензиламина в 1100 мл ацетона смешивали с 100 мг кетона Михлера и в атмосфере азота 5 часов облучали при помощи ртутной лампы высокого давления в 150 ваттт в аппаратуре из стекла "дуран" при комнатной температуре. Затем реакционную исходную смесь сгущали. Очистку сырого продукта (9,4 г) осуществляли хроматографией на колонке (силикагель, растворитель -хлористый метилен/метанол 98/2). Получают 3,3 г (36%) продукта, точка плавления: 126-128oC (малеинат).
6. 2,2,2-трифтор-1-[экзо-6-(3-пиридил)-3- азабицикло[3.2.0]гепт-3-ил]-этанон
14,0 г (51,8 ммол)N-аллил,2,2,2-трифторо-N-[3-(3-пиридил)- аллил]-ацетамида растворяли в 140 мл ацетона, смешивали с 30 мл 10%-ной водной соляной кислоты и в атмосфере азота 48 часов облучали при помощи ртутной лампы высокого давления и 150 ватт в аппаратуре из стекла "дуран" при комнатной температуре. После этого реакционную исходную смесь сгущали, поглощали в 150 мл воды и устанавливали при помощи водного раствора аммиака величину pH 8-9. Водную фазу экстрагировали два раза простым трет.-бутилметиловым эфиром, соединенные органические фазы сушили над сульфатом натрия и сгущали. Остающийся остаток разделяли на фракции методом хроматографии на колонке (силикагель, хлористый метилен + 2% метанол). Получали 6,2 г (42%) неизмененного N-аллил-2,2,2-трифторо-N-[3-(3-пиридил)-аллил] - ацетамида и 3,7 г (26%) 2,2,2-трифторо-1-[экзо-6-(3-пиридил)-3- азабицикло[3.2.0]гепт-3-ил]-этанона как темное масло.
7. экзо-6-(3-пиридил)-3-азабицикло[3.2.0]гептан
К раствору 3,7 г (13,7 ммол) 2,2,2-трифторо-1-[экзо-6-(3-пиридил)-азабицикло[3.2.0] гепт-3-ил] - этанола в 50 мл этанола добавляли 2,5 г таблеток гидроокиси калия. Реакционный раствор дополнительно перемешивали еще 2 часа при комнатной температуре и затем выливали на 100 мл ледяной воды. Водную фазу экстрагировали три раза простым трет.-бутилметиловым эфиром, соединенные органические фазы сушили над сульфатом натрия и сгущали. Выход 2,3 г (96%) желтого масла, точка плавления 202-205oC (гидрохлорид).
Аналогичным образом можно получать следующие вещества:
8. экзо-6-(m-фтор-фенил)-3-азабицикло[3.2.0]гептан,
9. экзо-6-(o-фтор-фенил)-3-азабицикло[3.2.0] гептан, точка плавления 118-120oC (малеинат),
10. экзо-6-(p-хлор-фенил)-3-азабицикло[3.2.0] гептан, точка плавления 152-154oC (малеинат),
11. экзо-6-(m-хлор-фенил)-3-азабицикло[3.2.0] гептан, точка плавления 130-132oC (малеинат),
12. экзо-6-(p-метокси-фенил)-3-азабицикло[3.2.0]гептан,
13. экзо-6-(m-метокси-фенил)-3-азабицикло[3.2.0]гептан,
14. экзо-6-(p-нитро-фенил)-3-азабицикло[3.2.0] гептан, точка плавления 158-160oC (малеинат),
15. экзо-6-(m-нитро-фенил)-3-азабицикло[3.2.0]гептан,
16. экзо-6-(p-трифторметил-фенил)-3-азабицикло[3.2.0]гептан, точка плавления 155-156oC (малеинат),
17. экзо-6-(m-трифторметил-фенил)-3-азабицикло[3.2.0]гептан,
18. экзо-6-(3,4-дихлор-фенил)-3-азабицикло[3.2.0]гептан,
19. экзо-6-(3,5-дихлор-фенил)-3-азабицикло[3.2.0]гептан, точка плавления > 250oC (гидрохлорид),
20. экзо-6-(3,4-диметокси-фенил)-3-азабицикло[3.2.0]гептан,
21. экзо-6-(m-гидрокси-фенил)-3-азабицикло[3.2.0]гептан,
22. экзо-6-(p-гидрокси-фенил)-3-азабицикло[3.2.0]гептан,
23. экзо-6-(3,4-дигидрокси-фенил)-3-азабицикло[3.2.0]гептан,
24. экзо-6-(p-метил-фенил)-3-азабицикло[3.2.0]гептан,
25. экзо-6-(m-метил-фенил)-3-азабицикло[3.2.0]гептан,
26. экзо-6-(p-трет.-бутил-фенил)-3-азабицикло[3.2.0]гептан, точка плавления > 255oC (гидрохлорид),
27. экзо-6-(m-амино-фенил)-3-азабицикло[3.2.0]гептан,
28. экзо-6-(p-амино-фенил)-3-азабицикло[3.2.0]гептан,
29. экзо-6-(p-циано-фенил)-3-азабицикло[3.2.0] гептан, точка плавления 168-170oC (малеинат),
30. экзо-6-тиен-2-ил-3-азабицикло[3.2.0] гептан, точка плавления 180-182oC (гидрохлорид),
31. экзо-6-тиен-3-ил-3-азабицикло[3.2.0] гептан, точка плавления 143-145oC (гидрохлорид),
32. экзо-6-(5-хлор-тиен-2-ил)-3-азабицикло[3.2.0]гептан, точка плавления 156-157oC (малеинат),
33. экзо-6-пиррол-2-ил-3-азабицикло[3.2.0]гептан,
34. экзо-6-пирид-4-ил-3-азабицикло[3.2.0]гептан,
35. экзо-6-пирид-2-ил-3-азабицикло[3.2.0]гептан,
Б) Получение конечных продуктов
Пример 1
1-(4-фтор-фенил)-4-[экзо-6-фенил-3-азабицикло[3.2.0] гептан- 3-ил] -бутил-1-он • HCl
8,65 г (50 ммол) экзо-6-фенил-3-азабицикло[3.2.0]гептана в 130 мл ксилола смешивали с 10,2 мл (60 ммол) ω- -хлор-4-фтор- бутирофенона, с 11,5 г (80 ммол) тонко измельченного в порошок карбоната калия вместе с 0,5 г йодида калия и кипятили при хорошем перемешивании 7 часов при флегме.
После охлаждения сгущали на ротационном выпарном аппарате и распределяли остаток между хлористым метиленом и водой.
Водную фазу дополнительно экстрагируют два раза хлористым метиленом и затем органическую фазу после однократной промывки водой и после сушки над сульфатом натрия сгущают. Сырой продукт (21 г) очищали хроматографией на колонке (силикагель, растворитель -хлористый метилен/метанол 94%). Свободное основание поглощали в 200 мл простого эфира, отфильтровали нерастворимые хлопья и смешивали эфирный раствор с избытком эфирного раствора соляной кислоты. Затем отсасывали твердые вещества в холодном виде и дополнительно промывали гидрохлорид большим количеством простого эфира. Выделяли 8,3 г (45%) продукта, точка плавления 169 - 171oC.
Аналогичным образом можно получать:
2. 1-фенил-4-[экзо-6-фенил-3-азабицикло[3.2.0]гептан-3-ил]-бутан- 1-он, точка плавления: 134 - 136oC (гидрохлорид),
3. 1-(4-фтор-фенил)-4-[экзо-6,7-дифенил-3-азабицикло[3.2.0]- гептан-3-ил]-бутан-1-он, точка плавления: 174 - 176oC (гидрохлорид),
4. 1-(4-фтор-фенил)-4-[экзо-6-фенил-3-азабицикло[3.2.0]-гептан- 3-ил]-бутан, точка плавления: 131 - 133oC (гидрохлорид),
5. 1-фенил-2-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этан- 1-он масло,
6. 1-(4-фтор-фенил)-4-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] - гептан-3-ил]-бутан, точка плавления 135 - 137oC (гидрохлорид),
7. 1-(4-фтор-фенил)-4-[экзо-6-m-фтор-фенил-3-азабицикло[3.2.0] - гептан-3-ил]-бутан-1-он, точка плавления 137 - 139oC (гидрохлорид),
8. 1-(4-фтор-фенил)-4-[экзо-6-o-фтор-фенил-3-азабицикло[3.2.0] - гептан-3-ил]-бутан-1-он, точка плавления 180 - 182oC (гидрохлорид),
9. 1-(4-фтор-фенил)-4-[экзо-6-p-хлор-фенил-3-азабицикло[3.2.0] гептан- 3-ил]-бутан-1-он,
10. 1-(4-фтор-фенил)4-[экзо-6-m-хлор-фенил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-он, точка плавления 137 - 139oC (гидрохлорид),
11. 1-(4-фтор-фенил)-4-[экзо-6-p-метокси-фенил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-он,
12. 1-(4-фтор-фенил)-4-[экзо-6-m,p-дихлор-фенил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-он,
13. 1-(4-фтор-фенил)-4-[экзо-6-m,p-диметокси-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-он.
Пример 14
1-(4-фтор-фенил)-4-[экзо-6-p-фтор-фенил-3- азабицикло[3.2.0]гептан-3-ил] -бутан-1-он • HCl
4,5 г (23,5 ммол) экзо-6-p-фтор-фенил-3-азабицикло[3.2.0]гептана в 50 мл толуола смешивали с 6,0 г (30 ммол) ω- -хлор-4-фтор-бутирофенона, с 4,2 г (30 ммол) тонко измельченного в порошок карбоната калия вместе с 0,5 г йодида калия и при хорошем перемешивании 7 часов кипятили при флегме. После охлаждения сгущали на ротационном выпарном аппарате и распределяли остаток между хлористым метиленом и водой.
Водную фазу дополнительно экстрагировали два раза хлористым метиленом и затем сгущали органическую фазу после однократной промывки водой и после сушки над сульфатом натрия. Сырой продукт (9,4 г) очищали хроматографией на колонке (силикагель, растворитель -хлористый метилен/метанол 96/4). Свободное основание поглощали в 150 мл простого эфира, отфильтровали от нерастворимых хлопьев и смешивали с избыточной эфирной соляной кислотой. После добавки 10 мл ацетона отсасывали твердые вещества в холодном состоянии и дополнительно промывали гидрохлорид большим количеством простого эфира. Выделяли 4,9 г (53%) продукта, точка плавления 166 - 168oC.
Аналогичным образом можно получать:
15. 1-фенил-4-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3- ил]-бутан-1-он, точка плавления: 141 - 143oC (малеинат),
16. 1-(4-фтор-фенил)-4-[экзо-6-p-фтор-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан,
17. 1-(4-фтор-фенил)-4-[экзо-6-p-нитро-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-он, точка плавления: 68 - 70oC (гидрохлорид),
18. 1-(4-фтор-фенил)-4-[экзо-6-m-нитро-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-он,
19. 1-(4-фтор-фенил)-4-[экзо-6-p-трифторметил-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-он, точка плавления: 158 - 161oC (гидрохлорид),
20. 1-(4-фтор-фенил)-4-[экзо-6-p-циано-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-он, точка плавления 158 - 160oC (фумарат),
21. 1-(4-фтор-фенил)-4-[экзо-6-тиен-3-ил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-он, точка плавления 148 - 150oC (гидрохлорид),
22. 1-(4-фтор-фенил)-4-[экзо-6-пирид-3-ил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-он,
23. 1-(4-фтор-фенил)-3-[экзо-6-p-фтор-фенил-3- азабицикло[3.2.0] гептан-3-ил]-пропан-1-он, точка плавления: 151 - 154oC (гидрохлорид).
Пример 24
1-(бис-4-фтор-фенил)-4-[экзо-6-p-фтор-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан • HCl
5,0 г (26,2 ммол) экзо-6-p-фтор-фенил-3-азабицикло[3.2.0]гептана в 80 мл ксилола смешивали с 8,8 г (28,4 ммол) 1,1'-(4-хлорбутилиден)бис-4'-фторбензола и с 7,0 г (50,6 ммол) тонко измельченного в порошок карбоната калия вместе с 0,3 г йодида калия и при хорошем перемешивании кипятили 15 часов при флегме. После охлаждения сгущали на ротационном выпарном аппарате и распределяли остаток между хлористым метиленом и водой. Водную фазу дополнительно экстрагировали два раза хлористым метиленом и после этого сгущали органическую фазу после однократной промывки водой и после сушки на сульфате натрия. Сырой продукт (110 г) очищали хроматографией на колонке (силикагель, растворитель -хлористый метилен/метанол 96/4). Свободное основание поглощали в 350 мл простого эфира, отфильтровывали нерастворимые хлопья и смешивали раствор простого эфира с избыточной эфирной соляной кислотой. Сгущение давало 4,9 г (40%) продукта, точка плавления 49 - 50oC.
Аналогичным образом можно получать:
25. 1-(бис-4-фтор-фенил)-4-[экзо-6-фенил-3- азабицикло]3.2.0]гептан-3-ил]-бутан, точка плавления 54 - 55oC, как гидрохлорид.
Пример 26
1-(4-фтор-фенил)-4-[экзо-6-фенил-3-азабицикло[3.2.0] гептан- 3-ил] бутан-1-ол
4,6 г (13,6 ммол) 1-(4-фтор-фенил)-4-[экзо-6-фенил-3- азабицикло[3.2.0] гептан-3-ил] -бутан-1-она в 60 мл метанола смешивали частями с 0,6 г |(16 ммол) бораната натрия. Дополнительно перемешивали еще 2 раза при комнатной температуре и сгущали на ротационном выпарном аппарате. Остаток в колбе распределяли между хлористым метиленом и водой при pH 10, экстрагировали водную фазу еще два раза хлористым метиленом, дополнительно промывали соединенные органические фазы водой и сгущали органическую фазу после сушки с сульфатом натрия. Сырой продукт (4,6 г) очищали хроматографией на колонке (силикагель, растворитель -хлористый метилен/метанол 96/4). Свободное основание поглощали в 150 мл простого эфира, отфильтровывали нерастворимые хлопья и смешивали раствор простого эфира с избыточной эфирной соляной кислотой. Затем отсасывали твердые вещества в холодном состоянии и промывали гидрохлорид большим количеством простого эфира. Выделяли 3,1 г (61%) продукта, точка плавления 147-149oC.
Аналогичным образом можно получать:
27. 1-(4-фтор-фенил)-4-[экзо-6-p-фтор-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-ол, точка плавления 128-129oC (гидрохлорид),
28. 1-(4-фтор-фенил)-4-[экзо-6,7-дифенил-3- азабицикло[3.2.0]гептан-ил] -бутан-1-ол, точка плавления 228-331oC (гидрохлорид),
29. 1-фенил-4-[экзо-6-фенил-3-азабицикло[3.2.0]гептан-3-ил]- бутан-1-ол, точка плавления 128-129oC (гидрохлорид),
30. 1-фенил-4-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан- 3-ил-бутан-1-ол,
31. 1-(4-фтор-фенил)-4-[экзо-6-o-фтор-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-ол, точка плавления 167-168oC (гидрохлорид),
32. 1-(4-фтор-фенил-4-[экзо-6-m-хлор-фенил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-ол, точка плавления 143-145oC (гидрохлорид),
33. 1-(4-фтор-фенил)-4-[экзо-6-p-трифторметил-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-ол, точка плавления 145-148oC (гидрохлорид).
Пример 34
1-(4-фтор-фенил)-4-[экзо-6-p-амино-фенил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-он
6,6 г (17,2 ммол) 1-(4-фтор-фенил)-4-[экзо-6-p-нитро-фенил-3- азабицикло[3.2.0] гептан-3-ил]-бутан-1-она растворяли в 200 мл ледяной уксусной кислоты, с 1,7 г палладия на угле (10%) смешивали и гидрировали 4 часа при комнатной температуре и при нормальном давлении. После отсасывания катализатора сгущали маточный раствор, распределяли остаток между хлористым метиленом и водой, устанавливали при перемешивании при помощи концентрированного раствора аммиака щелочную реакцию и экстрагировали два раза хлористым метиленом. После сушки и сгущения органической фазы получают 5,0 г сырого продукта, который очищали хроматографией на колонке (силикагель, растворитель метилен/метанол 95/5). Выделяли 2,2 г (36%) 1-(4-фтор-фенил)-4-[экзо-6-p-амино-фенил-3-азабицикло[3.2.0] гептан- 3-ил] -бутан-1-она (точка плавления гидрохлорида 136-139oC) и 1,4 г (23%) 1-(4-фтор-фенил)-4-[экзо-6-p-аминофенил-3- азабицикло[3.2.0]гептан-3-ил]-бутан-1-ола (точка плавления гидрохлорида 122-125oC).
Пример 35
N-(3-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил]-пропил)- 4-фтор-бензамид
3,5 (20 ммол) экзо-6-фенил-3-азабицикло[3.2.0]гептана в 40 мл толуола смешивали с N-(3-хлорпропил)-4-фтор-бензамидом и с 4,8 г (35 ммол) тонко измельченного в порошок карбоната калия вместе с 0,5 г йодида калия и при хорошем перемешивании кипятили 9 часов при флегме. После охлаждения сгущали на ротационном выпарном аппарате и распределяли остаток между хлористым метиленом и водой. Водную фазу дополнительно экстрагировали два раза хлористым метиленом и затем сгущали органическую фазу после сушки с сульфатом натрия. Сырой продукт (8,4 г) очищали хроматографией на колонке (силикагель, растворитель -хлористый метилен/метанол 96/4). Растворяли очищенное свободное основание в смеси из 100 мл простого эфира и 10 мл ацетона и медленно закапывали при охлаждении льдом и перемешивании раствор 1,6 г малеиновый кислоты в ацетоне. Осажденную соль отсасывали в атмосфере азота, промывали простым эфиром и сушили в атмосфере азота. Выделяли 4,9 г (70%) гигроскопичного продукта как малеинат-соль, точка плавления 122-124oC.
Аналогичным образом можно получать:
36. N-(3-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил] -пропил)-бензамид, точка плавления 70-72oC (гидрохлорид),
37. N-(2-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил -этил)-4-фтор-бензамид,
38. N-(2-[экзо-6-фенил-3-азабицикло[3.2.0]гептан-3-ил] -этил)-бензамид, точка плавления 89-90oC,
39. N-(2-[экзо-6-фенил-3-азабицикло[3.2.0]гептан-3-ил]-этил) -N-метил-4-фторбензамид, точка плавления 126-128oC (гридрохлорид),
40. N-(2-[экзо-6-фенил-3-азабицикло[3.2.0. ] гептан-3-ил] -этил)-N-метил-бензамид, точка плавления 121-122oC (гидрохлорид),
41. N-(2-[экзо-6-фенил-3-азабицикло[3.2.0]гептам-3-ил] -этил)-N-метил-4-изопропилбензамид, точка плавления 184-185oC (гидрохлорид),
42. N-(3-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил] -пропил) -4-хлор-бензамид,
43. N-(2-[экзо-6-p-трифторметил-фенил-3-азабицикло[3.2.0] гептан- 3-ил] -этил)-4-хлор-бензамид, точка плавления 112-114oC,
44. N-(3-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил] -пропил) -3-метокси-бензамид,
45. N-(3-[экзо-6-фенил-3-азабицикло[3.2.0] гептан-3-ил]-пропил) -3-нитро-бензамид,
46. N-(3-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -пропил)-4-фтор-бензамид, точка плавления 160-162oC (гидрохлорид),
47. N-(3-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -пропил)-бензамид, точка плавления 177-178oC (гидрохлорид),
48. N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-4-фтор-бензамид, точка плавления 111-113oC,
49. N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-бензамид, точка плавления 94-95oC,
50. N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-N-метил-4-фтор-бензамид, точка плавления 170-171oC (гидрохлорид),
51. N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-N-метил-бензамид, точка плавления 167-169oC (гидрохлорид),
52. N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-N-метил-4-изопропилбензамид, точка плавления 189-190oC (гидрохлорид),
53. N-(3-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -пропил)-4-хлор-бензамид,
54. N-(3-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0]гептан-3-ил] -пропил-3-метокси-бензамид, точка плавления 130-132oC (гидрохлорид),
55. N-(3-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -пропил)-3-нитро-бензамид.
56. N-(2-[экзо-6-m-хлор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-4-хлор-бензамид, точка плавления 96-98oC,
57. N-(2-[экзо-6-o-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-4-хлор-бензамид, точка плавления 91-93oC,
58. N-(2-[экзо-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-2-гидрокси-бензамид, точка плавления 93-95oC (см. также пример 59).
Пример 59
N-(2-[экзо-6-m-гидрокси-фенил-3-азабицикло[3.2.0] гептан-3-ил] -этил)-4-хлор-бензамид
В 4,2 г (11 ммол) N-(2-[экзо-6-m-метокси-фенил-3- азабицикло[3.2.0] гептан-3-ил] -этил)-4-хлор-бензамида в 70 мл хлористого метилена закапывали 13 мл (13 ммол) трехбромистого бора (1 мол. раствор в хлористом метилене) при комнатной температуре, и смесь перемешивали в течение ночи. После охлаждения добавляли 100 мл 2н. раствора гидроокиси аммония, отделяли органическую фазу и экстрагировали водную фазу хлористым метиленом. После сушки и сгущения получают 4,5 г сырого продукта, который очищали хроматографией на колонке (силикагель, растворитель -хлористый метилен/метанол 95/5. Выделяли 2,8 г (69%) продукта, точка плавления 65-68oC.
Пример 60
экзо-3-n-бутил-6-фенил-3-азабицикло[3.2.0]гептан малеинат
3,5 г (20 ммол) экзо-6-фенил-3-азабицикло[3.2.0]гептана в 50 мл тетрагидрофурана смешивали с 4,2 мл (30 ммол) триэтиламина и с 5,4 г (40 ммол) бромистого n-бутила и при хорошем перемешивании кипятили 9 часов при флегме.
После охлаждения сгущали на ротационном выпарном аппарате и распределяли остаток между хлористым метиленом и водой.
Водную фазу экстрагировали два раза хлористым метиленом и затем органическую фазу сгущали после сушки над сульфатом натрия. Сырой продукт (4,2 г) очищали хроматографией на колонке (силикагель, растворитель - хлористый метилен/метанол 96/4). Очищенное свободное основание (3,1 г) растворяли в 200 мл простого эфира и медленно закапывали при охлаждении льдом и перемешивании стехиометрическое количество малеиновой кислоты в ацетоне. Осажденную соль отсасывали в атмосфере азота, промывали простым эфиром и сушили в атмосфере азота. Выделяли 4,4 г (64%) соли малеината, точка плавления 125-126oC.
Аналогичным образом можно получать:
61. экзо-3-метил-6-фенил-3-азабицикло[3.2.0] гептан, точка плавления 129-131oC (малеинат),
62. экзо-3-метил-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан, точка плавления 129-131oC (малеат),
63. экзо-3-n-пропил-6-p-фтор-фенил-3-азабицикло[3.2.0] гептан, точка плавления 124-126oC (малеат),
64. экзо-3-метил-6,7-дифенил-3-азабицикло[3.2.0]гептан, точка плавления 197-198oC (гидрохлорид),
65. экзо-3-n-пропил-6-m-гидрокси-фенил-3-азабицикло[3.2.0] гептан (см. также пример 59), точка плавления 148-150oC (гидрохлорид),
66. экзо-3-аллил-6-m-метокси-фенил-3-азабицикло[3.2.0] гептан, точка плавления 118-120oC (гидрхлорид),
67. экзо-3-(3,4-диметокси)-фенэтил-6-фенил-3- азабицикло[3.2.0]гептан, точка плавления 207-209oC (гидрохлорид),
68. экзо-3-(3,4-диметокси)-фенэтил-6-p-фтор-фенил-3- азабицикло[3.2.0] -гептан, точка плавления 192-193oC (гидрохлорид),
69. экзо-3-(3,4-дигидрокси)-фенэтил-3-азабицикло[3.2.0]гептан (аналогично примеру 59), точка плавления 202-205oC,
70. экзо-3-фенэтил-6-p-фтор-фенил-3-азабицикло[3.2.0]гептан, точка плавления 128-129oC (малеинат).
Были осуществлены следующие тесты:
1. Седативное действие.
Вещества вводились орально 4-8 группам NMRI-мышей женского пола, причем каждая группа включала по 3 мыши.
Ориентационная гипермобильность, вызванная новым окружением, измерялась фотоэлектрически через 30 минут после введения веществ в течение 30 минут. Определялась величина ED50 (мг/кг), то есть доза, которая дает 50%-ное снижение ориентационной гипермобильности по сравнению с контрольными животными, которым вводилось плацебо.
2. Антагонистическое действие по отношению к апоморфину (антидопаминергическое действие).
У мышей, содержащихся в обычных условиях (например, в клетке из проволочной сетки), подкожное введение апоморфина (1,21 мг/кг) вызывало усиление карабканья. Животных наблюдали в течение 30 минут после введения апоморфина и количество карабканий подсчитывали каждые 2 минуты. Через 60 минут после введения перорально вводили испытуемые вещества. Вычисляли ED50% как дозу (мг/кг), которая уменьшает подсчитанное количество на 50% по сравнению с контрольной группой.
3. L-5-HTP-антагонизм
(антагонизм в отношении серотонина).
Внутрибрюшинное введение L-5-гидрокситриптамина (L-5-HTP), пролекарства серотонина, крысам (316 мг/кг) приводит к выраженной ажитации, проявляющейся в потряхивании головой, тремору и движении передних лап. За животными наблюдали в течение 1 часа после введения L-5-HTP и появившиеся симптомы суммировались каждые 10 минут с целью подсчета. За 1 час до введения L-5-HTP животным перорально вводились испытуемые соединения. Определялась ED50% как доза (мг/кг), которая приводит в среднем к 50%-ному снижению перечисленных симптомов (по подсчетам) по сравнению с контрольной группой.
4. Изучение связывания рецептора.
Изучение связывания осуществлялось с использованием трансфектированных Cos 7 клеток, экспрессированных клонированным человеческим D4 рецепторам. Лизисные клетки были ресуспендированы в инкубационный буфер (50 mM Tris-HCl, pH 7,4), содержащий 5 mM EDTA, 1,5 mM CaCl2, 5 mM KCl, 120 nM NaCl и 5 mM MgCl2, при концентрации 105 клеток в пробе. Инкубирование проводилось при 25oC с 50 pM [125I] в присутствии или отсутствии испытуемых соединений.
Неспецифическое связывание определялось с помощью 10-6 M галоперидола. Через 60 минут инкубирования связанная и свободная радиоактивность разделялись быстрой фильтрацией через GF/B фильтр из стеклянного волокна (Whatman, Англия) с использованием скатроновского клеточного собирателя (Skatron, Lier, Norway). Фильтры промывались холодным Tris-HCl-буфером, pH 7,0, содержащим 20 mM Tris, 20 mM MgCl2 и 7% полиэтиленгликоля 6000. Связанную радиоактивность определяли при помощи жидкого сцинцилляционного счетчика Паккарда 2200 СА.
Величина Ki (nmol/l) определялась анализом нелинейной регрессии с использованием программы LIGAND.
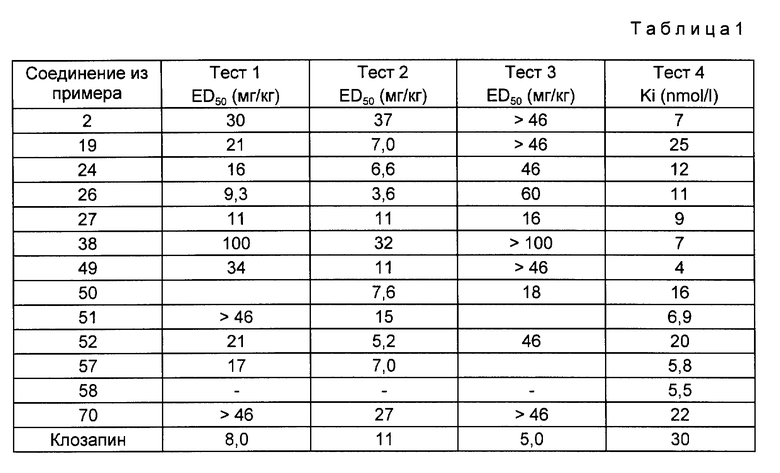
Прилагаемая таблица демонстрирует полученные результаты.
Приведенные результаты показывают дозозависимый эффект, а эффект в каждом из отдельных тестов может варьироваться. Что касается желаемого эффекта (апоморфиновый антагонизм), то новые соединения проявили себя в большинстве случаев не хуже, а даже в значительной степени лучше, чем известный препарат клозапин. Ингибирующие двигательную активность свойства (характерные для нежелательного седативного действия) в общем много менее выражены, чем у клозапина.
Это обусловлено тем, что новые соединения являются более мощными как антагонисты допамин D4-рецептора (см. тест 4). Это свойство является исключительно важным, поскольку сродство к допаминам D4-рецепторам благоприятно влияет на антипсихотическое действие с точки зрения его ответственности за низкое проявление экстрапирамидных побочных эффектов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ N-ЗАМЕЩЕННОГО 3-АЗАБИЦИКЛО[3.2.0]ГЕПТАНА | 1994 |
|
RU2136678C1 |
| ПРОИЗВОДНЫЕ N-ЗАМЕЩЕННЫХ 3-АЗАБИЦИКЛО(3.2.0) ГЕПТАНОВ | 1995 |
|
RU2160254C2 |
| ПРОИЗВОДНЫЕ N-ЗАМЕЩЕННЫХ 3-АЗАБИЦИКЛО [3.2.0]ГЕПТАНОВ И ИХ СОЛИ С ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫМИ КИСЛОТАМИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2163604C2 |
| ИНГИБИТОР ДИПЕПТИДИЛПЕПТИДАЗЫ-4 ДЛЯ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА 2-ГО ТИПА, СОЕДИНЕНИЯ (ВАРИАНТЫ) | 2018 |
|
RU2712097C1 |
| ПРОИЗВОДНЫЕ ХИНОЛОН- И НАФТИРИДОНКАРБОНОВОЙ КИСЛОТЫ, СМЕСЬ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ В ВИДЕ ГИДРАТА ИЛИ СОЛИ С АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ, ПРОИЗВОДНЫЕ ИЗОИНДОЛА В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ ДЛЯ ПОЛУЧЕНИЯ УКАЗАННЫХ ПРОИЗВОДНЫХ ХИНОЛОН- И НАФТИРИДОНКАРБОНОВОЙ КИСЛОТЫ | 1995 |
|
RU2145604C1 |
| ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ | 1996 |
|
RU2175315C2 |
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
| НОВЫЕ БЕНЗАМИДОАЛЬДЕГИДЫ | 1997 |
|
RU2189973C2 |
| Способ получения производных 4-бензил-1(2Н)-фталазинона или их физиологически переносимых кислотно-аддитивных солей | 1986 |
|
SU1454251A3 |
| ПРОИЗВОДНЫЕ ПИРИДОБЕНЗОКСАДИАЗИНА, СМЕСЬ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ, ИХ ГИДРАТЫ И СОЛИ | 1994 |
|
RU2131430C1 |
Производные 3-азабицикло(3.2.0)-гептана формулы I и, где R1-фенил, при необходимости замещенный одним или двумя атомами галогена, трифторметилом, гидроксилом, алкокси-, амино-, циано- или нитрогруппой, или тиенил; R2 - H или фенил; n - целое число от 1 до 4; A - водород или группа -C(R3)(R4)-C6H4(R5), - NR6-CO-C6Y4(R5) или -CH-CH2, R3 - H, OH или фенил, при необходимости замещенный атомом фтора, хлора или брома; R4 - H; или R3 и R4 вместе представляют атом кислорода; R5 - H, хлор, фтор или бром, гидрокси, алкил или метокси; R6 - H или метил и их соли обладают нейролептическим действием. 1 з.п. ф-лы, 1 табл. 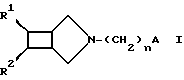 р
р
где R1 означает фенил, при необходимости одно- или двузамещенный атомами галогена, трифторметилом, гидроксилом, (C1-C4)-алкоксигруппой, аминогруппой, цианогруппой или нитрогруппой, или тиенил;
R2 означает атом водорода или фенил;
n - целое число от 1 до 4;
A означает атом водорода или группу

где R3 означает атом водорода, гидроксил или фенил, при необходимости замещенный атомом фтора, хлора или брома;
R4 - атом водорода;
или R3 и R4 представляют вместе атом кислорода;
R5 - атом водорода, атом фтора, хлора или брома, гидроксигруппу, (C1-C4)-алкилгруппу или метоксигруппу;
R6 - атом водорода или метил;
и их соли с физиологически переносимыми кислотами.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| EP, 400661, 12.05.90 | |||
| US, 4286095, 21.08.81 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1987, ч.1, с.37-68. | |||
Авторы
Даты
1998-10-20—Публикация
1993-12-09—Подача