Изобретение относится к биотехнологии, а именно к генетической инженерии животных, и может быть использовано в ветеринарной вирусологии для выявления инфекционных заболеваний сельскохозяйственных животных, в частности, классической чумы свиней (КЧС).
До настоящего времени основным способом диагностики классической чумы свиней является длительная процедура, основанная на иммунофлуоресцентном методе выявления возбудителя болезни. Известен способ иммунофлуоресцентной диагностики классической чумы свиней, включающий выделение вируса в перевиваемой культуре клеток почки поросенка РК-15, инокулированной испытуемыми материалами от павших или вынужденно убитых больных свиней, и идентификация его прямой иммунофлуоресценцией, затем выявление и титрование специфических антител к вирусу классической чумы свиней непрямой иммунофлуоресценцией в сыворотках крови переболевших свиней и, на последнем этапе, выявление и титрование вируснейтрализующих антител классической чумы свиней методом нейтрализации флуоресцирующих микробляшек (Методические указания по иммунофлуоресцентной диагностике классической чумы свиней //Покров: МСХ СССР. - 1984. - 14 с.).
К недостаткам данного способа можно отнести то, что он не позволяет различать вирус классической чумы свиней от вируса вирусной диареи крупного рогатого скота (ВД КРС).
Наиболее близким решением, принятым за прототип, является известный способ выявления вируса классической чумы свиней, основанный на полимеразной цепной реакции (ПЦР), включающий выделение РНК из КЧС-инфицированных тканей, обратно-транскрибирование РНК обратной транскриптазой AMV, амплифицирование полученной комплементарной ДНК с помощью Taq-полимеразы ДНК в присутствии двух КЧС-специфических праймеров, обнаружение амплифицированного фрагмента ДНК с помощью электрофореза в агарозном геле и, для повышения чувствительности, повторное амплифицирование ДНК набором гнездовых праймеров (Rapid detection of hog cholera virus in tissues by the polymerase chain reaction. S. - T.Liu, S.-N.Li, D.-C.Wang et al./Journal of Virological Methods, 1991, v. 35.-p. 227-236.).
К недостаткам данного способа можно отнести то, что он не позволяет обнаруживать значительную часть штаммов вируса классической чумы свиней, циркулирующих среди животных, так как олигонуклеотидные праймеры синтезируются по нуклеотидной последовательности одного штамма, что вызывает недостаточную специфичность при выявлении других штаммов вируса чумы свиней. Дифференциация вируса классической чумы свиней от вируса вирусной диареи крупного рогатого скота для этого способа не проводилась.
Технической задачей изобретения является повышение специфичности и возможности дифференцировать вирус КЧС от близкородственного вируса ВД КРС при сохранении чувствительности и быстроты проведения анализов.
Сущность изобретения заключается в том, что на первом этапе выбираются и синтезируются олигонуклеотидные праймеры, комплементарные консервативной области наибольшего сходства геномов различных штаммов вируса классической чумы свиней, которая имеет наибольшие отличия от нуклеотидных последовательностей РНК штаммов вируса вирусной диареи крупного рогатого скота. Затем синтезируется комплементарная ДНК на матрице вирусной РНК в реакции обратной транскрипции и проводится амплификация синтезированной комплементарной ДНК методом полимеразной цепной реакции с использованием вышеупомятуных праймеров.
Способ осуществляется следующим образом.
Выбираются и синтезируются олигонуклеотидные праймеры, например: N 1 - 5' - CTG GCC TGG GTG ACT ACG-3' и N 2-5'-ATA ACT CAA TGG AAC CTG-3'. Праймеры выбираются в консервативной области геномов различных штаммов вируса классической чумы свиней так, чтобы они имели 100% сходство между соответствующими участками вирусной РНК штаммов классической чумы свиней и различия с нуклеотидными последовательностями вирусной РНК ВД КРС. Первый праймер используют для синтеза первой цепи ДНК, комплементарной вирусной РНК классической чумы свиней, в реакции обратной транскрипции. Второй праймер - в ДНК-полимеразной реакции для синтеза второй цепи кДНК. Затем оба праймера используют для амплификации участка генома вируса в полимеразной цепной реакции.
Существенным отличием заявляемого способа от известного прототипа является то, что в качестве праймеров используются нуклеотидные последовательности, одинаковые для большинства штаммов вируса классической чумы свиней и отличающиеся от последовательностей РНК ВД КРС. Таким образом, заявляемый способ соответствует критерию "новизна". Новые признаки технического решения по совокупности признаков обеспечивают достижение цели изобретения: выявляется большее число штаммов вируса классической чумы свиней и их дифференциация от серологически родственного вируса ВД КРС. Следовательно, можно считать заявляемое техническое решение соответствующим критерию "изобретательный уровень".
Технической задачей изобретения является повышение специфичности и возможность дифференцировать два вида вирусов без снижения чувствительности способа выявления вируса классической чумы свиней.
Поставленная цель достигается выбором и синтезом олигонуклеотидных праймеров: N 1 - 5' - CTG GCC TGG GTG ACT ACG-3' и N 2 -5'-ATA ACT CAA TGG AAC CTG-3'. Праймеры были выбраны в консервативной области геномов различных штаммов вируса классической чумы свиней так, что имели 100% сходство между собой и соответствующими участками вирусной РНК классической чумы свиней и различия с неуклеотидными последовательностями вирусной РНК ВД КРС. Первый праймер использовали для синтеза первой цепи ДНК, комплементарной вирусной РНК КЧС, в реакции обратной транскрипции. Второй праймер - в ДНК-полимеразной реакции для синтеза второй цепи кДНК. Затем оба праймера использовали для амплификации участка генома вируса в полимеразной цепной реакции, проведя 30 циклов при следующем режиме: денатурация при 95oC в течение 1 мин, гибридизация - при 56oC в течение 1 мин и синтез - при 73oC в течение 2 мин. О положительном результате анализа судили по размеру синтезированного фрагмента кДНК, мигрирующего в 1% геле агарозы.
Существенным отличием заявляемого способа от известного прототипа является то, что в качестве праймеров используются нуклеотидные последовательности, одинаковые для большинства штаммов вируса КЧС и имеющих наибольшие отличия от последовательностей РНК ВД КРС.
Сущность технического решения раскрыта в примерах конкретного осуществления способа.
Пример. Операция 1. Выделение РНК вируса КЧС из патологического материала. Образец патологического материала (1 г) растирают в ступке со стеклянным порошком и добавляют 6 мл 4 М гуанидинтиоционата. Смесь пипетируют до образования однородной суспензии. После этого к суспензии добавляют 0,48 мл 3 М ацетата натрия pH 5,0 и 4,8 мл смеси фенол: хлороформ: изоамиловый спирт (25: 25:1). Содержимое встряхивают 30 сек и выдерживают на льду в течение 15 мин. Затем образец центрифугируют на центрифуге Beckman J2-21 в роторе JA-20 при 9500 об/мин в течение 20 минут при 2oC. Водную фазу собирают и к полученному объему добавляют равный объем охлажденного изопропанола, перемешивают и ставят на 30 мин при -45oC. Затем пробу центрифугируют 10 мин при 12000 об/мин в том же роторе. Осадок растворяют в 500 мкл 4 М гуанидинтиоционата и, добавив 50 мкл 3 М натрия ацетата pH 5,0 и 2,5 мл этилового спирта, выдерживают 30 мин при -45oC. После этого образец центрифугируют на центрифуге Eppendorf 5415 C при 14000 об/мин в течение 6 мин при комнатной температуре. Осадок растворяют в 100 мкл воды, добавив 10 мкл 3 М натрия ацетата pH 5,0 и 280 мкл этилового спирта, перемешивают и выдерживают 30 мин при -45oC. Далее центрифугирование проводят на центрифуге Eppendorf 5415 C при 14000 об/мин в течение 6 мин при комнатной температуре. Осадок промывают холодным этиловым спиртом и, высушив при 42oC, растворяют в 20 мкл воды.
Операция 2. Выделение вирусной РНК из культуры клеток РК-15, зараженных вакцинным штаммом вируса КЧС ЛК-ВНИИВВиМ. 400 мл суспензии клеток центрифугируют на центрифуге Beckman J2-21 в роторе JA-20 при 9500 об/мин в течение 20 минут при 2oC. Далее к осадку клеток добавляют 6 мл 4 М гуанидинтиоционата и проводят последующие операции как описано выше в операции 1.
Операция 3. Выделение РНК вируса ВД КРС из патологического материала от свиней, имевших антитела в сыворотке крови к вирусу ВД КРС в титрах 1:16-1: 32. Выделение проводят как описано в операции 1.
Операция 4. Выделение РНК вируса ВД КРС из культуры клеток MDBK, зараженных вакцинным штаммом вируса ВК-1. Выделение проводят как описано в операции 2.
Операция 5. Синтез комплементарной ДНК на матрице вирусной РНК КЧС. Выделенную вирусную РНК добавляют к 50 мкл реакционной смеси, содержащей 10 мМ Трис-HCl, pH 8,3; 10 мМ MgCl2; мМ KCl; 20 mM β-меркаптоэтанола; 100 мкг/мл праймера N1; мМdATF, dTTF, dCTF, dGTF, 800 ед/мл обратной транскриптазы. Реакцию проводят в течение 1 часа и 30 минут при 42oC. После этого содержимое пробирки прогревают в течение 3 мин при 95oC.
Операция 6. Синтез комплементарной ДНК на матрице вирусной РНК ВД КРС. Обратную транскрипцию проводят как описано в операции N5.
Операция 7. Полимеразная цепная реакция, 5 мкл раствора, содержащего кДНК вируса КЧС, добавляют к 45 мкл раствора, содержащего 67 мМ трис-HCl, pH 8,8; 1,5 мМ MgCl2, 0,01% TWeen-20; 0,2 мМ каждого из четырех дезокситрифосфатов, 2 единицы Tag-полимеразы и по 200 нг праймеров N1 и N2. Поверх реакционной смеси наслаивают 30 мкл вазелинового масла. ПЦР состоит из 30 циклов: 95oC в течение 1 мин, 56oC в течение 1 мин, 73oC в течение 2 мин. В конце реакции проводят завершающий синтез при 73oC в течение 3 мин.
После завершения ПЦР отбирают водную фазу и смешивают ее с равным объемом раствора, содержащего фенол : хлороформ : изоамиловый спирт (25:25:1). После центрифугирования в центрифуге Eppendorf при 14000 об/мин в течение 30 сек водную фазу отбирают и осаждают ДНК этиловым спиртом с ацетатом натрия. Осадок растворяют в 20 мкл воды.
Операция 8. Полимеразную цепную реакцию с кДНК ВД КРС проводят в тех же условиях, что и с кДНК КЧС (операция N 7).
Операция 9. Определение размера продуктов ПЦР. 15 мкл раствора продукта полимеразной цепной реакции смешивают с 5 мкл раствора, содержащего 50%-ный глицерин, бромфеноловый синий, и наносят в "карман" 1%-ного агарозного геля. Маркер молекулярной массы состоит из продуктов расщепления ДНК плазмиды pUC18 рестрикционной эндонуклеазной Alu1. Анализ считают положительным, если продукт ПЦР соответствует ожидаемому размеру фрагмента в 379 нуклеотидные пары.
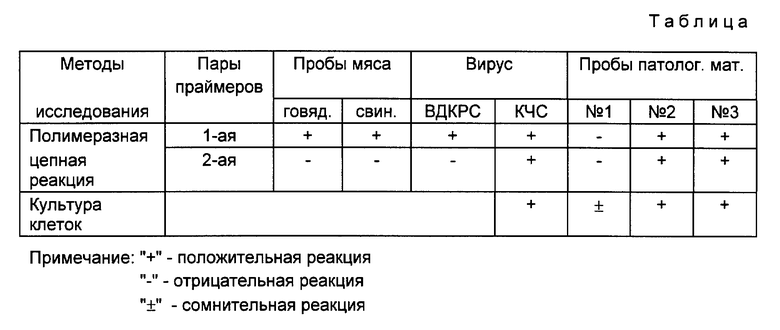
Результаты проведенных экспериментов показывают, что положительные анализы продуктов ПЦР получают только тогда, когда в качестве матрицы используют кДНК классической чумы свиней. Анализы были отрицательными, когда использовали кДНК вируса вирусной диареи крупного рогатого скота. Чувствительность предлагаемого способа выявления вируса КЧС достаточно высока и составляет 0,1 пг вирусной РНК, что соответствует 1000 вирусных частиц. Результаты испытаний различных пар праймеров в ПЦР приведены в таблице.
Способ предназначен для выявления классической чумы свиней. Способ включает синтез олигонуклеотидных праймеров 5' - CTG CTG GCC TG G GTG, ACT, ACG - 3' и 5' - ATA ACT CAA TGG AAC CTG - 3', синтез комплементарной РНК на матрице РНК. Затем осуществляют амплификацию синтезированной ДНК полимеразной цепной реакции и анализируют размер продуктов полимеразной цепной реакции. Предложенный способ обладает высокой специфичностью и позволяет дифференцировать вирус классической чумы свиней от близкородственного вируса диареи крупного рогатого скота. 1 табл.
Способ выявления вируса классической чумы свиней, включающий синтез олигонуклеотидных праймеров, синтез комплементарной ДНК на матрице РНК в реакции обратной транскрипции и амплификацию синтезированной комплементарной ДНК методом полимеразной цепной реакции с использованием олигонуклеотидных праймеров, анализ размера продуктов полимеразной цепной реакции, отличающийся тем, что синтезированные праймеры имеют нуклеотидные последовательности
5'-CTG GCC TGG GTG ACT ACG-3'
5'-ATA ACT CAA TGG AAC CTG-3'
| (Rapid detection of hog cholera virus in tissues by the polymerase chain reaction | |||
| S.-T.Liu, S.-N.Li, D.-C.Wang et al./Journal of Virological Methods, 1991, v | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| - p | |||
| Ротационный колун | 1919 |
|
SU227A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| Рекомбинантная плазмидная ДНК рЕК-7-ДНК-зонд для идентификации штаммов чумного микроба, несущих плазмиду пестициногенности, способ ее конструирования и штамм бактерий ЕSснеRIснIа coLI - продуцент ДНК-зонда для идентификации штаммов чумного микроба, несущих плазмиду пестициногенности | 1988 |
|
SU1615181A1 |
Авторы
Даты
1998-10-27—Публикация
1997-03-12—Подача