Изобретение касается способа получения 2-амино-4-(гидроксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент- [d] -оксазол-4,5,6-триола, имеющего ценные биологические активности и используемого для терапевтических и профилактических целей, а также штаммов актиномицетов, продуцирующих это соединение.
Способ по изобретению предназначен для получения соединений, формула которых представляется ниже (формула II). Эти соединения могут существовать в таутомерной форме, представленной формулой IIa
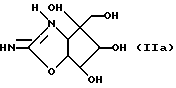
Соединения настоящего изобретения обладают способностью ингибировать активность различных гидролаз сахара, и, в особенности, β-глюкозидазы и β-фруктофуранозидазы (сахаразы инвертазы).
Сообщали, что соединения, обладающие сильной ингибирующей активностью против β- -глюкозидазы, такие как кастаноспермин и дезоксиноджиримицин, являются полезными в качестве противодиабетических средств и в качестве анти-СПИД-средств (Синдром Приобретенного Иммунного Дефицита)
[R.A. Gruters et al., Nature, 330, 74-77 (1987);
M.J. Humphries et al., Cancer Res., 46, 5215-5222 (1986)].
Поэтому предполагается, что соединения, обладающие способностью ингибировать активность β-глюкозидазы, будут полезными в качестве противодиабетических или анти-СПИДных средств.
Кроме того сообщали, что соединения, обладающие сильной ингибирующей активностью против β-фруктофуранозидазы, такие как AO-128 и Акарбоуз, являются полезными в качестве противодиабетических средств и в качестве средств против ожирения
[Satoshi Horii et al. Journal of Medicinal Chemistry, 29, 1038 - 1046 (1986);
T. Aida et al. Journal of Japanese Society of Food and Nutrition, 34, (2) 134-139 (1981)].
Поэтому предполагается, что соединения, обладающие способностью ингибировать активность β-фруктофуранозидазы, будут полезными для лечения и профилактики диабетов и ожирения.
Соединениями, имеющими определенное структурное сходство с соединениями настоящего изобретения, являются:
Манностатины, описанные, между прочим, Аойаги и другими Aoyagi et al. [The Journal of Antibiotics, Vol. XLII No. 6, 883 (1989)], которые, как сказано, обладают способностью ингибировать активность α-D-маннозидазы;
(1S, 2R, 3S, 4R, 5R)-метил-[2,3,4-триокси-5-(оксиметил)-циклопентил] амин, описанный, между прочим, Фарром и другими
R. A. Farr et al. [Tetrahedron Letters, 31, 7109 (1990), который, как сказано, также обладает способностью ингибировать активность α-маннозидазы;
аллосамидин, описанный, между прочим, Сакудой и другими S. Sakuda et al. [Tetrahedron Letters, 27, 2475 (1986)] 2475 (1986), который, как сказано, обладает способностью ингибировать активность хитиназы насекомых; и
кифуненсин, описанный, между прочим, H.Kayakiri et al. [J.Org. Chem., 54, 4015 (1989)], который, как сказано, является иммуномодулятором со способностью ингибировать активность α -маннозидазы.
Целью настоящего изобретения является способ получения новых соединений, обладающих ингибирующей активностью против определенных гидролаз сахара.
Дополнительной целью настоящего изобретения является предоставление соединений, обладающих такой активностью, которые поэтому, как предполагается, должны быть полезными при лечении и профилактике опухолей (неоплазм), СПИДа, ожирения и диабетов.
Другие цели и преимущества станут очевидными по мере описания изобретения.
Соединениями настоящего изобретения является 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол-4,5,6-триолы, общей формулы (II), представленной выше.
Изобретение дополнительно предлагает еще способ лечения или профилактики диабетов или ожирения у животных, например, млекопитающих, особенно людей, путем введения им эффективной дозы 2-амино-4-(оксиметил)-3a,5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол-4,5,6-триола.
2-Амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол-4,5,6-триол может быть получен ферментацией, используя микроорганизм рода Микромоноспора или Амиколатопсис.
Трехазолин, который может быть использован в качестве исходного вещества для получения соединений настоящего изобретения, может быть получен культивированием трехазолин-продуцирующего микроорганизма рода Микромоноспора или Амиколатопсис, предпочтительно трехазолин-продуцирующего микроорганизма рода Микромоноспора.
Примером трехазолин-продуцирующего микроорганизма рода Микромоноспора является Микромоноспора вида SANK62390. Этот микроорганизм сначала хранился в собственной коллекции Исследовательского Института ферментации, Агентство Промышленной Науки и Технологии, Цукуба-ши, Ибараки-кен, Япония, 26 июля 1990 года под номером FERM P-11631, а затем депонирован по условиям Будапештского Договора в Исследовательском Институте ферментации, Агентство Промышленной Науки и Технологии, 21 августа 1991 года под номером FERM BP-3521.
Примером трехазолин-продуцирующего микроорганизма рода Амиколатопсис является Амиколатопсис вида SANK 60791, который сдан на хранение по условиям Будапештского Договора в Исследовательский Институт ферментации, Агентство Промышленной Науки и Технологии, Цукуба-ши, Ибараки-кен, Япония, 14 августа 1991 года под номером FERM BP-3513.
Оба эти микроорганизма являются заново выделенными штаммами и оба составляют часть настоящего изобретения.
Характеристика микроорганизмов.
Микромоноспора вида SANK 62390.
Микромоноспора вида SANK 62390 имеет следующие микологические свойства:
1. Морфологические характеристики.
SANK 62390 вырастает нормально или несколько хуже во время культивирования при 28oC в течение периода времени от 7 до 14 суток на обычной агаровой культуральной среде, используемой для определения штамма. Субстрат (питательная среда) гифов (грибы) вытягивается надлежащим образом и разветвляется со светло-оранжевого, оранжевого в темно-коричневато-сероватый цвет, но без разрезов или резких поворотов, наблюдаемых у штаммов рода Нокардиа. Воздушные мицелии являются недоразвитыми и окрашиваются от белого в коричневато-белый цвет. Споры прослеживаются на самом субстрате гифов и образуются поодиночке на относительно коротком спорангиеносце. Форма спор является шарообразной, а поверхность спор является гладкой (однородной). Не наблюдаются особые организмы, такие как спорангии, склеротии, вирлы (WIRLS) или тому подобные.
2. Выращивание на различных средах.
Культивируется при 28oC в течение 14 суток на различных культуральных средах и проявляет свойства, представленные в таблице 1. Выражение "цветовые тона" представлено цветом, передаваемым номером в "Руководстве по цветовому стандарту" ("Guide to Color Standard"), изданному Исследовательским Институтом Красок в Японии.
В таблице используется следующие сокращения:
В: Выращивание; ВМ: воздушный мицелий; ОС: обратная сторона; РП: растворимый пигмент.
3. Физиологические свойства
Физиологические свойства SANK 62390, наблюдаемые в течение периода времени от 2-х суток до 21-х суток после начала культивирования при 28oC, представляются в таблице 2.
SANK 62390 культивируют также при 28oC, используя агар Придхема-Готлиба (ISP 9) в качестве культуральной среды. Усваивание источников углерода, наблюдаемое после культивации в течении 14 суток, представляется в таблице 3.
4. Компоненты клетки.
Оболочки клеток SANK 62390 анализируют по методу Беккера и других B. Becker et al. [Applied Microbiology, 12, 421 - 423 (1984)] и находят, что они включают мезо-диаминопимелиновую кислоту. Кроме того, компоненты сахара всех оболочек клеток SANK 62390 анализируют по методу Лешевалье M.P. Lechevalier [Journai of Laboratory & Clinical Medicine, 71, 934 (1968)] и находят, что они включают арабинозу и ксилозу, но не находят миколевую кислоту. Пептидный гликан ацильного типа в оболочке клеток, как было показано, является гликаном гликолильного типа. Основными выявленными компонентами менахинона были МК-10 (H6), МК-10 (H4) и МК-10 (H8).
Поэтому является очевидным то, что этот микроорганизм должен классифицироваться как новый вид, принадлежащий к роду Микромоноспора семейства Актиномицетов. Исходя из этого, он обозначается как Микромоноспора вида SANK 62390.
Амиколатопсис вида SANK 60791.
Амиколатопсис вида SANK 60791 имеет следующие микологические свойства:
1. Морфологические характеристики
SANK 60791 вырастает нормально или немного хуже во время культивации при 28oC в течение периода времени от 7 до 14 суток на обычной агаровой культуральной среде, используемой для выявления штамма. Субстрат гифов вытягивается (элонгирует) надлежащим образом и разветвляется однородно или нерегулярно с коричневато-белого, бледно-желтовато-коричневого в слабо-желтый цвет. На последних стадиях инкубации субстрат гифов и воздушные мицелии, разделенные по секциям, и воздушные мицелии, имеющие палочковидную структуру, временами наблюдаются. Гифы вытягиваются (элонгируют) без резких поворотов, наблюдаемых у штаммов рода Нокардиа. Не наблюдаются особые организмы, такие как спорангии, склеротии, вирлы или тому подобные.
2. Выращивание на различных средах
Культивируется при 28oC в течение 14 суток на различных культуральных средах и проявляет свойства, представленные в таблице 4. Выражение цветовые тона представляется цветом, передаваемым номером в "Руководстве по цветовому стандарту" ("Guide to Color Standard"), изданном Исследовательским Институтом Красок в Японии.
В таблице используются следующие сокращения:
В: Выращивание, ВМ: Воздушный мицелий, ОС: Обратная сторона, РП: Растворимый пигмент.
3. Физиологические свойства
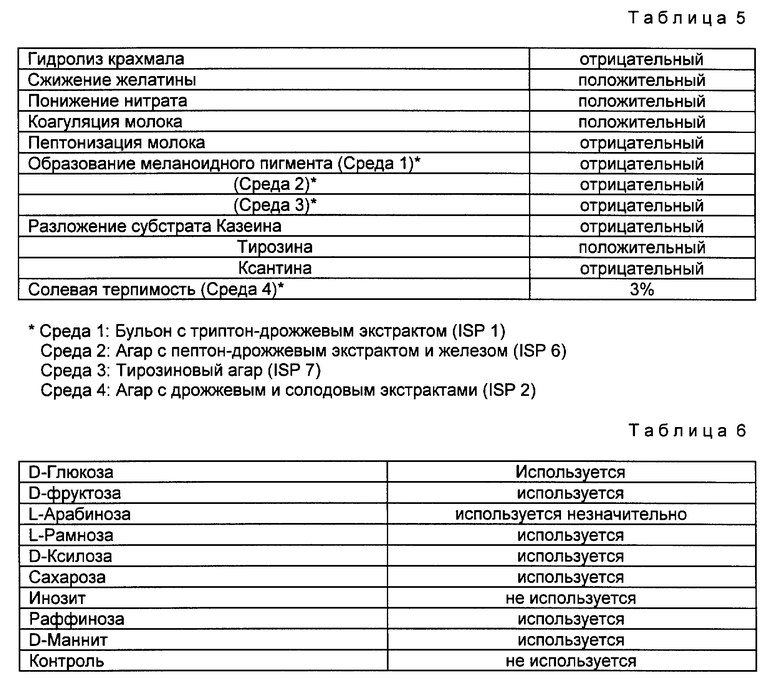
Физиологические свойства SANK 60791, наблюдаемые в течение периода времени от 2-х суток до 21-х суток после начала культивирования при 28oC, представляются в таблице 5.
SANK 60791 культивируют также при 28oC, используя агар Придхема-Готлиба (ISP 9) в качестве культуральной среды. Усваивание источников углерода, наблюдаемое после культивации в течение 14 суток, представляется в таблице 6.
4. Компоненты клетки.
Оболочки клеток SANK 60791 анализируют по методу Беккера и др. (Applied Microbiology, 12, 421 - 423 (1984)) и найдено, что они включают мезо-диаминопимелиновую кислоту. Кроме того, компоненты сахара всех оболочек клеток штамма SANK 60791 анализируют по методу Лешевалье (Journal of Laboratory and Clinical Medicine, 71, 934 (1968)) и найдено, что они включают арабинозу, но не найдена миколевая кислота. Пептидный гликан ацильного типа в оболочке клеток, как оказалось, является гликаном ацетильного типа. Основным выявленным компонентом менахинона был МК-9 (H4).
Поэтому разумно, что микроорганизм должен быть классифицирован как новый вид, принадлежащий к роду Амиколатопсис семейства Актиномицетов. Исходя из этого, он обозначается как Амиколатопсис вида SANK 60791.
Идентификацию SANK 62390 и SANK 60791 производят согласно стандартам ISP (Международный Стрептомицесс-Проект), Справочнику Бергея по систематической бактериологии, том 4 (Bergey's Manual of Systematic Bacteriology), Актиномицеты, том 2 (The Actinomycetes, vol 2) и другой последней литературе по Актиномицетам.
Установлено, что SANK 62390 и SANK 60791 продуцируют трехазолин и 2-амино-4-(оксиметил)-3а, 5,6,6а-тетрагидро-4H-циклопент[d] - оксазол-4,5,6-триол. Однако, как хорошо известно, свойства грибков вообще и актиномицетозных микроорганизмов в частности, могут изменяться значительно и такие грибки могут легко подвергаться мутации, оба посредством естественных факторов (причин) и в результате индукции искусственным способом (например, ультрафиолетовым облучением, радиоактивным излучением, химической обработкой и так далее). Таким образом, настоящее изобретение включает использование любого микроорганизма, который может быть классифицирован в пределах рода Микромоноспора или Амиколатопсис и который разделяет с SANK 62390 и SANK 60791 характерную способность продуцировать трехазолин и 2-амино-4-(оксиметил-3a,5,6,6a-тетрагидро- 4H-циклопент-[d]-оксазол-4,5,6-триол. Новые микроорганизмы SANK 62390 и SANK 60791, как предполагается, не являются исключительными, поскольку все мутанты SANK 62390 и SANK 60791 разделяют вместе с SANK 62390 и SANK 60791 их характерную способность продуцировать трехазолин и 2-амино-4-(оксиметил)-3a,5,6,6a-тетрагидро- 4H-циклопент-[d]-оксазол-4,5,6-триол. Кроме того, эти мутанты включают мутанты, полученные посредством способов генной инженерии, например, рекомбинации, трансдукции (преобразование), трансформации или тому подобными. Является вопросом несложного эксперимента определить, на основании представленного в описании сведения относительно свойств трехазолина и 2-амино-4-(оксиметил)-3a,5,6,6a- тетрагидро-4H-циклопент-[d] -оксазол-4,5,6-триола, продуцирует ли эти соединения какой-либо представленный штамм или продуцирует ли он эти соединения в достаточном количестве, чтобы придавать этому штамму повышенный коммерческий интерес.
Трехазолин и 2-амино-4-(оксиметил)-3a,5,6,6a-тетрагидро-4H- циклопент-[d]-оксазол-4,5,6-триол, согласно настоящему изобретению, могут быть получены выращиванием из этих штаммов грибка в культуральной среде такого типа, которая обычно используется для продуцирования других продуктов ферментации из подобных микроорганизмов. Такая среда обязательно содержит микробиологически усваиваемые источники углерода и азота, а также неорганические соли, которые хорошо известны специалистам в данной области техники.
Предпочтительные примеры источников углерода включают: глюкозу, фруктозу, мальтозу, сахарозу, маннит, глицерин, декстрин, овес, рожь, кукурузный крахмал, картофельный крахмал, кукурузную муку, соевую муку, жмых (фильтр-прессную лепешку) из семян хлопка, хлопковое масло, патоки (мелассы), лимонную кислоту, винную кислоту и тому подобные. Такие соединения могут быть использованы отдельно или в любом подходящем сочетании. Вообще используемое количество может варьироваться в пределах от 1 до 10 вес.% культуральной среды.
Предпочтительными источниками азота обычно являются вещества, содержащие белок, такие как обычно используемые в ферментативном процессе. Примеры таких источников азота включают: соевую муку, пшеничные отруби, арахисовую муку, жмых из семян хлопчатника, хлопковое масло, муку из семян хлопчатника, гидролизаты казеина, фармамин, рыбную муку, жидкость от замачивания кукурузы, пептон, мясной экстракт, дрожжи, дрожжевой экстракт, солодовый экстракт, нитрат натрия, нитрат аммония, сульфат аммония и тому подобные. Эти источники азота могут быть использованы отдельно или в любом подходящем сочетании. Вообще, мы предпочитаем применять их в концентрации между 0,2 и 6 вес.% культуральной среды.
Пищевые неорганические соли, которые могут быть введены в культуральную среду, являются обычными солями, которые способны предоставлять различные ионы, необходимые для выращивания микроорганизмов, такие как ионы натрия, аммония, кальция, фосфатные, сульфатные, хлоридные и карбонатные. Кроме того, среда должна содержать незначительные количества необходимых микроэлементов, таких как калия, кальция, кобальта, магния, железа и марганца.
Когда способ настоящего изобретения осуществляется методом использования культуры в жидкой среде, в культуральной среде предпочтительно используется противовспенивающее вещество, такое как силиконовое масло, растительное масло или поверхностно-активное вещество. pH культуральной среды для продуцирования трехазолина или 2-амино-4-(оксиметил)-3a,5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол- 4,5,6-триола путем выращивания микроорганизмов рода Микромоноспора или Амиколатопсис, в особенности SANK 62390 и SANK 60791, предпочтительно варьирует в пределах от 5,0 до 8,0, более предпочтительно от 6,5 до 7,5.
Выращивание может быть проведено при любой температуре в пределах от 15 до 38oС, хотя температура от 22 до 38oC является предпочтительной для хорошего выращивания, а температура от 22 до 28oC является предпочтительной для того, чтобы оптимизировать продуцирование трехазолина и 2-амино-4-(оксиметил)- 3a,5,6,6a-тетрагидро-4H-циклопент-[d]-оксазол-4,5,6-триола.
Эти соединения получаются при условиях аэробного культивирования и могут быть использованы обычные методы аэробного культивирования, такие как твердого культивирования, культивирования со встряхиванием, и методы культивирования с аэрацией и перемешиванием (погруженного культивирования). В случае маломасштабного культивирования культивирование со встряхиванием (покачиванием) в течение нескольких суток при 28oC является типичным методом. В таком маломасштабном методе культивирования культивирование может быть инициировано с 1 (одной) или 2-мя стадиями пролиферации (быстрого размножения), продуцирующими посевные культуры, например, в колбах Эрленмейера, снабженных отбойными перегородками (пластинами, отклоняющими поток), которые служат в качестве регулятора потока жидкости. Среда для стадий посевного культивирования предпочтительно содержит источники как углерода, так и азота. В предпочтительном ряде операций для такого маломасштабного культивирования колбы с посевной культурой встряхивают (покачивают) в инкубаторе с постоянной температурой при 28oC в течение 7 суток или до тех пор, пока не достигнется достаточное выращивание (культивирование). Выращенная посевная культура переносится затем во вторую посевную (питательную) среду или в продуцирующую среду. Когда используется фаза промежуточного выращивания, для выращивания используется в основном тот же самый метод и аликвотная часть получающегося промежуточного продукта инокулируется (засевается) в продуцирующую среду. Инокулированная (засеянная) колба может быть инкубирована в течение нескольких суток, встряхиваемая при этом, и, после завершения выращивания, содержимое колбы может быть подвергнуто центрифугированию или отфильтровано.
В случае крупномасштабного продуцирования предпочтительным является использование ферментеров, снабженных мешалкой и аппаратом для аэрации. В этом случае питательная среда может быть приготовлена внутри ферментера. Среда предпочтительно стерилизуется повышением температуры до 125oC; после охлаждения стерилизованная среда может быть инокулирована предварительно полученной посевной культурой. Культивирование протекает затем при перемешивании и аэрации, например, при 28oC. Этот метод является подходящим для получения соединений настоящего изобретения в большом количестве.
Течение культивирования и количество целевых трехазолина и 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент- [d] -оксазол-4,5,6-триола, продуцируемых по мере того, как протекает культивирование, могут быть определены измерением биологических активностей соединений или жидкостной хроматографией высокого разрешения или газовой хроматографией/масс-спектрометрией очищенного образца соединения из культурального бульона, как это описывается более подробно ниже. Трехазолин имеет ингибирующую активность против трегалазы тутового шелкопряда, и его продуцирование может быть проконтролировано путем прослеживания за активностью культурального бульона против трегалазы тутового шелкопряда, используя методики, такие как проиллюстрированные в следующем примере испытаний 3.
С другой стороны, продуцирование 2-амино-4-(оксиметил)-3a,5,6,6a- тетрагидро-4H-циклопент-[d]-оксазол-4,5,6-триола наилучшим образом контролируется жидкостной хроматографией высокого разрешения или газовой хроматографией/масс-спектрометрией. Это может быть проведено путем контактирования культурального бульона с подходящей адсорбирующей смолой (например смолой, продаваемой под торговой маркой Амберлит IRC-50 [NH
Обычно, количество трехазолина достигает максимума между 72 и 150 часами после инициирования ферментации (брожения), тогда как количество 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент- [d] -оксазол-4,5,6-триола достигает максимума между 96 и 168 часами после инициирования ферментаици. Однако точное время варьируется в зависимости от температуры и других условий ферментации, и точное оптимальное время для любого набора условий может быть легко определено, следуя по стадиям продуцирования целевого соединения, которые предложены выше.
При использовании штамма рода Микромоноспора обычно продуцируются как трехазолин, так и 2-амино-4-(оксиметил)-3a, 5,6,6a- тетрагидро-4H-циклопент-[d]-оксазол-4,5,6-триол, и они могут быть разделены обычным способом во время описанной ниже методики выделения. Штаммы рода Амиколатопсис обычно продуцируют только 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент-[d]-оксазол-4, 5,6-триол. Оба соединения выделяются в жидкую фазу, хотя они оба находятся также и в мицелии. Они наиболее легко выделяются из жидкой фазы.
После завершения культивирования целевые трехазолин и/или 2-амино-4-(оксиметил)-3a-5,6,6a-тетрагидро-4H-циклопент-[d]-оксазол-4, 5,6-триол, которые находятся в жидкой фазе культурального бульона, могут быть фракционированы отфильтровыванием мицелия и других твердых веществ, используя преимущественно диатомовую землю в качестве фильтра-помощника, или центрифугированием. Эти соединения, которые в таком случае находятся в фильтрате или в надосадочной жидкости, могут быть выделены путем экстракции, а затем могут быть очищены обычным способом, используя их физико-химические свойства.
Например, эти соединения могут быть выделены из фильтрата или надосадочной жидкости, пропуская его (ее) через колонку, содержащую адсорбент, такой как ионообменная смола, например, Амберлит IRC-50 или CG-50, или Дауэкс 50WX4 или SBR-P, с тем, чтобы или примеси удерживать на смоле и таким образом удалять их, или целевое соединение удерживать, а затем выделять элюированием, например, с помощью водного аммиака. Примеры других абсорбентов включают активированный древесный уголь или другие адсорбирующие смолы, такие как Амберлит ХАД-2 или ХАД-4 (продукция фирмы Рохм энд Хаас Ко.), или Дайайон НР-10, НР-20, СНР-20-, НР-50 (продукция Асахи Кемикэл Индастри Ко., Лтд. ). Раствор, содержащий трехазолин и/или 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент-[d]-оксазол-4, 5, 6-триол, пропускается через адсорбирующий слой, содержащий один из этих других адсорбентов, описанных выше, с тем, чтобы или примеси удерживались адсорбентом и таким образом удалялись, или целевое соединение удерживалось, а затем выделялось элюированием, например, с помощью водного метанола, водного ацетона или тому подобных.
Трехазолин или 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол-4, 5,6-триол, полученный таким образом, может быть очищен далее различными известными методами, например: абсорбционной колоночной хроматографией, используя носитель, такой как силикагель или флорисил; распределительной колоночной хроматографией, используя Авицел (продукция фирмы Асахи Кемикэл Индастри Со., Лтд.) или Сефадекс LH-20 (продукция фирмы Фармасиа Инк.,); или жидкостной хроматографией высокого разрешения, используя обычную обратимую (реверсивную) фазу или ионообменную колонку.
Получение соединений настоящего изобретения дополнительно поясняется следующими неограничивающими примерами.
Пример 1. Получение Трехазолина.
I (A) Культивирование.
Полную петлю Микромоноспоры вида SANK 62390 используют для засева каждой из трех колб Эрленмейера емкостью 500 мл, снабженных отбойными перегородками (пластинами, отклоняющими поток жидкости) и содержащих по 80 мл Среды I (имеющей указанный ниже состав). Инокулированные колбы инкубируют при 28oC в течение 216 часов на роторной трясучке, вращающейся со скоростью 220 об/мин, чтобы получить первую посевную культуру.
Среда I:
Глюкоза - 1%
Глицерин - 1%
Овсяная мука - 0.5%
Сахароза - 1%
Соевая мука - 2%
Кислоты касамино - 0,5%
Прессованные дрожжи - 1%
CaCO3 - 0,1%
CB442 - 0,01%
Вода (перед стерилизацией pH 7,0) - До 100%
Проценты являются весовыми, основанными на конечном объеме среды.
Каждая из четырех 2-литровых колб Эрленмейера, содержащих каждая по 800 мл Среды 2 (имеющей указанный ниже состав), инокулируется с 40 мл культурального бульона из первых колб и колбы встряхивают при 28oC в течение 96 часов на роторной трясучке со скоростью 220 об/мин, чтобы получить вторую посевную культуру. 1,5 л этого второго посевного культурального бульона используют, чтобы инокулировать каждую в двух 30-литровых вибрируемых ферментерах, содержащих в каждом из них 15 л Среды 2 (имеющей описанный ниже состав), которую сначала стерилизуют при 120oC в течение 35 минут и охлаждают до 28oC. Ферментеры перемешивают со скоростью 100 об/мин при 28oC в течение 96 часов с аэрацией при токе воздуха 15 л в минуту.
Среда 2:
Глюкоза - 2%
Растворимый крахмал - 1%
Прессованные дрожжи - 0,9%
Мясной экстракт (Киокуто) - 0,5%
Полипептон - 0,5%
NaCl - 0,5%
CaCO3 - 0,3%
CB442 - 0,01%
Вода (перед стерилизацией pH 7,2) - До 100%
Проценты являются весовыми в расчете на конечный объем среды.
(В) Выделение
3 кг Целита 545 (торговая марка для продукции фирмы Джонс Менвилл Продактс Корп.), в качестве помощника фильтрации, добавляют к 30 л всего бульона, полученного по описанному выше методу, и смесь фильтруют. Фильтрат (29 л) пропускают через колонку, содержащую 6 л Дауэкса SBR-P (Cl-1) (торговая марка для продукции фирмы Дау Кемикл). pH Элюата доводят затем до величины 5,0, после чего раствор пропускают через колонку, содержащую 6 л Дауэкса 50WX4 (H+) (торговая марка для продукции Дау Кемикл). Трехазолин адсорбирует и таким образом удерживается колонкой. Колонку промывают 20 л деионизированной воды, а затем элюируют 30 л 0,5 N водного аммиака, чтобы получить 13 л фракций с действующим (активным) соединением. Весь этот элюат (13 л) концентрируют выпариванием при пониженном давлении и лиофилизируют (высушивают при температуре ниже 0oC), чтобы получить 43,4 г неочищенного порошка, содержащего трехазолин. Неочищенный порошок растворяют в 2 л 10 мМ буферного раствора формиата аммония (pH 6,0) и раствор адсорбируют на колонке, содержащей 1,5 л Дауэкса 50WX4 (торговая марка), которую предварительно уравновешивают с помощью 20 мМ буферного раствора формиата аммония (pH 6,0). Колонку промывают 3 л того же буферного раствора формиата аммония (20 мМ), за которым следует промывание 2 л деионизированной воды, после чего колонку элюируют с помощью 0,2 N водного аммиака. Элюат фракционируют по частям объемом 500 мл. Фракции 2 - 4, которые содержат фактически весь трехазолин, объединяют и концентрируют выпариванием при пониженном давлении. Продукт реакции затем лиофилизируют, чтобы получить 2,55 г неочищенного порошка. Неочищенный порошок, полученный повторением стадий вплоть до этого момента, используют непосредственно, без какой-либо дополнительной очистки, в примере 3.
Этот неочищенный порошок абсорбируют на колонке, набитой 200 мл Авицела (торговая марка для продукции фирмы Асахи Кемикл Индастри Ко., Лтд.), используя 80 об.% водного ацетонитрила. Колонку промывают с 700 мл 80 об.% водного ацетонитрила, а затем элюируют сначала с 500 мл 75 об.% водного ацетонитрила, а затем с 700 мл 70 об.% водного ацетонитрила. Элюат фракционируют по частям объемом 19 мл. Фракции 35 - 50, содержащие трехазолин, объединяют и концентрируют выпариванием при пониженном давлении. Остаток затем лиофилизируют, чтобы получить 658 мг порошка. Весь этот порошок растворяют в 150 мл воды и pH полученного раствора доводят до величины 6,0. Затем раствор адсорбируют на колонке, набитой с 300 мл Амберлита CG-50 (H+: NH
Этот порошок очищают с помощью препаративной тонкослойной хроматографии следующим образом. Порошок (6,2 мг) растворяют в незначительном количестве воды и наносят на 3 пластины с силикагелью (Мерк Арт 5715, 20х20 см). Пластины проявляют с помощью смеси ацетонитрила, уксусной кислоты и воды 6:1:3 в объемном соотношении до высоты 15 см. Полосу между Rf 0,42 и 0,5 выскребывают из пластин и набивают в колонку. Колонку элюируют со 100 мл деионизированной воды. Элюат пропускают через колонку, содержащую 5 мл Дауэкса 50WX4 (H+), где адсорбируется и таким образом удерживается трехазолин. Колонку промывают с помощью деионизированной воды, а затем элюируют с 50 мл 0,5 N водного аммиака. Элюат концентрируют выпариванием при пониженном давлении и полученный остаток лиофилизируют, чтобы получить 5,1 мг трехазолина в виде бесцветного порошка, для которого жидкостная хроматография высокого разрешения показывает единственный пик.
Продукт реакции имеет следующие свойства:
1) основные свойства и вид: основной бесцветный порошок;
2) растворимость: растворим в воде и метаноле, нерастворим в ацетоне и хлороформе;
3) цветная реакция: положительная к серной кислоте;
4) молекулярная формула: C13H22N2O10;
5) молекулярная масса: 366 (определенная с помощью FAB-масс-спектрометрии - "FAB" означает Быстрая Бомбардировка Атомов ("ББА");
6) удельное вращение [α]
7) ультрафиолетовый спектр поглощения λмакс нм (E
8) инфракрасный спектр поглощения: νмакссм-1 (в KBr), 3367, 2938, 1663, 1552, 1384 и 1056;
9) спектр 1H-Ядерного магнитного резонанса: δм.д., спектр 1H-Ядерного магнитного резонанса (400 МГц) измеряют в окиси дейтерия (дейтерированной воде), используя ТМС (тетраметилсилан) в качестве внешнего стандарта, и показывает следующие сигналы:
3,22 (1H, дублет дублетов, J = 8,98 и 10,31 Гц);
3,38 (1H, мультиплет, J = 2,44, 5,26 и 10,31 Гц);
3,46 (1H, дублет дублетов, J = 8,98 и 9,99 Гц);
3,53 (1H, дублет, J = 11,96 Гц);
3,55 (1H, дублет дублетов, J = 5,26 и 12,21 Гц);
3,57 (1H, дублет дублетов, J = 5,38 и 9,99 Гц);
3,62 (1H, дублет дублетов, J = 2,44 и 12,21 Гц);
3,63 (1H, дублет, J = 11,96 Гц);
3,77 (1H, дублет, J = 4,89 Гц);
4,02 (1H, дублет дублетов, J = 2,08 и 4,89 Гц);
4,17 (1H, дублет, J = 8,55 Гц);
4,77 (1H, дублет дублетов, J = 2,08 и 8,55 Гц);
5,15 (1H, дублет, J = 5,38 Гц).
10) Спектр 13C-Ядерного магнитного резонанса: δм.д., . Спектр 13C-Ядерного магнитного резонанса (100 МГц) измеряют в окиси дейтерия, используя тетраметилсилан в качестве внешнего стандарта, и показывает следующие сигналы:
60,7, 61,9, 69,6, 69,9, 72,0, 73,0, 73,0, 80,1, 80,3, 80,6, 82,8, 87,3 и 161,1;
11) жидкостная хроматография высокого разрешения:
колонка для разделения: Сеншу Пак ОД⊘5-H-2151 (Сеншу Сайентифик Ко.), 6 x 150 мм (5 мк);
подвижная фаза: 10 об. % ацетонитрила-воды, содержащей 0,5% PIC B8 (продукция фирмы Уотерс Инк.);
скорость течения: 1,5 мл/мин;
контрольная длина волны: ультрафиолетовая 210 нм.
Пик, имеющий время удерживания 6,9 минут, наблюдают при температуре колонки 25oC; и
12) тонкослойная хроматография:
Rf величина: 0,44;
адсорбент: силикагель на стеклянной пластине (Мерк Арт 5715);
проявляющий растворитель: смесь ацетонитрила, уксусной кислоты и воды в объемном соотношении 6 : 1 : 3.
Пример 2. Получение 2-амино-4-(оксиметил)-3а,5,6,6а-тетрагидро- 4H-циклопент-[d]-оксазол-4,5,6-триола.
100 г неочищенного порошка, полученного по описанному в примере 1 методу и содержащего установленное количество (225 мг) трехазолина, растворяют в смеси 100 мл воды и 150 мл 4 N водной соляной кислоты и pH полученного раствора доводят до величины 2,5 добавлением 4 N водной соляной кислоты. Затем к раствору добавляют 8 мл концентрированной соляной кислоты и 72 мл воды, чтобы довести общий объем до 480 мл и чтобы получить концентрацию соляной кислоты, равную 0,2 N. Полученный раствор помещают в круглодонную колбу, а затем гидролизуют на масляной бане, поддерживаемой при 100oC в течение 6 часов. К концу этого времени реакционную смесь смешивают с водой, а затем концентрируют досуха выпариванием при пониженном давлении. Последовательность смешивания с водой и выпаривания досуха повторяют, чтобы отогнать соляную кислоту. Остаток растворяют в 400 мл воды и pH раствора доводят до величины pH 6,0 добавлением 1 N водного раствора гидроокиси натрия. Затем раствор разбавляют с водой до объема 8 л. Полученный раствор пропускают через колонку, набитую с 600 мл Амберлита CG-50 (NH
1) цвет и вид: основный бесцветный порошок;
2) растворимость: растворим в воде, нерастворим в ацетоне и хлороформе;
3) молекулярная формула: C7H12N2O5;
4) молекулярная масса: 204 (определенная с помощью FAB-масс-спектрометрии);
5) удельное вращение: [α]
6) ультрафиолетовый спектр поглощения: λмакс нм (E
7) инфракрасный спектр поглощения: νмакссм-1 (в KBr), 3358, 1668, 1528, 1398 и 1066;
8) Спектр 1H-Ядерного магнитного резонанса: δм.д., Спектр 1H-Ядерного магнитного резонанса (500 МГц) определяют в окиси дейтерия, используя ТСП (триметилсилилпропионат натрия) в качестве внутреннего стандарта, и показывает следующие сигналы:
3,73 (1H, дублет, J = 11,72 Гц);
3,82 (1H, дублет, J = 12,21 Гц);
3,97 (1H, дублет, J = 4,4 Гц);
4,23 (H, дублет дублетов, J = 4,4 и 2,44 Гц);
4,37 (1H, дублет, J = 8,79 Гц);
5,03 (1H, дублет дублетов, J = 8,79 и 2,44 Гц);
9) жидкостная хроматография высокого разрешения:
колонка для разделения: Асахи Пак E5-502C (Асахи Кемикл Индастри Ко., Лтд.);
подвижная фаза: 20 мМ ацетат аммония (pH 8,5) + 50 мМ водный хлористый натрий;
скорость течения: 1 мл/мин;
контрольная длина волны: ультрафиолетовая 210 нм,
температура: 25oC;
время удерживания: 8,39 минут.
Количественный анализ 2-амино-4-(оксиметил)-3а,5,6,6а- тетрагидро-4H-циклопент-[d] -оксазол-4,5,6-триола, используя газовую хроматографию/масс-спектрометрию.
Количественный анализ, на который ссылаются выше, проводят следующим образом.
Образец растворяют в растворителе (воде) известного объема жидкости. В ампулу помещают 10 мкл полученного раствора и выпаривают досуха для ацетилирования. К остатку добавляют 30 мкл уксусного ангидрида и 50 мкл пиридина и полученную смесь нагревают при 60oC в течение 40 минут. Любой избыток реагентов удаляют продуванием тока газообразного азота через реакционную смесь. Остаток смешивают с известным количеством внутреннего стандарта (пентаацетил-1-амино-1-дезокси -β-D-глюкозы), и смесь растворяют в 100 мкл этилацетата, чтобы получить опытный образец для газо-хроматографического/масс-спектрометрического анализа. Анализ проводят, используя капиллярную колонку с плавленым кремнеземом (продукция Джи энд Ви Сайентифик Ко., ДВ-5, 15 метров) в качестве колонки для газовой хроматографии. Опытный образец (2 мкл) инъецируют и температуру колонки повышают от 60oC до 280oC со скоростью 25oC/минуту. Отрицательные ионы определяют методом химической ионизации, используя газообразный метан вместе с квадрупольным масс-спектрометром Трио-1 (продукция фирмы УС). Пики отрицательных ионов при m/z 388 (соответствующий внутреннему стандарту - пентаацетильному соединению) и при m/z 413 (соответствующий пентаацетату 2-амино-4-(оксиметил)-3a,5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол- 4,5,6-триола) используют для количественного анализа. Содержание 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол- 4,5,6-триола вычисляют с помощью метода внутреннего стандарта.
Пример 3. Получение 2-амино-4-(оксиметил)-3a,5,6,6a-тетрагидро-4H-циклопент-[d]-оксазол- 4,5,6-триола
(A) Выращивание.
Петлю, взятую из скошенного агара Амиколатопсиса вида SANK 60791, используют для того, чтобы инокулировать каждую из двух колб Эрленмейера объемом 500 мл, каждая снабжена отбойными перегородками и каждая содержит 80 мл Среды 1 (имеющей представленный выше в примере 1 состав), и инокулированные колбы инкубируют при 28oC в течение 96 часов на роторной трясучке, вращающейся со скоростью 210 об/мин, чтобы получить посевной культуральный бульон.
Два 30-литровых вибрирующих (jar) ферментера, каждый содержащий 15 л Среды 2 (имеющей состав, представленный выше в примере 1), стерилизуют при 120oC в течение 30 минут. Затем их охлаждают до 28oC и в каждый вибрирующийся ферментер инокулируют 75 мл посевного культурального бульона. Затем вибрирующиеся ферментеры перемешивают при 28oC со скоростью, регулируемой в пределах от 100 до 400 об/мин (для того, чтобы поддерживать 2 м.д. растворенного кислорода) в течение 144 часов и с аэрацией при потоке воздуха 7,5 л в минуту.
(B) Выделение
К 25 л всего бульона (полученного по описанному выше в (A) способу) добавляют 1,5 кг Целита 545 в качестве помощника фильтрации, и смесь фильтруют, чтобы получить 23 л фильтрата. pH фильтрата регулируют до величины 6,0 добавлением водной соляной кислоты и раствор пропускают через колонку, набитую 3 л Амберлита IRC-50 (NH
Количественный анализ с использованием жидкостной хроматографии высокого разрешения.
Колонка для разделения: Асахи Пак EC-502C (продукция Асахи Кемикл Индастри Ко., Лтд.).
Подвижная фаза: 20 мМ ацетат аммония (pH 8,5) + 50 мМ солевого раствора;
скорость течения: 1 мл/минуту;
длина волны для детектирования: 210 нм;
температура: 25oC;
время удерживания: 8,39 минут.
Количественный анализ с использованием газовой хроматографии/масс-спектрометрии.
Названный выше количественный анализ проводят с использованием, в основном, тех же методик, что и описанные в примере 2.
Пример 4. Получение 2-амино-4-(оксиметил)-3a,5,6,6a-тетрагидро-4H-циклопент-[d]-оксазол- 4,5,6-триола.
(A) Выращивание.
Скошенный агар Микромоноспоры вида SANK 62390 гомогенизируют в 10 мл физиологического солевого раствора, чтобы получить суспензию. 1 мл суспензии инокулируют в каждую из двух 2-литровых колб Эрленмейера. Каждая снабжена отбойными перегородками и каждая содержит 500 мл Среды 3 (имеющей представленный ниже состав), и инокулированные колбы инкубируют при 28oC в течение 96 часов на роторной трясучке, вращающейся со скоростью 210 об/мин, чтобы получить первый посевной культуральный бульон.
Среда 3
Глюкоза - 2%
Дрожжевой экстракт (Дифко) - 0,5%
Полипептон - 0,5%
CaCO3 - 0,1%
CB-442 - 0,01%
Вода (перед стерилизацией pH 7,2) - До 100%
Проценты являются весовыми в расчете на конечный объем среды.
30 л Среды 3 помещают в 60-литровый вибрирующийся ферментер и стерилизуют при 120oC в течение 30 минут. Затем ее охлаждают до 28oC и в нее инокулируют 600 мл первого посевного культурального бульона. Ферментер перемешивают со скоростью 165 об/мин при 28oC в течение 48 часов с аэрацией при потоке воздуха 15 л в минуту, чтобы получить второй посевной культуральный бульон.
600-литровый бак, содержащий 300 л Среды 4 (имеющей представленный ниже состав), стерилизуют при 120oC в течение 35 минут. Его затем охлаждают до 28oC и в него инокулируют 15 л второго посевного культурального бульона. Затем содержимое бака перемешивают при 28oC со скоростью, регулируемой в пределах от 82 до 142 об/мин (для того, чтобы поддерживать 2 м.д. растворенного кислорода) в течение 144 часов, с аэрацией при потоке воздуха 150 л в минуту и при внутреннем давлении 0,5 кг/см2.
Среда 4:
Глюкоза (предварительно стерилизованная при 120oC в течение 15 минут) - 8%
Лустерген FK* - 2%
Прессованные дрожжи - 1,8%
Мясной экстракт (Киокуто) - 1%
Полипептон - 1%
NaCl - 0,5%
CaCO3 - 0,3%
K2HPO4 - 0,25%
CB-442 - 0,02%
Вода (перед стерилизацией pH 7,2) - До 100%
* Торговое название для ржавчинного (головневого) гриба крахмала, продаваемого фирмой Nichiden KagaKu Co. Ltd.
(B) Выделение.
К 300 л всего бульона, полученного так, как описано выше, добавляют 15 кг Целита 545, как помощника фильтрации, и смесь фильтруют, чтобы получить 290 л фильтрата. pH 20 л фильтрата доводят до величины 6,0 добавлением водной соляной кислоты. Полученный раствор пропускают через колонку, набитую 3 л Амберлита IRC-50 (NH
Пример испытаний 1. Ингибирующая активность 2-амино-4-(оксиметил)-3a, 5,6,6a-тетрагидро-4H-циклопент-[d] -оксазол- 4,5,6-триола [соединение (II)] против крысиной β- фруктофуранозидазы.
Согласно методу Кесслера и др. [M. Kessler et al., Biochimica et Вiophisica Acta, 506, 136 - 154 (1978)], ферментный раствор базальной граничной пластинки тонкой кишки крыс получают из тонких кишок трех крыс-самцов штамма Вистар и суспендируют в 3 мл физиологического солевого раствора.
Образец 4-аминоантипирина (A 4382) приобретают из Сигма Кемиклс Ко., а образцы пероксидазы (Сорт 1) и глюкозооксидазы (Сорт 1) приобретают из Бехрингер Маннгейм Ко. Буферный раствор (pH 6,2), включающий 20 мМ лимонной кислоты и 40 мМ динатрий-фосфата, используют в качестве разбавителя в следующем эксперименте.
Каждая ячейка панели микротитратора с 96-ю ячейками (продукция фирмы Фалкон Ко.) заполняется 130 мкл (во все ячейки) смеси, которая содержит 0,2 мг бычьего сывороточного альбумина (Сигма, A 7906), 3 единицы глюкозооксидазы, 0,132 единиц пероксидазы, 20 мкг 4-аминоантипирина, 40 мкг фенола, 3 микромоля сахарозы и испытуемое соединение. В ячейку добавляют 20 мкл 100-кратно разбавленного раствора ферментного раствора базальной граничной пластинки (оболочки Бруха) из тонкой кишки крыс. Смесь выделяющейся глюкозы контролируют по поглощению при 492 нм.
Когда ферментативные реакции проводят без добавления испытуемого соединения и без добавления ферментного раствора, концентрации глюкозы принимают равными 0% и 100% ингибированию соответственно. Концентрация соединения (II), требуемая для ингибирования активности β- фруктофуранозидазы крыс на 50% (IC50)), найдена равной 18 мкг/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ОКТАГИДРОНАФТАЛИНОКСИМА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2125043C1 |
| ЛЕЙСТРОДУКСИН, СПОСОБ ПОЛУЧЕНИЯ ЛЕЙСТРОДУКСИНА ШТАММ STREPTOMYCES PLATENSIS - ПРОДУЦЕНТ ЛЕЙСТРОДУКСИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КРОВЕТВОРНОЙ И ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ, ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО | 1992 |
|
RU2082760C1 |
| ГЕКСАГИДРОНАФТАЛИНОВЫЕ СЛОЖНОЭФИРНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2104997C1 |
| ТИОМАРИНОЛ C И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2089548C1 |
| ТИОМАРИНОЛ, ОБЛАДАЮЩИЙ АНТИБАКТЕРИАЛЬНЫМИ СВОЙСТВАМИ, ШТАММ МИКРООРГАНИЗМА ALTEROMONAS RAVA SANK-73390 - ПРОДУЦЕНТ ТИОМАРИНОЛА И СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА ТИОМАРИНОЛА | 1992 |
|
RU2077534C1 |
| ТИОМАРИНОЛ B И СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1993 |
|
RU2101353C1 |
| ЭФИРНЫЕ ПРОИЗВОДНЫЕ ГЕКСАГИДРОНАФТАЛИНА, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2114101C1 |
| ПРОИЗВОДНОЕ ПИРАНОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2098422C1 |
| ФРАГМЕНТ ДНК, СПОСОБ ПОЛУЧЕНИЯ НАТРИЙПРАВАСТАТИНА, ПЛАЗМИДА ЭКСПРЕССИИ (ВАРИАНТЫ), РЕКОМБИНАНТНЫЙ ШТАММ (ВАРИАНТЫ) | 1996 |
|
RU2140984C1 |
| Способ получения гербицида корнексистин или соответствующей с разомкнутым кольцом кислоты, или ее соли | 1988 |
|
SU1834639A3 |
Изобретение предназначено для получения 2-амино-4(гидроксиметил)-3а, 5, 6, 6а-тетрагидро-4Н-циклопент-(d)-оксазол-4, 5, 6-триола с помощью новых штаммов актиномицетов Micromonospora вида SANK 62390 FERM BP-3521 и Amycolatopsis вида SANK 60791 FERM BP-3513. Данное соединение обладает способностью ингибировать активность гидролаз сахара и может использоваться для лечения и профилактики рака, СПИДа, диабетов и ожирения. 3 с. и 2 з.п.ф-лы, 6 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| R.A | |||
| Gruter et al | |||
| Nature, 330, 74 - 77 (1987) | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Satoshi Horii et al | |||
| Journal of Medical Chemistry, 29, 1038 - 1046 (1986) | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Aoyagi et al | |||
| The Journal of Antibiotics, vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| R.A | |||
| Farr et al | |||
| Tetrahedron Letters, 31, 7109, (1990), 5 | |||
| S | |||
| Sakuda et al | |||
| The Structure of Allosamidin, a Novel Insect Chitinase Ingibitor, Produced by Streptomyces sp | |||
| Tetr | |||
| Letters, v | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Приспособление для склеивания коробок бандерольными лентами | 1924 |
|
SU2475A1 |
Авторы
Даты
1998-10-27—Публикация
1992-02-14—Подача