Изобретение относится к области биотехнологии и иммунологии и может быть использовано в технологии изготовления стандартных панелей сывороток, содержащих или не содержащих антитела к определенному антигену, для контроля качества тест-наборов и в научно-исследовательских целях.
Из источников патентной информации известны способы получения стандартных контрольных сывороток, используемых в диагностических анализах [1]. Однако такие сыворотки не могут быть использованы для контроля качества тест-систем и иммуноблотов (ИБ), т.к. они не отвечают предъявляемым к ним критериям при формировании стандартной панели сывороток.
Известен способ приготовления стандартной панели позитивных к вирусу иммунодефицита человека сывороток крови для оценки чувствительности диагностических иммуноферментных тест-систем [2]. Способ включает приготовление иммунных сывороток, содержащих специфические антитела ко всем основным белкам HIV-I и имеющих разную концентрацию этих антител. Полученная таким способом стандартная панель ГИСК им. Л.А.Тарасевича (OCO 42-28-145-88) включает 50 сывороток крови больных СПИД и носителей ВИЧ-1, выявленных на территории СССР.
Недостатками способа получения указанной панели сывороток являются низкие чувствительность и достоверность контроля тест-систем и иммуноблотов, и невозможность контроля их специфичности, т.к. она составлена только из позитивных сывороток.
Это объясняется тем, что данная панель составлена из нативных сывороток, имеющих обычно высокие титры, и тем, что сыворотки находятся в жидком состоянии. Использование в панели нативных сывороток не позволяет в должной мере проконтролировать чувствительность тест-систем, т.к. высоким титрам нативных сывороток сопутствуют очень высокие значения оптических плотностей (ОП) в ИФА. Поэтому панель ГИСКа оказывается малоэффективной в области значений ОП, близких к критическим значениям (ОПкрит). Кроме того, панель OCO 42-28-145-88 из-за малого количества сывороток с низким содержанием антител (1-2 сыворотки из 50) малопригодна для оценки достоверности результатов анализов, например, при дискриминации ложноположительных сывороток, имеющих значения ОП, близкие или совпадающие с ОПкрит. И, наконец, панель включает только позитивные сыворотки и для оценки специфичности тест-систем и ИБ необходимо использовать другие панели сывороток.
Наиболее близким техническим решением (прототипом) является способ приготовления панели сывороток фирмы Boston Biomedica Inc., именуемой Anti-HCV Mixed Titer Panel [3].
Способ включает приготовление иммунных сывороток, содержащих специфические антитела к основным антигенам тестируемого вируса и имеющих разную концентрацию этих антител, а также приготовление донорских сывороток с нулевым титром. Каждая панель включает 25 нативных сывороток в жидкой форме. Сыворотки панели не стабилизированы. По этой причине сыворотки панели должны храниться при минус 10oC или ниже. Запрещено замораживание-размораживание сывороток. Характеристики сывороток панели служат только для информационных целей и фирма не гарантирует воспроизведение указанных характеристик при проведении анализов пользователями. Соответственно эти панели не имеют статуса аттестованных или прошедших сертификацию в Институте стандартов - U.S. Food and Drug Administration (FDA) и область их применения ограничена рамками решения исследовательских задач..
Стоимость панелей колеблется от 300 до 1200 долларов США.
К недостаткам прототипа следует отнести следующее:
- панели составлены из нативных сывороток, имеющих обычно высокие титры;
- сыворотки находятся в жидком состоянии;
- сыворотки не стабилизированы;
- сыворотки не аттестованы.
Использование в панели нативных сывороток не позволяет в должной мере проконтролировать чувствительность тест-систем, т.к. высоким титрам нативных сывороток сопутствуют очень высокие значения оптических плотностей (ОП) в ИФА. Такие панели оказываются малоэффективными в области значений ОП, близких к критическим значениям (ОПкрит.). Более того, из-за малого количества сывороток с низким содержанием антител (2 сыворотки из 25) панель, изготовленная по способу-прототипу, малопригодна для оценки правильности результатов анализов, например, при дискриминации ложноположительных сывороток, имеющих значения ОП, близкие или совпадающие с ОПкрит (Cut off).
Кроме того, большое неудобство доставляет транспортировка и хранение панелей при температурах ниже минус 10oC, но не ниже минус 25oC (т.к. запрещено замораживание-оттаивание сывороток). При условиях перевозок, существующих в России и странах СНГ, такие панели быстро становятся непригодными. Все это, несомненно, связано с тем, что сыворотки панели не стабилизированы. С другой стороны, нестабилизированные сыворотки не могут быть аттестованы, т. к. по правилам ВОЗ биологические референс-материалы должны иметь срок сохранения не более 2-х лет.
Подводя итоги изложенному выше, следует отметить, что производимые за границей панели сывороток не могут быть рекомендованы к использованию российским производителям тест-систем или работникам станций переливания крови (гематологических центров), т. к. панели не имеют сертификатов даже национальных центров стандартизации, не говоря уже об аттестации их в ВОЗ. Зарубежные панели очень чувствительны к температурным условиям транспортировки и хранения и цены на них традиционно велики.
В основу настоящего изобретения поставлена задача создания такого способа, который обеспечивал бы изготовление стандартных низкотитражных панелей сывороток, позволяющих достоверно оценивать качество тест-систем и ИБ в области значений ОП, близких к ОП крит, т.е. повысить степень контроля чувствительности тест-систем и возможность контроля их специфичности.
Поставленная задача решается тем, что в способе получения стандартной панели сывороток для контроля качества тест-систем и иммуноблотов, включающем отбор иммуноспецифических сывороток, содержащих антитела к основным антигенам тестируемого вируса и имеющих разную концентрацию этих антител, а также отбор нативных донорских сывороток с нулевым титром, согласно изобретению отбор сывороток для панелей производят по результатам их исследования методом ИБ и/или полимеразной цепной реакции (ПЦР) на наличие инфекционного материала и титрования и ИФА. Причем в качестве иммуноспецифических сывороток выбирают только те, которые в процессе титрования соответствуют закономерному уменьшению величин ОП в ИФА и аналитического сигнала в ПДР. Отобранные иммуноспецифические сыворотки разводят до получения разной концентрации антител разбавителем, не содержащим антитела к тестируемому вирусу. Из нативных донорских сывороток с нулевым титром отбирают для панелей только те, которые не имеют полос преципитации в ИБ, имеют отрицательный результат в ПДР (минус), а в ИФА - оптическую плотность меньше критической оптической плотности (в диапазоне от 0,1 о.е. до ОП крит).
Разведение иммунных сывороток производят неиммунной сывороткой, причем во все сыворотки панели вводят стабилизатор.
Образцы иммунных сывороток дополнительно аттестовывают на содержание в них определенных видов антител путем постановки сывороток в лизатном иммуноблоте или путем постановки ИФА с отдельными антигенами исследуемого вируса. По результатам подтверждающих тестов отбирают такое минимальное количество сывороток, которое в формируемой стандартной панели обеспечивает полный спектр антител, соответствующих основным антигенам тестируемого вируса.
Окончательно для формирования стандартной панели отбирают 25-30% сывороток с нулевым титром, не менее 50% сывороток с титром от 1:100 до 1:200 и не более 20-25% сывороток с титром выше 1:400 при общем количестве сывороток в стандартной панели не менее 24.
Приготовление сыворотки высушивают до остаточной влажности не более 2,0 мас.% путем лиофилизации.
Обоснование уровня техники.
Важным вопросом при аттестации сывороток панели на антитела к некоторым тестируемым вирусам, например, к вирусу гепатита C (ВГС), является процедура дифференциации специфических антител относительно специфических антител к другим вирусным агентам того же или родственного семейства, например, выявление антител к ВГС относительно антител к некоторым видам флавивирусов.
В [4] проведено сравнительное изучение качества тест-систем на антитела к ВГС 1-го поколения, построенных на одном рекомбинантном белке C100, и тест-систем 2-го поколения, построенных на 3-х рекомбинантных белках C100, C33-c и коровом, при анализе сывороток, полученных из крови больных гемофилией и пациентов с диагнозом гепатит ни A, ни B. Чувствительность при переходе к тест-системам 2-го поколения увеличилась от 0,92 до 1,00, а вероятность ложноотрицательных результатов уменьшилась от 0,37 до 0. В [5] показано, что антитела к ВГС обнаруживаются у американских доноров, проверенных тест-системами 1-го поколения: 0,36% (22 подтвержденных позитива из 6 III образцов) среди доноров крови и 10,08% (375 подтвержденных позитивов из 3718 образцов) среди доноров плазмы. Как следует из приведенных примеров, в научной литературе и лечебной практике отсутствуют критерии однозначной идентификации антител к ВГС или диагноза гепатита C, а также к другим вирусам, которые не могут быть наработаны in vitro.
В настоящем изобретении предлагается для исследования иммуноспецифических сывороток к таким вирусам использовать в качестве подтверждающего теста результаты анализа в тест-системах 2-го поколения и в ПЦР. При этом сама процедура исследования предусматривает обязательное титрование сывороток от высоких значений оптической плотности (ОП) до ОП крит. И только в том случае, когда аналитический сигнал закономерно уменьшается с разведением в обоих видах анализа, принимается, что регистрируемые антитела являются антителами именно к тестируемому вирусу, например ВГС, а сама сыворотка содержит инфекционный материал. Дополнительным подтверждением этому служит спектр антител к ВГС, который определяют путем постановки рекомбинантного иммунного блотинга или ИФА на отдельных антигенах. Из научной литературы известно [6], что около 90% больных гепатитом C или хронических больных имеют антитела к коровому антигену, а представительство антител к неструктурным антигенам значительно ниже (20-30%) и варьируется в широких пределах.
Таким образом, процедура исследования сывороток панели включает три этапа, результаты которых независимы и позволяют надежно идентифицировать антитела к тестируемому вирусу.
Далее стандартную низкотитражную панель приготавливают из исследованных нативных сывороток с различной концентрацией антител.
При этом концентрация антител в сыворотках панели нормируется по показателям титра и оптической плотности в ИФА в трех диапазонах:
1. Оптическая плотность сывороток в ИФА от 0,06 до ОП крит, титр нулевой (25-30% сывороток).
2. ОП в ИФА - от ОП крит до 0,7, титр 1:100 - 1:200 (не мене 50% сывороток).
3. ОП в ИФА - от 0,7 до 2,0, титр 1:400 - 1:800 (не более 20-25% сывороток).
Нормировку сывороток в диапазонах 2 и 3 осуществляют путем разведения высокотитражных специфических сывороток с титром не менее 1:3200 донорской сывороткой, не содержащей антитела к тестируемому вирусу.
По результатам анализа иммунных сывороток в панель собирают сыворотки, имеющие в сумме антитела ко всем антигенам вируса.
Для сохранения неизменными значений специфических показателей сывороток панели в последние добавляют стабилизатор. Наибольшее количество сывороток приготавливают с концентрациями антител, близкими к критической их концентрации в сыворотках, являющейся границей между положительными и отрицательными сыворотками. Наименьшее количество сывороток в панели имеют концентрацию антител, близкую к их концентрации в нативных сыворотках. После приготовления сыворотки высушивают по специальному режиму методом лиофилизации до уровня остаточной влажности не более 2 мас.%.
Сравнение панели сывороток, приготовленной в соответствии с заявляемым способом, с панелью фирмы Boston Biomedica Inc. того же назначения, приготовленной по способу-прототипу [3], показывает, что отличная от прототипа совокупность существенных признаков обеспечивает новое раннее не известное свойство: возможность формирования стандартной панели из исследованных (аттестованных) сывороток, что позволяет более надежно и правильно контролировать качество изготовляемых тест-систем и иммуноблотов, особенно в области значений ОП, близких к ОП крит.
В качестве примеров использования панелей сывороток для контроля качества тест-систем приведены данные для стандартной панели анти-ВИЧ (вирус иммунодефицита человека) сер. 005 и панели анти-ВГС (вирус гепатита С) сер. 002Н.
Работу с сыворотками панели следует проводить в асептических условиях, используя автоматические пипетки и одноразовые сменные наконечники.
Во флакон с лиофильно высушенной сывороткой вносят 200 мкл дистиллированной воды. Раствор тщательно перемешивают до полного растворения сыворотки.
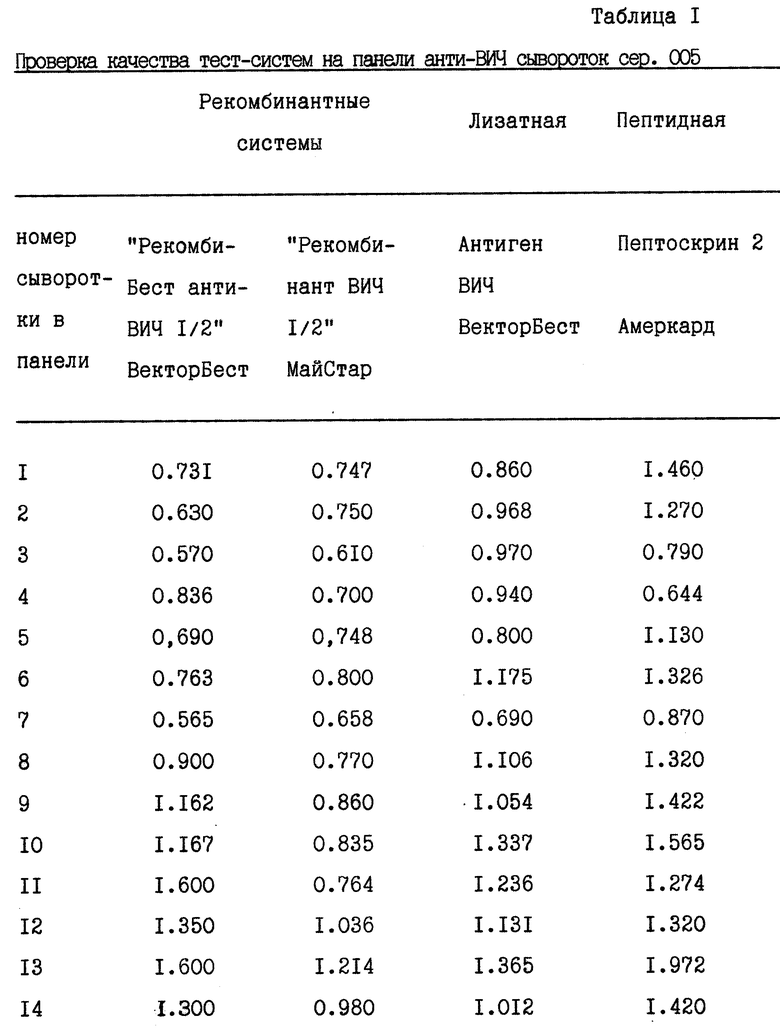
При проведении контроля качества диагностических тест-систем, применяемых для определения антител к ВИЧ, по тесту чувствительности используют полный комплект - 16 сывороток из стандартной панели.
Рабочие разведения сывороток готовят в соответствии с инструкцией по применению контролируемой тест-системы. Затем вносят каждую сыворотку панели в две лунки планшета с иммуносорбентом как неизвестные образцы и проводят анализ.
Учет результатов по образцам из панели следует проводить только в том случае, если величины оптической плотности (ОП) контроля конъюгата (положительного и отрицательного контролей) укладываются в пределах, регламентированныx фaрмакопейной статьей на испытуемую тест-систему.
ОП крит (критическая оптическая плотность, или Cut off) вычисляют в соответствии с формулой, приведенной в инструкции по применению тест-системы. Для т/системы "РекомбиБест анти-ВИЧ-1/2" расчет ОП проводят по формуле:
ОП крит = ОП (К-)ср + 0,2,
где
ОП(К-)ср - среднее значение оптической плотности отрицательного контроля
Результаты анализа качества тест-систем с использованием панели сывороток анти-ВИЧ сер. 005 представлены в табл. 1.
Если ОП всех сывороток панели выше значений ОП крит, чувствительность тест-системы принимается за 100%. В случае когда несколько значений ОП оказываются меньше или равными ОП крит, тест-система направляется на повторный контроль, и в случае повторного "неузнавания" хотя бы одной сыворотки панели - бракуется.
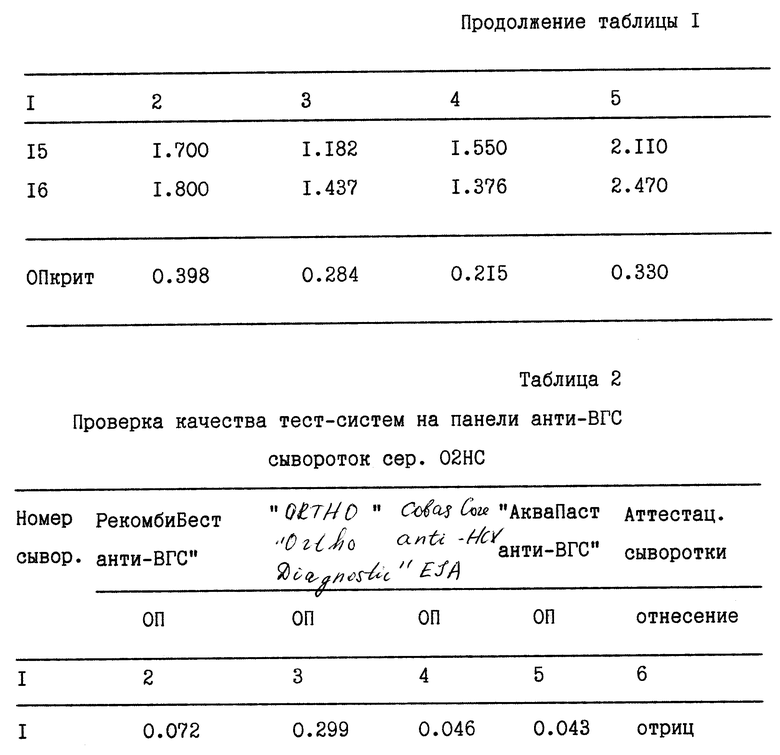
Аналогично проводится контроль качества тест-систем, используемых для диагностики вируса гепатита C.
Результаты анализа качества тест-систем с использованием панели сывороток анти-ВГС сер. 02НС представлены в табл. 2.
Если ОП всех сывороток панели выше значения ОП крит, чувствительность тест-системы принимается за 100%. В случае когда несколько значений ОП оказываются меньше или равными ОП крит, тест-система направляется на повторный контроль, и в случае повторного "неузнавания" хотя бы одной сыворотки панели - бракуется.
На основе аттестованных свойств панелей сывороток оцениваются качество и годность тест-систем, используемых в практической медицине.
При проведении контроля качества тест-систем, основанных на других принципах (иммуноблот, иммунофлуоресценция, агглютинация и др.), количество используемых сывороток стандартной панели и проведение испытаний регламентируются соответствующей НТД на тест-системы.
4. Для подтверждения области притязания приведен дополнительный пример приготовления низкотитражной панели сывороток с различной концентрацией ВИЧ-антител.
Пример выполнения способа.
Для приготовления низкотитражной панели сывороток с различной концентрацией антител отбирают в процессе первичного скрининга (методом ИФА) 15 иммуноспецифических сывороток крови ВИЧ-инфицированных лиц с ОП 2 о.е. (титр не менее 1: 3200) и 10 донорских сывороток (ОП в диапазоне от 0,1 до ОП крит), антитела, в которых не диагностировались используемыми для отбора (скрининга) тест-системами. Отобранные после первичного скрининга иммуноспецифические сыворотки титруют в тест-системе "РекомбиБест анти-ВИЧ-1,2" (АО "ВекторБест", г. Новосибирск). Причем сыворотки титруют в пяти параллельных определениях на двух планшетах. Одновременно эти же сыворотки исследуют в реакции иммунного блотинга (тест-система "Иммуноблот "ВекторБест").
В качестве иммуноспецифических сывороток для приготовления панели отбирают те сыворотки, которым в процессе титрования соответствует закономерное уменьшение величин ОП в ИФА и ослабление окраски полос в иммуноблоте. В качестве нативных донорских сывороток с нулевым титром отбирают только те, которые имеют не менее 2-х реактивных полос в иммуноблоте и ОП в ИФА < 0,15 о. е.
На основании анализа результатов ИФА и иммуноблота устанавливают, что используемые для приготовления панели иммуноспецифические сыворотки содержат антитела к ВИЧ-1,2. Определено, что в девяти иммуноспецифических сыворотках присутствуют антитела ко всем антигенам ВИЧ. Это служит дополнительным доказательством, что сыворотки, отобранные для приготовления панели, являются гомоспецифичными к вирусу иммунодефицита человека.
По результатам титрования на основе статистической обработки строят усредненные кривые титрования для каждой имуноспецифической сыворотки (аналогично кривой на чертеже).
Для определения кратности разведения выделяют участок прямо пропорциональной зависимости значений ОП от степени разведения (участок АВ на чертеже). На этих участках для каждой сыворотки выбирают значения титра (ОП) в соответствии с требуемой концентрацией специфических антител (требуемым титром). По кривым титрования определяют необходимую степень разведения для каждого номера сыворотки от N 1 до N 16 (всего 16 сывороток). Кратность разведения подбирают таким образом, чтобы значения оптических плотностей при выполнении ИФА лежали в диапазоне от значений ОП крит для выбранной тест-системы "РекомбиБест анти-ВИЧ" (АО "ВекторБест", г. Новосибирск) до значений ОП, равных 2,0 о.е.
На этапе разведения иммунную сыворотку каждого номера смешивают с разводящим раствором донорской сыворотки, в которую заранее добавляют стабилизатор. Смешивание для каждого номера от N 1 до N 16 осуществляют в течение 5-7 мин в колбе объемом 150 см3, установленной на магнитной мешалке. При этом получено 9 иммуноспецифических сывороток с титром в диапазоне от 1:50 до 1: 200 и 5 иммуноспецифических сывороток с титром в диапазонe от 1:200 до 1:600 и 2 сыворотки > 1:600.
Все сыворотки разливают по 200 мкм во флаконы и лиофильно высушивают на установке "TG-50" (ФРГ). Режим лиофилизации подбирают по результатам предварительного физико-химического анализа фазовых превращений в разводящей донорской сыворотке со стабилизатором при замораживании. Подготовленные сыворотки панели замораживают со скоростью 0,3-0,5oC/мин до температуры -60oC и выдерживают при этой температуре в течение 10 ч. На этапе сублимации льда температуру материала поддерживают ниже температуры его стеклования (-30oC). Средняя скорость нагревания материала на этапе досушивания составляет 6oC/мин, время выдерживания при 27oC составляет 10 ч.
Сыворотки панели инактивированы, но с ними необходимо обращаться как с потенциально инфекционным материалом.
Лиофильно высушенные сыворотки панели имеют остаточное содержание воды около 1,0 мас.%. Флаконы с сыворотками укупоривают под вакуумом.
Все сыворотки панели аттестовывают после лиофилизации в тест-системах: "РекомбиБест анти-ВИЧ- 1/2" (АО "ВекторБест"); "Рекомбинант ВИЧ-1/2" (АО "МайСтар"; "Антиген ВИЧ" (АО "ВекторБест"); "Пептострин-2", фирмa "Американд").
Установлено, что в процессе лиофилизации специфическая активность сывороток не изменяется.
Стабильность сывороток в различных условиях хранения в темноте во флаконах определяют по результатам теста термодеградации при температурах: -20, +4, +20, +37oC. По результатам теста установлено, что сыворотки панели должны сохранить неизменной специфическую активность в течение не менее трех лет.
Источники информации
1. Заявка ЕПВ N 0062227, МКИ G 01 N 33/96, опубл. 13.10.92 г.; заявка ЕПВ N 0131826, МКИ G 01 N 33/96, опубл. 23.01.85 г.; заявка ФРГ N 3324626, МКИ G 01 N 33/96, опубл. 17.01.85 г.
2. Воробьева М.С., Шаламберидзе А.Г., Ломанова Г.А. и др. "Вопросы вирусологии". - 1990, N 2, с. 125 - 128.
3. Информационный бюллетень фирмы Boston Biomedica, Inc., 1994, p. 12.
4. Bresters D., Cuypers HT., Reesink HW., Schaasberg WP., van-der-Po-lCL. , Mauser-Bunschoten EP., Houghton M, Choo QL., Kuo G., Lesniewski R. et al. - Enhanced sensitivity of a second generation ELISA for antibody to hepatitis C virus. - "Vox-Sang". 1992, v. 62, N 4, p. 213-7.
5. Dawson GJ., Lesniewski RR., Stewart JL., Boardway KM., Gutierrez RA., Pendy L., Johnson RG., Alcalde X., Rote KV., Devare SG., et al. - Detection of antibodies to hepatitis C virus in U.S. blood donors.-" J-Clin-Microbiol. ", 1991, Mar, v. 29, N 3, p. 551-6.
6. Kudesia, G. et al.-Need for second-generation anti-HCV testing in haemophilia. - "The Lancet", 1992, vol. 339, N 2, p. 501.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ НИЗКОТИТРАЖНОЙ ПАНЕЛИ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ИММУНОБЛОТОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К РАЗНЫМ СУБТИПАМ ВГС | 2009 |
|
RU2408024C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕФЕРЕНС-ПАНЕЛИ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ИММУНОБЛОТОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ СЕРОЛОГИЧЕСКОЙ ДИАГНОСТИКИ МАРКЕРОВ ВИЧ-1 | 2015 |
|
RU2603483C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕФЕРЕНС-ПАНЕЛИ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ВАКЦИН ПРОТИВ ГЕПАТИТА В | 1999 |
|
RU2181893C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КОНТРОЛЬНЫХ ПАНЕЛЕЙ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ДИАГНОСТИКИ ГЕПАТИТА В | 1999 |
|
RU2179726C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПАНЕЛИ СЫВОРОТОК ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ГЕПАТИТА В | 2007 |
|
RU2367960C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТАЛОННЫХ ПОЛОЖИТЕЛЬНЫХ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ | 1996 |
|
RU2123862C1 |
| ПАНЕЛЬ СЫВОРОТОК, СОДЕРЖАЩИХ АНТИТЕЛА К АНТИГЕНАМ HCV РАЗНЫХ СУБТИПОВ | 2010 |
|
RU2456617C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ РАБОЧЕГО СТАНДАРТА СЫВОРОТОК, СОДЕРЖАЩИХ АНТИТЕЛА К ВИРУСУ ГЕПАТИТА С | 2008 |
|
RU2380711C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КОНТРОЛЬНОЙ ПАНЕЛИ СЫВОРОТОК AY ЭНД AD СУБТИПОВ HBsAg ДЛЯ КОНТРОЛЯ КАЧЕСТВА ДИАГНОСТИКИ ГЕПАТИТА B | 2003 |
|
RU2265028C2 |
| ПАНЕЛЬ СЫВОРОТОК С НОРМИРОВАННЫМ СОДЕРЖАНИЕМ АНТИТЕЛ КЛАССА IgG K АНТИГЕНАМ p17 И p41 TREPONEMA PALLIDUM И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2004 |
|
RU2275635C2 |

Изобретение относится к биотехнологии и медицине и может быть использовано в технологии приготовления панели сывороток, содержащих антитела к тестируемому вирусу, для контроля чувствительности, специфичности и воспроизводимости тест-систем и иммуноблoтов. Сущность способа заключается в следующем: производят отбор иммуноспецифических сывороток, содержащих антитела к основным антигенам вируса и имеющих разную концентрацию этих антител, а также отбор нативных донорских сывороток с нулевым титром. Отбор сывороток для панелей производится по результатам их исследования методом полимеразной цепной реакции (ПЦР) на наличие инфекционного материала и титрования в иммуноферментном анализе (ИФА). В качестве иммуноспецифических сывороток выбирают сыворотки, которые в процессе титрования соответствуют закономерному уменьшению величины оптической плотности (ОП) в ИФА и величины аналитического сигнала в ПЦР. В качестве нативных донорских сывороток с нулевым титром выбирают сыворотки, которые имеют результат в ПЦР минус, а в ИФА - величину оптической плотности меньше критической (ОП крит). Отобранные иммуноспецифические сыворотки разводят разбавителем, не содержащим антитела к тестируемому вирусу с получением разной концентрации антител. Разведение специфических сывороток производят неиммунной сывороткой, причем во все сыворотки панели вводят стабилизатор. Образцы специфических сывороток дополнительно аттестовывают на содержание в них определенных видов антител путем постановки в ИФА с отдельными антигенами исследуемого вируса или в иммуноблоте, после чего отбирают такое минимальное количество сывороток в качестве стандартных, которое в формируемой стандартной панели обеспечивает полный спектр антител, соответствующих основным антигенам тестируемого вируса. Для формирования стандартной панели отбирают 25 - 30% сывороток с нулевым титром, не менее 50% сывороток с титром от 1:100 до 1:200 и не более 20 - 25% сывороток с титром выше 1:400 при общем количестве сывороток в стандартной панели не менее 24. Способ обеспечивает возможность правильной оценки результатов серологических анализов и повышение качества контроля чувствительности и специфичности тест-систем и иммуноблотов. Технический результат заключается в повышении степени контроля чувствительности тест-систем и возможности контроля их специфичности. 5 з.п. ф-лы, 2 табл., 1 ил.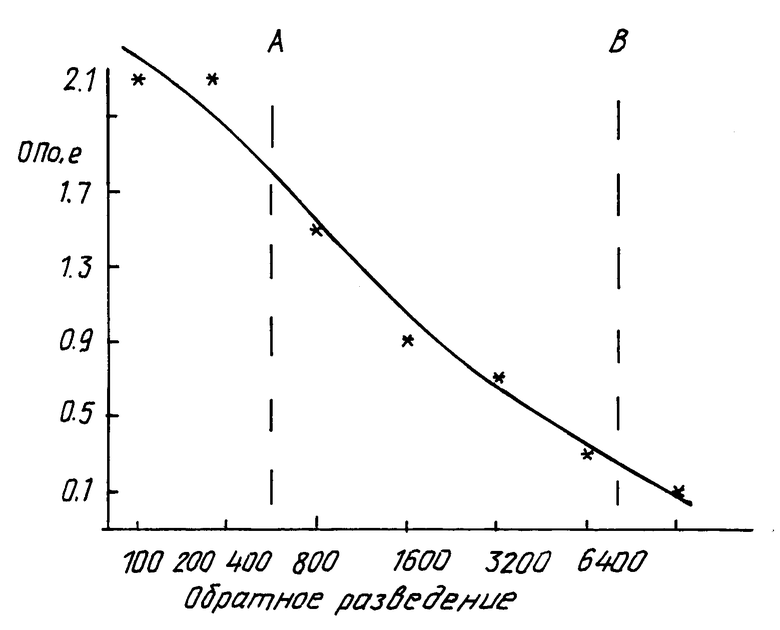
| Информационный бюллетень фирмы Boston Biomedica Inc., 1994, p | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ получения контрольной сыворотки крови | 1981 |
|
SU1064197A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 1992 |
|
RU2032907C1 |
Авторы
Даты
1998-11-27—Публикация
1995-04-28—Подача